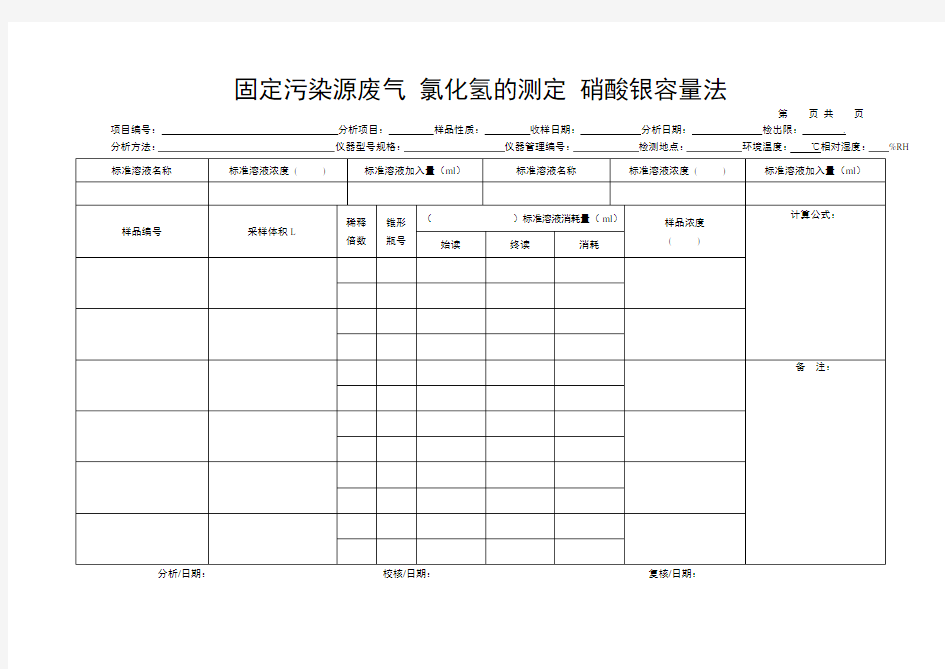

固定污染源废气氯化氢的测定硝酸银容量法
第页共页
项目编号:分析项目:样品性质:收样日期:分析日期:检出限:.
分析方法:仪器型号规格:仪器管理编号:检测地点:环境温度:℃相对湿度:%RH
分析/日期:校核/日期:复核/日期:
固定污染源废气氯化氢的测定硝酸银容量法(续表)
第页共页项目编号:分析项目:样品性质:收样日期:分析日期:检出限:.
分析/日期:校核/日期:复核/日期:
1.项目 硝酸银标准溶液的标定 2.仪器 25、50ml单标移液管,A或B级 50ml棕色酸式滴定管,分度值0.1ml,A或B级 天平,分度值0.0001g 250ml 锥形瓶 100 ml容量瓶,A或B级 1000ml容量瓶,A或B级 10 ml分度移液管,分度值0.1 ml,A或B级 洗耳球 3.试剂 氯化钠,分析纯或基准物质 硝酸银,分析纯 铬酸钾,分析纯 铬酸钾溶液:称取5.0克铬酸钾(精确到0.1克),溶于少量蒸馏水中, 然后滴加硝酸银,同时不断地用玻棒搅动直至红色不褪。放置过夜后过 滤。将滤液用蒸馏水稀释至100 ml。 4.步骤 氯化钠标准溶液的配置(0.500gNaCl/ml) 1)将氯化钠置于坩埚中于700℃灼烧1小时,放置干燥器中冷却备用。 2)称取8.2420克溶于蒸馏水并定容至1000ml. 3)用分度移液管从1000ML容量瓶中吸取10.0ML用蒸馏水准确定容至100ml。 此溶液1.00ml含0.500毫克氯化钠。 硝酸银标准溶液的标定 1) 称取2.4克硝酸银溶于蒸馏水并定容至1000ml。用氯化钠标准溶液进行滴定。 2) 用单标移液管吸取25.0ml氯化钠标准溶液置于锥形瓶中 3) 用单标移液管吸取25.0ml蒸馏水于另一锥形瓶中,做空白。
4) 各加入1ml铬酸钾溶液,用硝酸银标准溶液滴定,边滴边摇,直至硝酸银溶液滴定溶液的颜色由黄色至砖红色沉淀刚刚出现为终点. 5.计算 每毫升硝酸银相当于氯化钠的毫升数 W=25×0.500/(V2-V1) W---每毫升硝酸银相当于氯化钠的量 V2—氯化钠标准溶液消耗的硝酸银标准溶液的量(ml) V1—空白消耗的硝酸银标准溶液的量(ml) 6.标定周期:3个月
目的:规范硝酸银滴定液的配制操作。 适用范围:硝酸银滴定液。 责任者:配制者、复核者。 =169.87 AgNO 3 1.试药及试剂 硝酸银(分析纯)氯化钠(基准物) 糊精溶液(1→50)碳酸钙 荧光黄指示液:取荧光黄0.1g加乙醇 100ml溶解,即得。 2.配制 取硝酸银17.5g,加水适量使溶解成1000ml,摇匀。 3.标定 3.1 原理 荧光黄为具有颜色的阴离子弱酸,在中性溶液中可被带正电荷的物质吸附而显粉红色;硝酸银与氯化钠反应生成AgCL沉淀,微过量的银离子附于AgCL表面,吸附荧光黄阴离子而显红色。据此可指示终点并算出硝酸银浓度。反应式如下: Ag++Cl-→AgCl↓ (AgCl↓)Ag++FI-(黄色)→(AgCl↓)Ag+·FI-(粉红色) 3.2 步骤 取在 110℃干燥至恒重的基准氯化钠约0.2g,精密称定,加水50ml使溶解,再加糊精溶液(1→50)5ml、碳酸钙0.1g与荧光黄指示液8滴,用本液滴定至浑浊液由黄绿色变为微红色。每1ml的硝酸银滴定液(0.1mol/L)相当于 5.844mg的氯化钠。根据本液的消耗量与氯化钠的取用量,算出本液的浓度,即得。 如需用硝酸银滴定液(0.01mol/L)时,可取硝酸银滴定液(0.1mol/L)在临用前加水稀释制成。 3.3 计算公式 硝酸银滴定液的浓度C(mol/L)按下式计算:
C(mol/L)= m×0.1000V×5.844 式中:m为基准氯化钠的称取量(mg) V为本滴定液的消耗量(ml); 5.844 为每1ml的硝酸银液(0.1000mol/L)相当于氯化钠的毫克数。 4.贮藏 应置于具塞的棕色玻瓶中,密闭保存。 5.有关注释及注意事项 5.1 标定中采用以荧光黄为指示剂的吸附指示剂法,要求生成的氯化银呈胶体状态,以利于到达滴定终点时对指示剂阴离子的吸附而产生颜色的突变,因此在基准氯化钠加水溶解后要加入2%糊精溶液5ml,以形成保护胶体。 5.2 标定需要在中性或弱碱性(pH7~10)中进行,以利于荧光黄阴离子的形成,故需在溶液中加入碳酸钙0.1g,以维持溶液的微碱性。 5.3氯化银的胶体沉淀遇光极易分解析出黑色的金属银,因此在滴定过程中应避免强光直接照射。 5.4 本滴定液应避光保存,宜置于具塞的棕色玻瓶中,或用黑布包裹的玻瓶。
硝酸银滴定液(0.1mol/L)配制与标定的标准操作规程 一、目的:建立硝酸银滴定液(0.1mol/L)配制与标定的标准操作规程配制与标定操作规程 二、依据:《中华人民共和国药典》2010 年版一部。 三、适用范围:适用于本公司硝酸银滴定液(0.1mol/L)的配制、标定与复标工作。 四、职责:质量检验主任、滴定液配制人、复标人、检验员对本标准的实施负责。 五、操作程序: 1、试剂: ①硝酸银②基准氯化钠③糊精溶液(1→50)④碳酸钙⑤荧光黄指示液 2、仪器和用具 ①三角瓶250ml ②量筒50ml ③酸式滴定管50ml ④称量瓶⑤铁架台⑥天平⑦ 1000mL的棕色容量瓶 3、分子式和分子量: AgNO 3 169.87 4、配制浓度所需溶质量及体积 16.99→ I000ml 取硝酸银17.5g,加水适量使溶解成1000ml,摇匀。 5、反应原理 AgNO 3+NaCl→AgCl↓+NaNO 3 6、标定 取在110℃干燥至恒重的基准氯化钠0.2g,精密称定,加水50ml使溶解,再加糊精溶液(1→50)5ml、碳酸钙0.1g与荧光黄指示液8滴,用本液滴定至浑浊液由黄绿色变为微红色。每1ml硝酸银滴定液(0.1mol/l)相当于5.84mg的氯化钠。根据本液的消耗量与氯化钠的取用量,算出本液的浓度,即得。 如需用硝酸银滴定液(0.01mol/l)时,可用硝酸银滴定液(0.1mol/l)在临用前加水稀释制成。 7、计算 硝酸银浓度= 氯化钠重×0.1 0.005844 ×硝酸银的ml数
8、注意事项: 【贮藏】置玻璃塞的棕色玻瓶中,密闭保存。 【说明】①糊精为保护胶体,使沉淀保持胶体状态,以增加吸附力,因此要在整个胶体溶液中观察终点。 ②荧光黄为指示剂时要求溶液呈中性或弱碱性,而硝酸银溶液稍带酸性,滴定至终点时溶液pH值在5左右,影响终点观察,加入碳酸钙约0.1g或硼砂溶液2ml,调节酸度,使滴定终点明显,结果准确。 ③吸附指示剂可促进卤化银对光的敏感作用,因此在滴定时应避免强光照射,一般应在较暗处观察终点。 ④硝酸银见光易分解为银、二氧化氮和氧,故硝酸银滴定液必须保存于棕
硝酸银标准溶液的制备 一、实验目的: 1、掌握AgNO3溶液的配制和标定方法; 2、学会应用K2CrO4作指示剂判断滴定终点。 二、试剂: 1、固体AgNO3 2、K2CrO4溶液50g·L-1水溶液。 3、基准物质氯化钠。 三、实验内容: a、实验步骤 1、C(AgNO3)=0.1mol·L-1AgNO3标准液的配制:称取8.5g AgNO3溶于500ml 不含cl- 离子的蒸馏水中,贮存于带玻璃塞的棕色试剂瓶中,摇匀,置于暗处, 待标定。 2、AgNO3溶液的标定:准确称取基准试剂NaCl 0.12~0.15g,放入锥形瓶中,加 50ml水溶解,加K2CrO4指示剂1ml,在充分摇动下,用配好的AgNO3溶液滴 定直至溶液微呈砖红色即为终点,记下消耗的AgNO3溶液的体积。 b、实验记录: 四、浓度计算: C(AgNO3)=m(NaCl)÷【M(NaCl)×V(AgNO3)】C(AgNO3)---- AgNO3标准溶液浓度,mol·L-1; m ---- 基准物质NaCl的质量,g; M(NaCl)---- NaCl的摩尔质量,g·mol-1; V(AgNO3)---- 滴定时消耗AgNO3标准溶液体积,L。
水中氯含量的测定 一、实验目的: 1、掌握莫尔法测定水中氯含量的原理和方法。 2、学会正确判断滴定终点。 二、试剂: 1、AgNO3标准溶液C(AgNO3)= 0.1mol·L-1,或者C(AgNO3)= 0.05mol·L-1。 2、K2CrO4指示剂50g·L-1。 3、水试样(自来水或者天然水)。 三、实验内容: 1、实验步骤:准确吸取水样50ml放入锥形瓶中,加K2CrO4溶液1ml,在充分摇 动下,以C(AgNO3)= 0.05mol·L-1 AgNO3标准溶液滴定至呈砖红色,即为终 点。记下AgNO3标准溶液体积。 2、实验记录: 3、结果计算 ——蒸馏水消耗硝酸银标准溶液量,ml; 式中:V 1 V ——试样消耗硝酸银标准溶液量,ml; 2 M——硝酸银标准溶液浓度,mol·L-1; V——试样体积,ml。
固定污染源废气氯化氢得测定硝酸银容量法 警告:氯化氢对人体有害,采样时,应视采样环境佩戴防护器具,避免吸入或接触皮肤与眼睛、实验中使用得硝酸具有强氧化性与腐蚀性,操作时应佩戴防护用品,溶液配制及样品预处理过程应在通风橱中进行操作。 1.适用范围 本标准规定了测定固定污染源废气中氯化氢得硝酸银容量法。 本标准适用于固定污染源废气中氯化氢得测定。 当采样体积为15 L (标准状态),方法检出限为2mg/m3,测定下限为8.0mg/m3。 2.规范性引用文件 本标准内容引用了下列文件或其中得条款。凡就是不注明日期得引用文件,其有效版本适用于本标准。 GB/T16157固定污染源排气中颗粒物测定与气态污染物采样方法 HJ/T 373?固定污染源监测质量保证与质量控制技术规范(试行) 3.方法原理 氯化氢被氢氧化钠溶液吸收后,在中性条件下,以铬酸钾为指示剂,用硝酸银标准溶液滴定,生成氯化银沉淀,过量得银离子与铬酸钾指示剂反应生成浅砖红色铬酸银沉淀,指示滴定终点,反应式如下: Cl - +AgNO3 →、。NO3-+AgCl ↓ 2Ag + + CrO42-→Ag 2CrO 4↓(浅砖红色) 4.干扰与消除 当废气中含有硫化物、二氧化硫时,对本方法产生正干扰。硫化氢得浓度≤1000 mg/m 3, 二氧化硫得浓度≤10000mg/m3,均可通过加入1ml得30%过氧化氢消除干扰。 颗粒态得氯化物对本方法产生正干扰;当废气中硫酸雾浓度〉15g/m3时,本方法在滴定过程中产生白色沉淀,影响滴定过程得终点判定;当待测液中铁含量>10 mg/L时,对本方法滴定过程得终点判定产生影响。上述干扰可在采样时通过滤膜过滤去除、废气中共存氯气(Cl2)时,可与氢氧化钠反应生成等量得氯离子与次氯酸根离子,干扰氯化氢得测定、用碘量法测定次氯酸根,从总氯化物中减去其含量,即获得氯化氢含量。 5试剂与材料 除非另有说明,分析时均使用符合国家标准得分析纯试剂。实验用水为新制备得去离子水或同等纯度得水、 5、1 硝酸:p (HN〇3) =1。42 g/ml。 5.2 无水乙醇::〇(CH3CH2OH) =0、79 g/ml。 5、3氯化钠(NaCl):优级纯、 使用前应放入瓷坩埚中,于400°C?500°C灼烧40 min?50min,且不再发出爆裂声。 置于干燥器中冷却备用。 5、4氢氧化钠(NaOH)。 5、5 硝酸银(AgNO3)、 使用前应于105°C烘30min,置于干燥器中冷却备用。 5、6?铬酸钾(K2&O4)。 5、7 酚酞(C20H14O4)、 5.8 硝酸溶液:c (HNO3) = 0.1mol/L、 移取6.2 ml硝酸(5。1),用水稀释至1000 ml。
硝酸银标准滴定溶液〔c(AgNO3)=0.1mol/L〕 1 配制 1.1 称取17.5g硝酸银,加入适量水使之溶解,并稀释至1000mL,混匀,避光保存。 1.2 需用少量硝酸银标准滴定溶液时,可准确称取约4.3g在硫酸干燥器中干燥9 度,混匀,避光保存。 1.3 淀粉指示液:称取0.5g可溶性淀粉,加入约5mL水,搅匀后缓缓倾入100mL沸水中,随加随搅拌,煮沸2min,放冷,备用。此指示液应临用时配制。 1.4 荧光黄指示液:称取0.5g荧光黄,用无水乙醇溶解并稀释定容至100mL。 2 标定 2.1 采用1.1配制的硝酸银标准滴定溶液的标定: 准确称取约0.2g在270℃干燥至恒量的基准氯化钠, 加入50mL水使之溶解。 加入5mL淀粉指示液,边摇动边用硝酸银标准滴定溶液, 避光滴定,近终点时,加入3滴荧光黄指示液,继续滴定混浊液由黄色变为粉红色。 2.2 采用1.2配制的硝酸银标准滴定溶液不需要标定。 3 计算 3.1 由 1.1配制的硝酸银标准滴定溶液的浓度按式(B6)计算。m C6=------------------ V*0.05844 式中: C6——硝酸银标准滴定溶液的实际浓度,mol/L; m——基准氯化钠的质量,g; V——硝酸银标准滴定溶液用量,mL; 0.05844——与1.00mL硝酸银标准滴定溶液〔c(AgNO3)=1mol/L〕相当的基准氯化钠的质量,g。 3.2 由1.2配制的硝酸银标准滴定溶液的浓度按式(B7)计算。 m c7= ———— V*0.1699 式中: C7——硝酸银标准滴定溶液的实际浓度,mol/L; m——硝酸银(优级纯)的质量,g; V——配制成的硝酸银标准滴定溶液的体积,mL;
标 准 操 作 规 程 STANDARD OPERATION PROCEDURE 1目的:建立硝酸银滴定液配制、标定操作规程,以使检验操作规范化。 2适用范围:适用于硝酸银滴定液配制、标定。 3责任:QC 人员对本SOP 实施负责。 4内容 4.1.名称 硝酸银滴定液 4.2.分子式、分子量 87 169.=AgNO 3 16.99g →1000ml 4.3.配制浓度:0.1mol/L 4.4 所用仪器 电子天平、电热恒温鼓风干燥箱、酸式滴定管(50ml )、容量瓶(1000ml )、烧杯(50、100ml )、量杯(50ml )、移液管、称量瓶、锥形瓶、试剂瓶 4.5试药 硝酸银、基准氯化钠 糊精 碳酸钙 荧光黄 4.6配制 取硝酸银17.5g 加水适量使溶解成1000ml ,摇匀。 4.7标定 4.4.1.操作过程
取在110℃干燥至恒重的基准氯化钠约0.2g,精密称定,加水50ml使溶解,再加糊精溶液(1→50)5ml、碳酸钙0.1g与荧光黄指示液8滴,用本液滴定至浑浊液由黄绿色变为微红色。每1ml硝酸银滴定液(0.1mol/L)相当于5.844mg的氯化钠。根据本液的消耗量与氯化 钠的取用量,算出本液的浓度,即得。 如需用硝酸银滴定液(0.01mol/L)时,可取硝酸银滴定液(0.1mol/L)在临用前加水稀释 制成。 4.4.2. 计算方法 m c(mol/L)= V×5.844 式中 m为基准氯化钠的称取量(mg); V为本液滴定的消耗量(ml); 5.844为每1ml硝酸银滴定液(0.1mol/L)相当的以毫克表示的氯化钠的质量。 4.5 允许误差 滴定液标定不得少于3份标定和复标的相对偏差均不得超过0.1%,标定的平均值和复标所得 的平均值,二者的相对偏差不得超过0.1%。 4.6 复标规定 滴定液经第一人标定后,必须由第二人进行复标。 其标定份数也不得少于3份。 4.7.注意事项 4.7.1. 标定中采用以荧光黄为指示剂的吸附指示剂法,要求生成的氯化银呈胶体状态,以 利于在到达滴定终点时对指示剂阴离子的吸附而产生颜色的突变,因此在加入的基准氯化钠 溶解后再加入糊精溶液(1→50)5ml,以形成保护胶体。 4.7.2.氯化银的胶体沉淀遇光极易分解析出黑色的金属银,因此在滴定过程中应避免强光直 接照射。 4.8.贮藏置玻璃塞的棕色玻瓶中,密闭保存。 5.附页:无 6.历史 版本号修订主要内容描述生效日期 0.0 新制定文件2015年12月1日
DL 425 工业氢氧化钠中氯化钠含量的测定 DL 425.6—91 ——硝酸银容量法 中华人民共和国能源部 1991-10-04批准1992-04-01实施1方法概要 在pH 为7左右的中性溶液中,氯化物与硝酸银作用生成氯化银沉淀,过量的硝酸银与铬酸钾作用,生成铬酸银沉淀,使溶液显橙色,即为反应终点(试样中如氯化物含量高,则应对试样溶液进行稀释 ),其反应为:Cl Ag AgCl ( )-+白色2Ag CrO Ag CrO ( ) +4 2-24砖红色2 试剂2.1氯化钠标准溶液(1mL 含1mgCl-):取基准试剂或优级纯的氯化钠3~4g ,置于瓷坩埚内,于高温炉内升温至500℃灼烧10min ,然后在干燥器内冷却至室温,准确称取 1.6490g 氯化钠,用少量二级试剂水溶解并稀释至1000mL ,摇匀。 2.2硝酸银标准溶液(1mL 含1mgCl-):称取5.0g 硝酸银溶于1000mL 蒸馏水中,以氯化钠标准溶液标定,标定方法如下: 于三个锥形瓶中,用移液管分别注入10mL 氯化钠标准溶液,再各加入90mL 二级试剂水及1mL10%铬酸钾指示剂,均用硝酸银标准溶液滴定至橙色为终点,分别记录消耗硝酸银标准溶液的体积 (V)。运算其平均值,三个标样平行试验的相对 偏差应小于0.25%。
另取100mL 二级试剂水,不加氯化钠标准溶液作空白试验,记 录消耗硝酸银标准溶液体积(V1)。 硝酸银溶液的滴定度(mg/mL)按下式运算: T V V 101 1 式中V1——空白消耗硝酸银标准溶液的体积,mL ; V ——氯化钠标准溶液消耗硝酸银标准溶液的体积, m L ; 10——氯化钠标准溶液的体积,mL ; 1——氯化钠标准溶液的浓度,mg/mL 。 最后调整硝酸银溶液的浓度,使其成为滴定度为 1mL 相当1mg Cl-的标准溶液。 2.3 10%铬酸钾指示剂。2.4 1%酚酞指示剂(乙醇溶液)。2.5 0.05mol/L 硫酸(优级纯)溶液。3测定方法 吸取试样溶液(按DL 425.5—91《工业氢氧化钠中氢氧化钠和 碳酸钠含量的测定——容量法》 3.1的规定制取)25.0mL 置于250mL 锥形瓶中,加50mL 二级试剂水,摇匀。加2~3滴1%酚酞指示剂,用硫酸溶液中和至无色。再加入1mL10% 铬酸钾指示剂,用硝酸银标准溶液滴定至橙色。记录消耗硝酸银标准溶液的体积 (V),同时作空白试验记录消耗硝酸银标准溶液体积(V0) 。4 运算和承诺误差4.1 氯化钠含量x(以质量百分数表示)按下式运算:x V V m V c 111000164901000100%0(). 式中V ——滴定试样消耗硝酸银溶液的体积,mL ; V0——滴定空白消耗硝酸溶液的体积, mL ;1——硝酸银标准溶液的滴定度, 1 mL 相当于1 mgCl-;
实验七 硝酸银标准溶液的配制与标定 一、实验目的 1.掌握AgNO 3标准溶液的配制和标定; 2.深入理解银量法的原理; 3.学会观察与判断荧光黄指示剂的滴定终点。 二、实验原理 采用荧光黄(HFln )作指示剂 ,以AgNO 3溶液滴定NaCl 溶液,终点时混浊液由黄绿色转变为微红色。 终点前 Cl -过剩 AgCl(Cl - )∣M + 终点时 Ag+过剩 AgCl (Ag +)﹢Fln - → AgCl(Ag +)∣Fln - 黄绿色 微红色 为使终点变色敏锐,将溶液适当稀释并加入糊精作保护胶体。 三、实验仪器及试剂 1.仪器 分析天平、烘箱、称量瓶、量筒、锥形瓶、棕色磨口试剂瓶、酸式滴定管。 2.试剂 硝酸银(AR 或CP )、NaCl(基准试剂)、糊精(AR )、荧光黄指示剂。 3.试液 2%糊精水溶液、0.1%荧光黄乙醇溶液 四、实验内容与步骤 1.0.1mol/LAgNO 3溶液的配制 称取8gAgNO 3,置500ml 烧杯中,加100ml 蒸馏水溶解,然后移入棕色磨口瓶中,加蒸馏水稀释到500ml ,摇匀,紧塞,避光。 2.0.1mol/LAgNO 3溶液的标定 取在270℃干燥至恒重的基准NaCl 0.13g ,精密称定,置250ml 锥形瓶中,加50ml 蒸馏水,使溶解,,再加糊精5ml ,荧光黄指示剂8滴,用0.1mol/的LAgNO 3溶液滴定至混浊液由黄绿色转变为微红色终点,平行测定四次。 五、数据处理 C AgNO3=1000m 3 NaCl NaCl ??AgNO V M (NaCl M =58.44g/mol )
m:NaCl的质量(g)。 NaCl 六、实验注意事项及讨论 1.配制AgNO3标准溶液的水应无Cl-,否则配制的AgNO3溶液出现白色沉淀,不能使用。2.吸附指示剂不是使溶液发生颜色变化,而是使沉淀的表面颜色发生变化,故应尽可能使卤化银沉淀呈胶体状态,具有较大的比表面积。为此,在滴定前应将溶液稀释并加入糊精、淀粉等亲水性分子化合物以形成保护胶体。
氯化物的测定硝酸银滴定 法 Prepared on 22 November 2020
硝酸银滴定法 测 定 水 质 氯 化 物 实验操作说明
硝酸银滴定法测定水质氯化物 GB11896—89 1主题内容与适用范围 适用于天然水中氯化物的测定,也适用于经过适当稀释的高矿化度水如咸水、海水等,以及经过预处理除去干扰物的生活污水或工业废水。 本标准适用的浓度范围为10—500mg/L的氯化物。高于此范围的水样经稀释后可以扩大其测定范围。 溴化物、碘化物和氰化物能与氯化物一起被滴定。正磷酸盐及聚磷酸盐分别超过250mg/L及25mg/L时有干扰。铁含量超过10mg/L时使终点不明显。2原理 在中性至弱碱性范围内—,以铬酸钾为指示剂,用硝酸银滴定氯化物时,由于氯化银的溶解度小于铬酸银的溶解度,氯离子首先被完全沉淀出来后,然后铬酸盐以铬酸银的形式被沉淀,产生砖红色,指示滴定终点到达。该沉淀滴定的反应如下: Ag++Cl—→AgCl↓ 2Ag++CrO4→Ag2CrO4↓(砖红色) 3试剂
分析中仅使用分析纯试制及蒸馏水或去离子水。 高锰酸钾,C(1/5KMnO4)=/L。 过氧化氢(H2O2),30%。 乙醇(C6H5OH),95%。 硫酸溶液,C(1/2H2SO4)=/L。 氢氧化钠溶液,C(NaOH)=/L。 氢氧化铝悬浮液:溶解125g硫酸铝钾[KAl(SO4)2·12H2O]于1L蒸馏水中,加热至60℃,然后边搅拌边缓缓加入55mL浓氨水放置约1h后,移至大瓶中,用倾泻法反复洗涤沉淀物,直到洗出液不含氯离子为止。用水稀至约为300mL。 氯化钠标准溶液,C(NaCl)=/L,相当于500mg/L氯化物含量:将氯化钠(NaCl)置于瓷坩埚内,在500—600℃下灼烧40—50min。在干燥器中冷却后称取8.2400g,溶于蒸馏水中,在容量瓶中稀释至1000mL。用吸管吸取,在容量瓶中准确稀释至100mL。 此标准溶液含氯化物(C1-)。 硝酸银标准溶液,C(AgNO3)=/L:称取2.3950g于105℃烘半小时的硝酸银(AgNO3),溶于蒸馏水中,在容量瓶中稀释至1000mL,贮于棕色瓶中。 用氯化钠标准溶液标定其浓度:
硝酸银标准溶液的配制和标定 二、原理 AgNO3标准滴定溶液可以用经过预处理的基准试剂AgNO3直接配制。但非基准试剂AgNO3中常含有杂质,如金属银、氧化银、游离硝酸、亚硝酸盐等,因此用间接法配制。先配成近似浓度的溶液后,用基准物质NaCl标定。 以NaCl作为基准物质,溶样后,在中性或弱碱性溶液中,用AgNO3溶液滴定,以K2CrO4作为指示剂,其反应如下; 达到化学计量点时,微过量的Ag+与CrO42-反应析出砖红色Ag2CrO4沉淀,指示滴定终点。 三、试剂 1、固体试剂AgNO3(分析纯)。 2、固体试剂NaCl(基准物质,在500~600℃灼烧至恒重); 3、K2CrO4指示液(50g/L,即5%)。配制:称取5g K2CrO4溶于少量水中,滴加AgNO3溶液至红色不褪,混匀。放置过夜后过滤,将滤液稀释至100mL。 四、步骤 1、配制0.1mol/LAgNO3溶液 称取8.5g AgNO3溶于500mL不含Cl-的蒸馏水中,贮存于带玻璃塞的棕色试剂瓶中,摇匀,置于暗处,待标定。 2、标定AgNO3溶液 准确称取基准试剂NaCl 0.12~0.159,放于锥形瓶中,加50mL不含Cl-的蒸馏水溶解,加K2CrO4指示液lmL,在充分摇动下,用配好的AgNO3溶液滴定至溶液呈微红色即为终点。记录消耗AgNO3标
准滴定溶液的体积。平行测定3次。 注意事项 1、AgNO3试剂及其溶液具有腐蚀性,破坏皮肤组织,注意切勿接触皮肤及衣服。 2、配制AgNO3标准溶液的蒸馏水应无Cl-,否则配成的AgNO3溶液会出现白色浑浊,不能使用。 3、实验完毕后,盛装AgNO3溶液的滴定管应先用蒸馏水洗涤2~3次后,再用自来水洗净,以兔AgCl沉淀残留于滴定管内壁。 五、结果计算 AgNO3标准滴定溶液浓度按下式计算: m(NaCl) c(AgNO3)= ----------------------------- M(NaCl )V(AgNO3) 式中: c(AgNO3): AgNO3标准滴定溶液的浓度,mol/mL; m: 称取基准试剂NaCl 的质量,g; M: NaCl 的摩尔质量,58.44g/mol; V: 滴定时消耗AgNO3标准滴定溶液的体积,mL.
氯化物的测定(硝酸银容量法) 1 概要 适用于测定氯化物含量为5?100mg/L的水样。 在中性或弱碱性溶液中,氯化物与硝酸银作用生成白色氯化银沉淀,过量的硝酸银与铬酸钾作用生成砖红色铬酸银沉淀,使溶液显橙色,即为滴定终点。 2试剂及配制 2.1氯化钠标准溶液(1mL含1mg氯离子):取基准试剂或优级纯的氯化钠3?4g置于瓷坩埚 内,于高温炉内升温至500C灼烧lOmin ,然后放入干燥器内冷却至室温,准确称取1.69g氯化钠,先溶于少量蒸馏水,然后稀释至1OOOmL。 2.2 硝酸银标准溶液(1mL相当于1mgC「):称取5.0g硝酸银溶于1000mL蒸馏水中,以氯化钠标准溶液标定。标定方法如下:于三个锥形瓶中,用移液管分别注入10mL氯化钠标准溶 液,再各加入90mL蒸馏水及1.0mL10%铬酸钾指示剂,均用硝酸银标准溶液滴定至橙色,分别记录硝酸银标准溶液的消耗量V,以平均值计算,但三个平行试验数值间的相对误差应小于0.25%。另取100mL蒸馏水作空白试验,除不加氯化钠标准溶液外,其他步骤同上,记录硝酸银标准溶液的消耗量VI。 硝酸银标准溶液的滴定度(T)按下式计算: 10X 1 mg/mL (V —V1)
式中:V1 ――空白试验消耗硝酸银标准溶液的体积,mL ; V——氯化钠标准溶液消耗硝酸银标准溶液的平均体积,mL ; 10 氯化钠标准溶液的体积,mL; 1.0 氯化钠标准溶液的浓度,mg/mL。 最后凋整硝酸银溶液浓度,使其成为1mL相当1mg Cl —的标准溶液。 2.310%铬酸钾指示剂。 2.41%酚酞指示剂(以乙醇为溶剂)。 2.5cNaOH : 0.1moI/L。 2.6CH2SO4: 0.1mol/L。 3测定方法 3.1量取100mL水样于锥形瓶中,加2?3滴l%酚酞指示剂,若显红色,即用硫酸溶液中和至无色。若不显红色,则用氢氧化钠溶液中和至微红色,然后以硫酸溶液滴回至无色,再加入 I.OmLIO%铬酸钾指示剂。 3.2用硝酸银标准溶液滴定至橙色,记录硝酸银标准溶液的消耗体积VI。同时作空白试验(方法同2.2 )记录硝酸银标准溶液的消耗体积V2。 氯化物(C「)含量按下式计算: (V1 —V2) X 1.0 X 1OOOmg/L CI"= Vs 式中:V1 ――滴定水样消耗硝酸银溶液的体积,mL; V2 ――滴定空白水样消耗硝酸银溶液的体积,mL; 1.0――硝酸银标准溶液的滴定度,1mL相当于1mg Cl
水质-氯化物的测定-硝酸银滴定法
水质氯化物的测定硝酸银滴定法 1.范围 本方法规定了水中氯化物浓度的硝酸银滴定法。 本方法适用于天然水中氯化物的测定,也适用于经过适当稀释的高矿化度 水如咸水、海水等,以及经过预处理除去干扰物的生活污水或工业废水。 本方法适用的浓度范围为10~500mg/L的氯化物。高于此范围的水样经稀释后可以扩大其测定范围。 溴化物、碘化物和氰化物能与氯化物一起被滴定。正磷酸盐及聚磷酸盐分 别超过250mg/L及25mg/L时有干扰。铁含量超过10mg/L时使终点不明显。2.原理 在中性至弱碱性范围内(pH6.5~10.5)。以铬酸钾为指示剂,用硝酸银滴定氯化物时,由于氯化银的溶解度小于铬酸银的溶解度,氯离子首先被完全沉淀 出来后,然后铬酸盐以铬酸银的形式被沉淀,产生砖红色,指示滴定终点到达。 该沉淀滴定的反应如下: Ag++Cl-―AgCl 2Ag++CrO42-―Ag2CrO4 (砖红色) 3.试剂 分析中仅使用分析纯试剂及蒸馏水或去离子水。 3.1高锰酸钾,c(1/5KMnO4)=0.01mol/L。 3.2过氧化氢(H2O2),30%。 3.3乙醇(C2H5OH),95%。 3.4硫酸溶液,c(1/2H2SO4)=0.05mol/L。 3.5氢氧化钠溶液,c(NaOH)=0.05mol/L。 3.6氢氧化铝悬浮液:溶解125g硫酸铝钾[KAl(SO4)2·12H2O]于1L蒸馏水中, 加 热至60℃,然后边搅拌边缓缓加入55mL浓氨水放置约1h后, 移至大瓶中,用倾泻法反复洗涤沉淀物,直到洗出液不含氯离子为止。用水稀至约为300mL。 3.7氯化钠标准溶液,0.0141mol/L,相当于500mL/L氯化物含量:将氯化钠
精心整理固定污染源废气氯化氢的测定硝酸银容量法警告:氯化氢对人体有害,采样时,应视采样环境佩戴防护器具,避免吸入或 接触皮肤和眼睛。实验中使用的硝酸具有强氧化性和腐蚀性,操作时应佩戴防护用 品,溶液配制及样品预处理过程应在通风橱中进行操作。 1. 3。2. 3. 溶液 2Ag + + CrO 42-→Ag 2CrO 4↓(浅砖红色) 4.干扰和消除 当废气中含有硫化物、二氧化硫时,对本方法产生正干扰。硫化氢的浓度≤1000 mg/m3, 二氧化硫的浓度≤10000 mg/m3,均可通过加入1 ml的30%过氧化氢消除干扰。
颗粒态的氯化物对本方法产生正干扰;当废气中硫酸雾浓度>15 g/m3时,本方法在滴定过程中产生白色沉淀,影响滴定过程的终点判定;当待测液中铁含量>10 mg/L 时,对本方法滴定过程的终点判定产生影响。上述干扰可在采样时通过滤膜过滤去除。 废气中共存氯气(Cl2)时,可与氢氧化钠反应生成等量的氯离子和次氯酸根离子, 5 5.1 5.2 5.3 5.4 5.5 5.6 铬酸钾(K2&O4)。 5.7 酚酞(C20H14O4)。 5.8 硝酸溶液:c (HNO3) = 0.1 mol/L。 移取6.2 ml硝酸(5.1),用水稀释至1000 ml。 5.9乙醇溶液:1+1。
取250 ml无水乙醇(5.2),用水稀释至500 ml。 5.10 氢氧化钠吸收液:c (NaOH) =0.10 mol/L。 称取4.0 g氢氧化钠(5.4),用少量水溶解后全量转入1000 ml容量瓶,用水稀释并定容至标线,摇匀,临用现配。 5.11 氯化钠标准溶液:c (NaCl) =0.0141 mol/L。 用减量法称取8.24 g氯化钠(5.3)(精确至0.0001g),用少量水溶解后全量转入1000 ml容量瓶,用水稀释并定容至标线,摇匀。贮存于聚乙烯瓶中,于4C以下冷藏、密封可保存6个月。 准确移取10.00 ml上述标准溶液于100 ml容量瓶中,用水稀释定容至标线,摇匀,临用现配。按公式(1)准确计算氯化钠标准溶液的浓度: 式中:c(NaCl)——氯化钠标准溶液的浓度,mol/L; W——氯化钠的称取量,g; 58.44——氯化钠的摩尔质量,g/mol。 5.12 硝酸银标准溶液:c (AgNO3) =0.0141 mol/L。 称取2.4g硝酸银(5.5),溶解于水,稀释至1000ml,贮于棕色细口试剂瓶中,于4C以下冷藏保存,临用前标定。 5.12.2 标定 移取氯化钠标准溶液(5.11) 25.00 ml于250 ml锥形瓶中,加入25 ml水,摇匀。加入1ml铬酸钾指示剂(5.13),在不断摇动锥形瓶的同时,用硝酸银标准溶液(5.12)滴定至产生不消失的淡砖红色沉淀为止。记录硝酸银标准溶液的滴定体积。另取50 ml 水,同上述方法进行空白滴定。按公式(2)准确计算硝酸银标准溶液的浓度:
1 氢氧化钠标准滴定溶液 1.1 配制 称取110 g氢氧化钠, 溶于100 ml无二氧化碳的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液。按表1的规定,用塑料管量取上层清液,用无二氧化碳的水稀释至1000ml,摇匀 表1 1.2 标定 按表 2 的规定称取于105 ℃~110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示液(10 g/L) ,用配制好的氢氧化钠溶液滴定至溶液呈粉红色,并保持 30 s 。同时做空白试验。 表 2
氢氧化钠标准滴定溶液的浓度〔c(NaOH)] ,数值以摩尔每升(mol/ L) 表示,按以下公式计算: c(NaOH)=m×1000/ (V1-V2)M 式中: m —邻苯二甲酸氢钾的质量的准确数值,单位为克(g) V1—氢氧化钠溶液的体积的数值,单位为毫升(ml) V2一空白试验氢氧化钠溶液的体积的数值,单位为毫升(ml) M 一邻苯二甲酸氢钾的摩尔质量的数值,单位为克每摩尔 (g/mol)=204.22 2 盐酸标准滴定溶液 2.1 配制 按表3的规定量取盐酸,注入1000ml水中,摇匀 表3 2.2 标定 按表4的规定称取于270℃~300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,溶于50ml水中,加10滴溴甲酚绿一甲基红指
示液,用配制好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2 min ,冷却后继续滴定至溶液再呈暗红色。同时做空白试验。 表4 盐酸标准滴定溶液的浓度c(HCI)]. 数值以摩尔每升表示按以下公式计算 C(HCl)=m×1000/(V1-V2)M 式中: m一无水碳酸钠的质量的准确数值,单位为克(g) V1一盐酸溶液的体积的数值,单位为毫升(ml) V2一空白试验盐酸溶液的体积的数值,单位为毫升(ml) M 一无水碳酸钠的摩尔质量的数值,单位为克每摩尔=52.994 3. 重铬酸钾标准滴定溶液 C(1K2Cr2O7)=0.1mol/L 6 3. 1 方法一 3. 1. 1 配制 称取5g重铬酸钾,溶于1000ml水中,摇匀。 3. 1.2 标定
氯化物的测定硝酸银滴 定法 Document number:WTWYT-WYWY-BTGTT-YTTYU-2018GT
硝酸银滴定法 测 定 水 质 氯 化 物 实验操作说明
硝酸银滴定法测定水质氯化物 GB11896—89 1主题内容与适用范围 适用于天然水中氯化物的测定,也适用于经过适当稀释的高矿化度水如咸水、海水等,以及经过预处理除去干扰物的生活污水或工业废水。 本标准适用的浓度范围为10—500mg/L的氯化物。高于此范围的水样经稀释后可以扩大其测定范围。 溴化物、碘化物和氰化物能与氯化物一起被滴定。正磷酸盐及聚磷酸盐分别超过250mg/L及25mg/L时有干扰。铁含量超过10mg/L时使终点不明显。2原理 在中性至弱碱性范围内—,以铬酸钾为指示剂,用硝酸银滴定氯化物时,由于氯化银的溶解度小于铬酸银的溶解度,氯离子首先被完全沉淀出来后,然后铬酸盐以铬酸银的形式被沉淀,产生砖红色,指示滴定终点到达。该沉淀滴定的反应如下: Ag++Cl—→AgCl↓ 2Ag++CrO4→Ag2CrO4↓(砖红色) 3试剂
分析中仅使用分析纯试制及蒸馏水或去离子水。 高锰酸钾,C(1/5KMnO4)=/L。 过氧化氢(H2O2),30%。 乙醇(C6H5OH),95%。 硫酸溶液,C(1/2H2SO4)=/L。 氢氧化钠溶液,C(NaOH)=/L。 氢氧化铝悬浮液:溶解125g硫酸铝钾[KAl(SO4)2·12H2O]于1L蒸馏水中,加热至60℃,然后边搅拌边缓缓加入55mL浓氨水放置约1h后,移至大瓶中,用倾泻法反复洗涤沉淀物,直到洗出液不含氯离子为止。用水稀至约为300mL。 氯化钠标准溶液,C(NaCl)=/L,相当于500mg/L氯化物含量:将氯化钠(NaCl)置于瓷坩埚内,在500—600℃下灼烧40—50min。在干燥器中冷却后称取8.2400g,溶于蒸馏水中,在容量瓶中稀释至1000mL。用吸管吸取,在容量瓶中准确稀释至100mL。 此标准溶液含氯化物(C1-)。 硝酸银标准溶液,C(AgNO3)=/L:称取2.3950g于105℃烘半小时的硝酸银(AgNO3),溶于蒸馏水中,在容量瓶中稀释至1000mL,贮于棕色瓶中。 用氯化钠标准溶液标定其浓度:
. 氯化氢的测定硝酸银容量法固定污染源废气 应视采样环境佩戴防护器具,避免吸入或接触皮肤警告:氯化氢对人体有害,采样时,操作时应佩戴防护用品,溶液配制及样和眼睛。实验中使用的硝酸具有强氧化性和腐蚀性,品预处理过程应在通风橱中进行操作。 适用范围1. 本标准规定了测定固定污染源废气中氯化氢的硝酸银容量法。本标准适用于固定污染源废气中氯化氢的测定。33。8.0mg/m标准状态),方法检出限为2mg/m,测定下限为当采样体积为15 L ( 规范性引用文件2. 其有效版本适本标准内容引用了下列文件或其中的条款。凡是不注明日期的引用文件,用于本标准。GB/T 16157固定污染源排气中颗粒物测定与气态污染物采样方法固定污染源监测质量保证与质量控制技术规范(试行)HJ/T 373 方法原理3. 滴氯化氢被氢氧化钠溶液吸收后,在中性条件下,以铬酸钾为指示剂,用硝酸银标准溶液滴定,生成氯化银沉淀,过量的银离子与铬酸钾指示剂反应生成浅砖红色铬酸银沉淀,指示定终点,反应式如下:—- →NO + AgCl Cl + AgNO↓33 +2-2Ag + CrO →Ag CrO ↓(浅砖红色)4424.干扰和消除 3当废气中含有硫化物、二氧化硫时,对本方法产生正干扰。硫化氢的浓度≤1000 mg/m, 3二氧化硫的浓度≤10000 mg/m,均可通过加入1 ml的30%过氧化氢消除干扰。 3颗粒态的氯化物对本方法产生正干扰;当废气中硫酸雾浓度>15 g/m时,本方法在滴定过程中产生白色沉淀,影响滴定过程的终点判定;当待测液中铁含量>10 mg/L时,对本方法滴定过程的终点判定产生影响。上述干扰可在采样时通过滤膜过滤去除。 废气中共存氯气(Cl2)时,可与氢氧化钠反应生成等量的氯离子和次氯酸根离子,干扰氯化氢的测定。用碘量法测定次氯酸根,从总氯化物中减去其含量,即获得氯化氢含量。 5试剂和材料 除非另有说明,分析时均使用符合国家标准的分析纯试剂。实验用水为新制备的去离子 水或同等纯度的水。 5.1 硝酸:p (HN〇3) =1.42 g/ml。 5.2 无水乙醇::〇(CH3CH2OH) =0.79 g/ml。 5.3氯化钠(NaCl):优级纯。 使用前应放入瓷坩埚中,于400°C?500°C灼烧40 min?50 min,且不再发出爆裂声。置于干燥器中冷却备用。 5.4氢氧化钠(NaOH)。 5.5 硝酸银(AgNO3)。
硫代硫酸钠标准滴定溶液,0.1mol/L5.7.1 配制 溶解25g硫代硫酸钠在500mL新煮沸并冷却的水中,加0.11g碳酸钠,用新煮沸并冷却的水稀释至1L,静置24h,溶液贮存在密闭的玻璃瓶中。 5.7.2 标定 5.7.2.1 淀粉指示液(10g/L):按8.24配制。 5.7.2.2 称取(0.21±0.01)g经120℃干燥4h的基准重铬酸钾到250mL具玻璃塞的锥形瓶中,加100mL水溶解,拿去塞子,快速加入3g碘化钾,2g碳酸氢钠和5mL盐酸,立即塞好塞子,充分混匀,在暗处静置10min。用水洗涤塞子和锥形瓶壁,用硫代硫酸钠溶液(5.7.1)滴定至溶液呈黄绿色。加2mL淀粉指示液(5.7.2.1),继续滴定至蓝色消失,出现亮绿色为止。 5.7.3 计算 硫代硫酸钠标准滴定溶液浓度按式(7)计算: c(Na2S2O3)=m/0.04903×V (7) 式中:c(Na2S2O3)——硫代硫酸钠标准滴定溶液之物质的量浓度,mol/L; m——称取重铬酸钾质量,g; V——滴定用去硫代硫酸钠溶液实际体积,mL; 0.04903——与1.00mL硫代硫酸钠标准滴定溶液〔c(Na2S2O3)= 1 .000mol/L〕相当的以克表示的重铬酸钾的质量。 5.7.4 精密度 做五次平行测定,取平行测定的算术平均值为测定结果;五次平行测定的极差,应小于0.00040mol/L。 5.7.5 稳定性 硫代硫酸钠标准滴定溶液每月重新标定一次。 5.8.1 配制 称取4.9g已在120℃干燥过4h的重铬酸钾在1L量瓶中,加100mL水,摇动至溶解,用水稀释至刻度,贮存溶液在具玻璃塞的瓶中。 5.8.2 标定 置40mL水在250mL具玻璃塞的锥形瓶中,用滴定管加入40.00mL 重铬酸钾溶液(5.8. 1),塞上塞子,混匀。移去塞子,加入3g碘化钾,2g碳酸氢钠和5mL盐酸,立即塞上塞子,充分混匀,在暗处静置10min,用水洗涤塞子和锥形瓶内壁,用已标定的硫代硫酸钠标准滴定溶液(5.7)滴定至溶液呈黄绿色,加2mL淀粉指示液(5.7.2.1),继续滴定至蓝色消失,出现亮绿色为止。 5.8.3 计算 重铬酸钾标准滴定溶液浓度按式(8)计算: c(1/6K2Cr2O7)=c1V1/V2 (8) 式中:c(1/6K2Cr2O7)——重铬酸钾标准滴定溶液之物质的量浓度,mol/L ; c1——硫代硫酸钠标准滴定溶液浓度,mol/L; V1——滴定用去硫代硫酸钠标准滴定溶液实际体积,mL; V2——所取重铬酸钾溶液实际体积,mL。 5.8.4 精密度 做五次平行测定,取平行测定的算术平均值为测定结果;五次平行测定的极差,应小于0.00040mol/L。
水质氯化物的测定硝酸银滴定法 1 主题内容与适用范围 本标准规定了水中氯化物浓度的硝酸银滴定法. 本标准适用于天然水中氯化物的测定,也适用于经过适当稀释的高矿化度水如咸水、海水等,以及经过预处理除去干扰物的生活污水或工业废水. 本标准适用的浓度范围为10 ~ 500 mg/L 的氯化物,高于此范围的水样经稀释后可以扩大其测定范围。 溴化物、碘化物和氰化物能与氯化物一起被滴定。正磷酸盐及聚磷酸盐分别超过250mg/L及25mg/L时有干扰.铁含量超过10mg/L 时使终点不明显。 2 原理 在中性至弱碱性范围内(pH6.5~ 10.5 )、以铬酸钾为指示剂.用硝酸银滴定氯化物时,由于氯化银的溶解度小于铬酸银的溶解度,氯离子首先被完全沉淀出来后,然后铬酸盐以铬酸银的形式被沉淀.产生砖红色,指示滴定终点到达。该沉淀滴定的反应如下:++ Ag++Cl-—→AgCl↓ 2Ag++CrO4—→AgCr04↓(砖红色) 3 试剂 分析中仅使用分析纯试制及蒸馏水或去离子水。 3.1 高锰酸钾,C(1/5KMnO4)=0.01 mol/L。 3.2 过氧化氢(H202) , 30%。 3.3 乙醉(C6H5OH) , 95%。 3.4 硫酸溶液,C(1/2H2SO4)=0.05mol/L 。 3.5 氢氧化钠溶液,C(NaOH)=0.05mol/L 。 3.6 氢氧化铝悬浮液:溶解125g 硫酸铝钾〔KAl(SO4)2· 12H2O〕于1L蒸馏水 中.加热至60℃,然后边搅拌边缓缓加入55 mL 浓氨水放置约lh 后,移至大瓶中,用倾泻法反复洗涤沉淀物,直到洗出液不含氧离子为止。用水稀至约为300 mL 。 3.7 氯化钠标准溶液,C( Nacl )=0.0l4lmol/L,相当于500 mg/L氯化物含量:将氯化纳(Nacl )置于瓷坩祸内.在500~600℃下灼烧40~50min 。在干燥器中冷却后称取8.2400g ,溶于蒸馏水中,在容量瓶中稀释至1000mL。用吸管吸取10.0mL,在容量瓶中准确稀释至100mL。