
实验五双液系的气液平衡相图
一、实验目的与要求:
1、用沸点仪测定在一大气压下水——正丙醇双液系的气液平衡相图,确定其最低恒沸点温度及恒沸混合物的组成。
2、掌握双组分沸点的测定方法。通过实验进一步理解分馏原理。
3、用阿贝折射仪测定液体和蒸气的组成,学会用折光率确定双组分体系的组成。
二、预习要求:
1、了解绘制双液系相图的基本原理。
2、了解阿贝折射仪的使用方法。
3、了解本实验中的注意事项,如何判断气-液两相已达到平衡。
三、实验原理:
在常温下,两液态物质混合而成的体系称为双液系。两液体若只能在一定比例范围内互相溶解,称为部分互溶双液系,若两液体能以任意比例相互溶解,则称为完全互溶双液系。例如:苯-乙醇体系,正丙醇-水体系,环己烷—乙醇体系都是完全互溶双液系,苯-水体系则是部分互溶双液系。
液体的沸点是指液体的蒸气压与外压相等时的温度。在一定的外压下,纯液体的沸点有确定的值。但对于双液系来说,沸点不仅与外压有关,而且还与双液系的组成有关,即与双液系中两种液体的相对含量有关。
双液系在蒸馏时具有另一个特点是:在一般情况下,双液系的气相组成和液相组成并不相同。因此原则上有可能用反复蒸馏的方法,使双液系中的两液体互相分离。
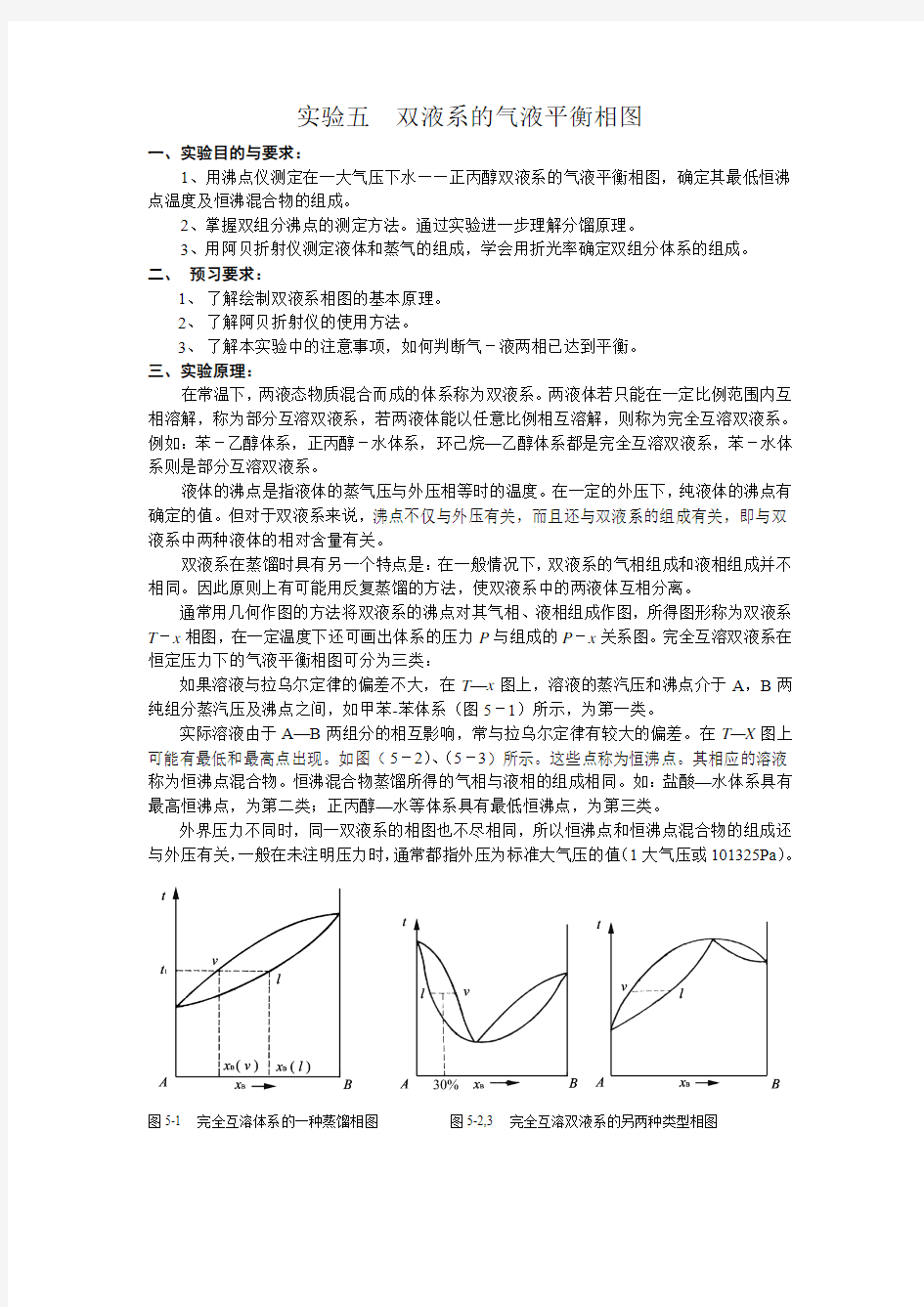
通常用几何作图的方法将双液系的沸点对其气相、液相组成作图,所得图形称为双液系T-x相图,在一定温度下还可画出体系的压力P与组成的P-x关系图。完全互溶双液系在恒定压力下的气液平衡相图可分为三类:
如果溶液与拉乌尔定律的偏差不大,在T—x图上,溶液的蒸汽压和沸点介于A,B两纯组分蒸汽压及沸点之间,如甲苯-苯体系(图5-1)所示,为第一类。
实际溶液由于A—B两组分的相互影响,常与拉乌尔定律有较大的偏差。在T—X图上可能有最低和最高点出现。如图(5-2)、(5-3)所示。这些点称为恒沸点。其相应的溶液称为恒沸点混合物。恒沸混合物蒸馏所得的气相与液相的组成相同。如:盐酸—水体系具有最高恒沸点,为第二类;正丙醇—水等体系具有最低恒沸点,为第三类。
外界压力不同时,同一双液系的相图也不尽相同,所以恒沸点和恒沸点混合物的组成还与外压有关,一般在未注明压力时,通常都指外压为标准大气压的值(1大气压或101325Pa)。
图5-1 完全互溶体系的一种蒸馏相图图5-2,3 完全互溶双液系的另两种类型相图
从相律来看,对二组分体系,当压力恒定时,在汽液二相共存区域中,自由度等于1,若温度一定,汽液两相成分也就确定。当总成分一定时,由杠杆原理知,两相的相对量也一定。反之,在一定的实验装置中,利用回流冷凝的方法保持气液两相相对量一定,则体系的温度恒定。此时,取出两相中的样品,用物理方法或化学方法分析两相的成分,可给出在该温度时气液两相平衡成分的坐标点。改变体系的总成分,再如上法可找出另一对坐标点,这样测得若干对坐标后,分别按气相点和液相点连成气相线和液相线,即得双液系的T -X 相图。本实验两相中的成分分析均采用折光率法,溶液折光率的测定,请看附录说明书。
物质的折光率是一特征数值,它与物质的浓度及温度有关。大多数液态有机化合物的折光率的温度系数为-0.0004,因此在测量物质的折光率时要求温度恒定。一般温度控制在±0.2℃时,能从阿贝折射仪上准确测到小数点后4位有效数字。溶液的浓度不同、组成不同折光率也不同。因此可先配制一系列已知组成,已知浓度的溶液,在恒定温度下测其折光率,作出组成??折光率工作曲线,便可通过测折光率的大小在工作曲线上找出未知溶液的浓度与组成。
沸点仪的构造及沸点的测定:
沸点仪的设计虽各有异,但其设计思想都集中在
如何正确地测定沸点和气液相的组成,以及防止过热
和避免分馏等方面。我们所使用的沸点仪如图5-4所
示:
这是一只带有回流冷凝管的长颈圆底烧瓶,冷凝
管底部有一球形小室D ,用以收集冷凝下来的汽相样
品。液相样品则通过烧瓶上的支管L 抽取,图中E 是
一根用300W 的电炉丝截制而成的电加热丝,直接浸
入溶液中加热,以减少溶液沸腾时的过热暴沸现象。
温度计安装时须注意使水银球一半浸在液面下,一半
露在蒸气中,并在水银球外围套一小玻璃管C ,这样,
溶液沸腾时,在气泡的带动下,使气液不断喷向水银
球而自玻璃管上端溢出;小玻璃管C 还可减少沸点周
围环境(如空气流动或其它热源的辐射)对温度计读
数可能引起的波动,因此这样测得的温度就能较好地
代表气液两相的平衡温度。
分析平衡时气相和液相的组成,须正确取得气相和液相样品。沸点仪中蒸气的分馏作用会影响气相的平衡组成,使取得的气相样品的组成与气液平衡时的组成产生偏差,因此要减少气相的分馏作用。本实验中所用沸点仪是将平衡时的蒸气凝聚在小球D 内,在容器A 中的溶液不会溅入小球D 的前提下,尽量缩短
小球D 与大球A 的距离,为防止分馏,尽量减少小球D 的体积即可达此目的。为了加速达到体系的平衡,可把D 球中最初冷凝的液体倾回到容器A 中。
沸点的测定:
用玻璃水银温度计测量溶液的沸点,如图5-5,固定在沸点仪上的水银温度计是全浸式的,使用时除了要对温度计的零点和刻度误差等因素进行校正外,还应作露茎校正。这是由于温度计未能完全置于被测体系中而引起的。根据玻璃与水银膨胀系数的差异,校正值的计算式为:
?t 露/℃=1.6?10-4·n ·(t 观-t 环)
图5-4 沸点仪 A-盛液容器; B-测量温度计; C-小玻管; D-小球; E-电热丝 F-冷凝管; G-温度计; L-支管
校正的方法是在测量沸点的温度计B旁再固定一支同样精度的温度计G,G的水银球底部应置于测量温度计沸点稳定值至固定温度计橡皮塞露出那一段水银柱的中部。读沸点时同时读取温度计G上的读数,得到温度t观和t环。在测量过程中,由于组成的变动,t观也在变动,因此温度计G的位置也应随着沸点稳定值而进行调整,始终让其置于温度计B露出水银柱的中部。式中的n是露出那段水银柱的长。1.6?10-4是水银对玻璃的相对膨胀系数。
沸点除了要进行露茎校正外,还需要进行压力校正。标准大气压下(P=760mmHg或101325Pa)测得的沸点为正常沸点。实际测量时,压力一般都不恰好为标准大气压。应用特鲁顿规则及克劳修斯-克拉贝龙公式,可得溶液沸点随大气压变动而变动的近似值:
?t C t C P Pa
/
(./)(/)?=
+?
?
-
27315
10
101325
101325
校正后,溶液的正常沸点为:
t沸=t观+?t压+?t露
图5-5 温度计露茎校正示意图
四、仪器与药品:
沸点仪1套阿贝折射仪1台
调压变压器1只超级恒温水浴1台
水银温度计(50~100℃,分度为0.1℃)1支
(0-50℃,分度为0.1℃)1支
10mL,20mL,50mL移液管各1支
干燥吸管20-30支擦镜纸
正丙醇(纯度99.5%)H2O。
五、实验步骤:
1、正丙醇-水溶液折光率与组成工作曲线的测定:
(1)配制正丙醇的质量百分比为10%、20%、30%、40%、55%、70%、80%、90%的正丙醇水溶液各10mL。准确计算正丙醇和水的量,用分析天平准确称量,为避免样品在称量过程中挥发,应尽量做到动作迅速。各个溶液确切的组成可按实际称量结果计算。
(2)调节恒温槽温度并使其稳定,使阿贝折射仪上的温度稳定在某一定值,用纯水校正阿贝折射仪,并测量上述溶液的折光率。为了适应季节的变化,可选择若干温度测量,一般可选25℃、30℃、35℃三个温度。
(3)在坐标纸上绘制不同温度时正丙醇-水溶液的组成与折光率工作曲线。
2、安装沸点仪:
将烘干的沸点仪按图5-4安装好,注意带有温度计和加热丝的橡皮塞要塞紧,不要触
及烧瓶底部,温度计和加热丝之间要有一定的距离,装上辅助温度计G。操作时要小心,防止打破水银温度计。
3、测正丙醇的沸点:
用50mL的移液管从支管L中加入正丙醇溶液50mL,注意观察电加热丝是否全部浸没在溶液中,水银温度计的水银球是否一半在溶液中,一半在蒸汽中。否则应调整好。夹上电热丝夹,打开冷却水,插上电源,调节变压器电压由零慢慢增加,观察加热丝上是否有小气泡逸出,电压控制在20V以内,溶液会慢慢沸腾。体系中的蒸汽经冷凝管冷凝后,聚于小球D中。冷凝液不断地冲刷D球,必要时可将D球中的冷凝液倾入烧瓶中,观察B温度计上的读数达到稳定,此时体系处于平衡状态,调整G温度计到正确位置;再稳定5-7分钟,准确记下温度计上t观和t环。并记下橡皮塞处温度计的读数。切断电源。
4、取样并测定组成(折光率)
用干燥的滴定管自冷凝管中取出小球D内的全部气相冷凝液,用另一支干燥吸管从L 口中取液相液1mL左右,分别放入带有磨口的小试管中,并将试管置于一盛有冷水的小烧瓶中让其冷却,防止挥发。
观察阿贝折射仪上的温度是否正确,用丙酮棉球擦拭镜面,并用吹风机吹干。把待测的气相液,液相液分别滴于镜面上迅速测量。每个样品测量2-3次,取读数的平均值。
5、用10mL移液管移取H2O 0.5 mL,从支管L加入烧瓶中,以改变溶液的总组成,按步骤3-4测量新体系中的液相、气相的折光率和平衡时的t观和t环。
6、依次向烧瓶中加入1,1.5,2,2.5,4,6mL的水,仍按步骤3-4逐一进行测量,分别得到不同组成时的汽相、液相的折光率及各自的沸点。
7、把该混合液置于试剂瓶中,用蒸馏水反复洗涤烧瓶;并用20mL的移液管加入40mL 蒸馏水,按以上方法测量水的折光率和沸点,并逐一加入0.5,1,1.5,2,4,10,20mL的正丙醇,改变体系的总组成,测量气液平衡时各个样品的折光率和沸点。
8、由以上测得的个点汽相、液相样品的折光率,从工作曲线上查找出其对应的组成。
在实验过程中,可观察到由正丙醇—纯水体系汽相、液相的折光率将向着降低或升高的方向移动,起初气液两相折光率的读数相差较小,相差慢慢增加,又慢慢减小,直至相等。表示此时已达到最低恒沸点组成,此组成为最低恒沸点混合物。该体系的最低恒沸点在87℃左右,正丙醇含量在69~71%之间。
9、实验结束时,先让老师审查实验结果,然后再拆除实验装置,做好卫生,方可离开实验室。
整个实验需要的时间较长,故在实验中可由两同学分别从水,从正丙醇开始做,各自进行一半的测量,共同完成一相图。
六、实验注意事项:
1、加热电阻丝一定要被欲测液体浸没,否则通电加热时可能会引起有机液体燃烧;所加电压不能太大,加热丝上有小气泡逸出即可;温度计的水银球不要直接碰到加热丝。
2、一定要使体系达到气液平衡,即温度读数要稳定,然后再取样;先停止通电再取样。
3、注意保护阿贝折射仪的棱镜,不能用硬物触及(如滴管),擦拭棱镜需用擦镜纸。
七、数据记录及处理:
室温:℃;大气压:(实验前)
大气压:(实验后)
沸点、折光率记录:
1、计算体系的正常沸点,把测得的沸点经压力,露茎校正后列入表中。
2、把气相、液相的折光率转换成百分含量一一对应的描绘在坐标纸上。
3、把气相点,液相点连接成平滑的曲线,并顺延交于一点,此点为最低恒沸点。
八、思考题:
1.双液系溶液的沸点有哪两个特点?
答:(1)沸点不仅与外压有关,而且与双液系的物质组成有关;
(2)在一般情况下,双液系的气相组成与液相组成并不相同。
2.恒沸点指什么?是什么因素引起的?
答:在T—X相图上有温度的最高点或最低点,并且此点的气相组成与液相组成相同。现象上表现为溶液中溶剂的蒸气压与组成的关系偏离拉乌尔定律,内在地看,是溶液中的分子间结构和相互作用与纯物质态时同种分子间的情况不同。
3.安装沸点仪时,加热电阻丝应该处于怎样的状态?
答:
4.B温度计的水银球应该处于什么状态?
答:
5.什么情况下才能取样?
答:
6.如何判断气液已达到平衡?
答:
7.变亚器电压应控制在多少伏以内?为什么?
答:
8.温度计G在实验装置中起到什么作用?它的水银球应该在什么位置?
答:
实验二二元液系气液平衡相图 一、实验目的 1、了解环己烷—乙醇系的沸点—组成图 2、由图上得出其最低恒沸温度及最低恒沸组成(含乙醇%) 3、学会使用数字阿贝折射仪 4、学会使用WTS—05数字交流调压器 二、原理 一个完全互溶双液体系的沸点—组成图,表明在气液二相平衡时沸点和二相成分间的关系,它对了解这一体系对行为及分馏过程都有很大的实用价值。 在恒压下完全互溶双液系的沸点与组分关系有下列三种情况:1、溶液沸点介于二纯组分之间;2、溶液有最高恒沸点;3、溶液有最低恒沸点。 图1表示有最低恒沸点,本次实验图形也像如此的样子,A′LB′代表液相线的交点表示在该温度时互成平衡的二相的成份。 绘制沸点—成份图的简单原理如下:当总成份为X的溶液开始蒸馏时,体系的温度沿虚线上升,开始沸腾时成份为Y的气相生成。若气相量很少,x、y二点即代表互成平衡时液气二相成份。继续蒸馏,气相量逐渐增多,沸点沿虚线继续上升,气液二相成份分别在气相和液相线上沿箭头指示方向变化。当二相成份达到某一对数值x′和y′,维持二相的量不变,则体系气液二相又在此成份达到平衡,而二相的物质数量按杠杆原理分配。 本实验利用回流的方法保持气液二相相对量一定,则体系温度恒定。待二相平衡后,取出二相的样品,用阿贝折光仪测定其折射率。得出该温度下气液二相平衡成份的坐标点,改变体系的总成份,再用上法找出一对坐标点,这样测得若干坐标点后,分别按气相点和液相点连成气相线和液相线,即得T—X平衡图。 三、步骤 1、安装接通仪器,打开冷凝水; 2、加入环己烷20ml,蒸馏至沸腾,待小兜有液体后回流三次,温度平衡2—3分钟基本不变,记下温度,关闭调压器; 3、A组加入乙醇0.5ml,用上法测定温度,然后关闭调压器,取出气相,液相的样品,测其折射率,以后分别加入1.0,2.0,4.0,8.0,12.0ml乙醇;
双液系气-液平衡相图的绘制 一、实验目的 (1)用回流冷凝法测定沸点时气相与液相的组成,绘制双液系相图。找出恒沸点混合物的组成及恒沸点的温度。 (2)掌握测定双组分液体的沸点及正常沸点的测定方法。 (3)了解阿贝折射计的构造原理,熟悉掌握阿贝折射计的使用方法。 二、实验原理 2.1液体的沸点 液体的沸点是液体饱和蒸汽压和外压相等时的温度,在外压一定时,纯液体的沸点有一个确定值。 2.2双液系的沸点 双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。理想的二组分体系在全部浓度范围内符合拉乌尔定律。结构相似、性质相近的组分间可以形成近似的理想体系,这样可以形成简单的T-x (y )图。大多数情况下,曲线将出现或正或负的偏差。当这一偏差足够大时,在T-x (y )曲线上将出现极大点(负偏差)或极小点(正偏差)。这种最高和最低沸点称为恒沸点,所对应的溶液称为恒沸混合物。 恒定压力下,真实的完全互溶双液系的气-液平衡相图(T -x ),根据体系对拉乌尔定律的偏差情况,可分为3类: (1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图1(a)所示。 (2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图1(b)所示。 (3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压都大,混合物存在着最低沸点,如水-乙醇体系,如图1(c))所示。 图1. 二组分真实液态混合物气—液平衡相图(T-x 图) 考虑综合因素,实验选择具有最低恒沸点的乙醇-乙酸乙酯双液系。根据相平衡原理,对二组分体系,当压力恒定时,在气液平衡两相区,体系的自由度为1。若温度一定时,则气液亮相的组成也随之而定。当溶液组成一定时,根据杠 t A t A t A t B t B t B t / o C t / o t / o x B x B x B A B A A B B (a) (b) (c)x ' x '
实验名称:二元液系相图 学院:XXXXXXXXXX 班级:XXXXXXXXX 姓名(学号):XXX(XXXXXXXX) 指导教师:XXX 实验时间:XXXXXXXXXXXXXX
二元液系相图 一、实验目的 1.测定环己烷-乙醇系统的沸点组成图(T-X图)。 2.掌握阿贝(Abbe)折光仪的使用方法。 二、实验原理 两种液态物质以任何比例混合都形成均相溶液的系统称这完全 互中溶双液系。在恒定压力下溶液沸点与平衡的气液相组成的关系,可用沸点-组成图(t-x图)表示。 完全互溶双液系的沸点-组成图可分为两三种: 一种为最简单的情况,溶液沸点介于两个纯组分沸点之间,如图6-1所示。纵坐标表示温度,横坐标表示组分B的摩尔分数(x B,y B)。下面一条曲线表示气液平衡时温度(即溶液沸点)与液想组成的关系,称液相线(T-x线)。上面的线表示平衡温度与气相组成的关系,称气相线(T-y线)。若总组成为Z B的系统在压力p及温度t时达到气液两相平衡,其液相组成为x B气相组成为y B(见图6-1)。 另两种类型为具有恒沸点的完全互溶双液系统气液平衡相图,如图6-2所示。其中(a)为具有低恒沸点相图,(b)为具有高恒沸点相图。这两类相图中气相线与液相线在某处相切。相切点对应的温度称为恒沸温度,对应组成的混合物称恒沸混合物。恒沸混合物在恒沸点达气液平衡,平衡的气、液组成相同。同一双液系在不同压力下,恒沸点及恒沸混合物是不同的。
本实验绘制环己烷-乙醇二元液系的T-X图。其方法为将不同组成的溶液于蒸馏仪中进行蒸馏,沸腾平衡后记下温度,依次吸取少量的蒸馏液和蒸出液。分别用阿贝折光计测定其折射率,然后由环己烷-乙醇的折射率-组成标准曲线或其数据表确定相应组成,从而绘制环己烷-乙醇二元液系相图。 三、仪器和试剂 沸点测定仪;取样管;阿贝折光仪。 环己烷(分析纯);无水乙醇(分析纯);环己烷摩尔分数分别为0.2、0.4、0.6、0.8的乙醇溶液。 四、实验步骤 1.纯液体折光率的测定 分别测定乙醇和环己烷的折光率。 2.标准曲线的绘制 测定环己烷摩尔分数分别为0.2、0.4、0.6、0.8的乙醇溶液的折光率,绘制标准曲线。 3.测定沸点-组成数据 1)安装沸点测定仪。 2)溶液配制。 粗略配制环己烷质量百分数分别为0.05、0.1、0.2、0.45、0.55、0.6、0.7、0.8、0.9等组成的环己烷-乙醇溶液约50ml。
`` 实验2 双液系的气液平衡相图 唐盛昌2006011835 分6 同组实验者:徐培 实验日期:2008-10-9,提交报告日期:2008-10-23 带实验助教:尚培华 1 引言(简明的实验目的/原理) 实验目的: 1.用沸点仪测定在常压下环已烷—乙醇的气液平衡相图。 2.掌握阿贝折射仪的使用方法。 实验原理: 将两种挥发性液体混合,若该二组分的蒸气压不同,则溶液的组成与其平衡气相的组成不同。在压力保持一定,二组分系统气液达到平衡时,表示液态混合物的沸点与平衡时组成关系的相图,称为沸点和组成(T-x)图。沸点和组成(T-x)的关系有下列三种:(1)理想液体混合物或接近理想液体混合物的双液系,其液体混合物的沸点介于两纯物质沸点之间见图5—1(a);(2)各组分蒸气压对拉乌尔定律产生很大的负偏差,其溶液有最高恒沸点见图5—1(b);(3)各组分蒸气压对拉乌尔定律产生很大的正偏差,其溶液有最低恒沸点见图5—1(c)。第(2)、(3)两类溶液在最高或最低恒沸点时的气液两相组成相同,加热蒸发的结果只使气相总量增加,气液相组成及溶液沸点保持不变,这时的温度称恒沸点,相应的组成称恒沸组成。第一类混合物可用一般精馏法分离出这两种纯物质,第(2)、(3)类混合物用一般精馏方法只能分离出一种纯物质和另一种恒沸混合物。 图1 沸点组成图 为了测定二元液系的T-x图,需在气液达到平衡后,同时测定溶液的沸点、气相和液相组成。 本实验是测定具有最低恒沸点的环己烷—乙醇双液系的T-x图。方法是用沸点仪(图2)直接测定一系列不同组成之溶液的气液平衡温度(即沸点),并收集少量馏出液(即气相冷凝液)及吸取少量溶液(即液相),分别用阿贝折射仅测定其折射率。为了求出相应的组成,必须先测定已知组成的溶液的折射率,
双液系气液平衡相图的绘制 (物化实验得认真做) 一、实验目的 1.用回流冷凝法测定沸点是气相和液相的组成,绘制双液系相图。 2找出恒沸点混合物的组成和恒沸点的温度。掌握测定双组分液体的沸点及正常沸点的测定方法。 3了解阿贝折射计的构造原理,熟悉掌握阿贝折射计的使用方法。 二、实验原理 1液体的沸点是液体饱和蒸汽压和外压相等时的温度,在外压一定时,纯液体的沸点有一个确定值。但双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。 2大多数情况下,T-x曲线将出现或正或负的偏差,当这个偏差足够大的时候,在曲线上将出现极大点或极小点。这种极大点或者极小点就称为恒沸点。 3考虑综合因素,实验选择具有最低恒沸点的乙醇-乙酸乙酯双液系。 4根据相平衡原理,对两组分体系,当压力恒定时,在气液平衡两相去,体系的自由度为1.若温度一定时,则气液两相的组成也随之而定。当原溶液的组成一定时,根据杠杆原理,两相的相对量一定。反之,实验中利用回流的方法保持气液两相相对量一定,测量体系温度不发生改变时,即两相平衡后,取出两相的样品,用阿贝折射计测定气相、液相的折射率,再通过预先测定的折射率-组成工作曲线来确定平衡时气相、液相的组成(即该温度下气液两相平衡成分的坐标点)。改变体系的总成分,再如上法找出另一对坐标点。这样得若干对坐标点分别按气相点和液相点连成气相线和液相线,即得T-x平衡图。 三、实验仪器和试剂 1、实验仪器
沸点仪、阿贝折射仪、调压变压器、温度计两只、干燥小烧杯3只,干燥5ml小试管16只,软木塞若干,擦镜纸 2、实验试剂 无水乙醇(AR)乙酸乙酯(AR)丙酮(C.P)乙醇体积分数为5%、10%、15%、22%、38%、50%、70%、90%组成的乙醇-乙酸乙酯溶液。 四、实验过程 1、将干燥的沸点仪安装好。从侧管加入约20mL5%混合液于蒸馏瓶内,并使温度计浸入液体内。冷凝管接通冷凝水。将稳流电源电压调至13V左右,使加热丝将液体加热至缓慢沸腾。最初在冷凝管下端内的液体不能代表平衡气相的组分,为加速达到平衡,可以等转折处液体收集较多时,倾斜装置是冷凝液体流回至圆底烧瓶,重复三次,待温度计的读数稳定后应再维持3~5min,以使体系达到平衡。记下温度计的读数,即为该混合液的沸点。同时读出环境的温度;算出露茎温度,以便进行温度的校正。 2、切断电源,停止加热,用吸管从小槽中取出气相冷凝液,同时用另一只干燥胶头滴管,从侧管处吸取容器中的溶液约1~2ml,分别转移到两只干燥的小试管中,立即塞紧。两只小试管置于盛有冷水的小烧杯中保持待测,以防组分改变。测定各自的折光率。将沸点仪的剩余溶液倒入回收瓶。按5%混合液的操作,依次测定10%、15%、22%、38%、50%、70%、90%混合液的沸点和气-液平衡时的气、液相折光率,同时直接测量乙醇(AR),乙酸乙酯(AR)的折光率(无须测定沸点) 3、折光率的测定先用去离子水测定阿贝折射计的读数校正值(水的折射率为 1.3325)。分别测定上面取的气相和液相样品的折射率。每次加样要测读数2次,取其平均值,并用水读数校正和温度读数校正,即为所测样品在该温度的折射率,每次加样测量之前,必须先将折光仪的棱镜面洗净,方法是用数滴丙酮淋洗,再用擦镜纸轻轻拭去残留在镜面上的溶剂,阿贝折射计在是用完毕后也必须将镜面处理干净。 五、实验分析和数据处理 1、实验注意事项 (1)测定折光率时,动作应迅速,以避免样品中易挥发组元损失,确保数据准确。
实验三双液系气液平衡相图的绘制姓名:学号: 班级:实验日期:2015年9月21日 提交报告日期:2015年9月28日 1、实验目的 1.了解沸点仪的原理和使用方法。 2.在大气压力下用沸点仪测绘环己烷-乙醇双液系的气相平衡相图。 3.掌握阿贝折射仪的使用方法。 2、实验原理 双液系是指两种液态物质混合而成的物系。双液系可以分为完全互溶双液系、部分互溶双液系和完全不溶双液系。 将两种挥发性液体混合,若该二组分的蒸气压不同,则溶液的组成与其平衡气相的组成不同。在压力保持一定,二组分系统气液达到平衡时,表示液态混合物的沸点与平衡时组成关系的平衡状态图,简称相图。沸点和组成的关系有下列三种:(1)理想液体混合物或接近理想液体混合物的双液系,其液体混合物的沸点介于两纯物质沸点之间;(2)各组分蒸气压对拉乌尔定律产生很大的负偏差,其溶液有最高恒沸点见;(3)各组分蒸气压对拉乌尔定律产生很大的正偏差,其溶液有最低恒沸点。第(2)、(3)两类溶液在最高或最低恒沸点时的气液两相组成相同,加热蒸发的结果只使气相总量增加,气液相组成及溶液沸点保持不变,这时的温度称恒沸点,相应的组成称恒沸组成。第一类混合物可用一般精馏法分离出这两种纯物质,第(2)、(3)类混合物用一般精馏方法只能分离出一种纯物质和另一种恒沸混合物。 为了测定二元液系的相图,需在气液达到平衡后,同时测定溶液的沸点、气相和液相组成。 本实验是测定具有最低恒沸点的环己烷—乙醇双液系的相图。方法是用沸点仪直接测定一系列不同组成之溶液的气液平衡温度(即沸点),并收集少量馏出液(即气相冷凝液)及吸取少量溶液(即液相),分别用阿
编号123456 7 8 贝折射仅测定其折射率。为了求出相应的组成,必须先测定已知组成的溶液的折射率,作出折射率对组成的工作曲线,在此曲线上即可查得对应于样品折射率的组成。 3、实验仪器和试剂 1.仪器 沸点仪1个、加热电源(0.5kW)1台、阿贝折射仪1台、长颈胶头滴管2支、镜头纸、 超级恒温槽、50~10℃温度计1支。 2.药品 乙醇、环己烷、丙酮。 4、实验操作步骤及方法要点 1.启动超级恒温槽的加热和搅拌系统,把超级恒温槽的控制温度调至27℃。 2.测定标准溶液的折射率 用与超级恒温槽相连接的已经恒温的阿贝折射仪测定标准溶液的折射率,作折射率对组成的工作曲线。 3.溶液沸点及气液平衡组成的测定。 往沸点仪中加入20mL乙醇,通冷却水,打开电源并调电压至12V,加热溶液至沸腾。待其温度计上所指示的温度保持恒定后,读下该温度值,同时停止加热,并立即在小泡中取气相冷凝液,迅速测定其折射率,并用另一滴管取少量液相测定其折射率。 接下来,往沸点仪中分别加入1mL、2mL、2mL、2mL、5mL环己烷,并按前述方法测定气液平衡温度和气液两相的折光率。结束后,将沸点仪中溶液倒入回收瓶并用电吹风把沸点仪烘干。 往沸点仪中加入20mL环己烷,经行实验。在之后往沸点仪中分别加入的是1mL、2mL、2mL、2mL、5mL乙醇。 注意:每次测量折射率后,要将折射仪的棱镜打开晾干,以备下次测定用。 5、实验数据 1)原始实验测量数据 大气压力:97.13kPa 室温:25.5℃ 以下数据测定过程中阿贝折射仪(恒温槽)温度为27.0℃。
双液系的气-液平衡相图 一实验目的 1.绘制在pθ下环己烷-异丙醇双液系的气-液平衡相图,了解相图和相律的基本概念; 2.掌握测定双组分液体的沸点及正常沸点的方法; 3.掌握用折光率确定二元液体组成的方法。 二实验原理 在常温下,任意两种液体混合组成的体系称为双液体系。若两液体能按任意比例互溶,则称完全互溶双液体系,若只能部分互溶,则称部分互溶双液体系。 液体的沸点是指液体的蒸汽压与外界压力相等时的温度,在一定的外压下,纯液体的沸点有其特定值,但双液系的沸点不仅与外压有关而且还与两种液体的相对含量有关。 通常,如果液体与拉乌尔定律的偏差不大,在T—X图上溶液的沸点介于A、B二纯液体的沸点之间见图中于 (a)。而实际溶液由于A 和B二组分的相互影响,常与拉乌尔定律有较大偏差,在T—X图上就会有最高或最低点出现,这些点称为恒沸点,其相应的溶液称为恒沸点混合物,如图2-4-1(b),(c)所示。恒沸点混合物蒸馏时,所得的气相与液相组成相同,因此通过蒸馏无法改变其组成。 本实验是用回流冷凝法测定环已烷—异丙醇体系的沸点—组成图。其方法是用阿贝折射仪测定不同组成的体系,在沸点温度时气、
液相的折射率,再从折射率—组成工作曲线上查得相应的组成,然后绘制沸点—组成图。 三仪器和试剂 沸点仪1套;恒温槽1台;阿贝折射仪1台;量筒8个;玻璃漏斗8个;滴管2个;环己烷(分析纯);异丙醇(分析纯); 实验装置如下:
四实验步骤 1.工作曲线的绘制 配制环己烷的质量百分数0.10, 0.20, 0.30, 0.40, 0.50, 0.60, 0.70, 0.80和0.90的环己烷-异丙醇溶液。计算所需环己烷和异丙醇的质量,并用分析天平准确称取。为避免样品挥发带来的误差,称量应尽可能的迅速。各种溶液的确切组成要按照实际称样结果精确计算。 调节超级恒温水浴的温度为35度,使阿贝折光仪上温度与其保持一致。分别测定上述九个溶液以及异丙醇和环己烷的折光率。 根据这些数据作出折光率-组成工作曲线。
化工专业实验报告 实验名称:二元气液平衡数据的测定 实验人员: 同组人 实验地点:天大化工技术实验中心 606 室 实验时间: 2015年4月20日下午14:00 年级: 2014硕;专业:工业催化;组号: 10(装置2);学号:指导教师:______赵老师________ 实验成绩:_____________________
一.实验目的 (1)测定苯-正庚烷二元体系在常压下的气液平衡数据; (2)通过实验了解平衡釜的结构,掌握气液平衡数据的测定方法和技能; (3)应用 Wilson 方程关联实验数据。 二.实验原理 气液平衡数据是化学工业发展新产品、开发新工艺、减少能耗、进行三废处理的重要基础数据之一。化工生产中的蒸馏和吸收等分离过程设备的改造与设计、挖潜与革新以及对最佳工艺条件的选择,都需要精确可靠的气液平衡数据。这是因为化工生产过程都要涉及相间的物质传递,故这种数据的重要性是显而易见的。 平衡数据实验测定方法有两类,即间接法和直接法。直接法中又有静态法、流动法和循环法等。其中循环法应用最为广泛。若要测得准确的气液平衡数据,平衡釜是关键。现已采用的平衡釜形式有多种,而且各有特点,应根据待测物系的特征,选择适当的釜型。用常规的平衡釜测定平衡数据,需样品量多,测定时间长。所以,本实验用的小型平衡釜主要特点是釜外有真空夹套保温,釜内液体和气体分别形成循环系统,可观察釜内的实验现象,且样品用量少,达到平衡速度快,因而实验时间短。 以循环法测定气液平衡数据的平衡釜类型虽多,但基本原理相同,如图 1 所示。当体系达到平衡时,两个容器的组成不随时间变化,这时从 A 和 B 两容器中取样分析,即可得到一组平衡数据。 图1 平衡法测定气液平衡原理图 当达到平衡时,除了两相的压力和温度分别相等外,每一组分的化学位也相等,即逸度相等,其热力学基本关系为:
双液系的气-液平衡相图 1. 简述由实验绘制环己烷-乙醇气-液平衡T-x相图的基本原理。 答:通过测定不同沸点下组分的气、液相的折射率,在标准的工作曲线上找出该折射率对应的浓度,结合其沸点画出平衡相图。 2. 在双液系的气-液平衡相图实验中,作环己烷-乙醇的标准折光率-组成曲线的目的是什么? 答:作标准曲线的目的是通过测气、液相相得折射率从而在标准工作曲线上找出对应的浓度。 3. 用精馏的方法是否可把乙醇和环己烷混合液完全分离,为什么? 答:不能完全分离。因为环己烷-乙醇二组分具有最低恒沸点。 4. 测定纯环己烷和纯乙醇的沸点时,沸点仪中有水或其它物质行吗? 答:有水和其他物质都是不行的。因为有水和其他物质会使所测沸点改变。 5. 为什么工业上常生产95%酒精?只用精馏含水酒精的方法是否可能获得无水酒精? 答:因为水-乙醇二组分具有最低恒沸点,所以工业上常生产95%的酒精。用精馏的方法无法获得无水酒精,只能获得95%的酒精。 6. 在双液系的气-液平衡相图实验中,如何判断气-液相达平衡状态?
答:观察贝克曼温度计的读数,如果读数稳定3-5分钟,说明已达平衡状态。 7. 在双液系的气-液平衡相图实验中,每次加入沸点仪中的环己烷或乙醇是否应按记录表所规定的体积精确计量?为什么? 答:不需要按记录表的加。因为组分的浓度不是按所加物质的量计算得来的,而是通过测折射率间接得到的。 8. 在双液系的气-液平衡相图实验中,在测定沸点时,溶液出现分馏现象,将使绘出的相图图形发生什么变化? 答:出现馏分将使测得的沸点偏高,使相图向上移动。 9. 在双液系的气-液平衡相图实验中,蒸馏器中收集气相冷凝的小球大小对结果有何影响? 答:小球太小难以收集气相,小球太大,小球内的组分更新太慢,产生馏分,导致实验误差。 10. 在双液系的气-液平衡相图实验中,通过测定什么参数来测定双液系气-液平衡时气相和液相的组成? 答:通过测定组分的折射率来测定双液系气-液平衡时气相和液相的组成。 11. 在双液系的气-液平衡相图中,如何通过测定溶液的折光率来求得溶液的组成? 答:通过测得的折射率在标准曲线上找出对应的浓度,根据气、液相平衡浓度与测得的沸点作出平衡相图。
双液系的气—液平衡相图 一、实验目的 1.绘制在Pθ环已烷—乙醇的气液平衡相图,了解相图和相律基本概念; 2.掌握测定双组分液体的沸点及正常沸点的方法; 3.掌握用折光率确定二元液体的组成方法。 二、实验原理 液体的沸点是指液体的蒸气压和外压相等时的温度,在一定的外压下,纯液体的沸点有确定值。但双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。根据相律: 自由度=组分数-相数+2 因此,一个气—液共存的二组分体系,其自由度为2。只要任意再确定一个变量,整个体系的存在状态就可以用二维图形来描述。 两种挥发性液体混合,若该二组分的蒸气压不同,则溶液的组成与其平衡气相的组成不同。在压力保持一定,二组分系统气液达到平衡时,表示液态混合物的沸点与平衡时组成关系的相图,称为沸点和组成(T-x)图。沸点和组成(T-x)的关系有下列三种: (1)理想液体混合物或接近理想液体混合物的双液系,其液体混合物的沸点介于两纯物质沸点之间见图1(a); (2)各组分蒸气压对拉乌尔定律产生很大的负偏差,其溶液有最高恒沸点见图1(b); (3)各组分蒸气压对拉乌尔定律产生很大的正偏差,其溶液有最低恒沸点见图1(c)。 第(2)、(3)两类溶液在最高或最低恒沸点时的气液两相组成相同,加热蒸发的结果只使气相总量增加,气液相组成及溶液沸点保持不变,这时的温度称恒沸点,相应的组成称恒沸组成。
图1. 沸点和组成(T-x)图 本实验是测定具有最低恒沸点的环己烷—乙醇双液系的T-x图。方法是用沸点仪(如图2所示)直接测定一系列不同组成之溶液的气液平衡温度(即沸点),并收集少量馏出液(即气相冷凝液)及吸取少量溶液(即液相),分别用阿贝折光仪测定其折光率。根据已知组成的溶液折光率,作出一定温度下(25℃)该溶液的折光率—组成工作曲线,然后根据测得的样品溶液的气液两相的折光率,在此曲线上即可按描法得到待测未知样品溶液的组成。 图2. 沸点测定仪示意图 三、仪器与药品 沸点测定仪1只丙酮(分析纯) 水银温度计(50~100℃,分度值0.1℃)1支超级恒温水浴1台玻璃温度计(0~100℃,分度值1℃)1支称量瓶(高型)10只
基 础 化 学 实 验 实验一纯液体饱和蒸气压的测量
= ?+C R ,由斜率可求算液体的?H。 一、目的要求 1.明确纯液体饱和蒸气压的定义和汽液两相平衡的概念,深入了解纯液体饱和蒸气压与温度的关系公式——克劳修斯-克拉贝龙方程式。 2.用数字式真空计测量不同温度下环己烷的饱和蒸气压。初步掌握真空实验技术。 3.学会用图解法求被测液体在实验温度范围内的平均摩尔气化热与正常沸点。 二、实验原理 通常温度下(距离临界温度较远时),纯液体与其蒸气达平衡时的蒸气压称为该温度下液体的饱和蒸气压,简称为蒸气压。蒸发1mol液体所吸收的热量称为该温度下液体的摩尔气化热。 液体的蒸气压随温度而变化,温度升高时,蒸气压增大;温度降低时,蒸气压降低,这主要与分子的动能有关。当蒸气压等于外界压力时,液体便沸腾,此时的温度称为沸点,外压不同时,液体沸点将相应改变,当外压为1atm (101.325kPa)时,液体的沸点称为该液体的正常沸点。 液体的饱和蒸气压与温度的关系用克劳修斯-克拉贝龙方程式表示为: d ln p?H vap d T RT2m 式中,R为摩尔气体常数;T为热力学温度;?H为在温度T时纯液体的 vap m 摩尔气化热。假定?H与温度无关,或因温度范围较小,?H可以近似 vap m vap m 作为常数,积分上式,得: ln p=-?H1 v ap m R T 其中C为积分常数。由此式可以看出,以ln p对1/T作图,应为一直线,直 线的斜率为-? v ap H m vap m 三、仪器、试剂 蒸气压测定装置1套循环式真空泵1台 精密数字压力计1台数字控温仪1只 无水乙醇(分析纯) 四、实验步骤 1.读取室内大气压 2.安装仪器:将待测液体(本实验是无水乙醇)装入平衡管,之后将平衡管安装固定。 3.抽真空、系统检漏 4排气体:先设定温度为20℃,之后将进气阀打开,调压阀关闭,稳定后,
二元液系相图 一、实验目的 二、1、用沸点仪测定在常压下环己烷-乙醇的气液平衡相图。 三、2、了解沸点的测定方法。 四、3、掌握阿贝折射仪的测量原理及使用方法。 五、二、实验原理 六、1、液体的沸点是指液体的饱和蒸汽压和外压相等时的温度。在一定外压下,纯液体的沸点有确定的值。但对于完全互溶的双液系,沸点不仅与外压有关,而且还与双液系的组成有关。 七、 八、2、用阿贝折射仪测定气液组成的折光率,来获得气液组成。 三、实验装置
四、仪器及试剂 仪器:EF-03沸点测量仪、阿贝折射仪、沸点仪、取样管 试剂:无水乙醇、环己烷 五、实验步骤 1、安装好干燥的沸点仪。 2、加入纯乙醇30ml左右,盖好瓶塞,使电热丝浸入液体中,温度传感器与液面接触。
3、开冷凝水,将稳流电源调至(1.8-2.0A),接通电热丝,加热至沸腾,待数字温度计上读数恒定后,读下该温度值。 4、关闭电源,停止加热,将干燥的取样管自冷凝管上端插入冷凝液收集小槽中,取气相冷凝液样,迅速用阿贝折射仪测其折光率。 5、用干燥的小滴管取液相液样,用阿贝折射仪测其折光率。 6、分别在沸点仪中加入混合液,1、2、3、4、5、6重复上述操作。 7、根据环己烷-乙醇标准溶液的折射率,将上述数据转换成环己烷的摩尔分数,绘制相图。 8、实验完毕后,关闭冷凝水,关闭电源,整理实验台。 六、阿贝折光仪的使用 1、用擦镜纸将镜面擦干,取样管垂直向下将样品滴加在镜面上,注意不要有气泡,然后将上棱镜合上,关上旋钮。 2、打开遮光板,合上反射镜。 3、轻轻旋转目镜,使视野最清晰。 4、旋转刻度调节手轮(下手轮),使目镜中出现明暗面(中间有色散面),图a。
双液系的气液平衡相图 实验者:林澄昱生04 2010030007 同组者:张弯弯 实验日期:2012-03-10 提交日期:2012-03-16 实验指导:刘晓惠 1引言 两种蒸气压不同的挥发性液体在混合之后,其溶液组成与与其平衡气相的组成不同。 在恒外压下,二组分系统达到气液平衡时,表示液态混合物的沸点与平衡时气液两相组成关系的相图,称为沸点和组成(T-x)图。大致分为三大类,包括: (1)理想液体混合物或接近理想液体混合物的双液系,其混合物沸点介于两纯物质沸点之间。见图1(a); (2)各组分蒸气压对拉乌尔定律产生很大的负偏差,有最高恒沸点。见图1(b); (3)各组分蒸汽压对拉乌尔定律产生很大的正偏差,有最低恒沸点。见图2(c)1。 图1 三类沸点组成(T-x)图 本实验为了绘制常压下环己烷-乙醇的气液平衡相图,先利用阿贝折射仪测定一系列已知组成混合溶液及纯液体的折射率,绘制标准曲线,再通过沸点仪测定一系列混合溶液的沸点,收集少量气相冷凝液以及溶液,测定其各自折射率,反查标准曲线得到气液两相的组成,绘得双液系的气液平衡相图。 2实验操作 2.1实验药品、仪器及测试装置示意图 2.1.1实验药品 环己烷,无水乙醇; 2.1.2实验仪器 沸点仪,调压器,温度传感器,锥形瓶,分析天平(AR2140),阿贝折射 仪(型号不明,为靠近恒温箱的一台),恒温箱,胶头滴管,10ml吸量管, 洗耳球; 2.1.3装置示意图
1. 冷却水入口 2. 气相冷凝液贮存小泡 3. 温度传感器 4. 喷嘴 5. 电热丝 6. 调压器2 图2 沸点仪 2.2实验条件 恒温槽温度:26 ℃ 室温:未测 气压:未测 2.3实验操作步骤及方法要点 2.3.1标准曲线的测定及绘制 2.3.1.1标准溶液的配制 取5个干燥、洁净的锥形瓶,编号为1~5,分别称量空瓶质量并记录;依照表1分别量取并加入相应体积的环己烷和无水乙醇,每加 入一种溶液以后称量其质量并记录;得到5份已知组分的标准溶液。 表1 标准溶液的配制方案 通过称量得到的质量,可以计算得到每锥形瓶中液体含有的环己烷质量分数,通过测定其折射率,可以确定特定环己烷质量分数与折 射率的关系;同时,直接量取纯的无水乙醇和环己烷,测定其折射率, 可以绘制在环己烷质量分数在0~1之间的无水乙醇混合溶液与折射率 的关系曲线。 2.3.1.2标准溶液折射率测定 (1)将阿贝折射仪与恒温箱相连,调节反光镜使目镜视野明亮,此 时仪器可以用来测量; (2)用胶头滴管加入待测溶液,在右目镜视野中观察,用右侧旋钮 调节色散程度,使明暗分界线清晰,再用左侧旋钮调节,使明 暗交界线处于叉丝中心。注意接下来实验过程中保证左侧旋钮
一、实验目的 1、了解和掌握用双循环汽液平衡器测定二元系统气液平衡数据的方法。 2、了解缔合系统汽—液平衡数据的关联方法,从实验测得的T-p-x-y 数据计算各组分的活度系数。 3、通过实验了解平衡釜的构造,掌握气液平衡数据的测定方法和技能。 4、掌握二元系统气液平衡相图的绘制。 二、实验原理 以循环法测定气液平衡数据的平衡釜类型虽多,但基本原理相同,如图1所示。当体系达到平衡时,两个容器的组成不随时间变化,这时从A和B两容器中取样分析,即可得到一组平衡数据。 图1、平衡法测定气液平衡原理图 当达到平衡时,除了两相的温度和压力分别相等外,每一组分化学位也相等,即逸度相等,其热力学基本关系为: L i f =V i f (1) 0i i i i i py f x ?γ= 常压下,气相可视为理想气体,再忽略压力对流体逸度的影响,0i i p f = 从而得出低压下气液平衡关系式为: i py =0i i i r p x (2) 式中,p ——体系压力(总压); 0i p ——纯组分i 在平衡温度下的饱和蒸汽压,可用Antoine 公式计算; i x 、i y ——分别为组分i 在液相和气相中的摩尔分率; i γ——组分i 的活度系数 由实验测得等压下气液平衡数据,则可用
i y = i i i py x p (3) 计算出不同组成下的活度系数。 本实验中活度系数和组成关系采用Wilson 方程关联。Wilson 方程为: ln γ1=-ln(x 1+Λ12x 2)+x 2( 212112x x Λ+Λ -121221 x x Λ+Λ) (4) ln γ2=-ln(x 2+Λ21x 1)+x 1( 121221x x Λ+Λ -2 12112 x x Λ+Λ) (5) Wilson 方程二元配偶函数Λ12和Λ21采用非线性最小二乘法,由二元气液平衡数据回归得到。 目标函数选为气相组成误差的平方和,即 F =2221211((j m j j y y y y ))计实计实-+-∑= (6) 三、实验装置和试剂 1、实验的装置:平衡釜一台、阿贝折射仪一台、超级恒温槽一台、50-100十分之一的标准温度计一支、0-50十分之一的标准温度计一支、1ml 注射器4支、5ml 注射器1支。 2 、实验的试剂:无水甲醇、异丙醇。 四、实验步骤 1、开启超级恒温槽,调温至测定折射率所需温度25℃或30℃。 2、测温套管中倒入甘油,将标准温度计插入套管中,并将其露出部分中间
双液系沸点-组成图测绘实验报告 实验时间:2015年4月15日 学号:1120132970 一、目的要求 1 ?测定相应组成时的沸点并制作常压下环已烷一无水乙醇双液系的平衡相图。 2 ?从沸点组成图了解分馏原理。 3.了解沸点的测定技术,掌握两组分液体沸点的测定方法。 4 ?掌握折光率与组成的关系及阿贝折光仪的测量原理和使用方法。 二.实验原理 1、由液态物质混合而成的二组分系统称为双液系统。若两液体能以任意比例互 溶,称其为完全互溶双液系,若两液体只能部分互溶,称其为部分互溶双液系。 一个完全互溶的二元体系,两个纯液体组分在所有组成范围内完全互溶。在 定压下,完全互溶的二元体系的沸点一组成图可分为三类,如图C7.1所示。 a. 溶液的沸点介于两纯组分沸点之间,如苯一甲苯体系; b. 溶液有最低恒沸点,如环己烷-乙醇体系; c. 溶液有最高恒沸点,如丙酮一氯仿体系。 阎C7J :元休系T-x擀 下面以a为例,简单说明绘制沸点-组成图的原理。加热总组成为x1的溶液, 体系的温度上升,达液相线上1点时溶液开始沸腾,组成为x2的气相开始生成,但气相量很少,趋于0,x1、x2二点代表达到平衡时液、气两相组成。继续加热, 气相量逐渐增多,沸点继续上升,气、液二相组成分别在气相线和液相线上变化,当达某温度(如2点)并维持温度不变时,则x3、x4为该温度下液、气两相组成,气相、液相的量之比按杠杆规则确定。从相律 f = c - p +2 可知:当
外压恒定时,在气、液两相共存区域自由度等于1;当温度一定时,则气、液两相的组成也就确定,总组成一定,由杠杆规则可知两相的量之比也已确定。因此,在一定的实验装置中,全回流的加热溶液,在总组成、总量不变时,当气相的量与液相的量之比也不变时(达气- 液平衡),则体系的温度也就恒定。分别取出气、液两相的样品,分析其组成,得到该温度下气、液两相平衡时各相的组成。改变溶液总组成,得到另一温度下气、液两相平衡时各相的组成。测得溶液若干总组成下的气液平衡温度及气、液相组成,分别将气相点用线连接即为气相线,将液相点用线连接即为液相线,得到沸点- 组成图。 气相、液相的成份分析采用折光率法:折光率是物质的一个特征数值,它与物质的浓度及温度有关,因此在测量物质的折光率时要求温度恒定。溶液的浓度不同、组成不同,折光率也不同。因此可先配制一系列已知组成的溶液,绘出折光率-组成(n-x)的等温线,方法是在定温下测定已知各种组成(x )的折光率(n),绘出n-x 等温线。对于未知组成的样品,取出各相样品后,迅速测出该温度下的折光率(n),便可以从n-x 线查出其相应组成。 2、阿贝折光仪的原理 它的主要部分为两块直角棱镜PI,PII ,棱镜PI 的粗糙表面与PII 的光学平面镜AD之间约有0.1到0.15mm的空隙,用于装待测液体并使在PI、PII间铺成一簿层。光线从反射镜射入棱镜PI 后,由于面是粗糙的毛玻璃而发生漫射,从各种角度透过缝隙的被测液体;进入棱镜PII 中,由前所知,从各个方向进入棱镜PII 的光线均产生折射,而其折射角都落在临界角rc 之内(因为棱镜的折射率大于液体的折射率,因此人射角从到的全部光线都能通过棱镜而发生折射)。具有临界角rc 的光线穿出棱镜PII 后射于目镜上,此时若将目镜的十字线调节到适当位置,则会见到目镜上半明半暗。 从几何光学原理可以证明,缝隙中液体的折射率n 液与rc 间的关系为:n 液=sinB ,B对一定的棱镜为一常数,n棱镜在定温下也是个定值。所以液体的折射率n 液是角rc 的函数。由rc 可计算液体折射率。折光仪上已经把读数rc 换算成n 液的值,可直接读出n 液的值。 3、阿贝折光仪使用方法
四川理工学院实验报告 系:材化系 课程名称:简明物理化学实验 日期:2011年4月18日 姓名 学号 实验室 528 专业 材料科学与工程 班号 2009级2班 老师鉴定 实验名称 完全互溶双液系气液平衡相图的绘制 成绩评定 一、实验目的 (1)测定常压下环已烷—乙醇二元系统的气液平衡数据,绘制沸点—组成相图;(2)掌握双组分沸点的测定方法,通过实验进一步理解分馏原理;(3)掌握阿贝折射仪的使用方法。二、实验原理 两种液体物质混合而成的两组分体系称为双液系。根据两组分间溶解度的不同,可分为完全互溶、部分互溶和完全不互溶3种情况。两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。当压力保持一定,混合物沸点与两组分的相对含量有关。 恒定压力下,真实的完全互溶双液系的气—液平衡相图(图),根据体系对拉乌x T 尔定律的偏差情况,可分为3类: (1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯—苯体系 ,如图2.7(a ) 所示。 (2)最大负偏差:存在一个最小蒸气压值,比两个纯液体的蒸气压都小,混合物存在着最高沸点,如盐酸—水体系,如图2.7(b )所示。 (3)最大正偏差:存在一个最大蒸气压值,比两个纯液体的蒸气压都大,混合物存在着最低沸点,如正丙醇—水体系,如图2.7(c )所示。 B B B B (a) (b) (c) 图2.7 二组分真实液态混合物气—液平衡相图(T-x 图) 后两种情况为具有恒沸点的双液系相图。它们在最低或最高恒沸点时的气相和液相组成相同,因而不能像第一类那样通过反复蒸馏的方法而使双液系的两个组分相互分离,而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。 为了绘制双液系的T-x 相图,需测定几组原始组成不同的双液系在气—液两相平衡后的沸点和液相、气相的平衡组成。 本实验以环已烷—乙醇为体系,该体系属于上述第3种类型。在沸点仪(如图2.8所示)中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T-x 相图。本实验中气液两相的组成均采用折光率法测定。 折光率是物质的一个特征数值,它与物质的浓度及温度有关,因此在测量物质的折光率
完全互溶双液系气液平衡相图的绘制 一.实验目的 1.测定常压下环己烷-乙醇二元系统的气液平衡数据,绘制沸点-组成相图。 2.掌握双组分沸点的测定方法,通过实验进一步理解分馏原理。 3.掌握阿贝折射仪的使用方法及原理。 4.了解和掌握沸点仪的测定原理及方法。 5.加深对完全互溶双液系气液平衡相图的理解和增强个人动手能力。 二.实验原理 两种液体物质混合而成的两组分体系称为双液系。根据两组分间溶解度的不同,可分为完全互溶、部分互溶和完全不互溶三种情况。两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。当压力保持一定,混合物沸点与两组分的相对含量有关。 恒定压力下,真实的完全互溶双液系的气-液平衡相图(T-x图),根据体系对拉乌尔定律的偏差情况,可分为三类: (1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图1(a)所示。 (2)最大负偏差:存在一个最小蒸气压值,比两个纯液体的蒸气压都小,混合物存在着最高沸点,如盐酸-水体系,如图1 (b)所示。 (3)最大正偏差:存在一个最大蒸气压值,比两个纯液体的蒸气压都大,混合物存在着最低沸点,如正丙醇—水体系,如图1(c))所示。 对于后两种情况,为具有恒沸点的双液系相图。它们在最低或最高恒沸点时的气相和液相组成相同,因而不能象第一类那样通过反复蒸馏的方法而使双液系的两个组分相互分离,而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。 为了绘制双液系的T-x相图,需测定几组原始组成不同的双液系在气-液两相平衡后的沸点和液相、气相的平衡组成。 本实验以环己烷-乙醇为体系,该体系属于上述第三种类型。在沸点仪(如图2所示)中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T-x相图。 本实验中气液两相的组成均采用折光率法测定。 折光率是物质的一个特征数值,它与物质的浓度及温度有关,因此在测量物质的折光率时要求温度恒定。溶液的浓度不同、组成不同,折光率也不同。因此可先配制一系列已知组成的溶液,在恒定温度下测其折光图1 二组分真实液态混合物气-液平衡相图(T-x图)
双液体系气—液平衡相图的绘制 一、 实验目的 1. 绘制环己烷—异丙醇双液体系的沸点组成图, 确定其恒沸组成和恒沸温度。 2. 掌握回流冷凝管法测定溶液沸点的方法。 3.掌握阿贝折射仪的使用方法。 二、 实验原理 两种液体物质混合而成的两组分体系称为双液系。根据两组分间溶解度的不 同, 可分为完全互溶、 部分互溶和完全不互溶三种情况。两种挥发性液体混合形成完全互溶体系时, 如果该两组分的蒸气压不同, 则混合物的组成与平衡时气相的组成不同。当压力保持一定, 混合物沸点与两组分的相对含量有关。 恒定压力下, 真实的完全互溶双液系的气-液平衡相图( T -x ) , 根据体系对拉乌尔定律的偏差情况, 可分为3类: ( 1) 一般偏差: 混合物的沸点介于两种纯组分之间, 如甲苯-苯体系, 如图 (a)所示。 ( 2) 最大负偏差: 存在一个最小蒸汽压值, 比两个纯液体的蒸汽压都小, 混合物存在着最高沸点, 如盐酸—水体系, 如图 (b)所示。 ( 3) 最大正偏差: 存在一个最大蒸汽压值, 比两个纯液体的蒸汽压都大, 混合 物存在着最低沸点如图 (c)) 所示。 t A t A t A t B t B t B t / o C t / o t / o x B x B x B A B A A B B (a) (b) (c) x ' x '
上图为二组分真实液态混合物气—液平衡相图( T-x图) 后两种情况为具有恒沸点的双液系相图。它们在最低或最高恒沸点时的气相和液相组成相同, 因而不能象第一类那样经过重复蒸馏的方法而使双液系的两个组分相互分离, 而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。 为了测定双液系的T-x相图, 需在气-液平衡后, 同时测定双液系的沸点和液相、气相的平衡组成。 本实验以环己烷-异丙醇为体系, 该体系属于上述第三种类型, 在沸点仪中蒸馏不同组成的混合物, 测定其沸点及相应的气、液二相的组成, 即可作出T -x相图。 本实验中两相的成分分析均采用折光率法测定。 三、仪器与试剂 1、仪器: 沸点仪1台; 调压变压器1台; 阿贝折射仪1台; 温度计(0-100℃) 1支; 长滴管1个; 短滴管2支; 2、试剂: 环己烷(分析纯); 异丙醇(分析纯) 异丙醇—环己烷标准溶液(异丙醇分别为0.20, 0.40, 0.50, 0.60, 0.80, 0.90) 四、主要实验步骤 1. 测定环己烷、异丙醇及标准溶液的折射率 调节阿贝折射仪, 用一支干燥的短滴管吸取环己烷数滴, 注入折射仪的加液孔内, 测定其折射率n, 读数两次, 取其平均值。然后打开棱镜组, 待环己烷挥发后, 再用擦镜纸轻轻吸去残留在镜面上的液体, 合上棱镜组。