
全皮下埋藏式心脏转复除颤器:安全有效的心脏除颤器
摘要:全皮下埋藏式心脏转复除颤器(Subcutaneous implantable cardioverter defibrillator,S-ICD)目前已在欧洲、新西兰、美国投入临床使用。S-ICD主要由脉冲发生器、电极导线组成,与经静脉植入型心律转复除颤器(Transvenous implantable cardioverter defibrillator,TV-ICD)不同的是,S-ICD的脉冲发生器经皮下置于左侧胸壁,电极是由两个感知电极及一个电击线圈组成的,经皮下置于胸骨旁。作为全皮下心脏除颤系统,S-ICD可在一定程度上避免与静脉导线相关的围手术期及长期并发症,且手术过程不需要在透视下进行。S-ICD的适应人群主要包括伴有静脉畸形或梗阻不适合经静脉行心脏转复除颤器的儿童、感染风险大以及有猝死风险的年轻心律失常患者(如Brugada综合症、长QT综合症及肥厚性心肌病)。然而,由于缺乏腔内电极,S-ICD无起搏功能(除电击后短期起搏外),因此,I-SCD不适合缓慢性心律失常患者及有心脏再同步化治疗(Cardiac resynchronization therapy,CRT)适应症的患者。
引言
埋藏式心律转复除颤器(Implantable cardioverter-defibrillator,ICD)目前是心源性猝死的一级预防[1,2]及二级预防[3]的有效手段。迄今为止,大部分ICD植入系统均通过传统植入方式,即经胸腔内大静脉将除颤电极置于右室,然而,TV-ICD具有较高的围手术期及远期并发症。最近的一项大规模研究表明,TV-ICD主要并发症的发生率大约为1.5%,这些主要并发症包括:院内死亡、心脏骤停、心脏穿孔、心脏瓣膜损伤、冠状静脉损伤、血胸、气胸、深静脉炎、短暂性脑缺血发作、中风、心肌梗死、心包填塞以及动静脉瘘[4]。同时,随着时间的推移,电极绝缘故障导致的电极故障的发生率日益增加,有研究显示,电极植入10年后电极故障的发生率约为20%[5]。因此,尽管TV-ICD能够有效治疗快速性室性心律失常,它的缺点也是显而易见的。而非TV-ICD,即S-ICD可有效的避免静脉导线相关的并发症,成为近年来人们研究的热点。S-ICD日前已在欧洲、新西兰、美国投入临床使用,目前全球范围内已成功植入2000余例。
1.S-ICD的构成、植入及程控
S-ICD系统包括脉冲发生器、皮下电极、电极植入工具及程控设施。脉冲发生器的使用寿命大约为5年,体积较TV-ICD稍大,重量145g,约为TV-ICD脉冲发生器的两倍。S-ICD 在感知到快速性室性心律失常时能够以80J高能量进行电复律,并且在电击后30s内,如果感知到有3.5s以上的心脏停搏,可激活起搏功能,利用200mA双相脉冲波以50次/分的起搏频率进行起搏。
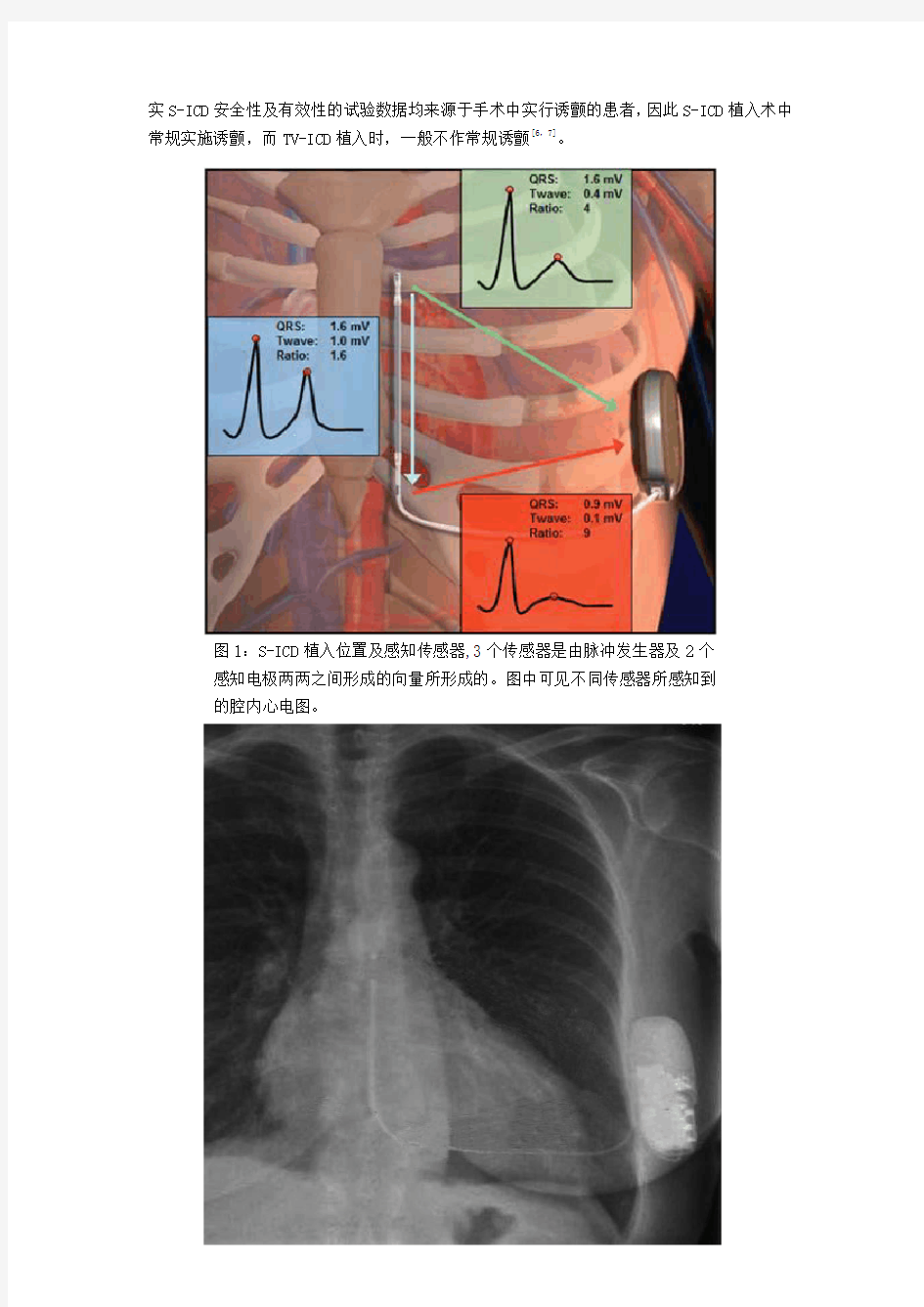
与TV-ICD不同,S-ICD不经胸腔大静脉引导电极植入心室,因此手术植入不需要在X 线透视下进行,避免了患者及手术医师的电离辐射暴露,且S-ICD手术过程较为简单,脉冲发生器置于左侧腋前线与腋后线水平第六肋间,电极导管通过两个胸骨旁切口,分别将远端与近端电极置于左侧胸骨旁1-2cm的第二肋间水平及剑突水平,除颤线圈位于两个感知电极之间,长约8cm。心脏节律的监测是通过远端、近端电极与脉冲发生器之间3个向量所形成的3个传感器完成的,S-ICD系统能够自动选择合适的传感器,避免双重QRS及T波过感知(见图1,2)。另外,虽然在S-ICD植入过程中,诱颤成功后以65J能量进行转复,但在植入术后,为了保证转复的成功率,S-ICD均以80J能量进行除颤[6]。值得一提的是,由于证
实S-ICD安全性及有效性的试验数据均来源于手术中实行诱颤的患者,因此S-ICD植入术中常规实施诱颤,而TV-ICD植入时,一般不作常规诱颤[6,7]。
图1:S-ICD植入位置及感知传感器,3个传感器是由脉冲发生器及2个
感知电极两两之间形成的向量所形成的。图中可见不同传感器所感知到
的腔内心电图。
图2:S-ICD植入术后患者胸片
S-ICD系统对心率的监测是通过计算最后4个心动周期的平均值来实现的,室性心动过速(Venticular tachycardia,VT)的诊断依据为18/24标准,定义为连续24个心动周期中18个能满足所设定的频率标准周长即可诊断为室性心动过速。确认为室性心动过速后,电容器开始充电(平均充电时间为14 ± 2 s),如果为非持续性室速则不进行电击,否则以80J能量进行电复律[6]。此外,除电击区外,S-ICD还设有条件电击区,即在一定的频率范围内,根据心电图的形态鉴别室上性心动过速与室性心动过速,防止室上性心动过速时发生不恰当电治疗事件。
S-ICD的程控较为简单,除电击治疗、电击后起搏治疗、条件电击区设置外,其他参数均为自动设置,电击治疗及电击后起搏治疗可选择开启或关闭,条件电击区除开关设置外,还可设置此区域的心率识别范围。
2.S-ICD的安全有效性研究
Bardy等人[6]对4项S-ICD临床前期研究进行了总结。第一项研究旨在确定脉冲发生器与除颤导线的最佳空间配置,共纳入78名患者,最终选定了除颤线圈位于胸骨左侧,脉冲发生器置于左侧胸壁这一配置;随后,第二项短期研究选择之前确定的最佳空间配置,纳入了49名患者,对S-ICD与传统的TV-ICD的除颤阈值进行比较,结果显示两组的除颤阈值分别为36.6 ± 19.8 J及11.1± 8.5 J(P<0.001),其中S-ICD组中有1名患者由于电极植入位置距离胸骨左缘6cm处导致诱颤时转律失败。随后的两项临床研究针对于植入永久性S-ICD的患者,分别纳入了6名新西兰患者及55名欧洲患者,排除标准为既往有心室率<170次/分的室速发作史、有抗心动过速起搏治疗(Antitachycardiapacing,ATP)可终止的室性心动过速患者,在包括6名患者的临床试验中,共诱发18次心室颤动(Ventricular fibrillation,VF ),均得到成功监测及转复,而在随后的16月随访中,所有患者均未出现室速、室颤事件。在欧洲进行的临床试验中,共诱发137次室颤事件,均被成功监测;在98%的患者中,两次连续发生的室颤事件均能以65J能量成功转律,电击治疗的平均时间为14.0 ± 2.5 s,在另外2%(1人)中,第一次诱颤时,S-ICD成功转律,而在第二次诱颤时转律失败。在随后的10月随访中,有3名患者共发生12次室速事件,均转律成功;5名患者出现轻微并发症(囊袋感染,胸骨旁皮下电极脱位);5名患者出现过感知事件,在设备程控后问题均得到解决;无针对室上性心动过速的误放电事件发生。鉴于以上结果,S-ICD 在2009年成功在欧洲国家及新西兰批准使用。
START研究[8]作为一项多中心、前瞻性的临床研究,进一步比较了S-ICD与TV-ICD在节律判断及管理方面的准确性。这项研究共纳入了64名符合ICD或CRT-D植入适应症的患者,根据患者个人情况不同植入单腔ICD、双腔ICD及CRT-D三种不同TV-ICD中的一种,并将S-ICD皮下电极置于前文提到的S-ICD系统所植入电极位置的皮肤表面,从而模拟了前面提到的向量环。对上述患者诱发房性及室性心律失常事件,并由S-ICD及TV-ICD同时记录监测。诱发的房性心律失常持续时间≥ 30 s,心室率> 170 bpm(n= 50),室性心律失常持续时间≥ 10 s,心室率> 170 bpm(n= 46),首先进行比较的是单腔TV-ICD与单电击区(VF≥ 170 bpm)S-ICD在判断室性心律失常事件的敏感性;然后改用双电击区((VF ≥ 240 bpm; VT≥ 170 bpm)S-ICD评估管理算法对监测室性心律失常的影响;随即将双电击区S-ICD与
双腔TV-ICD进行比较,用来评估心房电极对于频率管理算法敏感性的影响;最后,通过比较S-ICD与单腔或双腔T-ICD对于室上性心动过速的监测评价两者的特异性。在上述研究中,单电击区S-ICD患者中,所有的室性心动过速事件均得到监测,而在双电击区有1例室性心动过速事件未能成功监测。研究表明,S-ICD与TV-ICD在监测快速性室性心律失常事件的敏感性方面无明显差异,而在特异性方面,S-ICD较TV-ICD有明显的优势;单腔TV-ICD与双腔TV-ICD比较,未见明显差异。以上结果表明,S-ICD在判断室性快速性心律失常方面具有较高的准确性,与TV-ICD相比,S-ICD在减少不必要的电治疗方面具有一定的优越性。然而,值得一提的是,START研究具有一定的局限性,比如纳入的病例数较少,诱发的房性心律失常多为心房颤动等。
IDE研究[7]作为S-ICD在美国的上市前批准研究,它的一级终点为植入术后180天以内,所有患者中无并发症发生的患者比例>79%,室颤转复成功率>88%。本研究结果在2012年的美国心律协会年会上发表[7],结果显示,在321名患者中,180天内92%的患者无并发症发生,室颤转复的成功率达100%;在321天的中位随访时间内,共有16名患者发生了109次室性快速性心律失常事件,上述事件均以80J的能量成功转复;38名患者发生不恰当治疗事件,其中有15名患者是由于发生房颤时的心室率超过了电击管理区所设定的阈值,24名患者由于过感知导致了不恰当的电治疗。
然而上述研究仅仅对S-ICD术后近期的安全性及有效性做出了肯定,S-ICD及TV-ICD 对患者长期预后影响的差别仍未见报道。目前正在进行的EFFORTLESS S-ICD[9]及PRAETORIAN[10]研究均为大样本、多中心临床试验,对于评价S-ICD的长期有效性及安全性更有说服力。
3.S-ICD的局限性
目前的S-ICD仍有较多的局限性,使得某些特定的人群不适合行S-ICD植入术。尽管S-ICD能够以80J的能量治疗致命性的室性快速性心律失常,S-ICD并不能解决缓慢性心律失常,仅仅在电击后具有短暂起搏功能,因此有心动过缓的患者不适合植入S-ICD,同样的,有房室传导阻滞的证据,未来可能有起搏器植入指征的患者亦不应行S-ICD。
临床上符合ICD植入指征的患者对于ICD有不同的临床需求。研究表明,无论是恰当的还是不恰当的电治疗均不利于患者的长期预后,并增加患者的死亡率[11,12,13],因此对于既往有单形性室速病史的患者,ATP治疗可以减少不必要的电治疗,通常是终止心动过速的最佳方式[14]。然而目前的S-ICD系统由于无ATP功能,因此既往有单形性室速发作病史及有室速发作高危因素的患者可能不适合植入S-ICD。
除了解决缓慢性或快速性心律失常外,一部分有ICD植入指征的患者常伴有充血性心力衰竭、左室射血分数的降低及左束支传导阻滞,这部分患者可能从CRT中获益[15,16,17],而当双室起搏比例小于90%时,将明显降低CRT疗效。因此,这部分患者也不适合行S-ICD植入。
结论
S-ICD作为近年发展起来的一项新技术,目前已在欧洲、新西兰及美国投入临床使用。与TV-ICD相比,S-ICD可以避免静脉导线相关的围手术期并发症。S-ICD的短期内安全性及有效性已得到了多项临床试验的验证,目前正在进行的两项大规模临床试验将对S-ICD的长
期有效性及安全性做出评估,这也将决定S-ICD这项新技术未来的发展空间。
参考文献:
[1] Bardy G H, Lee K L, Mark D B, et al. Amiodarone or an implantable cardioverter–defibrillator for congestive heart failure[J]. New England Journal of Medicine, 2005, 352(3): 225-237.
[2] Moss A J, Zareba W, Hall W J, et al. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction[J]. New England Journal of Medicine, 2002, 346(12): 877-88.3.
[3] Connolly S J, Hallstrom A P, Cappato R, et al. Meta-analysis of the implantable cardioverter defibrillator secondary prevention trials[J]. European Heart Journal, 2000, 21(24): 2071-2078. [4] Curtis J P, Luebbert J J, Wang Y, et al. Association of physician certification and outcomes among patients receiving an implantable cardioverter-defibrillator[J]. JAMA: the journal of the American Medical Association, 2009, 301(16): 1661-1670.
[5] Kleemann T, Becker T, Doenges K, et al. Annual rate of transvenous defibrillation lead defects in implantable cardioverter-defibrillators over a period of> 10 years[J]. Circulation, 2007, 115(19): 2474-2480.
[6] Bardy G H, Smith W M, Hood M A, et al. An entirely subcutaneous implantable cardioverter–defibrillator[J]. New England Journal of Medicine, 2010, 363(1): 36-44.
[7] Burke MC. Safety and efficacy of a subcutaneous implantable defibrillator (S-ICD). Heart rhythm society 33rd annual scientific sessions; 2012 May 9-12; Boston, USA; 2012.
[8] Gold M R, Theuns D A, Knight B P, et al. Head‐To‐Head Comparison of Arrhythmia Discrimination Performance of Subcutaneous and Transvenous ICD Arrhythmia Detection Algorithms: The START Study[J]. Journal of Cardiovascular Electrophysiology, 2012, 23(4): 359-366.
[9] Pedersen SS, Lambiase P, Boersma LV, Murgatroyd F,Johansen JB, Reeve H, Stuart AG, Adragao P, Theuns DA. Evaluation oF FactORs ImpacTing CLinical Outcome and Cost EffectiveneSS of the S-ICD: design and rationale of the EFFORTLESS S-ICD Registry. Pacing Clin Electrophysiol 2012; 35: 574-579.
[10] Olde Nordkamp LR, Knops RE, Bardy GH, Blaauw Y,Boersma LV, Bos JS, Delnoy PP, van Dessel PF, Driessen AH, de Groot JR, Herrman JP, Jordaens LJ, Kooiman KM, Maass AH, Meine M, Mizusawa Y, Molhoek SG, van Opstal J, Tijssen JG, Wilde AA. Rationale and design of the PRAETORIAN trial: a Prospective, RAndomizEd comparison of subcuTaneOus and tRansvenous ImplANtable cardioverterdefibrillator therapy. Am Heart J 2012; 163: 753-760.
[11]van Rees J B, Borleffs C J W, de Bie M K, et al. Inappropriate Implantable Cardioverter-Defibrillator ShocksIncidence, Predictors, and Impact on Mortality[J]. Journal of the American College of Cardiology, 2011, 57(5): 556-562.
[12] Daubert J P, Zareba W, Cannom D S, et al. Inappropriate Implantable Cardioverter-Defibrillator Shocks in MADIT IIFrequency, Mechanisms, Predictors, and Survival Impact[J]. Journal of the American College of Cardiology, 2008, 51(14): 1357-1365.
[13] Poole J E, Johnson G W, Hellkamp A S, et al. Prognostic importance of defibrillator shocks in patients with heart failure[J]. New England Journal of Medicine, 2008, 359(10): 1009-1017. [14] Wathen M S, DeGroot P J, Sweeney M O, et al. Prospective randomized multicenter trial of empirical antitachycardia pacing versus shocks for spontaneous rapid ventricular tachycardia in patients with implantable cardioverter-defibrillators pacing fast ventricular tachycardia reduces shock therapies (PainFREE Rx II) trial results[J]. Circulation, 2004, 110(17): 2591-2596.
[15] Tang A S L, Wells G A, Talajic M, et al. Cardiac-resynchronization therapy for mild-to-moderate heart failure[J]. New England Journal of Medicine, 2010, 363(25): 2385-2395.
[16] Moss A J, Hall W J, Cannom D S, et al. Cardiac-resynchronization therapy for the prevention of heart-failure events[J]. New England Journal of Medicine, 2009, 361(14): 1329-1338.
[17] Bristow M R, Saxon L A, Boehmer J, et al. Cardiac-resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure[J]. New England Journal of Medicine, 2004, 350(21): 2140-2150.
皮下植入式心律转复除颤器的现状及展望(完整版) 心源性猝死(Sudden cardiac death,SCD)是一种常见而凶险的心血管疾病,患者在病情基本稳定的情况下突然发生严重心律失常导致迅速死亡。据国家心血管中心统计,我国每年心源性猝死者高达55万,居全球之首。近30年来,大陆SCD平均年发病率为40.7人/10万人,约50-70%的SCD与快速性室性心律失常有关。及时有效地除颤是预防SCD 的关键,大量临床研究试验已证实植入式心脏复律除颤器(ICD)应用于猝死高危患者的一级预防及二级预防,效果优于现有的药物治疗,可降低长期死亡率。但传统经静脉植入心律转复除颤器(TV-ICD)的围手术期和长期并发症发生率较高,且多数是由植入式电极引起的,如静脉血栓、气胸、血胸、感染、心脏穿孔、电极断裂、心包填塞、三尖瓣损伤等。部分患者由于心脏结构及解剖异常,如先天性心脏病、机械瓣及其他少见原因,以及ICD植入后感染并发静脉闭塞,而面临TV-ICD植入困难的问题。为满足临床需求,填补TV-ICD的缺陷和不足,皮下植入式心律转复除颤器(S-ICD)应运而生。其无需植入心内电极,简化了手术过程,避免了TV-ICD 电极相关并发症,活动限制少,为SCD高危患者提供了新的治疗选择。本文旨在阐述S-ICD的工作原理及临床应用。 一、S-ICD的组成及工作原理
S-ICD主要由脉冲发生器和皮下电极导线构成。其植入以体表解剖标志为参照,不需要X线照射。脉冲发生器植入患者胸部左外侧第6肋水平腋前线和腋中线之间的皮下组织囊袋中。皮下电极导线长45cm,两端有两个感知电极,两者中间有一直径3mm、长8cm的除颤线圈电极,电极经皮下隧道置于胸骨左缘1-2cm,近端位于剑突,远端位于胸骨柄。导线自第6肋水平行至左侧腋前线,与脉冲发生器相连,组成三个感知向量,S-ICD可自动选择最佳的感知向量,用于心脏节律分析及室性心律失常检测。与TV-ICD的腔内心电图不同,S-ICD获得的皮下心电信号类似于体表心电图,具有更高的分辨率,从而有利于通过形态学匹配来识别心脏节律。S-ICD对每次事件可提供最多5次电击治疗,每次固定释放80J的双相波除颤能量。除颤电流回路由线圈电极和机壳组成,线圈电极至机壳为标准极性,机壳至线圈电极为逆向极性。一次除颤失败后,S-ICD会自动反转极性进行再次除颤。系统自动存储并选择最后一个极性方向作为默认设置。S-ICD无起搏功能,但在除颤后30s内可提供经胸起搏。 二、SICD的适用人群 并不是所有有ICD植入适应症的患者都适合植入S-ICD。在2015年的欧洲心脏病学会(ESC)室性心律失常和SCD预防的指南中,已将S-ICD 列为Ⅱa类选择,用于需植入ICD但无需起搏和CRT的患者。根据2017年AHA/ACC/HRS对室性心律失常和SCD的指南,S-ICD是高危感染患
埋藏式心脏复律除颤器目前认识和建议 致命性室性心律失常(室性心动过速/心室颤动,VT/VF)是心脏性猝死(SCD)的主要原因,美国每年约40万人死于此症。一系列多中心临床试验证明埋藏式心脏复律除颤器(ICD)是优于药物的有效治疗方法,可明显降低SCD发生率。美国每年上万人安装ICD,其数量呈直线上升趋势。我国由于经济条件和认识水平普及的限制,采用ICD治疗的患者甚少,但近年来逐渐增多,一年约100例患者安装ICD。为提高医生和病人对应用ICD的认识及使用规范化,两个学会的ICD 专家组于2001年11月在北京召开研讨会,就ICD适应证、多中心试验结果、安置技术、随诊等专题,结合我国实际情况,进行了深入和认真的讨论,并提出建议。 美国Mirowski医生于20世纪60年代后期最先提出用置入型除颤器治疗危及病人生命的VF设想,1969年Mirowski和他的同事在狗身上进行实验并获得成功。1972年Mirowski等与Medrad公司(美国匹兹堡)合作,研究生产为临床应用的埋藏式自动除颤器(automatic im-plantable defibrillator ,AID)。在经过一段临床前试验和严格的审定后,并经美国FDA批准,于1980年2月4日,Mirowski和他的同事在美国Johns Hopkins大学医院首次为一位患者安置了世界第一台AID。1986年经静脉皮下除颤导线第一次应用于临床,避免了开胸手术,具有程控功能的Ventak-P(美国CPI公司生产)于1988年进入临床(第二代ICD)。1989年第三代ICD 开始用于临床,它的最大特点是分层次治疗(tiered therapy),即抗心动过速起搏(antitachycardiapacing ,ATP)、低能量心律转复和高能量电击除颤。此外还具有抗心动过缓、支持性VVI方式起搏和多项参数程控功能。1995年双腔ICD问世,可提供DDD或DDDR起搏,并能提高ICD对持续性室性快速心律失常识别的特异性,明显减少了误识别和误放电。目前,具有自动抗VT和自动除颤的置入性器械统一称为ICD。 一、ICD治疗的适应证 ICD用于临床20多年来,ICD治疗的适应证也在不断改变,其主要依据是大规模多中心前瞻性随机临床试验。最新的ICD治疗适应证是ACC/AHA专家组制定的,发表于1998年4月的美国心脏学杂志。从这一新制定的适应证中可以看出,ICD的治疗已从过去的“最后治疗选择”发展为今日的“首先治疗”。 现将1998年ICD治疗的适应证摘录如下,并说明其变化,供临床应用中参考。适应证指南制定的依据级别分为A、B、C三级。A级:资料来源于多个前瞻性随机的临床试验,包含了大量临床病例。B级:资料来源于数目有限的临床试验,包含的病例数相对较少,或来源于设计合理的非随机试验资料分析或是观察性注册资料。C级:以专家们的一致意见作为建议的重要依据。适应证指南还分为Ⅰ、Ⅱ、Ⅲ类。简单地说,Ⅰ类:意见一致,公认应植入ICD,相当于绝对适应证;Ⅱ类:意见分歧,又分为ⅡA类,意见倾向于使用ICD,ⅡB类,意见倾向于不用ICD,Ⅱ类相当于相对适应证;Ⅲ类:意见一致,不同意应用ICD,亦即非适应证。 Ⅰ类 1.非一过性或可逆性原因引起的VF或VT所致的心脏骤停。(A级) 2.自发的持续性VT。(B级) 3.原因不明的晕厥,在电生理检查时能诱发有血流动力学显著临床表现的持续性VT或VF,药物治疗无效、不能耐受或不可取。(B级) 4.伴发于冠心病、陈旧性心肌梗死和左心室功能不良的非持续性VT,在电生理检查时可诱发持续性VT或VF,不能被Ⅰ类抗心律失常药物所抑制。(B级) ⅡA类无 ⅡB类 1.推测心脏骤停是由于VF所致,而由于身体其他原因不能进行电生理检查。(C级) 2.在等待心脏移植时,有归咎于持续性室性快速心律失常的严重症状。(C级) 3.诸如长Q-T间期综合征或肥厚型心肌病等有致命性室性快速心律失常高危的家族性或
植入型心律转复除颤器植入 技术(I C D) -标准化文件发布号:(9456-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII
植入型心律转复除颤器植入技术 概述:(implantable cardiovertor-defibrillator,ICD)是近20多年来经大量的临床实践和循证医学证实的治疗恶性室性心律失常及预防心脏猝死的有效手段。ICD在人体内能在数秒钟内检测到危及生命的室速和(或)室颤,并进行相应的治疗。ICD的植入技术主要根据导线的植入方式分为开胸植入和经静脉植入。目前临床上已普遍采用经静脉植入技术 适应症:1.I类适应证 (1)因室速、室颤引起的心脏骤停,除外暂时性、可逆性原因(A)。 (2)自发性持续性室速,合并器质性心脏病(B)。 (3)不明原因的晕厥,合并电生理诱发出持续性室速,血流动力学不稳定,药物治疗无效、不能耐受药物治疗(B)。 (4)非持续性室速,有冠状动脉疾病、心肌梗死病史,合并左心室功能低下,电生理检查诱发出持续性室速或室颤,I类抗心律失常药不抑制其发作(BA)。 2.Ⅱ类适应证 (1)Ⅱa类适应证:左心室功能低下,LVEF<30%,心肌梗死后1个月,冠状动脉旁路移植术后3个月(B)。 (2)Ⅱb类适应证 ①临床推测心脏骤停是由于室颤引起,而由于其他原因不能行电生理检查(C)。 ②等待心脏移植,因室速产生严重症状(晕厥)(C)。 ③家族性或遗传性的高危状况导致致命性室性心动过速如长QT综合征、肥厚性心肌病(B)。 ④非持续性室速,合并冠状动脉疾病,心肌梗死病史、左心室功能低下者,电生理检查诱发出持续性VT/VF(B)。 ⑤不明原因晕厥,Jb功能低下,电生理检查诱发出室性心律失常(C)。
AHA穿戴式心脏除颤仪(WCD)指南解读 尽管多项临床研究证实植入式心律转复除颤器(Implantable Cardioverter Defibrillator, ICD)可以降低高危患者的死亡,但美国每年发生心源性猝死(Sudden Cardiac Death,SCD)的30万人中,大多数并不符合目前植入ICD的适应证,而这些患者很可能会从自动除颤仪中获益。主要包括两类患者:一类是明知有心脏猝死的风险,如冠状动脉重建术后、新诊断的急性心肌梗死或缺血性心脏病等,但并未达到ICD的适应证;第二类是有明确的ICD使用指征,但同时也存在植入ICD的禁忌证的患者,如活动性感染或预后不明等。穿戴式心脏除颤仪(Wearable Cardioverter Defibrillator, WCD)主要适用于那些有心脏猝死发生危险、但由于各种原因而未能立即植入ICD的患者。 由于WCD的使用率不断提高、以及临床心血管病医生对WCD的使用指征知之甚少,美国心脏病协会(American Heart Association,AHA)制定了这份科学指南,对WCD的独特工艺、临床定位以及可替代疗法三个方面进行了描述。但由于支持WCD应用的前瞻性研究证据尚少,尤其是已发表的、随机性临床试验的缺少,因此这份指南仅提供了临床治疗建议。WCD的应用由患者和医生共同决定,医患双方均应认识到WCD在有效性和安全性方面的不确定性,需要医患双方针对风险与获益的深入沟通。
SCD的预防与流行病学 非住院病人发生的心脏停搏约三分之一是由于室性心动过速或室颤 导致的。快速电复律可以救命,但大部分室速和室颤的病人并未得到及时的电复律。从致命性心律失常发生到电击复律所需的等待时间,是室速和室颤能否成功复苏的关键因素。如未及时进行心肺复苏,由室速和室颤引起的停搏,每耽搁1分钟除颤,生存率就会下降7%~10%;即便进行了心外按压,等待电复律所需的每分钟也会使生存率下降3%~4%。在美国,每5个发生室速或室颤引起心脏停搏的患者中,幸存人数不足1人。因此,近年来有关心脏猝死的危险分层与筛查,以及对高危患者植入ICD的研究举世关注。 关于ICD ICD持续监测患者的心脏节律和心率,在潜在致命性心律失常发生后经过很短的自动诊断时间和充电时间即可自动放电进行电复律。对于心脏骤停的高危患者,包括SCD幸存者、曾有室速室颤发作者、射血分数降低的缺血性和非缺血性扩张型心肌病、有SCD家族史等,植入ICD能够明显减少猝死,但存在需手术植入、长期电极导线留置带来的一系列不良反应等问题。皮下ICD能够减少(但不能避免)这些问题,已被FDA批准使用并证明有效,但有关皮下ICD与经静脉植入导线ICD的疗效对比研究资料尚少。
植入型心律转复除颤器植入技术 概述:(implantable cardiovertor-defibrillator,ICD)是近20多年来经大量的临床实践和循证医学证实的治疗恶性室性心律失常及预防心脏猝死的有效手段。ICD在人体内能在数秒钟内检测到危及生命的室速和(或)室颤,并进行相应的治疗。ICD的植入技术主要根据导线的植入方式分为开胸植入和经静脉植入。目前临床上已普遍采用经静脉植入技术 适应症: 1.I类适应证 (1)因室速、室颤引起的心脏骤停,除外暂时性、可逆性原因(A)。 (2)自发性持续性室速,合并器质性心脏病(B)。 (3)不明原因的晕厥,合并电生理诱发出持续性室速,血流动力学不稳定,药物治疗无效、不能耐受药物治疗(B)。 (4)非持续性室速,有冠状动脉疾病、心肌梗死病史,合并左心室功能低下,电生理检查诱发出持续性室速或室颤,I类抗心律失常药不抑制其发作(BA)。 2.Ⅱ类适应证 (1)Ⅱa类适应证:左心室功能低下,LVEF<30%,心肌梗死后1个月,冠状动脉旁路移植术后3个月(B)。
(2)Ⅱb类适应证 ①临床推测心脏骤停是由于室颤引起,而由于其他原因不能行电生理检查(C)。 ②等待心脏移植,因室速产生严重症状(晕厥)(C)。 ③家族性或遗传性的高危状况导致致命性室性心动过速如长QT综合征、肥厚性心肌病(B)。 ④非持续性室速,合并冠状动脉疾病,心肌梗死病史、左心室功能低下者,电生理检查诱发出持续性VT/VF(B)。 ⑤不明原因晕厥,Jb功能低下,电生理检查诱发出室性心律失常(C)。 ⑥不明原因晕厥,家族中有猝死史,合并RBBB+ST抬高(Brugada综合征)(C)。 ⑦晕厥合并进展型器质性心脏病,病因难以确定(C)。 3.Ⅲ类适应证 (1)原因不明的晕厥,没有可诱发的室性快速心律失常,也无器质性心脏病。 (2)无休止的室速或室颤。 (3)外科手术或导管消融可治疗的室速或室颤,例如伴随预激综合征的房性心律失常、右心室流出道室速、特发性左心室室速或分支性室速。 (4)由于一过性或可逆性病症(如急性心肌梗死、电解
ICD是植入型体内自动除颤器的简称。众所周知,心脏病患者的死亡中,大约一半属于猝死(即突然死亡)。造成猝死的最常见原因是严重的室性心律失常,如心室颤动及室性心动过速等。这些严重的心律失常发生前常无预兆,药物也不能完全预防其发生。这些心律失常发生时必须被马上终止,但即使是在医院内,有时也来不及进行治疗。因为心室颤动发生时,心脏实际上不能射血,而脑缺血超过6秒钟就会发生晕倒。如果心脏停止射血达5分钟以上,抢救成功的机会低于20%。ICD就是用来随时终止这些严重心律失常的一种仪器,大量研究表明,ICD 植入要较药物治疗有效得多。 ICD的外观与起搏器类似,植入的部位也基本相同,但ICD要较常规的起搏器大。通常,ICD只有一条电极导线(植入右心室)。ICD可以随时检测出并判断患者所发生的严重室性心律失常的类型并给予不同的处理,从而达到终止心律失常、挽救患者生命的目的。 自1980年,第一台体内埋藏式自动除颤器(ICD)置入以来,在临床医生和工程师的共同努力下,近年来,ICD及其置入系统较早年有了很大的改进。电极导线除少数年幼儿童以及先天性心脏病伴中央型分流的患者需经心外膜置入,多数患者可经静脉置入。脉冲发生器的体积也较以前明显缩小,不再需要埋于腹部。故其手术操作方法和设备条件与常规普通起搏器相似。 由于ICD置入术中需行心律失常(尤其是室颤)的诱发和终止,因此除了有经验丰富的术者和一组熟悉心脏介入治疗和心肺复苏技术的队伍,还需要有熟悉ICD使用的工程技术人员以及有经验的麻醉医师配合,同时除常规心电图、多导生理仪和起搏程控分析仪外,置入ICD还应确保以下设备能随时正常使用。1. 体外除颤器:在诱发VT/VF时如ICD不能终止需立即行体外除颤。2.麻醉机和气管插管:防止诱发VT/VF时的麻醉意外,或由于VT/VF导致呼吸抑制或发生血流动力学改变时,需即刻行气管插管和麻醉机吸氧。此外,术中应全程监测患者的血氧和血压,尤其是诱发VT/VF和放电治疗后要密切注意患者生命体征的变化,并备齐所有心肺复苏和心律失常等相关急救药品。 患者术前停用抗凝、抗血小板药物,应用抗凝药物的患者INR应<1.5,术前6小时禁食。手术前先开放静脉,并在整个手术过程中保持静脉通道。由于需要置入ICD的患者多合并严重的器质性心脏病,基础心功能比较差,术中VT/VF 的诱发有可能使心功能进一步恶化,增加手术的风险。因此,除常规术前检查外,需仔细询问患者的临床症状、并通过体格检查和超声心动图等辅助检查判断患者的心功能状况,对于心功能较差的患者,应先采取充分的药物治疗尽可能改善患者的心功能,以保证手术安全。同样,术后除注意伤口、囊袋情况以及常规心电图外,最好行24小时心电血压监测,密切关注患者的心功能变化。 ICD的置入操作技术与常规起搏器基本相同,但需要注意几点:1. ICD的电极导线较粗,选用锁骨下静脉时的穿刺点要注意避免过于偏内侧,否则容易造成导线挤压甚至发生断裂;2. ICD的机壳作为阳性端,故一般采用左前胸制作囊袋,以保证除颤电流最大面积通过左心室,达到最佳除颤效果。
心脏电除颤发展史 何庆万智 心肺复苏是20世纪医学领域及社会大层面上普及得最为成功的急救知识、技能。确切地讲,从徒手CPR的创始人PeterSafar教授自1958年开始在欧美各地报告用口对口人工呼吸挽救濒死者生命,到1960年胸外心脏按压被推荐面世之后,在“任何地方”不借助医疗器械、对呼吸、心跳骤停徒手进行的紧急救命术——徒手心肺复苏术正式步入社会,从而构成了现代急救的主题。40年间,以口对口人工呼吸、胸外心脏按压为标志的现代心肺复苏风靡全球,猝死者复苏成功病例像雨后春笋般涌现。研究发现心脏电击除颤带来的复苏成功率更胜于徒手心肺复苏、药物等。电除颤技术已是最基本和最重要的急救手段,在现代心肺复苏中执行的是“尽早除颤”的理念。 电除颤的发展是一个多学科研究人员协作的成功范例,这项临床突破来自于医生、生物医学家、生理学家和两个非医学产业(电力业和电话业)研究者的通力合作。一、对于电与心室纤颤、电击除颤关系的初步探索阶段 任何关于电除颤技术发展史的研究都无法绕开的一个话题是当代医学对心室纤颤的认识的发展过程,事实上,电除颤的历史是与医学对心室纤颤认识的历史交织发展的。 有文字记载的使用电除颤进行心肺复苏的历史可以追溯到1788年,Kite在英格兰皇家援救溺水协会年鉴上发表了一篇获得银奖的论文,描述了可能是首次成功的电除颤。文章中描述了一个手提式设备,将电无意中击向“所有目击者都认为已经死亡”的溺水女孩,挽救了生命。事实上这套电工用的设备具有许多现代除颤器特征,包括一个贮能的电容器、一个充电调钮和两个电极。 早在19世纪中叶,欧洲医学家开始研究电对实验动物和人的影响。 1849年德国生理学家和波动曲线的发明者CarlLudwig教授和学生首次发现并记录了由电刺激诱导产生的快速心肌收缩,导致心脏骤停。 1879年,德国医生HugoyonZiemssen首次完成了电流对人心脏影响的重要实验。他提出可以用直流电直击心脏,也可以通过在胸壁上电击来改变心率和节律。这是对心脏具有明显治疗价值的阳性干预,但由于一位英国医生进行动物实验后提出反对意见而一时被认为前途渺茫。 1887年Ludwig的学生MacWilliam首次阐释室颤的病因学及其临床意义。他认为“纤维状收缩”是心室肌肉不规则、无节律的收缩,同时动脉血压显著下降的状态。当心室壁快速颤动而不能将血液向前推动的时候,心肌活动也成为不协调的颤动。两年后,MacWilliam明确地将心脏骤停的原因区分为心脏停搏和心室纤颤。他认为“心脏骤停时仍表现出不规则的、不协调的能量(颤动),而不是静止的”,认为心室纤颤是猝死的重要原因,而且心室纤颤引起的猝死可能在各种心脏状态下发生。但由于当时其他研究者都在关注刚刚兴起的细菌学,所以MacWilliam 理论未得到应有的重视,这个发现被后来很多的研究证实和发展,直到1915年,ThomasLewis才肯定的评价MacWilliam是第一个提出室颤是猝死主要原因的学者。
AHA/ACC/HRS室性心律失常患者的管理和猝死预防的指南:植入型心律转复除颤器应用部分(最全版) 美国心脏协会/美国心脏病学会/美国心律学会(AHA/ACC/HRS)近期发布了2017室性心律失常患者的管理和猝死预防的指南,并发表在Heart Rhythm上。指南从室性心律失常的流行病学、发生机制、预防和治疗等方面做了全面、具体阐述。关于室性心律失常的治疗和猝死预防方面,指南进一步强调了植入型心律转复除颤器(ICD)的价值。据悉,上一次ACC/AHA/HRS发布室性心律失常猝死的管理指南还是在2006年。一、指南更新 1.指南强调:心脏骤停是心脏性猝死的常见原因,是主要的公共健康问题,其发生率占全部心血管病死亡的50%。 2.ICD是预防高危患者发生心脏性猝死最重要的治疗手段。对于既往从未发生过持续性室性心律失常的心脏病患者,左心室射血分数(LVEF)减低仍然是心脏性猝死的主要的危险标志。但是,对于预期生存时间<1年的患者,不推荐植入ICD。 3.对于LVEF减低(LVEF<40%)的心力衰竭患者,规范化药物治疗[包括β受体阻滞剂、醛固酮受体拮抗剂、血管紧张素转换酶抑制剂(ACEI)或血管紧张素受体拮抗剂(ARB)、血管紧张素受体-脑啡肽酶抑制剂]能够降低心脏性猝死发生率和全因死亡率。 4.关于ICD在非缺血性心肌病患者中的应用价值,新指南纳入了更多新的证据。基于DANISH等临床试验的结果,指南建议扩张型心肌病患者,
在最优化治疗(包括药物治疗)的基础上,心功能Ⅱ~Ⅲ级(NYHA分级),LVEF≤35%,预期生存时间>1年的患者应当植入ICD。 5.指南首次强调了临终关怀在室性心律失常和猝死高危人群中的意义,并据此作出相应推荐。指南建议:如患者出现难治性症状性心力衰竭、难治性持续性危及生命的心律失常,或者因其他疾病即将面临死亡,临床医师应当充分尊重患者的意愿和选择权,讨论是否需关闭除颤装置。 6.指南建议对于心肌病患者,尤其是肥厚型心肌病、心脏结节病、致心律失常性心肌病以及神经肌肉疾病患者,应当进行专门的猝死危险评估。 7.指南首次专门开辟一个章节从成本效益角度考虑治疗(尤其是ICD 治疗)的价值。例如,经静脉ICD推荐用于心脏性猝死的一级预防。当根据患者的并存疾病和心功能状态推测患者的室性心律失常的风险很高而非心律失常(心源性或非心源性)死亡风险低时,患者更能够从ICD中获益。 8.对于符合ICD植入适应证,但缺乏合适的血管入路或者感染高风险患者,同时这些患者目前不需要、预测将来也不需要起搏来治疗心动过缓或者终止心动过速,或者作为心脏再同步治疗(CRT)的一部分,全皮下ICD 为Ⅰ类推荐。 9.指南强调了医务人员应当以患者为中心,与患者共同商量治疗决策。在植入ICD前,医务人员需个体化告知患者心脏性猝死风险,以及因心力衰竭或者非心脏原因导致的非猝死的死亡风险。同时告知患者植入ICD的获益及潜在并发症。
埋藏式自动复律除颤器 Implantable Cardiovision Defibrillator ICD 简介心源性猝死是现代医学面临的一个重要问题在美国每年夺去大约40万人的生命现证实医院外心源性猝死多数是由于心室颤动引起大于80的患者先出现室速持续恶化为室颤因为室颤自动转复非常少见因此决定室颤患者生存的一个重要因素是从室颤发生到得到除颤治疗的时间医院外室颤的总死亡率高于75主要是由于不能得到及时有效的除颤治疗简介 ICD可以在心律失常发生8>1020秒内释放电击除颤在这段时间内除颤的成功率几乎为100因此ICD为恶性室性的治疗开辟了一个新领域自1980年2月4日Mirowski等在美国Johns Hopkins大学医学中心成功地安装了世界第一例埋藏式自动除颤器至80年代世界上已有400多个医学中心置入1万多只ICD至1995年新置入的ICD总数超过10万只每年新置入的ICD将超过2万只 ICD 治疗的评价 1980 - 现在中国ICD治疗进展 1992- 现在埋藏式自动复律除颤器 ICD系统主要包括两个基本部分脉冲发生器和识别心律失常释放电能系统最新一代ICD系统除了转复除颤功能外还具有抗心动过速起搏治疗和抗心动过缓起搏治疗 ICD 体积小胸部植入经静脉植入单一切口局部麻醉意识清醒住院时间短并发症少术后死亡率 1 可程控的治疗选项单腔或双腔治疗电池寿命可达9年 80000植入者年 2000年末 ICD治疗的非适应征原因不明的晕厥没有可诱发的室性快速心律失常无休止的室速或室颤室速或室颤其起源处可被外科手术或导管消融所消除例如伴随预激综合征的房性心律失常右室流出道室速特发性左室室速或分支性室速由于一过性或可逆性病症如急性心肌梗死电解质紊乱药物创伤所致的室性快速心律失常明显得精神性疾病可能被
除颤仪的临床应用 罗希芝 河南省人民医院急诊科
电复律是用直流电脉冲作用于心脏,使心律失常转为窦性心律的一种有效方法。分同步电复律与非同步电复律两种:同步电复律是指除颤器由R波的电信号 激发放电;非同步电复律是指除颤器在心动周期的任何时间都可放电。
当患者发生心室颤动或血流动力学改变的室性心动过速时最有效的治疗方法就是电除颤。成功除颤的机会转瞬即逝,不进行除颤数分钟后就可能转为心脏停搏。
及时的心肺复苏(CPR)虽可以维持脑和心脏功能,可延长室颤持续时间,但CPR却不能将室颤转为正常心律。所以除颤的时机是治疗室颤的关键,每延迟1min除颤,复苏成功率下降7%~10%。除时间因素,仍需选择适当的能量,以能产生足够穿过心脏(心肌)的电流,而达到除颤的效果,同时要尽量减少电流对心脏的损伤。
一、能量选择 传统推荐首次单相波除颤能量为200J,第2次和第3次除颤能量可仍是200J或者提高到360J,经过3次连续除颤后即可达到99%的除颤成功率。复发室颤时应给予先前有效的除颤能量水平电击。最近有对照试验显示对经胸行电转复时,应用低能量的双相波效果优于单相波。双相波已应用于心律转复,但对其疗效还需要更多的研究予以证实。
2005新指南建议除颤时仅做1次电击,给予1次电击后应该重新进行胸外按压,而循环评估应在实施5个周期(约2分钟)CPR后进行。因为大部分除颤器可1次终止室颤。中断按压去检查可能并不存在的室颤,其合理性值得怀疑。而且,室颤终止后数分钟内,心脏并不能有效泵血,立即实施CPR十分必要。建议成人使用单相波首次和系列电击的能量为360J。双相波选择首次成人电击能量为200J,直线双相波为120J。
埋藏式心脏复律除颤器(ICD) 一、ICD的概述 埋藏式心脏复律除颤器,简称为ICD,其心室电极通常集起搏、感知及除颤功能为一体。当它检测到室性心动过速或心室颤动时,将自动地发放电击来终止恶性心律失常。它于1980年开始应用于临床,能显著地降低心源性猝死高危患者的死亡率,是目前防止心源性猝死最有效的方法,但也会出现ICD介导的电风暴等并发症。 二、ICD的适应证 植入ICD可作为心源性猝死的一级预防措施,主要用于下列患者。 (1)有心肌梗死病史伴左心室收缩功能不全:LVEF≤30%或LVEF30%~40%伴有电生理检查可诱发的单形性室性心动过速、T波电交替、心室晚电位阳性、QRS波群增宽或左心室肥大。 (2)心肌病诊断时间>9个月,存在左心室收缩功能不全及心力衰竭:LVEF≤35%,心功能NYHA分级Ⅱ或Ⅲ级的心力衰竭患者。 (3)CRT联合ICD适应证:LVEF≤35%,QRS波群增宽,心功能NYHA
分级Ⅲ或Ⅳ级的心力衰竭患者。 (4)肥厚型心肌病:①有心源性猝死的家族史;②有反复发作室性心动过速史;③有晕厥史;④活动后血压异常反应;⑤左心室壁厚度>30mm。以上5项中出现2项者。 (5)Brugada综合征:自发的Ⅰ型心电图改变伴有晕厥史或反复发作室性心动过速者。 (6)长Q-T间期综合征:不明原因的晕厥史或反复发作室性心动过速者。 (7)短Q-T间期综合征:不明原因的晕厥史或反复发作室性心动过速者。 (8)致心律失常性右心室心肌病:不明原因的晕厥史或反复发作室性心动过速者。 三、ICD的构成 ICD由感知电极、除颤电极和脉冲发生器构成,其中脉冲发生器包括金属外壳、电池、高压电容和控制线路。
埋藏式心脏转复除颤器(ICD)的护理体会 发表时间:2011-01-21T10:36:10.470Z 来源:《中国美容医学》(综合)10年5期供稿作者:陈咏梅[导读] 饮食护理,术前不必禁食,但不宜过饱。⑥手术前应保证充足睡眠,必要时可给予镇静剂。陈咏梅(无锡市第二人民医院心内科江苏无锡214002)【摘要】目的:提高埋藏式心脏转复除颤器植入术的护理技术和质量,以保障病人生活品质。方法:对恶性心律失常患者植入埋藏式心脏 转复除颤器,实施术前、中、后的及健康指导。结果:消除了病人的思想负担,增强了战胜疾病的信心,使病人身心都得到康复。【关键词】除颤器;安装;护理体会【中图分类号】R654.2【文献标识码】A【文章编号】1008-6455(2010)11-0110-01 恶性心律失常,尤其是持续性室性心动过速和心室颤动是发生心脏性猝死的最主要的原因,约占心脏性猝死的87%。虽然随着心电监护技术的发展,已使院内的猝死率大为降低,但院外心脏猝死常因不能及时复苏而死亡。多个临床试验均已证实ICD具有准确检测和治疗猝死事件的功能。因此植入ICD已成为防治具有极高死亡率的室速和室颤的重要措施,改善病人的生活质量。现将我科成功进行埋藏式心脏转复除颤器植入术3例的体会总结如下: 1资料与方法 1.1一般资料:患者1,男 60岁,扩张型心脏病,心功能Ⅲ级,入院前心源性晕厥2次,入院后心电图证实室性心动过速。患者2,男65岁,在家突然晕厥,意识丧失,四肢抽搐为主诉来医院,入院后室性心动过速频发,药物治疗效果不理想。患者3,女 55岁,扩张型心脏病。 1.2方法:3例均择日手术,患者取平卧位,常规消毒,在局麻下于左侧锁骨中段下约2cm处,切开皮肤,分离皮下组织,在肠大肌筋膜下小心设置一起搏器囊袋,自切口内行左锁骨下静脉穿刺。用Seldinger法置入9F、10F撕开鞘二根,沿撕开鞘插入右小房双极螺旋电极及右心室双极电极。测试心房心室电极阀值,最大感知和阻抗。在丙泊酚静脉麻醉诱导下测试除颤阀值。除颤阈值测试首次采用15J,不成功采用最大能量34J。测试满意后关闭ICD除颤功能,逐层缝合直至皮肤,无菌敷料覆盖。开启ICD功能,并初步设置工作参数。 2护理体会 术前护理:①心理护理,术前以心理护理为主,向患者及家属耐心介绍ICD的效果、安全性,告诉他们安置ICD并非一件可怕的经历,它已帮助很多病人恢复正常和愉快的生活,根据患者的心理状态有针对性的向病人介绍手术、经过及注意事项,做好细致的思想工作,解除其恐惧与焦虑。这样不但可以增加患者的信心,也可增加患者对医护人员的信任,从而便于工作。②配合做好辅助检查,以了解脏器功能,如心脏彩色超声检查等。术前3天停用抗凝药减少创口出血。③皮肤准备,备皮范围为双侧颈部及腋下,前胸部的皮肤。④发放便盆,指导患者练习床上大小便,以免术后卧床出现排便困难。⑤饮食护理,术前不必禁食,但不宜过饱。⑥手术前应保证充足睡眠,必要时可给予镇静剂。 3术中护理 ①注意心率、呼吸、神态、心电监护及病人主体,发现异常随时报告医生。②保证静脉通道通畅,以便准确及时用药。③协助术中传递手术器械及所需物品。④全身麻醉时固定好病人,以防起搏器跌落。⑤出现病情变化及时配合抢救,特别是阀值功能测试时,诱发室速或室颤都必须严密做好应急抢救措施,在物品准备基础上操作分工明确,各尽其职,并做好记录,防止意外发生。 4术后护理 ①术后安排病人住监护病房,连续心电监护至少72h。②ICD体积较一般起搏器大,且一般要置入胸大肌筋膜下,因而手术创伤大,术后出血可能性随之增高,故需加强预防伤口出血,患者卧床72h,局部伤口用无菌纱布覆盖包扎,予沙袋局部压迫6h,术侧肩关节制动72h。③严密观察伤口有无渗血、血肿,观察心率、血压是否稳定,患者有无气胸、胸痛等,早期发现心肌穿孔。④防止伤口感染,遵医嘱使用抗生素5天,伤口部位一周内每天换药一次,并观察伤口情况及生命体征。⑤饮食应给予高蛋白、高维修素、多纤维素、易消化食物,以增加机体抵抗力,促进伤口愈合,保持大小便通畅。⑥术后不宜翻动体位和将术侧手臂高举至头部,以免电极移位。 5出院宣教 ①出院前,护理人员为患者列出详细的复诊计划,并在计划上详细写明需要随防的频率,如每次ICD放电后,ICD电能接近耗尽时均应来院检查ICD各项参数,以便能及时处理ICD故障,合理调整有关参数和用药情况。②减少ICD的放电次数,预防电子风暴现象,合理安排服药时间,防止遗漏服药,特别是长期服用排钾利尿剂要及时补钾,以防低血钾。③指导患者术侧上肢3个月避免负担,在可能产生对ICD 的干扰,应避免与之接触,禁止做磁场共振扫描,放射疗法等。 6小结 ICD植入提高了恶性心律失常患者的生存率,通过加强心理支持,术前、中、后精心护理和健康教育,避免各种诱发因素,延长ICD的使用寿命,从而提高患者的生活质量。
全皮下埋藏式心脏转复除颤器:安全有效的心脏除颤器 摘要:全皮下埋藏式心脏转复除颤器(Subcutaneous implantable cardioverter defibrillator,S-ICD)目前已在欧洲、新西兰、美国投入临床使用。S-ICD主要由脉冲发生器、电极导线组成,与经静脉植入型心律转复除颤器(Transvenous implantable cardioverter defibrillator,TV-ICD)不同的是,S-ICD的脉冲发生器经皮下置于左侧胸壁,电极是由两个感知电极及一个电击线圈组成的,经皮下置于胸骨旁。作为全皮下心脏除颤系统,S-ICD可在一定程度上避免与静脉导线相关的围手术期及长期并发症,且手术过程不需要在透视下进行。S-ICD的适应人群主要包括伴有静脉畸形或梗阻不适合经静脉行心脏转复除颤器的儿童、感染风险大以及有猝死风险的年轻心律失常患者(如Brugada综合症、长QT综合症及肥厚性心肌病)。然而,由于缺乏腔内电极,S-ICD无起搏功能(除电击后短期起搏外),因此,I-SCD不适合缓慢性心律失常患者及有心脏再同步化治疗(Cardiac resynchronization therapy,CRT)适应症的患者。 引言 埋藏式心律转复除颤器(Implantable cardioverter-defibrillator,ICD)目前是心源性猝死的一级预防[1,2]及二级预防[3]的有效手段。迄今为止,大部分ICD植入系统均通过传统植入方式,即经胸腔内大静脉将除颤电极置于右室,然而,TV-ICD具有较高的围手术期及远期并发症。最近的一项大规模研究表明,TV-ICD主要并发症的发生率大约为1.5%,这些主要并发症包括:院内死亡、心脏骤停、心脏穿孔、心脏瓣膜损伤、冠状静脉损伤、血胸、气胸、深静脉炎、短暂性脑缺血发作、中风、心肌梗死、心包填塞以及动静脉瘘[4]。同时,随着时间的推移,电极绝缘故障导致的电极故障的发生率日益增加,有研究显示,电极植入10年后电极故障的发生率约为20%[5]。因此,尽管TV-ICD能够有效治疗快速性室性心律失常,它的缺点也是显而易见的。而非TV-ICD,即S-ICD可有效的避免静脉导线相关的并发症,成为近年来人们研究的热点。S-ICD日前已在欧洲、新西兰、美国投入临床使用,目前全球范围内已成功植入2000余例。 1.S-ICD的构成、植入及程控 S-ICD系统包括脉冲发生器、皮下电极、电极植入工具及程控设施。脉冲发生器的使用寿命大约为5年,体积较TV-ICD稍大,重量145g,约为TV-ICD脉冲发生器的两倍。S-ICD 在感知到快速性室性心律失常时能够以80J高能量进行电复律,并且在电击后30s内,如果感知到有3.5s以上的心脏停搏,可激活起搏功能,利用200mA双相脉冲波以50次/分的起搏频率进行起搏。 与TV-ICD不同,S-ICD不经胸腔大静脉引导电极植入心室,因此手术植入不需要在X 线透视下进行,避免了患者及手术医师的电离辐射暴露,且S-ICD手术过程较为简单,脉冲发生器置于左侧腋前线与腋后线水平第六肋间,电极导管通过两个胸骨旁切口,分别将远端与近端电极置于左侧胸骨旁1-2cm的第二肋间水平及剑突水平,除颤线圈位于两个感知电极之间,长约8cm。心脏节律的监测是通过远端、近端电极与脉冲发生器之间3个向量所形成的3个传感器完成的,S-ICD系统能够自动选择合适的传感器,避免双重QRS及T波过感知(见图1,2)。另外,虽然在S-ICD植入过程中,诱颤成功后以65J能量进行转复,但在植入术后,为了保证转复的成功率,S-ICD均以80J能量进行除颤[6]。值得一提的是,由于证
全皮下植入式心脏复律除颤器ICD的临床应用与前景 (完整版) 植入式心脏复律除颤器(ICD)1980年首次成功植入人体开启了心源性猝死治疗的一个新时代,长期以来的临床证据已证明ICD可以改善多种致心源性猝死疾病的死亡率。自1998年开始,ACC/AHA将ICD作为二级预防的IA类推荐,最新的指南推荐的ICD的适应证包括多种心脏病心源性猝死的一级预防和二级预防,已成为预防心源性猝死的主要治疗手段。传统的ICD系统是通过外周静脉送入ICD导线至右心室,并与埋藏在左胸部皮下的脉冲发生器相联,除颤电极导线在静脉及心腔内。近年来一种全皮下ICD(subcutaneous ICD,S-ICD?)系统问世并开始应用于临床,本文就该系统的临床应用于前景进行介绍。 一、经静脉ICD存在的不足 虽然ICD对于心源性猝死的防治具有跨时代的医院,但相关并发症始终是临床应用的困扰。经静脉ICD系统的并发症包括操作相关的急性并发症和源于感染和电极功能不良的晚期并发症。急性并发症包括气胸、创伤性胸腔积液、电极移位、血肿和感染,这些并发症的发生率较低,一项荟萃分析表明,ICD植入后的最初16个月所有并发症的发生率为9.1%。
长期的并发症主要源于电极功能不良和器械感染。与普通起搏器电极相比,ICD电极的故障更常见,这与ICD电极组件多、工程学上更为复杂有关。长期的研究表明,电极无故障率五年后快速下降,8年时降至60%,10年时年故障率达20%。 感染风险是经静脉ICD另一个终身存在的顾虑,更换发生器是一个特别受关注的时间点,因为此时感染风险几乎较初次安装时翻倍[1]。REPLACE研究是一项多中心前瞻性注册研究,评估接受心脏植入电子装置发生器更换的患者,结果表明,更换IDC或CRT-D时感染的发生率为1.6%[2]。同时期的队列研究表明,单腔或双腔ICD平均电池寿命为5.9年,CRT-D为4.9年[3]。这样一来,大多数ICD植入患者一生至少需要更换一次发生器,有些则需要多次更换,尤其是对CRT有着阳性反应的患者。 CIED长期并发症最主要的顾虑是需要取出电极。显然几乎所有的器械感染病例都需要取出电极,电极功能不良虽然不是绝对需要取出电极,但可能是首选的处理方式。取出长期放置的经静脉电极是一个有潜在并发症和死亡率风险的操作。虽然并发症的绝对发生率低,但这些潜在并发症的严重性非常高,比如大面积胸腔出血和死亡。病例数大的中心的数据显示,操作相关主要并发症发生率为1.3%-1.9%,操作相关死亡率为 0.3%-0.65%[4, 5]。而且,取出电极后的死亡率,12个月时高达10%[6]。
2020中国早期进行自动体外除颤器AED布局与投放专家 共识(完整版) 一、背景 心源性猝死(s udde n c ardi ac d e at h,SC D)是由于各种心脏原因导致的突然死亡,早期表现常无典型性,患者突然出现心脏骤停等表现"。据报道,我国每年发生心源性猝死的患者约为54.4万。当患者发生心脏骤停时,及时抢救非常重要,抢救时间每延迟1mi n,其生存率会降低7%~10%。而心脏骤停多发生在院外的公共场所,其高发地点主要有公共运动场所、交通枢纽(如机场、火车站、地铁站)、大型购物中心和工厂等。因此,院外心脏骤停(ou t-o f-h o s pi t al c ar di ac ar re st,O HCA)的抢救对于保障公众的生命安全、维护全民健康非常重要。2015年美国心脏协会(A me ri can He art As s oc iat io n,A H A)提出的生存链中强调,早期呼救、早期实施高质量的心肺复苏(c ardi o pulmo n ar y r es u s citat io n,CP R)、早期进行自动体外除颤器(auto mat ed ext er n ald ef i bril l at or,A E D) 除颤等急救措施对提高O HCA患者的生存率十分重要。研究表明,在1m i n内实施CPR,3-5mi n进行A E D除颤,可使心脏骤停患者生存率达到50%~70%。由此可见,早期对O HC A患者进行除颤,将大大提高患者的生存率。
公众启动除颤(publi c ac c es s de fibr ill at io n,P A D)是指在O HC A发生率高、人员密集的公共场所配置A ED与公众培训CPR,当发现O H C A患者时,由现场第一目击者在急救人员到达现场前使用AE D对患者进行除颤,从而提高O HC A患者的院前复苏率和院内抢救成功率,改善其预后5-61。80% O HC A患者是由室颤所引起”,发病突然、进展迅速,数分钟后可能会死亡,室颤必须由电除颤才能被纠正。目前高度自动化的A ED操作很便捷,受训后使用极少发生差错,能够解决医务人员无法在第一时间对O HCA患者进行有效救治的难题。因此,在公共场所需合理、有效地配置A ED供心脏骤停患者抢救使用。目前,美国、欧洲一些国家、日本等多个国家或地区均开展了P A D项目,已有些国家制定了AE D对OHC A患者进行除颤的规范流程或指南,而国内也有学者对A E D的使用及应用效果进行了初步探讨,但国内A E D投放或P AD项目运行存在发展不平衡、不充分、不规范的现状,除少数几个大城市如杭州、深圳、上海和海口等重点健全医疗急救体系建设,出台相关急救医疗服务条例,公布A E D的具体布局位置与A E D 地图之外,大部分城市尚处于起步阶段。一项关于杭州公共场所A E D的研究显示,目前A E D投放项目存在重视程度不足、标准流程未规范、公共场所配置A E D数量不足、分布不均、社会公众使用A ED意识不高等一系列问题。
可穿戴式除颤器中国多中心临床观察性研究(2020完整版) 植入型心律转复除颤器(ICD)已经被多项临床研究证实是预防心脏性猝死(SCD)的首选治疗方式[1]。尽管如此,临床上仍有部分SCD发生高风险的患者存在ICD植入的禁忌证,或不符合现有指南的植入适应证[1-2]。可穿戴式除颤器(WCD)因其具有穿戴简单方便、可充电重复使用、除颤效果可靠等优点,很好地解决了上述患者SCD的预防难题[3-4]。现今,欧美和亚洲少数发达国家在应用WCD上已经积累了一定的经验[5-8]。我国在WCD的应用上起步较晚,2018年6月中国医学科学院阜外医院心律失常中心牵头国内多中心WCD应用研究,并率先开展首例WCD的临床应用[9]。本文通过对参与该多中心研究的国内5家医院所应用的WCD患者资料进行总结,对中国人WCD患者的临床特征、适应证情况及使用情况等进行分析。 资料和方法 “WCD的中国临床观察性研究”是一项前瞻性、多中心临床观察性研究。由中国医学科学院阜外医院牵头,卫生部北京医院、清华大学附属长庚医院、中国人民解放军总医院、首都医科大学附属北京朝阳医院共同参与。
1.研究对象: 2018年6月至2019年10月,来自5家医院共54例患者符合入选标准并接受了WCD使用。入选标准要求:①年龄16~80岁(含16、80岁);②符合2016年美国心脏协会(AHA)指南推荐的适应证,主要包括:急性心肌梗死早期(40 d内)伴有严重左心功能不良[左心室射血分数(LVEF)≤35%];急诊血管再通治疗后(3个月内)伴有LVEF≤35%;新诊断的非缺血性心肌病伴LVEF<35%;等待心脏移植且具有高危猝死发生风险;由于感染等原因暂时不能植入ICD;有猝死家族史合并不明原因晕厥患者的诊断[3]。另外将"SCD的二级预防但预计生存期不足1年"这一条纳入入选标准以加快研究进度;③同意并接受WCD的使用。所有患者签署知情同意书。排除标准包括:①已怀孕或在研究期间内怀孕;②存在精神类疾病,或因为身体状况而导致研究者认为不符合接受WCD;③已植入起搏器装置、需行血液透析等其他原因不适宜WCD使用。阜外医院新技术伦理审批号(2018-k-18)。 2.研究设备: WCD统一由美国ZOLL公司提供的最新一代LifeVest系列(图1)。