
头孢类药品皮肤过敏试验方法 关于头孢菌素类药物应用前是否需要做皮肤过敏试验,长期以来始终存在着争议。由于头孢菌素类药物过敏反应发生率明显低于青霉素类药物,所以在临床上多不做皮试,对一般青霉素过敏者也可慎用。多数头孢菌素类药品在《中国药典》也无明确规定必需做过敏试验,但在有过敏史或是过敏体质者等,可根据情况做皮肤试验,但皮试液浓度现无统一规定。参考有关资料提供以下皮试液的建议配制方法,仅供各医疗单位参考。 1、注射用头孢西丁钠皮肤过敏试验方法 规格皮试液配制步骤 1.0g (1)取本品1.0g一支,加10ml生理盐水制成100mg/ml的溶液A。 (2)用注射器取溶液A0.1ml加0.9ml生理盐水混匀制成10mg/ml的溶液B,(3)然后推出0.9ml溶液B,再加0.9ml生理盐水混匀制成1mg/ml的溶液C。(4)然后推出0.5ml溶液C,再加0.5ml生理盐水混匀制成0.5mg/ml的溶液D。 2.0g (1)取本品2.0g一支,加16ml生理盐水制成125mg/ml的溶液A。 (2)用注射器取溶液A0.1ml加0.9ml生理盐水混匀制成12.5mg/ml的溶液B,(3)然后推出0.9ml溶液B,再加0.9ml生理盐水混匀制成1.25mg/ml的溶液C。(4)然后推出0.6ml溶液C,再加0.6ml生理盐水混匀制成0.5mg/ml的溶液D。 2、注射用头孢硫脒皮肤过敏试验方法 规格皮试液配制步骤 0.5g (1)取本品0.5g一支,加5ml生理盐水制成100mg/ml的溶液A。 (2)用注射器取溶液A0.1ml加0.9ml生理盐水混匀制成10mg/ml的溶液B,(3)然后推出0.9ml溶液B,再加0.9ml生理盐水混匀制成1mg/ml的溶液C。(4)然后推出0.5ml溶液C,再加0.5ml生理盐水混匀制成0.5mg/ml的溶液D。 1.0g (1)取本品1.0g一支,加8ml生理盐水制成125mg/ml的溶液A。 (2)用注射器取溶液A0.1ml加0.9ml生理盐水混匀制成12.5mg/ml的溶液B,(3)然后推出0.9ml溶液B,再加0.9ml生理盐水混匀制成1.25mg/ml的溶液C。(4)然后推出0.6ml溶液C,再加0.6ml生理盐水混匀制成0.5mg/ml的溶液D。
多次完整皮肤刺激试验 中国科学院广州化学研究所分析测试中心 卿工---189--3394--6343 手和皮肤消毒剂:除按第一类、第二类或第三类消毒剂的要求进行毒理学试验外,还必须进行完整皮肤刺激试验。如果偶尔使用或间隔数日使用的消毒剂,采用一次完整皮肤刺激试验;如果每日使用或连续数日使用的消毒剂,采用多次完整皮肤刺激试验。接触皮肤伤口的消毒剂,还必须增做一次破损皮肤刺激试验;接触创面的消毒剂,应增做眼刺激试验。使用过程中,必需接触皮肤的其它消毒剂,也应增做完整皮肤刺激试验。根据消毒剂的成分,估计可能有致敏作用者,还需增做皮肤变态反应试验。 一、检测项目 多次完整皮肤刺激试验。 二、检测依据 中华人民共和国卫生部. 《消毒技术规范》(2002年版),皮肤刺激试验,多次完整皮肤刺激试验。 三、检测结论 在本试验条件下,*****公司送检的样品(对新西兰兔多次完整皮肤刺激强度为是否具有刺激性。 (本页以下无正文) 四、检测方法 多次完整皮肤刺激试验 (1)试验前动物皮肤准备同2.3.3.3.1 (1)。 (2)次日将受试物[浓度同 2.3.3.3.1 (2)]0.5ml(g)涂在一侧皮肤上,另一侧涂溶剂作为对照,在涂抹后4h,用水或无刺激的适宜溶剂清洗,除去残留物。每天涂抹一次,连续涂抹14d。在每次涂抹后24h观察结果,按表2-11评分。为了便于受试物的涂抹和结果观察,必要时应剪毛。对照区的处理方法同试验区。 2.3.3.4 评价规定 2.3.3.4.1一次皮肤刺激试验 在各个观察时间点,按照表2-11对动物的皮肤红斑与水肿形成情况进行评分,并分别按时间点将3只动物的评分相加,除以动物数,获得不同时间点的皮肤刺激反应积分均值(刺激指数)。取其中最高皮肤刺激指数,按表2-12评定该受试物对动物皮肤刺激强度的级别。 2.3.3.4.2多次皮肤刺激试验
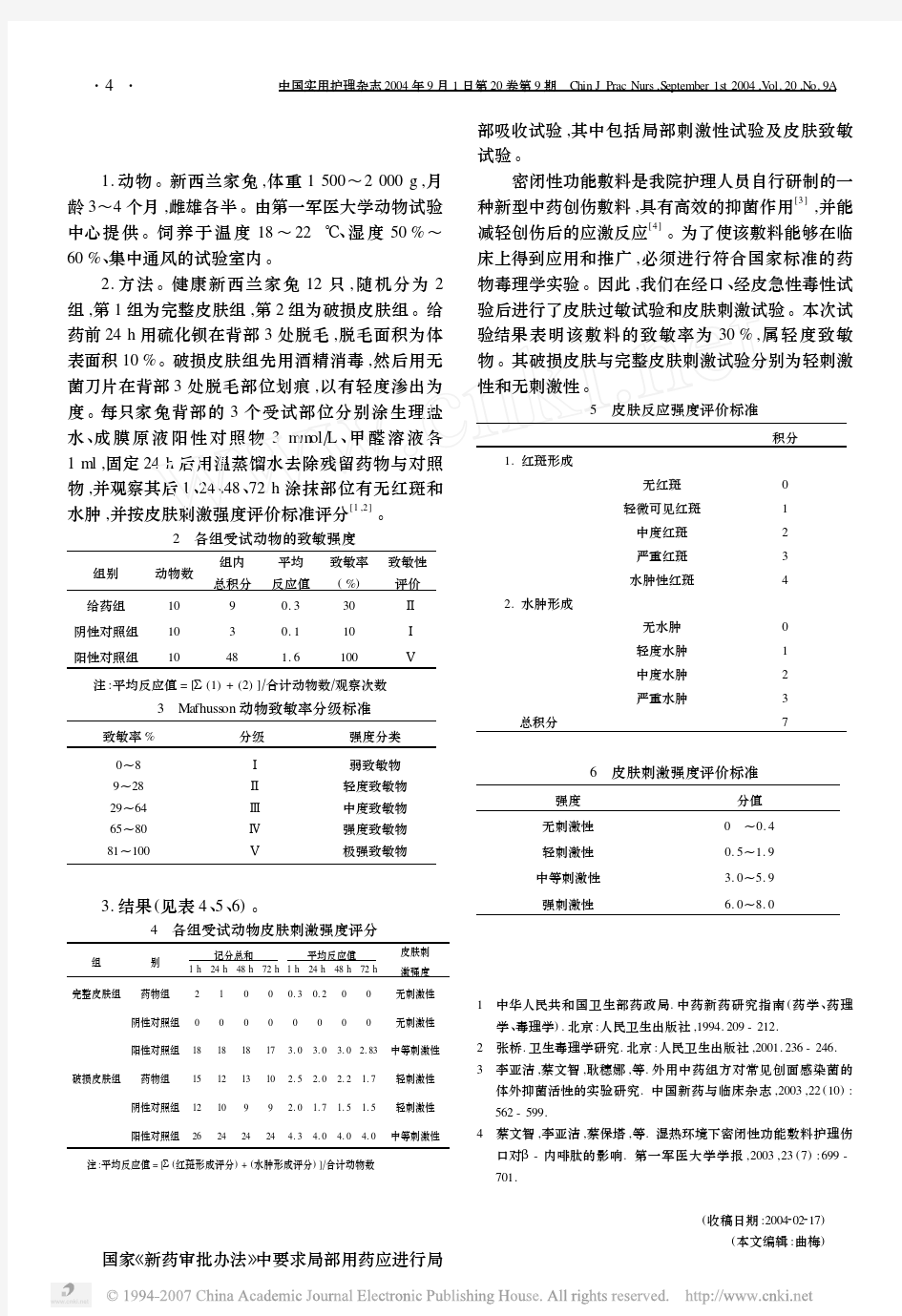
2020儿童过敏原皮肤点刺试验护理实践专家共识 (完整版) 据WHO统计,35%的人群有过敏性疾病,其中儿童占80%左右。WHO已经把过敏性疾病列为重点防治疾病。皮肤点刺试验(SPT)被广泛用于过敏性疾病的病因诊断中,但我国尚无统一的皮肤点刺试验操作和评估标准。为推动我国皮肤点刺试验操作的规范化,提高护士操作的准确性,由国家儿童医学中心儿科护理联盟小儿呼吸(哮喘)学组组织,在全国选取具有儿童过敏性疾病诊断、护理及皮肤点刺试验经验的专家组成专家组,编写《儿童过敏原皮肤点刺试验护理实践专家共识》(以下简称《共识》),旨在为儿童过敏原皮肤点刺试验临床实践的规范开展提供参考。 适用范围 儿童过敏原皮肤点刺试验适用于0~18岁人群,婴幼儿以食入性变应原过敏较为常见,但吸入性变应原过敏在婴幼儿早期也较常见,因此儿童过敏原皮肤点刺试验也可以应用于婴幼儿。适用科室为呼吸科、皮肤科、耳鼻喉科、儿童保健科等。 适应证 怀疑儿童对某种或几种变应原过敏,即可行过敏原皮肤点刺试验。疾
病包括哮喘过敏性鼻炎、特异性皮炎、变应性结膜炎、湿疹、食物过敏、丘疹性荨麻疹等。 禁忌证 1.皮肤存在皮疹或皮肤划痕症阳性; 2.哮喘急性发作期,病情未得到控制; 3.既往曾因暴露于所检测的变应原中而出现严重过敏反应,如过敏性休克; 4.因潜在疾病、心理原因等不能配合或不耐受者; 5.试验前曾服用过有抑制作用的药物且停药时间较短者,常见药物对过敏原皮肤点刺试验的影响见表1。 操作步骤
由于不同年龄儿童的皮肤面积不同,过敏原皮肤点刺试验可在单侧或双侧前臂进行。 1.操作前(1)用物准备:①过敏反应抢救用物(肾上腺素、生理盐水、注射器等)。②常规用物:75%乙醇溶液、生理盐水、棉签、点刺液、点刺针、划痕笔、刻度尺、锐器盒、计时器、签字笔、报告表。(2)被检测者准备:①询问被检测者用药情况。②确认被检测者是否伴皮肤划痕症:采用划痕笔在试验部位检测是否出现划痕症,如果是,则不宜进行过敏原皮肤点刺试验。③确认被检测者试验部位皮肤状况良好,无荨麻疹、湿疹等。④确认被检测者为非空腹状态。⑤询问被检测者是否对75%乙醇溶液过敏:如对75%乙醇溶液过敏则采用生理盐水擦拭试验部位,避免影响试验结果。 (3)护士准备:①儿童过敏原皮肤点刺试验应由经过规范培训的护士进行操作。②洗手、戴口罩。 2.操作中(1)用75%乙醇溶液或生理盐水清洁前臂曲侧,自然待干。(2)将适量点刺液滴于前臂曲侧,每2种点刺液间隔≥2 cm,以避免交叉浸染。(3)用点刺针与皮肤呈90°角,快速刺于皮肤上的点刺液,深度以刺入表皮层为宜,停留约1 s后拔出,每个点刺针仅用于1种过敏原试验。(4)告知被检测者或家长保持手臂掌心向上平放,15~20 min 后观察试验结果。此过程中避免抓挠试验部位皮肤,切勿离开留观区,如有不适如面色潮红、胸闷、气促、全身皮疹等请及时告知医护人员。
四、皮肤刺激性/腐蚀性试验 Dermal Irritation/Corrosion Test 1 范围 本规范规定了动物皮肤刺激性或腐蚀性试验的基本原则、要求和方法。 本规范适用于化妆品原料及其产品安全性毒理学检测。 2 规范性引用文件 OECD Guidelines for Testing of Chemicals (No.404, July 1992) USEPA OPPTS Harmonized Test Guidelines (Series 870. 2500, Aug. 1998 ) 3 试验目的 确定和评价化妆品原料及其产品对哺乳动物皮肤局部是否有刺激作用或腐蚀作用及其程度。 4 定义 4.1 皮肤刺激性(Dermal irritation):皮肤涂敷受试物后局部产生的可逆性炎性变化。 4.2 皮肤腐蚀性(Dermal corrosion):皮肤涂敷受试物后局部引起的不可逆性组织损伤。 5试验的基本原则 将受试物一次(或多次)涂敷于受试动物的皮肤上,在规定的时间间隔内,观察动物皮肤局部刺激作用的程度并进行评分。采用自身对照,以评价受试物对皮肤的刺激作用。急性皮肤刺激性试验观察期限应足以评价该作用的可逆性或不可逆性。 6 试验方法 6.1 受试物 液体受试物一般不需稀释,可直接使用原液。若受试物为固体,应将其研磨成细粉状,并用水或其它无刺激性溶剂充分湿润,以保证受试物与皮肤有良好的接触。使用其它溶剂,应考虑到该溶剂对受试物皮肤刺激性的影响。 受试物为强酸或强碱(pH值≤2或≥11.5),可以不再进行皮肤刺激试验。此外,若已知受试物有很强的经皮吸收毒性,经皮LD50小于200mg/kg体重或在急性经皮毒性试验中受试物剂量为5000mg/kg体重仍未出现皮肤刺激性作用,也无需进行急性皮肤刺激性试验。6.2 实验动物和饲养环境 多种哺乳动物均可被选为实验动物,首选白色家兔。应使用成年、健康、皮肤无损伤的动物,雌性和雄性均可,但雌性动物应是未孕和未曾产仔的。实验动物至少要用4只, 如要澄清某些可疑的反应则需增加实验动物数。实验动物应单笼饲养,试验前动物要在实验动物房环境中至少适应3d时间。 实验动物及实验动物房应符合国家相应规定。选用常规饲料,饮水不限制。 6.3急性皮肤刺激性试验步骤 6.3.1 试验前约24 h ,将实验动物背部脊柱两侧毛剪掉,不可损伤表皮,去毛范围左、右各约2cm×3cm。
过敏原皮肤点刺实验步骤及注意事项
过敏原皮肤点刺实验步骤及注意事项 皮肤点刺试验是将少量高度纯化的致敏原液体滴于患者前臂、再用点刺针轻轻刺入皮肤表层。如患者对该过敏原过敏,则会于十五分钟内在点刺部位出现类似蚊虫叮咬的红肿块,出现痒的反应,或者颜色上有改变。基本上就能够确定过敏性疾病的存在。皮肤点剌试验现为欧洲国家及美国公认最方便、经济、安全、有效的过敏原诊断方法,其优点为安全性及灵敏度均高,患者无痛楚,就如被蚊叮一样,而且可以立刻知道检验结果。 原理是点刺液含有的变应原,与病人皮肤中致敏肥大细胞的变应原特异性Ig E发生反应.形成变应原-抗体反应,导致肥大细胞Fcε受体交联,诱导预成介质组胺等活性物质释放,使局部毛细血管扩张(红斑),毛细血管通透性增强(水肿、风团),阳性者表示对该抗原过敏,可确认为IgE介导过敏反应病,属于速发型过敏反应。该方法采用组胺作阳性对照,以计算相对的反应强度,是一种有效测定过敏性皮肤病的特应性(对一种或多种变应原敏感)的方法。 实施方法及步骤 点刺工具采用一次性点刺针。 试剂变应原点刺液包括:(1)组胺(阳性对照液);(2)生理盐水(阴性对照液);(3)屋尘螨;(4)粉尘螨;(5)蟑螂;(6)花生;(7) 羊肉;(8)牛肉; (9)小虾;(9)蟹肉;(10)红辣椒;(11)鸡蛋;(12)牛奶。等 操作步骤 (1)选择前臂掌侧皮肤进行点刺。(2)用记号笔在前臂中部标记所用点刺液名称,两种点刺液间的距离不小于3cm,以防止反应红晕融
合;消毒皮肤。(3)自下而上滴各种点刺液1小滴(比针尖大即可)。(4)用一次性消毒点刺针垂直点在每一液滴中,轻压刺破皮肤(以不出血为度,仅用食指顶住针尾,向下轻压刺破皮肤。注意不可用力过猛,以防出血而影响皮肤反应的结果。),1秒后提起弃去,2-3分钟后将全部液滴擦去(檫液时宜向旁边檫,切勿向其它点刺点方向檫,以免过敏原点刺液混合,造成假阳性结果),15-20分钟后观察并记录皮肤反应。(5)为避免假阴性和假阳性,必需同时在变应原液滴上方3cm处作一个阴性对照(N)和变应原下方3cm处作一个阳性对照(H)。阴性对照用生理盐水,阳性对照一般用组胺,如同时做多种变应原测试,阴性和阳性对照可以共用,不必一一对照。(组胺反应高峰在8-10分钟,往后消退较快。此时宣先作记录)。 (6)结果评定标准(以组胺为标准)组胺引起的皮丘不论大小定为+++,比组胺大的皮丘为++++,与组胺一样大的皮丘为+++,比组胺小的皮丘为++,甚至+,阴性为?。(7)SPT反应表现为风团和红晕,如用计量法测定,可用直尺分别量风团和红晕的最长径及与其垂直的横径,两者相加后平均,称谓平均直径[D=(a+b)/2] 。原则上以风团反应为准,红晕反应仅作参考。(8)为记录反应形态,可用圆珠笔依风团和红晕的外缘绘两个圈,内圈绘风团用实线,外圈绘红晕用虚线。然后用透明胶带贴平在风团和红晕上,使圈色粘到胶带上,揭下后转贴到计算纸上作为记录。此不仅方便计算平均直径,还可以反应面积。 注意事项 1)明显损害全身症状的疾病、试验部位一皮肤病的病人不宜进行。 2)孕期点刺试验可能引起过敏反应,故应尽量避免。
附件4 药物刺激性、过敏性和溶血性 研究技术指导原则 一、概述 刺激性、过敏性、溶血性是指药物制剂经皮肤、粘膜、腔道、血管等非口服途径给药,对用药局部产生的毒性(如刺激性和局部过敏性等)和/或对全身产生的毒性(如全身过敏性和溶血性等),为临床前安全性评价的组成部分。 药物的原形及其代谢物、辅料、有关物质及理化性质(如pH值、渗透压等)均有可能引起刺激性和/或过敏性和/或溶血性的发生,因此药物在临床应用前应研究其制剂在给药部位使用后引起的局部和/或全身毒性,以提示临床应用时可能出现的毒性反应、毒性靶器官、安全范围。 本指导原则适用于中药、天然药物、化学药物。 二、基本原则 (一)试验管理 根据《药品注册管理办法》,药物刺激性、过敏性和溶血性研究必须执行《药物非临床研究质量管理规范》(GLP)。 (二)随机、对照、重复 试验设计应遵循随机、对照、重复的原则。 (三)整体性、综合性原则 应根据受试物特点,充分考虑和结合药学、药效学、其他毒理学及拟临床应用情况等综合评价,体现整体性、综合性的原则。
(四)具体问题具体分析 应在遵循安全性评价普遍规律的基础上,具体问题具体分析,结合受试物的特点,在阐明其研究方法或技术科学、合理的前提下进行规范性试验,对试验结果进行全面分析评价。 三、基本内容 (一)受试物和实验动物 1.受试物 中药、天然药物:受试物应能充分代表临床试验样品或上市药品。应采用工艺路线及关键工艺参数确定后的工艺制备,一般应为中试或中试以上规模的样品,否则应有充分的理由。应注明受试物的名称、来源、批号、含量(或规格)、保存条件及配制方法等,由于中药的特殊性,建议现用现配,否则应提供数据支持配制后受试物的质量稳定性及均匀性。试验中所用溶媒和/或辅料应标明名称、标准、批号、规格及生产单位。 化学药物:受试物应采用工艺相对稳定、纯度和杂质含量能反映临床试验拟用样品和/或上市样品质量和安全性的样品。受试物应注明名称、来源、批号、含量(或规格)、保存条件及配制方法等,并附有研制单位的自检报告。试验中所用辅料、溶媒等应标明批号、规格和生产单位,并符合试验要求。 在药品研发的过程中,若受试物的工艺发生可能影响其安全性的变化,应进行相应的安全性研究。 化学药物试验过程中应进行受试物样品分析,并提供样品分析报告。成分基本清楚的中药、天然药物也应进行受试物样品分析。 2.实验动物
常用药物的皮肤敏感试验 有些药品如抗生素中β–内酰胺类的青霉素、头孢菌素;氨基糖苷类抗生素的链霉素、庆大霉素,维生素、有机碘造影剂、局麻药、免疫调节剂、生物药品(酶、抗毒素、类毒素、血清、菌苗、疫苗)等药品在给药后极易引起过敏反应,甚至出现过敏性休克。为安全起见,需在注射给药前进行皮肤敏感试验,皮试后观察15~20分钟,以确定阳性或阴性反应。 对青霉素、头孢菌素、破伤风抗毒素等易致过敏反应的药品,注意提示患者在用药前(或治疗结束后再次应用时)进行皮肤敏感试验,在明确药品敏感试验结果为阴性后,再调配药品;对尚未进行皮试者、结果阳性或结果未明确者拒绝调配药品,同时注意提示有家族过敏史或既往有药物过敏史者在应用时提高警惕性,于注射后休息和观察30分钟,或采用脱敏方法给药。 鉴于头孢菌素类抗生素可引起过敏性反应或过敏性休克,同时与青霉素类抗生素存在有交叉过敏性,概率在3%~15%,但目前头孢菌素应用前是否做皮肤试验的临床意义尚有极大争议,《中华人民共和国药典临床用药须知》(2005年版)等相关著作尚无定论。国外文献证实:若患者以前发生过青霉素过敏性休克者,应禁用头孢菌素,若过敏反应轻微,必要时可在严密监护下,给予头孢菌素类抗生素。但近年来有多例报道,头孢菌素可致过敏性休克甚至死亡,为慎重起见和对患者的安全用药负责,建议在应用前做皮肤试验,并提示应用所注射的药品品种进行皮试。另外,具体到药物是否需要做药物皮肤敏感试验,请参照药品说明书和官方的药物治疗指南。鉴于各药品生产企业的产品标准不同而对皮肤试验要求不一,在用药前宜仔细阅读药品说明书。《中国人民共和国药典临床用药须知》(2005年版)中必须做皮肤敏感试验的药物情况,见附表1。 此外,在部分权威性较高的二次文献中,对部分常用药品也记载应做皮肤敏感试验,在此也列附表2提示。 附表1 常用药物皮肤敏感试验的药液浓度和给药方法与剂量 苯唑西林钠、氯唑西林钠、氨苄西林钠、阿莫西林、羧苄西林钠、哌拉西林钠、磺苄西林钠注射剂和青霉素片剂等皮试药液浓度和给药剂量同青霉素 附表2 部分提示应做皮肤敏感试验药物的药液浓度和给药方法与剂量
局部毒性作用——皮肤致敏试验: 选择豚鼠作为实验动物。每天涂皮或皮内注射受试物溶液,共14天,此阶段称为诱导阶段。间隔10~14天后,用激发剂量(通常低于诱导剂量)再皮内注射1次(称为激发阶段), 观察有无皮肤反应及反应程度并评分。 第四节皮肤致敏实验 一、实验材料 1. 动物:选择豚鼠雌雄各半,体重在 250-300g于给受试物前24小时将豚鼠背部两侧毛脱掉,去毛范围每侧约3cm×3cm。 2. 药物:若受试物是膏剂一般不稀释,可直接实验。若受试物为固体粉末,则需用适量水或适宜的赋形剂(如羊毛脂、凡士林、橄榄油等)混匀以保证受试物与皮肤的良好接触。 3. 阳性致敏物:2,4一二硝基氯代苯制成1%的致敏浓度和0.1%的激发浓度。 二、试验方法 1. 局部封闭涂皮法致敏 ⑴实验分组:将豚鼠按体重性别随机分成三组,每组10只(雌雄各半)。第一组给受试物, 第二组空白对照(给赋形剂),第三组阳性对照(给阳性致敏物)。 ⑵致敏接触:取受试物0.1-0.2mg(或g)涂在动物左侧脱毛区,用适宜方法固定,持续6小时。第7天和第14天,以同样方法重复一次。空白对照组与阳性对照组方法同上。 ⑶激发接触:与末次给受试物致敏后14天,将受试物0.1-0.2m1(或 g)涂于豚鼠背部右侧脱毛区,6小时后去掉受试物,即刻观察,然后子24小时、48小时、72小时再次观察皮肤过敏反应情况,按表评分(空白对照与阳性对照方法均同受试物)。
(4)结果判断与评价:实验结果按皮肤反应标准评分后,根据实验组与对照组豚鼠皮肤反应的差别,按表16-5判断受试物对皮肤过敏反应性质。 为了反应受试物的致敏强度,可按表16-6的分类判断其致敏率。致敏率的计算是:将出现皮肤红斑或水肿(不论程度轻重)的动物例数除以受试动物总数,即致敏率。 2. 皮内法致敏:第一天在豚鼠背部一侧去毛区内注射被试药物溶液或乳剂0.05m1(0.1%),第二天观察反应,第三天开始继续在同侧3cm×4cm去毛区内按同法给药,剂量增至每次0.1ml,给药日隔一日进行,给药部位依次更换,如此给药9次。对照组不致敏。激发,末次致敏后14天在豚鼠背部另一侧去毛区皮内注射0.05m1(0.1 %)药物,24小时后观察反应,必要时在致敏后28天再重复进行第二次激发;对照组作同样处理,该法的致敏剂量准确,对中等致敏强度的药物比较合适。 3. 皮内和涂皮相结合的方法:致敏,第一天在豚鼠顶部(4cm× 6cm去毛区的脊柱两侧从头向尾成对称地作皮内注射;①0.lml福氏完全佐剂(由轻质石蜡油或月桂基硫酸钠分枝杆菌50-10即物!组成,临用时加4:1羊毛脂或吐温80等乳化剂,经高压消毒后,再与等量盐水研磨成乳浊液)。②0.1m1 药物。③0. 1rn1药物与福氏完全佐剂的等量混合物。第8天用2cm ×4cm滤纸涂以适当赋形剂配成的药物斑贴于豚鼠颈部的注射部位,持续封闭固定48小时作为第二次致敏,为加强致敏作用,对无皮肤刺激作用的药物,可在第2次致敏前24小时用10%月桂基硫酸钠涂于斑贴处。对照组只用溶剂和赋形剂致敏、激发,末次致敏后14-28天分别用2cm ×2cm滤纸涂以药物及赋形剂,贴于豚鼠肩脚区左右两侧去毛区,持续封闭固定24小时,激发后24小时和48-小时观察反应,对照组作同样处理。在三种致敏方法中,方法3对致敏物检测率最高,尤其适用于弱致敏物的筛选。此方法已被Magnusson(1980)推荐为筛选化学物接触致敏作用的标准方法。 上述实验结果可用动物皮肤反应强度和致敏阳性率表示。皮肤反应强度评分标准见表16-7。 并依此比较实验组和对照组反应差异的显著性,确定被试药物有否致敏作用。致敏阳性率是阳
急性皮肤刺激试验 1 目的 确定化学品对哺乳动物皮肤局部是否有刺激作用及程度,为制定化学品对皮肤的保护措施提供依据。 2 制定依据 《化妆品卫生规范(2007版)》。 3试验方法 3.1受试样品处理 液体受试物一般不需稀释,可直接使用原液。若受试物为固体,应将其研磨成细粉状,并用水或其它无刺激性溶剂充分湿润,以保证受试物与皮肤有良好的接触。使用其它溶剂,应考虑到该溶剂对受试物皮肤刺激性的影响。需稀释后使用的产品,先进行产品原型的皮肤刺激性/腐蚀性试验,如果试验结果显示中度以上刺激性,可按使用浓度为受试物再进行皮肤刺激性/腐蚀性试验。 受试物为强酸或强碱(pH 值≤2 或≥11.5),可以不再进行皮肤刺激试验。此外,若已知受试物有很强的经皮吸收毒性,经皮LD50 小于200 mg/kg 体重或在急性经皮毒性试验中受试物剂量为2000 mg/kg 体重仍未出现皮肤刺激性作用,也无需进行急性皮肤刺激性试验。3.2实验动物和饲养环境 多种哺乳动物均可被选为实验动物,首选白色家兔。应使用成年、健康、皮肤无损伤的动物,雌性和雄性均可,但雌性动物应是未孕和未曾产仔的。实验动物至少要用4只,如要澄清某些可疑的反应则需增加实验动物数。实验动物应单笼饲养,试验前动物要在实验动物房环境中至少适应3d 时间。 实验动物及实验动物房应符合国家相应规定。选用常规饲料,饮水不限制。 3.3急性皮肤刺激性试验步骤 3.3.1试验前约24h,将实验动物背部脊柱两侧毛剪掉,不可损伤表皮,去毛范围左、右各约3cm×3cm。 3.3.2 取受试物约0.5mL(g)直接涂在皮肤上,然后用二层纱布(2.5cm×2.5cm)和一层玻璃纸或类似物覆盖,再用无刺激性胶布和绷带加以固定。另一侧皮肤作为对照。采用封闭试验,敷用时间为4h。对化妆品产品而言,可根据人的实际使用和产品类型,延长或缩短敷用时间。对用后冲洗的化妆品产品,仅采用2h 敷用试验。试验结束后用温水或无刺激性溶剂
皮肤急性毒性试验 一.试验目的观察动物完整皮肤及破损皮肤短期内接触受试物所产生的毒性反应。 二.实验材料 1.动物:选用成年健康家兔(2kg)、白色豚鼠(300g)、白色小型猪(7kg)或大鼠(200g)。家兔 或小型猪每组4只,豚鼠或大鼠每组10只。受试动物应皮肤光滑、无损伤、无皮肤病。 2.受试物:膏剂、液体或粉末。前两者可直接试验,后者需用适宜赋形剂(如羊毛脂、凡士 林等)混匀,以保证受试物与皮肤良好接触。 三试验方法 1 受试动物皮肤制备: ①完整皮肤制备:动物在给药前24h,将背部脊柱两侧去毛,可采用剪、剃或适宜的脱毛剂,如8%Na2S等。去毛范围约相当于体表面积的10%左右,即家兔约150cm2左右,豚鼠、大鼠约40cm2左右,小型猪约300cm2。去毛后24小时检查去毛皮肤是否因去毛而受伤,受伤的皮肤不宜做完好皮肤的毒性试验。 ②破损皮肤准备:按上述方法将受试动物去毛,消毒皮肤后,用消毒手术刀做井字形划破表皮,或用砂布纸摩擦打毛皮肤等,以皮肤出现轻度渗血为度。 2 剂量选择和分组:分对照组和试验组。对照组应设赋形剂组或空白组。试验组分为完整皮肤组和破损皮肤组,各2~3个剂量组。每组动物数为家兔或小型猪4只,大鼠或豚鼠10只,雌雄各半。低剂量组以临床用制剂(含辅料)用量不低于1g或1ml,高剂量组为低剂量组的2~4倍,或各剂量组间间距根据受试物毒性大小和预试结果而定,一般以0.65~0.85为宜。根据中药具体特点,可以提高浓度或增加24小时内用药次数。若用受试物剂量超过有效浓度20倍以上,仍未出现异常反应或死亡,则只设一个高剂量组 3 给药方法及观察时间:试验时,将受试物均匀的涂敷于动物背部脱毛区,破损皮肤则在脱毛区划破皮肤后再涂敷受试物,并用无刺激性砂布、胶布或网孔尼龙绷带加以固定。给受试物24小时后,可用温水或适当溶剂去除残留的受试物或赋形剂,每日观察,连续观察7天。给受试物时应注意,若受试物是固体粉末或中药散剂,则需加适量水或赋形剂(如羊毛脂、凡士林、橄榄油等)混匀,以保证受试物与皮肤的良好接触。如受试物时液体,除用纱布固定外,还应在其覆以聚乙烯薄膜,然后再包扎固定,以防止液体挥发。给药后,要防止动物舔食受试物。 4. 观察内容:观察动物全身中毒表现和死亡情况,包括动物体重、皮肤、毛发、眼睛和粘膜的变化,呼吸、循环、中枢神经系统、四肢活动等的变化。若有动物死亡则需进行尸检和肉眼观察。当有肉眼可见病变时,则需进行病理学检查。 四结果判断及实验报告 实验结果与对照组比较进行判断。试验报告应详细论述实验方法,列表说明分组、剂量、动物数、每日用药次数、中毒表现及死亡动物数,有死亡动物时,应报告病例解剖学及病理组织学检验报告,并与对照组进行对比评价。
头孢类抗菌药物皮肤过敏试验专家共识 (广东省药学会2008年10月30日印发) 一、青霉素类抗菌药物使用必须进行皮肤过敏试验,原因是:过敏反应的抗原—主要决定簇-青霉噻唑决定簇与次要决定簇-青霉烯酸决定簇非常明确;皮试符合率可达70%;皮试液的浓度与皮试方法均已规范。 二、头孢类抗菌药物使用前是否需要进行皮肤过敏试验世界上尚存在争议,原因在于:引发头孢类抗菌药物过敏反应的半抗原—主要决定簇与次要决定簇尚不明确,可能有Cephalosporoyl、Cephalosporanyl和产品中的杂质等;皮试符合率<30%;皮试液浓度与皮试方法未统一(国内皮试液和国外皮试液的种类、浓度和皮试液用量相差很大)。目前美国和大部分欧洲国家不进行皮肤过敏试验,而日本和北欧的一些国家仍规定进行皮肤过敏试验。 三、头孢类抗菌药物是否需要做皮肤过敏试验,在我国药品说明书和参考书中现有多种描述,但中华人民共和国药典委员会编写的《临床用药须知》(2005年版)和卫生部2004年发布的《抗菌药物临床应用指导原则》均未要求头孢类抗菌药物做皮肤过敏试验。目前达成的共识是:如药品说明书明文规定使用前需做皮肤过敏试验的,则必须做。如药品说明书上未明确规定,则需临床根据患者是否为过敏体质、既往药物过敏史、患者的患病严重程度等综合考虑是否进行皮肤过敏试验。 四、如果进行头孢类抗菌药物的皮肤过敏试验,必须使用原药配制皮试液,不能用青霉素皮试液代替,也不能用某一种头孢菌素配制成皮试液做所有头孢类抗菌药物的皮肤过敏试验。皮试液的浓度国、内外的差距较大,国内目前推荐的浓度为300-500μg/ml,注射量为0.1ml。 五、如果患者对青霉素类严重过敏,应禁用头孢类抗菌药物;如果患者对青霉素类一般过敏,可根据病情慎重地选用头孢类抗菌药物,现有的研究表明,青霉素类与一代头孢的交叉过敏反应发生率明显高于二代、三代和四代,因此,宜选用二、三、四代头孢,特别三、四代头孢更为安全。 六、头孢类抗菌药物的产品质量与临床上发生的过敏反应有相关性。现已经从头孢噻肟等头孢类抗菌药物中收集到了能引发动物过敏反应的基本无抗菌活性的高分子聚合物。说明控制产品中高聚物的含量是质量控制的关键之一。 七、临床使用头孢类抗菌药物,必须仔细询问病人药物过敏史,不管是否进行皮肤过敏试验,或皮肤过敏试验阴性,在首次使用后的0.5-1小时内应严密观察,一旦出现过敏反应征兆,应迅速处理。过敏反应是难以预测的,过敏反应的发生不是医务人员的责任,但发生后处理不当或没有相应的救治措施,医院则要面临一定的法律风险。
皮肤光变态反应试验 Skin Photoallergy Test 1.范围 本方法规定动物皮肤光变态反应试验的基本原则、要求与方法 本方法适用于化妆品原料和产品的皮肤光变态反应检测 2.规范性引用文件 ●GB 14924.3-2010 实验动物配合饲料营养成分 ●GB 14925-2010/XG1-2011《实验动物环境及设施》国家标准第1号修改单 ●光感作性。化粧品の安全性評価に関する指針2015(日本化粧品工業連合会編,2015 年11月27日出版,薬事日報社) 3.试验目的 本试验用于评估与预测人体重复接触化妆品原料及其产品,并在日光照射下引起皮肤光变态反应的可能性。 4.定义 4.1 光敏性(Photosensitivity) 广义的光敏性包括光毒性(Phototoxicity,又称为光刺激性,photoirritation)与光变态(Photoallergy)。 4.2皮肤光变态反应(皮肤光过敏反应,Skin Photoallergy) 皮肤接触受试物并经过紫外线照射,通过作用于机体免疫系统,诱导机体产生光致敏状态,经过一定间歇期后,皮肤再次接触同一受试物并在紫外线照射下,引起特定的皮肤反应,其反应形式包括:红斑,水肿等。 5.原理 皮肤光变态反应是一种细胞介导的由光激活的皮肤免疫性反应,是IV型过敏反应的特殊类型,系光感物质经皮吸收或通过循环到达皮肤后与吸收的光线在表皮细胞层发生的不良反应。目前较为公认的原理为:光感物质吸收光能后成激活状态,并以半抗原形式与皮肤中的蛋白结合成受试物一蛋白结合物,经表皮的郎罕氏细胞传递给免疫活性细胞,引起淋巴细胞致敏等免疫反应。致敏的淋巴细胞再次接触同一抗原时释放出淋巴因子,导致一系列有害反应。 6.试验的基本原则 6.1 光化学品安全性评价的一般原则 化妆品原料在紫外可见(UV/VIS)光谱(290-700 nm)有吸收,具有光稳定性,
过敏原皮肤点刺实验步骤及注意事项 皮肤点刺试验是将少量高度纯化的致敏原液体滴于患者前臂、再用点刺针轻轻刺入皮肤表层。如患者对该过敏原过敏,则会于十五分钟内在点刺部位出现类似蚊虫叮咬的红肿块,出现痒的反应,或者颜色上有改变。基本上就能够确定过敏性疾病的存在。皮肤点剌试验现为欧洲国家及美国公认最方便、经济、安全、有效的过敏原诊断方法,其优点为安全性及灵敏度均高,患者无痛楚,就如被蚊叮一样,而且可以立刻知道检验结果。 原理是点刺液含有的变应原,与病人皮肤中致敏肥大细胞的变应原特异性Ig E 发生反应.形成变应原-抗体反应,导致肥大细胞Fcε受体交联,诱导预成介质组胺等活性物质释放,使局部毛细血管扩张(红斑),毛细血管通透性增强(水肿、风团),阳性者表示对该抗原过敏,可确认为IgE介导过敏反应病,属于速发型过敏反应。该方法采用组胺作阳性对照,以计算相对的反应强度,是一种有效测定过敏性皮肤病的特应性(对一种或多种变应原敏感)的方法。 实施方法及步骤 点刺工具采用一次性点刺针。 试剂变应原点刺液包括:(1)组胺(阳性对照液);(2)生理盐水(阴性对照液); (3)屋尘螨;(4)粉尘螨;(5)蟑螂;(6)花生;(7) 羊肉;(8)牛肉; (9)小虾;(9)蟹肉;(10)红辣椒;(11)鸡蛋;(12)牛奶。等 操作步骤 (1)选择前臂掌侧皮肤进行点刺。(2)用记号笔在前臂中部标记所用点刺液名称,两种点刺液间的距离不小于3cm,以防止反应红晕融合;消毒皮肤。(3)自下而上滴各种点刺液1小滴(比针尖大即可)。(4)用一次性消毒点刺针垂直点在每一液滴中,轻压刺破皮肤(以不出血为度,仅用食指顶住针尾,向下轻压刺破皮肤。注意不可用力过猛,以防出血而影响皮肤反应的结果。),1秒后提起弃去,2-3分钟后将全部液滴擦去(檫液时宜向旁边檫,切勿向其它点刺点方向檫,以免过敏原点刺液混合,造成假阳性结果),15-20分钟后观察并记录皮肤反应。(5)为避免假阴性和假阳性,必需同时在变应原液滴上方3cm处作一个阴性对照(N)和变应原下方3cm处作一个阳性对照(H)。阴性对照用生理盐水,阳性对照一般用组胺,如同时做多种变应原测试,阴性和阳性对照可以共用,不必一一对照。(组胺反应高峰在8-10分钟,往后消退较快。此时宣先
实验三一次给药皮肤刺激实验 一、实验目的 掌握皮肤染毒技术,了解受试物对皮肤是否有刺激或腐蚀作用。 二、实验器材 1、实验动物: 小鼠24只,每组4只 2、材料 共用:剃毛器1把、剪毛剪2把、记号笔1支、透明胶1卷、纯桉叶油素10 mL、50%桉叶油素10 mL、25%桉叶油素10mL、3%吐温80 10mL、清洁温水500 mL 每组:长镊子1支、医用手套2双、、注射器(1 mL)1支、烧杯(50 mL)1个、纱布(1.5 cm×1.5 cm)8张。 三、实验内容与步骤 1、保定:一人用一手抓住小鼠颈部皮肤,另一手抓住小鼠尾部,轻轻按住固定在操作台面上。 2、剃毛:小鼠保定后,一人用电动剃毛剪将小鼠背部脊柱两侧的毛剃净,不可损伤表皮,去毛范围左、右各约2 cm×2 cm。注意需将皮肤绷紧,把剪刀贴紧皮肤剪,但不可用手提起被毛,以免剪破皮肤;依次剪毛,不要乱剪;剪下来的被毛集中在一个装水的烧杯内,勿遗留在和操作台周围。 3、破损皮肤的制备:给药前24 h,用75%酒精消毒小鼠裸露皮肤部位,用消毒针头在剃毛部位做“井”字状划划痕,划破皮肤,以有组织液和血液渗出为度。 3、染毒:吸取1 mL受试物滴于两层灭菌纱布(1.5 cm×1.5 cm)上,将浸有受试物的纱布覆盖在左侧裸露皮肤区域,用透明胶布固定,右侧皮肤以3%吐温80为对照。 4、观察:一次给药4 h后,以温水洗去残留受试物,观察1 h,24 h、48 h、72 h涂抹部位的红斑和水肿等反应。按表1进行皮肤反应评分,以受试动物积分的平均值进行综合评价,将观察结果填入表3中。 5、结果判定:根据24、48和72 h各观察时点最高积分均值,按表2判定皮肤刺激强度。 6、实验分组:见表4 四、注意事项 在实验操作过程中,注意安全,以免被小鼠咬伤,防止小鼠丢失;实验使用的有毒化学药品妥善处理;做好实验观察记录。 五、思考题 皮肤刺激实验与皮肤毒性实验有何区别?
化妆品皮肤致敏检测方法整理 化妆品引起的皮肤过敏可分为诱导接触、诱导阶段和激发接触三个阶段, 诱导接触是由于机体接触过敏原而诱导出致敏状态, 此时皮肤产生较轻的反应或无明 显反应, 经过一段时间( 几周, 甚至几年) 的诱导期, 如果机体再次接触过敏原, 就会引起迟发性超敏感反应, 且在最初染毒部位以外的皮肤均可发生。 皮肤致敏可解分为5 个方面: ①化学物穿透进入皮肤; ②与内源性蛋白反应; ③皮肤代谢, 有的化学物, 称为前半抗原, 需要通过皮肤代谢进行活化成为半抗原之后才具备结合皮肤蛋白的能力。④树突细胞( D C ) 激活: 半抗原化的蛋白被未成熟的D C 细胞识别, 导致D C活化, 然后启动一系列的反应。激活后的D C 具有一些特性, 如上调细胞表面标志物(C D 83 或c D 86) , 分泌多种细胞因子( I L 一1β) , 下调参与抗原摄取的蛋白( 如水通道蛋白)。⑤抗原特异性免疫反应。 传统人体实验 单次斑贴试验: 受试者接受单次斑贴, 分别持续24、72 或96 h , 在诱发期间和去除斑贴后的10一14d, 用激发斑贴作用48 h 后, 对皮肤反应进行评分。通常在激发斑贴后, 需继续试用产品4w , 该试验仅能检测潜在的有效致敏剂,敏感性不足。 人体重复斑贴试验: 重复斑贴基本上与上述方法相同, 不同的是在1 0一 14d 的致敏诱导期间, 每隔2d 在同一部位连续给予受试物数次; 2 周后, 必须 在另一位置的皮肤上再做一次斑贴测试。 人体最大化试验: 包括同一皮肤位置的5 次重复的4 h8 封闭式斑贴, 在去除和再施加斑贴之间有24 h 的休止期。刺激性物质的浓度是引起中等程度红斑的浓度, 对非刺激物质, 试验部位诱发前预先经5% 的S L S 斑贴2 h4 处理。最后一次诱发斑贴后, 休止2 周。在发生轻微刺激反应的皮肤部位经4 h8 封闭斑贴后进行评分,记录致敏指数。人体最大化试验可能对皮肤造成严重的后果, 操作起来有一定的风险。 通常认为, 已通过动物实验或其它有效的方法证实为致敏原的化妆品原料, 不应当再用志愿者进行测试。由于每次测试通常需要15 0一200 名志愿者参与, 不仅耗时,且非常昂贵, 尽管考虑使用人体最大化试验可能会减少志愿者数量, 但 这种测试会增加某一反应的严重程度。而且人体志愿者个体反应差异较大, 为了获得95 % 置信区间, 仍然需要大量志愿者参与才能获得可靠结果。但基于伦理的考虑, 人体试验总是难以实现预期的效果。 体外代替方法动物实验 豚鼠最大值试验( Guinea, G PMT)使用福氏完全佐剂作为免疫增强剂, 试验包括 皮内注射、局部接触诱导和激发封闭斑贴三个过程。试验组至少10 只豚鼠, 对照组5 只, 诱导受试物浓度为能引起皮肤轻度刺激反应的最高浓度, 激发接触 受试物浓度为不能引起皮肤刺激反应的最高浓度。第0 天( 诱导接触) , 将受试物皮内注射人豚鼠颈背部皮下, 第7d( 诱导接触) 将涂有受试物的封闭斑贴贴敷在同一注射部位去毛区固定4 8 h。2 周后第21d ( 激发接触),再将涂有受试物的斑贴贴敷在同一注射部位去毛区固定2h4。激发接触后, 除去受试物斑贴后24h、48h 和72h观察和比较实验组与对照动物的皮肤反应强度。
皮肤致敏的定量风险评估 孔淑仪 道康宁(中国)投资有限公司 皮肤致敏是由T淋巴细胞介导的免疫反应,属于迟发性IV型超敏反应。皮肤致敏包括两个阶段:1)诱导阶段。皮肤首次接触半抗原,半抗原穿过表皮到达真皮层与蛋白质或多肽结合形成完整的抗原,由朗格汉斯细胞递呈给T淋巴细胞。部分T淋巴细胞分化为记忆T淋巴细胞并分布于全身。2)激发阶段。皮肤再次接触同一致敏原,记忆T淋巴细胞大量增殖分泌炎症因子,产生炎症反应。研究发现单位面积皮肤上暴露浓度决定了是否能够引起皮肤致敏反应。也就是说,只有当单位面积皮肤上的暴露浓度超过某一阈值时,才会引起皮肤致敏反应。这为皮肤致敏的定量风险评估提供了理论基础。皮肤致敏的定量风险评估步骤主要包括危害识别,危害表征,暴露评估及风险表征。在危害识别阶段应用最广泛的动物试验方法为豚鼠最大值反应试验(GPMT)和局部涂皮试验(BT)。然而标准的豚鼠试验往往无法获得明确的剂量-反应关系。小鼠局部淋巴结试验(LLNA)作为豚鼠试验的替代方法,通过比较受试物与溶剂对照引起T淋巴细胞增殖的剂量-反应关系(即刺激指数,SI)来评估淋巴细胞增殖状况,定量检测受试物的致敏性。SI ≥ 3表示受试物具有致敏性。当SI = 3时,对应的受试物浓度称为EC3,通常以受试物的浓度百分比进行表示。EC3经过适当换算可作为皮肤致敏定量风险评估的关键作用起始点(POD)或称为预测无皮肤致敏诱导水平 (No-expected-skin-sensitization-induction-level,NESIL)。人体试验(HRIPT,HMT)可对受试物的皮肤致敏进行验证。若人体试验的未观察到作用水平(NOEL)和EC3同时存在,推荐采用证据权重法(WoE)决定NESIL。皮肤致敏定量风险评估中引入了可接受暴露水平(Acceptable exposure level,AEL)的概念。这一概念类似于非致癌性风险评估中的参考剂量(RfD),人群暴露于该水平预期发生皮肤致敏的风险可低至忽略不计。由NESIL推导AEL时需要考虑到的不确定系数/致敏评估因子(SAF)包括个体差异、溶剂/基质效应及物质使用条件。其中个体差异SAF一般为10,根据不同的试验条件和实际使用情况,溶剂/基质效应及物质使用条件SAF推荐取值为1、3或10。此外,荷兰国家公共卫生及环境研究院(RIVM)提出,利用动物试验结果推导AEL时还应考虑种间差异。风险表征时,通过预测人群暴露水平(CEL)与AEL比较,对物质的潜在皮肤致敏风险进行定量评估。当AEL/CEL ≥ 1时,一般认为风险可控。目前皮肤致敏的定量风险评估主要用于香精和化妆品中安全性风险物质的评价,随着该方法的推广,相信不久的将来会在工业化学品等更广泛的领域有进一步的应用。
0引言 太极贴以当归、干姜、冰片、生草乌、生川乌、麻黄、三七、红花、樟脑为原料,经加工而成,具有使用简便、有效、价廉特点,把药物贴敷于机体的相应穴位,使药物刺激穴位、疏通经络而调节机体的功能状态[1]。在临床上用于治疗骨质增生,颈椎病,关节炎,肌肉疼痛,急、慢性扭、挫伤。本文主要对太极贴的家兔多次皮肤刺激试验进行观察[2],为临床用药安全及相关刺激性研究提供依据。 1材料 1.1受试样品 由某公司提供的太极贴(一种膏贴)。 1.2受试物处理 把原样品剪成2.5cm×2.5cm大小用于试验。 1.3实验动物和饲养环境 普通级日本大耳兔3只,体重2300—2500g,皮肤完好健康,由南昌龙平兔业有限公司提供,实验动物生产许可证号:SCXK(赣)2009-0001。实验兔饲养在本疾控中心动物实验室,实验动物使用许可证号:SYXK(赣)2007-0001。室温21.6—24.5℃,湿度40.0%~70.0%RH,单笼饲养。 2方法 2.1实验方法 实验前24h把动物背部脊柱两侧被毛剪去,每块面积约3cm×3cm,实验时将受试物2.5cm×2.5cm样品贴在一侧去毛区,另一侧为空白对照,在斑贴后4h,用水清洗,去除残留物。每天斑贴一次,连续斑贴14天,每次斑贴后24h观察结果。 2.2评分与计算 按《消毒技术规范》(2002年版)中皮肤刺激反 太极贴对家兔多次皮肤刺激试验的结果和分析 ResultsandAnalysisofDermalIrritationTestofTaiChiStickersonRabbit'skin 肖岗夏芝璐曾立爱谌乐礼蔡宏丁晟 Xiao Gang Xia Zhilu Zeng Liai Shen Yueli Cai Hong Ding Sheng (江西省疾病预防控制中心,江西南昌330029) (Jiangxi Province Center for Disease Control and Prevertion,Jiangxi Nanchang330029) 摘要:目的:对太极贴进行动物多次皮肤刺激试验,为其提供使用前安全性评价。方法:用太极贴斑贴家兔完整皮肤,每天一次,连续斑贴14天,并逐日观察症状表现。结果:太极贴对家兔的刺激评分为2.2分。结论:太极贴对家兔刺激反应强度为中度,有可能对使用者敷用部位产生刺激作用,长期使用可能对使用者身体造成不良影响。 关键词:多次皮肤刺激;家兔 中图分类号:R-332文献标识码:A文章编号:1671-4792(2012)12-0209-02 Abstract:Objective:To evaluate the dermal irritation test of Tai Chi stickers to animals'skin,and to provide safety evaluation of pre-application.Methods:The rabbits healthy skin were locally treated with Tai Chi stickers for14days continuously,and their symptoms were observed day by day.Results:The stimulation scores of type3of Tai Chi stickers were2.2.Conclusion:Tai Chi stickers has moderate irritation on rabbits'skin,and long-term use may adversely affect the health of user's body. Keywords:Dermal Irritation Test;Rabbits 太极贴对家兔多次皮肤刺激试验的结果和分析 209