
浅谈β-内酰胺酶及其抑制剂
摘要:随着抗生素药物使用的大量普及,抗生素耐药形势也日趋严峻。抗生素耐
药的主要机制为产生β-内酰胺酶。β-内酰胺酶依据分子结构中氨基酸序列差异
可主要分为两类,分别是以丝氨酸为活性位点的A、C、D类,还有以金属离子
为活性位点的金属酶类。随着β-内酰胺酶的泛滥,一些β-内酰胺酶抑制剂应运
而生。在治疗微生物感染时,常将抗生素与β-内酰胺酶抑制剂联用,治疗效果
显著。本文将对β-内酰胺酶及其抑制剂进行简要的介绍。
关键词:β-内酰胺酶β-内酰胺酶抑制剂细菌耐药
On the β-lactamase and its inhibitors
Abstract :With the increasing popularity of the use of antibiotic, the situation of antibiotic resistance becomes worsening. The main mechanism of antibiotic resistance
is due to the producing of β-lactamase.β-lactamase can be divided into two categories based on its amino acid sequence in molecular structure. The class of A, C, and D is of Ser active site while the class of B has metal ions in its active site. Some
β-lactamase inhibitor come into being because of the spreading of β-lactamase. In
the treatment of microbial infection, a number of commonly used antibiotics and β
-lactamase inhibitor were combined with favored results. In this article, I will have a briefintroduction ofβ-lactamase and its inhibitor.
Keywords :β-lactamase β-lactamase inhibitor antibiotic resistance
1 抗生素耐药性及其耐药机制
抗生素(antibiotic)是生物在其生命活动过程中产生的(以及用化学、生物、
生物化学方法衍生的),能在低微浓度下有选择性抑制或影响它种生物功能的有
机化合物。细菌耐药性(antibiotic resistance)是指细菌对抗生素不敏感的现象,
又可分为固有耐药(intrinsic resistance)和获得性耐药(acquired resistance)。固有
耐药是由细菌染色体基因决定、代代相传,不会改变的。如链球菌对氨基糖苷类
抗生素天然耐药。获得性耐药是由于细菌与抗生素接触后,通过改变自身的代谢
途径,使其不被抗生素杀灭。如本文将重点讨论的细菌对β-内酰胺酶的耐药性。
抗生素的作用机制如下表所示:
表一抗生素的作用机制
作用机制代表抗生素
干扰细菌细胞壁的合成,使其不能生长繁殖β-内酰胺类、万古霉素、环丝霉素
损伤细菌细胞膜,破坏其屏障作用多粘菌素B、两性霉素B、制霉菌素等影响细菌蛋白质合成,四环素、氯霉素、大环内酯类等
抑制核酸合成或作用,影响核酸代谢,利福霉素类、喹诺酮类、甲硝唑等
抑制细菌代谢磺胺药、甲氧苄氨嘧啶
抑制结核环脂酸的合成异烟肼
图1 抗生素的作用机制
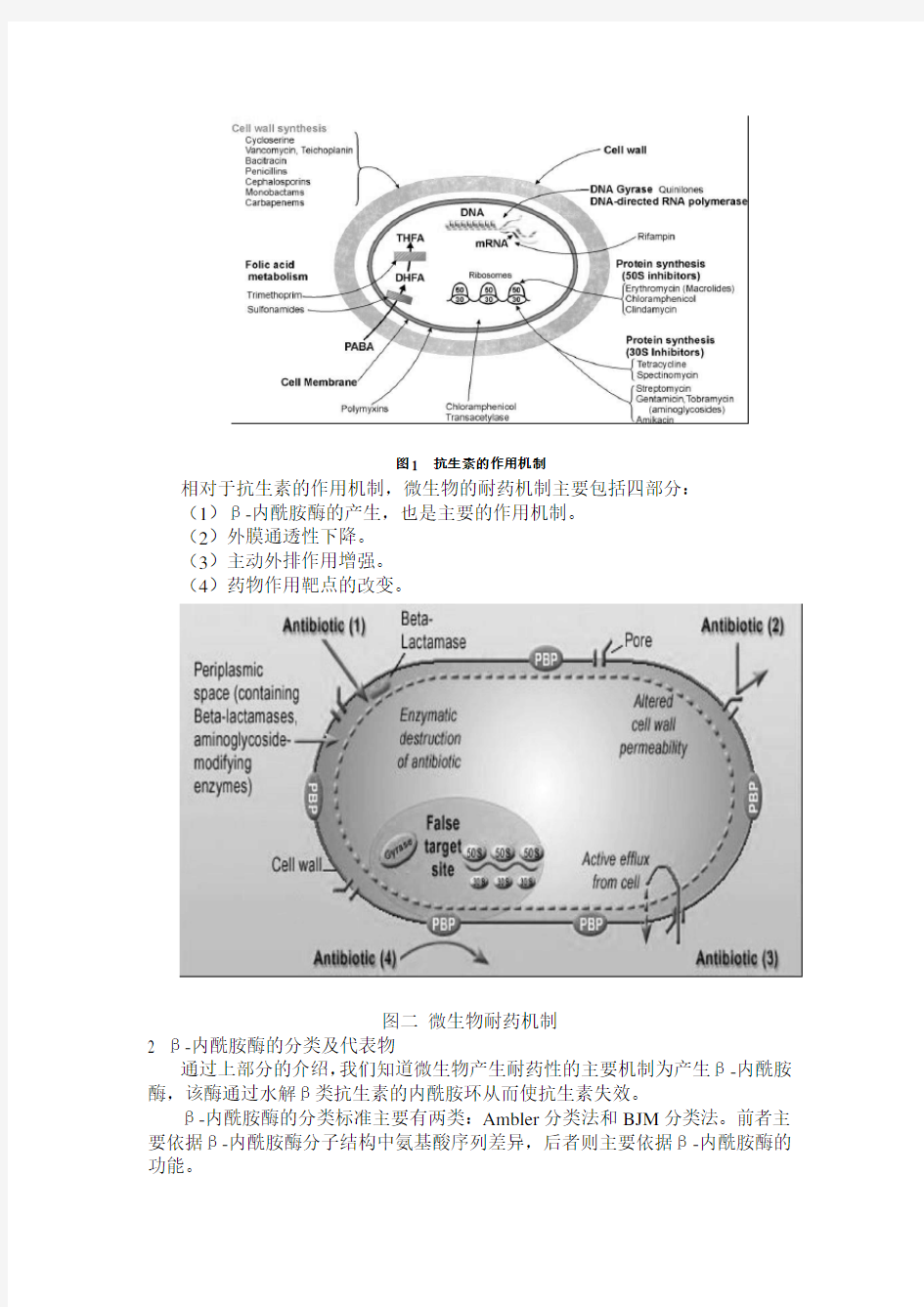
相对于抗生素的作用机制,微生物的耐药机制主要包括四部分:
(1)β-内酰胺酶的产生,也是主要的作用机制。
(2)外膜通透性下降。
(3)主动外排作用增强。
(4)药物作用靶点的改变。
图二微生物耐药机制
2 β-内酰胺酶的分类及代表物
通过上部分的介绍,我们知道微生物产生耐药性的主要机制为产生β-内酰胺酶,该酶通过水解β类抗生素的内酰胺环从而使抗生素失效。
β-内酰胺酶的分类标准主要有两类:Ambler分类法和BJM分类法。前者主要依据β-内酰胺酶分子结构中氨基酸序列差异,后者则主要依据β-内酰胺酶的功能。
2.1 Ambler分类法
图三Ambler分类法2.2 BJM分类法(Bush-Jacoby-Medeiros)
表二BJM分类法
类别分子
类型
被抑制
水解底物代表酶CA EDTA
1 C类- - 头孢菌素G-菌的AmpC
2a A + - 青霉素G+菌的青霉素酶
2b A + - 青霉素、头孢菌素TEM-1、TEM-2、SHV-1
2be A + - 青霉素、窄谱与超广谱
头孢菌素类、单环类
TEM-3至TEM-26,SHV-2
至SHV-6
2br A ±- 青霉素TEM-30至TEM-36
2c A + - 青霉素、羧苄西林PSE-1 、PSE-3、PSE-4 2d D ±- 青霉素、氯唑西林OXA-1
2e A + - 头孢菌素普通变形杆菌的头孢菌素酶
2f A + - 青霉素、头孢菌素、碳
青霉烯
阴沟肠杆菌的NMC-A
3a
B - + 青霉素、头孢菌素类嗜麦芽黄单胞菌的L1
3b - + 碳青霉烯类产气单胞菌
3c - + 氨苄西林、头孢立啶戈氏荧光杆菌
4 未知- 未知青霉素洋葱假单胞菌的青霉素酶3 β-内酰胺酶与β-内酰胺类抗生素的作用机制
β-内酰胺酶的作用机制由于其活性中心的不同主要分为两类,一类是以丝氨酸为活性中心的酶,涉及Ambler分类法中的A、C、D类。另一类则是以金属为活性中心的酶,主要是B类。下面将分别加以介绍。
3.1 丝氨酸活性酶
β-内酰胺酶与青霉素结合蛋白(PBPs)之间具有高度保守的氨基酸序列,它们与D-丙酰氨-D-丙氨酸转肽酶一起属于“青霉素识别酶”家族。A、C、D类β-内酰胺酶在活性位点上都有丝氨酸,故又称活性位点丝氨酸酶。它们的氨基
酸序列同源性不强,但酶分子的三级结构非常相似。下图就是A类β-内酰胺酶的三级结构图以及头孢菌素分子与它的作用机制图。
A B
图4 (A)图为A类β-内酰胺酶活性部位结构图。其中,W1为水分子。
(B)图为头孢菌素分子与β-内酰胺酶作用机制。
如图4所示,由4个氨基酸残基组成的四联体SXXK位于70-73位点,其中X代表任意一种氨基酸,活性位点丝氨酸(Class A为Ser-70,Class C为Ser-64)位于A-螺旋的N-端。由三个氨基酸残基组成的三联体KTG位于β-折叠上(Class A为Lys-234,Class C为Lys-315),另一个三联体SDN定位于130-132;KTG 和SDN之间通过氢键连接起稳定的作用。166-170位点上数个氨基酸残基组成Ω环,环上氨基酸序列在Class A中高度保守,Ω环可将亲核水解反应所需的水分子准确定位。SXXK、KTG、SDN和Ω环这几个结构域单元(motifs)之间的空间相对位置所形成的腔即为β-内酰胺底物与酶作用的“键合腔”(binding cavity),A-螺旋结构正好使丝氨酸活性位点Ser-70定位于键合腔的中央。Ser-70的OH、-NH和Ala-237的-NH共同形成Oxyanion盒(酰化反应点),β-内酰胺环上的羰基在此与-OH、-NH形成酰化酶复合物。
Class A β-内酰胺酶在244位上有一个Arg,具有定位另一个水分子的作用,此结构可水解含非典型B-内酰胺环的底物如克拉维酸、舒巴坦;由于Class C β-内酰胺酶缺乏此结构,对克拉维酸无效。
整体上,Class Aβ-内酰胺酶严整的“键合腔”结构和对水分子的精确定位能力使它能高效地水解底物.而Class C β-内酰胺酶的活性位点为Ser 64 ,并且“键合腔”结构较为松散,更适于具有较大空间位阻的底物进入。Class Dβ-内酰胺酶的一级结构与Class A相似,其三级结构也具有类似于Class A的结构域单元(如KTG三联体等),虽然这些单元在其氨基酸组成和空间的相对位置上与Class A有一定差别,但一般认为其执行的功能是相同的。
3.2 金属活性酶
Class Bβ-内酰胺酶的结构与其它类型相比最大的不同在于金属离子可与氨基酸残基之间形成配位化合物而干预活性位点上的反应,更为特殊的是不同的金属酶其所含的金属离子数目并不固定,从而造成本类酶与底物结合方式上的多样性。
4 β-内酰胺酶抑制剂的作用机制
目前关于β-内酰胺酶抑制剂的作用机理尚不完全清晰。证明了A类、C类β-内酰胺酶(丝氨酸蛋白酶)都是由羧肽酶经由不同途径反应生成,从而证实了β-内酰胺酶和羧肽酶与β-内酰胺类化合物具有相似的作用机制。大量的实验研究表明,A类β-内酰胺酶中得Ser 70去亲核进攻β-内酰胺环上的羰基。但是
目前对于活性点部位各残基参与酰化及去酰反应的角色尚有分歧。因此,对于β-内酰胺酶抑制剂的作用机制不能进行详细的介绍。
5 β-内酰胺酶抑制剂的发展
目前应用较多的β—内酰胺酶抑制剂主要是针对A类酶的,如克拉维酸(Clavulanic acid),舒巴坦(Sulbactam)和泰唑巴坦(tazobactam),这是三种临床上最常用的抑制剂。它们均为β-内酰胺衍生物,即它们与β-内酰胺抗生素一样,在结构中都存在一个β-内酰胺环。下面将进行详细的介绍。
5.1 克拉维酸(Clavulanic acid)
克拉维酸(结构式见图5)的抗菌谱广,但活性很弱,其特点是能抑制革兰氏阴性菌和葡萄球菌产生的许多β-内酰胺酶,是第一个应用于临床的β-内酰胺酶抑制剂。目前临床上使用的Augmentin和Timentin就是它分别与羟氨苄青霉素和替卡西林的复配制剂。
图5 克拉维酸结构式
5.2舒巴坦(Sulbactam)
舒巴坦(结构式见图6)属于青霉烷砜类的β-内酰胺酶抑制剂,也是第一个人工合成的此类抑制剂。
图6 舒巴坦结构式
5.3泰唑巴坦(tazobactam)
他唑巴坦(结构如图7)是从舒巴坦的衍生物中筛选出来的一种高效β-内酰胺酶抑制剂。它最早由Hall等人从6-APA出发制得,它的结构是在舒巴坦的基础上增加一个三氮唑环,以提高抑酶效果。它是目前临床效果最佳的β-内酰胺酶抑制剂。他唑巴坦与数种β-内酰胺类抗生素产生极其有效的协同作用,增加了β-内酰胺类抗生素的抗菌活性并扩大了其抗菌谱。它与哌拉西林的复方制剂是1990年至今唯一投放市场的青霉素类抗生素品种。
图7泰唑巴坦结构式6 常用的β内酰胺类抗生素酶复合制剂
奥格门丁克维阿莫西林? 或1/4
特美汀克拉替卡西林1/1.5
优立新舒巴氨苄西林?
舒他西林舒氨苄西林1/1
舒普深舒巴头胞哌酮1/1
他唑西林他唑哌拉西林1/8
舒头胞他啶
β-内酰胺酶来源分析 β-内酰胺酶(β-lactamase)的产生是细菌对(β内酰胺类)抗菌药物耐药最常见的机制,在各种耐药机制中占80%。β-内酰胺酶是由多种酶组成的酶家族,能水解β-内酰胺类抗生素,这些酶的基因存在于细菌的染色体或质粒中。至今β-内酰胺酶的数量已超过200种,其中超广谱β-内酰胺酶(extended spectrum β-lactamase,ESBL)已超过50种。 β-内酰胺酶是指能催化水解6-氨基青霉烷酸(6-APA)和7-氨基头孢烷酸(7-ACA)及其 N -酰基衍生物分子中β-内酰胺环酰胺键的灭活酶。细菌产生β-内酰胺酶是细菌对β-内酰胺类抗生素耐药的主要机制。β-内酰胺酶分为染色体介导酶和耐药质粒介导酶二大类,以其水解对象可分为青霉素酶、头孢菌素酶、广谱酶和超广谱酶四种。质粒是一种密闭环状双股螺旋结构的DNA,存在于胞浆内,也是具有遗传功能的基因成分,质粒带有各种基因,包括耐药基因,但不是细菌存活所不可缺少的组成物质。染色体基因决定细菌对抗生素固有耐药性,近代研究证明在院内感染病人中产生质粒介导酶的耐药菌,其产生耐药性大多是在接触抗生素后获得的,并通过耐药基因的转移而播散,也可由基因表达而传至下代。 β-内酰胺酶掺杂于饲料中或直接喂食的可能性:可操作性几乎为零。 1.成品饲料的保存条件下(温度和氧化),β-内酰胺酶会很快失活。 2.β-内酰胺酶直接喂食:β-内酰胺酶在进入动物胃肠道后,会在胃酸,及各种胃肠道内 的蛋白酶(如胃蛋白酶,胰蛋白酶,胆汁,糜蛋白酶等等)作用下水解失活,而不能进入血液循环。即便有微量β-内酰胺酶进入血液循环,其也会在肝脏解毒分解失活或经肾脏排出。 内源性β-内酰胺酶 —— 本身存在于动物体内的β-内酰胺酶:微乎其微 β - 内酰胺酶是由细菌产生的酶类,生成后存在于细菌内,通过水解或非水解方式破坏进入菌体内的β - 内酰胺环,导致β - 内酰胺类抗生素失活,这是大多数致病菌对β - 内酰胺类抗生素耐药性的主要机制。因此,产生β - 内酰胺酶的耐药菌在保持其本身结构完整时,是不会将其自身的β - 内酰胺酶释放至宿主(动物)体内的;而当产生β - 内酰胺酶的耐药菌被宿主细胞(如白细胞或淋巴细胞)吞噬破坏后,细菌内的β - 内酰胺酶会释放至动物体细胞内(如白细胞或淋巴细胞),而动物细胞内部的蛋白酶会自动识别作为异体蛋白的
β-内酰胺类抗生素研究进展 摘要:自从弗莱明在1929年报道了青霉素的抗菌作用,80多年来,各种抗生素广泛应用于临床,为人类健康做出了巨大的贡献。然而,由于抗生素的过度使用,许多抗菌药物灭活酶(如窄谱、广谱、超广谱、金属β 内酰胺酶,头孢菌素酶等)的产生,以及抗菌药物作用靶位的改变、青霉素结合蛋白的改变、药物通透性的下降导致许多细菌对已经成熟的早期抗生素产生了耐药性,因而不能发挥它们应有的作用。因此,药物化学家做了大量的工作对它们进行结构改造,取得了很大进展。 关键词:β-内酰胺类抗生素结构改造进展 1、青霉素类 通过结构改造,青霉素类已由原来的不稳定、窄抗菌谱的天然青霉素发展出了耐酸、耐酶、广谱、强效的新型半合成青霉素。 1、1耐酸青霉素 药物学家们发现天然青霉素V有耐酸性,它的结构与青霉素G的差别是6位酰胺基上是苯氧基,为吸电子基团,可降低羟基上的电子云密度,从而阻止了侧链羰基电子向β-内酰胺环的转移,增加了对酸的稳定性。所以药物学家们根据同系物原理设计合成了在酰胺基α位引入O、N、X等电负性原子的衍生物,如阿度西林、非奈西林和丙匹西林,有很好的抗酸性。 1、2耐酶青霉素
青霉素产生耐药性的原因之一为β-内酰胺酶促使青霉素发生分解而失效。在研究中发现三苯甲基青霉素对β-内酰胺酶非常稳定,设想可能是由于三苯甲基有较大的空间位阻,阻止了化合物与酶活性中心的结合。又由于空间障碍限制酰胺侧链R与羧基间的单链旋转,从而降低了青霉素分子与酶活性中心作用的适应性,加之R基比较靠近β-内酰胺环,也可能有保护作用。但三苯甲基青霉素的抗菌作用极低,无临床使用价值。于是合成了侧链体积较大的半合成青霉素,得到具有耐酶性质的青霉素,如甲氧西林及萘夫西林等。 1、3广谱青霉素 青霉素G对革兰阳性菌有较强的抑制作用,对革兰阴性菌却几乎无抑制作用,所以抗菌谱窄。研究者发现青霉素N对革兰阴性菌有较强的抑制作用。其化学结构与青霉素G的差别仅在侧链含有D-α-氨基己二酰胺,这提示改变侧链扩大抗菌谱,考虑到青霉素N侧链上的取代性质,首先有氨基侧链的一系列半合成青霉素,在苄青霉素的侧链引入α-氨基得到氨苄西林。氨苄西林对革兰阳性、阴性菌都有较强的抑制作用,为临床上使用的第一个广谱青霉素。 随后发现用羧基和磺酸基等代替氨基时得到衍生物羧苄西林和磺苄西林,它们对革兰阳性、阴性菌均有抑制作用,并且对铜绿假单胞细菌和流感杆菌也有较强的抑制作用,其抗菌谱进一步扩大。 进一步研究发现在氨苄西林的氨基上引入杂环取代的酰胺基时,由于能迅速穿透革兰阳性菌的细胞膜,作用强而迅速,为抗菌谱更广的青霉素衍生物,如:哌拉西林、阿帕西林和美洛西林等。
β-内酰胺类抗生素:联合酶抑制剂,提升抗菌能力 文张永信(复旦大学附属华山医院传染科教授) 基层医院2013年5月20日D11版 【问】氨曲南属于窄谱抗生素,有哪些药理特点?其临床适应证是什么? 【答】氨曲南是单环类β-内酰胺抗生素,主要针对革兰阴性(G-)菌。对肠杆菌和铜绿假单胞菌有效,但对不动杆菌、产碱杆菌以及革兰阳性(G+)菌和厌氧菌无效。该药化学结构特殊,对β-内酰胺酶稳定,毒性低;对青霉素和头孢菌素过敏的患者仍可选用该药。临床适用于敏感菌引起的脑膜炎、严重感染、院内感染、免疫缺陷者感染,以及不能使用青霉素和头孢菌素的患者。如合并有G+菌感染,应加用林可霉素或克林霉素。 【问】头霉素与二代头孢菌素,氧头孢烯类与三代头孢菌素的抗菌谱有什么不同?对临床适应证有何影响? 【答】头霉素与二代头孢菌素、氧头孢烯类与三代头孢菌素抗菌谱上的不同在于:头霉素、氧头孢烯类对各种厌氧菌(包括脆弱类杆菌)有良好的抗菌活性。由于头霉素和氧头孢烯类对需氧菌和厌氧菌均有良好的抗菌作用,常适用于需氧菌和厌氧菌的混合感染。 【问】β-内酰胺酶抑制剂与β-内酰胺类抗生素联用,有什么作用?舒巴坦、克拉维酸和三唑巴坦(他唑巴坦)在透过血脑屏障方面有何差异? 【答】β-内酰胺酶抑制剂可以保护β-内酰胺类抗生素免受细菌产生的β-内酰胺酶破坏,两者联合应用具有协同作用,能增强β-内酰胺类抗生素的抗菌效果。而且扩大了β-内酰胺类抗生素的抗菌谱。如原来对产酶葡萄球菌无效的药物,在联用后对产酶葡萄球菌有效。β-内酰胺类抗生素对脆弱类杆菌等厌氧菌的抗菌活性较弱,但联用后的复合制剂对厌氧菌具有良好的抗菌活性。 舒巴坦、克拉维酸和三唑巴坦对β-内酰胺酶都有抑制作用,但以三唑巴坦最强,其次为克拉维酸,舒巴坦最弱。在血脑屏障穿透力方面,舒巴坦比三唑巴坦更易透过,而克拉维酸基本不能透过。所以克拉维酸的复合制剂不宜用于中枢神经系统感染。 【问】氨苄西林/舒巴坦、阿莫西林/克拉维酸、替卡西林/克拉维酸、头孢哌酮/舒巴坦、哌拉西林/三唑巴坦这5种复合制剂在抗菌谱、临床适应证及不良反应方面有何异同? 【答】在抗菌谱方面,对厌氧菌的差别不大,对需氧菌有所不同。氨苄西林/舒巴坦、阿莫西林/克拉维酸对肠杆菌科细菌有良好的抗菌作用,但对铜绿假单胞菌和沙雷菌等没有抗菌作用;其他3种药物不仅对肠杆菌科细菌有良好抗菌作用,且优于前两者,对铜绿假单胞菌和沙雷菌、不动杆菌等葡萄糖不发酵菌也有良好的抗菌活性。 由于抗菌谱不同,临床适应证也就不同。氨苄西林/舒巴坦、阿莫西林/克拉维酸主要应用于肠杆菌科或肠杆菌科与厌氧菌的混合感染;由于克拉维酸的抑酶作用优于舒巴坦,阿莫
β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂临床应用专家共识 一、概述 革兰阴性菌是我国细菌感染性疾病最常见的病原体。近年来,革兰阴性菌对β-内酰胺类抗生素的耐药性不断增加,最重要的耐药机制是细菌产生各种β-内酰胺酶。β-内酰胺酶抑制剂能够抑制大部分β-内酰胺酶,恢复β-内酰胺类抗生素的抗菌活性。因此,β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂在临床抗感染中的地位不断提升,已成为临床治疗多种耐药细菌感染的重要选择。目前我国临床使用的β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂的种类和规格繁多,临床医师对该类合剂的特点了解不够,临床不合理使用问题较突出。为规范β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂的临床应用,延缓其耐药性的发生和发展,特制定本共识。 二、主要β-内酰胺酶及β-内酰胺酶抑制剂 β-内酰胺酶是由细菌产生的能水解β-内酰胺类抗生素的一大类酶。β-内酰胺酶种类繁多,有多种分类方法,最主要的分类方法有根据β-内酰胺酶的底物、生化特性及是否被酶抑制剂所抑制的功能分类法(Bush分类法),将β-内酰胺酶分为青霉素酶、广谱酶、超广谱β-内酰胺酶、头孢菌素酶和碳青霉烯酶等;根据β-内酰胺酶末端的氨基酸序列特征的分子生物学分类法(Ambler分类法),将β-内酰胺酶分为丝氨酸酶和金属酶。目前引用较多的是基于上述2种方法建立的分类方法。见表1。 表1:β-内酰胺酶的分类和3种主要酶抑制剂的作用 功能分类分 子 分 型 主要底物 可被抑制 代表性酶 克 拉 维 酸 舒 巴 坦 他 唑 巴 坦 1 C 头孢菌素类- - - AmpC,ACT-1,CMY-2,FOX-1,MIR-1 2a A 青霉素类+ + + 青霉素酶 2b A 青霉素类,窄谱头孢菌素类+ + + TEM-1,TEM-2,SHV-1 2be A 青霉素类,超广谱头孢菌素类,单环酰胺类+ + + TEM-3,SHV-2,CTX-M-15,PER-1,VER-1 2br A 青霉素类- - - TEM-30,SHV-10,TRC-1
β-内酰胺类抗生素β内酰胺酶抑制剂复方制剂临床应用 专家共识(2020年版) 一、概述 革兰阴性菌及少数革兰阳性菌对β-内酰胺类抗生素耐药的最重要机制是产生各种β-内酰胺酶。β-内酰胺酶抑制剂能够抑制部分β-内酰胺酶,避免β-内酰胺类抗生素被水解而失活。因此,β-内酰胺类抗生素/β-内酰胺酶抑制剂复方制剂(简称β-内酰胺酶抑制剂复方制剂)是临床治疗产β-内酰胺酶细菌感染的重要选择。我国临床使用的β-内酰胺酶抑制剂复方制剂的种类和规格繁多,临床工作者对该类制剂的特点了解参差不齐,临床不合理使用问题比较突出。 二、主要β-内酰胺酶及产酶菌流行情况 β-内酰胺酶是由细菌产生的,能水解β-内酰胺类抗生素的一大类酶。β-内酰胺酶种类繁多,有多种分类方法,最主要的分类方法有两种: 一、是根据β-内酰胺酶的底物、生化特性及是否被酶抑制剂所抑制的功能分类法(Bush分类法),其将β-内酰胺酶分为青霉素酶、广谱酶、超广谱β-内酰胺酶(ESBLs)、头孢菌素酶(AmpC酶)和碳青霉烯酶等; 二、是根据β-内酰胺酶末端的氨基酸序列特征的分子生物学分类法(Ambler分类法),将β-内酰胺酶分为丝氨酸酶(包括A类、C类酶和D 类酶)及金属酶(B类酶)。目前引用较多的是1995年Bush等基于上述二种方法建立的分类方法,2019年Bush等又将该分类表进一步完善和细化(表1)。其中临床意义最大的是下列三类β-内酰胺酶: 表1 常见β-内酰胺酶分类及特点,常见酶抑制剂抑酶活性
1、ESBLs主要属2be\2br\2ber类酶,是由质粒介导的能水解青霉素类、头孢菌素及单环酰胺类等β-内酰胺类抗生素的β-内酰胺酶,其对碳青霉烯类和头霉素类水解能力弱。ESBLs主要由肠杆菌科细菌产生,以肺炎克雷伯菌、大肠埃希菌、变形杆菌最为常见。根据编码基因的同源性,ESBLs可分为TEM型、SHV型、CTX-M 型、OXA型和其他型共5大类型。 2、AmpC酶属C类酶,通常由染色体介导,可以被β-内酰胺类抗生素诱导。部分由质粒介导,常呈持续高水平表达。其对第一、二、三代头孢菌素水解能力强,但对碳青霉烯类抗生素和第四代头孢菌素的水解能力弱。该酶主要存在于肠杆菌属、柠檬酸杆菌属、普鲁菲登菌属、黏质沙雷菌属和摩根菌属等细菌,非发酵菌中主要见于铜绿假单胞菌。质粒介导的β-内酰胺酶可分为CMY-2组、CMY-1组、MIR-1/ACT-1组、DHA-1组和ACC-1组等。 3、碳青霉烯酶是指能水解碳青霉烯类抗生素的一大类β-内酰胺酶,分别属于Ambler分子分类中的A类、B类和D类酶。A类、D类为丝氨酸酶,B类为金属酶,以锌离子为活性中心。A类碳青霉烯酶可由染色体介导,也可由质粒介导。前者包括SME、NMC和IMI酶等,后者包括KPC和GES酶等。KPC酶是近年来肠杆菌科细菌尤其是肺炎克雷伯菌对包括碳青霉烯类抗生素在内的几乎所有β-内酰胺类抗生素耐药的最主要机制,我国最常见的是KPC-2,其对头孢吡肟和头孢他啶的水解能力相对较弱。
2010年第30卷 有 机 化 学 V ol. 30, 2010 * E-mail: hliu@https://www.doczj.com/doc/d415010906.html, Received April 16, 2009; revised August 6, 2009; accepted September 7, 2009. 国家高技术研究发展计划(“863”计划)(No. Grant 2006AA020602)资助项目. ·综述与进展· HIV 整合酶抑制剂的研究进展 郭涤亮a ,b 刘冠男a 周 宇a 李 建a 徐进宜b 蒋华良a 陈凯先a 柳 红*,a ,b (a 中国科学院上海药物研究所 新药研究国家重点实验室药物设计和发现中心 上海 201203) (b 中国药科大学药学院 南京210009) 摘要 HIV 整合酶是病毒DNA 复制所必需的3个基本酶之一, 是新批准上市的抗艾滋病药物Raltegravir (MK-0518, Isentress)的分子靶标. HIV 整合酶抑制剂已经成为新一类治疗获得性免疫缺陷综合症的药物. 对HIV 整合酶抑制剂的研究进展进行了综述, 为研究新型人类免疫缺陷病毒整合酶抑制剂提供参考. 关键词 人类免疫缺陷病毒; 整合酶抑制剂; 二酮酸类; Raltegravir Research Progress in HIV Integrase Inhibitors Guo, Diliang a ,b Liu, Guannan a Zhou, Yu a Li, Jian a Xu, Jinyi b Jiang, Hualiang a Chen, Kaixian a Liu, Hong *,a ,b (a Drug Discovery and Design Centre , State Key Laboratory of Drug Research , Shanghai Institute of Materia Medica , Chinese Academy of Sciences , Shanghai 201203) (b School of Pharmacy , China Pharmaceutical University , Nanjing 210009) Abstract HIV integrase is one of the three essential enzymes for viral DNA replication and the molecular target of the newly approved anti-AIDS drug raltegravir (MK-0518, Isentress). HIV integrase inhibitors have emerged as a new class of drugs for the treatment of AIDS. In this article, the recent progress of HIV inte-grase inhibitors is reviewed to provide some useful information for the further research and development of HIV integrase inhibitors. Keywords HIV; integrase inhibitor; diketoacid; Raltegravir 人类免疫缺陷病毒(HIV)感染引起的艾滋病(AIDS)是目前人类所经历的最严重的疾病之一, 截止2004年底, 全球已有4000万艾滋病毒携带者和艾滋病患者, 已有310万人死于艾滋病, 新感染艾滋病病毒的人数约为490万, 艾滋病在全球范围内的传播速度惊人. 鉴于此, 研究和开发抗艾滋病的新药显得日益紧迫和重要. 随着人类对HIV 病毒及其感染过程的研究不断深入, 以及各国药物研发人员的不断努力, 抗HIV 药物有了突飞猛进的发展, 尤其是全新作用机制的HIV 进入抑制剂和HIV 整合酶抑制剂的出现, 为抗HIV 药物的研制带来了新的 发展方向, 也为艾滋病治疗带来了新的希望. 1 抗艾滋病药物的作用机制和分类 抗艾滋病药物的作用机制是通过影响HIV 复制周期的某个环节, 从而抑制病毒的复制和感染. 根据HIV-1的生命周期, 目前抗艾滋病药物主要针对病毒复制过程的8个重要环节, 即HIV 对宿主细胞的依附(viral attachment)-进入抑制剂(entry inhibitor); 辅受体相互作用(coreceptor interaction)-进入抑制剂; HIV 与
垦匾唑堕苤查!!!!堡箜!!鲞筮!塑!坐』垦望£i!!垒21:!!!!!∑!!:!!:塑!:!金属13一内酰胺酶的研究进展 曹孟淑张德平 【摘要】近年来随着碳青霉烯类药物在I临床的广泛使用,其耐药率逐年上升,在越来越多的耐药细 菌中发现了金属酶,而金属酶对几乎所有的B一内酰胺类抗生素耐药。本文就金属酶的流行病学、种类、检测 及意义等方面研究作一综述。 【关键词】金属酶;流行病学;分类;检测 ’金属J3一内酰胺酶(metallo—beta—lactamases,MBL)又称金属酶,是~类活性位点含有金属离子的G一内酰胺酶。这些酶能够有效水解除单环类抗菌药物以外的几乎所有B一内酰胺类抗生素,使得致病菌对青霉素、头孢菌素和碳青霉烯类耐药,耐药基因由染色体或质粒介导,并在革兰阴性菌尤其是临床铜绿假单胞和其它非发酵菌中广泛传播。因此产金属酶细菌引起的感染已经成为一个非常严重的问题,在临床上变得越来越重要。 1金属酶产生的流行病学特征 自从1988年Bush将含金属离子的G一内酰胺酶定为金属酶以后,日本首先发现了铜绿假单胞菌所产生的金属酶(imipenem,IMP)L1J,1991年出现IMP—l在革兰阴性菌中播散,随后新加坡、韩国和欧洲也出现了产金属酶的菌株,而欧洲则最早报道VIM酶心],2000年以后中国台湾和香港、加拿大、美国陆续报道了不同类型的金属酶,2001年中国广州首次报道了产IMP一4的柠檬酸杆菌[3]。所以从目前看来产金属酶的细菌已在全球范围内广泛存在。产金属酶的细菌不仅波及范围广泛,在某些国家和地区有爆发流行的趋势,在不同的国家和地区流行菌株可能不同。如1997~1998年间意大利发生产VIM一1型的金属酶铜绿假单胞菌的爆发流行[43;2001~2002年日本研究耐药革兰阴性菌发现l类整合子携带的IMP一1是日本的主要流行菌株[53;韩国2000~2001年从全国28家医院收集了对亚胺培南(IMP)不敏感的细菌,其中60.7%的医院中可检测到产MBL的细菌,其中假单胞菌MBL检出率11.4%,不动杆菌检出率14.2%[6]。国内对金属酶研究的文献不多,已有的文献中研究例数也不多,尚不能说明其发生情况和流行规律。 早期的研究发现蜡样芽胞杆菌、亲水性气单胞菌属、气味黄杆菌、戈氏军团菌、脆弱拟杆菌、黄单胞 作者单位:210008南京大学医学院附属鼓楼医院呼吸科菌可产生金属酶,最近发现铜绿假单胞菌、恶臭假单胞菌、黏质沙雷菌和其它肠杆菌属细菌如大肠埃希菌、肺炎克雷伯菌、阴沟肠杆菌、鲍曼不动杆菌、弗氏枸橼酸菌等均可产生金属酶。由于质粒介导的金属酶可在不同的菌株间传播,造成耐药菌种也逐渐增多,到2004年底已发现了近30种不同亚型的金属酶,它们之间有着相似又不完全相同的特征。 Hirakata等[71通过病例对照研究报道了产IMP型金属酶的铜绿假单胞菌的临床和细菌学特征。产IMP型金属酶的致病菌有四个高危因素:①延长住院时间,②抗肿瘤化疗,③皮质类固醇激素的应用,④留置导尿管,主要的来源是尿路;抗生素治疗时间和剂量病例组明显高于对照组;产酶细菌对多种抗生素耐药;感染相关的死亡明显高于对照组。结果表明采取预防措施对控制产酶细菌的传播是必要的,而使用单一抗生素治疗这类致病菌引起的感染还不够。2003年美国进行了环境因素的研究发现产VIM的细菌来自受感染部门的洗涤槽、听诊器,不是来自工作人员的手。所以一旦消毒储存器和加强卫生预防措施,耐药问题可以大大减轻∽]。 2金属酶的种类和特征 金属酶是一个异基因家族,不同的酶相互之间的一级结构表现出低水平的序列相似性,但三维结构呈现高水平的相似性,综合起来有以下四个主要特征:①能水解碳青霉烯类抗生素;②对单环类药物敏感;③对螯合剂敏感;④对锌离子有依赖性。到目前为止共发现了4个不同家族的金属酶,其中IMP和VIM酶是两类最主要的获得性金属酶,近来随着研究的深入又发现了新的金属酶。 2.1IMP家族到2004年底IMP家族共发现了10余种不同亚型的金属酶,包括IMP一1到IMP一16。IMP一1是最早发现的铜绿假单胞菌所产的金属酶,水解底物较广泛,包括青霉素类、头孢菌素类、头霉素类、碳青霉烯类抗生素,但不能水解单环类药物。blaIMP一1是由易变的基因盒携带,插入到质粒或染色体来源的整合子上。目前在大肠埃希菌中也发现 万方数据
蛋白酶抑制剂的研究进展 郭川 微生物专业,200326031 摘要:自然界共发现四大类蛋白酶抑制剂:丝氨酸蛋白酶抑制剂、巯基蛋白酶抑制剂、金属蛋白酶抑制剂和酸性蛋白酶抑制剂,本文就各大类蛋白酶抑制剂的结构特点,活性部位的研究概况及其在各领域应用的原理及进展。 关键词:蛋白酶抑制剂;结构;应用 天然的蛋白酶抑制剂(PI)是对蛋白水解酶有抑制活性的一种小分子蛋白质,由于其分子量较小,所以在生物中普遍存在。它能与蛋白酶的活性部位和变构部位结合,抑制酶的催化活性或阻止酶原转化有活性的酶。在一系列重要的生理、病理过程中:如凝血、纤溶、补体活化、感染、细胞迁移等,PI发挥着关键性的调控作用,是生物体内免疫系统的重要组成部分。从Kunitz等最早分离纯化出一种PI至今,已有多种PI被发现,根据其作用的蛋白酶主要分以下几类:抑制胰蛋白酶、胰凝乳蛋白酶等的丝氨酸蛋白酶抑制剂,抑制木瓜蛋白酶、菠萝蛋白酶等的巯基蛋白酶抑制剂,抑制胃蛋白酶、组织蛋白酶D等的羧基蛋白酶抑制剂、抑制胶原酶、氨肽酶等的金属蛋白酶抑制剂等。而根据作用于酶的活性基团不同及其氨基酸序列的同源性,可将自然界发现的PI分为四大类:丝氨酸蛋白酶抑制剂、巯基蛋白酶抑制剂(半胱氨酸蛋白酶抑制剂)、金属蛋白酶抑制剂和酸性蛋白酶抑制剂[1]。 1 结构与功能 1.1丝氨酸蛋白酶抑制剂(Serine Protease Inhibitor,Serpin) 丝氨酸蛋白酶抑制剂是一族由古代抑制剂趋异进化5亿年演变而来的结构序列同源的蛋白酶抑制剂。Sepin为单一肽链蛋白质。各种serpin大约有30%的同源序列,疏水区同源性高达70%。血浆中的serpin多被糖基化,糖链经天东酰胺的酰胺基与主链相连。位于抑制性serpin表面、距C端30~40个氨基酸处的环状结构区RSL(reactive site loop)中,存在能被靶酶的底物识别位点识别的氨基酸P1[2];近C端与P1相邻的氨基酸为P1’,依此类推,即肽链结构表示为N端-P15~P9~P1-P1’~P9’~P15’-C端。在对靶酶的抑制中。Serpin 以RSL中的类底物反应活性位点与靶酶形成紧密的不易解离的酶-抑制剂复合物,同时P1-P1’间的反应活性位点断裂。几种perpin氨基酸序列比较发现,serpins各成员的抑制专一性是由P1决定的,且被抑制的酶特异性切点一致。如抗凝血酶,抑制以Arg羧基端为敏感部位的丝氨酸蛋白酶,其中P1为Arg[2]。 1.2巯基蛋白酶抑制剂(Cytsteine Proteinase Inhiitor,CPI) 对于丝氨酸蛋白酶抑制剂(SPI)已有大量研究,巯基蛋白酶抑制剂(CPI)的研究则相对要晚一些。而动物和微生物来源的CPI已有一些研究,发现它们在结构上具有同源性,Barrett等将CPI统称为胱蛋白超家族,并按分子内二硫键的有无与数量,分子量大小等将此家族分为3个成员(F1、F2、F3)。在3个家族中,大多数F1和F3的CPI中都有Glu53-Val54-Val55-Ala56-Gly57保守序列,其同源序列在其它CPI中也被发现,如F2中的Gln-X-Val-Y-Gly和CHα-ras基因产物中的Gln-Val-Val肽段。人工合成的Glu-Val-Val-Ala-Gly 短肽也显示对木瓜蛋白酶有抑制活性,因此可以认为这一保守区段在抑制活性中起着全部或部分的关键作用[3]。对植物来源的CPI研究的不多,已有报道的有水稻、鳄梨和大豆。水稻巯基蛋白酶抑制剂(Oryzacystatin,OC) 具有102个氨基酸残基,有典型的Glu-Val-Val-Ala-Gly保守序列,应与动物CPI同源进化而来。从OCI没有二硫键来看,它应归为F1成员,但从序列比较看,则更接近F3。对OCIGlu---Gly保守序列进行点突变试验表明,突变使其抑制活性大幅度下降,其中当Glu被Pro替代时则活性全无,由此说明,这一段保守序列在OCI的抑制活性中,同动物CPI一样必不可少。除Glu---Gly保守区域外,OCI序列中其
金属类β-内酰胺酶 β-内酰胺酶是革兰阴性杆菌对内酰胺类抗生素耐药的主要机制,细菌产生的β-内酰胺酶大部分系活性部位带丝氨酸残基的酶类,也有一小部分是活性部位为金属离子的酶类,称为金属β-内酰胺酶(metallo-β-lactamase,MBL),简称为金属酶。金属β-内酰胺酶,属Bush分类3群,Ambler分类B类,该群酶最大特点是可以水解碳青霉烯类等抗生素,而对哌拉西林和氨曲南影响较小。酶活性中心需金属锌离子的参与而发挥催化活性,故称为金属β-内酰胺酶。底物为包括碳青霉烯类在内的一大类β-内酰胺抗生素,其活性不被常见的β-内酰胺酶酶抑制剂如克拉维酸等所抑制,但可被离子鳌合剂乙二胺四乙酸(EDTA)、菲咯啉或硫基化合物抑制所抑制。金属β-内酰胺酶可由染色体和质粒介导,可在铜绿假单胞菌、嗜麦芽窄食单胞菌、粘质沙雷菌、肠杆菌属菌、肺炎克雷伯菌、嗜水气单胞菌和不动杆菌、脆弱类杆菌属、等细菌中检出此类酶。 一、发现和分布 第一个报道的金属酶是从蜡样芽孢杆菌( Bacill us cereus) 中发现的,该酶为锌依赖酶。20 世纪80 年代初期日本从嗜麦芽窄食单胞菌中鉴定出第二种锌依赖青霉素酶L1 型酶,随后又从嗜水气单胞菌和脆弱拟杆菌中鉴定出多种能水解亚胺培南的金属酶。这些酶都由染色体基因编码。该类金属酶分布在蜡样芽孢杆菌、嗜麦芽窄食单胞菌、脆弱拟杆菌、气单胞菌属和戈氏军团菌中,除嗜麦芽窄食单胞菌外,在临床上都极为罕见,而且都是单株散发的。1991年日本学者在铜绿假单胞菌中发现了第一种质粒介导的金属酶( IMP21) ,不久又从脆弱拟杆菌中发现了一种可转移金属酶,这两个酶的发现意味着金属酶已经从单株散发向随机分布过渡。现在已报道了10多种可转移金属酶: IMP21~8 和VIM21~3,分布在铜绿假单胞菌、不动杆菌和肠杆菌科细菌中,地域分布上已经不再局限于日本,现已分布至亚洲、欧洲和美洲的多个国家(见表1)。 二、生化分类和生化性质 1995 年Bush 等将金属酶全部归入功能类型3群,主要分类依据为:能被金属螯合剂螯合,不被β-内酰胺酶抑制剂克拉维酸、舒巴坦和三唑巴坦抑制。当时没有再作进一步分类。随着金属酶报道的增多,1997 年Rasmussen 和Bush 将金属酶按功能分成三个亚群:3a、3b 和3c 。 1) 3a 亚群绝大多数金属酶属于3a 亚群。其特点是底物谱宽,水解青霉素的速度与水解亚胺培南的速度相近或更快,还能有效水解头孢菌素,因此,3a亚群金属酶是β-内酰胺酶中最危险的单一酶种。许多3a 亚群酶需添加Zn2+才能达到最大活性或被激活,提示该亚群与Zn2+的亲和力低。 2) 3b 亚群分布于气单胞菌中,包括亲水气单胞、杀蛙气单胞、温和气单胞和简达气单胞菌。特点是底物特异性高,优先水解碳青霉烯,弱水解青霉素(A2h 除外) 和头孢菌素,不水解nitrocefin ,因此不能用nitrocefin 纸片法检出。等电聚焦电泳和凝胶柱层析时必须用亚胺培南作底物才能检测到。能被EDTA抑制,加EDTA 后,再加Z2+又可恢复酶活性。高浓度Zn2+可增加酶活性而在低浓度时酶活性受抑制。当Zn2+在15μmol 或更低时,至少有3 种3b 酶的活性受抑制。
超广谱内酰胺酶(ESBLs)研究进展 发表时间:2013-04-25T09:14:06.890Z 来源:《医药前沿》2013年第8期供稿作者:刘瑞菡1,2 董亮3 [导读] 产ESBLs的菌株可造成严重的医院交叉感染和院外耐药菌的扩散,甚至引起爆发流行。 刘瑞菡1,2 董亮3(通讯作者) (1武汉大学医学院湖北武汉 430000) (2孝感市中心医院检验科湖北孝感 432000) (3孝感市中心医院输血科湖北孝感 432000) 【中图分类号】R9 【文献标识码】A 【文章编号】2095-1752(2013)08-0044-01 超广谱β-内酰胺酶(ESBLs)是丝氨酸蛋白酶的衍生物,它能够水解青霉素、广谱及超广谱头孢菌素和单环β-内酰胺抗生素的β-内酰胺酶,且能被克拉维酸抑制。ESBLs主要由肠杆菌科细菌产生,以肺炎克雷伯杆菌和大肠埃希菌为代表。ESBLs基因由质粒介导,可通过接合、转化和转导等形式在细菌间扩散,给临床抗感染治疗造成极大的困难。目前,ESBLs已成为细菌对β-内酰胺类抗生素产生耐药性的主要原因。 1.ESBLs类型 自1983年德国学者首次从臭鼻克雷伯菌中发现了超广谱β-内酰胺酶(ESBLs)SHV-2[1]以来,ESBLs种类已超过200多种。其类型可以分为TEM 型、SHV型、OXA 型、CTX-M 型、其它型等5类。其中TEM 和SHV型酶是临床较常见的。 1.1 TEM 型ESBLs:最早发现的TEM-3型对头孢噻肟耐药[2]2005年发现的TEM-94[3]对头孢泊肟和头孢噻肟耐药。还有小部分是抑制剂耐药性酶(IRT)。2005年F.Robin等[6]报道了一种新型的抑制剂耐药性酶TEM-109(CMT-5),它同时具有TEM-6的特性和TEM-33(IRT-5)对抑制剂的耐药性它代表了一种新型ESBLs的出现。 1.2 SHV 型ESBLs:SHV家族中第一个SHV型ESBLs是SHV-2。SHV-2发生了Gly-238-Ser位点的突变,增加了对氧亚氨基类抗生素的亲和力和水解能力。卢月梅等[4]同对新型β-内酰胺酶SHV-59的研究发现,其发生了A1a 134-Val和Pro 269-ku位点的变化,携带SHV-59基因的菌株对氨苄西林/舒巴坦耐药,对头孢噻肟中介,对其他药物均敏感。 1.3 OXA 型ESBLs:对酶抑制剂均耐药或仅低度敏感,特别是对青酶烷类抗生素(包括苯唑西林及相关复合制剂)有高度水解活性[5],主要涉及铜绿假单胞菌[6]和鲍氏不动杆菌[7-8]。2004年Poirel L.等首次在肠杆菌科的肺炎克雷伯菌中发现了OXA型ESBLs[9],该菌对包括碳青霉烯类在内的几乎所有β-内酰胺类抗生素耐药。 1.4 CTX-M 型ESBLs:Bauerufeind等[10-11]首次报道CTX-M 型ESBLs,对头孢噻肟高水平耐药,对头孢他啶相当敏感,周建英等[12]用头孢他啶治疗产CTx-M-l4型ESBLs大肠埃希菌造成的细菌性腹膜炎时发现其治疗效果明显好于头孢噻肟,而与哌拉西林/他唑巴坦相当。这为利用头孢他啶治疗产CTX-M型ESBLs的细菌的感染提供了试验依据。 1.5 其它类型的ESBLs:如VEB、GES、BES、CME、PER等,大多数容易水解头孢他啶,且呈区域性流行。GES型对头孢他啶和头孢西丁耐药,BES对氨曲南、头孢噻肟和头孢他啶高度耐药,PER型主要在地中海沿岸国家流行。 2.ESBLs的检测方法 产ESBLs的菌株可造成严重的医院交叉感染和院外耐药菌的扩散,甚至引起爆发流行。所以准确检测ESBLs至关重要,及早检测ESBLs 有助于制定相应的抗感染措施,为其他的治疗和预防打下基础。目前检测方法主要分为表型确认试验和分子生物学检测两大类。 2.1 表型确认试验:最经典的为肉汤稀释法和纸片扩散法。二者是美国临床试验室标准化委员会(NCCLs)推荐检测ESBLs的标准方法,其主要原理是ESBLs水解第三代头孢菌素的活性可被酶抑制剂所抑制。此后又研究出了Etest法、Vitek法、三维实验法(TD)双纸片、协同扩散法等快速简便的方法,特别是Etest法、Vitek法已经商品化,在临床上得到了广泛的应用。 2.2 分子生物学的检测:主要有PCR、核酸杂交、DNA指纹和基因序列分析。PCR法是目前常用的检测方法;核酸杂交法过于繁复,费时费力,目前已较少应用;DNA指纹法是检测SHV变种的一种快速检测基因突变的方法,但不能确定SHV 型ESBLs的存在;基因序列分析法是基因型鉴定的标准方法,目前已可方便地进行全长基因检测。 3.对ESBLs的治疗与预防 3.1 对产ESBLs菌株引起的感染的治疗:可选用碳青霉烯类抗生素,轻、中度感染町选头孢哌酮/舒巴坦、哌拉西林/三唑巴坦,也可根据药敏结果选用头霉素类、氨基糖苷类或喹诺酮类抗菌药物。疗效不佳时可改用碳青霉烯类抗生素,头孢他啶、头孢吡肟体外敏感性较高或感染部位浓度较高时可以选用,但需密切观察。 3.2 对ESBLs的预防:1.提高标本的送检率,早期发现多重耐药菌株,及早合理使用抗生素。2.加强对ICU的监控,调查各科室感染ESBLs的情况,对感染产ESBLs菌的患者进行隔离,严格消毒,控制产ESBIs菌在医院内的扩散。 临床微生物实验室应快速准确检测产ESBLs菌株,及时与临床联系,减少经验用药和盲目用药,合理使用抗菌药物。对有效地治疗疾病和控制ESBLs菌株感染具有重要意义。 参考文献 [1] Knothe H,Shah P,Kremery V,et a1.Transferable resistance to ee-fotaxime,eefoxitin,eefamandole and eefuroxime in clinical isolates of klebsiella pneumoniae an dserratia marcescens[J].Infection,1983,11:3l5-317. [2] Paterson D L, Ko W C, Von Gottberg A, et al. Antibiotic therapy for Klebsiella pneumoniae bacteremia: implications of production of extended-spectrum β-lactamases[J]. Clinical infectious diseases, 2004, 39(1): 31-37. [3] Anna Baraniak,Janusz Fiett,Agnieszka Mro wka et a1.Evolution of TEM-type Extended spectrum laetanmses in Clinical Enterobacteri-aceae Strains in Poland[J].Antimicrobial Agents and Chemotherapy,2005,1872-1880. [4] 卢月梅,张阮章,何林,等.一种新型13-内酰胺酶SHV一59的发现[J].中华医院感染学杂志,2005,09(15):965~969. [5] Thomson K,Moland E.Version 2000:the new13-lactamases of Gram- negative bacteria at the dawn of the new millennium [J].MicrobInfect,2000,2(10):1225-1235.
上海应用技术学院 研究生课程(论文类)试卷 2 014 / 2 015学年第二学期 课程名称:新药研发与申报 课程代码:NX0702016 论文题目:神经氨酸酶抑制剂的研究进展 学生姓名:王震 专业﹑学号:化工1班,146061114 学院:化学与环境工程学院 课程(论文)成绩: 课程(论文)评分依据(必填): 1.论文结构规范,检索的文献资料经认真的综合分析整理,选材精简得当,条理清晰,语言流畅, 版面整洁美观。得分为90-100分。 2.论文结构较规范,检索的文献资料经分析整理,材料组织得当,条理清晰,语言流畅。得分为 80-89分。 3.论文结构基本规范,内容有小问题,检索的文献资料经一般性分类整理,条理较清晰,得分为 70-79分。 4.论文结构基本规范,内容未经认真整理,一般性罗列所检索的文献资料。得分为60-69分。 5.达不到上述第4点要求的论文,得分为0-59分。 任课教师签字: 日期:年月日
神经氨酸酶抑制剂的研究进展 摘要:2009年高致病性的H1N1流感大爆发,再次向人们敲响了警钟:随着毒株变异性的加强,流感疫苗已无力完全遏制疫情的传播[1]。我们知道,流感病毒在感染和传播过程中,作为其四大活性位点之一(其他三个是血凝素、M2离子通道和部分RNA聚合酶)的神经氨酸酶(NA)起到了重要作用。因此,抗流感病毒神经氨酸酶抑制剂的设计与合成势在必行。本文综述了抗流感病毒神经氨酸酶抑制剂(NAIs)的研究进展。 关键词:神经氨酸酶;变异;抑制剂;合成
The development of neuraminidase inhibitors Abstract: The pandemic of influenza virus in 2009 to human beings sounded the alarm: the influenza vaccine was feeling powerless to suppress the transmission of epidemic with the strengthening of strain’s variability. As we know, in the process of influenza virus’ infection and propagation, the neuraminidase, one of four neuraminiric active site (another active site,ie,Hemagglutinin,M2 ion channels and RNA polymerase), played a important role. Therefore, the designing and synthesis of anti-influenza virus neuramnidase inhibitors are imperative. And this paper reviewed the development of influenza-resistant virus neuraminidase inhibitors. Keywords: neuraminidase; variation; inhibitors; synthesis
详解β-内酰胺类抗生素和β-内酰胺酶抑制剂 详解β-内酰胺类抗生素和β-内酰胺酶抑制剂 一、概述 革兰阴性菌是我国细菌感染性疾病最常见的病原体。近年来,革兰阴性菌对β-内酰胺类抗生素的耐药性不断增加,最重要的耐药机制是细菌产生各种β-内酰胺酶。β-内酰胺酶抑制剂能够抑制大部分β-内酰胺酶,恢复β-内酰胺类抗生素的抗菌活性。因此,β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂在临床抗感染中的地位不断提升,已成为临床治疗多种耐药细菌感染的重要选择。目前我国临床使用的β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂的种类和规格繁多,临床医师对该类合剂的特点了解不够,临床不合理使用问题较突出。为规范β-内酰胺类抗生素/β-内酰胺酶抑制剂合剂的临床应用,延缓其耐药性的发生和发展,特制定本共识。 二、主要β-内酰胺酶及β-内酰胺酶抑制剂 β-内酰胺酶是由细菌产生的能水解β-内酰胺类抗生素的一大类酶。β-内酰胺酶种类繁多,有多种分类方法,最主要的分类方法有根据β-内酰胺酶的底物、生化特性及是否被酶抑制剂所抑制的功能分类法(Bush分类法),将β-内酰胺酶分为青霉素酶、广谱酶、超广谱β-内酰胺酶、头孢菌素酶和碳青霉烯酶等;根据β-内酰胺酶末端的氨基酸序列特征的分子生物学分类法(Ambler分类法),将β-内酰胺酶分为丝氨酸酶和金属酶。目前引用较多的是基于上述2种
方法建立的分类方法。 超广谱β-内酰胺酶(ESBLs)是由质粒介导的能水解青霉素类、头孢菌素及单环酰胺类等β-内酰胺类抗生素的β-内酰胺酶,其对碳青霉烯类和头霉素类水解能力弱。这类酶可被β-内酰胺酶抑制剂如克拉维酸、舒巴坦及他唑巴坦等抑制。ESBLs主要由肠杆菌科细菌产生,以肺炎克雷伯菌、大肠埃希菌、变形杆菌最为常见。到目前为止,全世界共发现了200余种ESBLs。根据编码基因的同源性,ESBLs可分为TEM型、SHV型、CTX-M型、OXA型和其他型共5大类型。 头孢菌素酶(AmpC酶)通常是由染色体介导,对第一、二、三代头孢菌素水解能力强,但其对碳青酶烯类抗生素和第四代头孢菌素的水解能力弱,克拉维酸钾不能抑制其活性,他唑巴坦和舒巴坦有部分抑酶作用,氯唑西林抑制头孢菌素酶作用强。该酶主要存在于肠杆菌属、柠檬酸杆菌属、普鲁菲登菌属、粘质沙雷菌属和摩根菌属等细菌。染色体介导的头孢菌素酶可以被β-内酰胺类抗生素诱导和选择。近年来,质粒介导的头孢菌素酶陆续被报道,主要出现于肺炎克雷伯菌、大肠埃希菌及沙门菌属细菌中,常呈持续高水平表达,可通过质粒广泛传播。根据其与染色体介导的头孢菌素酶的同源性,可分为CMY-2组、CMY-1组、MIR-1/ACT-1组、DHA-1组和ACC-1组等。 碳青霉烯酶是指能水解碳青霉烯类抗生素的一大类β-内酰胺酶,分别属于Ambler分子分类中的A类、B类和D类酶。A类、D类为丝氨酸酶,B类为金属酶,以锌离子为活性中心。 A类碳青霉烯酶可以由染色体介导,也可由质粒介导,前者包括
3-内酰胺类抗生素B内酰胺酶抑制剂复方制剂临床应用 专家共识(2020年版) 一、概述 革兰阴性菌及少数革兰阳性菌对3 -内酰胺类抗生素耐药的最重要机制是产 生各种3 -内酰胺酶。3 -内酰胺酶抑制剂能够抑制部分3 -内酰胺酶,避免3 - 内酰胺类抗生素被水解而失活。因此,3 -内酰胺类抗生素/ 3-内酰胺酶抑制 剂复方制剂(简称3 -内酰胺酶抑制剂复方制剂)是临床治疗产3 -内酰胺酶 细菌感染的重要选择。我国临床使用的3 -内酰胺酶抑制剂复方制剂的种类 和规格繁多,临床工作者对该类制剂的特点了解参差不齐,临床不合理使用问题比较突出。 二、主要3-内酰胺酶及产酶菌流行情况 3-内酰胺酶是由细菌产生的,能水解3 -内酰胺类抗生素的一大类酶。3-内 酰胺酶种类繁多,有多种分类方法,最主要的分类方法有两种: 一、是根据3 -内酰胺酶的底物、生化特性及是否被酶抑制剂所抑制的功能分类法(Bush分类法),其将3 -内酰胺酶分为青霉素酶、广谱酶、超广谱 3-内酰胺酶(ESBLs)、头抱菌素酶(AmpC酶)和碳青霉烯酶等; 二、是根据3-内酰胺酶末端的氨基酸序列特征的分子生物学分类法(Ambler分类法),将3 -内酰胺酶分为丝氨酸酶(包括A类、C类酶和D 类酶)及金属酶(B类酶)。目前引用较多的是1995年Bush等基于上述 二种方法建立的分类方法,2019年Bush等又将该分类表进一步完善和细 化(表1)。其中临床意义最大的是下列三类3 -内酰胺酶:
表1常见B-内酰胺酶分类及特点,常见酶抑制剂抑酶活性
1、E SBLs主要属2be\2br\2ber 类酶,是由质粒介导的能水解青霉素类、头抱 菌素及单环酰胺类等B -内酰胺类抗生素的B -内酰胺酶,其对碳青霉烯类和头霉素类水解能力弱。ESBLs主要由肠杆菌科细菌产生,以肺炎克雷伯菌、大肠埃希菌、变形杆菌最为常见。根据编码基因的同源性,ESBLs可分为TEM型、SHV型、 CTX-M型、OXA型和其他型共5大类型。 2、A mpC酶属C类酶,通常由染色体介导,可以被B -内酰胺类抗生素诱导。部分由质粒介导,常呈持续高水平表达。其对第一、二、三代头抱菌素水解能力强,但对碳青霉烯类抗生素和第四代头抱菌素的水解能力弱。该酶主要存在于肠杆菌 属、柠檬酸杆菌属、普鲁菲登菌属、黏质沙雷菌属和摩根菌属等细菌,非发酵菌