
河南省新乡市新乡县第一中学新高一分班考试化学
一、选择题
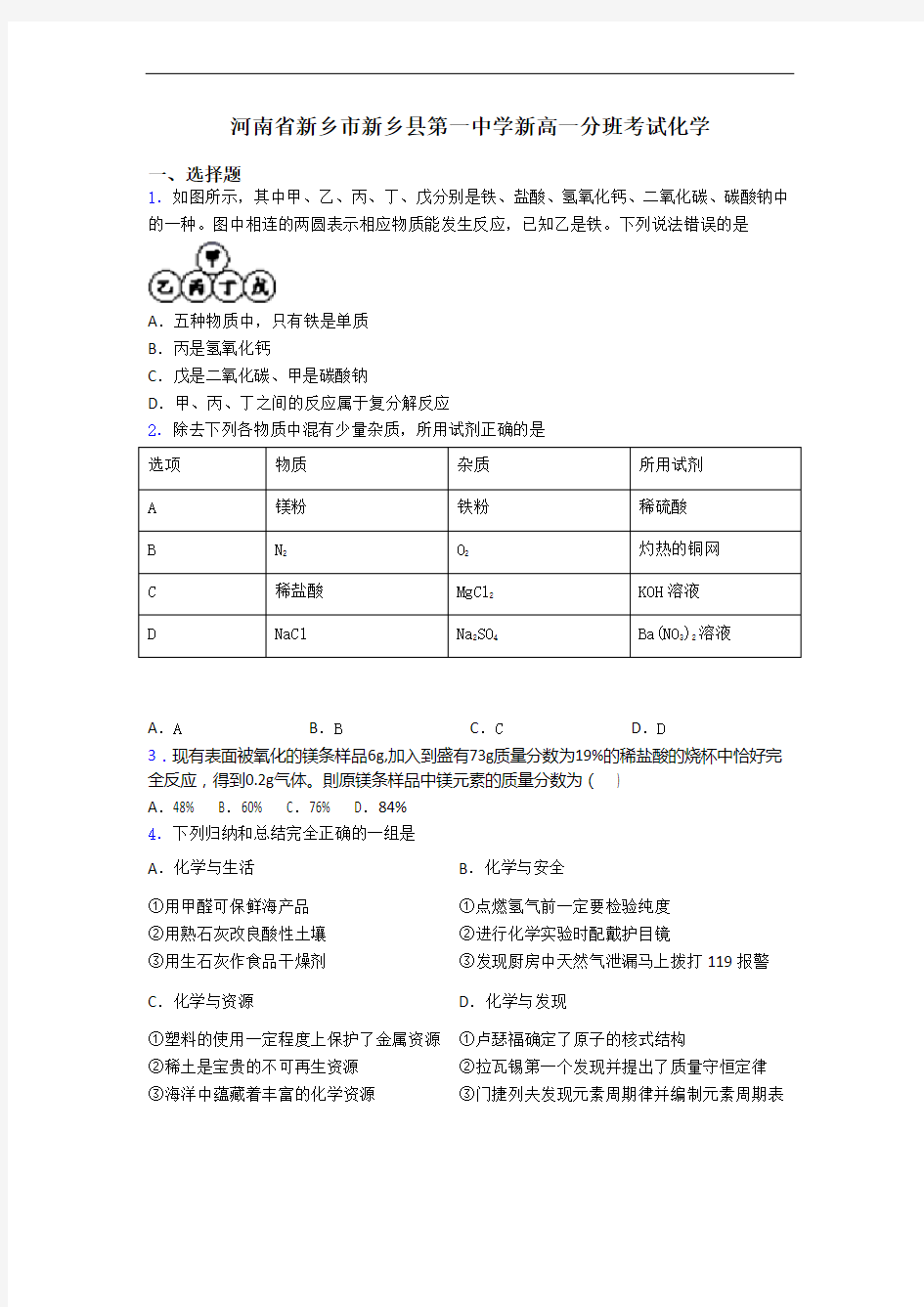
1.如图所示,其中甲、乙、丙、丁、戊分别是铁、盐酸、氢氧化钙、二氧化碳、碳酸钠中的一种。图中相连的两圆表示相应物质能发生反应,已知乙是铁。下列说法错误的是
A.五种物质中,只有铁是单质
B.丙是氢氧化钙
C.戊是二氧化碳、甲是碳酸钠
D.甲、丙、丁之间的反应属于复分解反应
2.除去下列各物质中混有少量杂质,所用试剂正确的是
选项物质杂质所用试剂
A镁粉铁粉稀硫酸
B N2O2灼热的铜网
C稀盐酸MgCl2KOH溶液
D NaCl Na2SO4Ba(NO3)2溶液
A.A B.B C.C D.D
3.现有表面被氧化的镁条样品6g,加入到盛有73g质量分数为19%的稀盐酸的烧杯中恰好完全反应,得到0.2g气体。則原镁条样品中镁元素的质量分数为( )
A.48% B.60% C.76% D.84%
4.下列归纳和总结完全正确的一组是
A.化学与生活B.化学与安全
①用甲醛可保鲜海产品
②用熟石灰改良酸性土壤
③用生石灰作食品干燥剂
①点燃氢气前一定要检验纯度
②进行化学实验时配戴护目镜
③发现厨房中天然气泄漏马上拨打119报警C.化学与资源D.化学与发现
①塑料的使用一定程度上保护了金属资源
②稀土是宝贵的不可再生资源
③海洋中蕴藏着丰富的化学资源
①卢瑟福确定了原子的核式结构
②拉瓦锡第一个发现并提出了质量守恒定律
③门捷列夫发现元素周期律并编制元素周期表
A.A B.B C.C D.D
5.如图所示是A、B、C三种物质的溶解度,下列有关说法错误的是()
A.高于20℃以后,B的溶解度比C大
B.10℃时,C接近饱和的溶液升高温度可以达到饱和
C.20℃时,A、B的饱和溶液的溶质质量分数相等
D.35℃时,A物质的饱和溶液的溶质质量分数为30%
6.向硫酸亚铁、硫酸铜的混合溶液中加入一些锌粉,充分反应后,过滤,得到滤渣A和滤液。将滤渣A加入少量稀硫酸中,有气泡产生。以下对滤渣A的组成成分判断的五种情况,其中合理的有
①Cu ②Fe、Cu ③Zn、Fe ④Zn、Cu ⑤Zn、Fe、Cu
A.②⑤ B.②③ C.②③④⑤ D.①②⑤
7.将一个不与盐酸反应的小球放入盛有盐酸的烧杯中,小球漂浮在液面上,将几枚洁净的小铁钉投入烧杯中,当不再有气泡逸出时(忽略溶液体积的变化),小球的位置与开始时比较,将()
A.下沉一些 B.不变 C.上浮一些 D.无法判断
8.取一定质量的CaCO3高温煅烧一段时间后冷却,测得剩余固体为12.8 g,向剩余固体中加入200 g稀盐酸,恰好完全反应,得到208.4 g不饱和溶液。则加热前碳酸钙的质量为A.15 g B.18 g C.20 g D.30 g
9.下列制备物质的设计中,理论上正确,操作上可行。经济上合理的是
A.
B.
C.
D.
10.已知A、B、C、D、E分别是初中化学中所学常见物质,它们之间相互转化的关系如图所示,“→”表示物质相互之间的转化,“—”表示物质之间能发生反应,A、B、C、E分别属于不同类别的化合物,A与C、E与C之间的反应产物完全相同,E在农业上可用于改良酸性土壤。下列叙述错误的
A.上述五种物质之间相互转化的化学反应类型中不包含置换反应
B.D与水反应生成酸,A与水反应生成碱
C.可用水除去E中含有的少量A杂质
D.B、D两种物质在一定条件下,不能互相转化
11.下列不能正确反映相关实验过程中量的变化关系的图像是( )
A.分别向等质量Fe和Al中加入足量的溶质质量分数的稀盐酸
B.一定压强下,氧气在水中的溶解度
C.一定温度下,向不饱和硝酸钾溶液中加入硝酸钾
D.氯酸钾和二氧化锰混合加热制氧气中,a使用催化剂,b未使用催化剂
12.除去物质中的少量杂质,下列方法不能达到目的的是()
选项物质杂质除去杂质的方法
A CaO CaCO3高温充分煅烧
B KCl溶液CaCl2通入足量的CO2,过滤
C CO2CO通过足量的灼热氧化铜
D H2HCl依次通过足量的NaOH溶液和浓硫酸
A.A B.B C.C D.D
13.除去下列物质中的少量杂质,所选用的试剂或操作方法错误的是( )
选项物质杂质试剂操作方法
A H2O油污活性炭振荡、搅拌
B空气甲醛过量焦炭通过焦炭净化器
C CO水蒸气足量生石灰通过生石灰的干燥管
D NaNO3溶液Na2CO3适量Ca(NO3)2溶液过滤,蒸发结晶
A.A B.B C.C D.D
14.下表中对部分知识的归纳完全正确的一组是()
A.A B.B C.C D.D
15.下列四个图象能正确反映实验变化关系的有( )
A.A B.B C.C D.D
16.为测定某赤铁矿石中氧化铁的含量,小冰用一氧化碳还原12g该赤铁矿石样品,充分反应完成后,称得剩余固体质量为9.3g,假设矿石中其他物质不参与反应,请你推算,该矿石中氧化铁的含量为()
A.85% B.80% C.75% D.70%
17.把二氧化碳、一氧化碳、氢气和氮气混合气体通过石灰水,灼热的氧化铜(假设每个过程中发生的化学反应充分),冷却后留下的气体是( )
A.二氧化碳和氮气 B.氮气和水蒸汽
C.一氧化碳和二氧化碳 D.氮气和氢气
18.化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属。流程如下:
其中正确的是
A.固体丙中一定只含银 B.四种金属活动性强弱顺序Zn、X、Cu、Ag
C.固体甲中一定含有Cu和Ag,可能含有X D.滤液A中含有两种溶质
19.有一个反应在密闭容器中发生,三种物质CaCO3、CaO和CO2的质量比例变化如图所示。下列有关该反应的说法,正确的是
A.该反应是化合反应
B.CaO在反应中起催化作用
C.CO2是生成物
D.反应中CaO和CaCO3的质量比为1:1
20.下列有关氯酸钾和二氧化锰共热反应时各物质间的质量关系,正确的是
A.B.
C.D.
21.如下图是甲、乙、丙三种物质的溶解度曲线。根据曲线分析,错误的是
A.t1℃时,等质量的甲、乙饱和溶液中所含溶质的质量为乙>甲
B.t2℃时,可配制溶质质量分数为30%的丙溶液
C.将组成在M点的甲溶液转变为N点的甲溶液,可加适量水稀释
D.t3℃时,将甲、乙、丙三种物质的饱和溶液降温至t2℃,所得溶液溶质质量分数的大小关系为乙>甲>丙
22.下列各组对比实验,能达到实验目的的是:
实验目的
实验方案
实验①实验②
A 探究碘在汽油和植物油中的溶解性
B 探究温度对反应剧烈程度的影响
C 探究催化剂对反应快慢的影响
D探究CO2的化学性质
A.A B.B C.C D.D
23.实验室有一包含有少量氯化钠杂质的硝酸钾固体,为提纯硝酸钾,设计如下图所示操作,
有关分析中正确的是
A.操作Ⅰ~Ⅲ分别是加热浓缩、蒸发结晶、过滤
B.操作Ⅰ是过滤,将氯化钠固体从溶液中分离除去
C.操作Ⅱ是加热浓缩,趁热过滤,除去杂质氯化钠
D.操作Ⅲ是过滤,将硝酸钾晶体从溶液中分离出来
24.下图是某反应的微观示意图。下列有关说法正确的是()
A.该反应生成物有三种B.该反应属于置换反应
C.反应前后分子的个数没有改变D.该反应中H2S与O2的分子个数比为2:3 25.将一定质量的铜锌合金的粉末加入到一定量的硝酸银溶液中充分反应后过滤,向滤渣中滴加少量的稀盐酸,有气泡产生,下列说法正确的是()
A.滤液中的溶质一定含有硝酸铜 B.滤液中溶质一定不含硝酸银
C.滤渣中可能含有银和锌 D.滤渣中一定没有铜
二、流程题
26.有一包由KCl、MgSO4和CaCl2组成的固体混合物,为了除去其中的MgSO4和CaCl2,得到纯净的KCl,设计如下实验方案:
(1)M溶液中的溶质是什么_____?
(2)请设计实验证明滤液Ⅱ中除KCl外的其他溶质_____。(写出实验步骤和现象)
(3)最后所得KCl的质量大于原固体中KCl的质量,写出一个可使KCl质量增加的化学方程式_____。
27.纯碱是一种重要的有机化工原料,主要用于平板玻璃、玻璃制品和陶瓷釉的生产。还
广泛用于生活洗涤、酸类中和以及食品加工等。
(一)侯德榜是我国著名科学家,1933 年出版《纯碱制造》一书,创立了中国自己的制碱工艺。其纯碱制造原理如图所示:
(1)NH3和 CO2通入饱和食盐水的顺序是___________(填字母序号)。
A 先通 NH3,后通 CO2
B 先通 CO2,后通 NH3
(2)NaHCO3在水中溶解度相对比较小,以沉淀形式析出,图中“操作”的名称是
___________,该操作中使用的玻璃仪器有烧杯、漏斗和___________。
(二)为了充分利用副产品 NH4Cl,利用 NH4Cl 生产 NH3和HCl。
(1)方法一:直接加热分解 NH4Cl。
但是这种方法获得 NH3和HCl 的产率往往很低,原因是___________(用化学反应方程式表示)。
(2)方法二:采用MgO 循环分解 NH4Cl。
加热,在 300℃以下获得 NH3;继续加热至 350℃~600℃获得 HCl 气体。利用下列装置(加热及加持装置略)可测量 NH3和HCl 的产率。
①低于 300℃时,干燥管盛装的干燥剂是___________。NH3吸收完全后,更换干燥剂和吸收装置中的吸收液。
②产生 NH3的化学反应方程式是___________。
③在 350℃~600℃,如图虚线框内应选择的安全瓶是___________ 。
④侯氏制碱法在滤去碳酸氢钠的母液中通氨气并加入细小食盐颗粒,冷却析出副产品,通氨气的作用是:①___________;②使NaHCO 3转化为 Na 2CO 3,提高析出的NH 4Cl 纯度。
28.氯化亚铜(CuCl )广泛应用于冶金、电镀、医药等行业。CuCl 制备流程如图: 已知:CuCl 难溶于水,在潮湿空气中易变质。
(1)“反应”中发生的化学变化是2CuCl 2+Na 2SO 3=2CuCl↓+2NaCl+SO 3,Na 2SO 3中硫元素的化合价是__________,产生的SO 3能迅速与水化合生成一种常见的酸,该反应的化学方程式为___________。
(2)“操作a”中的玻璃棒的作用是___________。若得到的滤液2有浑浊,原因可能是(写出一种即可)_______________________。
(3)可用“水洗”的原因是___________________________。
(4)本流程中可以循环利用的物质(水除外)是_________(填化学式)。
29.工业粗盐(含少量沙土、氯化钙和氯化镁)精制的工艺流程如下,请回答下列问题:
(1)写出操作2的名称_____。
(2)写出加入NaOH 后发生反应的化学方程式_____。
(3)试剂B 的作用是什么_____?
30.如图是实验室模拟工业上用大理石(含少量Fe 2O 3和SiO 2)为原料提纯碳酸钙的实验流程,请回答下列问题:
已知:①SiO 2不溶于水也不溶于酸;②氨水呈碱性,与盐酸反应的化学方程式为:3242NH H O+HCl NH Cl+H O =。
(1)稀盐酸不能用稀硫酸代替,原因是________________。
(2)操作a、b、c中需要用到的玻璃仪器有烧杯、玻璃棒和________。
(3)滤液A中所含有的溶质的化学式是_________;写出滤液A中加氨水生成Fe(OH)3的化学方程式______________。
(4)滤液B中加入试剂X,恰好完全反应,若滤液C中只含有两种溶质,则试剂X的化学式为_______。
【参考答案】***试卷处理标记,请不要删除
一、选择题
1.B
解析:B
【解析】
甲、乙、丙、丁、戊分别是铁、盐酸、氢氧化钙、二氧化碳、碳酸钠中的一种,铁会与盐酸反应,盐酸会与氢氧化钙、碳酸钠反应,氢氧化钙会与盐酸、二氧化碳、碳酸钠反应,二氧化碳会与氢氧化钙反应,乙是铁,所以丙是盐酸,故B错误;甲、丁是碳酸钠或氢氧化钙,如果甲是碳酸钠,丁就是氢氧化钙,戊就是二氧化碳,合理;如果甲是氢氧化钙,丁是碳酸钠,二氧化碳不会与碳酸钠反应,不合理,所以甲是碳酸钠,丁是氢氧化钙,戊是二氧化碳,所以C正确;五种物质中,只有铁是单质所以A正确;碳酸钠和氢氧化钙,盐酸之间的反应属于复分解反应,所以D正确。故选B
2.B
解析:B
【解析】
利用混合物中两种物质的性质差别,分析除杂方法对混合物组成的影响,判断该方法是否能达到除去杂质的目的,选出不能达到的选项。
A. 镁粉(铁粉)加稀硫酸。稀硫酸与镁和铁都会发生反应,故错误;
B. N2(O2)通过灼热的铜网。氧气与铜反应生成氧化铜,氮气不与铜反应。正确;
C. 稀盐酸(MgCl2)加KOH溶液。稀盐酸与KOH溶液反应,而MgCl2不与KOH溶液反应,故
错误;
D. NaCl(Na2SO4)加Ba(NO3)2溶液。Ba(NO3)2溶液与Na2SO4反应生成硫酸钡的沉淀和硝酸钠。生成的硝酸钠是杂质。故错误。
故本题选B。
点睛:除去混合物中的杂质,所选用的试剂或方法应对杂质有作用,不影响主要成分,并且过程中不能产生新的杂质。
3.C
解析:C
【解析】表面被氧化的镁条其成分有氧化镁和镁,其中镁与盐酸反应生成氯化镁和氢气,氧化镁和盐酸反应生成氯化镁和水;表面被氧化的镁条样品6g,加入到盛有73g质量分数为19%的稀盐酸的烧杯中恰好完全反应,所以反应后镁元素都以氯化镁的形式存在;由氯化镁的化学式MgCl2-可得镁元素与氯元素的关系式如下:Mg---2Cl- MgCl2-2HCl,Mg--- -2HCl,设样品中镁元素的质量为x,Mg---2HCl
24 73
x 73g×19%
x=4.56g 則原镁条样品中镁元素的质量分数为4.56g÷6g×100%=76%
点睛:利用反应前后元素的种类质量不变计算使计算题变得简单。
4.C
解析:C
【解析】A.根据物质的性质和作用分析解答;
B. 根据物质的性质及安全常识分析解答;
C.根据资源的保护和利用分析解答;
D.根据各科学家的发现分析解答。
解:A. 甲醛会与海产品中蛋白质发生反应,破坏蛋白质的结构,使其变质,危害人体健康,故归纳错误;
B.天然气泄漏拒绝一切产生火花的行为。拨打电话可能产生火花,故归纳错误;
C. ①塑料在有些方面的使用可以代替金属。因此塑料的使用一定程度上保护了金属资源;
②稀土是宝贵的不可再生资源③海洋中蕴藏着丰富的化学资源,归纳正确;
D. ①卢瑟福确定了原子的核式结构,②拉瓦锡第一个发现并提出了质量守恒定律,③门捷列夫发现元素周期律并编制元素周期表,归纳正确;
故本题选CD。
5.D
解析:D
【解析】A、在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。由图可知高于20℃以后,B的溶解度比C大;B、溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。由图可知C的溶解度随温度的升高而减小,因此10℃时,C接近饱和的溶液升高温度可以达到饱和;C、饱和溶液溶质的质量分数=溶解度÷(溶解度+100g)×100%,20℃
时,A、B的溶解度相同,故其饱和溶液的溶质质量分数相等;D. 饱和溶液溶质的质量分
数=溶解度÷(溶解度+100g)×100%,20℃时,35℃时,A物质的溶解度为30g,其饱和
溶液的溶质质量分数为溶解度÷(30g+100g)×100%<30%,选D
6.A
解析:A
【解析】三种金属的活动性顺序是锌>铁>铜,向硫酸亚铁、硫酸铜的混合溶液中加入一些
锌粉,锌先与硫酸铜反应生成硫酸锌和铜,硫酸铜反应完全反应后,剩余的锌再与硫酸亚
铁反应生成硫酸锌和铁,充分反应后,过滤,得到滤渣A和滤液。将滤渣A加入少量稀硫
酸中,有气泡产生。说明固体中一定有铜、铁,可能有锌。选A
点睛:金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金属活动顺
序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属
的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。
7.C
解析:C
【解析】小球漂浮于液面上,所以小球所受的浮力不变,根据阿基米德原理的公式F浮=ρ
gV排可知,在浮力不变时,当ρ液增大时,则v排减小,小球将上浮一些;当ρ液减小液
时,则v排增大,小球将下沉一些。
解:因为小球漂浮于液面上,所以小球所受的浮力不变。
盐酸和铁反应生成氯化亚铁和氢气,氯化亚铁溶于水所以溶液的密度变大,所以液体的密
度增大,而小球受到的浮力不变,根据公式F浮=ρ液gV排可知,排开液体的体积减小,所
以小球会上浮,故A正确。
故选C。
点睛:物体的浮沉条件和阿基米德原理的应用,通过小球所受浮力不变,与化学知识结合
起来考查了溶液密度的变化,完成此题,要依据已有的物理知识和化学知识结合起来。
8.A
解析:A
【解析】
取一定质量的CaCO3高温煅烧一段时间后冷却,测得剩余固体为12.8g,向剩余固体中加入
200g稀盐酸,恰好完全反应,得到208.4g不饱和溶液。所以生成二氧化碳的质量为:
12.8g,+200g-208.4g=4.4g。设剩余固体中碳酸钙的质量为x,
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
100 44
x 4.4g
100/x=44/4.4g x=10g
固体中氧化钙的质量为12.8g-10g=2.8g
设分解的碳酸钙质量为y
CaCO3高温CaO+CO2↑
100 56
y 2.8g
100/y=56/2.8g y=5g
所以原碳酸钙的质量为5g+10g=15g 选A
点睛:方程式的计算,关键根据化学反应方程式找出相关物质的质量关系,利用反应中物质的质量比不变进行列比例计算,易错点是,由方程式求质量比算数错误,所以这一步要仔细检查。
9.D
解析:D
【解析】理论上正确,要求物质的转化需符合物质的性质及变化规律;操作上可行,要求操作应简便易行;经济上合理,要求不能利用价格昂贵的物质转化为价格低廉的物质;根据以上要求,分析每个方案;分析时可首先判断理论上是否可行,然后再考虑操作上的可行性与经济上的合理性。
解:A、一氧化碳高温下与氧化铜反应生成铜和二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠;理论上正确,操作中需要加热不够简便,且使用氢氧化钠制取碳酸钠,经济上不合理;故A不正确;
B、与硝酸银反应可生成硝酸铜,硝酸铜与氢氧化钠可生成氢氧化铜沉淀;理论上正确,操作上也较简便,但利用硝酸银、氢氧化钠制取氢氧化铜,经济上不合理;故B不正确;
C、铁在氧气中燃烧生成四氧化三铁而不能生成三氧化二铁,因此该方案在理论上就是错误的;故C不正确;
D、氧化钙与水反应可生成氢氧化钙,氢氧化钙与碳酸钠反应可生成氢氧化钠;理论上正确,操作也只需要加入液体较为简便,利用碳酸钠获得氢氧化钠,经济上也合理;故D正确。
故选D。
点睛:熟练掌握物质的性质与变化规律为解答理论上正确所需要的知识基础,熟悉常见物质的用途则为经济上合理的判断提供参考依据。
10.D
解析:D
【解析】由题意可知,E是氢氧化钙,A、B、C、E分别属于不同类别的化合物,A、B、C 为酸、盐、氧化物中的一种,A能转化为E,A可能是氧化钙或水,是氧化物;A能与C反应,又C为酸或盐,A为氧化钙,故C为酸,B为盐,B能转化为A,B为碳酸钙,则D为二氧化碳。
解:A.B转化为A是分解反应;A转化为E是化合反应;E和D的反应及D转化为B的反应不属于基本反应类型;其余都是复分解反应。故说法正确;
B.D是二氧化碳,二氧化碳与水反应生成碳酸;A是氧化钙,与水反应生成氢氧化钙,故说法正确;
C.E是氢氧化钙,A是氧化钙,氧化钙与水反应生成氢氧化钙,故说法正确;
D.B是碳酸钙,D是二氧化碳,B、D两种物质在一定条件下能互相转化,故说法错误。
因此本题选D。
11.B
解析:B
【解析】A、根据铁、铝与足量溶质质量分数相同的稀盐酸反应进行分析判断;
B、根据气体的溶解度随着温度的升高而减小,进行分析判断;
C、不饱和溶液加入溶质会溶解,溶质的质量分数会增大,但达到饱和时就不再溶解了,溶质的质量分数也就不变了;
D、根据实验室制取氧气的原理,分解氯酸钾制取氧气时加入催化剂的作用进行分析判断。解:A、Fe +2HCl== FeCl2+H2↑ ,2Al+6HCl==2AlCl3+3H2↑。铁与盐酸反应生成2份质量的氢气需要56份质量的铁,铝与盐酸反应生成2份质量的氢气需要18份质量的铝。由此可知,分别向等质量Fe和Al中加入足量的溶质质量分数相同的稀盐酸,铝产生的气体质量较多;正确;
B、一定压强下,气体的溶解度随着温度的升高而减小,故图象不能正确反映相关实验过程中量的变化关系;错误;
C、不饱和的硝酸钾溶液加入硝酸钾会溶解,溶质的质量分数会增大,但当达到饱和时就不再溶解了,溶质的质量分数也就不变了;图象应该是先上升后成一条水平直线,故图象能正确反映相关实验过程中量的变化关系;正确;
D、实验室用氯酸钾制取氧气时加入催化剂二氧化锰,能加快反应的速率,不会改变气体的质量,a使用催化剂,所需时间较短,反应速率较快;故图象能正确反映相关实验过程中量的变化关系。正确。
故选:B。
点睛:本题是一道图象坐标与化学知识相结合的综合题,解题的关键是结合所涉及的化学知识,正确分析各变化的过程,注意分析坐标轴表示的意义、曲线的起点、折点及变化趋势,进而确定正确的图象。
12.B
解析:B
【解析】
利用混合物中两种物质的性质差别,分析除杂方法对混合物组成的影响,判断该方法是否能达到除去杂质的目的,选出不能达到的选项。
A. 高温充分煅烧CaCO3,生成氧化钙和二氧化碳,正确;
B. CaCl2溶液不与二氧化碳反应,故错误;
C. CO2(CO)通过足量的灼热氧化铜,CO与氧化铜反应,生成CO2,正确;
D. HCl气体溶于水与NaOH溶液反应生成氯化钠和水,氢气不与氢氧化钠反应,然后通过浓硫酸干燥,正确。
点睛:除去混合物中的杂质,所选用的试剂或方法应对杂质有作用,不影响主要成分,并且过程中不能产生新的杂质。
13.A
解析:A
【解析】
A、活性炭能吸附色素异味,但不能除油污;B通过焦炭净化器能将空气中的甲醛吸附;C 生石灰即氧化钙和水反应生成固体氢氧化钙,因而可用于吸水,而且由于不与一氧化碳反应,可用于干燥一氧化碳;D,适量的硝酸钙和碳酸钠反应生成碳酸钙沉淀和硝酸钠,过滤
后溶液中的溶质只有硝酸钠,符合除杂要求。选A
点睛:除杂的原则:只除杂,不引杂。即所加试剂只能与杂质反应,不能与想要的主要成分反应,同时不能引入新的杂质
14.A
解析:A
【解析】A、向水中加入肥皂水时,如果产生的泡沫较多,是软水,如果产生大量浮渣,是硬水,因此可以用肥皂水区分硬水和软水;点燃羊毛纤维和棉纤维时,能够产生烧焦羽毛的气味的是羊毛纤维,另一种是棉纤维,因此利用灼烧闻气味的方法可以区分羊毛纤维和棉纤维;加熟石灰粉末研磨时,能够产生刺激性气味气体的是硫酸铵,不产生刺激性气味气体的是硫酸钾,因此利用氢氧化钙可以区分硫酸铵和硫酸钾,正确;B、出行多乘交通工具可以减少二氧化碳的排放;生活中用火烧毁废旧塑料和橡胶时,能够产生大量二氧化碳气体;用废旧报纸制作铅笔杆可以减少二氧化碳的排放;,不完全正确,错误;C、铁、碘、是人体必需的微量元素,而钙元素是人体需要的常量元素;②服用含Al(OH)3的药物可治疗胃酸过多,这是因为氢氧化铝能和胃酸中的盐酸反应生成氯化铝和水;③油脂虽然是人体重要的营养物质,但是也不能大量摄入油脂,要适量摄取,以保持身体健康;不完全正确,错误;D、钢铁、硬铝和黄铜都是合金;②纯铁比生铁的硬度小;③聚氯乙烯塑料属于有机合成材料,不完全正确,错误。故选A。
15.A
解析:A
【解析】
A,镁的活动性比铁强,所以镁比铁反应快,先反应完,由于镁和铁足量,与等量、等浓度的盐酸反应时,最终生成氢气的质量由盐酸决定,所以最终生成氢气的质量一样多,符合题意;B浓硫酸有吸水性,敞口放置质量因溶剂增多,溶液质量增加,不符合题意;C、硝酸钾的溶解度随温度升高而增大,所以加热硝酸钾饱和溶液时,溶液会变成不饱和溶液,但溶质、溶剂的质量都不改变,溶质的质量分数不变,氢氧化钙的溶解度随温度升高而而减小,加热氢氧化钙饱和溶液时,会有溶质析出,溶质的质量分数减小,不符合题意;
D、碳和氧气反应时,每一个碳原子和一个氧分子恰好完全反应生成一个二氧化碳分子,故反应中气体的分子数不变,不符合题意;选A
点睛:图像的问题主要是结合化学反应分析图的起点的位置,变化趋势,终点的位置是否正确
16.C
解析:C
【解析】在高温下,一氧化碳与氧化铁反应生成铁和二氧化碳,根据质量守恒定律,反应后固体减少的质量为氧元素的质量,设矿石中氧化铁的含量为x,则
12g×x×163
160
×100%=12g-9.3g,解得x=75%。故选C。
17.A
解析:A
【解析】二氧化碳、一氧化碳、氢气和氮气混合气体通过石灰水,二氧化碳会与石灰水反
应生成碳酸钙沉淀和水,CO 2被吸收;再通过灼热的氧化铜后,一氧化碳、氢气与灼热的氧化铜反应分别生成铜和二氧化碳、铜和水蒸气,一氧化碳吸收,但生成了二氧化碳、水蒸气;冷却后留下的气体是二氧化碳和氮气。故选A 。
18.B
解析:B
【解析】金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au ,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。根据金属的活泼性顺序:锌>氢>铜>银,故向锌、X 、铜、银的金属混合物中加入稀硫酸,锌一定参加反应产生气泡,而铜和银一定没反应,得到的滤液A 再加入过量的锌得到固体混合物乙和滤液B ,说明锌除了和过量的硫酸反应产生气体外,还和盐溶液发生了置换反应,而铜和银没有参加反应,因此是锌和X 的盐溶液发生的反应,因此说明锌的活动性比X 强,且X 位于氢前;铜和硝酸银反应产生硝酸铜和银,因此:A 、由于硝酸银是一定量,可能不足,所以固体丙中一定含有的金属是被置换出的银及原有的银,及可能有剩余的铜,错误;B 、四种金属的活动性顺序由强到弱的是Zn 、X 、Cu 、Ag ,正确;C 、由于硫酸过量,固体甲中只含有铜和银,没有活泼金属锌和X ,错误;D 、滤液A 中一定有X 的硫酸盐和硫酸锌,滤液A 中加入锌后有气体生成,说明滤液中还有硫酸,所以溶质有三种,错误。故选B 。
点睛:分析反应后的成分时除考虑生成物外,还要考虑剩余的反应物。
19.A
解析:A
【解析】反应后二氧化碳和氧化钙的质量都减小了,是反应物,碳酸钙的质量增大了,是生成物,该反应是二氧化碳和氧化钙反应生成碳酸钙;A 、该反应是化合反应,正确;B 、氧化钙在反应中不是催化剂,是反应物,错误;C 、该反应中二氧化碳是反应物,错误;D 、反应中CaO 和CaCO ,的质量比为56: 100,错误;故选A 。
20.B
解析:B
【解析】
【分析】
【详解】
A 、氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,可见随着氯化钾的质量增加,氧气的质量增加,Δ3222KClO 2MnO 24514KCl +3O 996
↑,且质量比为: 149:96=49.7:32,不符合质量比关系,错误;
B 、氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,可见随着氯酸钾反应的质量增加,氧气的质量增加,Δ3222KClO 2MnO 24514KCl +3O 996
↑,且质量比为:245:96=24.5:32,符合题
意,正确;
C 、氯酸钾在二氧化锰的催化作用下生成氨化钾和氧气,二氧化锰作催化剂,反应前后质量不变,氧气的生成质量与二氧化锰无关,故图象与实验操作过程不对应,错误;
D 、氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,随着固体混合物质量的减少,氧气的质量增加,故图象与实验操作过程不对应,错误。故选B 。
21.B
解析:B
【解析】A 、据图可以看出,t 1℃时,等质量的甲、乙饱和溶液中所含溶质的质量为乙>甲,正确;B 、 t 2℃时,丙的溶解度是30g ,其饱和溶液的溶质质量分数为:
30g 100%30%30100g g
?<+,故不可配制溶质质量分数为30%的丙溶液,错误;C 、将组成在M 点的甲溶液转变为N 点的甲溶液,就是变成不饱和溶液,可加适量水稀释,正确;
D 、t 3℃时,将甲、乙、丙三种物质的饱和溶液降温至t 2℃,甲和乙的溶解度减小,形成t 2℃时的饱和溶液,根据溶解度可以看出,乙的溶质质量分数大于甲,而丙的溶解度随温度的降低而减小,根据图象可以看出,丙的溶质质量分数小于甲,故所得溶液溶质质量分数的大小关系为乙>甲>丙,正确。故选B 。
22.A
解析:A
【解析】
A 、食盐和高锰酸钾都能溶于水,能够达到实验目的;
B 、铜和盐酸不能发生反应,不能够达到实验目的;
C 、由于温度不一样,因此无法比较催化剂对反应快慢的影响,该选项不能达到实验目的;
D 、实验1中蜡烛由下而上依次熄灭,说明二氧化碳密度比空气大,不燃烧,也不支持燃烧,实验2中澄清石灰水变浑浊,说明二氧化碳能使澄清石灰水变浑浊,实验1和实验2探究的化学性质不同,不能够达到实验目的。故选A 。
23.D
解析:D
【解析】
提纯含少量氯化钠杂质的硝酸钾,结合流程可知,操作Ⅰ为溶解,二者溶解度受温度影响不同,采取冷却热饱和溶液法分离出硝酸钾,则操作Ⅱ为蒸发浓缩,冷却结晶,操作Ⅲ是过滤、洗涤;A 、提纯含少量氯化钠杂质的硝酸钾,结合流程可知,操作Ⅰ为溶解,操作Ⅱ为蒸发浓缩,冷却结晶,操作Ⅲ是过滤、洗涤,错误;B 、提纯含少量氯化钠杂质的硝酸钾,结合流程可知,操作Ⅰ为溶解,错误;C 、提纯含少量氯化钠杂质的硝酸钾,结合流程可知,操作Ⅱ为蒸发浓缩,冷却结晶,错误;D 、提纯含少量氯化钠杂质的硝酸钾,结合流程可知,操作Ⅲ是过滤,将硝酸钾晶体从溶液中分离出来,正确。故选D 。
24.D
解析:D
【解析】
由图示可知反应前后存在相同的分子,故该图示可转化为如图的反应图示:
依据反应前后物质的分子结构可知反应物是氧气和
硫化氢生成物是水和二氧化硫,则反应方程式为:3O2+2H2S2H2O+2SO2;A、由图示或化学方程式都可以看出该反应生成物有两种,错误;B、置换反应要求反应物生成物均是一种单质与一种化合物,而该反应的生成物是两种化合物,所以不是置换反应,错误;C、由方程式可知,反应前后分子的个数有改变,错误;D、由图示或化学方程式都可以看出反应物H2S与O2的分子个数比为2:3,正确。故选D。
25.B
解析:B
【解析】根据金属活动性强弱关系锌>氢>铜>银,将铜锌合金的粉末加入到硝酸银溶液中,锌先与硝酸银发生反应,待锌完全反应后,铜再与硝酸银发生反应,可见锌的量会对反应结果产生很大影响;向充分反应后所得滤渣中滴加少量的稀盐酸,有气泡产生,说明反应后剩余固体中还含有锌。
解:A、向充分反应后所得滤渣中滴加少量的稀盐酸,有气泡产生,说明反应后剩余固体中还含有锌。则滤液中的溶质一定不含硝酸铜;故A错误;
B、向充分反应后所得滤渣中滴加少量的稀盐酸,有气泡产生,说明反应后剩余固体中还含有锌。则所得滤液中的溶质一定不含有硝酸银;故B正确;;
C、向充分反应后所得滤渣中滴加少量的稀盐酸,有气泡产生,说明反应后剩余固体中还含有锌。则滤渣中一定含有银和锌,故错误;
D、向充分反应后所得滤渣中滴加少量的稀盐酸,有气泡产生,说明反应后剩余固体中还含有锌。则滤渣中一定含有铜;故D错误。
故选B。
点睛:将活动性强的金属混合物放入活动性弱的金属的盐溶液中,金属由强到弱依次与盐发生反应,即金属混合物中活动性最弱的金属首先与盐溶液发生反应,依次类推。
二、流程题
26.Ba(OH)2取滤液Ⅱ少量,加入足量CaCl2溶液(或BaCl2溶液等),有白色沉淀生成,证明有K2CO3;静置后取上层清液滴加酚酞溶液,溶液变成红色,证明有KOH。
K2CO3+CaCl2=CaCO3↓ +2KCl
【解析】
【分析】
由KCl、MgSO4和CaCl2组成的固体混合物,加水溶解,然后加过量的氢氧化钡溶液,硫酸镁和氢氧化钡反应生成硫酸钡和氢氧化镁白色沉淀,过滤后,滤液Ⅰ中为氯化钾、氯化钙和氢氧化钡混合溶液,向滤液Ⅰ中加入过量的碳酸钾溶液,氯化钙和碳酸钾反应生成碳酸钙白色沉淀和氯化钾,氢氧化钡和碳酸钾反应生成碳酸钡白色沉淀和氢氧化钾,过滤后,
向滤液Ⅱ加盐酸,蒸发即可得到固体氯化钾。
【详解】
(1)由分析可知,M 溶液中的溶质是Ba(OH)2。
(2)滤液Ⅱ为碳酸钾、氢氧化钾、氯化钾的混合物,碳酸钾、氢氧化钾都显碱性,都能使酚酞变红色,所以设计实验证明滤液Ⅱ中除KCl 外的其他溶质是:取滤液Ⅱ少量,加入足量CaCl 2溶液(或BaCl 2溶液等),有白色沉淀生成,证明有K 2CO 3;静置后取上层清液滴加酚酞溶液,溶液变成红色,证明有KOH ;
(3)氢氧化钾、碳酸钾都会与稀盐酸反应生成氯化钾,碳酸钾为后加入的,碳酸钾和氯化钙反应生成碳酸钙沉淀和氯化钾,化学方程式为:K 2CO 3+CaCl 2=CaCO 3↓+2KCl 。
27.A 过滤 玻璃棒 34NH HCl NH Cl += 碱石灰
432230022H O MgO NH CI
NH MgCI +↑++↑℃ c 增大NH 4+的浓度,使NH 4Cl 更多
地析出
【解析】
【分析】
【详解】 (一)(1)氨气易溶于水,二氧化碳在水中溶解度较小,因此过程Ⅰ应该先通入NH 3后通入CO 2,故答案为:先通NH 3,后通CO 2,选A ;
(2)NaHCO 3在水中溶解度相对比较小,以沉淀形式析出,操作后体系变成沉淀和滤液,故操作为过滤;过滤操作使用的玻璃仪器为烧杯、漏斗、玻璃棒。
(二)(1)直接加热NH4Cl 生产NH3和HCl ,温度降低后NH 3和HCl 又化合生成氯化铵,导致产率往往很低,故答案为:34NH HCl NH Cl +=
(2)低于300℃时获得NH 3,干燥管应该盛装碱石灰; 根据题意,氧化镁和氯化铵加热时生成了氨气,同时生成氯化镁和水,反应的化学反应方程式为:
432230022H O MgO NH CI NH MgCI +↑++↑℃;氯化氢极易溶于水,安全瓶可以选择c 装置,防止倒吸,影响实验;氨气溶于水后生成氨水,氨水电离成铵根,增大铵根的浓度有利于氯化铵的析出来,另外通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度,故填:增大NH 4+的浓度,使NH 4Cl 更多地析出。
28.+4, SO 3+H 2O=H 2SO 4 。 引流, 滤纸破损(其他合理答案均给分)。 CuCl 难溶于水 NaCl (填化学式)。
【解析】
本题是流程题。考查了元素化合价的计算,混合物的分离,化学方程式的书写等。根据题中提供的信息结合已有的知识进行分析解答。
(1)在Na 2SO 3中,钠元素显+1价,氧元素显-2价,设:硫元素的化合价为x ,在化合物中元素的化合价的代数和为零。则有(+1)×2+x+(-2)×3=0,x=+4;SO 3能迅速与水化合生成硫酸,化学方程式为:SO 3+H 2O=H 2SO 4;
(2)“操作a”是将固体与液体分离,操作a 是过滤,过滤中的玻璃棒的作用是引流;若得到的滤液2有浑浊,原因可能是滤纸破损等;
(3)可用“水洗”的原因是CuCl 难溶于水,能够除去可溶性杂质;
(4)根据流程图可知,本流程中可以循环利用的物质(水除外)是NaCl 。
点睛:分析流程中的每一步骤是解题的基础,一般从以下几个方面了解流程:①反应物是什么,②发生了什么反应,③该反应造成了什么后果,对制造产品有什么作用。抓住一个关键点:一切反应或操作都是为了获得产品而服务。
29.蒸发 ()222NaOH + MgCl = Mg OH + 2NaCl ↓ 除去滤液中的 NaOH 和 Na 2CO 3
【解析】
【分析】
粗盐中含有少量沙土、CaCl 2和 MgCl 2,加蒸馏水溶解过滤后,滤液中有氯化钠、氯化钙、氯化镁,加入过量NaOH 除去 MgCl 2,但是会带入多余的NaOH ,再加入碳酸钠除去CaCl 2,过滤后,滤液中有NaCl 、NaOH 和Na 2CO 3,加入稀盐酸除去NaOH 和Na 2CO 3,再进行蒸发结晶得到NaCl 固体。
【详解】
(1)通过蒸发操作可将溶质从溶液中结晶出来;故答案为:蒸发;
(2)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,化学方程式为:
()222NaOH + MgCl = Mg OH + 2NaCl ↓;故答案为:
()222NaOH + MgCl = Mg OH + 2NaCl ↓;
(3)前面加入过量的氢氧化钠和碳酸钠会混入溶液中,所以加入试剂B 稀盐酸是为了除去过量的氢氧化钠和碳酸钠。故答案为:除去滤液中的 NaOH 和 Na 2CO 3。
30.硫酸和块状大理石反应生成微溶的硫酸钙附着在碳酸钙的表面,阻止反应的继续进行 漏斗 HCl 、CaCl 2、FeCl 3 3NH 3?H 2O+FeCl 3=Fe (OH )3↓+3NH 4Cl (NH 4)2CO 3
【解析】
【分析】
【详解】
(1)稀盐酸不能用稀硫酸代替,原因是硫酸和块状大理石反应生成微溶的硫酸钙附着在碳酸钙的表面,阻止反应的继续进行。
(2)操作a 、b 、c 都是将固体和液体分离的操作,为过滤,所以需要用到的玻璃仪器有烧杯、玻璃棒和漏斗。
(3)二氧化硅和酸不反应,氧化铁和稀盐酸反应生成氯化铁和水,碳酸钙和稀盐酸反应生成氯化钙和水和二氧化碳,盐酸过量,可知滤液A 中含有的溶质是氯化氢和氯化钙和氯化铁,化学式HCl 、CaCl 2、FeCl 3;氯化铁和氨水反应生成Fe (OH )3和氯化铵,对应的化学方程式为 3NH 3?H 2O+FeCl 3=Fe (OH )3↓+3NH 4Cl 。
(4)氨水和过量盐酸以及氯化铁反应都生成氯化铵,因此滤液B 中含有生成的氯化铵、氯化钙和过量的NH 3?H 2O ,加入试剂X ,恰好完全反应,且滤液C 中只含有两种溶质,同时还要生成碳酸钙,则X 是碳酸盐,则滤液C 中一定含有氨水和氯化物,根据复分解反应的条件可知加入的X 的化学式为 (NH 4)2CO 3,碳酸铵和氯化钙反应生成碳酸钙沉淀和氯化铵,所得溶质为氨水和氯化铵。
【点睛】
首批河南省示范性普通高中名单 郑州市 郑州市第一中学郑州市外国语学校郑州市第四中学郑州市第七中学郑州市第十一中学巩义市第二中学郑州铁路第一中学 开封市 开封市高级中学 洛阳市 洛阳市第一高级中学偃师市高级中学孟津县第一高级中学 洛阳轴承集团有限公司第一中学中国一拖集团有限公司高级中学 平顶山市 平顶山市第一中学平顶山市第一高级中学 安阳市 安阳市第一中学安阳市实验中学林州市第一中学汤阴县第一中学鹤壁市 鹤壁市高级中学 新乡市 新乡市第一中学辉县市第一中学卫辉市第一中学长垣县第一中学焦作市 焦作市第一中学温县第一高级中学沁阳市第一中学 濮阳市 濮阳市第一高级中学中原油田第一中学 许昌市
许昌市高级中学襄城县高级中学 漯河市 漯河市高级中学临颍县第一高级中学 三门峡市 三门峡市第一高级中学灵宝市第一高级中学 南阳市 南阳市第一中学桐柏县实验高级中学内乡县高级中学 西峡县第一高级中学 商丘市 商丘市第一高级中学睢县高级中学虞城县高级中学夏邑县高级中学信阳市 信阳市高级中学固始县高级中学光山县第二高级中学 周口市 周口市第一高级中学扶沟县高级中学淮阳中学项城市第一高级中学驻马店市 驻马店市高级中学上蔡县第一高级中学遂平县第一高级中学 济源市 济源市第一中学 直属 河南省实验中学河南大学附属中学河南师范大学附属中学 第二批河南省示范性普通高中名单 郑州市
郑州市回民中学郑州市第二中学郑州市第四十七中学郑州中学郑州市铁六中学郑州市第十九中学北大附中河南分校中牟县第一高级中学 郑州市第九中学 开封市 开封市第二十五中学杞县高级中学尉氏县第三高级中学 兰考县第一高级中学 洛阳市 新安县第一高级中学宜阳县第一高级中学栾川县第一高级中学伊川高中平顶山市 平顶山市实验高级中学(平煤集团一高)宝丰县第一高级中学叶县高级中学安阳市 安阳县第二高级中学安阳县第一高级中学 滑县第一高级中学内黄县第一中学安阳市第二中学 鹤壁市 浚县第一中学鹤壁市外国语中学 新乡市 新乡市第二中学辉县市高级中学封丘县第一中学 焦作市 焦作市第十一中学武陟县第一中学修武县第一中学 濮阳市 华龙区高级中学南乐一中清丰县第一高级中学 许昌市
河北省衡水十三中新高一分班考试化学 一、选择题 1.下列从左到右依次代表ABCD四个图像中,能正确表示对应变化关系的是() A.向氢氧化钠和碳酸钠的混合溶液中滴加盐酸 B.向一定量稀硫酸中加水稀释C.加热等质量的氯酸钾制取氧气 D.向饱和氢氧化钙溶液中加入CaO 2.除去下列各物质中混有的少量杂质(括号内为杂质),所用试剂及方法不正确 ...的是A.N2(O2)——将气体通过灼热且足量的Cu粉 B.铜粉(CuO)——通入足量的CO气体并加热 C.烧碱溶液(Na2CO3)——加入过量的Ca(OH)2溶液,过滤 D.CaCl2溶液(盐酸)——加入过量的CaCO3固体,过滤 3.下列图像能正确反映其对应关系的是 A.向氢氧化钠溶液中加水稀释 B.浓硫酸敞口放置一段时间 C.向饱和石灰水中加入少量生石灰 D.催化剂对过氧化氢分解的影响 4.除去下列各物质中混有少量杂质,所用试剂正确的是
选项物质杂质所用试剂 A镁粉铁粉稀硫酸 B N2O2灼热的铜网 C稀盐酸MgCl2KOH溶液 D NaCl Na2SO4Ba(NO3)2溶液 A.A B.B C.C D.D 5.下列除杂(括号内为杂质)选用的试剂或方法正确的是 ( ) A.CuO(C):隔绝空气高温加热 B.N a2SO4溶液(N a OH):加适量稀盐酸 C.CO2(HCl):将气体通入足量的氢氧化钠溶液 D.CaCl2溶液(HCl):加入过量碳酸钙,充分反应后过滤 6.下列归纳和总结完全正确的一组是 A.化学与生活B.化学与安全 ①用甲醛可保鲜海产品 ②用熟石灰改良酸性土壤 ③用生石灰作食品干燥剂①点燃氢气前一定要检验纯度 ②进行化学实验时配戴护目镜 ③发现厨房中天然气泄漏马上拨打119报警 C.化学与资源D.化学与发现 ①塑料的使用一定程度上保护了金属资源 ②稀土是宝贵的不可再生资源 ③海洋中蕴藏着丰富的化学资源①卢瑟福确定了原子的核式结构 ②拉瓦锡第一个发现并提出了质量守恒定律 ③门捷列夫发现元素周期律并编制元素周期表 A.A B.B C.C D.D 7.取一定量的氧化铁与氧化铜的混合物,加入稀硫酸(含0.2molH2SO4),恰好完全反应成盐和水.原混合物中氧元素的质量是 A.12.8 g B.6.4g C.3.2g D.1.6g 8.下列曲线能正确表达对应的反应或过程的是
2020-2021新乡市第一中学小学一年级数学上期末模拟试卷及答案 一、选择题 1.女生有6人,男生有8人,坐一辆车去动物园,()座的车最合适? A. 12座 B. 15座 C. 20座 2.小军做了8朵,小方做了7朵,一共做了________朵.() A. 5 B. 1 C. 15 D. 11 3.看图列式计算,正确的是() A. 6-6=0(棵) B. 6+6=12(棵) C. 12-6=6(棵) D. 12-8=6(棵) 4.停车场原来停了9辆汽车,后来又开来了5辆,停车场现在停了( ) A. 4 B. 5 C. 14 D. 13 5.秒针走半圈经过的时间是() A. 5秒半 B. 30秒 C. 60秒 6.哪个算式得数最小?() A. 6+6 B. 4+7 C. 15-10 7.从星期五到星期日放假,放了()天假。 A. 2天 B. 3天 C. 4天 8.数一数,下图是由()个小正方体搭成的。 A. 7 B. 5 C. 6 9.妈妈给红红和东东同样多的糖果。()剩下的糖果多 A. 红红 B. 东东 C. 无法判断 10.左边数起的第6个,就是右边数起的第()个。
A. 2 B. 3 C. 4 D. 5 11.比48大一些的数是( )。 A. 52 B. 30 C. 45 D. 96 二、填空题 12.这一排共有________个小朋友。 13.在横线上填上“>”、“<”或“=”。 7+6________14 18-3________7+7 6+5________12 6+8________6+9 6+9________9+6 12________6+6 6+8________13 8+7________9+6 13+2________11 14.看表填时间。 ________时 ________时 快________时 ________时 15.在横线上填上“ ”,“ ”或“=” 17________9 14+2________18 16-3________8+4
【学习目标】 ●掌握重点词汇acquire, urge, inspire, beneficial 短语be accustomed to, tend to…, approve of 及句式It +be+adj.+that…的用法; ●通过连词和指示代词理解文章。 【整体阅读】 读课文,做《学习指导》第66页的判断正误及语篇理解。 1. 【词组句型互译】 (1) to start with: to begin with (= at first 为一独立成分,置句首) ___________________________________________ (2) 获得知识_________________________ (3) 习惯于__________________________ = be used to (4) 搜索引擎__________________________ (5) spit out __________________________ (6) go against __________________________ (7) come to one’s defence _________________________ 联想拓展:come for one’s defence _________________________ come to one’s help _________________________ come for one’s help __________________________ (8) make assumptions ___________________________ (9) put forward ___________________________ (10) approve of ___________________________ (11) 值得尊重的人物___________________________ (12) at times ______________ 区别: at all times ____________________ (13) 换句话说_________________________ (14) 舒服地坐着,袖手旁观_______________________ (15) be vital to __________________________ (16) be beneficial to _________________________ 2. 【问题导学】 (1)What does the writer advise us to do first to understand things in your mind? ____________ A. Asking somebody for help B. Discussing with others C. Asking questions
四川省泸州市泸化中学高一新生分班考试化学试卷(含答案) 一、选择题 1.下列四个图像分别表示对应的四种操作过程,其中正确的是: A.加热等质量的氯酸钾制氧 B.含有水蒸气的氢气通过浓硫酸 C.引淡水浸泡盐碱地 D.向硝酸钡溶液中滴加稀硫酸 2.除去物质中的少量杂质,下列方法不能达到目的的是() 选项物质杂质除去杂质的方法 A CaO CaCO3高温充分煅烧 B KCl溶液CaCl2通入足量的CO2,过滤 C CO2CO通过足量的灼热氧化铜 D H2HCl依次通过足量的NaOH溶液和浓硫酸 A.A B.B C.C D.D 3.下列图像能正确反映其对应关系的是 A.向氢氧化钠溶液中加水稀释 B.浓硫酸敞口放置一段时间 C.向饱和石灰水中加入少量生石灰
D.催化剂对过氧化氢分解的影响 4.除去下列各物质中混有少量杂质,所用试剂正确的是 选项物质杂质所用试剂 A镁粉铁粉稀硫酸 B N2O2灼热的铜网 C稀盐酸MgCl2KOH溶液 D NaCl Na2SO4Ba(NO3)2溶液 A.A B.B C.C D.D 5.甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示。下列说法正确的是 A.t1℃时,甲溶液中溶质的质量分数一定等于乙溶液 B.降低温度,可使甲的饱和溶液变为不饱和溶液 C.t2℃时,分别在100 g水中加入50 g 甲、乙,同时降温至t1℃,甲、乙溶液均为饱和溶液 D.将t2℃时甲的饱和溶液降温至t1℃,溶液质量不变 6.等质量的镁、铝、锌分别与相同质量20%的盐酸充分反应,产生氢气的质量大小关系的猜测:①Al>Mg>Zn; ②Al=Mg=Zn; ③Al=Mg>Zn; ④Al=Zn>Mg; ⑤Al>Mg=Zn.其中错误的个数为 A.5个 B.2个 C.3个 D.4个 7.甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是()
2020-2021新乡市第一中学七年级数学下期末模拟试卷及答案 一、选择题 1.如图,直线BC与MN相交于点O,AO⊥BC,OE平分∠BON,若∠EON=20°,则 ∠AOM的度数为() A.40°B.50°C.60°D.70° 2.如图,将△ABC沿BC方向平移3cm得到△DEF,若△ABC的周长为20cm,则四边形ABFD 的周长为() A.20cm B.22cm C.24cm D.26cm 3.将一块直角三角板ABC按如图方式放置,其中∠ABC=30°,A、B两点分别落在直线m、n上,∠1=20°,添加下列哪一个条件可使直线m∥n( ) A.∠2=20°B.∠2=30°C.∠2=45°D.∠2=50° 4.如图所示的表格是某次篮球联赛部分球队的积分表,则下列说法不正确的是()队名比赛场数胜场负场积分 前进1410424 光明149523 远大147a21 卫星14410b 钢铁1401414
… … … … … A .负一场积1分,胜一场积2分 B .卫星队总积分b =18 C .远大队负场数a =7 D .某队的胜场总积分可以等于它的负场总积分 5.若不等式组20{ 210x a x b +---><的解集为0<x <1,则a ,b 的值分别为( ) A .a =2,b =1 B .a =2,b =3 C .a =-2,b =3 D .a =-2,b =1 6.如图,如果AB ∥CD ,那么下面说法错误的是( ) A .∠3=∠7 B .∠2=∠6 C .∠3+∠4+∠5+∠6=180° D .∠4=∠8 7.在平面直角坐标系内,线段CD 是由线段AB 平移得到的,点A (-2,3)的对应点为C (2,5),则点B (-4,-1)的对应点D 的坐标为() A .()8,3-- B .()4,2 C .()0,1 D .()1,8 8.如图,已知两直线1l 与2l 被第三条直线3l 所截,下列等式一定成立的是( ) A .12∠∠= B .23∠∠= C .24∠∠+=180° D .14∠∠+=180° 9.在直角坐标系中,若点P(2x -6,x -5)在第四象限,则x 的取值范围是( ) A .3<x <5 B .-5<x <3 C .-3<x <5 D .-5<x <-3 10.下列图中∠1和∠2是同位角的是( ) A .(1)、(2)、(3) B .(2)、(3)、(4) C .(3)、(4)、(5) D .(1)、(2)、(5) 11.将点A (1,﹣1)向上平移2个单位后,再向左平移3个单位,得到点B ,则点B 的 坐标为( ) A .(2,1) B .(﹣2,﹣1) C .(﹣2,1) D .(2,﹣1)
2017年博爱一中高二第一次月考 物理试题 (考试时间:90分钟总分:100分) 一、选择题(共12小题,每小题4分,共48分。有的有一个选项符合题目要求,有的有多项符合题目要求,全选对得4分,选不全的得2分,有选错的得0分) 1.某人分别用如图所示的两种姿势吊在单杠上保持静止状态,下列说法正确的是() A.人对单杠的作用力,图甲大于图乙 B.人对单杠的作用力,图甲小于图乙 C.人手臂的拉力,图甲大于图乙 D.人手臂的拉力,图甲小于图乙 2.(多选)如图甲所示,在直铁棒上有两匝线圈,线圈n1=20匝,n2=400匝,原线圈输入电压u1随时间变化如图乙所示,则( ) A.电压表读数为V B.电压表读数为200V C.副线圈交流电的周期为0.02s D.滑动变阻器滑片向下滑动,则电路输入功率变大 3.如图所示,一固定斜面上两个质量相同的小物块和B紧挨着一起匀速下滑,与B的接触面光滑.已知与斜面之间的动摩擦因数是B与斜面之间动摩擦因数的2倍,斜面倾角为α,B与斜面之间的动摩擦因数是( )
A.2 tan 3 α B. 2 3tanαC.tanαD. 1 tanα 4.如图所示,一电子束垂直于电场线与磁感线方向入射后偏向A极板,为了使电子束沿射入方向做直线运动,可采用的方法是() A. 将变阻器滑动头P向右滑动 B.将变阻器滑动头P向左滑动 C.将极板间距离适当减小 D.将极板间距离适当增大 5. 下列说法中正确的() A.质量一定的物体,若动能发生变化,则动量不一定变化 B.质量一定的物体,若动量发生变化,则动能必定变化 C.若物体所受的合外力不为零,其动能不可能总是不变 D.若物体所受的合外力不为零,其动量不可能总是不变 6. 2013年斯诺克上海沃德大师赛于9月16日至22日在上海体育馆举行.如图为丁俊晖正在准备击球,设丁俊晖在这一杆中,白色球(主球)和花色球碰撞前后都在同一直线上运动,碰前白色球的动量为p A=5kg.m/s,花色球静止,白球A与花色球B发生碰撞后,花色球B的动量变为p B′=4kg?m/s,则两球质量mA与mB间的关系可能是() A. m B=m A B.m B=m A C.m B=m A D.m B=6m A 7.如图所示,在光滑水平面上,有一质量为M=3 kg的薄板和质量为m=1 kg的物块,都以v=4 m/s 的初速度朝相反方向运动,它们之间有摩擦,薄板足够长,当薄板的速度为2.4 m/s时,物块的运动情况是() A.做加速运动 B.做减速运动 C.做匀速运动 D.以上运动都可能 8.如图所示为卢瑟福α粒子散射实验装置的示意图,图中的显微镜可在圆周轨道上转动,通过显微镜前相连的荧光屏可观察α粒子在各个角度的散射情况.下列说法中正确的是()
高一实验班分班考试化学试卷(1) 一、选择题 1.已知A、B、C、D、E分别是初中化学中所学常见物质,它们之间相互转化的关系如图所示,“→”表示物质相互之间的转化,“—”表示物质之间能发生反应,A、B、C、E分别属于不同类别的化合物,A与C、E与C之间的反应产物完全相同,E在农业上可用于改良酸性土壤。下列叙述错误的 A.上述五种物质之间相互转化的化学反应类型中不包含置换反应 B.D与水反应生成酸,A与水反应生成碱 C.可用水除去E中含有的少量A杂质 D.B、D两种物质在一定条件下,不能互相转化 2.除去下列各物质中混有的少量杂质(括号内为杂质),所用试剂及方法不正确 ...的是A.N2(O2)——将气体通过灼热且足量的Cu粉 B.铜粉(CuO)——通入足量的CO气体并加热 C.烧碱溶液(Na2CO3)——加入过量的Ca(OH)2溶液,过滤 D.CaCl2溶液(盐酸)——加入过量的CaCO3固体,过滤 3.有一包白色固体样品,可能由硫酸钠、氢氧化钠、碳酸钙、氯化钡、氯化镁中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行实验。 下列说法不正确的是 A.滤渣a的成分是碳酸钙和氢氧化镁 B.滤液中溶质的成分除氯化钠还有氢氧化钠、硫酸钠 C.白色沉淀b的成份是碳酸钡 D.若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,则不能确定原样品中一定存在氯化镁 4.下列图像能正确反映其对应关系的是
A.向氢氧化钠溶液中加水稀释 B.浓硫酸敞口放置一段时间 C.向饱和石灰水中加入少量生石灰 D.催化剂对过氧化氢分解的影响 5.下列四个图像中,能正确反映对应关系的是A.一定温度下,向一定量水中加入KNO3固体B.加热一定量的高锰酸钾固体 C.向一定量的硫酸铜溶液中加入铁粉
新小升初数学模拟试题(1) 一、选择 1.一桶纯净水20() A. ml B. L C. D. 2.10以内所有质数的和是( )。 A. 18 B. 17 C. 26 D. 19 3.与方程6x-15=43的解相等的方程是()。 A. 43-6x=15 B. 15+6x=43 C. 6x-43=15 4.在52的后面加上一个百分号,与原数相比() A. 扩大100倍 B. 缩小100倍 C. 不变 5.生产零件的个数一定,生产每个零件的时间与生产这批零件的总时间() A. 成正比例 B. 成反比例 C. 不成比例 6.用2个边长1厘米的正方形拼成的长方形的周长是()厘米. A. 6 B. 7 C. 8 7.依据折线统计图,下面说法正确的是()。 A. 2010至2017年人均电子书阅读量一直呈上升趋势 B. 2010至2017年人均纸质书阅读量迅速减少 C. 2010至2017年两种阅读方式的阅读量差距越来越大 D. 纸质书比电子书更受人们喜欢 8.一袋上好佳薯片的外包装上写着50g±2g,这袋薯片最多或最少重()g. A. 50,48 B. 51,49 C. 52,48 D. 49,52 9.n表示一个奇数,下面哪个数表示偶数?() A. 2n B. n+2 C. 2n+1 D. 2n-1
10.如图,线段AB绕点A顺时针旋转90°后得到的图形是()。 A. B. C. D. 二、填空。 11.写出下面各数. 四千零二十万________六千零六十亿________ 12.20÷________=________(填小数)= ________= ________=50%= ________ 13.是一个________比例尺,它表示图上6厘米相当于实际距离________米;把它转化为数值比例尺是________。 14.如图,甲圆柱形容器是空的,乙长方体容器水深6.28厘米,若将容器乙中的水全部倒入甲容器,这时水深________厘米。
河南焦作博爱县2018年特岗教师招聘面试方案 【8月26日】 【导语】河南焦作博爱县2018年特岗教师招聘面试方案已发布,面试时间:2018年8月26日,老师现将公告原文发布如下: 1、资格复审时间:8月24日上午8:00---12:00。 2、资格复审地点:博爱县教育局三楼会议室。 3、面试资格审查时,考生需携带:1、面试通知单(在招聘系统内*打印);2、身份证;3、毕业证; 4、教师资格证等证件原件参加资格复审,并在资格复审现场填写《河南省农村义务教育阶段学校特岗教师招聘登记表》(此表由县教育局统一印制,不需考生*打印),考生要认真填写个人基本信息,并粘贴与笔试准考证同一底版照片(4张); 5、通过资格复审的考生方可参加面试。 6、考生如缺少有关材料或没按规定时间参加资格复审,取消其面试资格,责任自负。 二、面试 1、时间:8月26日上午7:10。 2、地点:博爱县第一中学。
3、面试内容及形式:面试主要考察应聘者学科知识、教师基本素养、语言表达能力、仪表举止等,满分为100分。面试采取试讲形式,并进行简短答辩。 4、试讲教材范围及版本 (1)小学试讲教材各学科版本如下: 语文:四年级下册语文版 数学:四年级下册人教版 外语:四年级下册外语教学与研究出版社 音乐:四年级下册人音版 体育:三-四年级人教版 美术:四年级下册人美版 信息技术:四年级下册河南科技 心理健康:七年级大象出版社 (2)初中试讲教材各学科版本如下: 语文:七年级下册人教版 数学:七年级下册北师大 外语:七年级下册人教版 物理:八年级下册人教版 化学:九年级下册人教版 思政:七年级下册人教版
四川省成都外国语学校新高一分班考试化学 一、选择题 1.除去下列各组物质中的杂质,所用试剂和方法均正确的是 物质杂质除杂所用的试剂和方法 A CaO CaCO3加入适量的稀盐酸,蒸发 B H2HCl依次通过NaOH溶液、浓硫酸 C NaOH溶液Ca(OH)2先加入过量的Na2CO3溶液,再过滤 D KCl溶液CuCl2加入氢氧化钠溶液至不再产生沉淀,过滤 A.A B.B C.C D.D 2.现有表面被氧化的镁条样品6g,加入到盛有73g质量分数为19%的稀盐酸的烧杯中恰好完全反应,得到0.2g气体。則原镁条样品中镁元素的质量分数为( ) A.48% B.60% C.76% D.84% 3.下列除杂(括号内为杂质)选用的试剂或方法正确的是 ( ) A.CuO(C):隔绝空气高温加热 B.N a2SO4溶液(N a OH):加适量稀盐酸 C.CO2(HCl):将气体通入足量的氢氧化钠溶液 D.CaCl2溶液(HCl):加入过量碳酸钙,充分反应后过滤 4.下图是甲、乙、丙三种物质的溶解度曲线。下列叙述正确的是 ( ) A.升高丙溶液的温度,一定有晶体析出 B.在t3℃时,分别制成甲、乙的饱和溶液,乙中溶质质量比甲中的小 C.组成为N点的甲溶液可通过增加溶质或恒温蒸发水变为M点的溶液 D.将t3℃时的甲、乙、丙三种物质的饱和溶液降温到t2℃,这三种溶液的溶质质量分数的大小关系是乙>甲=丙 5.下列归纳和总结完全正确的一组是 A.化学与生活B.化学与安全
①用甲醛可保鲜海产品 ②用熟石灰改良酸性土壤 ③用生石灰作食品干燥剂①点燃氢气前一定要检验纯度 ②进行化学实验时配戴护目镜 ③发现厨房中天然气泄漏马上拨打119报警 C.化学与资源D.化学与发现 ①塑料的使用一定程度上保护了金属资源 ②稀土是宝贵的不可再生资源 ③海洋中蕴藏着丰富的化学资源①卢瑟福确定了原子的核式结构 ②拉瓦锡第一个发现并提出了质量守恒定律 ③门捷列夫发现元素周期律并编制元素周期表 A.A B.B C.C D.D 6.等质量的镁、铝、锌分别与相同质量20%的盐酸充分反应,产生氢气的质量大小关系的猜测:①Al>Mg>Zn; ②Al=Mg=Zn; ③Al=Mg>Zn; ④Al=Zn>Mg; ⑤Al>Mg=Zn.其中错误的个数为 A.5个 B.2个 C.3个 D.4个 7.下列除杂方案中(括号中物质是杂质),正确的是() A.N2(O 2):通过红热的木炭 B.烧碱(纯碱):加适量稀盐酸、蒸发 C.Cu(CuO):加过量的盐酸溶液并过滤 D.NaHCO3(Na2CO3):高温煅烧 8.取一定量的氧化铁与氧化铜的混合物,加入稀硫酸(含0.2molH2SO4),恰好完全反应成盐和水.原混合物中氧元素的质量是 A.12.8 g B.6.4g C.3.2g D.1.6g 9.如图所示是A、B、C三种物质的溶解度,下列有关说法错误的是() A.高于20℃以后,B的溶解度比C大 B.10℃时,C接近饱和的溶液升高温度可以达到饱和 C.20℃时,A、B的饱和溶液的溶质质量分数相等 D.35℃时,A物质的饱和溶液的溶质质量分数为30% 10.将一定质量的镁、锌混合物粉末放入到一定质量的硫酸铜溶液中,待反应停止后,过滤得滤渣和滤液,再向滤渣中加入足量的稀盐酸,滤渣部分溶解且有气体生成,则下列说法正确的是() A.滤渣中一定有镁、铜 B.滤渣中一定有镁、锌、铜 C.滤液中一定有硫酸铜和硫酸锌 D.滤液中一定有硫酸镁,一定没有硫酸铜 11.除去下列物质中含有的杂质所选用的试剂或操作方法不正确的一组是()物质所含杂质除去杂质的试剂或方法 A CO依次通过足量的NaOH和浓硫酸 B KCl加入,加热 C NaCl过量盐酸,蒸发
河南新乡市第一中学高一上学期生物期末试卷(有答案) 一、单选题 1.从结构与功能观的角度分析,下列不属于细胞结构与功能相适应的叙述是()A.溶酶体内含有多种水解酶,能分解衰老损伤的细胞器 B.在叶绿体内,合成有机物的同时伴随着能量的储存 C.细胞膜外表面的糖被与细胞表面的识别等功能有关 D.线粒体内膜内折成嵴,增大了有氧呼吸酶的附着面积 2.下列关于“观察洋葱根尖分生组织细胞的有丝分裂”实验的叙述,正确的是()A.制片流程为解离→染色→漂洗→制片 B.显微镜下绝大多数细胞中能观察到染色体 C.龙胆紫溶液或醋酸洋红液可以使染色体着色便于观察 D.可以观察到分裂后期染色体向细胞两极缓慢移动的过程 3.下列关于生物膜结构、功能的叙述,不正确的是() A.细胞膜、内质网膜与小肠黏膜都属于细胞内的生物膜系统 B.细胞膜均以磷脂双分子层为基本结构支架 C.细胞内的囊泡可来自于内质网和高尔基体膜 D.细胞膜上的受体是参与细胞间信息交流的结构 4.光合作用包括光反应和暗反应两个阶段,下列参与暗反应必须的物质是() A.H2O、CO2、ADP B.H2O、CO2、ATP C.CO2、[H]、ATP D.[H]、H2O、ADP 5.以下二倍体生物的细胞中含有两个染色体组的是() ①有丝分裂中期细胞②有丝分裂后期细胞③减数第一次分裂中期细胞④减数第二次分裂中期⑤减数第一次分裂后期细胞⑥减数第二次分裂后期细胞 A.①②③B.①③⑤C.①③⑤⑥D.①④⑤⑥6.下列实验中,加入试剂后不能产生特定颜色的是() A.取成熟香蕉匀浆,用斐林试剂加热检测还原糖 B.黑暗中放置24h的天竺葵叶片,用碘液检测淀粉 C.口腔上皮细胞经健那绿染色后,在显微镜下观察线粒体 D.花生子叶经苏丹III染色后,在显微镜下观察脂肪颗粒 7.下列有关细胞膜上的糖蛋白和载体蛋白叙述错误的是() A.膜上的载体蛋白和糖蛋白都具有特异性 B.膜上的糖蛋白具有识别并接受信号分子的作用 C.膜上的载体蛋白具有降低化学反应活化能的作用 D.糖蛋白和载体蛋白空间结构不同导致功能不同 8.将植物栽培在适宜的光照、温度和充足的CO2条件下,如果在2h时,将环境中某一条件改变,此时,叶肉细胞中的C3、C5、ATP含量变化如图。那么改变的条件是()
湖北省安陆市第一高级中学新高一分班考试化学 一、选择题 1.下列有关图像的描述,正确的是() A.加水稀释浓盐酸 B.点燃一定质量的镁带 C.一定质量锌粒放入稀硫酸中 D.电解水 2.除去下列各物质中混有少量杂质,所用试剂正确的是 选项物质杂质所用试剂 A镁粉铁粉稀硫酸 B N2O2灼热的铜网 C稀盐酸MgCl2KOH溶液 D NaCl Na2SO4Ba(NO3)2溶液 A.A B.B C.C D.D 3.现有表面被氧化的镁条样品6g,加入到盛有73g质量分数为19%的稀盐酸的烧杯中恰好完全反应,得到0.2g气体。則原镁条样品中镁元素的质量分数为( ) A.48% B.60% C.76% D.84% 4.下列四个图像中,能正确反映对应关系的是 A.一定温度下,向一定量水中加入KNO3固体 B.加热一定量的高锰酸钾固体
C.向一定量的硫酸铜溶液中加入铁粉 D.向一定量的MnO2中加入H2O2溶液 5.甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示。下列说法正确的是 A.t1℃时,甲溶液中溶质的质量分数一定等于乙溶液 B.降低温度,可使甲的饱和溶液变为不饱和溶液 C.t2℃时,分别在100 g水中加入50 g 甲、乙,同时降温至t1℃,甲、乙溶液均为饱和溶液 D.将t2℃时甲的饱和溶液降温至t1℃,溶液质量不变 6.如图所示是A、B、C三种物质的溶解度,下列有关说法错误的是() A.高于20℃以后,B的溶解度比C大 B.10℃时,C接近饱和的溶液升高温度可以达到饱和 C.20℃时,A、B的饱和溶液的溶质质量分数相等 D.35℃时,A物质的饱和溶液的溶质质量分数为30% 7.中和一定质量的稀硫酸,需用m克氢氧化钠,若改用m克氢氧化钾,反应后溶液的PH 应当是() A.<7 B.>7 C.=7 D.无法确定 8.利用废硫酸制备K2SO4的流程如下图.则下列说法不正确的是 A.流程中CaCO3可循环使用 B.将CaCO3研成粉末的目的使反应更充分 C.M和碱混合微热产生无色无味气体 D.洗涤所得晶体,是为了除去表面的杂质 9.取一定质量的CaCO3高温煅烧一段时间后冷却,测得剩余固体为12.8 g,向剩余固体中加入200 g稀盐酸,恰好完全反应,得到208.4 g不饱和溶液。则加热前碳酸钙的质量为A.15 g B.18 g C.20 g D.30 g 10.下列制备物质的设计中,理论上正确,操作上可行。经济上合理的是
2020-2021新乡市第一中学九年级数学上期末模拟试卷及答案 一、选择题 1.关于x 的一元二次方程2(1)20x k x k ---+=有两个实数根12,x x , ()1212122(2)2x x x x x x -+--+3=-,则k 的值( ) A .0或2 B .-2或2 C .-2 D .2 2.下列命题错误..的是 ( ) A .经过三个点一定可以作圆 B .经过切点且垂直于切线的直线必经过圆心 C .同圆或等圆中,相等的圆心角所对的弧相等 D .三角形的外心到三角形各顶点的距离相等 3.已知一次函数()10y kx m k =+≠和二次函数()2 20y ax bx c a =++≠部分自变量和对 应的函数值如表: x … -1 0 2 4 5 … y 1 … 0 1 3 5 6 … y 2 … -1 5 9 … 当y 2>y 1时,自变量x 的取值范围是 A .-1<x <2 B .4<x <5 C .x <-1或x >5 D .x <-1或x >4 4.若⊙O 的半径为5cm ,点A 到圆心O 的距离为4cm ,那么点A 与⊙O 的位置关系是 A .点A 在圆外 B .点A 在圆上 C .点A 在圆内 D .不能确定 5.抛物线2 y ax bx c =++经过点(1,0),且对称轴为直线1x =-,其部分图象如图所示.对于此抛物线有如下四个结论:①abc <0; ②20a b +=;③9a-3b+c=0;④若 0m n >>,则1x m =-时的函数值小于1x n =-时的函数值.其中正确结论的序号是 ( ) A .①③ B .②④ C .②③ D .③④
开学考试化学试卷03——2020年秋季高一新生入学分班考试化学试卷(全国通用) 学校_________ 班级__________ 姓名__________ 学号__________ 一、单选题 1. 我国历史悠久,下列古文明或工艺中一定包含化学变化的是( ) A.打磨磁石制造指南针B.在甲骨文上刻字 C.酿酒工艺D.用石块修长城 2. 下列物质属于纯净物的是( ) A.黄铜B.火碱C.石灰石D.纯净的空气 3. 下列图标,属于“国家节水标志”的是( ) A.B. C.D. 4. 化学与生活紧密相连。下列说法不正确的是( ) A.天然气、瓦斯气等气体和面粉、煤粉等固体粉尘遇明火可能会发生爆炸B.“白色污染”是随意丢弃塑料制品导致的 C.农业上过量使用农药化肥,增加农作物产量 D.大力推广公共交通使用新能源汽车 5. 下列化学实验操作中不正确的是( ) A.B.
C. D. 6. 一些物质的近似pH如图,下列有关说法正确的是( ) A.苹果汁的酸性比纯鲜牛奶的酸性弱 B.肥皂水的碱性比炉具清洁剂的碱性强 C.厕所清洁剂与炉具清洁剂能混用 D.人被某些蚊虫叮咬后可涂抹肥皂水减轻痛痒 7. 如图为元素周期表的一部分,X、Y、Z 代表 3 种不同的元素,以下判断不正确的是( ) A.原子序数:Z>X B.X 的核内质子数为 8 C.Y 和X 化学性质相似D.Y 处于第二周期 8. 下列物质在氧气中燃烧会产生蓝紫色火焰的是( ) A.铁B.木炭C.氢气D.硫 9. 化学与健康息息相关。下列说法正确的是( ) A.摄入足量的钙预防骨质疏松 B.缺乏维生素A会引起坏血病 C.工业用盐可代替食盐用于烹调 D.必需微量元素只能用药物补充 10. 下列物质的用途主要由物理性质决定的是( ) A.氧气用于医疗急救B.氦可用于制造低温环境 C.一氧化碳用于炼铁D.天然气用作燃料
2021届高三一轮复习模拟考试 理 科 数 学(一) 注意事项: 1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。 2.选择题的作答:每小题选出答案后,用2B 铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。 3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。 4.考试结束后,请将本试题卷和答题卡一并上交。 第Ⅰ卷 一、选择题:本大题共12小题,每小题5分,在每小题给出的四个选项中,只有一项是符合题目要求的. 1.已知集合{|02}P x x =≤≤,集合2{|34}Q x x x =+<,则P Q =( ) A .[0,1] B .(1,2] C .[0,2] D .(1,2) 【答案】B 【解析】由2 34x x +<,得13x <<,所以(1,3)Q =,故(1,2]P Q =. 2.已知复数z 满足(2i)1i z -=+,则z =( ) A . 13i 55 + B . 31i 55 + C . 13i 55 - D . 31i 55 - 【答案】C 【解析】1i (1i)(2i)13i 13 i 2i (2i)(2i)555 z ++++= ===+--+,故13i 55z =-. 3.已知3sin 32αα=,则π cos()3 α-的值为( ) A . 13 B .13 - C 3 D .3【答案】C
【解析】因为3sin 3cos 2αα+=,所以13 3(cos sin )122 αα+ =, 即ππ3cos cos sin sin 333αα+= ,所以π3 cos()33 α-=. 4.执行如图所示的程序框图,若输入的6a =,3b =,则输出的x 的值是( ) A .1 B .1- C .0 D .2- 【答案】C 【解析】执行程序框图,6,3,3a b x ===;4,5,1b a x ===;2,4,2b a x ===; 3,3,0b a x ===,此时退出循环,故输出的x 的值是0. 5.2019年10月20日,第六届世界互联网大会发布15项“世界互联网领先科技成果”,有5项成果属于芯片领域,分别为华为高性能服务器芯片“鲲鹏920”清华大学“面向通用人工智能的异构融合天机芯片”、特斯拉“特斯拉全自动驾驶芯片”、寒武纪云端AI 芯片“思元270”赛灵思“Versal 自适应计算加速平台”.若从这15项“世界互联网领先科技成果”中任选3项,则至少有一项属于“芯片领域”的概率为( ) A . 6791 B . 2491 C . 7591 D . 1691 【答案】A 【解析】由已知得,这15项“世界互联网领先科技成果”中有5项成果属于芯片领域. 记“从这15项‘世界互联网领先科技成果’中任选3项,至少有一项属于‘芯片领域’”为事件A , 则A 为“选出的3项都不属于‘芯片领域’”,
博爱一中2020学年第一次月考试卷 高二政治 一、单选题:共30题每题2分共60分 1.我国第一艘航空母舰“辽宁舰”按计划完成建造和试验试航工作后,已正式交付海军。“辽宁”号航空母舰是在苏联“瓦良格号”基础上发展而来的,凝聚了中国舰船人的智慧和心血。从引进到改造,“辽宁”号在防空武器、电子设备、舰载机配备等方面均有不小的创新。这说明( ) ①人能够能动地认识世界和改造世界②实践具有客观物质性和主观能动性 ③树立雄心壮志是实现梦想的基础和前提④改造客观世界的目的在于改造主观世界 A.①② B.②③ C.①④ D.③④ 2.回顾上世纪,物理学在半导体、集成电路、激光、磁性、超导等方面取得了巨大成就。这些成就不仅为生物、医疗、地质学、农业提供了强大的探测手段和研究方法,促进了化学、天文、材料、能源等学科的发展,而且极大地推动了哲学的发展。材料说明了 A.具体科学伴随着哲学的发展而发展 B.具体科学是哲学存在和发展的基础 C.哲学为具体科学提供世界观和方法论的指导 D.哲学和具体科学的研究对象相同 3.根雕艺术是结合自然美和创造美的造型艺术。技工们以树根(包括树身、树瘤、竹根等)的自生形态及畸变形态为艺术创作对象,通过构思立意、艺术加工及工艺处理,创作出人物、动物、器物等,正所谓“三分人工,七分天成”。根雕艺术创作说明
①意识活动具有主动创造性和自主选择性②艺术创作存在自身特有的规律,可随心所欲 ③艺术创作不能破坏事物的本来面貌④艺术创作能实现对创作原型的主观超越 A.①② B.②③ C.①④ D.③④ 4.中国特色社会主义理论体系作为马克思主义中国化的最新成果,具备以下基本特点 ①实现了唯物主义与辩证法的统一②实现了实践基础上的科学性与革命性的统一 ③实现了马克思主义的基本原则与中国具体国情相结合④实现了世界观与方法论的统一 A.①②③ B.②③④ C.①③④ D.①②④ 5.“世界无车日”活动节约的能虽然有限,但是当环保意识深入人心并化为自觉保护环境的实践,就会对全球节能减排事业作出巨大的贡献。这说明: ①实践是主观见之于客观的能动的物质性活动; ②实践是按照主观的内在本性改造世界的活动; ③实践具有能动性、社会性和客观性的突出特点; ④实践是人类应对环境的有效合理的适应性活动。 A.①② B.①③ C.②③ D.③④ 6.繁荣发展哲学社会科学,推进学科体系、学术观点、科研方法创新,鼓励哲学社会科学界为党和人民事业发挥思想库作用,推动我国哲学社会科学优秀成果和优秀人才走向世界。这是因为 ①哲学是关于世界观的科学②哲学社会科学是关于方法论的科学学说③哲学社会科学对社会发展提供世界观和方法论的指导④掌握必备的哲学社会科学知识,对于提高中华民族的整体素质十分重要 A.②③ B.①② C.①④ D.③④
辽宁省沈阳市实验中学高一新生入学分班考试化学_图文 一、选择题 1.黄铜渣中约含Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下图(杂质不溶于水、不参与反应): 下列说法正确的是 A.溶液A中的溶质有2种 B.Ⅰ、Ⅱ中的操作均包含过滤 C.溶液A的质量大于溶液B D.溶液C中溶质的质量分数小于溶液B 2.除去物质中的少量杂质,下列方法不能达到目的的是() 选项物质杂质除去杂质的方法 A CaO CaCO3高温充分煅烧 B KCl溶液CaCl2通入足量的CO2,过滤 C CO2CO通过足量的灼热氧化铜 D H2HCl依次通过足量的NaOH溶液和浓硫酸 A.A B.B C.C D.D 3.现有表面被氧化的镁条样品6g,加入到盛有73g质量分数为19%的稀盐酸的烧杯中恰好完全反应,得到0.2g气体。則原镁条样品中镁元素的质量分数为( ) A.48% B.60% C.76% D.84% 4.除去下列各物质中少量杂质,所选用的试剂和操作方法均正确的是() 选项物质(括号内为杂质)试剂操作方法 A Fe 粉(CuSO4)加水溶解、过滤、洗涤、干燥 B MnO2固体(KC1)加水溶解、过滤、洗涤、干燥 C CO2 (H2)足量氧气点燃 D KNO3溶液(K2SO4)过量Ba(NO3)2溶液过滤 A.A B.B C.C D.D 5.下列四个图像中,能正确反映对应关系的是
A.一定温度下,向一定量水中加入KNO3固体 B.加热一定量的高锰酸钾固体 C.向一定量的硫酸铜溶液中加入铁粉 D.向一定量的MnO2中加入H2O2溶液 6.下列除杂方案中(括号中物质是杂质),正确的是() A.N2(O 2):通过红热的木炭 B.烧碱(纯碱):加适量稀盐酸、蒸发 C.Cu(CuO):加过量的盐酸溶液并过滤 D.NaHCO3(Na2CO3):高温煅烧 7.取一定量的氧化铁与氧化铜的混合物,加入稀硫酸(含0.2molH2SO4),恰好完全反应成盐和水.原混合物中氧元素的质量是 A.12.8 g B.6.4g C.3.2g D.1.6g 8.将6g碳放在盛有12g氧气的密闭容器中燃烧,两者恰好完全反应,此时密闭容器中的物质是 A.CO B.CO2 C.CO、CO2 D.无法确定 9.除去下列各物质中的少量杂质所选用的试剂及操作方法均正确的是() 项目物质杂质(少量)试剂操作方法 A CaO固体CaCO3固体加入适量的稀盐酸过滤、洗涤、干燥 B CO2CO通O2点燃 C NaNO3Na2SO4适量氢氧化钡溶液过滤 D KClO3MnO2水溶解、过滤、蒸发A.A B.B C.C D.D