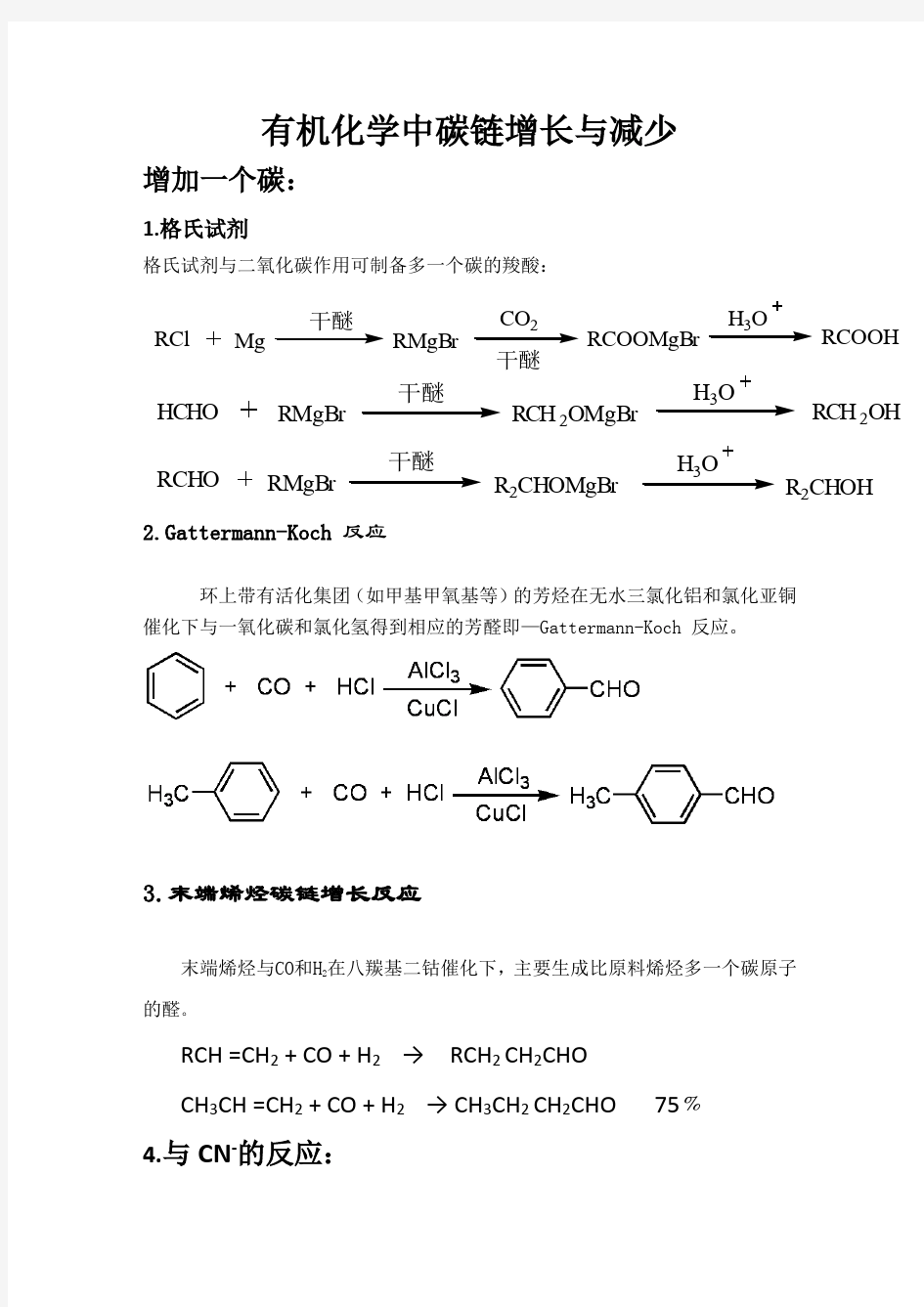
RCl Mg
干醚
RMgBr
干醚
CO2
RCOOMgBr
H3O
RCOOH HCHO RMgBr
干醚
RCH2OMgBr
H3O
RCH2
OH RCHO RMgBr
干醚
R2CHOMgBr
H3O
R2CHOH 有机化学中碳链增长与减少
增加一个碳:
1.格氏试剂
格氏试剂与二氧化碳作用可制备多一个碳的羧酸:
2.Gattermann-Koch反应
环上带有活化集团(如甲基甲氧基等)的芳烃在无水三氯化铝和氯化亚铜
催化下与一氧化碳和氯化氢得到相应的芳醛即—Gattermann-Koch反应。
3.末端烯烃碳链增长反应
末端烯烃与CO和H
2
在八羰基二钴催化下,主要生成比原料烯烃多一个碳原子
的醛。
RCH =CH2 + CO + H2 → RCH2 CH2CHO
CH3CH =CH2 + CO + H2 → CH3CH2 CH2CHO 75﹪
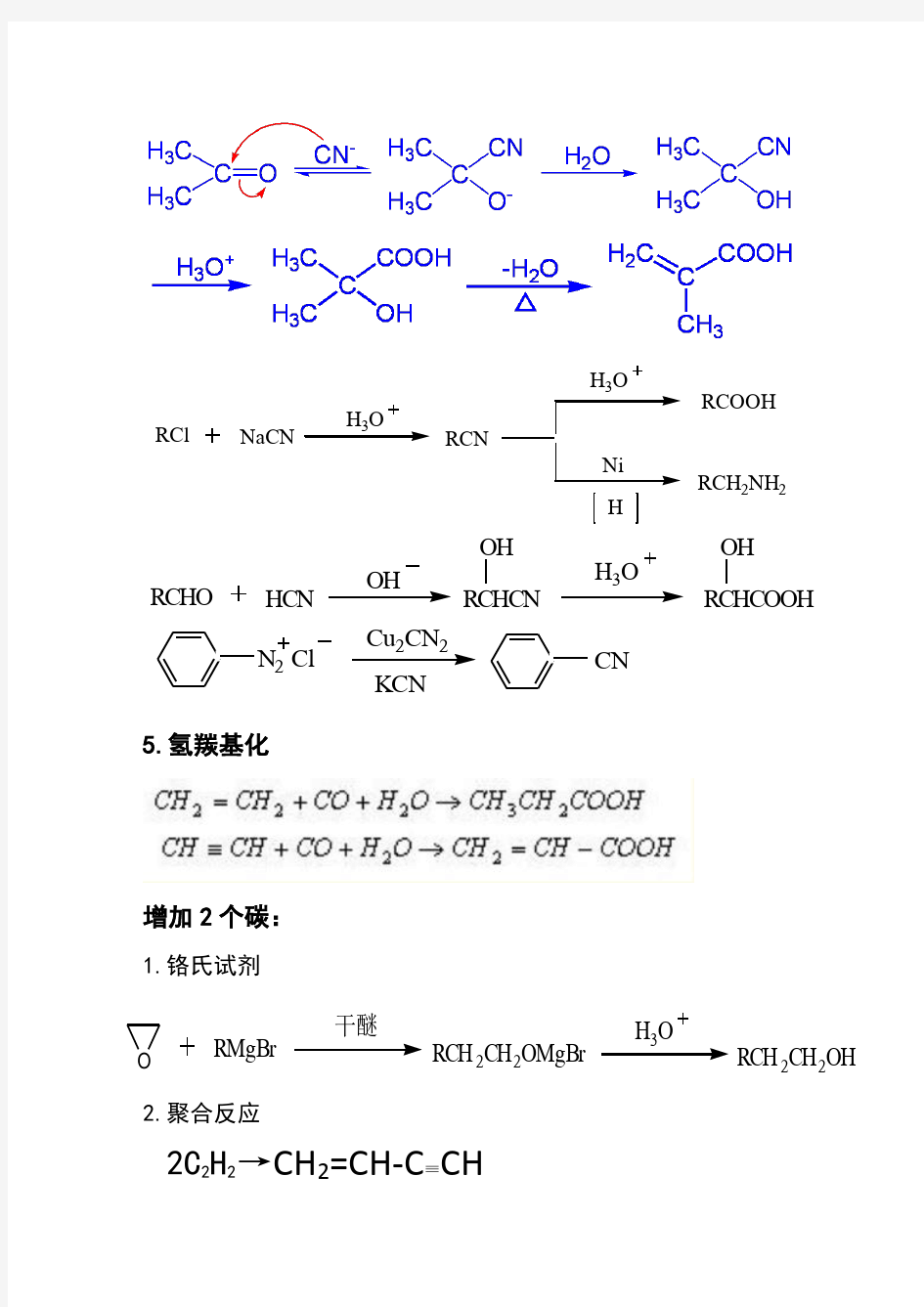
4.与CN-的反应:
RCl
NaCN
H 3O
RCN
H 3O
RCOOH
H
Ni RCH 2NH
2
RCHO HCN
OH
RCHCN
OH
H 3O
RCHCOOH
OH O RMgBr
干醚
RCH 2CH 2OMgBr
H 3O
RCH 2CH 2
OH
N 2 Cl
Cu 2CN 2KCN
CN
5.氢羰基化
增加2个碳:
1.铬氏试剂
2.聚合反应 2C 2H 2
→CH 2=CH-C ≡CH
2.傅克烷基化
+CH
3
CH
2
X-CH2CH3
增加多个碳:
1、自由基聚合
烯在高压下,在体系少量氧的引发下可进行自由基加成的链式反应,最后形成大分子聚合物,共轭双烯尤其容易聚合。改反应可制备高聚物,是合成塑料、橡胶的基础。该反应无法合成特定碳链个数的小分子。
(1)nCH2=CH2-----(引发剂)-----[-CH2-CH2-]-n 加聚反应
引发剂:TiCI4--AI(C2H5)3条件:0.1~1MPa,60~70o C
(2)nCH2=CH--CH3-----(引发剂)-----[-CH2-CH-]-n 加聚反应
|
CH3
3CH3
→
条件:500℃
2、酯化反应
羧酸与醇在酸的催化作用下失去一分子水而生成酯的反应称为酯化反应。(1)1O ROH,2O ROH酯化时按加成-消除机制进行,反应中酰氧键断裂。
CH3COOH + C2H5OH→CH3COOC2H5 + H2O
(2)3O ROH按碳正离子反应机制进行酯化,即:
3、炔烃的亲核加成反应
由于炔烃与烯烃相比,采用的杂化不同,炔烃为SP 杂化,其中S 轨道占有的成分高,对电子的吸引能力强,所以炔烃可一发生亲核加成而烯烃不能,利用这个性质,可以用来延长碳链
这里以乙炔为例。Nu 为带有碳链的亲核基团
C
C
H
H
H Nu
C CH
H
H
Nu
C CH
H
H
Nu
4、 炔钠的应用
缺氢具有一定的酸性,可以与活泼金属,如钠,或氨基钠反应,生成炔负离子。
炔负离子具有较强的亲核性,可以与卤代烃发生亲核取代。
R'C
CNa
+R X
R'C CR
+NaX
如果是乙炔,还可以生成第二个炔钠进行第二次亲核取代。
CH
CH
NaNH 2
RC
CNa
R X
HC CR
HC
CNa
R'X
NaNH 2
RC
CR'
5、傅-克(Friedel-Crafts )烷基化和傅克酰基化
6、格氏试剂
“格氏试剂”是含卤化镁的有机金属化合物,是一类亲核试剂,在有机合成中应用十分广泛。
格氏试剂可以合成氘代烃:
R MgX
D 2O
R D
格氏试剂与醛、酮、酯、环氧烷发生亲核加成反应成相应的醇:
R MgX
R''
R'(H)
O
R
C R'(H)
OMgX
R''
H 3O+
R
C R'(H)
OH R''
9、狄-阿(Diels –Alder )反应 共轭双烯与亲双烯体生成环己烯的反应
CHO
+
CHO
10、武兹反应(Wurtz Reaction )
OH
RCHO RCH2CHO RCHCHCHO
OH
R
RCH CCHO
R
RCH2CHCH2OH
R
RCH CCH2OH
R
Ni
H
LiAlH4
H
武兹反应使两个烃基互相相连为长链,用来合成高级烷烃。
2RX+2Na R-R+2NaX
11、二烃基铜锂
二分子烃基锂与一分子卤化亚铜在醚中、低温下与氮气流和氩气流中进行
RLi+CuX→RCu+LiX RCu+RLi→R2CuLi
12.醛、酮与苯肼反应
>C=O+H2N-NH-C6H5→>C=N-NH-C6H5
13.羟醛缩合反应:
安息香缩合
曼尼希反应
RCNH 2O
Br 2
NaOH
RNH 2NaBr
Na 2CO
3
14.酯缩合:
克莱森
混合酯
碳链的减少:
减少一个碳: 1.甲基酮卤仿反应
R-CO-CH2R‘ + 4NaOH + 3X2 = R
-COONa + 3NaX + R'-CX3
2.霍夫曼降级
3.脱羧反应
RCCH 3
O NaOH
I 2
RCOONa
CHI
3
RCOONa
NaOH
CaO
RH
Na 2CO 3
4.氧化反应
5.羟基酸
6.羰基酸
7.贝耶尔-维立格反应
8..洪赛迪克尔反应
RCH C
R ,
R KMnO 4 , H 3O RCOOH
RCR
,
O
H 2O
RCH C
R
,R
O 3
RCH C R ,R
O O
O
Zn RCR
,O RCH
O
KMnO 4 , H 3O
RCOOH
RC
CR
,R COOH
,
KMnO 4 , H 3O
R
COOH
CN
CN
9.热裂解 CH 3CH 2CH 3-高温、无氧
-------CH 2=CH 2+CH 4
减少两个与多个碳 1.氧化反应
2.高温裂解
3.各类酯的分解
RCOOCH2R﹣﹣﹣﹣RCOOH+RCH2OH
4.酸酐的分解
RCOOOCR+H2O﹣﹣﹣﹣RCOOH+HOCOR RCOOOCR+NH3﹣﹣﹣﹣ROCNH2+HOCOR
5.β-二羟基化合物的酸式、酮式分解
应化11本一110712025 傅良武
自由基的稳定性次序为: (CH3)3C·>(CH3)2CH·>CH3CH2CH2·>CH3· 虽然溴化反应比氯化缓慢,但溴化反应选择性更高:溴化反应速度:叔氢﹕伯氢≈1500 ﹕1 增长碳链:卤代烃与氰化钠反应。 卤代烃的鉴别:卤代烃与硝酸银的乙醇溶液反应,生成硝酸酯和卤化银沉淀 ***碘代烷或三级卤代烷在室温下可与硝酸银的醇溶液反应生成卤代银沉淀,而一级二级氯代烷和溴代烷则需要温热几分钟才能产生卤代银沉淀。 ***苯甲型及烯丙型卤化物的卤素非常活泼,与硝酸银的醇溶液能迅速地进行反应,而卤原子直接连接于双键及苯环上的卤化物则不易发生此反应。 ***两个或多个卤原子连接在同一个碳原子上的多卤代烷,也不起反应。 ***碘化钠可溶于丙酮,而氯化钠和溴化钠都不溶于丙酮,因此可通过氯代烃或溴代烃与碘化钠的丙酮溶液的反应来鉴别氯代烃和溴代烃。 卤代烃的反应活性: ***具有相同烃基结构的卤代烃,RI>RBr>RCl>RF ***卤原子相同,烃基结构不同,3°>2°>1° ***一级卤代烃与亲核试剂发生Sn2反应的速率很快,因此消除反应很少,只有存在强碱和反应条件比较强烈时才以消除产物为主。 ***二级卤代烃:低极性溶剂,强亲核试剂有利于Sn2反应,低极性溶剂,强碱性试剂有利于E2 ***三级卤代烃在无强碱存在时,进行单分子反应;但如有强碱甚至弱碱存在时,主要发生E2反应 取代基的空间体积大,有助于进行消除反应。 氢化铝锂(LiAlH4):很强的还原试剂,所有类型的卤代烃包括乙烯型卤代烃均可被还原,还原反应在溶剂乙醚中进行。 卤代烃的还原: ***氢化铝锂(LiAlH4)适用于一级卤代烷和二级卤代烷还原,三级卤代烷易发生消除反应,不适合用此法 ***硼氢化钠(NaBH4)适用于二级、三级卤代烷还原,而一级卤代烷不易用此试剂还原(常用醇作溶剂) ***卤代烷制成格氏试剂,然后格氏试剂再与水反应,可以将卤代烷还原成烷烃 其他可使卤代烷还原的方法:Zn和HCl、氢碘酸、催化氢解(H2/Pd)、钠和液氨(对于双键碳上的卤原子,还原时双键的构型不变) 用催化氢化法使碳与杂原子(O,N,X等)之间的键断裂,称为氢解
增长碳链的常用方法: a、双烯合成:在无水AlCl3的作用下,两个分子的烯结合成一新的分子; (1)双烯体是以顺式构象进行反应的,反应条件为光照或加热。 (2)双烯体(共轭二烯)可是连状,也可是环状。如环戊二烯,环己二烯等。 (3)亲双烯体的双键碳原子上连有吸电子基团时,反应易进行。常见的亲双烯体有: CH2=CH-CHO CH2=CH-COOH CH2=CH-COCH3 CH2=CH-CN CH2=CH-COOCH3 CH2=CH-CH2Cl b、羟醛缩合:如聚乙烯醇缩丁醛; 具有α-H的醛,在碱催化下生成碳负离子,然后碳负离子作为亲核试剂对醛酮进行亲核加成,生成β-羟基醛,β-羟基醛受热脱水成不饱和醛。 c、成酯:聚酯; 酸和醇在浓硫酸作用下,脱去水,形成酯 d、成酰胺:尼龙; 你给的例子就属于这个 e、格列亚反应:与烷基卤化镁反应; 烷基卤化物易溶于醚类溶剂,与镁反应生成烷基氯化镁(即格氏试剂)。 f、亲核取代:卤代烷与烷基铜锂的反应; 饱和碳上的亲核取代反应很多。例如,卤代烷能分别与氢氧化钠、醇钠或酚钠、硫脲、硫醇钠、羧酸盐和氨或胺等发生亲核取代反应,生成醇、醚、硫醇、硫醚、羧酸酯和胺等。醇可与氢卤酸、卤化磷或氯化亚砜作用,生成卤代烃。卤代烷被氢化铝锂还原为烷烃,也是负氢离子对反应物中卤素的取代。当试剂的亲核原子为碳时,取代结果形成碳-碳键,从而得到碳链增长产物,如卤代烷与氰化钠、炔化钠或烯醇盐的反应。 苯的烷化和酰化,付克酰化反应苯环上的氯甲基化卡宾反应2HC=CH2+CF3COOH==3HC-CH2-OCOCF3 聚合反应。如乙烯的聚合反应 炔加HCN 炔和NaNH2反应之后再和卤代烷反应 由于时间问题方程式没写以后的有时间再来
高中有机化学方程式总结 一、烃 1. 烷烃 —通式:C n H 2n -2 (1)氧化反应 ①甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O ②甲烷不可使酸性高锰酸钾溶液及溴水褪色。 (2)取代反应 一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿) 四氯化碳:CHCl 3+Cl 2 CCl 4+HCl (3)分解反应 CH 4 C+2H 2 2. 烯烃 —通式:C n H 2n 乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O (1)氧化反应 ①乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O ②乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。 (2)加成反应 与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH 3 与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH (3)聚合反应 乙烯加聚,生成聚乙烯:n H 2C=CH 2 n 3. 炔烃 —通式:C n H 2n-2 乙炔的制取:CaC 2+2H 2O HC ≡CH↑+Ca(OH)2 (1)氧化反应 ①乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O ②乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。 (2)加成反应 与溴水加成:HC ≡CH+Br 2 HC=CH Br CHBr=CHBr+Br 2 CHBr 2—CHBr 2 与氢气加成:HC ≡CH+H 2 H 2C=CH 2 与氯化氢加成:HC ≡CH+HCl CH 2=CHCl (3)聚合反应 氯乙烯加聚,得到聚氯乙烯:n CH 2=CHCl n 乙炔加聚,得到聚乙炔:n HC ≡CH n 点燃 光 光 光 光 浓硫酸 170℃ 点燃 催化剂 △ 催化剂 加热加压 催化剂 CH 2-CH 2 图1 乙烯的制取 点燃 图2 乙炔的制取 催化剂 △ 催化剂 △ Br CH 2—CH 催化剂 Cl 催化剂 CH=CH 催化剂 △ 高温 溴的CCl 4可用于鉴别烯烃和烷烃,也可用于除去烷烃中混有的烯烃。 制得的C 2H 4中往往混有CO 、CO 2、SO 2等气体 电石中含有的CaS 与水反应会生成H 2S ,可用CuSO 4或NaOH 溶液将 H 2S 除去
关于有机合成碳链增长的分类综述 四川大学材料学院2012级张敏 【背景】 对于有机合成而言,碳链的增长与断裂是必不可少的环节。为什么要进行这两个环节,在于我们能够大量获得的有机原料的种类以及这些原料的单个分子中C原子个数十分有限:1、来自石油、天然气中的烷烃、芳香烃以及通过裂解得到的乙烯;2、通过微生物发酵得到的酒精、乙酸,但是大多不纯;3、天然橡胶、油漆或者动植物体内的油脂、糖类、蛋白质。 在这些有限碳数的原料下,我们通过运用自己的发现、创造和想象合成了数以千万计的自然界没有的或难以提取的有机化合物,正是利用了碳原子与碳原子之间的惺惺相惜和千变万化的可能碳架结构,合成了这些物质。碳链的断裂主要用于从天然多碳有机化合物分子中裂解出小分子的有机原料;碳链的增长则是利用这些小分子的原料,一步又一步的漫长合成,完成了各种碳数分子合成和各种碳架结构的实现。上个世纪六十年代,我国科学家就已经人工合成了具有生物活性的牛胰岛素结晶,可以预期在不久的将来人类甚至可以通过有机合成的方式来制备出具有生物活性的DNA序列而自然界没有的。 【摘要】 本文将按照碳链增长的机理进行分类介绍,主要是-C机理或碱催化、+C机理或酸催化、自由基机理三个方面,从机理进行解析和归类,从应用范围和效果来对比优缺点,从而系统的认识碳链增长。 C机理、酸催化、+C机理、自由基机理、碳链增长的最新【关键词】碱催化、- 研究进展。 【正文】 1、-C机理或碱催化条件碳链增长 (1)有机金属化合物 炔钠
① ② ③ ④ 炔钠中的- C进攻+δ的C原子,进行亲核取代或者亲核加成,生成含有不和炔键的碳链,进而可以通过炔键再次引入1~2个官能团,使增长的碳链可塑性更强,可发展性更高。炔钠中的- C亲核能力强,反应的速度快,反应副产物少。-C 碱性较强,极易与酸性基团发生中和反应而丧失亲核能力,故其反应要在非水非醇非酸的惰性溶剂中进行,反应物中也不能带有这些基团。炔钠只能通过带有酸性氢的端炔与强碱氨基钠中和反应制的或者直接与钠单质进行置换反应制的,制备的成本较高;若直接使用那制备还可能使端炔偶联;且制备的条件要求绝对干燥并且用纯氮气或稀有气体隔绝空气的条件,进一步是的成本加大。 【1等在3-己炔-1-醇合成方法的研究中就是利用上述③反应的原吴雄】 【2在2-庚炔酸甲酯的合成中①反应。 理,江焕峰】 格氏试剂
碳链增长和减短反应的总结 有机合成中,碳骨架的构建是极其重要的一步,这就涉及到了碳链的增长。有机化学的碳链增长的反应众多,适用场合不一,若无法很好的理解各个反应的优缺点,便很难得心应手的完成有机合成。因此,我们对几个常见的碳链增长反应进行了总结。 1、自由基聚合 烯在高压下,在体系少量氧的引发下可进行自由基加成的链式反应,最后形成大分子聚合物,共轭双烯尤其容易聚合。改反应可制备高聚物,是合成塑料、橡胶的基础。该反应无法合成特定碳链个数的小分子。 2、炔钠的应用 缺氢具有一定的酸性,可以与活泼金属,如钠,或氨基钠反应,生成炔负离子。 炔负离子具有较强的亲核性,可以与卤代烃发生亲核取代。 反应所用的卤代烃必须是伯卤代烃,仲卤、叔卤与炔钠反应主要生成相应的消除产物。乙烯型卤也不与炔钠反应。该反应是由低级炔制备高级炔的重要方法,之后可由炔烃的还原,制备立体专一的顺式烯烃或反式烯烃。还可以直接水合成酮。 如果是乙炔,还可以生成第二个炔钠进行第二次亲核取代。 3、炔烃的亲核加成反应 由于炔烃与烯烃相比,采用的杂化不同,炔烃为SP杂化,其中S轨道占有的成分高,对电子的吸引能力强,所以炔烃可一发生亲核加成而烯烃不能,利用这个性质,可以用来延长碳链 这里以乙炔为例。Nu为带有碳链的亲核基团
C C H H H Nu C CH H H Nu C CH H H Nu 利用炔烃可以进行亲核加成的特性可以让炔与羧酸反应制备无法用烯醇直接酯化制得的酸烯酯。还可是让炔与氢氰酸生成烯腈,烯腈再水解就可以得到α,&不饱和酸,以此衍生制备各种α,&不饱和不饱和化合物。 4、狄-阿(Diels–Alder)反应 共轭双烯与亲双烯体生成环己烯的反应。狄尔斯-阿尔德反应可以合成带有不饱和键六元环和桥环化合物,是有机化学合成反应中非常重要的碳碳键形成的手段之一,也是现代有机合成里常用的反应之一。 该反应条件所需条件不严格,只需加热便可进行。亲双烯体上带有吸电子基可以更好的进行D-A反应。 CHO + CHO 以此制备含侧链官能团的六元环,侧链上的官能团还可以进行其他碳链增长的反应。 5、傅-克(Friedel-Crafts)烷基化和傅克酰基化 在路易斯酸存在下芳烃与烷基卤和酰卤的反应叫傅克反应。可分为烷基化和酰基化两类。 5.1傅-克(Friedel-Crafts)烷基化 氯乙烷在三氯化铝催化下与苯发生取代反应,生成乙苯,放出氯化氢。 +CH 3 CH2Cl AlCl3 CH2CH3 +HCl
有机化学中碳链增长 的反应
有机化学中碳链增长的反应 姓名:应化10(本1)汪吉伟 100712024 摘要:在对有机化学反应的研究过程中,有机合成是必不可少的一个重要环节,然而碳骨架的构建是极其关键的一步,碳链的增长是形成分子骨架的主要手段之一。在有机化学反应中碳链增长的反应有很多,不同的方法都有其不同的特点及适用范围,因此熟悉并掌握有机反应中各种增加碳链方法的机理和优缺点将有助于我们对有机合成反应的研究,以下是对几种常见的碳链增长反应的总结。 关键词:碳链增长有机金属烃基化亲核加成 正文: 一、利用有机金属化合物增长碳链 卤代烷能和某些金属发生反应,生成有机金属化合物。有机金属化合物是指金属原子直接与碳原子相连的一类化合物。有机反应中利用有机金属化合物增长碳链是重要的手段之一。 1.与格氏试剂的反应 “格氏试剂”是含卤化镁的有机金属化合物(在常温下把镁屑放在无水乙醚中,滴加卤代烷,卤代烷与镁作用生成的有机镁化合物,该化合物不需分离即可直接用于有机合成反应),是一类亲核试剂,在有机合成中应用十分广泛。 (1)格氏试剂与醛、酮、酯、环氧烷发生亲核加成反应成相应的醇: R MgX R''R'(H) O R C R'(H) OMgX R'' H3O+ R C R'(H) OH R'' 反应若生成二级醇,还可以氧化成酮,再继续与格氏试剂反应生成三级醇。
(2)格氏试剂和CO2进行亲核加成后经水解可以可制备多一个碳的羧酸,反应可以从卤代烃出发,得到碳链增长的羧酸,适合伯、仲、叔卤代烃以及烯丙基和苯基卤代烃。 2.与二烃基铜锂的反应 二分子烃基锂与一分子卤化亚铜在醚中、低温下与氮气流和氩气流中进行反应,可以形成二烃基铜锂。二烃基铜锂也是一个反应适用范围很广的试剂。 RLi+CuX→RCu+LiX RCu+RLi→R2CuLi 二烃基铜锂的烃基可以是甲基,一级烷基,二级烷基,也可以是烯丙基、苄基、乙烯基、芳基等烃基,故可称为二烃基铜锂或有机锂试剂。 二烃基铜锂可与卤代烃发生偶联反应,反应如下: 卤代烃中的烃基可以是一级、二级烷基,也可以是乙烯烃、芳烃、烯丙基和苯甲基,二烃基铜锂中的烃基可以是一级烷基,也可以是其它烃基如乙烯基、芳基和稀丙基等,因此这个偶联反应选用范围很广。 3.与炔钠的反应 缺氢具有一定的酸性,可以与活泼金属,如钠,或氨基钠反应,生成炔负离子。 炔负离子具有较强的亲核性,可以与卤代烃发生亲核取代:R'C CNa+R X R'C CR+NaX 反应所用的卤代烃必须是伯卤代烃,仲卤、叔卤与炔钠反应主要生成相应的消除产物。乙烯型卤也不与炔钠反应。该反
碳链增长反应的总结 林剑锋罗祎迩洪宇浩张述熙吴明 【摘要】本文主要总结了几个常见的有机合成中碳链增长的反应,阐述了其适应范围和优缺点。 【关键词】碳链增长有机合成 有机合成中,碳骨架的构建是极其重要的一步,这就涉及到了碳链的增长。有机化学的碳链增长的反应众多,适用场合不一,若无法很好的理解各个反应的优缺点,便很难得心应手的完成有机合成。因此,我们对几个常见的碳链增长反应进行了总结。 1、自由基聚合 烯在高压下,在体系少量氧的引发下可进行自由基加成的链式反应,最后形成大分子聚合物,共轭双烯尤其容易聚合。改反应可制备高聚物,是合成塑料、橡胶的基础。该反应无法合成特定碳链个数的小分子。 2、炔钠的应用 缺氢具有一定的酸性,可以与活泼金属,如钠,或氨基钠反应,生成炔负离子。 炔负离子具有较强的亲核性,可以与卤代烃发生亲核取代。 反应所用的卤代烃必须是伯卤代烃,仲卤、叔卤与炔钠反应主要生成相应的消除产物。乙烯型卤也不与炔钠反应。该反应是由低级炔制备高级炔的重要方法,之后可由炔烃的还原,制备立体专一的顺式烯烃或反式烯烃。还可以直接水合成酮。 如果是乙炔,还可以生成第二个炔钠进行第二次亲核取代。 3、炔烃的亲核加成反应 由于炔烃与烯烃相比,采用的杂化不同,炔烃为SP杂化,其中S轨道占有
的成分高,对电子的吸引能力强,所以炔烃可一发生亲核加成而烯烃不能,利用这个性质,可以用来延长碳链 这里以乙炔为例。Nu 为带有碳链的亲核基团 利用炔烃可以进行亲核加成的特性可以让炔与羧酸反应制备无法用烯醇直接酯化制得的酸烯酯。还可是让炔与氢氰酸生成烯腈,烯腈再水解就可以得到α,&不饱和酸,以此衍生制备各种α,&不饱和不饱和化合物。 4、狄-阿(Diels –Alder )反应 共轭双烯与亲双烯体生成环己烯的反应。狄尔斯-阿尔德反应可以合成带有不饱和键六元环和桥环化合物,是有机化学合成反应中非常重要的碳碳键形成的手段之一,也是现代有机合成里常用的反应之一。 该反应条件所需条件不严格, 只需加热便可进行。亲双烯体上带有吸电子基可以更好的进行D-A 反应。 CHO + CHO 以此制备含侧链官能团的六元环,侧链上的官能团还可以进行其他碳链增长的反应。 5、傅-克(Friedel-Crafts )烷基化和傅克酰基化 在路易斯酸存在下芳烃与烷基卤和酰卤的反应叫傅克反应。可分为烷基化和酰基化两类。 5.1傅-克(Friedel-Crafts )烷基化 氯乙烷在三氯化铝催化下与苯发生取代反应,生成乙苯,放出氯化氢。
有机化学中碳链增长的反应 姓名:应化10(本1)汪吉伟100712024 摘要:在对有机化学反应的研究过程中,有机合成是必不可少的一个重要环节,然而碳骨架的构建是极其关键的一步,碳链的增长是形成分子骨架的主要手段之一。在有机化学反应中碳链增长的反应有很多,不同的方法都有其不同的特点及适用范围,因此熟悉并掌握有机反应中各种增加碳链方法的机理和优缺点将有助于我们对有机合成反应的研究,以下是对几种常见的碳链增长反应的总结。 关键词:碳链增长有机金属烃基化亲核加成 正文: 一、利用有机金属化合物增长碳链 卤代烷能和某些金属发生反应,生成有机金属化合物。有机金属化合物是指金属原子直接与碳原子相连的一类化合物。有机反应中利用有机金属化合物增长碳链是重要的手段之一。 1.与格氏试剂的反应 “格氏试剂”是含卤化镁的有机金属化合物(在常温下把镁屑放在无水乙醚中,滴加卤代烷,卤代烷与镁作用生成的有机镁化合物,该化合物不需分离即可直接用于有机合成反应),是一类亲核试剂,在有机合成中应用十分广泛。 (1)格氏试剂与醛、酮、酯、环氧烷发生亲核加成反应成相应的醇:R MgX R''R'(H) O R C R'(H) OMgX R'' H3O+ R C R'(H) OH R'' 反应若生成二级醇,还可以氧化成酮,再继续与格氏试剂反应生成三级醇。 (2)格氏试剂和CO2进行亲核加成后经水解可以可制备多一个碳的羧酸,反应可以从卤代烃出发,得到碳链增长的羧酸,适合伯、仲、叔卤代烃以及烯丙基和苯基卤代烃。
2.与二烃基铜锂的反应 二分子烃基锂与一分子卤化亚铜在醚中、低温下与氮气流和氩气流中进行反应,可以形成二烃基铜锂。二烃基铜锂也是一个反应适用范围很广的试剂。 RLi+CuX→RCu+LiX RCu+RLi→R2CuLi 二烃基铜锂的烃基可以是甲基,一级烷基,二级烷基,也可以是烯丙 基、苄基、 乙烯基、芳基等烃基,故可称为二烃基铜锂或有机锂试剂。 二烃基铜锂可与卤代烃发生偶联反应,反应如下: 卤代烃中的烃基可以是一级、二级烷基,也可以是乙烯烃、芳烃、烯丙基和苯甲基,二烃基铜锂中的烃基可以是一级烷基,也可以是其它烃基如乙烯基、芳基和稀丙基等,因此这个偶联反应选用范围很广。 3.与炔钠的反应 缺氢具有一定的酸性,可以与活泼金属,如钠,或氨基钠反应,生成炔负离子 。 炔负离子具有较强的亲核性,可以与卤代烃发生亲核取代:R'C CNa+R X R'C CR+NaX 反应所用的卤代烃必须是伯卤代烃,仲卤、叔卤与炔钠反应主要生成相应的消除产物。乙烯型卤也不与炔钠反应。该反应是由低级炔制备高级炔的重要方法,之后可由炔烃的还原,制备立体专一的顺式烯烃或反式烯烃,还可以直接水合成酮。 如果是乙炔,还可以生成第二个炔钠进行第二次亲核取代: CH CH NaNH2 RC CNa R X HC CR HC CNa R'X NaNH2 RC CR'
高中化学学案
⑤由乙烯和英它无机原料合成环状化合物E,请在下列方框内填入合适的化合物的结构简式。 CH2=CH2 B [探讨学习2]:通过对以上有机合成路线的分析,回答以下问题 1、有机合成过程中,原料和U标产物在结构上发生了哪些变化?有机合成的关 键是什么? 2、碳链增长的途径有哪些? 3、碳链缩短的途径有哪些? 归纳小结:「_________________ 一.有机合成的关键是[ ___________________ (一)、碳骨架的构建<_________________ 1、碳链增长的途径: ri)方出1:卤代婭的取代反应 ①卤虑子的氛基取代 如:浪乙烷f丙酸:增长一个碳原子 CH.CHzBr + NaCN 一________________________________________ CH3CH2CN +2H2+H _ ________________________________ ②卤虑子的块晟取代 如:浪乙烷一2—戊烘:增长两个碳原子 CH3CH2Br + Na-C三CCHs - ________________________________ (其中Na-C三CCHs 的制备:2CH3C=CH + 2Na - 2CHsC^CNa + H2) ③笨与R-X的取代 如:由苯制取乙苯 __________________________________________ (2)方法2:加成反应 ①雜.酌的加成反应 如:CH3CHO + HCN __ ___________________________ CHsCOCHs + HCN _ ______________________________ ②轻理缩合 如CH3CH2CHO + CH3CH2CHO f _________________________________ ③炜婭.块婭的加聚.加成反应
高中有机化学结程式总方一、烃烷烃1. H —通式:C -22nn)氧化反应(1点燃O CO ①甲烷的燃烧:CH+2O+2H 2422②甲烷不可使酸性高锰酸钾溶液及溴水褪色。)取代反应(2光Cl+HCl 一氯甲烷:CH+Cl CH342光+HCl Cl 二氯甲烷:CHCl+Cl CH 2223光又叫氯仿)三氯甲烷:CHCl+Cl CHCl+HCl(CHCl32 232光+HCl CCl 四氯化碳:CHCl+Cl 423 3)分解反应 ( 高温C+2HCH 中往往混有制得的CH2 442烯烃2. —通式:CH 等气体、SOCO、CO nn2浓硫酸22↑+HO HC=CHCH乙烯的制取:CHOH 22232 170℃(1)氧化反应点燃O C=CH+3O 2CO+2H①乙烯的燃烧:H22222②乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。)加成反应(2溴的CCl可用于鉴4Br —CH CHBr与溴水加成:HC=CH+Br 22222催化剂别烯烃和烷烃,也CH C=CH+H CH与氢气加成:H32223△可用于除去烷烃中催化剂混有的烯烃。Cl CH CH 与氯化氢加成:HC=CH+HCl 2223△催化剂图乙烯的制取1 OH CH CH H与水加成:C=CH+HO 22322加热加压(3)聚合反应催化剂CH-CH HC=CH乙烯加聚,生成聚乙烯:n2 2n 22
与水反CaS电石中含有的3. 炔烃—通式:CH n-22n用可S生应会成H,?O +2HCaC乙炔的制取:CH ↑+Ca(OH) HC2222溶液将CuSONaOH或(1)氧化反应4点燃SH除去?O 4CO +2H ①乙炔的燃烧:HCCH+5O 2222②乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。()加成反应2?HC=CH CH+BrHC与溴水加成:2Br Br CHBr—CHBr CHBr=CHBr+Br 2 ?C=CH与氢气加成:HCCH+HH2 22催化剂图乙炔的制取2 ?=CHCl 22△催化剂 CH HC与氯化氢加成:CH+HCl 2△Cl )聚合反应3(催化剂CHCH —2. CH=CHCl 氯乙烯加聚,得到聚氯乙烯:n 2n催化剂?CH=CH HC CH 乙炔加聚,得到聚乙炔:n n 苯4. H C 6 6 1)氧化反应(点燃2CH+15O 12CO+6HO ①苯的燃烧:26262②苯不能使溴水和酸性高锰酸钾溶液褪色。(2)取代反应①苯与溴反应 FeBr Br —3+HBr +Br 2 (溴苯)SO作催化剂和吸水剂浓H42②硝化反应HSO浓NO—422O +H +HO—NO 2 2 △(硝基苯) (3)加成反应 Ni (环己烷)+3H 2 △5. 甲苯苯的同系物通式:CH2n-6n (1)氧化反应点燃O +4H 7CO CH+9O ①甲苯的燃烧:27282②甲苯不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色。)取代反应(2 CHCH 三硝基甲苯(TNT),是一种淡黄色33| | 浓硫酸晶体,不溶于水。它是一种烈性炸药Cl CHCH —NONO—3222O +3H +3HNO | | 23△甲苯和氯气在光照和铁的催化条光+ HCl | + Cl 件下发生的取代反应不一样2 NOCHCH 233Cl —| | Fe (3)加成反应+ HCl + Cl 2CH CH33| | 催化剂+ 3H 2△二、烃的衍生物烃的衍生物的重要类别和主要化学性质:
增长碳链常用的几种方法Last revision on 21 December 2020
增长碳链的常用方法: a、双烯合成:在无水AlCl3的作用下,两个分子的烯结合成一新的分子; (1)双烯体是以顺式构象进行反应的,反应条件为光照或加热。 (2)双烯体(共轭二烯)可是连状,也可是环状。如环戊二烯,环己二烯等。 (3)亲双烯体的双键碳原子上连有吸电子基团时,反应易进行。常见的亲双烯体有: CH2=CH-CHO CH2=CH-COOH CH2=CH-COCH3 CH2=CH-CN CH2=CH-COOCH3 CH2=CH-CH2Cl b、羟醛缩合:如聚乙烯醇缩丁醛; 具有α-H的醛,在碱催化下生成碳负离子,然后碳负离子作为亲核试剂对醛酮进行亲核加成,生成β-羟基醛,β-羟基醛受热脱水成不饱和醛。 c、成酯:聚酯; 酸和醇在浓硫酸作用下,脱去水,形成酯 d、成酰胺:尼龙; 你给的例子就属于这个 e、格列亚反应:与烷基卤化镁反应; 烷基卤化物易溶于醚类溶剂,与镁反应生成烷基氯化镁(即格氏试剂)。 f、亲核取代:卤代烷与烷基铜锂的反应; 饱和碳上的亲核取代反应很多。例如,卤代烷能分别与氢氧化钠、醇钠或酚钠、硫脲、硫醇钠、羧酸盐和氨或胺等发生亲核取代反应,生成醇、醚、硫醇、硫醚、羧酸酯和胺等。醇可与氢卤酸、卤化磷或氯化亚砜作用,生成卤代烃。卤代烷被氢化铝锂还原为烷烃,也是负氢离子对反应物中卤素的取代。当试剂的亲核原子为碳时,取代结果形成碳-碳键,从而得到碳链增长产物,如卤代烷与氰化钠、炔化钠或烯醇盐的反应。 苯的烷化和酰化,付克酰化反应苯环上的氯甲基化卡宾反应2HC=CH2+CF3COOH==3HC-CH2-OCOCF3 聚合反应。如乙烯的聚合反应 炔加HCN 炔和NaNH2反应之后再和卤代烷反应 由于时间问题方程式没写以后的有时间再来
龙源期刊网 https://www.doczj.com/doc/bd3745114.html, 浅谈有机合成碳链增长与减少的反应 作者:晏雄 来源:《化学教学》2017年第07期 摘要:有机物碳链增长与减少知识在中学化学教材中没有涉及,在考试大纲中也无具体要求。高考有机合成题中常以信息形式提示,但学生总感到陌生与困惑。通过对近几年高考题分析,整理出有机合成题中五种常见的碳链增长反应与一种常见的碳链减少反应。教师以信息形式让学生阅读并仿写有机合成方程式,从而提高复习效率。 关键词:碳链增长;碳链减少;有机合成;高考试题;活泼α-H 文章编号:1005–6629(2017)7–0084–03 中图分类号:G633.8 文献标识码:B 有机合成题是高考试题中的常见题型,同时也是高考的热点与难点。有机合成工业有两条主线:一条是碳骨架的构建,包括碳链的增长、减少、异构、成环、开环等反应;另一条是官能团的形成与转化。在教学中往往以官能团为中心,对官能团的引入、转变、增减和消除复习总结较多,而对有机物碳链的增长与减少涉及较少。尽管在这类题中会有信息提示,但学生遇到时依然很陌生总感到不是那么得心应手。故而,对高考有机合成题中常见的碳链增长与减少反应进行整理、归纳,以提高复习效率。 1 有机合成题中常见的碳链增长反应 1.1 与格氏试剂的反应 “格氏试剂”是含卤化镁的有机金属化合物(在常温下把镁屑放在无水乙醚中,滴加卤代烷,卤代烷与镁作用生成的有机镁化合物,该化合物不需分离即可直接用于有机合成反应),是一類亲核试剂,在有机合成中应用十分广泛。一般先加成后水解是制备醇的一种方法。近四年部分高考试题中有机物与格氏试剂的反应统计见表1。
常用的增长碳链的反应有以下几个: 1.金属有机化合物的反应: 在做题目上,这个反应用的最多的是格氏试剂,有时也用有机锂试剂,包括如与卤化物的偶联反应: 与羰基,氰基的加成反应: 和环氧化合物的开环反应: 这些反应应用很广泛而且相当方便,我个人的感觉是,如果一个合成题能用格氏试剂, 那这个题目一定非常好做. 2.各类缩合反应,这是碳链增长一个很重要的方法,不过也最难掌握,因为反应种类实在太多了,而且应用是技巧性很强,重要的缩合反应有羟醛缩合: 克莱森缩合: 还有各种缩合比如曼尼希反应,麦克尔加成,瑞福马斯基反应等. 3.炔烃,芳环,酮,酯,β-二羰基化合物,β-羰基腈的烷基化和酰基化.在题目上很多 时候这些反应通常和上面的缩合反应共同使用以构建复杂的碳架.如: 当然也可以单独用,比如付氏反应: 炔化物的烃化: 4.环加成反应. 考试中如果用这个反应的话一般也只涉及这个反应,或者和它的逆反应一起出,所以也比较简单. 5.加HCN. 这个反应只加一个碳原子,不过有时没有它是真是无路可走. 与碳链的增长反应相比,常用的缩短碳链的反应就少了些,题目中应用也不及碳链的增长广泛,常用的缩短碳链的反应有以下几个: 1.脱羧反应.我觉得做题目中碰得最多的就是它. 2.烯,炔,芳环侧链,α-二醇,α-羟基醛,酮的氧化断裂反应. 3.环加成逆反应. 4.甲基酮的卤仿反应. 5.酰胺的霍夫曼降解反应 6.β-二羰基化合物的分解. 7.酯,黄原酸酯和四级铵盐的热裂. 由上面可以看到,碳架的建造虽然是一件高度技巧性的工作,但也有规律可循,以上就是总结的一些常用的方式,当然,还要反复练习,认真总结,才能把这些方法融会贯通,这也是有机化学学习中一条必备的准则.
RCl Mg 干醚 RMgBr 干醚 CO2 RCOOMgBr H3O RCOOH HCHO RMgBr 干醚 RCH2OMgBr H3O RCH2 OH RCHO RMgBr 干醚 R2CHOMgBr H3O R2CHOH 有机化学中碳链增长与减少 增加一个碳: 1.格氏试剂 格氏试剂与二氧化碳作用可制备多一个碳的羧酸: 2.Gattermann-Koch反应 环上带有活化集团(如甲基甲氧基等)的芳烃在无水三氯化铝和氯化亚铜 催化下与一氧化碳和氯化氢得到相应的芳醛即—Gattermann-Koch反应。 3.末端烯烃碳链增长反应 末端烯烃与CO和H 2 在八羰基二钴催化下,主要生成比原料烯烃多一个碳原子 的醛。 RCH =CH2 + CO + H2 → RCH2 CH2CHO CH3CH =CH2 + CO + H2 → CH3CH2 CH2CHO 75﹪ 4.与CN-的反应:
RCl NaCN H 3O RCN H 3O RCOOH H Ni RCH 2NH 2 RCHO HCN OH RCHCN OH H 3O RCHCOOH OH O RMgBr 干醚 RCH 2CH 2OMgBr H 3O RCH 2CH 2 OH N 2 Cl Cu 2CN 2KCN CN 5.氢羰基化 增加2个碳: 1.铬氏试剂 2.聚合反应 2C 2H 2 →CH 2=CH-C ≡CH
2.傅克烷基化 +CH 3 CH 2 X-CH2CH3 增加多个碳: 1、自由基聚合 烯在高压下,在体系少量氧的引发下可进行自由基加成的链式反应,最后形成大分子聚合物,共轭双烯尤其容易聚合。改反应可制备高聚物,是合成塑料、橡胶的基础。该反应无法合成特定碳链个数的小分子。 (1)nCH2=CH2-----(引发剂)-----[-CH2-CH2-]-n 加聚反应 引发剂:TiCI4--AI(C2H5)3条件:0.1~1MPa,60~70o C (2)nCH2=CH--CH3-----(引发剂)-----[-CH2-CH-]-n 加聚反应 | CH3 3CH3 → 条件:500℃ 2、酯化反应 羧酸与醇在酸的催化作用下失去一分子水而生成酯的反应称为酯化反应。(1)1O ROH,2O ROH酯化时按加成-消除机制进行,反应中酰氧键断裂。 CH3COOH + C2H5OH→CH3COOC2H5 + H2O (2)3O ROH按碳正离子反应机制进行酯化,即:
一.醛酮羰基上的亲核加成反应 影响因素:电子效应、空间效应和亲核试剂的亲核能力 1. 与氢氰酸的加成 反应条件:碱催化,醛、脂肪族甲基酮和8个碳以下的环酮。 应用:制备多一个C 的 -羟基酸 2.与NaHSO3 加成 产物:白色结晶物 反应物条件:醛(芳香醛、脂肪醛)脂肪族甲基酮8个碳以下的环酮。 应用:醛或甲基酮的分析 醛或甲基酮的纯化 鉴别醛脂肪族甲基酮8个碳以下的环酮 3. 与醇和水的加成 (1) 与醇的加成 注意:可逆反应 条件:干燥HCl 常用于:保护醛基,抗氧化、抗还原、抗碱 (2)与醛的加成 与醛相比,酮与醇反应生成缩酮的反应比较困难。但醇易于乙二醇作用,生成具有五元环状结构的缩酮。
条件:干燥HCl 应用:保护酮基或连二醇结构 4. 与Grignard试剂的加成 条件:乙醚 应用:制备各种醇(碳链增长) 5. 醛酮与胺类化合物的缩合 (1)与2, 4-二硝基苯肼反应(羰基化试剂)生成2, 4-二硝基苯腙(黄色固体) 注意:可逆反应 条件:所有醛类,酮类物质 酸性条件 应用:鉴别醛酮类物质 (2)羰基化合物与伯胺加成产生希夫碱 注意:可逆反应 可从羰基的正电性、试剂的亲核性、反应物的空间位阻分析亲核反应二、α-碳和α-氢的反应 醛、酮分子中,与羰基直接相连的碳原子称α-碳,α-碳上的氢成为α-氢。含α-H的醛、酮,其α-H受C=O影响,可发生离解。(①羰基的吸电子作用增大了C-H键的极性,α-氢易离去②α-氢离去后,醛,酮可通过形成负电荷离域化氧原子和α-碳上,趋于稳定)α-H 的反应主要有两种:卤代(醛酮合成羧酸)、缩合(醛酮合成醇)Ⅰ.卤代(卤仿)
1. Single Step Step Stages Notes Yield 1 1.1C:Pt 1.2R:H2 8 TOTAL PRODUCTS, Reactants: 1, Reagents: 1, Catalysts: 1, Steps: 1, Stages: 2 Transformation: 1. Carbon-Carbon Coupling at a Susceptible Carbon CASREACT ?: Copyright ? 2013 American Chemical Society. All Rights Reserved. CASREACT contains reactions from CAS and from: ZIC/VINITI database (1974-1999) provided by InfoChem; INPI data prior to 1986; Biotransformations database compiled under the direction of Professor Dr. Klaus Kieslich; organic reactions, portions copyright 1996-2006 John Wiley & Sons, Ltd., John Wiley and Sons, Inc., Organic Reactions Inc., and Organic Syntheses Inc. Reproduced under license. All Rights Reserved. 2. Single Step Step Stages Notes Yield
有机物中增减碳链的常用方法一、增加碳链的反应: 1.1-烯烃与CO、H2(催化剂)反应增加一个碳 2.格氏试剂与酮、醛、CO2、环氧乙烷的反应 3.卤代物与KCN的反应 4.缩醛、醛酮与胺衍生物的加成 5.羟醛缩反应等 二、减碳链的反应
1、增长: a、双烯合成:在无水AlCl3的作用下,两个分子的烯结合成一新的分子; b、羟醛缩合:如聚乙烯醇缩丁醛; c、成酯:聚酯; d、成酰胺:尼龙; e、格列亚反应:与烷基卤化镁反应; f、亲和取代:卤代烷与烷基铜锂的反应; 2、缩短: a、高锰酸钾氧化;与酸性或碱性高锰酸钾反应; b、臭氧化;臭氧化后水解; c、脱羧基: d、霍夫曼重排:酰胺转变成胺; e、二醇的氧化: 脱羧反应 脂肪酸 这个反应对一般的脂肪酸,特别是长链的脂肪酸,由于反应温度太高,产率低,加之不易分离,所以一般不用来制备烷烃。但是若脂肪酸的α-碳原子上带有吸电子基团如硝基、卤素、羰基、氰基等时,则使得脱羧容易而且产率也高,但是它们的反应历程不完全一样。例如三氯乙酸的钠盐在水中50℃就可脱羧生成氯仿。 羧酸分子中失去羧基放出二氧化碳的反应叫做脱羧反应(decarboxylation)。一般情况下,羧酸中的羧基较为稳定,不易发生脱羧反应,但在特殊条件下,羧酸能脱去羧基(失去二氧化碳)而生成烃。最常用的脱羧方法是将羧酸的钠盐与碱石灰(CaO+NaOH)或固体氢氧化钠强热。 脱羧反应化学方程式示意图
三氯乙酸盐 三氯乙酸的钠盐在水中完全离解成负离子,由于三个氯原子具有强的吸电子作用,就使得碳碳之间的电子云偏向于有氯取代的碳一边,这样形成的负碳离子就更加稳定,然后和质子结合形成氯仿,而羧基负离子上的电子转移到碳氧之间而形成二氧化碳。此反应是通过负离子进行的脱羧反应。 β-酮酸 β-酮酸很易脱羧,其反应过程与上述不同,而是通过一个六元环进行的协同反应,首先生成烯醇,然后经重排得到酮。由于反应的过渡态是一个六元环,能量低,因而反应很易进行。此反应在合成上很重要,丙二酸型化合物以及α,β-不饱和酸等的脱羧,一般都属于这一类型的反应。芳香酸的脱羧比脂肪酸容易进行,如苯甲酸在喹啉溶液中加少许铜粉作为催化剂,加热即可脱羧。特别是2,4,6-三硝基苯甲酸最容易脱羧,这是由于有三个强吸电子的硝基的作用,使得羧基与苯环间的碳碳键更容易断裂。 其它 当羧酸的α-C上连有强吸电子基时,加热可使它较顺利地脱羧。如:临二芳香有机酸加强热的时候,也很容易脱去一个羧基,但温度低了会形成酸酐。 不同的多元羧酸加热的时候,根据活性的不同,有的脱羧,有的脱水,有的又脱羧又脱水,庚二酸以上的脱水,以下的一般脱羧。
形成和改造 碳架的主要反应1 碳链的延长 1-1 通过亲核取代反应(S N)接长碳链 1. Wurtz反应 Na 2. 格氏试剂法 (3°) ′R X 3. Corey-House试剂法(R2CuLi) 4. NaCN 甚广。 5. RC≡CH NaNH 6. CH3COCH2CO2Et 法
7. CH2(CO2Et )2法
8. 在酮的α-位烃基化和酰基化法 9. PhBr + RBr PhR Na 10. PhH + RCl PhR AlCl3 11. PhH + RCOCl PhOCR AlCl3 12. PhH + CO + HCl(F)AlCl Cu 13. PhOH + CHCl3NaOH 1-2 通过亲核加成反应接长碳链 1. 金属有机化合物亲核加成反应 1)RMgX的亲核加成反应 RMgX可与下述试剂进行亲核加成反应使碳链加长: R CONH2CO 3)R2Cd与RCOX反应生成酮并停止于此 2)烷基铜锂试剂的亲核加成反应 O H 2O O
4)RLi 与CO 2生成-CO 2H 5)Reformatsky 反应制备β-羟基酸类化合物 R R CO 2H ′ 2. Aldol Condensation 及其变种 1)Tollens 反应 - OH 稳定的碳负离子对羰基的加成 CH 2=O H O CH 3CH=O +(Mannich 反应) CH 3CH=O 3CH 2=O +2)Claisen-Schmidt 反应 O 3) Perkin 反应 (CH CO)4) Knoevenagel 反应 5) Darzen 反应 ClCH
有机化学中碳链增长的反应 有机化学中的碳链生长反应 姓名:华英10(本1)王记伟100712024 在有机化学反应的研究过程中,有机合成是一个必不可少的重要环节。然而,碳骨架的构建是至关重要的一步。碳链的生长是形成分子骨架的主要手段之一。有机化学反应中有许多碳链生长反应。不同的方法有不同的特点和适用范围。因此,熟悉和掌握有机反应中各种碳链生长方法的机理、优缺点将有助于我们研究有机合成反应。以下是几种常见碳链生长反应的总结。 关键词:碳链增长有机金属烃化亲核加成 文本: 首先,使用有机金属化合物来生长碳链 哈龙可以与一些金属反应形成有机金属化合物。有机金属化合物是指一类金属原子直接与碳原子相连的化合物。使用有机金属化合物在有机反应中生长碳链是重要的手段之一。 1.与格氏试剂的反应 “格氏试剂”是一种含卤化镁的有机金属化合物(常温下将镁废料置于无水乙醚中,滴加卤代烷烃,卤代烷烃与镁作用生成的有机镁化合物可直接用于有机合成反应,无需分离)。它是一种亲核试剂,广泛用于有机合成。 (1)格氏试剂与醛、酮、酯和烯化氧发生亲核加成反应形成相应的醇;奥格XR’(H)RCR’’R’(H)高级驻地协调员’ ‘ R’(H)RMgXR’’H3O+
如果在反应中生成仲醇,它也可以被氧化成酮,然后继续与格氏试剂反应生成叔醇。 (2)在格氏试剂和CO2的亲核加成后,通过水解可以制备多一个碳的羧酸。具有碳链延伸的羧酸可以从卤代烃中获得,其适用于伯、仲和叔卤代烃、烯丙基和苯基卤代烃。 2.与二烃基铜锂的反应 二烃基锂可以通过卤化亚铜分子与氮气和氩气在乙醚中低温反应而形成。二烃基铜锂也是一种应用广泛的试剂。 RLi+CuX→RCu+LiX RCu+RLi→R2CuLi 二烷基铜锂的烃基可以是甲基、伯烷基、仲烷基或烃基如烯丙基、苄基、乙烯基、芳基等,因此它可以被称为二烷基铜锂或有机锂试剂。二烃基铜锂可以与卤代烃偶联,反应如下: 卤代烃中的烃基可以是伯或仲烷基,或乙基烯烃、芳香烃、烯丙基和苄基。二烷基铜锂中的烃基可以是伯烷基或其它烃基,如乙烯基、芳基、稀丙基等。因此,偶联反应具有广泛的选择范围。 3.与炔钠的反应 缺氢具有一定的酸性,能与钠或钠氨基等活性金属反应生成炔负离子。 乙炔阴离子具有很强的亲核性,可以被卤代烃亲核取代; 中国注册会计师协会+RXR注册会计师协会+中国注册会计师协会 反应中使用的卤代烃必须是初级卤代烃。仲卤、叔卤和炔钠主要反应生成相应的消除产物。乙烯卤素也不与炔钠反应。该反应是由低级炔