工程热力学知识点
1.什么是工程热力学
从工程技术观点出发,研究物质的热力学性质,热能转换为机械能的规律和方法,以及有效、合理地利用热能的途径。
2.能源的地位与作用及我国能源面临的主要问题
3. 热能及其利用
[1]热能:能量的一种形式
[2]来源:一次能源:以自然形式存在,可利用的能源。
如风能,水力能,太阳能、地热能、化学能和核能等。
二次能源:由一次能源转换而来的能源,如机械能、机械能等。
[3]利用形式:
直接利用:将热能利用来直接加热物体。如烘干、采暖、熔炼(能源消耗比例大)
间接利用:各种热能动力装置,将热能转换成机械能或者再转换成电能,
4..热能动力转换装置的工作过程
5.热能利用的方向性及能量的两种属性
[1]过程的方向性:如:由高温传向低温
[2]能量属性:数量属性、,质量属性 (即做功能力)
[3]数量守衡、质量不守衡
[4]提高热能利用率:能源消耗量与国民生产总值成正比。
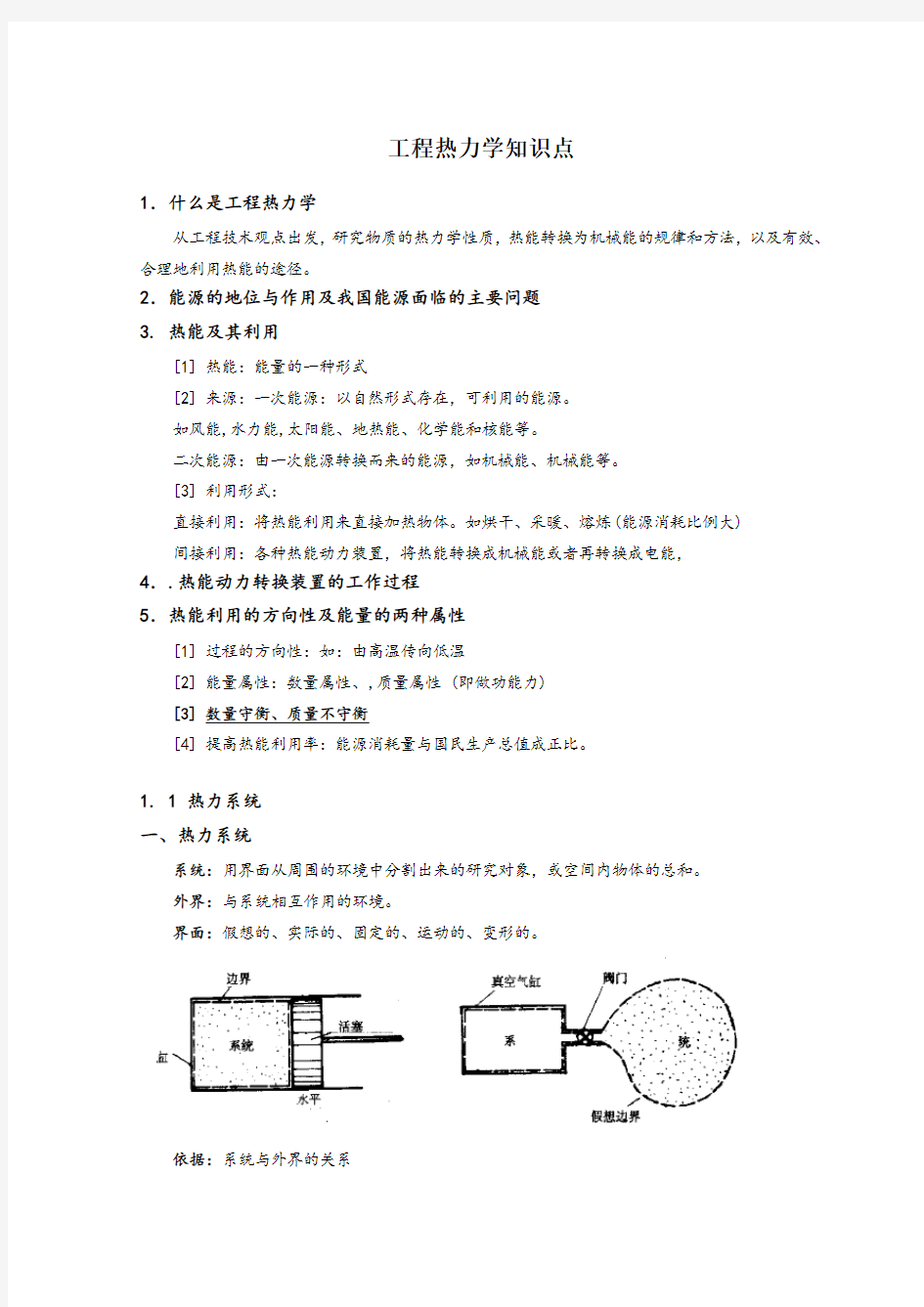
1. 1 热力系统
一、热力系统
系统:用界面从周围的环境中分割出来的研究对象,或空间内物体的总和。
外界:与系统相互作用的环境。
界面:假想的、实际的、固定的、运动的、变形的。
依据:系统与外界的关系
系统与外界的作用:热交换、功交换、质交换。
二、闭口系统和开口系统
闭口系统:系统内外无物质交换,称控制质量。
开口系统:系统内外有物质交换,称控制体积。
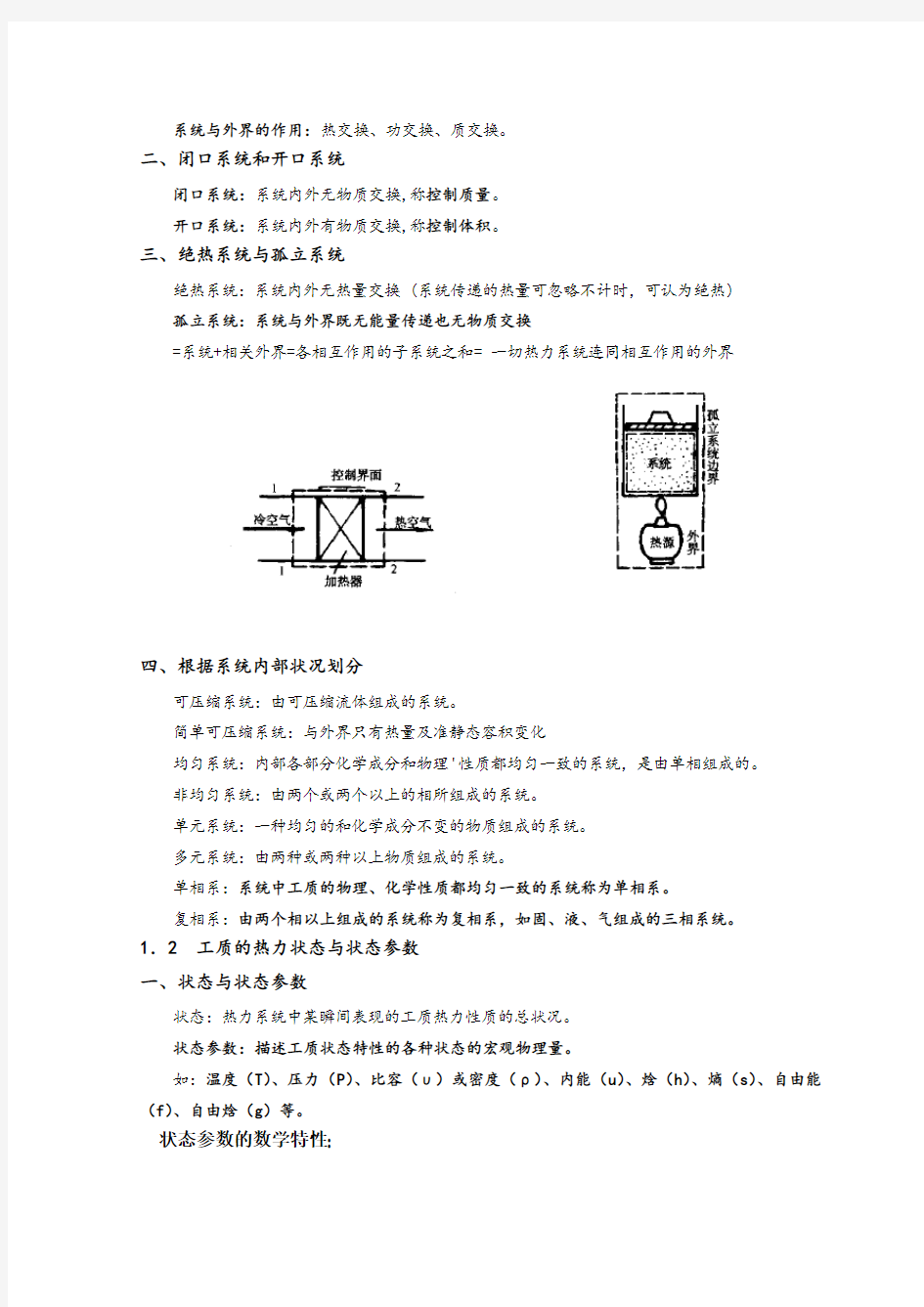
三、绝热系统与孤立系统
绝热系统:系统内外无热量交换 (系统传递的热量可忽略不计时,可认为绝热)
孤立系统:系统与外界既无能量传递也无物质交换
=系统+相关外界=各相互作用的子系统之和= 一切热力系统连同相互作用的外界
四、根据系统内部状况划分
可压缩系统:由可压缩流体组成的系统。
简单可压缩系统:与外界只有热量及准静态容积变化
均匀系统:内部各部分化学成分和物理'性质都均匀一致的系统,是由单相组成的。
非均匀系统:由两个或两个以上的相所组成的系统。
单元系统:一种均匀的和化学成分不变的物质组成的系统。
多元系统:由两种或两种以上物质组成的系统。
单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。
复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。
1.2 工质的热力状态与状态参数
一、状态与状态参数
状态:热力系统中某瞬间表现的工质热力性质的总状况。
状态参数:描述工质状态特性的各种状态的宏观物理量。
如:温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。
状态参数的数学特性:
1. 12
1
2x x dx -=?
表明:状态的路径积分仅与初、终状态有关,而与状态变化的途径无关。
2.?dx =0
表明:状态参数的循环积分为零
基本状态参数:可直接或间接地用仪表测量出来的状态参数:温度、压力、比容或密度
温度:宏观上,是描述系统热力平衡状况时冷热程度的物理量。 微观上,是大量分子热运动强烈程度的量度
2.压力:
垂直作用于器壁单位面积上的力,称为压力,也称压强。
f
F
p = 式中:F —整个容器壁受到的力,单位为牛顿(N )
; f —容器壁的总面积(m2)。 微观上:分子热运动产生的垂直作用于容器壁上单位面积的力。 压力测量依据:力平衡原理 压力单位:MPa
相对压力:相对于大气环境所测得的压力。工程上常用测压仪表测定的压力。 以大气压力为计算起点,也称表压力。 g
p B p += (P>B )
H B p -= (P
Pg —高于当地大气压力时的相对压力,称表压力;
H —低于当地大气压力时的相对压力,称为真空值。
注意:只有绝对压力才能代表工质的状态参数 3.比容:
比容:单位质量工质所具有的容积。 密度:单位容积的工质所具有的质量。
m
V
v =
m 3/kg 关系:1=v ρ
式中:ρ—工质的密度
kg/m3 ,v —工质的比容 m3/kg
例:表压力或真空度为什么不能当作工质的压力?工质的压力不变化,测量它的压力表或真空表的读数是否会变化?
解:作为工质状态参数的压力是绝对压力,测得的表压力或真空度都是工质的绝对压力与大气压力的相对值,因此不能作为工质的压力;因为测得的是工质绝对压力与大气压力的相对值,即使工质的压力不变,当大气压力改变时也会引起压力表或真空表读数的变化。
1.3准静态过程与可逆过程
热力过程:系统状态的连续变化称系统经历了一个热力过程。
一、准静过程:如果造成系统状态改变的不平衡势差无限小,以致该系统在任意时刻均无限接近于某个平衡态,这样的过程称为准静态过程。
注意:准静态过程是一种理想化的过程,实际过程只能接近准静态过程。
二、可逆过程:系统经历一个过程后,如令过程逆行而使系统与外界同时恢复到初始状态,而不留下任何痕迹,则此过程称为可逆过程。
实现可逆过程的条件:
过程无势差 (传热无温差,作功无力差)
过程无耗散效应。
三、可逆过程的膨胀功 (容积功)
系统容积发生变化而通过界面向外传递的机械功。
?=2 1pdv
w J/kg
规定: 系统对外做功为正,外界对系统作功为负。问题:比较不可逆过程的膨胀功与可逆过程膨胀功四、可逆过程的热量:
系统与外界之间依靠温差传递的能量称为热量。
可逆过程传热量:?
=2
1
Tds q q J/kg
规定:系统吸热为正,放热为负。
1.4 热力循环:
定义:工质从某一初态开始,经历一系列状态变化,最后由回复到初态的过程。, 一、正循环
正循环中的热转换功的经济性指标用循环热效率:
1
2121101q q q q q q w t -=-==
η 式中
q1—工质从热源吸热;q2—工质向冷源放热;
w0—循环所作的净功。
二、逆循环
以获取制冷量为目的。 制冷系数: 212
021q q q w q -=
=
ε 式中:q1—工质向热源放出热量;q2—工质从冷源吸取热量;w0—循环所作的净功。 供热系数: 2
11
012q q q w q -=
=
ε 式中:q1—工质向热源放出热量,q2—工质从冷源吸取热量,w0—循环所作的净功
热力学第一定律
2.1系统的储存能
系统的储存能的构成:内部储存能+外部储存能
一.内能
热力系处于宏观静止状态时系统内所有微观粒子所具有的能量之和,单位质量工质所具有
的内能,称为比内能,简称内能。U=mu
内能=分子动能+分子位能 分子动能包括:
1.分子的移动动能 2.分子的转动动能 3.分子内部原子振动动能和位能 分子位能:克服分子间的作用力所形成
u=f (T,V) 或u=f (T,P) u=f (P,V)
注意: 内能是状态参数. 特别的: 对理想气体u=f (T)
二 外储存能:
系统工质与外力场的相互作用(如重力位能)及以外界为参考坐标的系统宏观运动所具有的
能量(宏观动能)。 宏观动能:2
2
1mc E k =
重力位能:mgz E p = 式中
g —重力加速度。
三 系统总储存能:
p k E E U E ++=
或mgz mc U E ++=22
1 gz c u e ++
=2
2
1 2.
2 系统与外界传递的能量
与外界热源,功源,质源之间进行的能量传递
一、热量
在温差作用下,系统与外界通过界面传递的能量。 系统吸热热量为正,系统放热热量为负。 单位:kJ kcal l kcal=4.1868kJ
特点: 热量是传递过程中能量的一种形式,热量与热力过程有关,或与过程的路径有关.
二、功
除温差以外的其它不平衡势差所引起的系统与外界传递的能量. 1.膨胀功W :在力差作用下,通过系统容积变化与外界传递的能量。 单位:l J=l Nm
规定: 系统对外作功为正,外界对系统作功为负。 膨胀功是热变功的源泉 2 轴功W s :
通过轴系统与外界传递的机械功
注意: 刚性闭口系统轴功不可能为正,轴功来源于能量转换
三、随物质传递的能量
1.流动工质本身具有的能量
mgz mc U E ++
=2
2
1 2. 流动功(或推动功):
维持流体正常流动所必须传递量,是为推动流体通过控制体界面而传递的机械功.
推动1kg 工质进、出控制体所必须的功 1
122v p v p w f -= 注意: 流动功仅取决于控制体进出口界面工质的热力状态。流动功是由泵风机等提供
四、焓的定义:
焓=内能+流动功
对于m 千克工质:
pV U H +=
对于1千克工质:h=u+ p v
五、焓的物理意义:
对流动工质(开口系统),表示沿流动方向传递的总能量中,取决于热力状态的那部分能量. 对不流动工质(闭口系统),焓只是一个复合状态参数
2.3 闭口系统能量方程 一、能量方程表达式
W Q U -=? 适用于mkg 质量工质 w q u -=? 1kg 质量工质
注意: 该方程适用于闭口系统、任何工质、任何过程。
由于反映的是热量、内能、膨胀功三者关系,因而该方程也适用于开口系统、任何工质、任何过程.
特别的: 对可逆过程 ?-=?2
1pdv q u
二、.循环过程第一定律表达式
??=w q δδ
结论: 第一类永动机不可能制造出来
三、理想气体内能变化计算
由dT c du q v v v ==δ得:
dT c du v =,?=?2
1dT c u v
适用于理想气体一切过程或者实际气体定容过程
或: )(12T T c u v -=?
用定值比热计算
1020
121221
t c t c dt c dt c dt c u t vm
t vm
t v t v t t v ?-?=-==????
用平均比热计算
()T f c v =的经验公式代入?=?2
1
dT c u v 积分。
理想气体组成的混合气体的内能: ∑∑====+++=n
i i i n i i n u m U U U U U 1
1
21Λ
2.4 开口系统能量方程
由质量守恒原理:
进入控制体的质量一离开控制体的质量=控制体中质量的增量 能量守恒原理:
进入控制体的能量一控制体输出的能量=控制体中储存能的增量 设控制体在τd 时间内:
进入控制体的能量=112
11)21(m gz c h Q δδ++
+ 离开控制体的能量=222
22)2
1(m gz c h W S δδ+++
控制体储存能的变化cv cv cv E dE E dE -+=)(
代入后得到:
=Q δ22222)21(m gz c h W S δδ+++11211)2
1
(m gz c h δ++-+cv dE
注意:本方程适用于任何工质,稳态稳流、不稳定流动的一切过程,也适用于闭口系统
2.5 开口系统稳态稳流能量方程 一 稳态稳流工况
工质以恒定的流量连续不断地进出系统,系统内部及界面上各点工质的状态参数和宏观运动参数都保持一定,不随时间变化,称稳态稳流工况。
条件:1.符合连续性方程
2.系统与外界传递能量,收入=支出,且不随时间变化
s w gdz dc dh q δδ+++=22
1
适用于任何工质,稳态稳流热力过程
二 技术功
在热力过程中可被直接利用来作功的能量,称为技术功。 技术功=膨胀功+流动功
2211v p v p w w t -+=
特别的:对可逆过程:
?-=2
1
vdp w t
公式:s w q dh δδ-=
适用于任何工质稳态稳流过程,忽略工质动能和位能的变化。
三、理想气体焓的计算
对于理想气体
()T f RT u h =+=
dT c dh p =,dT c h p ?=?21
适用于理想气体的一切热力过程或者实际气体的定压过程
)(12T T c h p -=?
适用于理想气体的一切热力过程或者实际气体的定压过程, 用定值比热计算
1020
121221
t c t c dt c dt c dt c h t pm
t pm
t p t p t t p ?-?=-==????
用平均比热计算
把
()T f c p =的经验公式代入?=?2
1
dT c h p 积分。
气体和蒸汽的性质
3.1 理想气体状态方程 一、理想气体与实际气体
定义:气体分子是一些弹性的,忽略分子相互作用力,不占有体积的质点, 注意:当实际气体p →0 v →∞的极限状态时,气体为理想气体。
二、理想气体状态方程的导出
状态方程的几种形式
1.RT pv = 适用于1千克理想气体。 式中:p —绝对压力 Pa
v —比容 m3/kg , T —热力学温度 K
2.mRT pV = 适用于m 千克理想气体。 式中V —质量为mkg 气体所占的容积
3.T R pV M 0= 适用于1千摩尔理想气体。
式中VM=Mv —气体的摩尔容积,m3/kmol ; R0=MR —通用气体常数, J/kmol ·K
4.T nR pV 0= 适用于n 千摩尔理想气体。
式中V —nKmol 气体所占有的容积,m 3;n —气体的摩尔数,M
m
n =
,kmol 5.
2
2
2111T v P T v P = 6.
2
2
2111T V P T V P =
仅适用于闭口系统 3.2 理想气体的比热 一、比热的定义与单位
定义:单位物量的物体,温度升高或降低1K (1℃)所吸收或放出的热量,称为该物体比热。
dT
q
c δ=
单位:式中 c —质量比热,kJ/Kg ·k
'c —容积比热,kJ/m3·k
Mc —摩尔比热,kJ/Kmol ·k
换算关系:
4.22'ρc Mc
c ==
注意:比热不仅取决于气体的性质,还于气体的热力过程及所处的状态有关。
二、定容比热和定压比热
定容比热:v
v v
v T u dT du dT
q c ???
????==
=
δ 表示:明单位物量的气体在定容情况下升高或降低1K 所吸收或放出的热量. 定压比热:dT
dh dT
q c p
p =
=
δ 表示:单位物量的气体在定压情况下升高或降低1K 所吸收或放出的热量。
迈耶公式:R c c v p =- R c c v p 0''ρ=-
0R MR Mc Mc v p ==-
比热比: v
p v
p v
p Mc Mc c c c c ===
''κ 1-=
κκR
c v 1
-=κnR c p 三、定值比热、真实比热与平均比热
1、定值比热:凡分子中原子数目相同因而其运动自由度也相同的气体,它们的摩尔比热值都相等,称为定值比热。
2、真实比热:相应于每一温度下的比热值称为气体的真实比热。 常将比热与温度的函数关系表示为温度的三次多项式
332210T a T a T a a Mc p +++=
3.平均比热
气体和蒸汽的基本热力过程
一、定压过程
12h h h q -=?= )(1212v v p h h u ---=?
u q w ?-= ?=-=0vdp w t
二、定容过程
?==0pdv w u q ?=
)(1212p p v h h u ---=? ?-=-=)(21p p v vdp w t
三、定温过程
)(12s s T q -= u q w ?-=
h q w t ?-= )(112212v p v p h h u ---=?
四、绝热过程
q=0 u w ?-= h w t ?-=
)(112212v p v p h h u ---=?
热力学第二定律
5.1 自然过程的方向性 一、磨擦过程
功可以自发转为热,但热不能自发转为功
二、传热过程
热量只能自发从高温传向低温
三、自由膨胀过程
绝热自由膨胀为无阻膨胀,但压缩过程却不能自发进行
四、混合过程
两种气体混合为混合气体是常见的自发过程
五、燃烧过程
燃料燃烧变为燃烧产物(烟气等),只要达到燃烧条件即可自发进行 结论:自然的过程是不可逆的
5.2 热力学第二定律的实质
克劳修斯说法:热量不可能从低温物体传到高温物体而不引起其它变化
开尔文说法:不可能制造只从一个热源取热使之完全变为机械能,而不引起其它变化的循环发动机。
5.3 卡诺循环与卡诺定理
意义:解决了热变功最大限度的转换效率的问题
一.卡诺循环:
[一] 正循环
组成:两个可逆定温过程、两个可逆绝热过程
过程a-b :工质从热源(T1)可逆定温吸热 b-c :工质可逆绝热(定'熵)膨胀 c-d :工质向冷源(T2)可逆定温放热
d-a :工质可逆绝热(定熵)压缩回复到初始状态。 循环热效率:
1
2101q q q w t -==
η )(11a b s s T q -==面积abefa )(22d c s s T q -==面积cdfec
因为 )()(d c a b s s s s -=- 得到 1
2
1T T t -
=η 分析:
1、热效率取决于两热源温度,T1、T2,与工质性质无关。
2、由于T1,∞≠ T2≠0,因此热效率不能为1
3、若T1=T2,热效率为零,即单一热源,热机不能实现。 [二] 逆循环:
包括:绝热压缩、定温放热。 定温吸热、绝热膨胀。 制冷系数:2
12
212021T T T q q q w q c -=-==ε 供热系数2
11
211012T T T q q q w q c -=-==
ε 关系:112+=c c εε
分析:通常T2>T1-T2 所以: 11>c ε
二 卡诺定理:
1、所有工作于同温热源、同温冷源之间的一切热机,以可逆热机的热效率为最高。 2.在同温热源与同温冷源之间的一切可逆热机,其热效率均相等.
压气机的热力过程
1 压气机的理论压缩功
压气机: 用来压缩气体的设备
一、单机活塞式压气机工作过程
吸气过程、压缩过程、排气过程。理想化为可逆过程、无阻力损失. 1.定温压缩轴功的计算
st w =?-=2
1
vdp w t 1
2
11ln
p p v
p - 按稳态稳流能量方程,压气机所消耗的功,一部分用于增加气体的焓,一部分转化为热能向外放出.
对理想气体定温压缩,表示消耗的轴功全部转化成热能向外放出.
st w =T Q
2.定熵压缩轴功的计算,
?-=21vdp w t s k k kw p p k kRT =????
?????????? ??--=-1
12
111 按稳态稳流能量方程,绝热压缩消耗的轴功全部用于增加气体的焓,使气体温度升高,该式也适用于不可逆过程
3.多变压缩轴功的计算
?-=21vdp w t s n n nw p p n nRT =???
?
?
????????? ??--=-1
12111 按稳态稳流能量方程,多变压缩消耗的轴功部分用于增加气体的焓,部分对外放热,该式同样适用于不可逆过程
结论: ss sn st w w w -<-<- T sn s T T T 22>>
可见定温过程耗功最少,绝热过程耗功最多
8.2 多级压缩及中间冷却
由
k
k p p T T 11212-???
?
??=
即:压力比越大,其压缩终了温度越高,较高压缩气体常采用中间冷却设备,称多级压气机. 最佳增压比:使多级压缩中间冷却压气机耗功最小时,各级的增压比称为最佳增压比。 压气机的效率:在相同的初态及增压比条件下,可逆压缩过程中压气机所消耗的功与实际不可逆压缩过程中压气机所消耗的功之比,称为压气机的效率。
特点:
1.减小功的消耗,由p-v 图可知 2.降低气体的排气温度,减少气体比容 3.每一级压缩比降低,压气机容积效率增高
中间压力的确定: 原则:消耗功最小。 以两级压缩为例,得到:
2
312//p p p p =
结论:两级压力比相等,耗功最小。 推广为Z 级压缩
z z p p 1121/.......+===ββ
推理:
1.每级进口、出口温度相等. 2.各级压气机消耗功相等.
3.各级气缸及各中间冷却放出和吸收热量相等.
8.5 活塞式压气机余隙影响 一、余隙对排气量的影响
余隙:为了安置进、排气阀以及避免活塞与汽缸端盖间的碰撞,在汽缸端盖与活塞行程终点间留有一定的余隙,称为余隙容积,简称余隙
活塞式压气机的容积效率:活塞式压气机的有效容积和活塞排量之比,
3
13
41V V V V v ---
=λ
结论:余隙使一部分汽缸容积不能被有效利用,压力比越大越不利。
二 余隙对理论压缩轴功的影响
????
?????????? ??---=-n n s n p p V V p n n w 1
122111)(1
式中:41V V V -=为实际吸入的气体体积。
结论:不论压气机有无余隙,压缩每kg 气体所需的理论压缩轴功都相同,所以应减少余隙容积。
气体动力循环
9.2 活塞式内燃机实际循环的简化
开式循环(open cycle);
燃烧、传热、排气、膨胀、压缩均为不可逆; 各环节中工质质量、成分稍有变化。
9.3 活塞式内燃机的理想循环 一、混合加热理想循环
0?1 吸气 1?2 压缩 2?3 喷油、燃烧 3?4 燃烧 4?5 膨胀作功 5?0 排气
蒸汽动力装置循环
热机:将热能转换为机械能的设备叫做热力原动机。热机的工作循环称为动力循环。 动力循环可分:蒸汽动力循环和燃气动力循环两大类。
10.1蒸汽动力基本循环一朗肯循环
朗肯循环是最简单的蒸汽动力理想循环,热力发电厂的各种较复杂的蒸汽动力循环都是在朗肯循环的基础上予以改进而得到的。
一、装置与流程
蒸汽动力装置:锅炉、汽轮机、凝汽器和给水泵等四部分主要设备。 工作原理:p-v 、T-s 和h-s 。
朗肯循环可理想化为:两个定压过程和两个定熵过程。
二、朗肯循环的能量分析及热效率
取汽轮机为控制体,建立能量方程:
3
12
1h h h h --=
η
三、提高朗肯循环热效率的基本途径
依据:卡诺循环热效率 1、提高平均吸热温度
直接方法式提高蒸汽压力和温度。 2、降低排气温度
..
制冷循环
11.1 空气压缩制冷循环
空气压缩式制冷:将常温下较高压力的空气进行绝热膨胀,会获得低温低压的空气。 原则:实现逆卡诺循环 工作原理如图:
注意:空气的热物性决定了空气压缩致冷循环的致冷系数低和单位工质的致冷能力小。
1
)(
1111
1
2
1
2
1-=-=
-k k p p T T ε
或:1
21
1T T T -=
ε 11.2 蒸汽压缩制冷循环
一、实际压缩式制冷循环
蒸气压缩致冷装置:压缩机、冷凝器、膨胀阀及蒸发器组成。
原理:由蒸发器出来的致冷剂的干饱和蒸气被吸入压缩机,绝热压缩后成为过热蒸气(过程1-2),蒸气进入冷凝器,在定压下冷却(过程2-3),进一步在定压定温下凝结成饱和液体(过程3-4)。饱和液体继而通过一个膨胀阀(又称节流阀或减压阀)经绝热节流降压降温而变成低干度的湿蒸气。
注意:工业上,用节流阀取代膨胀机。
二、制冷剂的压焓图(lgp-h 图)
原理:以致冷剂焓作为横坐标,以压力对数为纵坐标,共绘出致冷剂的六种状态参数线簇: 定焓(h)、定压力(p)、定温度(T)、定比容(v)、定熵(s)及定干度(x)线.
蒸气压缩式致冷循环各热力过程在lgp-h 图上的表示:
1-2表示压缩机中的绝热压缩过程。2-3-4是冷凝器中的定压冷却过程 4-5为膨胀阀中的绝热节流过程。5-1表示蒸发器内的定压蒸发过程。
三、制冷循环能量分析及致冷系擞
实际蒸气压缩致冷循环整个装置的能量分析。其致冷系数为
2
1w q =
ε=收获/消耗 制冷剂质量流量:2
2
q Q m = 压缩机所需功率:3600
mw p =
冷凝器热负荷:()121h h M Q -=
四、影响制冷系数的主要因素
降低制冷剂的冷凝温度 提高蒸发温度
工程热力学大总结 '
… 第一章基本概念 1.基本概念 热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。 边界:分隔系统与外界的分界面,称为边界。 外界:边界以外与系统相互作用的物体,称为外界或环境。 闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。 ) 开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。 绝热系统:系统与外界之间没有热量传递,称为绝热系统。 孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。 单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。 复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。 单元系:由一种化学成分组成的系统称为单元系。 多元系:由两种以上不同化学成分组成的系统称为多元系。 } 均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。 非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。 热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。 平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。 状态参数:描述工质状态特性的各种物理量称为工质的状态参数。如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。 基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。
工程热力学与传热学课 程总结与体会 Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】
工程热力学与传热学 题目:工程热力学与传热学课程总结与体 会 院系:水利建筑工程学院给排水科学与工 程 班级:给排水科学与工程一班 姓名:张琦文 指导老师:姚雪东 日期:2016年5月1日 认识看法地位作用存在问题解决措施未来 发展展望 传热学在高新技术领域中的应用 摘要: 热传递现象无时无处不在【2】它的影响几乎遍及现代所有的工业部门【1】也渗透到农业、林业等许多技术部门中。本文介绍了航空航天、核能、微电子、材料、生物
医学工程、环境工程、新能源以及农业工程等诸多高新技术领域在不同程度上应用传热研究的最新成果。可以说除了极个别的情况以外,很难发现一个行业、部门或者工业过程和传热完全没有任何关系。不仅传统工业领域,像能源动力、冶金、化工、交通、建筑建材、机械以及食品、轻工、纺织、医药等要用到许多传热学的有关知识【1】而且诸如航空航天、核能、微电子、材料、生物医学工程、环境工程、新能源以及农业工程等很多高新技术领域也都在不同程度上有赖于应用传热研究的最新成果,并涌现出像相变与多相流传热、(超)低温传热、微尺度传热、生物传热等许多交叉分支学科。在某些环节上,传热技术及相关材料设备的研制开发甚至成为整个系统成败的关键因素。 前言:通过对传热学这门课程的学习,了解了传热的基本知识和理论。发现传热学是一门基础学科应用非常广泛,它会解决许许多多的实际问题更是与机械制造这门学科息息相关。传热学是研究由温度差异引起的热量传递过程的科学。传热现象在我们的日常生活中司空见惯。早在人类文明之初人们就学会了烧火取暖。随着工业革命的到来,蒸汽机、内燃机等热动力机械相继出现,传热研究更是得到了飞速的发展,被广泛地应用于工农业生产与人们的日常生活之中。当今世界国与国之间的竞争是经济竞争,而伴随着经济的高速发展也带来了资源、人口与环境等重大国
第一章基本概念 .基本概念 热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。 边界:分隔系统与外界的分界面,称为边界。 外界:边界以外与系统相互作用的物体,称为外界或环境。 闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。 开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。 绝热系统:系统与外界之间没有热量传递,称为绝热系统。 孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。 单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。 复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。 单元系:由一种化学成分组成的系统称为单元系。 多元系:由两种以上不同化学成分组成的系统称为多元系。 均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。 非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。 热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。 平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。 状态参数:描述工质状态特性的各种物理量称为工质的状态参数。如温度()、压力()、比容(υ)或密度(ρ)、内能()、焓()、熵()、自由能()、自由焓()等。 基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。 温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。 热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。 压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。 相对压力:相对于大气环境所测得的压力。如工程上常用测压仪表测定系统中工质的压力即为相对压力。 比容:单位质量工质所具有的容积,称为工质的比容。 密度:单位容积的工质所具有的质量,称为工质的密度。 强度性参数:系统中单元体的参数值与整个系统的参数值相同,与质量多少无关,没有可加性,如
《工程热力学》期末总结 一、闭口系能量方程的表达式有以下几种形式: 1kg 工质经过有限过程:w u q +?= (2-1) 1kg 工质经过微元过程:w du q δδ+= (2-2) mkg 工质经过有限过程:W U Q +?= (2-3) mkg 工质经过微元过程:W dU Q δδ+= (2-4) 以上各式,对闭口系各种过程(可逆过程或不可逆过程)及各种工质都适用。 在应用以上各式时,如果是可逆过程的话,体积功可以表达为: pdv w =δ (2-5) ? = 2 1 pdv w (2-6) pdV W =δ (2-7) ? = 2 1 pdV W (2-8) 闭口系经历一个循环时,由于U 是状态参数,?=0dU ,所以 W Q ??= δδ (2-9) 式(2-9)是闭口系统经历循环时的能量方程,即任意一循环的净吸热量与净功量相等。 二、稳定流动能量方程 t s w h w z g c h q +?=+?+?+?=2 21 (2-10) (适用于稳定流动系的任何工质、任何过程) ? - ?=2 1 vdp h q (2-11) (适用于稳定流动系的任何工质、可逆过程) 三、几种功及相互之间的关系(见表一) 表一 几种功及相互之间的关系
四、比热容 1、比热容的种类(见表二) 。 )/3 kg m 2、平均比热容:1 21 1221 20 t t t t c t t c t t c - -= (2-12) 3、利用平均比热容计算热量:11220 t t c t t c q -= (2-13) 4、理想气体的定值比热容(见表三)
其中:M M R R g 83140= = [J/(kg ·K)] M —气体的摩尔质量,如空气的摩尔质量为28.96kg/kmol 。 空气的kmol /kg 96.28K)kmol /(J 83140?= = M R R g =287[J/(kg ·K)],最好记住空气的气体常数。 引入比热容比k 后,结合梅耶公式,又可得: g p R k k c 1 -= (2-14) g V R k c 1 1-= (2-15) 五、理想气体的热力学能、焓、熵(见表四) (焓的定义:pv u h += kJ/kg , 焓是状态参数) 六、气体主要热力过程的基本计算公式(见表五)
第一章基本概念 1.基本概念 热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。 边界:分隔系统与外界的分界面,称为边界。 外界:边界以外与系统相互作用的物体,称为外界或环境。 闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。 开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。 绝热系统:系统与外界之间没有热量传递,称为绝热系统。 孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。 单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。 复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。 单元系:由一种化学成分组成的系统称为单元系。 多元系:由两种以上不同化学成分组成的系统称为多元系。 均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。 非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。 热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。 平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。 状态参数:描述工质状态特性的各种物理量称为工质的状态参数。如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。 基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。 温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。 热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。 压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。 相对压力:相对于大气环境所测得的压力。如工程上常用测压仪表测定系统中工质的压力即为相对压力。 比容:单位质量工质所具有的容积,称为工质的比容。 密度:单位容积的工质所具有的质量,称为工质的密度。
第一章基本概念 1、基本概念 热力系统:用界面将所要研究得对象与周围环境分隔开来,这种人为分隔得研究对象,称为热力系统,简称系统。 边界:分隔系统与外界得分界面,称为边界。 外界:边界以外与系统相互作用得物体,称为外界或环境。 闭口系统:没有物质穿过边界得系统称为闭口系统,也称控制质量。 开口系统:有物质流穿过边界得系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。 绝热系统:系统与外界之间没有热量传递,称为绝热系统。 孤立系统:系统与外界之间不发生任何能量传递与物质交换,称为孤立系统。 单相系:系统中工质得物理、化学性质都均匀一致得系统称为单相系。 复相系:由两个相以上组成得系统称为复相系,如固、液、气组成得三相系统。 单元系:由一种化学成分组成得系统称为单元系。 多元系:由两种以上不同化学成分组成得系统称为多元系。 均匀系:成分与相在整个系统空间呈均匀分布得为均匀系。 非均匀系:成分与相在整个系统空间呈非均匀分布,称非均匀系。 热力状态:系统中某瞬间表现得工质热力性质得总状况,称为工质得热力状态,简称为状态。 平衡状态:系统在不受外界影响得条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热得与力得平衡,这时系统得状态称为热力平衡状态,简称为平衡状态。 状态参数:描述工质状态特性得各种物理量称为工质得状态参数。如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。 基本状态参数:在工质得状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。 温度:就是描述系统热力平衡状况时冷热程度得物理量,其物理实质就是物质内部大量微观分子热运动得强弱程度得宏观反映。 热力学第零定律:如两个物体分别与第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。 压力:垂直作用于器壁单位面积上得力,称为压力,也称压强。 相对压力:相对于大气环境所测得得压力。如工程上常用测压仪表测定系统中工质得压力即为相对压力。 比容:单位质量工质所具有得容积,称为工质得比容。 密度:单位容积得工质所具有得质量,称为工质得密度。 强度性参数:系统中单元体得参数值与整个系统得参数值相同,与质量多少无关,没有可加性,如温度、压力等。在热力过程中,强度性参数起着推动力作用,称为广义力或势。 广延性参数:整个系统得某广延性参数值等于系统中各单元体该广延性参数值之与,如系统得容积、内能、焓、熵等。在热力过程中,广延性参数得变化起着类似力学中位移得作用,称为广义位移。
工程热力学复习重点2012. 3 绪论 [1]理解和掌握工程热力学的研究对象、主要研究内容和研究方法 [2]理解热能利用的两种主要方式及其特点 [3]了解常用的热能动力转换装置的工作过程 1.什么是工程热力学 从工程技术观点出发,研究物质的热力学性质,热能转换为机械能的规律和方法,以及有效、合理地利用热能的途径。 2.能源的地位与作用及我国能源面临的主要问题 3. 热能及其利用 [1]热能:能量的一种形式 [2]来源:一次能源:以自然形式存在,可利用的能源。 如风能,水力能,太阳能、地热能、化学能和核能等。 二次能源:由一次能源转换而来的能源,如机械能、机械能等。 [3]利用形式: 直接利用:将热能利用来直接加热物体。如烘干、采暖、熔炼(能源消耗比例大) 间接利用:各种热能动力装置,将热能转换成机械能或者再转换成电能, 4..热能动力转换装置的工作过程 5.热能利用的方向性及能量的两种属性 [1]过程的方向性:如:由高温传向低温 [2]能量属性:数量属性、,质量属性(即做功能力) [3]数量守衡、质量不守衡 [4]提高热能利用率:能源消耗量与国民生产总值成正比。 第1章基本概念及定义 1. 1 热力系统 一、热力系统 系统:用界面从周围的环境中分割出来的研究对象,或空间内物体的总和。 外界:与系统相互作用的环境。 界面:假想的、实际的、固定的、运动的、变形的。
依据:系统与外界的关系 系统与外界的作用:热交换、功交换、质交换。 二、闭口系统和开口系统 闭口系统:系统内外无物质交换,称控制质量。 开口系统:系统内外有物质交换,称控制体积。 三、绝热系统与孤立系统 绝热系统:系统内外无热量交换(系统传递的热量可忽略不计时,可认为绝热) 孤立系统:系统与外界既无能量传递也无物质交换 =系统+相关外界=各相互作用的子系统之和= 一切热力系统连同相互作用的外界 四、根据系统内部状况划分 可压缩系统:由可压缩流体组成的系统。 简单可压缩系统:与外界只有热量及准静态容积变化 均匀系统:内部各部分化学成分和物理'性质都均匀一致的系统,是由单相组成的。 非均匀系统:由两个或两个以上的相所组成的系统。 单元系统:一种均匀的和化学成分不变的物质组成的系统。 多元系统:由两种或两种以上物质组成的系统。 单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。 复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。思考题: 孤立系统一定是闭口系统吗?反之怎样? 孤立系统一定不是开口的吗、
工程热力学基础简答题
————————————————————————————————作者:————————————————————————————————日期:
1、什么是叶轮式压气机的绝热效率? 答: 2、压缩因子的物理意义是什么? 它反映了实际气体与理想气体的偏离 程度,也反映了气体压缩性的大小,Z>1表示实际气体较理想气体难压缩,Z<1表示实际气体较理想气体易压缩。 3、准平衡过程和可逆过程的区别是什么? 答:无耗散的准平衡过程才是可逆过程,所以可逆过程一定是准平衡过程,而准平衡过程不一定是可逆过程。 4、什么是卡诺循环?如何求其效率? 答:卡诺循环包括四个步骤:等温吸热,绝热膨胀,等温放热,绝热压缩。 5、余隙容积对单级活塞式压气机的影响? 答:余隙容积的存在会造成进气容积减少,所需功减少。余隙容积过大会使压缩机的生产能力和效率急剧下降,余隙容积过小会增加活塞与气缸端盖相碰撞的危险性 6、稳定流动工质焓火用的定义是如何表达的?
答:定义:稳定物流从任意给定状态经开口系统以可逆方式变化到环境状态,并只与环境交换热量时所能做的最大有用 功。 7、写出任意一个热力学第二定律的数学表达式、 答: 8、理想气体经绝热节流后,其温度、压力、热力学能、焓、熵如何变化? 答:温度降低,压力降低,热力学能减小、焓不变、熵增加。 9、冬季室内采用热泵供暖,若室内温度保持在20度,室外温度为-10度时,热泵的供暖系数理论上最高可达到多少? 答: 10、对于简单可压缩系统,实现平衡状态的条件是什么?热力学常用的基本状态参数有哪些? 答:热平衡、力平衡、相平衡;P、V、T 11、简述两级压缩中间冷却压气机中,中间冷却的作用是什么?如何计算最佳中间压力? 答:减少高压缸耗功,利于压气机安全运行,提高容积效率, 降低终了温度;中间压力: 12、混合理想气体的分体积定律是什么?写出分体积定律 的数学表达式。
工程热力学复习知识点 一、知识点 基本概念的理解和应用(约占40%),基本原理的应用和热力学分析能力的考核(约占60%)。 1. 基本概念 掌握和理解:热力学系统(包括热力系,边界,工质的概念。热力系的分类:开口系,闭口系,孤立系统)。 掌握和理解:状态及平衡状态,实现平衡状态的充要条件。状态参数及其特性。制冷循环和热泵循环的概念区别。 理解并会简单计算:系统的能量,热量和功(与热力学两个定律结合)。 2. 热力学第一定律 掌握和理解:热力学第一定律的实质。 理解并会应用基本公式计算:热力学第一定律的基本表达式。闭口系能量方程。热力学第一定律应用于开口热力系的一般表达式。稳态稳流的能量方程。 理解并掌握:焓、技术功及几种功的关系(包括体积变化功、流动功、轴功、技术功)。 3. 热力学第二定律 掌握和理解:可逆过程与不可逆过程(包括可逆过程的热量和功的计算)。 掌握和理解:热力学第二定律及其表述(克劳修斯表述,开尔文
表述等)。卡诺循环和卡诺定理。 掌握和理解:熵(熵参数的引入,克劳修斯不等式,熵的状态参数特性)。 理解并会分析:熵产原理与孤立系熵增原理,以及它们的数学表达式。热力系的熵方程(闭口系熵方程,开口系熵方程)。温-熵图的分析及应用。 理解并会计算:学会应用热力学第二定律各类数学表达式来判定热力过程的不可逆性。 4. 理想气体的热力性质 熟悉和了解:理想气体模型。 理解并掌握:理想气体状态方程及通用气体常数。理想气体的比热。 理解并会计算:理想气体的内能、焓、熵及其计算。理想气体可逆过程中,定容过程,定压过程,定温过程和定熵过程的过程特点,过程功,技术功和热量计算。 5. 实际气体及蒸气的热力性质及流动问题 理解并掌握:蒸汽的热力性质(包括有关蒸汽的各种术语及其意义。例如:汽化、凝结、饱和状态、饱和蒸汽、饱和温度、饱和压力、三相点、临界点、汽化潜热等)。蒸汽的定压发生过程(包括其在p-v和T-s图上的一点、二线、三区和五态)。 理解并掌握:绝热节流的现象及特点 6. 蒸汽动力循环
2011/6/1 第一部分:绪论 1、工程热力学 工程热力学是研究热能有效利用及其热能与其他形式能量转换规律的科学。 2、热力学分类 工程热力学(热能与机械能),物理热力学,化学热力学等 3、热力装置的共同特点 热源和冷源、工质、容积变化功、循环 4、热效率 1 W Q η= =收益 代价 5、工程热力学研究内容 能量转换的基本定律,工质的基本性质和热力过程,热工转换设备及其工作原理,化学热力学基础。 6、工程热力学研究方法 (1)宏观方法:连续体(continuum),用宏观物理量描述其状态,其基本规律是无数经验的总结(如:热力学第一定律)。 特点:可靠,普遍,不能任意推广 经典 (宏观,平衡)热力学 (2)微观方法:从微观粒子的运动及相互作用角度研究热现象及规律 特点:揭示本质,模型近似 微观(统计)热力学
第一章:基本概念 1、热力系统 (1)热力系统(热力系、系统):人为指定的研究对象(如:一个固定的空间); (2)外界:系统以外的所有物质; (3)边界(界面):系统与外界的分界面; (4)系统与外界的作用都通过边界; (5)以系统与外界关系划分: 有无 是否传质开口系闭口系 是否传热非绝热系绝热系 是否传功非绝功系绝功系 是否传热、功、质非孤立系孤立系 (6)简单可压缩系统 只交换热量和一种准静态的容积变化功; 2、状态和状态参数 (1)状态:某一瞬间热力系所呈现的宏观状况 (2)状态参数:描述热力系状态的物理量 (3)状态参数的特征: ●状态确定,则状态参数也确定,反之亦然 ●状态参数的积分特征:状态参数的变化量与路径无关,只与初终态有关 ●状态参数的微分特征:全微分 (4)强度参数与广延参数 ●强度参数:与物质的量无关的参数,如压力p、温度T ●广延参数:与物质的量有关的参数可加性,如质量m、容积V、内能(也称之 为:热力学能)U、焓H、熵S 3、基本状态参数 (1)压力p ( pressure ) ●物理中压强,单位: Pa (Pascal), N/m2。 ●绝对压力与环境压力的相对值——相对压力; ●只有绝对压力p 才是状态参数; ●大气压随时间、地点变化;
第一章基本概念 1. 基本概念 热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。 边界:分隔系统与外界的分界面,称为边界。 外界:边界以外与系统相互作用的物体,称为外界或环境。 闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。 开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制 界面。 绝热系统:系统与外界之间没有热量传递,称为绝热系统。 孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。 单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。 复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。 单元系:由一种化学成分组成的系统称为单元系。 多元系:由两种以上不同化学成分组成的系统称为多元系。 均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。 非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。 热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。 平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。 状态参数:描述工质状态特性的各种物理量称为工质的状态参数。如温度(T)、压力(P)、比容 (u )或密度(p )、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。 基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。 温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。 热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。 压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。 相对压力:相对于大气环境所测得的压力。如工程上常用测压仪表测定系统中工质的压力即为相对 压力。 比容:单位质量工质所具有的容积,称为工质的比容。 密度:单位容积的工质所具有的质量,称为工质的密度。 强度性参数:系统中单元体的参数值与整个系统的参数值相同,与质量多少无关,没有可加性,如
工程热力学与传热学 题目:工程热力学与传热学课程总结与体会院系:水利建筑工程学院给排水科学与工程班级:给排水科学与工程一班 姓名:张琦文 指导老师:姚雪东 日期:2016年5月1日 认识看法地位作用存在问题解决措施未来 发展展望
传热学在高新技术领域中的应用 摘要: 热传递现象无时无处不在【2】它的影响几乎遍及现代所有的工业部门【1】也渗透到农业、林业等许多技术部门中。本文介绍了航空航天、核能、微电子、材料、生物医学工程、环境工程、新能源以及农业工程等诸多高新技术领域在不同程度上应用传热研究的最新成果。可以说除了极个别的情况以外,很难发现一个行业、部门或者工业过程和传热完全没有任何关系。不仅传统工业领域,像能源动力、冶金、化工、交通、建筑建材、机械以及食品、轻工、纺织、医药等要用到许多传热学的有关知识【1】而且诸如航空航天、核能、微电子、材料、生物医学工程、环境工程、新能源以及农业工程等很多高新技术领域也都在不同程度上有赖于 应用传热研究的最新成果,并涌现出像相变与多相流传热、(超)低温传热、微尺度传热、生物传热等许多交叉分支学科。在某些环节上,传热技术及相关材料设备的研制开发甚至成为整个系统成败的关键因素。 前言:通过对传热学这门课程的学习,了解了传热的基本知识和理论。发现传热学是一门基础学科应用非常广泛,它会解决许许多多的实际问题更是与机械制造这门学科息息相关。传热学是研究由温度差异引起的热量传递过程的科学。传热现
象在我们的日常生活中司空见惯。早在人类文明之初人们就学会了烧火取暖。随着工业革命的到来,蒸汽机、内燃机等热动力机械相继出现,传热研究更是得到了飞速的发展,被广泛地应用于工农业生产与人们的日常生活之中。当今世界国与国之间的竞争是经济竞争,而伴随着经济的高速发展也带来了资源、人口与环境等重大国际问题。传热学在促进经薪发展和加强环境保护方面起着举足轻重的作用。20世纪以前传热学是作为物理热学的一部分而逐步发展起来的。20世纪以后,传热学作为一门独立的技术学科获得迅速发展,越来越多地与热力学、流体力学、燃烧学、电磁学和机械工程学等一些学科相互渗透,形成多相传热、非牛顿流体传热、燃烧传热、等离子体传热和数值计算传热等许多重要分支。现在,机械工程仍不断地向传热学提出大量新的课题。如浇铸和冷冻技术中的相变导热,切削加工中的接触热阻和喷射冷却,等离子工艺中带电粒子的传热特性。核工程中有限空间的自然对流,动力和化工机械中超临界区换热,小温差换热,两相流换热,复杂几何形状物体的换热湍流换热等。随着激光等新的实验技术的引入和计算机的应用,为传热学的发展提供了广阔前景。 传热学是研究热量传递规律的一门学科,生产部门存在的多种多样的热量传递问题都可以用传热学来解决,这些部门包括能源、化工、冶金、建筑、机械制造、电子、制冷、
第一章基本概念1.基本概念 热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力 系统,简称系统。 边界:分隔系统与外界的分界面,称为边界。 外界:边界以外与系统相互作用的物体,称为外界或环境。 闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。 开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控 制界面。 绝热系统:系统与外界之间没有热量传递,称为绝热系统。 孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。 单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。 复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。 单元系:由一种化学成分组成的系统称为单元系。 多元系:由两种以上不同化学成分组成的系统称为多元系。 均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。 非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。 热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。平 衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立 了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。 状态参数:描述工质状态特性的各种物理量称为工质的状态参数。如温度(T)、压力(P)、比容 (υ)或密度(ρ )、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。基本状 态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出 来,称为基本状态参数。 温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热 运动的强弱程度的宏观反映。 热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平 衡。 压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。 相对压力:相对于大气环境所测得的压力。如工程上常用测压仪表测定系统中工质的压力即为相 对压力。
工程热力学大总结大全 -标准化文件发布号:(9456-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII
第一章基本概念 1.基本概念 热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。 边界:分隔系统与外界的分界面,称为边界。 外界:边界以外与系统相互作用的物体,称为外界或环境。 闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。 开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。 绝热系统:系统与外界之间没有热量传递,称为绝热系统。 孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。 单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。 复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。 单元系:由一种化学成分组成的系统称为单元系。 多元系:由两种以上不同化学成分组成的系统称为多元系。 均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。 非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。 热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。 平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。 状态参数:描述工质状态特性的各种物理量称为工质的状态参数。如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。 基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。 温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。 热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。 压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。 相对压力:相对于大气环境所测得的压力。如工程上常用测压仪表测定系统中工质的压力即为相对压力。 比容:单位质量工质所具有的容积,称为工质的比容。 密度:单位容积的工质所具有的质量,称为工质的密度。 强度性参数:系统中单元体的参数值与整个系统的参数值相同,与质量多少无关,没有可加性,如温度、压力等。在热力过程中,强度性参数起着推动力作用,称为广义力或势。 广延性参数:整个系统的某广延性参数值等于系统中各单元体该广延性参数值之和,如系统的容
1).工质经历一热力循环,吸热过程吸热40kJ,膨胀过程对外作功80kJ,放热过程对外放热20kJ,压缩过程外界对工质作功50kJ;该循环不违背热力学基本定律,可以实现。()2).有一制冷循环,工质从温度为-20℃的恒温冷物体吸热180kJ,向温度为20℃的环境放热200kJ,该循环违背热力学基本定律,不能实现。() 3).对于开口系统,引起系统熵增的因素是系统吸热和过程的不可逆性二项。() 4).水蒸气的焓熵图上,湿蒸气区的等温线既为等压线,是一组斜率相同的倾斜直线。() 5).压缩比相同时,活塞式内燃机定容加热循环的热效率比定压加热循环的热效率高。() 6).mkg理想气体从压力P1(bar),容积V1(m3),以可逆定温过程膨胀到V2(m3),过程的容积功 为:W=102mP1V1 n V V 2 1 kJ。 () 7).不可逆过程无法在T-s图上表示,也无法计算其熵的变化。() 8).定比热理想气体CO2(绝热指数K=1.29)进行n=1.35的膨胀过程时,吸热,熵增加。() 9)理想气体的定压比热C P和定容比热C V的差值和比值在任何温度下都是常数。() 10).因为实际滞止过程是不可逆绝热过程,实际滞止温度一定高于定熵滞止温度。() 11).某制冷机消耗功率为5kw,每分钟可从0℃的恒温冷库中取出3600kJ的热量排给30℃的恒温环境。() 12)空气进行一多变过程,当多变指数n=1.2时,空气的比热为负值。() 13).在给定的初终态之间有一热力过程,过程中工质与环境发生热交换。已知一切过程均为可逆时耗功400kJ,若实际过程耗功380kJ,则依热力学知识可判明该实际过程可以实现。 () 14).水蒸气h-s图(焓熵图)上湿蒸气区域的等压线为倾斜直线,压力越高,斜率越大。() 15)若物体吸热,则该物体熵一定增加;反之,一物体放热,则该物体熵一定减少。() 16).理想气体从同一初态绝热滞止,一为可逆,一为不可逆,则不可逆滞止温度要比可逆高些。() 17).对湿空气加热,湿空气的相对湿度和含湿量都减少。() 18).容积为V(m3)的容器内盛有某种工质,容器上压力表的读数为P(bar),若工质的内能为U(kJ),则容器内工质的焓,H=U+PV(kJ)。() 19).实际气体节流后温度可能升高。() 20).喷管的背压越低,流量越大。() 21).一热力系统经历一不可逆过程,其熵可能会减少。() 22).等容过程加热量计算式dq V=C V dT可适用于任何气体。() 23).若容器内气体的压力不变,则容器上压力表的读数就不会改变。() 24)在相同温限间工作的一切可逆热机,其热效率均相等。() 25).工质经历一可逆循环,其熵变为零;经历一不可逆循环,其熵变大于零。() 26)高于临界温度的气体,不可能通过压缩使其变为液体。() 27)如果从同一初态到同一终态有两条途径、一为可逆,一为不可逆,那么不可逆过程的熵变一定大于可逆过程的熵变。() 28)如果在活塞式压气机内可以实现等温压缩,则在任何情况下也不用采用分级压缩。() 29)蒸汽动力装置采用再热的根本目的是提高循环的热效率。() 30).理想气体绝热节流前后的h1=h2,t1=t2,P1=P2() 31).制冷系数ε不可能大于1。() 32).不管是理想气体还是实际气体,当其对真空作绝热膨胀时,内能的变化?U=0。() 33)燃气轮机定压加热实际循环内部效率ηi随增压比π的增加总是增大的。() 34).活塞式内燃机定容加热循环的热效率总是大于定压加热循环的热效率。() 35).气体工质吸热一定膨胀。() 36).气体工质的定温过程Q=W。() 37).使系统熵增大的过程一定是不可逆过程。() 38)系统的熵只能增大不能减少。()
工程热力学大总结第五 版 IMB standardization office【IMB 5AB- IMBK 08- IMB 2C】
第一章基本概念1.基本概念 热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。 边界:分隔系统与外界的分界面,称为边界。 外界:边界以外与系统相互作用的物体,称为外界或环境。 闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。 开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。 绝热系统:系统与外界之间没有热量传递,称为绝热系统。 孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。 单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。 复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。 单元系:由一种化学成分组成的系统称为单元系。 多元系:由两种以上不同化学成分组成的系统称为多元系。 均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。 非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。 热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。
平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。 状态参数:描述工质状态特性的各种物理量称为工质的状态参数。如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。 基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。 温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。 热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。 压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。 相对压力:相对于大气环境所测得的压力。如工程上常用测压仪表测定系统中工质的压力即为相对压力。 比容:单位质量工质所具有的容积,称为工质的比容。 密度:单位容积的工质所具有的质量,称为工质的密度。 强度性参数:系统中单元体的参数值与整个系统的参数值相同,与质量多少无关,没有可加性,如温度、压力等。在热力过程中,强度性参数起着推动力作用,称为广义力或势。
工程热力学的认识与学习体会 工程热力学,英文名engineering thermodynamics 。热力学是研究热现象中,物质系统在平衡时的性质和建立能量的平衡关系,以及状态发生变化时,系统与外界相互作用的学科。 工程热力学是热力学最先发展的一个分支,它主要研究热能与机械能和其他能量之间相互转换的规律及其应用,是机械工程的重要基础学科之一。 工程热力学是关于热现象的理论,它以热力学第一定律、热力学第二定律和热力学第三定律作为推理的基础,通过物质的压力 、温度、比容等参数和受热、冷却、膨胀、收缩等行为,对现象和热力过程进行研究。 1842年,法国科学家卡诺提出来卡诺定理和卡诺循环,之处热机必须工作于不同温度的热源之间,提出了热机最高效率的概念,这在本质上已经阐明了热力学第二定律的基本内容。但是他的证明过程却是错的。在卡诺的基础上1850-1851年间克劳修斯和汤姆逊先后独自从热量传递和热转变成功的角度提出了热力学第二定律,指明了热过程的方向性。 1850年,焦耳在他的关于热工相当实验的总结论文中,以各种精确的实验结果使能量守恒与转换定律,即热力学第一定律得到了充分的证实。1851年,汤姆逊把能量这一概念引入热力学, 热力学第一定律的建立宣告第一类永动机(即不消耗能量的永动机)是不可能实现的。热力学第二定律则使制造第二类油动机(只从一个热源吸热的永动机)的梦想破灭。1906年,能斯特根据低温下化学反应的大于1912年将之表述为绝对零度不能达到元力,即热力学第三定律。热力学第三定律的建立使热力学理论更加完善。这三个定理是热力学的基础。 在整个热力学的学习过程中,我对熵这一部分的学习印象最深。 熵是与热力学第二定律紧密相关的状态参数。它为判别实际过程的方向,过程能否实现,热力学第二定律的量化等方面有至关重要的作用。?÷??=T Q s σd ,可以用来判断过程是否可逆,任何不可逆过程的熵变大于) (T Q ÷?σ,极限状况(可逆)时相等,不可能出现小于的过程。闭口系可逆绝热过程中熵不变,是顶上过程,而不可逆绝热过程中工质的熵必定增大。 除了课本上这些外,最让我印象深刻的是,老师说过一句:任何过程都可以看做是一个负熵的过程,包括生命过程。当时有点惊讶,却半信半疑。 熵(entropy )指的是体系的混乱的程度,它在控制论、概率论、数论、天体物理、生命科学等领域都有重要应用,在不同的学科中也有引申出的更为具体的定义,是各领域十分重要的参量。社会学意义:从宏观上表示世界和社会在进化过程中的混乱程度。百度告诉我。 我细细的看完百度中熵的解释。原来熵真的在这么多领域内有独特的作用。 这让我对熵有了浓厚的兴趣,我想知道熵是如何在生命等领域内发挥功效的。 我会继续研究它。
工程热力学大总结第五 版 HUA system office room 【HUA16H-TTMS2A-HUAS8Q8-HUAH1688】
第一章基本概念 1.基本概念 热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。 边界:分隔系统与外界的分界面,称为边界。 外界:边界以外与系统相互作用的物体,称为外界或环境。 闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。 开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。 绝热系统:系统与外界之间没有热量传递,称为绝热系统。 孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。 单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。 复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。 单元系:由一种化学成分组成的系统称为单元系。 多元系:由两种以上不同化学成分组成的系统称为多元系。 均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。
非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。 热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。 平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。 状态参数:描述工质状态特性的各种物理量称为工质的状态参数。如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。 基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。 温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。 热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。 压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。 相对压力:相对于大气环境所测得的压力。如工程上常用测压仪表测定系统中工质的压力即为相对压力。 比容:单位质量工质所具有的容积,称为工质的比容。