
专题训练三物质的除杂(导学)
一、课前检测
1.写出NaOH溶液变质的化学方程式
2.如何证明长期暴露在空气中的氢氧化钠溶液已经变质?设计实验方案并验证。
二、中考地位、题型、分值分析
地位:必考题型
题型分布:选择题、填空题、实验探究题
分值:2-10分之间
2012:填空题(10分)2013:选择题(3分)、实验题(8分)
2014:选择题(2分)2015:实验题(2分)
2016:选择题(4分)2017:填空题(1分)、实验题(1分)
三、学习目标
1.除杂的原则、方法和类型
2.典型题各选项的具体分析
3.考点延伸题的思路点拨
四、教学过程
1.除杂的三原则
“不增”——不增加新杂质
“不减”——不减少主成分
“易分”——生成物质易分离
2.“除杂”的思路
①将杂质从混合物中除去;
②将有用物质从混合物中取出。
3.“除杂”的方法
①物理方法:过滤、分馏、结晶、磁铁吸引等
KNO3(NaCl)降温结晶法NaCl(KNO3)蒸发结晶法
②化学方法:溶解法、洗气法、沉淀法、转化法、加热或灼烧法、多步反应法等
4、常见除杂类型
1)气体除杂
①除水蒸气:干燥剂常见干燥剂有:浓硫酸(液)、无水氯化钙(固)生石灰、NaOH(固) 、碱石灰(固) 注:不能与被干燥气体反应。
②除其他气体
N2(H2)CO2(CO)CO2(O2)CO(CO2)H2(HCl)
2)离子除杂
一般将杂质离子转化为沉淀或气体或水而除去,如:KCl(K2CO3),加足量稀盐酸将碳酸根离子转
化为二氧化碳和水而除去;也可以通过加入氯化钙或氯化钡溶液将碳酸根离子转化为碳酸钙或碳酸钡沉淀而除去。
2.典型题各选项的具体分析
3.考点延伸题的思路点拨
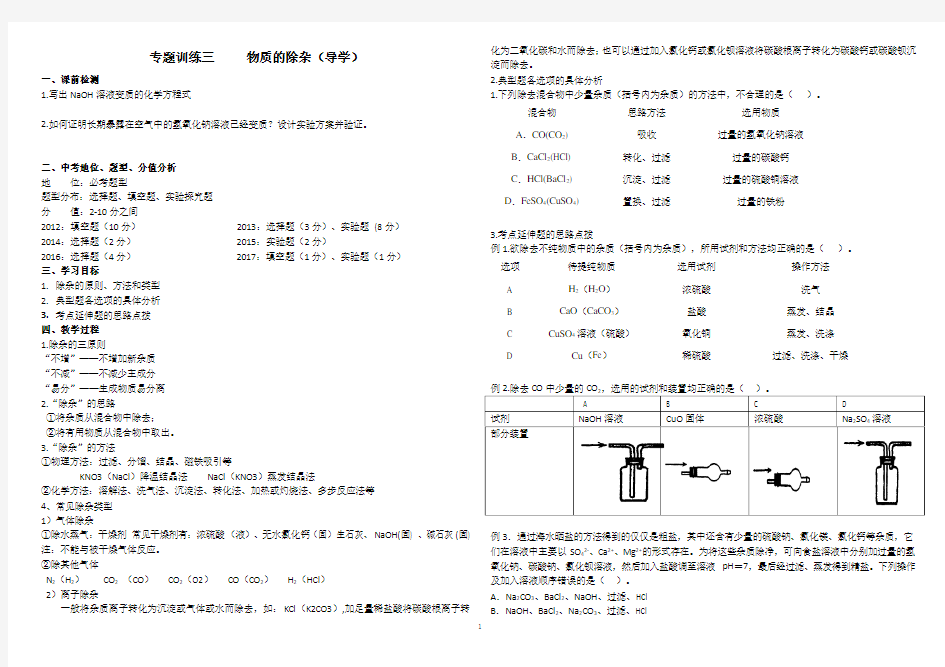
例1.欲除去不纯物质中的杂质(括号内为杂质),所用试剂和方法均正确的是()。
例2.除去CO中少量的CO,选用的试剂和装置均正确的是()。
例3.通过海水晒盐的方法得到的仅仅是粗盐,其中还含有少量的硫酸钠、氯化镁、氯化钙等杂质,它们在溶液中主要以SO42-、Ca2+、Mg2+的形式存在。为将这些杂质除净,可向食盐溶液中分别加过量的氢氧化钠、碳酸钠、氯化钡溶液,然后加入盐酸调至溶液pH=7,最后经过滤、蒸发得到精盐。下列操作及加入溶液顺序错误的是()。
A.Na2CO3、BaCl2、NaOH、过滤、HCl
B.NaOH、BaCl2、Na2CO3、过滤、HCl
1
C.BaCl2、Na2CO3、NaOH、过滤、HCl D.BaCl2、NaOH、Na2CO3、过滤、HCl
五、课堂练习:
)
2.(2014)(2分)下列除去物质所含杂质的方法不正确的是(括号内为杂质)()
A.MnO2(KCl),加足量水溶解,过滤,洗涤,干燥
B.N2(O2),将气体缓缓通过灼热的铜网
C.FeSO4溶液(CuSO4),加过量Fe粉,过滤
D.CO2(HCl),通过NaOH溶液后用浓硫酸干燥
4.(2012)(10分)现有40g固体混合物(硝酸钾、少量氯化钠、泥沙),利用化学实验室常用仪器把硝酸钾从混合物中分离出来。回答下列问题:
(1)分离步骤为:①②趁热过滤③④再过滤⑤洗涤晶体⑥干燥晶体;
(2)过滤所用的玻璃仪器为;
(3)趁热过滤的目的是;
(4)步骤③的理论依据是
;
(5)洗涤晶体的目的是。
5.(8分)(2013)现有一定质量含有少量泥沙等不溶性杂质和少量Na2SO4,MgCl2,CaCl2等可溶性
杂质的粗盐样品,某实验小组利用化学实验室常用仪器对粗盐样品进行提纯,提纯步骤如下:
请根据提纯步骤回答下列问题.
(1)步骤⑦的操作名称为.
(2)请写出实验步骤②中所涉及的化学方程式.
(3)步骤⑥中加入过量盐酸的目的是.
(4)步骤②和步骤④(填“可以”或“不可以”)颠倒,理由是.(5)检验步骤④中Na2CO3溶液已过量的方法是.
六、本节课的收获
1、除杂的原则:不增、不减、易分
2、除杂的思路:①将杂质从混合物中除去;②将有用物质从混合物中取出。
3、除杂的方法:①物理方法:过滤、分馏、结晶、磁铁吸引等
②化学方法:溶解法、洗气法、沉淀法、转化法、加热或灼烧法、多步反应法等
2
初中化学化学除杂分离和提纯解题技巧及练习题 一、中考化学除杂分离和提纯 1.如表中除去物质所含少量杂质的方法,错误的是() A.A B.B C.C D.D 【答案】C 【解析】 试题分析:A、氧气通过灼热的铜网时可与铜发生反应生成氧化铜,而氮气不与铜反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确. B、碳酸钙高温煅烧生成氧化钙和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确. C、盐酸能与过量氢氧化钙溶液反应生成氯化钙和水,能除去杂质但引入了新的杂质氢氧化钙(过量的),不符合除杂原则,故选项所采取的方法错 误. D、氯化镁能与过量氢氧化钠溶液反应生成氢氧化镁沉淀和氯化钠,再过滤、向滤液中加适量稀盐酸除去过量的氢氧化钠,至溶液pH=7,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.故选C. 考点:物质除杂或净化的探究;常见气体的检验与除杂方法;酸的化学性质;盐的化学性质. 2.除去下列物质中含有的少量杂质,所用试剂或方法不正确的是()
A.A B.B C.C D.D 【答案】D 【解析】 【分析】 除杂(提纯),是指除去杂质,同时被提纯物质不得改变。 【详解】 A、CuO能与稀硫酸反应生成硫酸铜和水,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故A正确; B、KCl易溶于水,MnO2难溶于水,可采取加水溶解、过滤、洗涤、烘干的方法进行分离除杂,故B正确; C、碳酸钠能与过量稀盐酸反应生成氯化钠、水和二氧化碳,盐酸具有挥发性,再蒸发除去盐酸,能除去杂质且没有引入新的杂质,符合除杂原则,故C正确; D、除去二氧化碳中的一氧化碳不能够点燃,当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的,故D不正确。故选D。 【点睛】 除杂条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。 3.除去下列物质中的杂质,选用的方法和试剂正确的是
专题六 物质的分离、除杂和提纯 归纳整理 物质的分离、除杂和提纯是化学实验中的一个重要环节。所谓分离就是用物理或化学的方法将混合物 中的各组分一一分开。分离完成后各组分要保持(经过化学反应使混合物的组分经过转化而分离还要恢复 为)原有的物质组成和状态。除杂和提纯是将混合物中的某组分用物理或化学的方法除去而得到纯物质。 在提纯物质的过程中除了选择合适的试剂外,还应选择适宜的杂质(或产物),以便于同被提纯物进行分 离。 现将有关要点归纳如下: 1、应注意几个“不” ⑴不能“玉石俱焚”。即试剂一般与杂质反应,不与要保留的物质反应。但特殊情况下,所加试剂需 要和保留物质反应,但最终要转化成需要保留的物质。如除去FeCl 3溶液中的NaCl ,可加过量的NaOH 溶 液→过滤→洗涤→加适量稀盐酸。 ⑵“不增”、“不减”。即不增加新的杂质,不减少要保留的物质。 ⑶不污染环境。即要求所选用的除杂方法,不能产生可污染环境的物质。 ⑷不能“旧貌变新颜”。即除杂结束前,要恢复保留物质的原有状态。 2、除杂方法的几个优化原则 ⑴若同时有多种方法能除去杂质,要选择那些简单易行、除杂彻底的方法。 ⑵应尽量选择既可除去杂质,又可增加保留物质的方法,即“一举两得”。 ⑶先考虑物理方法,再用化学方法。 拓展延伸 一、气体的净化与干燥 1、气体净化的几种方法 ⑴吸收法:用吸收剂将杂质气体吸收除去。如,除去CO 中混有的少量CO 2,可先用浓NaOH 溶液吸 收CO 2,再用浓硫酸等干燥剂除去水蒸气。 常见气体吸收剂见下表: ⑵转化法:通过化学反应,将杂质气体转化为所要得到的气体。如,除去CO 2中的少量CO ,可将混合气 体通过足量的灼热CuO ,CO + CuO △ Cu + CO 2 。 2、气体的干燥 气体的干燥是通过干燥剂来实现的,选择干燥要根据气体的性质,一般原则是:酸性干燥剂不能用来 干燥碱性气体,碱性干燥剂不能用来干燥酸性气体,干燥装置由干燥剂状态决定。 ⑵常用干燥装置如下:
第二单元课题一物质的分离与提纯 【归纳整理】 物质的分离、除杂和提纯是化学实验中的一个重要环节。所谓分离就是用物理或化学的方法将混合物中的各组分一一分开。分离完成后各组分要保持(经过化学反应使混合物的组分经过转化而分离还要恢复为)原有的物质组成和状态。除杂和提纯是将混合物中的某组分用物理或化学的方法除去而得到纯物质。在提纯物质的过程中除了选择合适的试剂外,还应选择适宜的杂质(或产物),以便于同被提纯物进行分离。 现将有关要点归纳如下: 1. 应注意几个“不” ⑴不能“玉石俱焚”。即试剂一般与杂质反应,不与要保留的物质反应。但特殊情况下,所加试剂需要和保留物质反应,但最终要转化成需要保留的物质。如除去FeCl3溶液中的NaCl,可加过量的NaOH溶液→过滤→洗涤→加适量稀盐酸。 ⑵“不增”、“不减”。即不增加新的杂质,不减少要保留的物质。 ⑶不污染环境。即要求所选用的除杂方法,不能产生可污染环境的物质。 ⑷不能“旧貌变新颜”。即除杂结束前,要恢复保留物质的原有状态。 2. 除杂方法的几个优化原则 ⑴若同时有多种方法能除去杂质,要选择那些简单易行、除杂彻底的方法。 ⑵应尽量选择既可除去杂质,又可增加保留物质的方法,即“一举两得”。 ⑶先考虑物理方法,再用化学方法。 【拓展延伸】 一、气体的净化与干燥 1. 气体净化的几种方法 ⑴吸收法:用吸收剂将杂质气体吸收除去。如,除去CO中混有的少量CO2,可先用浓NaOH溶液吸收CO2,再用浓硫酸等干燥剂除去水蒸气。 吸收剂吸收的气体杂质吸收剂吸收的气体杂质 水可溶性气体:HCl、NH3等NaOH固体CO2、HCl、H2O 无水CuSO4H2O 碱石灰CO2、HCl、H2O 灼热的铜网O2NaOH溶液CO2、HCl 灼热的CuO H2、CO 浓硫酸H2O ⑵转化法:通过化学反应,将杂质气体转化为所要得到的气体。如,除去CO2中的少量CO, 可将混合气体通过足量的灼热CuO,CO + CuO △ Cu + CO2。 2. 气体的干燥 气体的干燥是通过干燥剂来实现的,选择干燥要根据气体的性质,一般原则是:酸性干燥剂
『中考真题·分项详解』『真金试炼·备战中考』
编在前面: 历年的中考卷可以让学生认识到中考的题型,命题风格,各知识板块的分值分布,考查的重点及难点。这对于初三学生备战中考具有很大的指导意义。而且历年的中考真题还有中考风向标的作用,学生可以通过中考试卷分析命题趋势自我预测一下可能会出现的重点难点。这对于学生来说帮助非常大。 很多学生在初三在复习阶段会买很多的预测试卷儿或者是模拟题。虽然也能够帮助学生扩展题面见识更多的题型,但是这些复习资料是与中考真题相比是无法比拟的。利用好中考真题可以获得事半功倍的效果。 老师通常会在中考第二轮复习期间要求学生做至少三遍中考真题,每一遍都会有不同的侧重点。通常第一遍就是按照中考节奏去完成试卷。目的就是为了让学生能够掌握中考的节奏。了解中考题试卷难易的题型分布等。中考真题通常是80%是基础题型,20%是难题。第一遍做中考真题并不强调分数的重要性。主要是要把握中考的做题节奏,合理安排时间。第二遍通常要注重准确率。因为通过第一遍做题和对答案以后,需要花时间对错题进行分析,对难题做出归纳总结。掌握中考真题的做题思路和方法。而且在做第二遍的时候,要尽可能的去缩短时间。同时避免再犯第一次做题的错误,以能够锻炼做题的速度和准确率。做第三遍的时候就要要求百分之百的正确率。因为经过前两次的反复练习,对中考真题已经很熟悉。尤其是对中考试卷进行研究以后,那么对于平时的模拟考试,就会显得非常简单。一般情况下模拟考试的题型都能够在之前的中考真题中找到真实题型!需要注意的是,如果在第三次,做中考真题的时候还会出现错误,那就需要好好地反省一下了。 中考真题的作用是独一无二的,你做再多的模拟试卷都不如做一套中考真题作用大,所以在考试前一定要认真做中考真题,并总结分析真题规律!
关于初中化学中物质的除杂与分离 物质的除杂就是除去种物质中混有的其他质。除杂方法有物理方法如洗涤、解、过滤、蒸发、吸附等;学方法如一定条件下加入某种学试剂,通过化学应将杂质反应掉或杂质转化成所要保留物质。除杂要求是能除去杂质,但混入新杂质,并且不坏要保留的物质。在实际操作,物理方法和化学法常常是联合使用。 例如要除去固体NaOH中有的Na2CO3,操作方法:将混合物加水溶解后并加入适量石灰水充反应后,过滤,再将滤液干便得到所需要的固体NaOH: Na2CO3+Ca2===2NaOH+CaCO3↓ 题中选择除杂试剂是键。 如果选择盐酸做除杂剂,就会在除去Na2CO3同时破坏了要保留的物质NaOH: Na2CO3+2HCl===2NaCl+CO2↑+H2O,NaOH+HCl===NaCl+H2O 如选择CaCl2做除试剂,虽然可除去Na2CO3,但混入新杂质NaCl:Na2CO3+CaCl2===CaCO3↓+2NaCl 所以本题不能选用盐酸或CaCl2做除杂试剂。另外加石水必须适量,加少了质除不净,加多了剩余的灰水又作为新杂质混入其中。 最后要将滤液蒸干,因为我需要的是固体NaOH,而不是它溶液。 物质的除杂与离很相似,但又有所不同。除杂是要将杂质除去就行;而分离将几种物质分开,几物质都需要,且都不能破坏。
现有一氧化碳和二氧碳组成的混合气体,若将二化碳当杂质除去,只保留一化碳,这就是一个除杂问题可以把混合气体通过NaOH溶液:2NaOH+CO2===Na2CO3+H2O 若一氧化碳和二氧化碳分开,既要一化碳又要二氧化碳,这是一个分离问题。其操方法是:先将混合气通过NaOH溶液,首先收集一氧化碳;再向刚才通过混合体的溶液中加入适盐酸,第二步收集到二氧化碳,从间接的将一氧化碳和氧化碳分离开来: CO2+2NaOH===Na2CO3+H2O,Na2CO3+2HCl===2NaCl+CO2↑+H2O 除去或化二氧化碳用NaOH溶液,因该反应进行彻底,转化快;验二氧化碳用澄清石水,因为该反应灵敏、现象明显且独立性。
除杂的原则: (1)不增:不增加新的杂质 (2)不减:被提纯的物质不能减少 (3)易分:操作简便,易于分离 常见物质除杂总结 原物所含杂质除杂质试剂除杂质的方法 (1)N2(O2)-------灼热的铜丝网洗气 (2)CO2(H2S)-------硫酸铜溶液洗气 (3)CO(CO2)-------石灰水或烧碱液洗气 (4)CO2(HCl)-------饱和小苏打溶液洗气 (5)H2S(HCl)-------饱和NaHS溶液洗气 (6)SO2(HCl)-------饱和NaHSO3溶液洗气 (7)Cl2(HCl)-------饱和NaCl溶液洗气 (8)CO2(SO2)-------饱和小苏打溶液洗气 (9)碳粉(MnO2)-------浓盐酸加热后过滤 (10)MnO2(碳粉)-------加热灼烧 (11)碳粉(CuO)-------盐酸或硫酸过滤 (12)Al2O3(Fe2O3)-------NaOH溶液(过量),再通CO2过滤、加热固体 (13)Fe2O3(Al2O3)-------NaOH溶液过滤 (14)Al2O3(SiO2)-------盐酸NH3·H2O过滤、加热固体 (15)SiO2(ZnO)-------盐酸过滤 (16)CuO(ZnO)-------NaOH溶液过滤 (17)BaSO4(BaCO3)-------稀硫酸过滤 (18)NaOH(Na2CO3)-------Ba(OH)2溶液(适量)过滤 (19)NaHCO3(Na2CO3)-------通入过量CO2 (20)Na2CO3(NaHCO3)-------加热
(21)NaCl(NaHCO3)-------盐酸蒸发结晶 (22)NH4Cl[(NH4)2SO4]-------BaCl2溶液(适量)过滤 (23)FeCl3(FeCl2)-------通入过量Cl2 (24)FeCl3(CuCl2)-------铁粉、Cl2过滤 (25)FeCl2(FeCl3)-------铁粉过滤 (26)Fe(OH)3胶体(FeCl3)-------(半透膜)渗析 (27)CuS(FeS)-------稀盐酸或稀硫酸过滤 (28)I2(NaCl)------升华 (29)NaCl(NH4Cl)-------加热 (30)KNO3(NaCl)-------蒸馏水重结晶 (31)乙烯(SO2、H2O)碱石灰洗气 (32)乙烷(乙烯)-------溴水洗气 (33)溴苯(溴)-------稀NaOH溶液分液 (34)硝基苯(NO2)-------稀NaOH溶液分液 (35)甲苯(苯酚)-------NaOH溶液分液 (36)乙醛(乙酸)-------饱和Na2CO3溶液蒸馏 (37)乙醇(水)-------新制生石灰蒸馏 (38)苯酚(苯)-------NaOH溶液、CO2分液 (39)乙酸乙酯(乙酸)-------饱和Na2CO3溶液分液 (40)溴乙烷(乙醇)-------蒸馏水分液 (41)肥皂(甘油)-------食盐过滤 (42)葡萄糖(淀粉)-------(半透膜)渗析 气体除杂的原则: (1)不引入新的杂质 (2)不减少被净化气体的量注意的问题: ①需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最后除去。 ②除杂选用方法时要保证杂质完全除掉,如:除CO2最好用NaOH不用Ca(OH)2
物质的分离、除杂和提纯 北重一中 卜丽玲 【知识疏理】 一、物质的分离和提纯原理 不增 不减、易分 二、物质的分离和提纯方法 (一)、常用的物理方法:利用物质物理性质的不同,采用相应的分离方法。 1. 过滤法:当可溶性物质混入不溶性物质或不溶性物质中混有可溶性物质时,用此法。 如:食盐中混有泥沙,可按如下步骤: ①先将混合物溶于水。 ②过滤。 ③将滤液蒸发得NaCl 。 2. 结晶法:当两种物质都可溶,但溶解度随温度变化差异较大时,用此法。如:KNO 3 中混入NaCl ,可按如下步骤:①溶于水加热,把混合物制成高温下的饱和溶液。②降温结 晶。③过滤。 3. 升华法:当易升华物质与其他物质相混合时,可用此法。如:碘单质中混有砂子,其 操作是:①加热使碘升华,收集碘蒸气。②冷凝,得单质碘。 4. 特殊性质法:利用混合物中某些物质的特性进行物质分离。如:Cu 粉中混有Fe 粉, 可用磁铁吸出铁粉。 (二)、常用的化学方法:化学方法是利用两种物质化学性质的差异,选用合适的试剂,进 行化学反应,然后再用物理方法分离。(关键是转变物质的状态) 1. 沉淀法:即加入一种试剂和杂质反应生成沉淀经过滤而除去。如:HNO 3中混有H 2SO 4, 可加入适量的Ba(NO 3)2溶液: 342342HNO BaSO )NO (Ba SO H +↓=+ 2. 化气法:即加入一种试剂和杂质反应,使其生成气体而除去。如一般某盐中混有少量
碳酸盐、碳酸氢盐等常用此法除去。如NaCl 溶液中混有Na 2CO 3,可加入适量的稀盐酸: ↑++=+2232CO O H NaCl 2HCl 2CO Na 3. 置换法:即在某盐溶液中加入某金属,把盐溶液中的金属置换出来,从而把杂质除去。 如4ZnSO 溶液中混有4CuSO ,可加入过量的锌: Cu ZnSO CuSO Zn 44+=+ 4. 转化法:即通过某种方法,把杂质转化为被提纯的物质。如CO 2气体中混有少量的CO , 可将混合气体通过盛有足量灼热的CuO 的试管: 2CO Cu CuO CO +?+ 5. 加热法:即通过加热的方法使杂质转化为气体或使杂质分解变成气体而除去。如CuO 中混有少量的木炭粉,可把混合物放在氧气流中加热,使C 转化为CO 2气体而除去: 22CO O C 点燃+ 6. 吸收法:即把混合气体通过某溶液,使其中杂质被吸收。如CO 中混有少量CO 2,可 将混合气体通入足量的NaOH 溶液,CO 2被吸收而除去: O H CO Na NaOH CO 2322+=+ 7. 溶解法:即往混合物中加入某种溶液将杂质溶解而除去。如Cu 里混有少量CuO ,可 往其中加入足量稀硫酸(或盐酸)CuO 溶解过滤而除去: O H CuSO SO H CuO 2442+=+ 三、物质的分离与提纯原则 1、对于物质的提纯和分离,不论用何种方法都应遵循以下原则:①不增:即在除掉杂 质时不增加新杂质。②不减:即被提纯的物质不能减少或改变。③易分:即操作简便易行, 杂质易分离除去,即反应后的生成物必须容易分离(最好是转化为沉淀或气体)。④最佳:即 最好在除去杂质的同时能增加被提纯物质的量。④不污染环境。即要求所选用的除杂方法, 不能产生可污染环境的物质。 2、除杂方法的几个优化原则 (1)若同时有多种方法能除去杂质,要选择那些简单易行、除杂彻底的方法。 (2)应尽量选择既可除去杂质,又可增加保留物质的方法,即“一举两得”。 (3)先考虑物理方法,再用化学方法。
常见物质的检验 2.几种重要阳离子的检验 (l)H+能使紫色石蕊试液或橙色的甲基橙试液变为红色。 (2)Na+、K+用焰色反应来检验时,它们的火焰分别呈黄色、浅紫色(通过钴玻片)。 (3)Ba2+能使稀硫酸或可溶性硫酸盐溶液产生白色BaSO4沉淀,且沉淀不溶于稀硝酸。 (4)Mg2+能与NaOH溶液反应生成白色Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液。 (5)Al3+能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液。 (6)Ag+能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀HNO3,但溶于氨水,生成[Ag(NH3)2]+。 (7)NH4+铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出使湿润的红色石蓝试纸变蓝的有刺激性气味NH3气体。 (8)Fe2+能与少量NaOH溶液反应,先生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新制的氯水后,立即显红色。2Fe2++Cl2=2Fe3++2Cl - (9)Fe3+能与KSCN溶液反应,变成血红色Fe(SCN)3溶液,能与NaOH溶液反应,生成红褐色Fe(OH)3沉淀。 (10)Cu2+蓝色水溶液(浓的CuCl2溶液显绿色),能与NaOH溶液反应,生成蓝色的Cu(OH)2沉淀,加热后可转变为黑色的CuO沉淀。含Cu2+溶液能与Fe、Zn片等反应,在金属片上有红色的铜生成。 3.几种重要的阴离子的检验 (1)OH-能使无色酚酞、紫色石蕊、橙色的甲基橙等指示剂分别变为红色、蓝色、黄色。 (2)Cl-能与硝酸银反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水,生成[Ag(NH3)2]+。 (3)Br-能与硝酸银反应,生成淡黄色AgBr沉淀,不溶于稀硝酸。 (4)I-能与硝酸银反应,生成黄色AgI沉淀,不溶于稀硝酸;也能与氯水反应,生成I2,使淀粉溶液变蓝。
一、物质除杂净化的原则: 1.不能把物质中的主要成分除掉。 2.不能带入新的杂质。 3.操作方法简便易行。 4.除杂后恢复原物质的状态。问:除去生石灰中的石灰石加稀盐酸(为什么错?)问:除去 Al2(SO4)3 溶液中 CuSO4 加过量锌(为什么错?)二、物质除杂净化的方法: 1.物理方法(没有产生新物质):(1)过滤法:把不溶于液体的固体与液体分开。步骤:先将混合物加水溶解,由于氯化钙溶于水,而碳酸钙难溶于水,过滤除去固体杂质碳酸钙,然后蒸发滤液,得到固体氯化钙。问题:如何除去氯化钙中少量碳酸钙杂质?二、物质除杂净化的方法:(2)结晶法:除去可溶性固体组成的混合物中的杂质。步骤:先在较高温度下制成硝酸钾的饱和溶液,然后逐步冷却,由于硝酸钾的溶解度随温度的升高而显著增大,温度降低,大部分硝酸钾成为晶体析出,而氯化钠的溶解度受温度影响不大,所以大部分氯化钠仍留在母液中,通过过滤把硝酸钾晶体和氯化钠溶液分开。注意:结晶法分为降温结晶和蒸发结晶。问题:如何除去固体硝酸钾中少量的氯化钠杂质?思考:如何除去固体氯化钠中少量的硝酸钾杂质?(此方法为降温结晶)二、物质除杂净化的方法: 2.化学方法(通过化学反应除杂):(1)沉淀法:使混合物中的杂质与适量试剂反应,生成沉淀通过过滤而除去。问题:如何除去氯化钠中少量碳酸钠杂质?步骤:除去氯化钠中少量碳酸钠杂质。先将混合物加水溶解,加适量氯化钙溶液,过滤除去固体沉淀,然后蒸发滤液,得到固体氯化钠。二、物质除杂净化的方法:(2)转化为气体或水法:使混合物中的杂质与适量试剂反应,生成气体或
水除去。问题:除氯化钠中少量碳酸钠杂质还可以用什么方法?步骤:除去氯化钠中少量碳酸钠杂质。先将混合物加水溶解,加适量稀盐酸,无气泡产生后,然后蒸发液体,得到固体氯化钠。二、物质除杂净化的方法:(3)置换法:将混合物中的杂质与适量试剂通过发生置换反应而除去。问题:如何除去硫酸锌固体中少量的硫酸铜杂质?步骤:硫酸锌固体中含有少量硫酸铜杂质,可将混合物溶解之后,加人适量锌粉,再过滤除去被置换出来的铜,蒸发滤液获得硫酸锌固体。二、物质除杂净化的方法: 2.化学方法(通过化学反应除杂):(4)吸收法:两种以上混合气体中的气体杂质被液体吸收,而要提纯的气体不能被吸收。如:一氧化碳含有少量的二氧化碳,可将气体混合物通过足量的氢氧化钠溶液吸收二氧化碳。二、物质除杂净化的方法:(5)其他法:高温或加热等。如:生石灰含有少量的石灰石,可以通过高温煅烧除杂。如:一氧化碳含有少量的二氧化碳,也可将气体混合物通过高温炽热的碳。三、物质除杂净化的实验操作方法: 1. 过滤:把不溶于液体的固体与液体分开。 2. 蒸发:提取溶液中的固体溶质。 3. 洗涤:把过滤后固体表面的溶液洗净。 4. 干燥:把固体中的水分除去。三、物质除杂净化的实验操作方法: 5. 操作方法的综合使用:(1)得到溶液中的溶质:过滤后滤液蒸发。如:粗盐提纯,加水溶解,过滤后滤液蒸发。(2)得到溶液中的固体:过滤后洗涤干燥。如:铜粉中混有少量铁,加足量稀硫酸后,过滤,固体洗涤干燥。四、物质除杂净化的实验装置:甲:通过固体试剂与气体杂质加热反应除去。如除去
物质的分离、除杂和提纯 归纳整理 物质的分离、除杂和提纯是化学实验中的一个重要环节。所谓分离就是用物理或化学的方法将混合物中的各组分一一分开。分离完成后各组分要保持(经过化学反应使混合物的组分经过转化而分离还要恢复为)原有的物质组成和状态。除杂和提纯是将混合物中的某组分用物理或化学的方法除去而得到纯物质。在提纯物质的过程中除了选择合适的试剂外,还应选择适宜的杂质(或产物),以便于同被提纯物进行分离。 现将有关要点归纳如下: 1、应注意几个“不” ⑴不能“玉石俱焚”。即试剂一般与杂质反应,不与要保留的物质反应。但特殊情况下,所加试剂需要和保留物质反应,但最终要转化成需要保留的物质。如除去FeCl 3溶液中的NaCl ,可加过量的NaOH 溶液→过滤→洗涤→加适量稀盐酸。 ⑵“不增”、“不减”。即不增加新的杂质,不减少要保留的物质。 ⑶不污染环境。即要求所选用的除杂方法,不能产生可污染环境的物质。 ⑷不能“旧貌变新颜”。即除杂结束前,要恢复保留物质的原有状态。 2、除杂方法的几个优化原则 ⑴若同时有多种方法能除去杂质,要选择那些简单易行、除杂彻底的方法。 ⑵应尽量选择既可除去杂质,又可增加保留物质的方法,即“一举两得”。 ⑶先考虑物理方法,再用化学方法。 拓展延伸 一、气体的净化与干燥 1、气体净化的几种方法 ⑴吸收法:用吸收剂将杂质气体吸收除去。如,除去CO 中混有的少量CO 2,可先用浓NaOH 溶液吸收CO 2,再用浓硫酸等干燥剂除去水蒸气。 常见气体吸收剂见下表: 2可将混合气体通过足量的灼热CuO ,CO + CuO △ Cu + CO 2。 2、气体的干燥 气体的干燥是通过干燥剂来实现的,选择干燥要根据气体的性质,一般原则是:酸性干燥剂不能用来干燥碱性气体,碱性干燥剂不能用来干燥酸性气体,干燥装置由干燥剂状态决定。
2019-2020学年中考化学二轮复习专题突破专题3 常见物质的分离、除 杂、提纯教案 【复习目标】 1、了解除杂的定义、方法、原则,会应用它除去杂质; 2、了解物质分离、提纯定义、方法,会应用分离、提纯解决问题。 【课时安排】教学安排:2课时 【复习重点和难点】 1、了解除杂的定义、方法、原则,会应用它除去杂质; 2、了解物质分离、提纯定义、方法,会应用分离、提纯解决问题。 【教学过程】 (一)、知识梳理: 物质的分离、除杂和提纯是化学实验中的一个重要环节。所谓分离就是用物理或化学的方法将混合物中的各组分一一分开。分离完成后各组分要保持(经过化学反应使混合物的组分经过转化而分离还要恢复为)原有的物质组成和状态。除杂和提纯是将混合物中的某组分用物理或化学的方法除去而得到纯物质。在提纯物质的过程中除了选择合适的试剂外,还应选择适宜的杂质(或产物),以便于同被提纯物进行分离。 现将有关要点归纳如下: 1、应注意几个“不” ⑴不能“玉石俱焚”。即试剂一般与杂质反应,不与要保留的物质反应。但特殊情况下,所加试剂需要和保留物质反应,但最终要转化成需要保留的物质。如除去FeCl3溶液中的NaCl,可加过量的NaOH溶液→过滤→洗涤→加适量稀盐酸。 ⑵“不增”、“不减”。即不增加新的杂质,不减少要保留的物质。 ⑶不污染环境。即要求所选用的除杂方法,不能产生可污染环境的物质。 ⑷不能“旧貌变新颜”。即除杂结束前,要恢复保留物质的原有状态。 2、除杂方法的几个优化原则 ⑴若同时有多种方法能除去杂质,要选择那些简单易行、除杂彻底的方法。 ⑵应尽量选择既可除去杂质,又可增加保留物质的方法,即“一举两得”。 ⑶先考虑物理方法,再用化学方法。 拓展延伸
专题16 物质的检验与鉴别、除杂(提纯)、分离1.(2015陕西13题2分)下列各组物质用稀硫酸不能 ..完全区分开的是() A. 镁粉、氧化铜粉、木炭粉 B. NaOH溶液、Ba(OH)2溶液、KOH溶液 C. Na2CO3溶液、NaCl溶液、BaCl2溶液 D. 铝片、铁片、银片 2.(2014陕西15题2分)下列实验所对应的两种方案均正确的是() 3.(2016陕西副题14题2分)区分下列同类物质的两种方案均正确的是() .. ... 6.(2013陕西15题2分)下列实验能达到实验目的的是()
拓展训练 7. (2018天津)下列有关实验方案设计正确的是() 8.(2018锦州)在“粗盐中难溶性杂质的去除”的实验课上,同学们制得了“白色的盐”,小刚很高兴,并大声 地说:“我制得了纯净的NaCl。”老师否定了他的说法,并解释说:“同学们制得的白色的盐中除了含有NaCl以外,还含有MgCl2、CaCl2、Na2SO4等可溶性杂质。”于是同学们为了得到更纯的NaCl,设计了如下的实验方案: 第8题图 请回答下列问题: (1)沉淀A的化学式是________。 (2)若将步骤④和⑤顺序颠倒会引发的后果是________________。 (3)沉淀B中除了含有CaCO3以外还含有________________。(填化学式) (4)滤液乙中含有的阴离子是______________。(填离子符号) (5)小刚向滤液乙中,滴入几滴稀盐酸后就进行蒸发操作。丽丽马上制止,并设计实验,探究蒸发皿内溶 液中除了NaCl以外,是否还含有其他溶质。于是,取少量该溶液于试管中,接下来进行的操作是 ______________________________________。观察到的现象是______________________。由此得出该溶液中溶质成分为NaCl和Na2CO3。如果用该溶液蒸发结晶,则得不到更纯的NaCl。
一、中考初中化学除杂分离和提纯 1.下列除去杂质的方法中,不正确的是() A.①②B.②③C.③④D.②④ 【答案】D 【解析】 【分析】 【详解】 ①氯化钠易溶于水,泥沙难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,故选项所采取的方法正确; ②二氧化碳能与氢氧化钠固体反应生成碳酸钠和水,氢氧化钠固体具有吸水性,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误; ③铁粉能与CuSO4反应生成硫酸亚铁和铜,再过滤除去不溶物,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确; ④Na2CO3能与过量的Ca(OH)2溶液反应生成碳酸钙沉淀和氢氧化钠,能除去杂质但引入了新的杂质氢氧化钙,不符合除杂原则,故选项所采取的方法错误,故②④方法不正确,故选D。 【点睛】 本题为除杂题,是中考的重点,也是难点,解决除杂问题时,抓住除杂的必需条件(加入的试剂只与杂质反应,反应后不能引入新杂质)是正确解题的关键。 2.除去下列物质中的杂质,所用试剂和方法不正确的是()
A.A B.B C.C D.D 【答案】D 【解析】 【分析】 【详解】 A、KC1易溶于水,泥沙难溶于水,可采取加水溶解、过滤、蒸发的方法进行分离除杂,选项A正确; B、CO2能与氢氧化钠溶液反应生成碳酸钠和水,CO不与氢氧化钠溶液反应,能除去杂质且没有引入新的杂质,符合除杂原则,选项B正确; C、盐酸能与过量的碳酸钙反应生成氯化钙、水和二氧化碳,再过滤除去过量的碳酸钙,能除去杂质且没有引入新的杂质,符合除杂原则,选项C正确; D、Ca(OH)2能与过量碳酸钠溶液反应生成碳酸钙沉淀和氢氧化钠,能除去杂质但引入了新的杂质碳酸钠(过量的),不符合除杂原则,选项D不正确。故选D。 【点睛】 除杂质至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。 3.下列选项中的除杂方法不能达到目的的是() A.A B.B C.C D.D 【答案】D 【解析】 【分析】 除杂(提纯),是指除去杂质,同时被提纯物质不得改变。 【详解】
物质的分离、除杂和提纯 北重一中 卜丽玲 【知识疏理】 一、物质的分离和提纯原理 不增 不减、易分 二、物质的分离和提纯方法 (一)、常用的物理方法:利用物质物理性质的不同,采用相应的分离方法。 1. 过滤法:当可溶性物质混入不溶性物质或不溶性物质中混有可溶性物质时,用此法。如:食盐中混有泥沙,可按如下步骤: ①先将混合物溶于水。 ②过滤。 ③将滤液蒸发得NaCl 。 2. 结晶法:当两种物质都可溶,但溶解度随温度变化差异较大时,用此法。如:KNO 3中混入NaCl ,可按如下步骤:①溶于水加热,把混合物制成高温下的饱和溶液。②降温结晶。③过滤。 3. 升华法:当易升华物质与其他物质相混合时,可用此法。如:碘单质中混有砂子,其操作是:①加热使碘升华,收集碘蒸气。②冷凝,得单质碘。 4. 特殊性质法:利用混合物中某些物质的特性进行物质分离。如:Cu 粉中混有Fe 粉,可用磁铁吸出铁粉。 (二)、常用的化学方法:化学方法是利用两种物质化学性质的差异,选用合适的试剂,进行化学反应,然后再用物理方法分离。(关键是转变物质的状态) 1. 沉淀法:即加入一种试剂和杂质反应生成沉淀经过滤而除去。如:HNO 3中混有H 2SO 4,可加入适量的Ba(NO 3)2溶液: 342342HNO BaSO )NO (Ba SO H +↓=+ 2. 化气法:即加入一种试剂和杂质反应,使其生成气体而除去。如一般某盐中混有少量碳酸盐、碳酸氢盐等常用此法除去。如NaCl 溶液中混有Na 2CO 3,可加入适量的稀盐酸: ↑++=+2232CO O H NaCl 2HCl 2CO Na 3. 置换法:即在某盐溶液中加入某金属,把盐溶液中的金属置换出来,从而把杂质除去。如4ZnSO 溶液中混有4CuSO ,可加入过量的锌:
物质除杂的原则是: ①不增,即在除去杂质的同时,不能引入新的杂质; ②不减,即不能减少被提纯的物质; ③简便,即分离操作简便易行; ④易得,即除杂试剂价格便宜,容易得到; ⑤最好,即所选用的方法在保证除去杂质的同时,最好能增加被提纯物质的量。 常见的物质除杂方法有以下几种: 一、利用物理性质的差异 1.溶解性差异法:如果提纯物质与杂质在溶解性上有明显差异时,可用溶解性差异法除杂。 2.结晶法:若混合物中各组分在某一溶剂中的溶解度随温度变化不同时,可采用结晶法除杂。 3.萃取分液法:利用溶质在互不相溶的溶剂里溶解度不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提取出来,然后利用分液漏斗将其分开。 4.升华法:把能够升华的固体物质和不能挥发的固体物质分开。 5.磁铁法:利用磁铁能把铁吸引,可以把铁从其他不能被铁吸引的杂质中分离出来或从不能被铁吸引的物质中把铁杂质除去。 6.渗析法:把混有离子或分子杂质的胶体装入半透膜袋里,并把袋放入溶剂中,从而使离子或分子从胶体溶液里分离的操作,叫做渗析。渗析法主要用来提纯、精制液溶胶。来源: 7.蒸馏法:利用物质沸点不同,来分离互溶混合物。 二、利用化学性质的差异1.热分解法:对于稳定性差异较大的固体混合物,可采用热分解法。 2.氧化还原法:利用物质的氧化性与还原性,将杂质氧化或还原,使其转化为易于分离的物质。 3.络合法:加入络合剂,将杂质转化为可溶性络合物,使之易与所需的物质分离。 4.沉淀法:用化学试剂将液体或气体混合物中的杂质转变为沉淀除去。 5.酸碱溶解法:利用固体杂质与酸或碱反应的性质,将杂质转变为可溶性的盐而除去。 6.酸、碱洗涤法:利用杂质与酸或碱反应的性质,将气体混合物中的杂质分别转入酸溶液或碱溶液。 除杂的三原则: (1)将杂质转变成与被提纯的物质状态不同的物质除掉,例如转变成气体、水、沉淀。 (2)不能把被提纯的物质反应掉(3)在除杂之后不能引进新的杂质 常见的除杂题目类型 1、水为杂质:R(H2O) 试剂:三大干燥剂,浓硫酸、氢氧化钠固体、生石灰 选择:若R为中性气体(H2、O2、N2、CO)则选择哪个干燥剂都可以; 若R为酸性气体(HCl、SO2、CO2)只能选择浓硫酸(H2S除外); 若R为碱性气体(NH3)只能选择固体氢氧化钠(氨气可以和生石灰生成配合物) 2、有规律可循的题目:XY(XZ) 找出物质和杂质之间的不同部分(Z),然后用对应的离子N将Z转化成气体、水或沉淀。具体加入的物质应该为NY,才不会引进其他的杂质。 例如: (1)KCl(K2CO3) A:不同的部分就是CO32-,可以将其转化为CO2除去,所以需要加入H+,应该加入HCl,发生K2CO3+2HCl=2KCl+ H2O +CO2↑ B:也可以将可以将其转化为沉淀除去,常见的碳酸盐沉淀有CaCO3、BaCO3,所以可以加入Ca2+
物质的分离、除杂和提纯 北重一中 卜丽玲 【知识疏理】 一、物质的分离和提纯原理 不增 不减、易分 二、物质的分离和提纯方法 (一)、常用的物理方法:利用物质物理性质的不同,采用相应的分离方法。 1. 过滤法:当可溶性物质混入不溶性物质或不溶性物质中混有可溶性物质时,用此法。 如:食盐中混有泥沙,可按如下步骤: ①先将混合物溶于水。 ②过滤。 ③将滤液蒸发得NaCl 。 2. 结晶法:当两种物质都可溶,但溶解度随温度变化差异较大时,用此法。如:KNO 3 中混入NaCl ,可按如下步骤:①溶于水加热,把混合物制成高温下的饱和溶液。②降温结 晶。③过滤。 3. 升华法:当易升华物质与其他物质相混合时,可用此法。如:碘单质中混有砂子,其 操作是:①加热使碘升华,收集碘蒸气。②冷凝,得单质碘。 4. 特殊性质法:利用混合物中某些物质的特性进行物质分离。如:Cu 粉中混有Fe 粉, 可用磁铁吸出铁粉。 (二)、常用的化学方法:化学方法是利用两种物质化学性质的差异,选用合适的试剂,进 行化学反应,然后再用物理方法分离。(关键是转变物质的状态) 1. 沉淀法:即加入一种试剂和杂质反应生成沉淀经过滤而除去。如:HNO 3中混有H 2SO 4, 可加入适量的Ba(NO 3)2溶液: 342342HNO BaS O )NO (Ba S O H +↓=+ 2. 化气法:即加入一种试剂和杂质反应,使其生成气体而除去。如一般某盐中混有少量 碳酸盐、碳酸氢盐等常用此法除去。如NaCl 溶液中混有Na 2CO 3,可加入适量的稀盐酸: ↑++=+2232CO O H NaCl 2HCl 2CO Na 3. 置换法:即在某盐溶液中加入某金属,把盐溶液中的金属置换出来,从而把杂质除去。 如4ZnSO 溶液中混有4CuSO ,可加入过量的锌:
常见物质的除杂方法 除杂的原则: (1)不增:不增加新的杂质 (2)不减:被提纯的物质不能减少 (3)易分:操作简便,易于分离 气体除杂的原则: (1)不引入新的杂质 (2)不减少被净化气体的量注意的问题: ①需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如:氯化氢气体,CO2、SO2等,水蒸气要在最后除去。 ②除杂选用方法时要保证杂质完全除掉,如:除CO2最好用NaOH不用Ca(OH)2溶液,因为Ca(OH)2是微溶物,石灰水中Ca(OH)2浓度小,吸收CO2不易完全。 方法: A. 杂质转化法:欲除去苯中的苯酚,可加入氢氧化钠,使苯酚转化为苯酚钠,利用苯酚钠易溶于水,使之与苯分开 B. 吸收洗涤法;欲除去二氧化碳中混有的少量氯化氢和水,可使混合气体先通过饱和碳酸氢钠溶液,再通过浓硫酸即可除去 C. 沉淀过滤法:欲除去硫酸亚铁溶液中混有的少量硫酸铜,加入少量铁粉,待充分反应后,过滤除去不溶物即可 D. 加热升华法:欲除去碘中的沙子,即可用此法 E. 溶液萃取法:欲除去水中含有的少量溴,可采用此法 F. 结晶和重结晶:欲除去硝酸钠溶液中少量的氯化钠,可利用二者的溶解度不同,降低溶液温度,使硝酸钠结晶析出,可得到纯硝酸钠晶体 G. 分馏蒸馏法:欲除去乙醚中少量的酒精,可采用多次蒸馏的方法 H. 分液法:欲将密度不同且又互不相溶的液体混合物分离,可采用此法,如将苯和水分离 K. 渗析法:欲除去胶体中的离子,可采用此法。如除去氢氧化钠胶体中的氯离子 常见物质除杂总结: 原物所含杂质除杂质试剂除杂质的方法 (1)N2(O2)-------------------------灼热的铜丝网洗气 (2)CO2(H2S)----------------------硫酸铜溶液洗气 (3)CO(CO2)---------------------石灰水或烧碱液洗气 (4)CO2(HCl)-------------------饱和小苏打溶液洗气 (5)H2S(HCl)--------------------饱和NaHS溶液洗气 (6)SO2(HCl)------------------饱和NaHSO3溶液洗气 (7)Cl2(HCl)---------------------饱和NaCl溶液洗气 (8)CO2(SO2)--------------------饱和小苏打溶液洗气 (9)碳粉(MnO2)------------------浓盐酸加热后过滤 (10)MnO2(碳粉) 加热灼烧 (11)碳粉(CuO)-------------------盐酸或硫酸过滤 (12)Al2O3(Fe2O3)--------------NaOH溶液(过量)再通CO2 过滤、加热固体
物质的分离、除杂和提纯 北重一中 卜丽玲 【知识疏理】 一、物质的分离和提纯原理 不增 不减、易分 二、物质的分离和提纯方法 (一)、常用的物理方法:利用物质物理性质的不同,采用相应的分离方法。 1. 过滤法:当可溶性物质混入不溶性物质或不溶性物质中混有可溶性物质时,用此法。如:食盐中混有泥沙,可按如下步骤: ①先将混合物溶于水。 ②过滤。 ③将滤液蒸发得NaCl 。 2. 结晶法:当两种物质都可溶,但溶解度随温度变化差异较大时,用此法。如:KNO 3中混入NaCl ,可按如下步骤:①溶于水加热,把混合物制成高温下的饱和溶液。②降温结晶。③过滤。 3. 升华法:当易升华物质与其他物质相混合时,可用此法。如:碘单质中混有砂子,其操作是:①加热使碘升华,收集碘蒸气。②冷凝,得单质碘。 4. 特殊性质法:利用混合物中某些物质的特性进行物质分离。如:Cu 粉中混有Fe 粉,可用磁铁吸出铁粉。 (二)、常用的化学方法:化学方法是利用两种物质化学性质的差异,选用合适的试剂,进行化学反应,然后再用物理方法分离。(关键是转变物质的状态) 1. 沉淀法:即加入一种试剂和杂质反应生成沉淀经过滤而除去。如:HNO 3中混有H 2SO 4,可加入适量的Ba(NO 3)2溶液: 342342HNO BaSO )NO (Ba SO H +↓=+ 2. 化气法:即加入一种试剂和杂质反应,使其生成气体而除去。如一般某盐中混有少量碳酸盐、碳酸氢盐等常用此法除去。如NaCl 溶液中混有Na 2CO 3,可加入适量的稀盐酸: ↑++=+2232CO O H NaCl 2HCl 2CO Na 3. 置换法:即在某盐溶液中加入某金属,把盐溶液中的金属置换出来,从而把杂质除去。如4ZnSO 溶液中混有4CuSO ,可加入过量的锌: Cu ZnSO CuSO Zn 44+=+ 4. 转化法:即通过某种方法,把杂质转化为被提纯的物质。如CO 2气体中混有少量的CO ,可将混合气体通过
(化学)初三化学化学除杂分离和提纯技巧和方法完整版及练习题 一、中考化学除杂分离和提纯 1.下列哪种试剂最适合用来除去NaCl 溶液中混有的少量NaOH ( ) A .23Na CO 溶液 B .24H SO 溶液 C .HCl 溶液 D .2Ca(OH)溶液 【答案】C 【解析】 【分析】 【详解】 A 、23Na CO 溶液和NaOH 不反应,不能用于除去NaCl 溶液中混有的少量NaOH ,故A 错; B 、24H SO 溶液和NaOH 发生反应生成硫酸钠和水,会引入新杂质硫酸钠,故B 错; C 、HCl 溶液和NaOH 发生反应生成氯化钠和水,不会引入新杂质,符合题意故C 正确; D 、2Ca(OH)溶液和NaOH 不反应,不能用于除去NaCl 溶液中混有的少量NaOH ,故D 错; 故选:C 。 【点睛】 除杂的原则不引入新杂质,被提纯物质不能减少,杂质容易分离。 2.如表中除去物质所含少量杂质的方法,错误的是( ) A .A B .B C .C D .D 【答案】C
【解析】 试题分析:A、氧气通过灼热的铜网时可与铜发生反应生成氧化铜,而氮气不与铜反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确. B、碳酸钙高温煅烧生成氧化钙和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确. C、盐酸能与过量氢氧化钙溶液反应生成氯化钙和水,能除去杂质但引入了新的杂质氢氧化钙(过量的),不符合除杂原则,故选项所采取的方法错 误. D、氯化镁能与过量氢氧化钠溶液反应生成氢氧化镁沉淀和氯化钠,再过滤、向滤液中加适量稀盐酸除去过量的氢氧化钠,至溶液pH=7,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.故选C. 考点:物质除杂或净化的探究;常见气体的检验与除杂方法;酸的化学性质;盐的化学性质. 3.铝可以被氢氧化钠溶液溶解生成可溶性的偏铝酸钠,下列设计的除杂方案(括号内为杂质)都能达到目的的是() A.A B.B C.C D.D 【答案】A 【解析】 【分析】 除杂(提纯),是指除去杂质,同时被提纯物质不得改变。 【详解】 A、铁粉能被磁铁吸引,铜粉不能,铁粉和稀硫酸反应生成硫酸亚铁和氢气,铜粉和稀硫酸不反应,故A正确; B、镁粉和铝粉均和稀盐酸反应,把原物质除去了,故B不正确; C、一氧化碳点燃生成二氧化碳,把原物质除去了,故C不正确; D、铁粉和氧化铁均与稀盐酸反应,把原物质除去了,故D不正确。故选A。 【点睛】 除杂条件:加入的试剂只能与杂质反应,不能与原物质反应;反应后不能引入新的杂质。 4.除去下列物质中的杂质,选用的方法和试剂正确的是