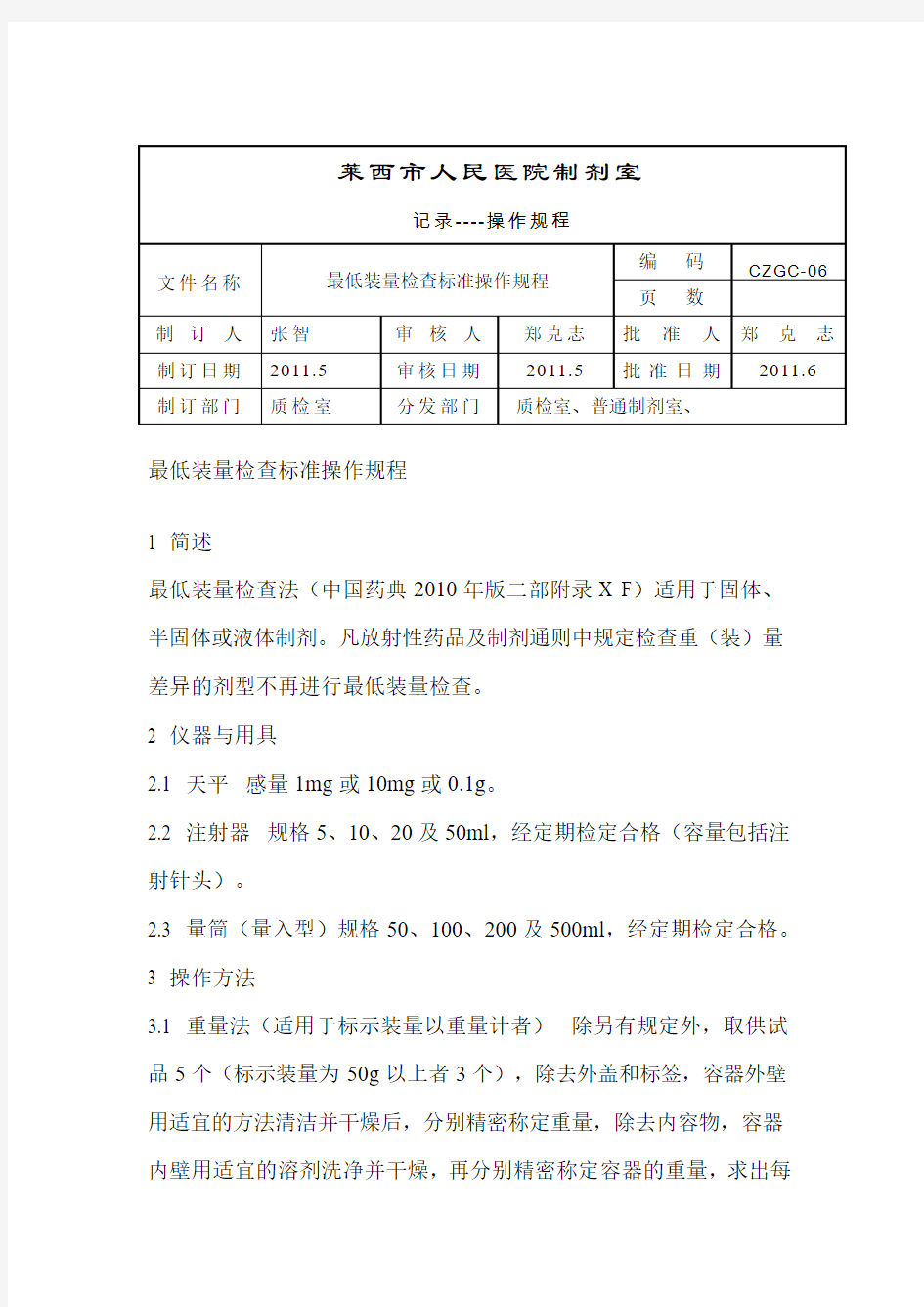

最低装量检查标准操作规程
1 简述
最低装量检查法(中国药典2010年版二部附录X F)适用于固体、半固体或液体制剂。凡放射性药品及制剂通则中规定检查重(装)量差异的剂型不再进行最低装量检查。
2 仪器与用具
2.1 天平感量1mg或10mg或0.1g。
2.2 注射器规格5、10、20及50ml,经定期检定合格(容量包括注射针头)。
2.3 量筒(量入型)规格50、100、200及500ml,经定期检定合格。
3 操作方法
3.1 重量法(适用于标示装量以重量计者)除另有规定外,取供试品5个(标示装量为50g以上者3个),除去外盖和标签,容器外壁用适宜的方法清洁并干燥后,分别精密称定重量,除去内容物,容器内壁用适宜的溶剂洗净并干燥,再分别精密称定容器的重量,求出每
个容器内容物的装量与平均装量(均取三为有效数字)。
3.2 容量法(适用于标示量以容量计者)除另有规定外,取供试品5个(50ml以上者3个0,将内容物分别用响应体积的干燥注射器抽尽;50ml以上者可倾入响应体积的干燥量筒(量入型)中,黏稠液体倾出后,将容器倒置15分钟,尽量倾净。读出每个容器内容物的装量,并求出其平均装量。(均取三为有效数字)。
4 注意事项
4.1开启瓶盖时,应注意避免损失。
4.2 每个供试品的两次称量中,应注意编号顺序和容器的对号。
4.3 所用注射器或量筒必须洁净、干燥并经定期检定;其最大刻度值与供试品的标示装量一致,或不超过标示装量的2倍。
5 记录与计算
5.1 记录室温、标示装量、仪器及其规格、每个容器内容物读数(ml),或每个供试品重量及其自身空容器重量、并求算每个容器装量。
5.2 每个容器装量之和除以5(或3),即得平均装量。
5.3按下表,求出每个容器允许的最低装量,以及黏稠液体允许的最低平均装量(均取三为有效数字)。
5.4 如遇平均装量处于标示装量边缘者,计算出平均装量为标示量的百分率,再取三为有效数。
标示装量固体、半固体、液体粘稠液体(容量法)
平均装量每个容器装量平均装量每个容器装量
20g(ml)以下不少于标示装量不少于标示装量的93%不少于标示装
量的90%不少于标示装量的85%
20g(ml)~50g(ml)不少于标示装量不少于标示装量的95%不少于标示装量的95%不少于标示装量的90%
50g(ml)以上不少于标示装量不少于标示装量的97%不少于标示装量的95%不少于标示装量的93%
6 结果判定
6.1 每个容器的装量不少于允许最低装量,且平均装量不少于标示装量(黏稠液体不少于允许最低平均装量),判为符合规定。
如仅有一个容器的装量不符合规定,则另取5个[50g(ml)以上者3个]复试,复试结果全部符合规定,仍可判为符合规定。
6.2初试结果的平均装量少于标示装量(黏稠液体少于允许最低平均装量),或有一个以上容器的装量不符合规定,或在复试中仍不能全部符合规定;均判为不符合规定。
HIV-1病毒载量试剂1技术参数 1.名称:人类免疫缺陷病毒(1型)核酸检测试剂盒(PCR-荧光法)。 2.用途:用于定量检测人血浆中人类免疫缺陷病毒(1型)。 3.原理:应用实时荧光定量聚合酶链式反应原理。 4.检测项目:HIV-1RNA定量检测。 5.检测亚型:HIV-1M、O组。 6.检测方法:全自动核酸分离纯化,全自动核酸扩增和实时荧光PCR方法。 7.适用样品种类:非肝素抗凝血浆。 8.定量方式:内部标准品定量。 9.质控品:提供阴性、弱阳性、强阳性对照质控品。 10.技术要求: a.检测灵敏度:≤20copies/ml,置信度≥95%。 b.检测范围:20-1×107copies/ml。 c.检测特异性:100%。 d.重复性:CV值≤0.3log。 e.规格:48T/盒。 f.即开即用型液体试剂。 11.试剂储存条件:2-8℃保存。 12.试剂组份:包括核酸提取、纯化、扩增和检测的全部试剂。 13.抗污染方案:采用UNG酶防止PCR产物污染。 14.样品处理能力:可以同时进行检测1-72个样品 15.备件:含完整实验过程中所需的相关耗材及洗液。 16.适用设备:适用于CobasAmpliprepCobasTaqman全自动病毒载量检测系统。 17.认证文件:中国医疗器械进口注册证等文件。 18.供货计划:按用户要求数量准时分批供货,试剂到货时有效期大于10个 月。
HIV-1病毒载量试剂2技术参数 1.名称:人类免疫缺陷病毒(HIV-1)核酸(RNA)提取及检测试剂盒 2.用途:用于定量检测人血浆中人类免疫缺陷病毒(1型)。3.检测方法:应用RT-PCR和Real-time实时荧光定量检测技术HIV-1型各组病毒载量。 4.检测项目:HIV-1RNA定量检测。 5.检测亚型:HIV-1型M组(A-H)、O组、N组。 6.适用设备:m2000sp自动核酸提取仪,m2000rt实时荧光定量PCR仪; 7.定量方式:外部标准品定量 8.技术要求 8.1检测灵敏度:≤40copies/mL(0.6mL、1.0mL样本体系) 8.2特异性:100%(95%CI99.28-100%) 8.3检测范围:40-107copies/mL 8.4适用样本种类:血浆(ACD-A或EDTA抗凝) 8.5检测样本体积:可选0.2mL、0.5mL、0.6mL和1.0mL 8.6检测方式:96孔PCR反应板 8.7检测批量:一次检测批量可选24,48,72和96 8.8内测标准差(SD):≤0.25log copies/mL 8.9内参要求:与样本一起提取和扩增,质控整个实验过程; 9.认证文件:中国医疗器械进口注册证等文件。 10.供货计划:按用户要求数量准时分批供货,到货时试剂有效期大于10个月。
最低装量检查法标准操作规程 目的: 建立最低装量检查法的标准操作规程,保证临床用药剂量。 2.依据: 《中华人民共和国药典》2000年版二部。 3 范围: 适用于固体、半固体制剂中标示装量不大于500g(ml),液体制剂标示装量为500ml以下的制剂。 4.职责: 质量部QC检验员对本标准的实施负责。 5. 程序: 5.1.重量法(适用于标示装量以重量计者)。除另有规定外,取供试品5个(50g 以上者3个),除去外盖和标签,容器外壁用适宜的方法清洁并干燥,分别精密称定重量,除去内容物,容器内容物用适宜的溶剂洗净并干燥,再分别精密称定空容器的重量,求出每个容器物的装量与平均装量,均应符合规定。如有1个容器装量不符合规定,则另取5个(或3个)复试,应全部符合规定。 5.2. 容量法(适用于标示装量以容量计者)。除另有规定外,取供试品5个(50ml以上者3个),开启时注意避免损失,将内容物分别用干燥并预经标化的注射器(包括注射针头)抽尽,50ml以上者可倾入预经标化的干燥量筒中,黏稠液体倾出后,将容 倒置15分钟,尽量倾净。读出每个容器内容物的装量,并求其平均装量,均应符合规定。 如有1个容器装量不符合规定,则另取5个(或3个)复试,应全部符合规定。 6. 附:装量控制表:
注射液中不溶性微粒检查法(光阻法)标准操作规程 目的: 建立注射液不溶性微粒检查法(光阻法)标准操作规程。 2.依据: 《中华人民共和国药典》2000年版二部。 3. 范围: 适用于静脉滴注用注射液(装量为100ml以上者)经澄明度检查符合规定后的不溶 性微粒的检查。 4.职责: 质量部QC检验员对本标准的实施负责。 5. 程序: 5.1. 原理: 当液体中的微粒通过一窄小的检测区时,与流体流向垂直的入射光,由于被不溶性 微粒所阻挡,从而使传感器输出的信号变化,这种信号变化与微粒的截面积成正比,光阻法检查注射液中不溶性微粒即依据此原理。
本指南由中国疾病预防控制中心性病艾滋病预防控制中心艾滋病参比实验室组织有关专家撰写,由中国疾病预防控制中心批准执行。 编写主持人:蒋岩 编写人员:潘品良蒋岩李敬云钟平尚红李太生 审核咨询专家及技术人员:邵一鸣康来仪朱效科王佑春汪宁朱红郭志宏季阳 刘海林肖瑶邱茂锋马春涛 编写单位:中国疾病预防控制中心性病艾滋病预防控制中心 参编单位:中国人民解放军军事医学科学院 上海市疾病预防控制中心 中国医科大学 北京协和医院 技术顾问:Mike Ussery, Hao Zhang 美国国立卫生研究院过敏及传染病研究所 James W. Bremer 美国Rush 大学医学中心VQA实验室 Trever Peter 克林顿基金中国艾滋病防治项目实验室专家 Donald J. Brambilla 美国华盛顿大学新英格兰研究所 Francis F. Mandy 加拿大公共卫生局疾病预防控制中心国家免疫学实验室
前言 随着HIV-1病毒载量检测在艾滋病临床辅助诊断和抗病毒治疗监测以及艾滋病科研工作中的广泛应用,我国开展该项检测工作的实验室日益增多。自1997年艾滋病实验室首次引进HIV-1病毒载量检测技术,截至2007年底,全国已经配备了近120台HIV-1病毒载量检测仪,覆盖了疾控、医院、检疫、军队等系统。目前,虽然许多实验室已经将病毒载量检测纳入艾滋病相关辅助诊断和治疗监测工作,但大多数实验室开展工作的时间较短,经验不足,因此,急需加强该领域的培训和质量控制工作,以保证检测结果的准确性和可靠性。 为了加强质控和保证检测质量,并得到国际上的认可,艾滋病参比实验室2004年开始参加美国NIH组织的HIV-1病毒载量检测能力验证工作。在通过考核和积累经验的基础上,2005年启动了国内HIV-1病毒载量检测能力验证工作。在积极组织实验室能力验证的同时,艾滋病参比实验室也对实验室技术人员进行培训,积极开展室内质控。这些工作对提高HIV-1病毒载量的检测技术,保证质量起到了重要作用。为了进一步规范艾滋病实验室HIV-1病毒载量检测,建立标准化质量控制程序,准确开展各项检测及质量控制工作,特制定本指南。 本指南是根据各种HIV-1病毒载量检测方法的技术要求,结合现行的国内外相关技术规范而制定。本指南针对HIV-1病毒载量检测的实验室设置、样品管理、检测技术、质量控制、生物安全等方面提出指导。 本指南自2006年初正式开始编写,性病艾滋病预防控制中心多次组织了有国内外专家参加的指南编写专项技术咨询会,与会专家对指南提出了很多建设性意见和建议,美国NIH 病毒载量检测质量保证实验室专家多次对指南进行认真的审阅和具体指导。指南编写过程中,也认真听取了实验室一线检测人员的具体需求和建议,并补充了大量的实验数据,包括HIV-1病毒载量检测值的稳定性、冻融影响实验与不同检测方法之间比较的实验数据等。在此基础上,经过多次修订、补充和审定,于2007年11月完成《HIV-1病毒载量检测及质量保证指南》的最后定稿。 由于国内外还没有可作为参考的HIV-1病毒载量检测及质量控制的相关指南,因此本指南主要提出一些原则上的参考建议,其中定有不妥之处,希望广大同仁提出意见,以便不断完善。 致谢 在本指南的编写过程中,世界卫生组织、克林顿基金中国艾滋病防治项目和美国NIH 等国际组织与机构给予了大力支持,全国HIV-1病毒载量检测实验室一线操作人员提出了许多建设性的意见和具体需求,艾滋病参比实验室工作人员毛玮、陶晓霞进行了大量的补充实验和文字编辑工作,才保证本指南的编写顺利完成,在此一并向他们表示真诚的感谢。 中国疾病预防控制中心性病艾滋病预防控制中心主任吴尊友研究员在本指南编写过程中提出了重要的修改意见,在此特别致谢。
---------------------------------------------------------------最新资料推荐------------------------------------------------------ 水利工程取样检测规程完整 范文范例学习指导原材料及中间产品质量主要检验项目和数量 1、原材料名称主要检测项目主要技术标准检测组数/批量水泥3d、28d 抗压强度及抗折强度,细度,凝结时间,安定性等。 《通用硅酸盐水泥》GB175—2 007 《水工混凝土试验规程》(SL 352-2006)以同一水泥厂、同品牌、同强度等级、同一出厂编号,袋装水泥每≤200t 为一验收批;散装水泥每≤500t 为一验收批。 含泥量、泥块含量、云母《普通混凝土用砂石质量及砂含量、有机质含量、颗粒检验方法标准》JGJ52—2006级配等。 《建筑用卵石、碎石》(GB/T碎(卵)石含泥量、泥块含量、颗粒级配、压碎指标、有机质含量、软弱颗粒含量等。 14685—2001)、《建筑用砂》 1 组/600t,不足 600 吨亦取一组。 (GB/T14684—2001)、《水工混凝土试验规程》(SL3522006)石料抗压强度、软化系数等《水利水电工程岩石试验规程》SL264-2001浆(干)砌石料:1 组/2000 方;抛填石料:1 组/2 万方;不足方数的也应取一组。 试样的石料不宜小于20cm×20cm×15cm砖钢筋强度、外观质量、耐久性等《砌墙砖试验方法》GB/T2542 -2003每 3.5~15 万块为一检验批次 1、同厂家、同炉号、同级别、同规格、同截面、同《钢筋混凝土用钢第 1 部一出厂时间每 60 吨为一检验批次,不足 60 吨按一批外观质量及公称直径、重量偏差、抗拉强度、屈服点、伸 1/ 24
注射用无菌粉末装量差异检查法标准操作规程 目的: 建立注射用无菌粉末装量差异检查法标准操作规程,控制各瓶间装量的一致性,以保证使用剂量的准确。 2.依据: 《中华人民共和国药典》2000年版二部。 3. 范围: 适用于橡皮塞铝盖玻瓶或安瓿装的注射用无菌粉末的装量差异检查。 4. 职责: QA检查员、QC检验员对本标准的实施负责。 5. 程序: 5.1. 仪器与用具:分析天平感量1mg或0.1mg(适用于检查装量小于0.1g的粉针剂) 5.2.检查法: 5.2.1. 取供试品5瓶(支),除去铝盖和瓶签(若为纸标签,用水润湿后除去纸屑; 若为直接在玻璃上印字标签,用适当有机溶媒擦除字迹),容器外壁用乙醇洗净,置干燥器内放置1-2小时,俟干燥后,分别编号,依次放于固定位置。 5.2.2.轻扣橡皮塞或安瓿颈,使其上附着的粉末全部落下,分别精密称定每瓶(支)的重量,开启容器(注意避免玻璃屑等异物落入容器中),倾出内容物,容器用水、乙 醇洗净,依次放回原固定位置,在适当的条件下干燥后,再分别精密称定每一容器的重量,即可求出每1瓶(支)的装量和平均装量。 5.2.3.复试、初试中,如有1瓶的装量超过装量差异限度规定时,另取10瓶(支) 按5.2.1.、5.2.2.项下复试。
5.3.记录与计算: 5.3.1. 记录每次称量数据。 5.3.2.根据每瓶(支)的重量与其空瓶重之差,求算每瓶(支)内容物重量。 5.3.3.每瓶(支)内容物重量之和除以5(复试时除以10),即得平均装量( m ), 保留3位有效数字。 5.3.4.按下表规定装量差异限度,求出允许装量范围(m±m×装量差异限度)。 注射用无菌粉末装量差异限度规定 5.4.结果与判定: 5.4.1. 每1瓶(支)中的装量与平均装量相比较,均末超过者,判为符合规定。 5.4.2.每1瓶(支)中的装量与平均装量相比较,超过1瓶者,判为不符合规定。 5.4.3.初试结果仅有1瓶(支)的装量超过允许装量范围时,另取10瓶(支)复 试。复试结果每1瓶(支)的装量与其允许装量范围相比较,均末超过者,可判为符合规定;若有1瓶(支)或1瓶(支)以上超过时,判为不符合规定。 5.5.注意事项: 5.5.1. 开启安瓿装粉针时,应避免玻璃屑落入或溅失。 5.5.2.用水、乙醇洗涤倾去内容物后的容器时,慎勿将瓶外编号的字迹擦掉,以免
—————————— 文件类别:技术标准 1/6 文件名称《中华人民共和国药典》(一部)制剂通则 检验标准操作规程 文件编号:09T-I698-01 起草人审核人批准人 日期:日期:日期: 颁发部门:质量管理部生效日期: 分发部门:质量控制科 1.目的:建立《中华人民共和国药典》(一部)制剂通则检验标准操作规程,并 按规程进行检验,保证检验操作规范化。 2.依据: 2.1.《中华人民共和国药典》2010年版一部。 3.范围:适用于所有用《中华人民共和国药典》(一部)制剂通则测定的供试品。 4.责任:检验员、质量控制科主任、质量管理部经理对本规程负责。 5.正文: 制剂通则 5.1. 附录ⅠA丸剂。 5.1.1. 丸剂系指饮片细粉或提取物加适宜的黏合剂或其他辅料制成的球形或类 球形制剂,分为蜜丸、水蜜丸、水丸、糊丸、蜡丸和浓缩丸等类型。 5.1.2. 蜜丸:系指饮片细粉以蜂蜜为黏合剂制成的丸剂。其中每丸重量在0.5g (含0.5g)以上的称大蜜丸,每丸重量在0.5g以下的称小蜜丸。 5.1.3. 水蜜丸系指饮片细粉以蜂蜜和水为黏合剂制成的丸剂。 5.1.4. 水丸系指饮片细粉以水(或根据制法用黄酒、醋、稀药汁、糖液等)为黏 合剂制成的丸剂。 5.1.5. 糊丸系指饮片细粉以米粉、米糊或面糊等为黏合剂制成的丸剂。 5.1. 6. 蜡丸系指饮片细粉以蜂蜡为黏合剂制成的丸剂。 5.1.7. 浓缩丸系指饮片或部分饮片提取浓缩后,与适宜的辅料或其余饮片细粉, 以水、蜂蜜或蜂蜜和水为黏合剂制成的丸剂。根据所用黏合剂的不同,分为浓缩水丸、浓缩蜜丸和浓缩水蜜丸。 5.1.8. 丸剂在生产与贮藏期间应符合下列有关规定。
药典对颗粒剂的规定 颗粒剂系指药物与适宜的辅料制成具有一定粒度的干燥颗粒状制剂。颗粒剂可分为可溶颗粒(通称为颗粒)、混悬颗粒、泡腾颗粒、肠溶颗粒、缓释颗粒和控释颗粒等。供口服用。 混悬颗粒系指难溶性固体药物与适宜辅料制成一定粒度的干燥颗粒剂。临用前加水或其他适宜的液体振摇即可分散成混悬液供口服。 除另有规定外,混悬颗粒应进行溶出度检查。 泡腾颗粒系指含有碳酸氢钠和有机酸,遇水可放出大量气体而呈泡腾状的颗粒剂。 泡腾颗粒中的药物影视易溶性的,加水产生气泡后应能溶解。有机酸一般用枸橼酸、酒石酸等。 泡腾颗粒应溶解或分散于水中后服用。 肠溶颗粒系指采用肠溶材料包裹颗粒或其他适宜方法制成的颗粒剂。 肠溶颗粒耐胃酸而在肠液中释放活性成分,可防止药物在胃内分解失效,避免对胃的刺激或控制药物在肠道内定位释放。 肠溶颗粒应进行释放度检查。 缓释颗粒系指子啊规定的释放介质中缓慢地非恒速释放药物的颗粒剂。 缓释颗粒应符合缓释制剂的有关要求并应进行释放度检查。 控释颗粒系指在规定的释放介质中缓慢地恒速释放药物的颗粒剂。 控释颗粒应符合控释制剂的有关要求并应进行释放度检查。 颗粒剂在生产与贮藏期间应符合下列有关规定。 一、药物与辅料应均匀混合;凡属挥发性药物或遇热不稳定的药物在制备过程中应注意控制适宜的温度条件,凡遇光不稳定的药物应遮光操作。 二、颗粒剂应干燥,颗粒均匀,色泽一致,无吸潮、结块、潮解等现象。 三、根据需要可加入适宜的矫味剂、芳香剂、着色剂、分散剂和防腐剂等添加剂。 四、颗粒剂的溶出度、释放度、含量均匀度、微生物限度等应符合要求。必要时,包衣颗粒剂应检查残留溶剂。 五、除另有规定外,颗粒剂应密封,置干燥处贮存,防止受潮。 六、单剂量包装的颗粒剂在标签上要表明每个袋(瓶)中活性成分的名称及含量。多剂量包装的颗粒剂除应有明确的分剂量方法外,在标签上要标明颗粒中活性成分的名称和重量。 除另有规定外,颗粒剂应进行一下相应检查。 【粒度】除另有规定外,照粒度和粒度分布测定法检查,不能通过一号筛与能通过五号筛的总和不超过供试量的15%。 【干燥失重】除另有规定外,照干燥失重测定法测定,与105℃干燥至恒重,含糖颗粒应在80℃减压干燥,减失重量不得过2.0%。 【溶化性】除另有规定外,可溶颗粒和泡腾颗粒照下述方法检查,溶化性应符合规定。 可溶颗粒检查法取供试品10g,加热水200mL,搅拌5分钟,可溶颗粒应全部溶化或轻微浑浊,但不得有异物。 泡腾颗粒检查法取单剂量包装的泡腾颗粒3袋,分别置盛有200mL水的烧杯中,水温为15~25℃,应迅速产生气体而成泡腾状,5分钟内颗粒均应完全
目的:制订装量差异检查法标准操作规程。 适用范围:装量差异检查。 责任:检验室人员按本规程操作,检验室主任监督本规程的执行。程序: 1. 简述 1.1 本法适用于胶囊剂的装量差异检查。凡规定检查含量均匀度的胶囊剂可不进行装量差异检查。 1.2 在生产过程中,由于空胶囊容积和粉末的流动性,以及工艺、设备等原因,可引起胶囊内容物装量的差异。本项检查的目的在于控制各粒装量的一致性,保证用药剂量的准确。 2. 仪器与用具 2.1 分析天平感量0.1mg 2.2 扁形称量瓶 2.3 小毛刷 2.4 剪刀或刀片 2.5 弯头或平头手术镊 3. 操作方法 3.1 硬胶囊剂除另有规定外,取供试品20粒,分别精密称定重量后,依次放置于固定位置;分别取开囊帽,倾出内容物(不得损失囊壳),用小毛刷或其它适宜用具将囊壳(包括囊体和囊帽)内外拭净,并依次精密称定每一囊壳重量,即可求出每粒内容物的装量和平均装量。
3.2 软胶囊剂 除另有规定外,取供试品20粒,分别精密称定重量后,依次放置于固定位置;分别用剪刀或刀片划破囊壳,倾出内容物(不得损失囊壳),用乙醚等易挥 发性溶剂洗净,置通风处使溶剂挥尽,并依次精密称定每一囊壳重量,即可求出每粒内容物的装量和平均装量。 4. 注意囊项 4.1 每粒胶囊的两次称量中,应注意编号顺序以及囊体和囊帽的对号,不得混淆。 4.2 洗涤软胶囊壳应用与水不混溶又易挥发的有机溶剂,其中以乙醚最好。挥散溶剂时,应在通风处使自然挥散,不得加热或长时间置干燥处,以免囊壳失水。 4.3 其它注意囊事项同片剂重量差异检查法4.1项下。 5. 记录与计算 5.1 依次记录每粒胶囊及其自身囊壳的称量数据。 5.2 根据每粒胶囊重量与囊壳重量之差求算每粒内容物重量。 5.3 每粒内容物重量之和除以20,得每粒平均装量( ),准确至装量的千分之一。 5.4 按下表现定装量差异限度,求出允许装量范围( ± ×装量差异限度)。 平均重量 重量差异限度(%) 0.30g 以下 ±10 0.30g 或0.30g 以上 ±7.5 6. 结果与判定 6.1 每粒的装量与平均装量相比较,均未超出装量差异限度;或超出装量 m m m
第一章绪言 一、判断题 1 ?优先数系列一定是等差级数。(X ) 2?误差是设计人员给定的,公差是在加工过程中产生的。(X) 二、填空题 1 ?家用灯泡15?100W中的各种瓦数为15, 25, 40, 60, 100,该优先数系属于_R5系列。 2. 某机床主轴转速为50, 63, 80, 100, 125,……,单位为r/min,该优先数系属于_R10系列。 3 ?机械加工误差包括尺寸误差、形状误差、位置误差和表面微观不平度等。 三、名词解释 1. 互换性:零件的互换性是指在同一规格的一批零、部件中,可以不经选择、调整或修配,任取一件都能装配在机器上,并能达到规定的使用性能要求。零部件具有的这种性质称为互换性。 2. 几何量公差:实际几何参数值所允许的变动量。
第二章掌握极限与配合基础基本术语和定义 一、判断题 1极限偏差的数值可以为正、负、零,而公差数值则不能为零。(V ) 2. 过渡配合是可能具有间隙或过盈的配合,孔和轴的公差带相互交叠。(V ) 3. 实际尺寸是通过测量所得的尺寸,所以实际尺寸是真值。(x ) 4. 配合公差越大,配合精度越低;配合公差越小,配合精度越高。(V ) 5. 零件的实际尺寸小于其基本尺寸则一定不合格。(x ) 6. 最大实体尺寸等于最大极限尺寸; 最小实体尺寸等于最小极限尺寸。(x ) 7. 零件的公差值可为正、负、零。(x ) 8. 零件的偏差值可为正、负、零。(V ) 9. 通过极精确的测量所得的实际尺寸即为真实尺寸。(x ) 10. 零件的极限偏差是用来控制实际偏差的。(V ) 11. 按GB键槽属于孔。(V ) 12. 对于孔来说,最大实体尺寸就是最大极限尺寸;最小实体尺寸就是 最小极限尺寸。(x ) 13. 极限偏差控制实际偏差,极限尺寸可控制实际尺寸。(V ) 14. 在基本尺寸相同的前提下,孔的尺寸公差带在轴的公差带之下则为过盈配 合。(V ) 15. 公差虽为绝对值,但公差值前面却不能加“ +”号。(V ) 16. 零件的实际尺寸大于其基本尺寸则一定不合格。(x ) 17. 零件的极限偏差值是可为正、负、零,公差只能为正。(V ) 18. 平均尺寸是零件加工后要达到的理想尺寸。(x ) 19. 实际尺寸为基本尺寸,该零件一定合格。(x )20.零件实际尺寸为即其真值。(x ) 21. 极限偏差不能控制实际偏差,而极限尺寸可控制实际尺寸。(x ) 22. 由于上偏差一定大于下偏差,且偏差可正可负,因而一般情况下,上偏差为正值,下偏差为负值。(x ) 23. 尺寸公差是尺寸允许的变动量,是用绝对值来定义的,因而它没有正、负的
一、目的:建立注射剂检验标准操作规程,防止错检、漏检的发生。 二、范围:适用于注射剂的检验操作方法。 三、责任:质量部、化验室相关操作人员。 四、内容: 注射剂 注射剂(《中国药典》2010年版二部附录IB)系指药物与适宜的溶剂或分散介质制成的供注入体内的溶液、乳状液或混悬液,以及供临用前配制或稀释成溶液或混悬液的粉末或浓溶液的无菌制剂。 注射剂可分注射液(其中供静脉滴注用的大体积注射液也称静脉输液)、注射用无菌粉末与注射用浓溶液。 注射剂除应按药典品种项下规定的检验项目外,还应检查“装量”或“装量差异”、“可见异物”和“无菌”。静脉用注射剂应加查“热原”或“细菌内毒素”;溶液型静脉用注射液、溶液型静脉注射用粉末及注射用浓溶液应加查“不溶性微粒”;静脉输液及插管注射用注射液应加查“渗透压摩尔浓度”。 混悬型注射液,除另有规定外,药物粒度应控制在l5um以下,含15~20um(间有个别20~50um)者,不应超过10%,若有可见沉淀,振摇时应容易分散均匀;乳状液型注射液不得有相分离现象;静脉用乳状液型注射液分散相球粒的粒度90%应在lum以下,并不得有大于5um的乳滴。 “装量”检查法 1 简述 1.1本法适用于50ml及50ml以下的单剂量注射液的装量检查,其目的在于保证单剂量注射液的注射用量不少于标示量,以达到临床用药剂量要求。 1.2标示装量为50ml以上的注射液和注射用浓溶液,按最低装量检查法标准操作规范检查,应符合规定。
1.3 凡规定检查含量均匀度的注射液(如塞替派注射液).可不进行“装量”检查。 2 仪器与用具 2.1注射器及注射针头。 2.2量筒(量入型)规格l、2、5、1O、20及50ml的量筒,均应预经标化。 3 操作方法 3.1 按下表规定取用量抽取供试品。 标示装量供试品取用量(支) 2ml或2ml以下 5 2ml以上至50ml 3 3.2取供试品,擦净瓶外壁,轻弹瓶颈部使液体全部下落,小心开启,将每支内容物分别用相应体积的干燥注射器(包括注射器针头)抽尽,注入预经标化的量筒内,在室温下检视,读出每支装量。 3.3如供试品为油溶液或混悬液时,检查前应先微温摇匀,立即按3.2项下方法操作,并冷至室温后检视。 4 注意事项 4.1所用注射器及量筒必须洁净、干燥并经定期校正;其最大容量应与供试品的标示装量相一致,量筒的体积应使待测体积至少占其额定体积的40%。 4.2 注射器应配上适宜号数的注射针头,其大小与临床使用情况相近为宜。 5 记录与计算主要记录室温,抽取供试品支数,供试品的标示装量,每支供试品的实测装量。 6 结果与判定 每支注射液的装量均不得少于其标示装量;如有少于其标示装量者,即判为不符合规定。 “装量差异”检查法 l 简述 1.1本法适用于注射用无菌粉末的装量差异检查。 1.2本项检查的目的在于控制各瓶间装量的一致性,以保证使用剂量的准确。 1.3凡规定检查含量均匀度的注射用无菌粉末,可不进行“装量差异”检查。 2 仪器与用具 分析天平感量0. 1mg(适用于平均装量为0.15g及其以下的粉针剂)或感量1mg
病毒载量测定及质量保证指南 (版) 中国疾病预防控制中心 年月 前言 随着病毒载量检测在艾滋病临床辅助诊断、抗病毒治疗监测及相关科研工作中的广泛应用,我国开展该项检测工作的实验室日益增多。自年艾滋病实验室首次引进病毒载量检测技术以来,截至年底全国已经配备台病毒载量检测仪,覆盖疾控、医院、检疫、军队等系统,艾滋病流行重点地区及少数县级实验室均已配备病毒载量检测仪,每年检测量已达万人份以上。由于病毒载量检测质量对艾滋病的早期诊断及治疗有重要影响,因此急需加强该领域的培训和质量控制,规范实验室操作,以保证检测结果的准确性和可靠性。 自年开始实施《病毒载量测定及质量保证指南》(试行,以下简称《指南》)以来,参与病毒载量能力验证工作的实验室从年的家增加到年的家,占已开展工作实验室的百分之九十以上。通过综合分析近几年能力验证发现的问题与检测技术发展的实际情况,考虑各种试剂的检测要求,结合专家意见和一线实验室工作人员的经验与需求,对本指南进行了适当修改、调整和补充,主要修改内容包括:()增加“人员要求”章节;()修改“常用病毒载量检测方法”;()修改“病毒载量检测能力验证()”;()补充常见问题分析和处理等内容。 修订后的《指南》共分八章,包括:总则,人员要求,实验室环境与设施,样品的采集、处理保存运输,常用检测方法简介,室内质量控制,实验室检测能力验证(),实验室生物安全,以及四个附表。 本指南在修改过程中,接纳了国内专家、同行的意见和建议,经过多次修改编写成《指南》()版。本指南由中国疾病预防控制中心性病艾滋病预防控制中心艾滋病参比实验室组织有关专家撰写,由中国疾病预防控制中心批准执行,并在病毒载量检测实验室网络内发布实施。 由于国内各实验室条件不同,不能采纳所有实验室的建议,因此本指南主要提出一些原则上的参考建议,其中定有不妥之处,希望广大同仁提出意见,以便不断完善。
第一章绪言 一、判断题 1.优先数系列一定是等差级数。 ( × ) 2.误差是设计人员给定的,公差是在加工过程中产生的。(×) 二、填空题 1.家用灯泡15~100W中的各种瓦数为15,25,40,60,100,该优先数系属于R5系列。 2.某机床主轴转速为50,63,80,100,125,……,单位为r/min,该优先数系属于R10系列。 3.机械加工误差包括尺寸误差、形状误差、位置误差和表面微观不平度等。 三、名词解释 1.互换性:零件的互换性是指在同一规格的一批零、部件中,可以不经选择、调整或修配,任取一件都能装配在机器上,并能达到规定的使用性能要求。零部件具有的这种性质称为互换性。 2. 几何量公差:实际几何参数值所允许的变动量。
第二章掌握极限与配合基础基本术语和定义 一、判断题 1.极限偏差的数值可以为正、负、零,而公差数值则不能为零。(√) 2. 过渡配合是可能具有间隙或过盈的配合,孔和轴的公差带相互交叠。(√) 3. 实际尺寸是通过测量所得的尺寸,所以实际尺寸是真值。(×) 4. 配合公差越大,配合精度越低;配合公差越小,配合精度越高。(√) 5.零件的实际尺寸小于其基本尺寸则一定不合格。(×) 6.最大实体尺寸等于最大极限尺寸;最小实体尺寸等于最小极限尺寸。(×) 7.零件的公差值可为正、负、零。(×) 8.零件的偏差值可为正、负、零。(√) 9. 通过极精确的测量所得的实际尺寸即为真实尺寸。(×) 10. 零件的极限偏差是用来控制实际偏差的。(√) 11. 按GB键槽属于孔。(√) 12. 对于孔来说,最大实体尺寸就是最大极限尺寸;最小实体尺寸就是 最小极限尺寸。(×) 13.极限偏差控制实际偏差,极限尺寸可控制实际尺寸。(√) 14.在基本尺寸相同的前提下,孔的尺寸公差带在轴的公差带之下则为过盈配 合。(√) 15.公差虽为绝对值,但公差值前面却不能加“+”号。(√) 16.零件的实际尺寸大于其基本尺寸则一定不合格。(×) 17.零件的极限偏差值是可为正、负、零,公差只能为正。(√) 18.平均尺寸是零件加工后要达到的理想尺寸。(×) 19.实际尺寸为基本尺寸,该零件一定合格。(×) 20.零件实际尺寸为即其真值。(×) 21.极限偏差不能控制实际偏差,而极限尺寸可控制实际尺寸。(×) 22. 由于上偏差一定大于下偏差,且偏差可正可负,因而一般情况下,上偏差为正值,下偏差为负值。(×) 23.尺寸公差是尺寸允许的变动量,是用绝对值来定义的,因而它没有正、负的
目的:为检验头孢拉定胶囊中间产品规定一个标准的程序,以便获得准确的实验数据。 范围:适用于头孢拉定胶囊中间产品的检验。 职责:检验员、检验室主任对本规程实施负责。 规程: 1性状:本品内容物为白色或类白色粉末。 2鉴别 2.1 试剂与仪器 2.1.1 头孢拉定对照品 2.1.2 正十四烷、正已烷 2.1.3 丙酮、甲醇 2.1.4 枸橼酸溶液 (0.1mol/L) 2.1.5 茚三酮 2.1.6 磷酸氢二钠溶液 (0.2mol/L) 2.1.7 硅胶G薄层板 2.1.8 烧杯 (50ml)、量筒 (100ml) 2.1.9 容量瓶 (10ml、25ml) 2.1.10 微量注射器 (25μl) 2.1.11 层析缸、烘箱 2.1.13 电子天平 (万分之一克) 2.1.13 高效液相色谱仪 2.2 项目与步骤 2.2.1 薄层色谱法鉴别:精密称取本品与头孢拉定对照品各约0.06g,分别置10ml容量 瓶中,加水振荡使溶解并稀释至刻度,摇匀,分别作为样品溶液和对照溶液,吸取上述各种溶液各5μl,按“有关物质”项下的薄层色谱法检测,样品溶液所显主斑点的位置与对照溶液相同,为符合规定。 2.2.2 高效液相色谱法鉴别: 含量测定项下的色谱图中,样品溶液主峰保留时间与对照溶液相一致,为符合规定。 3 检查 3.1 试剂与仪器:
3.1.1 甲醇 3.1.2 头孢拉定对照品 3.1.3 水-4%醋酸-3.86%醋酸钠-甲醇 (1564:6:30:400) 3.1.4 五氧化二磷 3.1.5 0.1mol/L 盐酸溶液 3.1.6 微量进样器 (10μl) 3.1.7 容量瓶 、 单标移液管 3.1.8 电子天平 (万分之一克) 3.1.9 真空干燥箱 3.1.10 ZRS-4智能溶出仪 3.2 项目与步骤 3.2.1 头孢氨苄: 精密称取本品适量,按含量测定项下的方法制备供试品溶液,照头孢拉定项下的方法测定,含头孢氨苄不得过头孢拉定和头孢氨苄总量的6.0%,为符合规定。 3.2.2 干燥失重: 取本品的内容物约1g ,以五氧化二磷为干燥剂,在60℃减压干燥3小时,减失重量不得过7.0%,为符合规定。 3.2.3 溶出度: 取本品6粒,照溶出度测定法 (SOP-QC-331-00) 检测,以0.1mol/L 盐酸溶液为溶剂,转速为每分钟100转,依法操作,45分钟时,取溶液适量,滤过,精密量取续滤液10ml 置100ml 容量瓶中,加0.1mol/L 盐酸溶液稀释至刻度,为样品溶液。另取装量差异项下的内容物,混合均匀,精密取适量 (相当于1粒的平均装量),置100ml 容量瓶中,加0.1mol/L 盐酸溶液稀释至刻度,精密量取2 ml 至200ml 容量瓶中,加0.1mol/L 盐酸溶液稀释至刻度。取上述两种溶液,照分光光度法 (SOP-QC-301-00),在255nm 的波长处分别测定吸收度,按二者吸收度的比值计算每粒的溶出量,按下式计算,限度为大于80%为符合规定。 计算:溶出量 %= %100*10010*900*1002 * 100*1W A W A 对对 式中:A1 ;样品溶液吸收度; A 对:对照品溶液吸收度;
最低装量检查法 附录Ⅻ C. 最低装量检查法 本法适用于固体、半固体和液体制剂。除制剂通则中规定检查重(装)量差异与装量 的剂型及放射性药品外,标示装量不大于500g(ml)者,按下述方法检查,应符合表中规定。──────────┬───────────┬────────────── │固体、半固体、液体│黏稠液体 (容量法) 标示装量├────┬──────┼──────┬─────── │平均装量│每个容器装量│平均装量│每个容器装量 ──────────┼────┼──────┼──────┼─────── 20g(ml)以下│不少于标│不少于标示装│不少于标示装│不少于标示装 │示装量│量的93%│量的90%│量的85% ──────────┼────┼──────┼──────┼─────── 20g(ml)至50g(ml) │不少于标│不少于标示装│不少于标示装│不少于标示装 │示装量│量的95%│量的95%│量的90% ──────────┼────┼──────┼──────┼─────── 50g(ml)至500g(ml) │不少于标│不少于标示装│不少于标示装│不少于标示装 │示装量│量的97%│量的95%│量的93% ──────────┴────┴──────┴──────┴───────检查法重量法(适用于标示装量以重量计者)。除另有规定外,取供试品5个(50g 以上者3个),除去外盖和标签,容器外壁用适宜的方法清洁并干燥,分别精密称定重量, 除去内容物,容器用适宜的溶剂洗净并干燥,再分别精密称定空容器的重量,求出每个 容器内容物的装量与平均装量,均应符合规定。如有1个容器装量不符合规定,则另取5 个(或3个)复试,应全部符合规定。 容量法(适用于标示装量以容量计者)。除另有规定外,取供试品5个(50ml以上者 3个),开启时注意避免损失,将内容物分别用干燥并预经标化的注射器(包括注射针头)抽尽,50ml以上者可倾入预经标化的干燥量筒中,黏稠液体倾出后,将容器倒置15分钟,尽量倾净。读出每个容器内容物的装量,并求其平均装量,均应符合规定。如有1个容器 装量不符合规定,则另取5个(或3个)复试,应全部符合规定。
目的:制订胶囊灌装过程中及胶囊成品的平均装量和装量差异的测定标准操作规程。 适用范围:胶囊灌装过程中及胶囊成品的平均装量和装量差异的测定。 责任:胶囊灌装操作工、车间质管员、检验室检验员执行本规程,质管部负责监督本规程的执行。程序: 1.设备:千分之一天平。 2.取样按预定的时间间隔从灌装机出口至少取10粒胶囊,且在整个一批胶囊中至少有5次取样机会。每批的总样品量至少须有50粒。 3.灌装过程中的测定首先按不同部位从所使用的囊壳中抽取50粒称总重,得囊壳的平均重量,如使用了不止一批的囊壳,则应分别取样称重。并将结果记录。然后每次称取10粒,去皮重,获囊心总重,计算平均装量。并将结果与中间控制的限度进行比较。称取20粒胶囊重量,然后将每个胶囊内盛物倒出,分别称重,按下列限度 其中超出装量差异限度的胶囊不得多于2粒,并不得有一粒超出限度的1倍。 4.质管员测定:在灌装过程中,由质管员抽取具有代表作的样品按“3”进行测定。 5.结果 在控制限度内如果测得的结果在控制限度内,通知操作工,灌装可继续进行。如测定结果恰好在限度内或有接近限度的趋势,则须立即告知操作工,对机器设备进行适当的调整。调整后,另取样品再进行试验。 超出控制限度一旦测得的结果超出控制限度,则须重新取样称重以证实结果。如
果第二次测定的结果与上次一致时,应立即通知操作工对灌装机进行调整。在灌装机调整后,取一新样品再次测定。如再次测定结果在控制范围内,立即通知操作工必须更换另一容器收集胶囊。在调整前,最后一次测定结果合格与调整后重新得到合格品之间灌装的胶囊,必须与该批合格的胶囊分开放置,并在容器上贴上“待处理”标签,直到作出有关的决定为止。如灌装过程调整后,测定结果仍超出规定限度,应立即通知质管员及质管部。
《互换性原理与技术测量》 一、填空题 (共20分,每空1分) 1.一个孔或轴允许尺寸的两个极端称为。 2. 一零件表面切削加工要求轮廓的算术平均偏差Ra为μm,在零件图上标注为____________。 3.配合基准制分__________和__________两种。一般情况下优先选用______________。 4.滚动轴承内圈与轴的配合采用基制,而外圈与箱体孔的配合采用基_________制。 5. 现代工业对齿轮传动的使用要求归纳起来有四项,分别为____________、 _______________ 、________________、________________ 。 6. 普通螺纹结合的基本要求为__________、__________。 7. 零件的尺寸合格,其________ 应在上偏差和下偏差之间。 8.公差原则分__________和相关要求,相关要求包括____________、 _______________ 、________________、________ 四种。 9. 在同一尺寸段内,从IT01~IT18,公差等级逐渐降低,公差数值逐渐。 二、选择题(共10分,每题1分) 1.当孔与轴的公差带相互交叠时,其配合性质为()。 A. 间隙配合 B. 过渡配合 C. 过盈配合 2.公差带的大小由()确定。 A.实际偏差 B. 基本偏差 C. 标准公差 3.下列孔与基准轴配合,组成间隙配合的孔是()。 A.孔两个极限尺寸都大于基本尺寸 B.孔两个极限尺寸都小于基本尺寸 C.孔最大极限尺寸大于基本尺寸,最小极限尺寸小于基本尺寸 4.基本偏差是()。 A.上偏差 B .下偏差 C. 上偏差和下偏差 D. 上偏差或下偏差
文件内容: 1、主题内容和适用范围 (2) 2、引用标准 (2) 3、定义 (2) 4、检查项目 (2) 5、更改信息 (5) 颁发部门: 质量管理部。 分发清单: QC办公室、化学室、微生物室、稳定性考察室。
1 主题内容和适用范围 本程序规定了注射剂的检查项目、操作方法和注意事项,使其规范化、标准化,并描述了更改信息。 本程序适用于注射剂的检验。 2 引用标准 中国药典2010年版二部附录Ⅰ B“注射剂”、中国药品检验标准操作规范2010年“注射剂”。 版P 4 3 定义 注射剂(中国药典2010年版二部附录ⅠB)系指药物与适宜的溶剂或分散介质制成的供注入体内的溶液、乳状液或混悬液,以及供临用前配制或稀释成溶液或混悬液的粉末或浓溶液的无菌制剂。 注射剂可分注射液(其中供静脉滴注用的大体积注射液也称静脉输液)、注射用无菌粉末与注射用浓溶液。 4 检查项目 注射剂除应按药典品种项下规定的检验项目外,还应检查“装量”或“装量差异”、“可见异物”和“无菌”。静脉用注射剂应加查“热原”或“细菌内毒素”;溶液型静脉用注射液、溶液型静脉注射用粉末及注射用浓溶液应加查“不溶性微粒”。静脉输液及插管注射用注射液应加查“渗透压摩尔浓度”。 4.1装量 本法适用于50ml及50ml以下的单剂量注射液的装量检查,其目的在于保证单剂量注射液的注射用量不少于标示量,以达到临床用药剂量要求。 标示装量为50ml以上的注射液和注射用浓溶液,按最低装量检查法标准操作规范检查,应符合规定。 凡规定检查含量均匀度的注射液(如塞替派注射液),可不进行“装量”检查。 4.1.1仪器与用具 注射器及注射针头。 量具(量入型)规格1、2、5、10、20及50ml的量具,均应预经标化。 4.1.2操作方法 4.1.2.1按下表规定取用量抽取供试品。
零件几何量检测试题库及答案 第一章绪言 一、判断题 1.优先数系列一定是等差级数。 ( × ) 2.误差是设计人员给定的,公差是在加工过程中产生的。(×) 二、填空题 1.家用灯泡15~100W中的各种瓦数为15,25,40,60,100,该优先数系属于R5系列。 2.某机床主轴转速为50,63,80,100,125,……,单位为r/min,该优先数系属于R10系列。 3.机械加工误差包括尺寸误差、形状误差、位置误差和表面微观不平度等。 三、名词解释 1.互换性:零件的互换性是指在同一规格的一批零、部件中,可以不经选择、调整或修配,任取一件都能装配在机器上,并能达到规定的使用性能要求。零部件具有的这种性质称为互换性。 2. 几何量公差:实际几何参数值所允许的变动量。
第二章掌握极限与配合基础基本术语和定义 一、判断题 1.极限偏差的数值可以为正、负、零,而公差数值则不能为零。(√) 2. 过渡配合是可能具有间隙或过盈的配合,孔和轴的公差带相互交叠。(√) 3. 实际尺寸是通过测量所得的尺寸,所以实际尺寸是真值。(×) 4. 配合公差越大,配合精度越低;配合公差越小,配合精度越高。(√) 5.零件的实际尺寸小于其基本尺寸则一定不合格。(×) 6.最大实体尺寸等于最大极限尺寸;最小实体尺寸等于最小极限尺寸。(×) 7.零件的公差值可为正、负、零。(×) 8.零件的偏差值可为正、负、零。(√) 9. 通过极精确的测量所得的实际尺寸即为真实尺寸。(×) 10. 零件的极限偏差是用来控制实际偏差的。(√) 11. 按GB键槽属于孔。(√) 12. 对于孔来说,最大实体尺寸就是最大极限尺寸;最小实体尺寸就是 最小极限尺寸。(×) 13.极限偏差控制实际偏差,极限尺寸可控制实际尺寸。(√) 14.在基本尺寸相同的前提下,孔的尺寸公差带在轴的公差带之下则为过盈配合。(√) 15.公差虽为绝对值,但公差值前面却不能加“+”号。(√) 16.零件的实际尺寸大于其基本尺寸则一定不合格。(×) 17.零件的极限偏差值是可为正、负、零,公差只能为正。(√) 18.平均尺寸是零件加工后要达到的理想尺寸。(×) 19.实际尺寸为基本尺寸,该零件一定合格。(×) 20.零件实际尺寸为即其真值。(×) 21.极限偏差不能控制实际偏差,而极限尺寸可控制实际尺寸。(×) 22. 由于上偏差一定大于下偏差,且偏差可正可负,因而一般情况下,上偏差为正值,下偏差为负值。(×) 23.尺寸公差是尺寸允许的变动量,是用绝对值来定义的,因而它没有正、负的含义。(√)