
注射用无菌粉末装量差异检查法标准操作规程 目的: 建立注射用无菌粉末装量差异检查法标准操作规程,控制各瓶间装量的一致性,以保证使用剂量的准确。 2.依据: 《中华人民共和国药典》2000年版二部。 3. 范围: 适用于橡皮塞铝盖玻瓶或安瓿装的注射用无菌粉末的装量差异检查。 4. 职责: QA检查员、QC检验员对本标准的实施负责。 5. 程序: 5.1. 仪器与用具:分析天平感量1mg或0.1mg(适用于检查装量小于0.1g的粉针剂) 5.2.检查法: 5.2.1. 取供试品5瓶(支),除去铝盖和瓶签(若为纸标签,用水润湿后除去纸屑; 若为直接在玻璃上印字标签,用适当有机溶媒擦除字迹),容器外壁用乙醇洗净,置干燥器内放置1-2小时,俟干燥后,分别编号,依次放于固定位置。 5.2.2.轻扣橡皮塞或安瓿颈,使其上附着的粉末全部落下,分别精密称定每瓶(支)的重量,开启容器(注意避免玻璃屑等异物落入容器中),倾出内容物,容器用水、乙 醇洗净,依次放回原固定位置,在适当的条件下干燥后,再分别精密称定每一容器的重量,即可求出每1瓶(支)的装量和平均装量。 5.2.3.复试、初试中,如有1瓶的装量超过装量差异限度规定时,另取10瓶(支) 按5.2.1.、5.2.2.项下复试。
5.3.记录与计算: 5.3.1. 记录每次称量数据。 5.3.2.根据每瓶(支)的重量与其空瓶重之差,求算每瓶(支)内容物重量。 5.3.3.每瓶(支)内容物重量之和除以5(复试时除以10),即得平均装量( m ), 保留3位有效数字。 5.3.4.按下表规定装量差异限度,求出允许装量范围(m±m×装量差异限度)。 注射用无菌粉末装量差异限度规定 5.4.结果与判定: 5.4.1. 每1瓶(支)中的装量与平均装量相比较,均末超过者,判为符合规定。 5.4.2.每1瓶(支)中的装量与平均装量相比较,超过1瓶者,判为不符合规定。 5.4.3.初试结果仅有1瓶(支)的装量超过允许装量范围时,另取10瓶(支)复 试。复试结果每1瓶(支)的装量与其允许装量范围相比较,均末超过者,可判为符合规定;若有1瓶(支)或1瓶(支)以上超过时,判为不符合规定。 5.5.注意事项: 5.5.1. 开启安瓿装粉针时,应避免玻璃屑落入或溅失。 5.5.2.用水、乙醇洗涤倾去内容物后的容器时,慎勿将瓶外编号的字迹擦掉,以免
目的:制订装量差异检查法标准操作规程。 适用范围:装量差异检查。 责任:检验室人员按本规程操作,检验室主任监督本规程的执行。程序: 1. 简述 1.1 本法适用于胶囊剂的装量差异检查。凡规定检查含量均匀度的胶囊剂可不进行装量差异检查。 1.2 在生产过程中,由于空胶囊容积和粉末的流动性,以及工艺、设备等原因,可引起胶囊内容物装量的差异。本项检查的目的在于控制各粒装量的一致性,保证用药剂量的准确。 2. 仪器与用具 2.1 分析天平感量0.1mg 2.2 扁形称量瓶 2.3 小毛刷 2.4 剪刀或刀片 2.5 弯头或平头手术镊 3. 操作方法 3.1 硬胶囊剂除另有规定外,取供试品20粒,分别精密称定重量后,依次放置于固定位置;分别取开囊帽,倾出内容物(不得损失囊壳),用小毛刷或其它适宜用具将囊壳(包括囊体和囊帽)内外拭净,并依次精密称定每一囊壳重量,即可求出每粒内容物的装量和平均装量。
3.2 软胶囊剂 除另有规定外,取供试品20粒,分别精密称定重量后,依次放置于固定位置;分别用剪刀或刀片划破囊壳,倾出内容物(不得损失囊壳),用乙醚等易挥 发性溶剂洗净,置通风处使溶剂挥尽,并依次精密称定每一囊壳重量,即可求出每粒内容物的装量和平均装量。 4. 注意囊项 4.1 每粒胶囊的两次称量中,应注意编号顺序以及囊体和囊帽的对号,不得混淆。 4.2 洗涤软胶囊壳应用与水不混溶又易挥发的有机溶剂,其中以乙醚最好。挥散溶剂时,应在通风处使自然挥散,不得加热或长时间置干燥处,以免囊壳失水。 4.3 其它注意囊事项同片剂重量差异检查法4.1项下。 5. 记录与计算 5.1 依次记录每粒胶囊及其自身囊壳的称量数据。 5.2 根据每粒胶囊重量与囊壳重量之差求算每粒内容物重量。 5.3 每粒内容物重量之和除以20,得每粒平均装量( ),准确至装量的千分之一。 5.4 按下表现定装量差异限度,求出允许装量范围( ± ×装量差异限度)。 平均重量 重量差异限度(%) 0.30g 以下 ±10 0.30g 或0.30g 以上 ±7.5 6. 结果与判定 6.1 每粒的装量与平均装量相比较,均未超出装量差异限度;或超出装量 m m m
装量差异检查法 1 简述 1.1 本法适用于橡皮塞铝盖玻瓶装或安瓿装的注射用无菌粉末的装量差异检查。 1.2 本项检查的目的在于控制各瓶间装量的一致性,以保证使用剂量的准确。 1.3 凡规定检查含量均匀度的注射用无菌粉末,可不进行“装量差异”检查。 2 仪器与用具 分析天平感量0.1mg(适用于平均装量为0.15g及其以下的粉针剂)或感量1mg(适用于平均装量在0.15g以上的粉针剂)。 3 操作方法 3.1 取供试品5瓶(支),除去瓶签(若为纸标签,用水润湿后除去纸屑;若为直接在玻璃上印字标签,用适当有机溶剂擦除字迹),容器外壁用乙醇擦净,置干燥器内放置1~2小时,俟干燥后,除去铝盖,分别编号,依次放于固定位置。 3.2 轻扣橡皮塞或安瓿颈,使其上附着的粉末全部落下,开启容器(注意避免玻璃屑等异物落入容器中),分别迅速精密称定每瓶(支)的重量,倾出内容物,容器用水、乙醇洗净,依次放回原固定位置,在适当的条件下干燥后,再分别精密称定每一容器的重量,即可求出每1瓶(支)的装量和平均装量。 3.3 复试初试中,如有1瓶(支)的装量超过装量差异限度规
定时,应另取10瓶(支)按3.1~3.2项下方法复试。 4 注意事项 4.1 开启安瓿装粉针时,应避免玻璃屑落入或溅失;开启橡皮塞铝盖玻璃瓶装粉针时,应先稍稍打开橡皮内塞使瓶内外的气压平衡,再盖紧后称重。 4.2 用水、乙醇洗涤倾去内容物后的容器时,慎勿将瓶外编号的字迹擦掉,以免影响称量结果;并将空容器与原橡皮塞或安瓿颈部配对放于原固定位置。 4.3 空容器的干燥,一般可用60~70℃加热1~2小时,也可在干燥器内干燥较长时间。 4.4 称量空容器时,应注意瓶身与瓶塞(或折断的瓶颈部分)的配对。 5 记录与计算 5.1 记录每次称量数据。 5.2 根据每瓶(支)的重量与其空瓶重之差,求算每瓶(支)内容物重量。 5.3 每瓶(支)内容物重量之和除以5(复试时除以10),即得平均装量(m),保留三位有效数字。 5.4 按下表规定装量差异限度,求出允许装量范围(m±m×装量差异限度)。 平均装量装量差异限度
Xxx生物化学有限公司 片剂重量差异检查法操作规程 1. 主题内容与适用范围 本规程规定了片剂重量差异检查操作的内容、方法与要求。 本规定适用于片剂重量差异的检查。 2. 引用标准 《中华人民共和国药典》(2010年版)二部附录。 3. 仪器与用具 分析天平:感量(适用于平均片重0.30g以下的片剂)或感量1 mg(适用于平均片重0.30g或0.30g以上的片剂)。扁形称量瓶、弯头和平头手术镊。 4. 操作方法 取空称量瓶,精密称定重量;再取供试品20片,置此称量瓶中,精密称定。两次称量值之差即为20片供试品产总重量,除以20,得平均片重(m)。 从已称定总重量的20片供试品中,依次用镊子取出1片,分别精密称定重量,得各片重量,(凡无含量测定的片剂,每片重量应与标示片重相比较)。 重量差异限度规定 5. 记录与计算 记录分析天平的型号,记录称量室的温度与湿度。 记录20片的总重量,记录每片的重量,记录超出限度的数据。 求出平均片重(m),保留三位有效数字。 计算20片的平均片重,根据平均片重和重量差异限度规定计算出允许差异的限度范
围 (m±m×重量差异限度)。 计算超出限度范围的片数及超出数据。遇有超出允许片重范围并处于边缘者,应再与平均片重相比较,计算出该片重量差异的百分率,再根据上表规定的重量差导电异限度作为判定依据(避免在计算允许装量范围时受数值修约的影响) 。 6. 结果与判定 20片中超出重量差异限度的不多于2片,但均未超出限度1倍的,判为符合规定。 20片中超出重量差异限度的多于2片,判为不符合规定。 20片中有1片超出重量差异限度且超出限度1倍的,判为不符合规定。
目的:制订胶囊灌装过程中及胶囊成品的平均装量和装量差异的测定标准操作规程。 适用范围:胶囊灌装过程中及胶囊成品的平均装量和装量差异的测定。 责任:胶囊灌装操作工、车间质管员、检验室检验员执行本规程,质管部负责监督本规程的执行。程序: 1.设备:千分之一天平。 2.取样按预定的时间间隔从灌装机出口至少取10粒胶囊,且在整个一批胶囊中至少有5次取样机会。每批的总样品量至少须有50粒。 3.灌装过程中的测定首先按不同部位从所使用的囊壳中抽取50粒称总重,得囊壳的平均重量,如使用了不止一批的囊壳,则应分别取样称重。并将结果记录。然后每次称取10粒,去皮重,获囊心总重,计算平均装量。并将结果与中间控制的限度进行比较。称取20粒胶囊重量,然后将每个胶囊内盛物倒出,分别称重,按下列限度 其中超出装量差异限度的胶囊不得多于2粒,并不得有一粒超出限度的1倍。 4.质管员测定:在灌装过程中,由质管员抽取具有代表作的样品按“3”进行测定。 5.结果 在控制限度内如果测得的结果在控制限度内,通知操作工,灌装可继续进行。如测定结果恰好在限度内或有接近限度的趋势,则须立即告知操作工,对机器设备进行适当的调整。调整后,另取样品再进行试验。 超出控制限度一旦测得的结果超出控制限度,则须重新取样称重以证实结果。如
果第二次测定的结果与上次一致时,应立即通知操作工对灌装机进行调整。在灌装机调整后,取一新样品再次测定。如再次测定结果在控制范围内,立即通知操作工必须更换另一容器收集胶囊。在调整前,最后一次测定结果合格与调整后重新得到合格品之间灌装的胶囊,必须与该批合格的胶囊分开放置,并在容器上贴上“待处理”标签,直到作出有关的决定为止。如灌装过程调整后,测定结果仍超出规定限度,应立即通知质管员及质管部。
实验十一装量差异检查 一、实验目的 1. 掌握注射用无菌粉末装量差异检查的步骤、结果和判断标准。 2. 熟练使用分析天平。 二、实验原理 控制各瓶间装量的一致性,以保证使用剂量的准确。《中国药典》规定,注射用无菌粉末平均装量0.30g以下时,需做装量差异检查。 注射用无菌粉末装量差异限度规定 三、实验仪器与试剂 1. 仪器:分析天平、 2. 试剂:注射用青霉素钠(0.48g) 四、实验内容 1、注射用无菌粉末装量差异检查 (1)实验内容及步骤 取注射用青霉素钠(0.48g)5瓶,除去铝盖和瓶签(若为纸标签,用水润湿后除去纸屑;若为直接在玻璃上印字标签,用适当有机溶媒擦除字迹),容器外壁用乙醇洗净,置干燥器内放置1-2小时,等干燥后,分别编号,依次放于固定位置。 轻扣橡皮塞,使其上附着的粉末全部落下,分别精密称定每瓶的重量,开启容器(注意避免玻璃屑等异物落入容器中),倾出内容物,容器用水、乙醇洗净,依次放回原固定位置,在适当的条件下干燥后,再分别精密称定每一容器的重量,即可求出每1瓶(支)的装量和平均装量。 (2)记录与计算: 1)记录每次称量数据。
2)计算 a. 每瓶的内容物重量 根据每瓶(支)的重量与其空瓶重之差,求算每瓶(支)内容物重量。 b. 平均装量 每瓶(支)内容物重量之和除以5(复试时除以10),即得平均装量( m ), 保留3位有效数字。 c. 按下表规定装量差异限度,求出允许装量范围(m±m×装量差异限度)。 d. 遇有超出允许装量范围并处于边缘者,应再与平均装量相比较,计算出该瓶装量差异的百分率,再根据上表规定的装量差异限度作为判定的依据(避免在计算允许装量范围时受数字修约的影响)。 3) 结果与判定: a. 每瓶中的装量均未超出允许装量范围(m±m×装量差异限度);或其每1瓶中的装量与平均装量相比较,均末超过者,判为符合规定。 b. 每1瓶中的装量与平均装量相比较,超过1瓶者,判为不符合规定。 c. 初试结果仅有1瓶的装量超过允许装量范围时,另取10瓶(支)复试。复试结果每1瓶的装量与其允许装量范围相比较,均末超过者,可判为符合规定;若仍有1瓶或1瓶以上超过时,判为不符合规定。 五、实验结果与讨论 六、注意事项 a. 平均装量0.15g及其以下的粉针剂用感量0.1mg分析天平;平均装量0.15g以上的粉针剂用感量1mg分析天平; b. 开启安瓿装粉针时,应避免玻璃屑落入或溅失。 c. 用水、乙醇洗涤倾去内容物后的容器时,慎勿将瓶外编号的字迹擦掉,以免 影响称量结果;并将空容器与原橡皮塞或安瓿颈部配对放于原固定位置。 d. 空容器的干燥,一般可用60—70℃加热1—2小时,也可在干燥器内干燥 较长时间。 e. 称量空容器时,应注意瓶身与瓶塞(或折断的瓶颈部分)的对号。 七、思考题 装量差异检查时应注意哪些问题?
精品文档 1. 目的: 学会按片剂重量差异检验操作规程操作,保证检验人员操作规范化、标准化,确保产品质量。 2. 内容: 学会使用电子天平,学会片剂重量差异检查方法。 3. 片剂 3.1. 片剂系指药物与适宜的辅料通过制剂技术制成片状或异形片状的制剂。 32片剂以口服普通片为主,也有含片、舌下片、口腔贴片、咀嚼片、分散片、泡腾片、阴道片、速释或缓释、控释片与肠溶片等。 3.3. 片剂的质量要求除外观应完整平洁、色泽均匀,有适宜的硬度,以及药典品种正文项下规定的检验 项目外,还应检查“重量差异”和“崩解时限”。 3.4. 片剂的重量差异检查法 3.4.1. 简述 341.1. 本法适用于片剂的重量差异检查。凡规定检查含量均匀度的片剂,不再进行重量差异的检查。 3.4.12在片剂生产中,由于颗粒的均匀度和流动性,以及工艺、设备和管理等原因,都会引起片剂重量差异。本项 检查的目的在于控制各片重量的一致性,保证用药剂量的准确。 3.4.2. 仪器与用具 分析天平感量0.1mg (适用于平均片重0.30g以下的片剂)或感量1mg (适用于平均片重0.30g 或0.30g以上的片剂) 扁形称量瓶 弯头或平头手术镊
3.4.3. 操作方法 3.4.3.1. 取空称量瓶,精密称定重量;再取供试品20片,置此称量瓶中,精密称定。两次称量值之差 即为20片供试品的总重量,除以20,得平均片重(m )。 3.4.3.2. 从已称定总重量的20片供试品中,依次用镊子取出1片,分别精密称定重量,得各片重量。 精品文档 3.44注意事项 在称量前后,均应仔细查对药片数。称量过程中,应避免用手直接接触供试品。已取出的药片,不 得再放回供试品原包装容器内。 3.4.5.记录与计算 3.4.5.1.记录每次称量数据。 3452求出平均片重(m ),保留3位有效数字。 345.3. 按下表规定的重量差异限度,求出允许片重范围(m ±m X装量差异限度)。 3.4.6.结果与判定 3.4.6.1.每片重量与平均片重相比较(凡无含量测定的片剂,每片重量应与标示片重比较),均未超出重 量差异限度;或超出重量差异限度的药片不多于2片,且均未超出限度1倍;均判为符合规定。3462每片重量与平均片重相比较,超出重量差异限度的药片多于2片;或超出重量差异限度的药片虽不多于2片,但其中1片超出限度的1倍;均判为不符合规定。
************有限公司GMP文件 文件名称: 重(装)量差异检查标准操作规程文件编号: ********** 起草人日期年月日第 1 页,共 2 页 审核人日期年月日分发号 QA审核日期年月日生效日期年月日批准人日期年月日颁发部门质量部 分发部门化验室 1 范围:本标准规定了片剂重量差异,胶囊剂、颗粒剂装量差异检查的方法和操作要求,适用于本公司检品采用重(装)量差异的检查。 2 引用标准:《中华人民共和国药典》2015年版四部 通则0101 片剂 通则0103 胶囊剂 通则0104 颗粒剂 3 仪器与用具: 电子分析天平 4 标准内容: 4.1片剂重量差异 4.1.1 检查法 取供试品20片,精密称定总重量,求得平均片重后,再分别精密称定每片的重量,每片重量与平均片重比较(凡无含量测定的片剂或有标示片重的重要片剂,每片重量应与标示片重比较),按表中的规定,超出重量差异限度的不得多于2片,并不得有1片超出限度1倍。 平均片重或标示片重重量差异限度 0.30g以下±7.5% 0.30g及0.30g以上±5% 糖衣片的片芯应检查重量差异并符合规定,包糖衣后不再检查重量差异。薄膜衣片应在包薄膜衣后检查重量差异并符合规定。 凡规定检查含量均匀度的片剂,一般不再进行重量差异检查。
****************重(装)量差异检查标准操作规程第 2 页共 2页4.2 胶囊剂装量差异 4.2.1 检查法 取供试品20粒(中药取10粒),分别精密称定重量,倾出内容物(不得损失囊壳),硬胶囊囊壳用小刷或其他适宜的用具拭净;软胶囊或内容物为半固体或液体的硬胶囊囊壳用乙醚等易挥发性溶剂洗净,置通风处使溶剂挥尽,再分别精密称定囊壳重量,求出每粒内容物的装量与平均装量。每粒装量与平均装量相比较(有标示装量的胶囊剂,每粒装量应与标示装量比较),超出装量差异限度的不得多于2粒,并不得有1粒超出限度1倍。 平均装量或标示装量装量差异限度 0.30g以下0.30g或0.30g以上 ±10% ±7.5%(中药±10%) 凡规定检查含量均匀度的胶囊剂,一般不再进行装量差异的检查。 4.3 颗粒剂装量差异 4.3.1 检查法 取供试品 10袋(瓶),除去包装,分别精密称定每袋(瓶)内容物的重量,求出每袋(瓶)内容物的装量与平均装量。每袋(瓶)装量与平均装量相比较[凡无含量测定颗粒剂或有标示装量的颗粒剂,每袋(瓶)装量应与标示装量比较],超出装量差异限度的颗粒剂不得多于2袋(瓶),并不得有1袋超出装量差异限度1倍。 平均装量或标示装量装量差异限度 1.0g及1.0g以下 1.0g以上至1.5g 1.5g以上至6.0g 6.0g以上+10% +8% +7% +5% 凡规定检查含量均匀度的颗粒剂,一般不再进行装量差异检查。 4.3.2 装量多剂量包装的颗粒剂,照最低装量检查法(通则0942)检查,应符合规定。
标题:装(重)量差异检验规程 分发部门:总经理室、质量技术部,行政部(存档) 装(重)量差异测定检验规程 1 目的 本规程的制定是为了规范该项检验操作,确保检验结果的准确、可靠,确保产品质量。 2 范围 本规程规定了胶囊剂、液体口服制剂装量差异,片剂的重量差异的检测方法。 适用于本厂软胶囊剂、液体口服制剂和片剂的装(重)量差异的测定。 3 责任人 本厂化学检验人员对执行本规程负责。 4 规程 4.1 软胶囊剂装量差异测定 4.1.1 原理 以乙醚为溶剂分别测得大丸含油量以及小丸含油量与每丸平均含油量之比,得出大丸为平均含油量的百分比和小丸为平均含油量的百分比,即为装量差异。 4.1.2 试剂 乙醚 4.1.3 仪器 分析天平 4.1.4 测定方法 任意取胶囊20粒,精密称定总量,然后分别精密称定每丸重量后,切开丸壳,倾出内容物(不得损失丸壳),用乙醚洗净,置于通风处使溶剂自然挥发,再分别精密称定每囊囊壳重量及总囊壳的重量,求出每粒内容物的装量及平均装量。每粒的装量与平均装量
相比较,超出装量差异限度的胶囊不得多于2粒,并不得有1粒超出限度1倍。 4.1.5 计算 每丸平均含油量= (20丸油重量) /20 大丸含油量与平均含油量之比(%)= 最大丸含油量(克)/每丸平均含油量(克)×100 小丸含油量与平均含油量之比(%)= 最小丸含油量(克)/每丸平均含油量(克)×100 4.1.6 装量差异限度 平均装量0.30克以下装量差异限度±10% 平均装量>= 0.30克装量差异限度±7.5% 4.2 液体口服制剂装量差异测定 4.2.1 原理 药物制剂以量取法测定实际装量与规定装量之间的差异程度。 4.2.2 仪器 量筒 4.2.3 测定方法 将液体状样品全部倒入与其装量规格相适应的量筒中,量出其实际装量数。 4.2.4 装量差异限度 装量为450ml 装量差异限度:±1 % 装量为50ml 装量差异限度:±2 % 装量为25ml 装量差异限度:±3 % 装量为15ml 装量差异限度:±5 % 4.3 片剂重量差异测定 4.3.1 原理 药物制剂以称量法测定每片的重量与平均重量之间的差异程度。 4.3.2 仪器 分析天平 4.3.3 测定方法 取药片20片,精密称定总重量,求得平均片重后,再分别精密称定各片的重量,每片重量与平均片重相比较,超出重量差异限度的药片不得多于2片,并不得有1片超出限度1倍。 糖衣片的片芯应检查重量差异并符合规定,包糖衣后不再检查重量差异;薄膜衣片应
目的:制订颗粒剂装量差异检查法操作规程,明确其检查法的操作。 依据:《中华人民共和国药典》2010年版; 《中国药品检验标准操作规范》2010年版。 范围:颗粒剂装量差异的检查。 责任:质检室主任、化验员。 内容: 1本法适用于单剂量包装颗粒剂的装量差异检查。但如已规定检查含量均匀度的,不再进行装量差异的检查。 2仪器与用具:分析天平、感量1mg或0.1mg 3操作方法:取供试品10袋(瓶),除去包装,分别精密称定每袋(瓶)内容物的装量,并求出平均装量。 4注意事项:试验过程中应避免用手直接接触供试品的内容物。 5记录与计算 5.1记录每袋(瓶)内容物的重量。 5.2每袋(瓶)内容物重量之和除以10,得每袋(瓶)的平均装量(m),准确至平均装量的千分之一。凡无含量测定的颗粒剂,则以其标示装量作为平均装量。 5.3按下表规定的装量差异限度,求出允许装量范围(m±m×装量差异限度)。
5.4遇有超出允许装量范围并处于边缘者,应再与平均装量相比较,计算出该袋(瓶)装量差异的百分率,再根据上表规定的装量差异限度作为判定的依据(避免在计算允许装量范围时受数值修约的影响)。 6结果与判定: 6.1每袋(瓶)的装量均未超出允许装量范围(m±m×装量差异限度)者;或与平均装量相比较(无含量测定的颗粒剂,应与标示装量相比较),均未超出装量差异限度者;或超出装量差异限度的颗粒剂不多于2袋(瓶),且均未超出限度的1倍;均判为符合规定。 6.2每袋(瓶)的装量与平均装量相比较(无含量测定的颗粒剂,应与标示装量相比较),超出装量差异限度的颗粒剂多于2袋(瓶)者;或超出装量差异限度的颗粒剂虽不多于2袋(瓶),但有1袋(瓶)超出限度的1倍;均判为不符合规定。
“装量差异”检查法 1 简述 1.1本法适用于胶囊剂的装量差异检查。凡规定检查含量均匀度的胶 囊剂可不进行装量差异检查。 1.2在生产过程中,由于空胶囊容积、粉末的流动性以及工艺、设备 等原因,可引起胶囊剂内容物装量的差异。本项检查的目的在于控制各粒装量的一致性,保证用药剂量的准确。 2仪器与用具 2.1分析天平感量0.1mg(适用于平均装量0.30g以下的胶囊剂)或 感量1mg(适用于平均装量0.30g或0.30g以上的胶囊剂)。 2.2扁形称量瓶。 2.3小毛刷。 2.4剪刀或刀片。 2.5弯头或平头手术镊。 3操作方法 3.1硬胶囊除另有规定外,取供试品20粒,分别精密称定每粒重量 后,取开囊帽,倾出内容物(不得损失囊壳),用小毛刷或其他适宜用具将囊壳(包括囊体和囊帽)内外拭净,并依次精密称定每一囊壳重量,即可求出每粒内容物的装量和平均装量。 3.2 软胶囊除另有规定外,取供试品20粒,分别精密称定每粒重量 后,依次放置于固定位置;分别用剪刀或刀片划破囊壳,倾出内容物(不得损失囊壳),用乙醚等易挥发性溶剂洗净,置通风处使
溶剂自然挥尽,再依次精密称定每一囊壳重量,即可求出每粒内容物的装量和平均装量。 4 注意事项 4.1 每粒胶囊的两次称量中,应注意编号顺序以及囊体和囊帽的对号,不得混淆。 4.2 洗涤软胶囊壳应用与水不混溶又易挥发的有机溶剂,其中以乙醚最好。挥散溶剂时,应在通风处使自然挥散,不得加热或长时间置干燥处,以免囊壳失水。 4.3 在称量前后,均应仔细查对胶囊数。称量过程中,应避免用手直接接触供试品。已取出的胶囊,不得再放回供试品原包装容器内。 5 记录与计算 5.1 依次记录每粒胶囊极其自身囊壳的称量数据。 5.2 根据每粒胶囊重量与囊壳重量之差求算每粒内容物重量,保留三位有效数字。 5.3 每粒内容物重量之和除以20,得每粒平均装量(?m),保留三位有效数字。 5.4 按下表规定的装量差异限度,求出允许装量范围(?m±?mX装量差异限度)。
“装量差异”检查法 1. 简述 1.1 本法适用于胶囊剂的装量差异检查。凡规定检查含量均匀度的胶囊剂可不进行装量差异检查。 1.2 在生产过程中,由于空胶囊容积、粉末的流动性以及工艺、设备等原因,可引起胶囊剂内容物装量的差异。本项检查的目的在于控制各粒装量的一致性,保证用药剂量的准确。 2. 仪器与用具 2.1 分析天平感量0.1mg(适用于平均装量0.30g 以下的胶囊剂)或感量1mg(适用于平均装量0.30g 或0.30g以上的胶囊剂)。 2.2 扁形称量瓶。 2.3 小毛刷。 2.4 剪刀或刀片。 2.5 弯头或平头手术镊。 3. 操作方法 3.1 硬胶囊除另有规定外,取供试品20粒,分别精密称定每粒重量后,取开囊帽,倾出内容物(不得损失囊壳),用小毛刷或其它适宜用具将囊壳(包括囊体和囊帽)内外拭净,并依次精密称定每一囊壳重量,即可求出每粒内容物的装量和平均装量。 3.2 软胶囊除另有规定外,取供试品20粒,分别精密称定每粒重量后,依次放置于固定位置;分别用剪刀或刀片划破囊壳,倾出内容物(不得损失囊壳),用乙醚等易挥发性溶剂洗净,置通风处使溶剂自然挥尽,再依次精密称定每一囊壳重量,即可求出每粒内容物的装量和平均装量。 4. 注意事项 4.1 每粒胶囊的两次称量中,应注意编号顺序以及囊体和囊帽的对号,不得混淆。 4.2 洗涤软胶囊壳应用与水不混溶又易挥发的有机溶剂,其中以乙醚最好。挥散溶剂时,应在通风处使自然挥散,不得加热或长时间置干燥处,以免囊壳失水。 4.3 在称量前后,均应仔细查对胶囊数。称量过程中,应避免用手直接接触供试品。已取出的胶囊,不得再放回供试品原包装容器内。 5. 记录与计算 5.1 依次记录每粒胶囊及其自身囊壳的称量数据。 5.2 根据每粒胶囊重量与囊壳重量之差求算每粒内容物重量,保留三位有效数字。 5.3 每粒内容物重量之和除以20,得每粒平均装量(m),保留三位有效数字。 5.4 按下表规定装量差异限度,求出允许装量范围(m±m×装量差异限度)。 平均装量装量差异限度 0.30g 以下±10% 0.30g或0.30g以上±7.5% 5.5 遇有超出允许装量范围并处于边缘者,应再与平均装量相比较,计算出该粒装量差异的百分率,再根据上表规定的装量差异限度作为判定的依据(避免在计算允许装量范围时受数值修约的影响)。 6. 结果与判定 6.1 每粒的装量均未超出允许装量范围(m±m×装量差异限度);或与平均装量相比较,均未超出上表中的装量差异限度;或超过装量差异限度的胶囊不多于2粒,且均未超出限度1倍;均判为符合规定。 6.2 每粒的装量与平均装量相比较,超出装量差异限度的胶囊多于2粒;或超出装量差异限度的胶囊虽不多于2粒,但有1粒超出限度的1倍;均判为不符合规定。
【目的】建立注射用无菌粉末装量差异检查法标准操作程序,确保按规范操作注射用无菌粉末装量差异检查法 【范围】适用于公司注射用无菌粉末装量差异的检查。 【职责】质量部检验员对本方法负责。 【内容】 1.简述 1.1 本法适用于胶塞铝盖玻瓶装的注射用无菌粉末的装量差异检查。 1.2 本项检查的目的在于控制各瓶间装量的一致性,以保证使用剂量的准确。 2.仪器与用具 分析天平:感量1mg(适用于平均装量在0.15g以上的粉针剂)或0.1mg(适用于平均装量为0.15g及其以下的粉针剂)。 3.操作方法 3.1 取供试品5瓶(支)除去铝盖和瓶签(若为纸标签,用水润湿后除去纸屑; 若为直接在玻璃上印字标签,用适当有机溶媒擦除字迹),容器外壁用乙醇洗净,置干燥器内放置1~2小时,干燥后,分别编号,依次放于固定位置。 3.2 轻扣胶塞,使其上附着的粉末全部落下,分别精密称定每瓶(支)的重量,开启容器(注意避免玻璃屑等异物落入容器中),倾出内容物,容器用水、乙醇洗净,依次放回原固定位置,在适当的条件下干燥后,再分别精密称定每一容器的重量,即可求出每1瓶(支)的装量和平均装量。 3.3 复试:初试中,如有1瓶的装量超过装量差异限度规定时,另取10瓶(支)按(3.1~3.2)项下方法复试。 4.注意事项 4.1 开启瓶装粉针时,应避免玻璃屑落入或溅失;开启橡皮塞铝盖玻璃瓶装粉针时,应先稍稍打开橡皮内塞使瓶内外的气压平衡,再盖紧后称重。 4.2 用水、乙醇洗涤倾去内容物后的容器时,慎勿将瓶外编号的字迹擦掉,以免影响称量结果;并将空容器与原橡胶塞配对放于原固定位置。 4.3 空容器的干燥,一般可用60~70℃加热1~2小时,也可在干燥器内干燥较长时间。 4.4 称量空容器时,应注意瓶身与瓶塞的配对。
精品文档 . “装量差异”检查法 1. 简述 1.1 本法适用于胶囊剂的装量差异检查。凡规定检查含量均匀度的胶囊剂可不进行装量差异检查。 1.2 在生产过程中,由于空胶囊容积、粉末的流动性以及工艺、设备等原因,可引起胶囊剂内容物装量的差异。本项检查的目的在于控制各粒装量的一致性,保证用药剂量的准确。 2. 仪器与用具 2.1 分析天平感量0.1mg(适用于平均装量0.30g 以下的胶囊剂)或感量1mg(适用于平均装量0.30g 或0.30g以上的胶囊剂)。 2.2 扁形称量瓶。 2.3 小毛刷。 2.4 剪刀或刀片。 2.5 弯头或平头手术镊。 3. 操作方法 3.1 硬胶囊除另有规定外,取供试品20粒,分别精密称定每粒重量后,取开囊帽,倾出内容物(不得损失囊壳),用小毛刷或其它适宜用具将囊壳(包括囊体和囊帽)内外拭净,并依次精密称定每一囊壳重量,即可求出每粒内容物的装量和平均装量。 3.2 软胶囊除另有规定外,取供试品20粒,分别精密称定每粒重量后,依次放置于固定位置;分别用剪刀或刀片划破囊壳,倾出内容物(不得损失囊壳),用乙醚等易挥发性溶剂洗净,置通风处使溶剂自然挥尽,再依次精密称定每一囊壳重量,即可求出每粒内容物的装量和平均装量。 4. 注意事项 4.1 每粒胶囊的两次称量中,应注意编号顺序以及囊体和囊帽的对号,不得混淆。 4.2 洗涤软胶囊壳应用与水不混溶又易挥发的有机溶剂,其中以乙醚最好。挥散溶剂时,应在通风处使自然挥散,不得加热或长时间置干燥处,以免囊壳失水。 4.3 在称量前后,均应仔细查对胶囊数。称量过程中,应避免用手直接接触供试品。已取出的胶囊,不得再放回供试品原包装容器内。 5. 记录与计算 5.1 依次记录每粒胶囊及其自身囊壳的称量数据。 5.2 根据每粒胶囊重量与囊壳重量之差求算每粒内容物重量,保留三位有效数字。 5.3 每粒内容物重量之和除以20,得每粒平均装量(m),保留三位有效数字。 5.4 按下表规定装量差异限度,求出允许装量范围(m±m×装量差异限度)。 平均装量装量差异限度 0.30g 以下±10% 0.30g或0.30g以上±7.5% 5.5 遇有超出允许装量范围并处于边缘者,应再与平均装量相比较,计算出该粒装量差异的百分率,再根据上表规定的装量差异限度作为判定的依据(避免在计算允许装量范围时受数值修约的影响)。 6. 结果与判定 6.1 每粒的装量均未超出允许装量范围(m±m×装量差异限度);或与平均装量相比较,均未超出上表中的装量差异限度;或超过装量差异限度的胶囊不多于2粒,且均未超出限度1倍;均判为符合规定。 6.2 每粒的装量与平均装量相比较,超出装量差异限度的胶囊多于2粒;或超出装量差异限度的胶囊虽不多于2粒,但有1粒超出限度的1倍;均判为不符合规定。
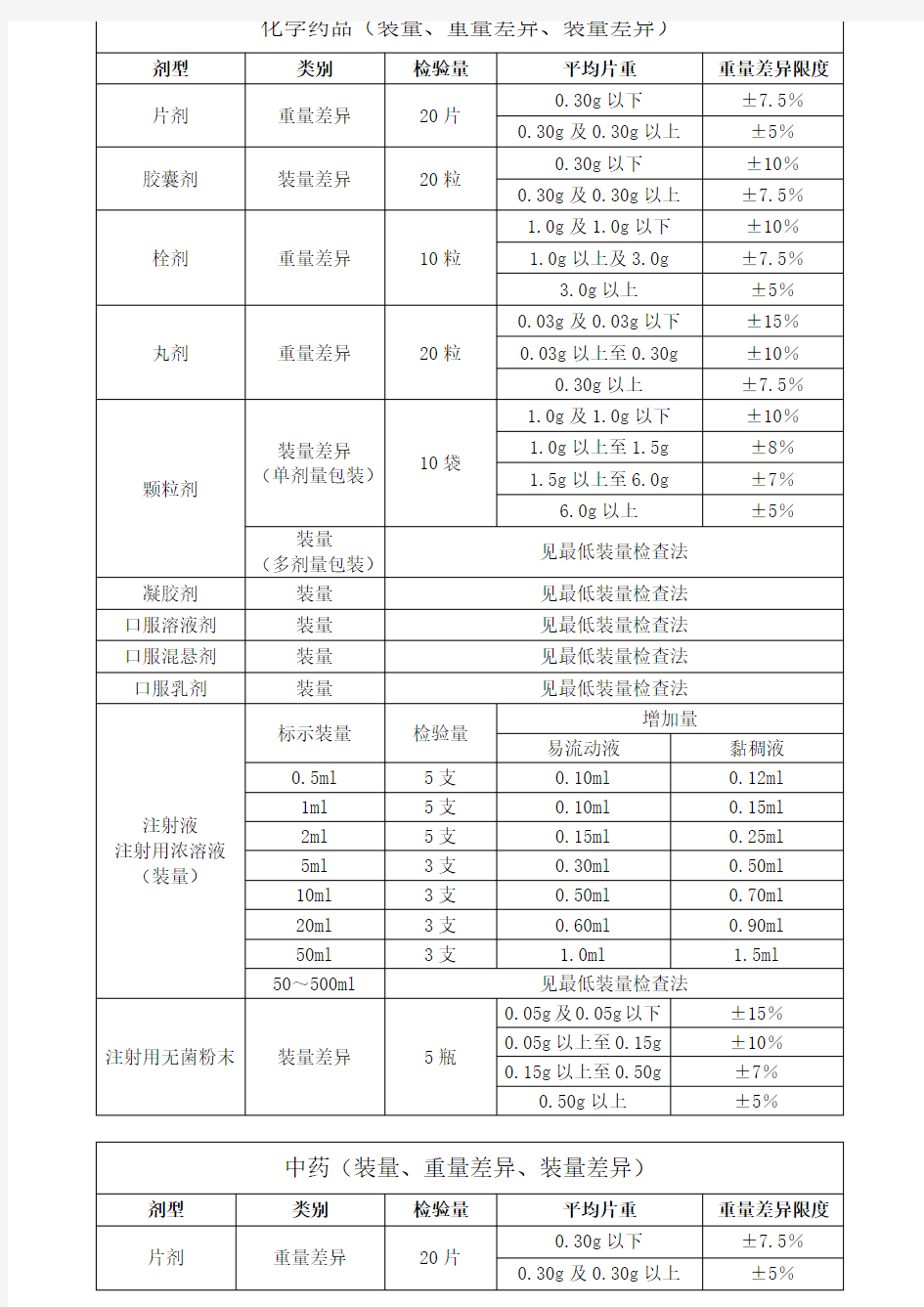
化学药品(装量、重量差异、装量差异)剂型类别检验量平均片重重量差异限度片剂重量差异20 片0.30g 以下±7.5%0.30g 及0.30g 以上±5%胶囊剂装量差异20 粒0.30g 以下±10%0.30g 及0.30g 以上±7.5%栓剂重量差异10 粒 1.0g 及 1.0g 以下±10%1.0g 以上及3.0g ±7.5%3.0g 以上±5%丸剂重量差异20 粒0.03g 及0.03g 以下±15%0.03g 以上至0.30g ±10%0.30g 以上±7.5%颗粒剂装量差异(单剂量包装)10 袋1.0g 及1.0g 以下±10%1.0g 以上至1.5g ±8% 1.5g 以上至6.0g ±7% 6.0g 以上±5%装量(多剂量包装)见最低装量检查法凝胶剂装量见最低装量检查法口服溶液剂装量见最低装量检查法口服混悬剂装量见最低装量检查法口服乳剂装量见最低装量检查法注射液注射用浓溶液(装量)标示装量检验量增加量易流动液黏稠液0.5ml 5 支0.10ml 0.12ml 1ml 5 支0.10ml 0.15ml 2ml 5 支0.15ml 0.25ml 5ml 3 支0.30ml 0.50ml 10ml 3 支0.50ml 0.70ml 20ml 3 支0.60ml 0.90ml 50ml 3 支 1.0ml 1.5ml 50~500ml 见最低装量检查法注射用无菌粉末装量差异5 瓶0.05g及0.05g以下±15%0.05g 以上至0.15g ±10%0.15g 以上至0.50g ±7%0.50g 以上±5%中药(装量、重量差异、装量差异)剂型类别检验量平均片重重量差异限度片剂重量差异20 片0.30g 以下±7.5%0.30g 及0.30g 以上±5%胶囊剂装量差异10 粒±10%栓剂重量差异10 粒1g 及1g 以下±10%1g 以上至3g ±7.5%3g 以上±5%丸剂重量差异(一法)(按丸数服用)10 份0.05g 及0.05g 以下±12%0.05g 以上至0.1g ±11%0.1g 以上至0.3g ±10%0.3g 以上至1.5g ±9% 1.5g 以上至3g ±8%3g 以上至6g ±7%6g 以上至9g ±6%9g 以上±5%重量差异(二法)(按重量服用)10 份0.05g 及0.05g 以下±12%0.05g 以上至0.1g ±11%0.1g 以上至0.3g ±10%0.3g 以上至1g ±8%1g 以上至2g ±7%2g 以上±6%装量差异(单剂量包装)10 袋0.5g 及0.5g 以下±12%0.5g 以上至1g ±11%1g 以上至2g ±10%2g 以上至3g ±8%3g 以上至6g ±6%6g 以上至9g ±5%9g 以上±4%装量装量以重量标示的多剂量包装照最