
三种分析蛋白结构域(Domains)的方法
三种分析蛋白结构域(Domains)的方法
1,SMART入门,蛋白结构和功能分析
SMART介绍
SMART (a Simple Modular Architecture Research Tool) allows the identification and annotation of genetically mobile domains and the analysis of domain architectures. More than 500 domain families found in signalling, extracellular and chromatin-associated proteins are detectable. These domains are extensively annotated with respect to phyletic distributions, functional class, tertiary structures and functionally important residues. Each domain found in a non-redundant protein database as well as search parameters and taxonomic information are stored in a relational database system. User interfaces to this database allow searches for proteins containing specific combinations of domains in defined taxa. For all the details, please refer to the publications on SMART.
SMART(,可以说是蛋白结构预测和功能分析的工具集合。简单点说,就是集合了一些工具,可以预测蛋白的一些二级结构。如跨膜区(Transmembrane segments),复合螺旋区(coiled coil regions),信号肽(Signal peptides),蛋白结构域(PFAM domains)等。
SMART前该知道的
1,SMART有两种不同的模式:normal 或genomic
主要是用的数据库不一样。Normal SMART, 用的数据库 Swiss-Prot,
SP-TrEMBL 和 stable Ensembl proteomes。Genomic SMART, 用全基因组序列。详细列表:
,一些名词解释
进行时
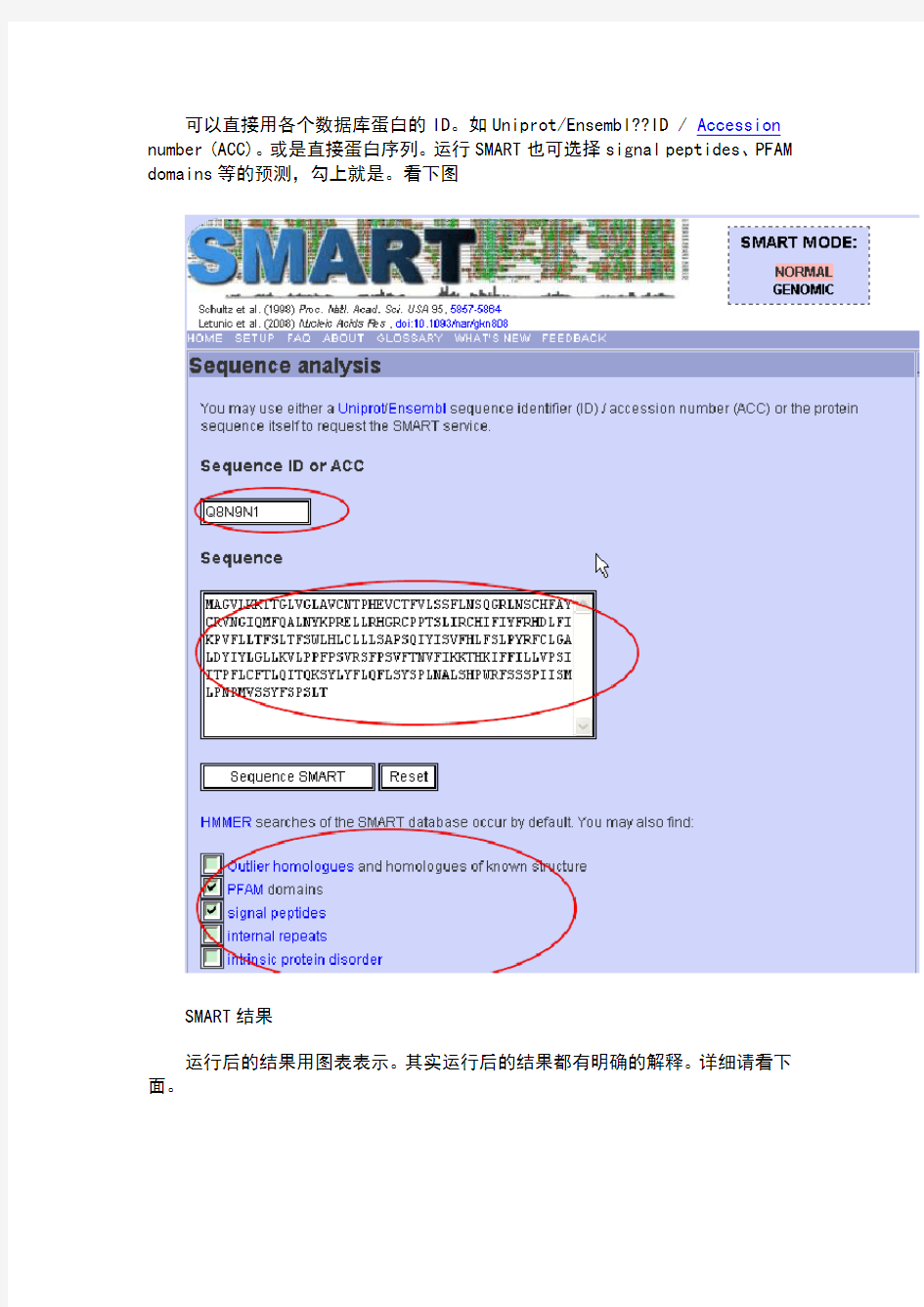
可以直接用各个数据库蛋白的ID。如Uniprot/Ensembl??ID / Accession number (ACC)。或是直接蛋白序列。运行SMART也可选择signal peptides、PFAM domains等的预测,勾上就是。看下图
SMART结果
运行后的结果用图表表示。其实运行后的结果都有明确的解释。详细请看下面。
不同结构的预测由不同的工具完成。如果你想了解更多,可访问去该工具的网站。
跨膜区(Transmembrane segments), TMHMM2 program 。(用表示 ) 复合螺旋区(coiled coil regions),Coils2 program。( 用表示) 信号肽(Signal peptides),SignalP program。( )
蛋白结构域(PFAM),PFAM。
等等。。不止这几个的。其它不一一列举。因为都是详细的说明。点击图标链接,就能看到该区域的序列,或是一些详细的描述。如上图的跨膜区,点击进去就是该跨膜区从开始到结束的序列。
另外,不一定所有预测的区域都会用在图示里看到。一般SMART的显示顺序是SMART > PFAM > PROSPERO repeats > Signal peptide > Transmembrane > Coiled coil > Unstructured regions > Low complexity。另外其它不用图解显示的区域,在底下的表格也有详细说明。
2,Sanger的Pfam数据库
网址:目前的版本:Pfam (July 2008, 10340 families)
The Pfam database is a large collection of protein families, each represented by multiple sequence alignments and hidden Markov models (HMMs).
3,NCBI的CDD(Conserved Domain Database)数据库
网址: often contain several modules or domains, each with a distinct evolutionary origin and function. NCBI’s Conserved Domain Database is a collection of multiple sequence alignments for ancient domains and full-length proteins.
最后,自己试验一下。上面两个图的结果的数据是用了NP_776850的蛋白序列。你也可以拿这个序列来运行一下看看。
三种分析蛋白结构域(Domains)的方法 1,SMART入门,蛋白结构和功能分析 SMART介绍 SMART (a Simple Modular Architecture Research Tool) allows the identification and annotation of genetically mobile domains and the analysis of domain architectures. More than 500 domain families found in signalling, extracellular and chromatin-associated proteins are detectable. These domains are extensively annotated with respect to phyletic distributions, functional class, tertiary structures and functionally important residues. Each domain found in a non-redundant protein database as well as search parameters and taxonomic information are stored in a relational database system. User interfaces to this database allow searches for proteins containing specific combinations of domains in defined taxa. For all the details, please refer to the publications on SMART. SMART(,可以说是蛋白结构预测和功能分析的工具集合。简单点说,就是 集合了一些工具,可以预测蛋白的一些二级结构。如跨膜区(Transmembrane segments),复合螺旋区(coiled coil regions),信号肽(Signal peptides),蛋白结构域(PFAM domains)等。 SMART前该知道的 1,SMART有两种不同的模式:normal 或genomic 主要是用的数据库不一样。Normal SMART, 用的数据库 Swiss-Prot, SP-TrEMBL 和 stable Ensembl proteomes。Genomic SMART, 用全基因组序列。详细列表:,一些名词解释 进行时 可以直接用各个数据库蛋白的ID。如Uniprot/Ensembl??ID / Accession number (ACC)。或是直接蛋白序列。运行SMART也可选择signal peptides、PFAM domains等的预测,勾上就是。看下图 SMART结果 运行后的结果用图表表示。其实运行后的结果都有明确的解释。详细请看下面。
蛋白质结构解析的方法对比综述 工程硕士李瑾 摘要:到目前为止,蛋白质结构解析的方法主要是两种,x射线衍射法和NMR法,这两种方法各有优点和不足。 关键词:x射线衍射法 NMR法 到目前为止,蛋白质结构解析的方法主要是两种,x射线衍射法和NMR法。其中X射线的方法产生的更早,也更加的成熟,解析的数量也更多,第一个解析的蛋白的结构,就是用x晶体衍射的方法解析的。而NMR方法则是在90年代才成熟并发展起来的。这两种方法各有优点和不足[1]。 首先是X射线晶体衍射法。该方法的前提是要得到蛋白质的晶体。通常是将表达目的蛋白的基因经PCR扩增后克隆到一种表达载体中,然后转入大肠杆菌中诱导表达,目的蛋白提纯之后摸索结晶条件,等拿到晶体之后,将晶体进行x射线衍射,收集衍射图谱,通过一系列的计算,得到蛋白质的原子结构[2]。 x射线晶体衍射法的优点是:速度快,通常只要拿到晶体,最快当天就能得出结构,另外不受肽链大小限制,无论是多大分子量的蛋白质或者RNA、DNA,甚至是结合多种小分子的复合体,只要能够结晶就能够得到其原子结构。所以x射线方法解析蛋白的关键是摸索蛋白结晶的条件。该方法得到的是蛋白质分子在晶体状态下的空间结构,这种结构与蛋白质分子在生物细胞内的本来结构有较大的差别。晶体中的蛋白质分子相互间是有规律地、紧密地排列在一起的,运动性较差;而自然界的生物细胞中的蛋白质分子则是处于一种溶液状态,周围是水分子和其他的生物分子,具有很好的运动性。而且,有些蛋白质只能稳定地存在于溶液状态,无法结晶[2]。 核磁共振NMR(nuclear magnetic resonance)现象很早就被科研人员观察到了,但将这种方法用来解析蛋白质结构,却是近一二十年的事情。NMR法具体原理是对水溶液中的蛋白质样品测定一系列不同的二维核磁共振图谱,然后根据已确定的蛋白质分子的一级结构,通过对各种二维核磁共振图谱的比较和解析,在图谱上找到各个序列号氨基酸上的各种氢原子所对应的峰。有了这些被指认的峰,就可以根据这些峰在核磁共振谱图上所呈现的相互之间的关系得到它们所对应的氢原子之间的距离。[3]可以想象,正是因为蛋白质分子具有空间结构,在序列上相差甚远的两个氨基酸有可能在空间距离上是很近的,它们所含的氢原子所对应的NMR峰之间就会有相关信号出现[4] 。通常,如果两个氢原子之间距离小于0.5纳米的话,它们之间就会有相关信号出现。一个由几十个氨基酸残基组成的蛋白质分子可以得到几百个甚至几千个这样与距离有关的信号,按照信号的强弱把它们转换成对应的氢原子之间的距离,然后运用计算机程序根据所得到的距离条件模拟出该蛋白质分子的空间结构。该结构既要满足从核磁共振图谱上得到的所有距离条件,还要满足化学上有关原子与原子结合的一些基本限制条件,如原子间的化学键长、键角和原子半径等[4]。 NMR解析蛋白结构常规步骤如下:首先通过基因工程的方法,得到提纯的目的蛋白,在蛋白质稳定的条件下,将未聚合,而且折叠良好的蛋白样品(通常是1mM-3mM,500ul,PH6-7的PBS)装入核磁管中,放入核磁谱仪中,然后由写好的程序控制谱仪,发出一系列的电磁波,激发蛋白中的H、13N、13C原子,等电磁波发射完毕,再收集受激发的原子所放出的“能量”,通过收集数据、谱图处理、电脑计算从而得到蛋白的原子结构[5] [6]。 用NMR研究蛋白质结构的方法,可以在溶液状态进行研究,得到的是蛋白质分子在溶液中的结构,这更接近于蛋白质在生物细胞中的自然状态[7]。此外,通过改变溶液的性质,还可以模拟出生物细胞内的各种生理条件,即蛋白质分子所处的各种环境,以观察这些周围环境的变化对蛋白质分子空间结构的影响。在溶液环境中,蛋白质分子具有与自然环境中类
蛋白质结构分析原理及工具 (南京农业大学生命科学学院生命基地111班) 摘要:本文主要从相似性检测、一级结构、二级结构、三维结构、跨膜域等方面从原理到方法再到工具,系统地介绍了蛋白质结构分析的常用方法。文章侧重于工具的列举,并没有对原理和方法做详细的介绍。文章还列举了蛋白质分析中常用的数据库。 关键词:蛋白质;结构预测;跨膜域;保守结构域 1 蛋白质相似性检测 蛋白质数据库。由一个物种分化而来的不同序列倾向于有相似的结构和功能。物种分化后形成的同源序列称直系同源,它们通常具有相似的功能;由基因复制而来的序列称为旁系同源,它们通常有不同的功能[1]。因此,推测全新蛋白质功能的第一步是将它的序列与进化上相关的已知结构和功能的蛋白质序列比较。表一列出了常用的蛋白质序列数据库和它们的特点。 表一常用蛋白质数据库 网址可能有更新 氨基酸替代模型。进化过程中,一种氨基酸残基会有向另一种氨基酸残基变化的倾向。氨基酸替代模型可用来估计氨基酸替换的速率。目前常用的替代模型有Point Accepted Mutation (PAM)矩阵、BLOck SUbstitution Matrix (BLOSUM)矩阵[2]、JTT模型[3]。 序列相似性搜索工具。序列相似性搜索又分为成对序列相似性搜索和多序列相似性搜索。成对序列相似性搜索通过搜索序列数据库从而找到与查询序列相似的序列。分为局部联配和全局联配。常用的局部联配工具有BLAST和SSEARCH,它们使用了Smith-Waterman 算法。全局联配工具有FASTA和GGSEARCH,基于Needleman-Wunsch算法。多序列相似性搜索常用于构建系统发育树,这里不阐述。表二列举了常用的成对序列相似性比对搜索工具
结构域 科技名词定义 中文名称:结构域 英文名称:domain;structural domain;motif 其他名称:模体,基序 定义1:多肽链内一段类似球形的折叠区。多数结构域具有一定的一级结构和相应功能。 所属学科:免疫学(一级学科);概论(二级学科);免疫学相关名词(三级学科) 定义2:蛋白质或核酸分子中含有的、与特定功能相关的一些连续的或不连续的氨基酸或核苷酸残基。 所属学科:生物化学与分子生物学(一级学科);总论(二级学科) 定义3:蛋白质多肽链中可被特定分子识别和具有特定功能的三级结构元件。 所属学科:细胞生物学(一级学科);细胞化学(二级学科) 本内容由全国科学技术名词审定委员会审定公布 结构域是生物大分子中具有特异结构和独立功能的区域,特别指蛋白质中这样的区域。在球形蛋白中,结构域具有自己特定的四级结构,其功能部依赖于蛋白质分子中的其余部分,但是同一种蛋白质中不同结构域间常可通过不具二级结构的短序列连接起来。蛋白质分子中不同的结构域常由基因的不同外显子所编码。 目录 编辑本段介绍 (Domain)
在蛋白质三级结构内的独立折叠单元。结构域通常都是几个超二级结构单元的组合 结构域 。 结构域(Structural Domain)是介于二级和三级结构之间的另一种结构层次。所谓结构域是指蛋白质亚基结构中明显分开的紧密球状结构区域,又称为辖区。多肽链首先是在某些区域相邻的氨基酸残基形成有规则的二级结构,然后,又由相邻的二级结构片段集装在一起形成超二级结构,在此基础上多肽链折叠成近似于球状的三级结构。对于较大的蛋白质分子或亚基,多肽链往往由两个或多个在空间上可明显区分的、相对独立的区域性结构缔合而成三级结构,这种相对独立的区域性结构就称为结构域。对于较小的蛋白质分子或亚基来说,结构域和它的三级结构往往是一个意思,也就是说这些蛋白质或亚基是单结构域。结构域自身是紧密装配的,但结构域与结构域之间关系松懈。结构域与结构域之间常常有一段长短不等的肽链相连,形成所谓铰链区。不同蛋白质分子中结构域的数目不同,同一蛋白质分子中的几个结构域彼此相似或很不相同。常见结构域的氨基酸残基数在100~400个之间,最小的结构域只有40~50个氨基酸残基,大的结构域可超过400个氨基酸残基。 编辑本段连接状况 有些球 结构域 形蛋白的一条肽链,或以共价键相连的两条或多条肽链在空间结构上可以区分为若干个球状的子结构,其中的每一个球状子结构就被称为一个结构域。
第六章 蛋白质的功能域、结构及其药物设计 随着人类基因组全序列测定的完成,预示着基因组研究从结构基因组(Structural Genomics)进入了功能基因组(Functional Genomics)研究时代。研究基因组功能当然首先要研究基因表达的模式。当前研究这一问题可以基于核酸技术,也可以基于蛋白质技术,即直接研究基因的表达产物。测定一个有机体的基因组所表达的全部蛋白质的设想是由Williams于1994年正式提出的,而“蛋白质组”(proteome)一词是Wilkins于1995年首次提出。蛋白质组是指由一个细胞或组织的基因组所表达的全部相应的蛋白质。蛋白质组与基因组相对应,均是一个整体概念,但是两者又有根本的不同:一个有机体只有一个确定的基因组,组成该有机体的所有不同细胞都共享有一个基因组;但是,基因组内各个基因表达的条件、时间和部位等不同,因而它们的表达产物(蛋白质)也随条件、时间和部位的不同而有所不同。因此,蛋白质组又是一个动态的概念。由于以上原因,再加上由于基因剪接,蛋白质翻译后修饰和蛋白质剪接,基因遗传信息的表达规律更趋复杂,不再是经典的一个基因一个蛋白的对应关系,而是一个基因可以表达的蛋白质数目大于一。由此可见,蛋白质组研究是一项复杂而艰巨的任务。 蛋白质结构与功能的研究已有相当长的历史,由于其复杂性,对其结构与功能的预测不论是方法论还是基础理论方面均较复杂。统计学方法曾被成功地应用于蛋白质二级结构预测中,如Chou和Fasman提出的经验参数法便是最突出的例子。 该方法统计分析了各种氨基酸的二级结构分布特征,得出相应参数(P а,P β 和P t )并 用于预测。本章将简要介绍蛋白质结构与功能预测的生物信息学途径。 第一节 蛋白质功能预测 一、根据序列预测功能的一般过程 如果序列重叠群(contig)包含有蛋白质编码区,则接下来的分析任务是确定表达产物——蛋白质的功能。蛋白质的许多特性可直接从序列上分析获得,如疏水性,它可以用于预测序列是否跨膜螺旋(transmenbrane helix)或是前导序列(leader sequence)。但是,总的来说,我们根据序列预测蛋白质功能的唯一方法是通过数据库搜寻,比较该蛋白是否与已知功能的蛋白质相似。有2条主要途径可以进行上述的比较分析: ①比较未知蛋白序列与已知蛋白质序列的相似性; ②查找未知蛋白中是否包含与特定蛋白质家族或功能域有关的亚序列或保守区段。 图6.1给出了根据序列预测蛋白质功能的大致过程。由于涉及数条技术路线,所得出的分析结果并不会总是相一致。一般来说,数据库相似性搜索获得的结果最为可靠,而来自PROSITE的结果相对不可靠。
实验名称:蛋白质结构与功能的生物信息学研究 实验目的:1.掌握运用BLAST工具对指定蛋白质的氨基酸序列同源性搜索的方法。 2.掌握用不同的工具分析蛋白质的氨基酸序列的基本性质 3掌握蛋白质的氨基酸序列进行三维结构的分析 4.熟悉对蛋白质的氨基酸序列所代表蛋白的修饰情况、所参与的 代谢途径、相互作用的蛋白,以及与疾病的相关性的分析。实验方法和流程: 一、同源性搜索 同源性从分子水平讲则是指两个核酸分子的核苷酸序列或两个蛋白质分子的氨基酸序列间的相似程度。BLAST工具能对生物不同蛋白质的氨基酸序列或不同的基因的DNA序列极性比对,并从相应数据库中找到相同或相似序列。对指定的蛋白质的氨基酸序列进行同源性搜索步骤如下: ↓ 登录网址https://www.doczj.com/doc/a915094316.html,/blast/ ↓ 输入序列后,运行blast工具 ↓ 序列比对的图形结果显示
序列比对的图形结果:用相似性区段(Hit)覆盖输入序列的范围判断两个序列 的相似性。如果图形中包含低得分的颜色(主要是红色) 区段,表明两序列的并非完全匹配。 ↓ 匹配序列列表及得分
各序列得分 可选择不同的比对工具 备注: Clustal是一款用来对()的软件。可以用来发现特征序列,进行蛋白分类,证明序列间的同源性,帮助预测新序列二级结构与三级结构,确定PCR引物,以及 在分子进化分析方面均有很大帮助。Clustal包括Clustalx和Clustalw(前者是 图形化界面版本后者是命令界面),是生物信息学常用的多序列比对工具。 该序列的比对结果有100条,按得分降序排列,其中最大得分2373,最小得分 分为1195. ↓ 详细的比对序列的排列情况 第一个匹配 序列 第一个序列的匹配率为100% Score表示打分矩阵计算出来的值,由搜索算法决定的,值越大说明匹配程度
蛋白质序列、性质、功能和结构分析 基于网络的蛋白质序列检索与核酸类似,从NCBI或利用SRS系统从EMBL检索。 1、疏水性分析ExPASy的ProtScale程序(https://www.doczj.com/doc/a915094316.html,/cgi-bin/protscale.pl)可用来计算蛋白质的疏水性图谱。输入的数据可为蛋白质序列或SWISS-PROT数据库的序列接受号。也可用BioEdit、DNAMAN等软件进行分析。 2、跨膜区分析蛋白质跨膜区域分析的网络资源有: TMPRED:https://www.doczj.com/doc/a915094316.html,/software/TMPRED_form.html PHDhtm: http:www.embl-heidelberg.de/Services/ ... predictprotein.html MEMSAT: ftp://https://www.doczj.com/doc/a915094316.html, 3、前导肽和蛋白质定位一般认为,蛋白质定位的信息存在于该蛋白自身结构中,并且通过与膜上特殊受体的相互作用得以表达。这就是信号肽假说的基础。这一假说认为,穿膜蛋白质是由 mRNA编码的。在起始密码子后,有一段疏水性氨基酸序列的RNA片段,这个氨基酸序列就称为信号序列(signal sequence)。蛋白质序列的信号肽分析可联网到http://genome.cbs.dtu.dk/services/SignalP/或其二版网址http: //genome.cbs.dtu.dk/services/SignalP-2.0/。该服务器也提供利用e-mail 进行批量蛋白质序列信号肽分析的方案(http://genome.cbs.dtu.dk/services/SignalP/mailserver.html),e-mail 地址为 signalp@ genome.cbs.dtu.dk。蛋白质序列中含有的信号肽序列将有助于它们向细胞内特定区域的移动,如前导肽和面向特定细胞器的靶向肽。在线粒体蛋白质的跨膜运输过程中,通过线粒体膜的蛋白质在转运之前大多数以前体形式存在,它由成熟蛋白质和N端延伸出的一段前导肽或引肽(leader peptide)共同组成。迄今有40多种线粒体蛋白质前导肽的一级结构被阐明,它们约含有20~80个氨基酸残基,当前体蛋白跨膜时,前导肽被一种或两种多肽酶所水解转变成成熟蛋白质,同时失去继续跨膜能力。前导肽一般具有如下性质:①带正电荷的碱性氨基酸(特别是精氨酸)含量较丰富,它们分散于不带电荷的氨基酸序列中间;②缺失带负电荷的酸性氨基酸;③羟基氨基酸(特别是丝氨酸)含量较高;④有形成两亲(即有亲水又有疏水部分)α-螺旋结构的能力。和信号肽与跨膜区结构一样,蛋白质的亚细胞定位也和其功能密切相关,蛋白质亚细胞定位分析可通过如下网址进行:http://predict.
4.2 针对蛋白质的预测方法 传统的生物学认为,蛋白质的序列决定了它的三维结构,也就决定了它的功能。由于用X光晶体衍射和NMR核磁共振技术测定蛋白质的三维结构,以及用生化方法研究蛋白质的功能效率不高,无法适应蛋白质序列数量飞速增长的需要,因此近几十年来许多科学家致力于研究用理论计算的方法预测蛋白质的三维结构和功能,经过多年努力取得了一定的成果。 1. 从氨基酸组成辨识蛋白质 根据组成蛋白质的20种氨基酸的物理和化学性质可以分析电泳等实验中的未知蛋白质,也可以分析已知蛋白质的物化性质。ExPASy工具包中提供了一系列相应程序: AACompIdent:根据氨基酸组成辨识蛋白质。这个程序需要的信息包括:氨基酸组成、蛋白质的名称(在结果中有用)、pI和Mw(如果已知)以及它们的估算误差、所属物种或物种种类或“全部(ALL)”、标准蛋白的氨基酸组成、标准蛋白的SWISS-PROT编号、用户的Email地址等,其中一些信息可以没有。这个程序在SWISS-PROT和(或)TrEMBL数据库中搜索组成相似蛋白。 AACompSim:与前者类似,但比较在SWISS-PROT条目之间进行。这个程序可以用于发现蛋白质之间较弱的相似关系。 除了ExPASy中的工具外,PROPSEARCH也提供基于氨基酸组成的蛋白质辨识功能。程序作者用144种不同的物化性质来分析蛋白质,包括分子量、巨大残基的含量、平均疏水性、平均电荷等,把查询序列的这些属性构成的“查询向量”与SWISS-PROT和PIR中预先计算好的各个已知蛋白质的属性向量进行比较。这个工具能有效的发现同一蛋白质家族的成员。可以通过Web使用这个工具,用户只需输入查询序列本身。 ExPASy的网址是:http://www.expasy.ch/tools/。 PROSEARCH的网址是:http://www.embl-heidelberg.de/prs.html。 2. 预测蛋白质的物理性质 从蛋白质序列出发,可以预测出蛋白质的许多物理性质,包括等电点、分子量、酶切特性、疏水性、电荷分布等。相关工具有: Compute pI/MW:是ExPASy工具包中的程序,计算蛋白质的等电点和分子量。对于碱性蛋白质,计算出的等电点可能不准确。 PeptideMass:是ExPASy工具包中的程序,分析蛋白质在各种蛋白酶和化学试剂处理后的内切产物。蛋白酶和化学试剂包括胰蛋白酶、糜蛋白酶、LysC、溴化氰、ArgC、AspN 和GluC等。
分析蛋白结构域(Domains)的三种方法 生物信息编程2009-09-24 23:55:50 阅读1235 评论0 字号:大中小订阅 三种分析蛋白结构域(Domains)的方法 1,SMART入门,蛋白结构和功能分析 SMART介绍 SMART (a Simple Modular Architecture Research Tool) allows the identification and annotation of genetically mobile domains and the analysis of domain architectures. More than 500 domain families found in signalling, extracellular and chromatin-associated proteins are detectable. These domains are extensively annotated with respect to phyletic distributions, functional class, tertiary structures and functionally important residues. Each domain found in a non-redundant protein database as well as search parameters and taxonomic information are stored in a relational database system. User interfaces to this database allow searches for proteins containing specific combinations of domains in defined taxa. For all the details, please refer to the publications on SMART. SMART(http://smart.embl-heidelberg.de/),可以说是蛋白结构预测和功能分析的工具集合。简单点说,就是集合了一些工具,可以预测蛋白的一些二级结构。如跨膜区(Transmembrane segments),复合螺旋区(coiled coil regions),信号肽(Signal peptides),蛋白结构域(PFAM domains)等。 SMART前该知道的 1,SMART有两种不同的模式:normal 或genomic 主要是用的数据库不一样。Normal SMART, 用的数据库Swiss-Prot, SP-TrEMBL 和stable Ensembl proteomes。Genomic SMART, 用全基因组序列。详细列表:http://smart.embl-heidelberg.de/smart/list_genomes.pl 2,一些名词解释 http://smart.embl-heidelberg.de/help/smart_glossary.shtml
晶体结构解析过程1 1:分子置换法 使用condition:目标蛋白A有同源1蛋白结构B,同源性30%以上。 用到的软件及程序:HKL2000,CCP4,COOT,Phenix,CNS。 解析过程:收集数据(X-RAY)--> hkl2000 处理数据--> 置换前数据处理分子置换(ccp4Molecular Replacement--MR)-->COOT手工修正,氨基酸序列调换-->phenix refine--coot 手工修正phenix refine。。。__拉氏构象图上outlier为0为之,且R-free,R-work达到足够低的值。-->phenix 加水refine(溶剂平滑)。。。(若修正过程中有bias 最好也用CNS修正一下) 2:同晶置换法--硒代蛋白 使用condition:目标蛋白没有同源结构。 用到的软件及程序:HKL2000,CCP4,COOT,Phenix,CNS。 解析过程:收集数据(X-ray 硒代蛋白及母体蛋白)--> hkl2000处理数据-->ccp4 程序包搜索搜索硒信号(gap),相位确定-->搭模--->以硒代数据得到的pdb为模型和母体高分辨数据得到的mtz进行分子置换--> 后面修正过程与分子置换相似。 各步骤介绍: (1)hkl2000:将x-ray 收集的图像编译转化为数字信息,得到的关键文件有.sca和.log ,log文件会给出hkl2000 处理的过程记录,sca文件是最终处理的输出文件。sca文件包含晶体的空间群等信息。带有可以被转化为电子密度图的信息。评价hkl2000处理是否成功的参数有数据完整度,最高分辨率等,一般希望处理出在完整度允许的情况下最高分辨率的数据。 分子置换前处理:ccp4 软件包 a. data reduction,即将sca文件转换为mtz文件。用imported integrated data。 b. cell content analysis 这个是晶体中蛋白聚集体数的分析,通过分析晶体含水量得到一个晶胞内的蛋白分子数。用mtz文件进行。含水量在40%-60%之间时对应得n即为正确值。这个聚集体数会在mr中使用。
蛋白结构分析和比较 姓名________ 学号______________ 日期________年___月___日 阅读分子月报科普短文,参阅相关文献,从蛋白质结构数据库下载以下蛋白质三维结构原子坐标文件,利用Swiss-PdbViewer显示观察,说明其结构特点。 猪胰岛素(4INS): 由几个亚基组成,每个亚基有几条多肽链,每条多肽链由哪些二级结构单元组成; 每条多肽链有几对链内二硫键,多肽链之间由几对二硫键连接; 每个亚基如何与锌原子结合。 抹香鲸肌红蛋白(1MBO): 由几股alpha螺旋组成; 与血色素卟啉环中央铁原子以配位健结合的是哪个组氨酸,该组氨酸位于第几股alpha 螺旋; 与血色素携带的氧分子通过氢键连接的是哪个组氨酸,该组氨酸位于第几股alpha螺旋。 小鼠免疫球蛋白(1IGT): 由几个亚基组成,每个亚基各有几个结构域; 两条重链之间由几对二硫键连接,重链和轻链之间由几对二硫键连接; 每个结构域内部的二硫键和色氨酸如何形成疏水内核; 多糖链对稳定分子结构的作用。 水母(Jellyfish)绿色荧光蛋白(1GFL): 选择PDB原始文件中二聚体A链,保存为单个亚基1GFLa.pdb; 打开1GFLa.pdb,并用不同颜色显示二级结构beta折叠; 找出分子内部发光基团Ser65-Tyr66-Gly67并说明其发光机理。 核小体(1AOI): 用不同颜色显示组蛋白8个亚基; 观察DNA分子碱基配对特点; 显示组蛋白表面与DNA相互作用的碱性氨基酸。 斑头雁和灰雁血红蛋白比较实例 从UniProt数据库中提取斑头雁和灰雁血红蛋白alpha亚基序列,进行序列比对,找出差异位点。 用SwissPDB-Viwer软件中选择并保存灰雁氧合血红蛋白1FAW中四个亚基中的A链B 链两个亚基。 用结构叠合方法分析比较灰雁氧合血红蛋白A链B链两个亚基与斑头雁血红蛋白1A4F 两个亚基的结构,计算基于alpha碳叠合后的均方根误差(RMSD)。 找出斑头雁血红蛋白A链第119位丙氨酸侧链beta碳原子CB和B链55位亮氨酸侧链末端两个碳原子CD1和CD2,分别测量A119CB和B55CD1、B55CD2之间的距离。 找出灰雁血红蛋白A链第119位脯氨酸侧链gamma碳原子CG和B链55位亮氨酸侧链末端两个碳原子CD1和CD2,分别测量A119CG和B55CD1、B55CD2之间的距离。 根据上述分析结果,参阅相关文献,说明斑头雁和灰雁血红蛋白A119侧链大小和柔性不同,如何影响其构象变化,从而进一步引起氧气结合能力的变化。 利用模拟突变的方法,将灰雁血红蛋白A链第119位脯氨酸突变成丙氨酸,测量突变后的A119CB和B55CD1、B55CD2之间的距离。 课题相关蛋白质结构分析
蛋白质结构与功能的关系 专业:植物学 摘要:蛋白质特定的功能都是由其特定的构象所决定的,各种蛋白质特定的构象又与其一级结构密切相关。天然蛋白质的构象一旦发生变化,必然会影响到它的生物活性。由于蛋白质的构象的变化引起蛋白质功能变化,可能导致蛋白质构象紊乱症,当然也能引起生物体对环境的适应性增强。而分子模拟技术为蛋白质的研究提供了一种崭新的手段。在理论上解决了结构预测和功能分析以及蛋白质工程实施方面所面临的难题。它在蛋白质的结构预测和模建工作中占有举足轻重的地位,实现了生物技术与计算机技术的完美结合。 关键词:蛋白质的结构、功能;折叠/功能关系;蛋白质构象紊乱症;分子模拟技术;同源建模 RNase是由124个氨基酸残基组成的单肽链,分子中 8 个Cys的-SH构成4对二硫键,形成具有一定空间构象的蛋白质分子。在蛋白质变性剂和一些还原剂存在下,酶分子中的二硫键全部被还原,酶的空间结构破坏,肽链完全伸展,酶的催化活性完全丧失。当用透析的方法除去变性剂和巯基乙醇后,发现酶大部分活性恢复,所有的二硫键准确无误地恢复原来状态。若用其他的方法改变分子中二硫键的配对方式,酶完全丧失活性。这个实验表明,蛋白质的一级结构决定它的空间结构,而特定的空间结构是蛋白质具有生物活性的保证。前体与活性蛋白质一级结构的关系,由108个氨基酸残基构成的前胰岛素原,在合成的时候完全没有活性,当切去N-端的24个氨基酸信号肽,形成84个氨基酸的胰岛素原,胰岛素原也没活性,在包装分泌时,A、B链之间的33个氨基酸残基被切除,才形成具有活性的胰岛素。 功能不同的蛋白质总是有着不同的序列;种属来源不同而功能相同的蛋白质的一级结构,可能有某些差异,但与功能相关的结构也总是相同。若一级结构变化,蛋白质的功能可能发生很大的变化。蛋白质特定的功能都是由其特定的构象所决定的,各种蛋白质特定的构象又与其一级结构密切相关。天然蛋白质的构象一旦发生变化,必然会影响到它的生物活性。由于蛋白质的构象的变化引起蛋白质功能变化,可能导致蛋白质构象紊乱症,当然也能引起生物体对环境的适应性增强。 虽然蛋白质结构与生物功能的关系比序列与功能的关系更加紧密,但结构与功能的这种关联亦若隐若现,并不能排除折叠差别悬殊的蛋白质执行相似的功能,折叠相似的蛋白质执行差别悬殊功能的现象的存在。无奈,该领域仍不得不将100多年前Fisher提出的“锁一钥
实验名称:蛋白质结构与功能的生物信息学研究实验目的:1.掌握运用BLAST工具对指定蛋白质的氨基酸序列同源性搜索 的方法。 2.掌握用不同的工具分析蛋白质的氨基酸序列的基本性质 3掌握蛋白质的氨基酸序列进行三维结构的分析 4.熟悉对蛋白质的氨基酸序列所代表蛋白的修饰情况、所参与的 代谢途径、相互作用的蛋白,以及与疾病的相关性的分析。 实验方法和流程: 一、同源性搜索 同源性从分子水平讲则是指两个核酸分子的核苷酸序列或两个蛋白质分子的氨基酸序列间的相似程度。BLAST工具能对生物不同蛋白质的氨基酸序列或不同的基因的DNA序列极性比对,并从相应数据库中找到相同或相似序列。对 指定的蛋白质的氨基酸序列进行同源性搜索步骤如下: ↓ 登录网址https://www.doczj.com/doc/a915094316.html,/blast/ ↓ 输入序列后,运行blast工具 ↓ 序列比对的图形结果显示
序列比对的图形结果:用相似性区段(Hit)覆盖输入序列的范围判断两个序列 的相似性。如果图形中包含低得分的颜色(主要是红色) 区段,表明两序列的并非完全匹配。 ↓ 匹配序列列表及得分
各序列得分 可选择不同的比对工具 备注: Clustal是一款用来对()的软件。可以用来发现特征序列,进行蛋白分类,证明 序列间的同源性,帮助预测新序列二级结构与三级结构,确定PCR引物,以及 在分子进化分析方面均有很大帮助。Clustal包括Clustalx和Clustalw(前者是图 形化界面版本后者是命令界面),是生物信息学常用的多序列比对工具。 该序列的比对结果有100条,按得分降序排列,其中最大得分2373,最小得分 分为1195. ↓ 详细的比对序列的排列情况 第一个匹配 序列 第一个序列的匹配率为100% Score表示打分矩阵计算出来的值,由搜索算法决定的,值越大说明匹配程度
1蛋白质家族和结构域数据库 1.1蛋白质模体及结构域数据库 模体和结构域 PROSITE数据库 PRINTS数据库 BLOCKS数据库 ProDom数据库 Pfam数据库 SMART数据库 InterPro数据库 Conserved Domain数据库 CDART 模体(motifs)和结构域(domains): Biologists can gain insight of the protein function based on identification of short consensus sequences related to known functions. These consensus sequence patterns are termed motifs and domains. A motif is a short conserved sequence pattern associated with distinct functions of a protein or DNA. It is often associated with a distinct structural site performing a particular function. A typical motif, such as a Zn-finger motif, is ten to twenty amino acids long. A domain is also a conserved sequence pattern, defined as an independent functional and structural unit. Domains are normally longer than motifs. A domain consists of more than 40 residues and up to 700 residues, with an average length of 100 residues. A domain may or may not include motifs within its boundaries. Examples,transmembrane domains, ligand-binding domains. Identification of motifs and domains heavily relies on multiple sequence alignment as well as profile and hidden Markov model (HMM) construction PROSITE(蛋白质家族及结构域数据库): The first established sequence pattern database https://www.doczj.com/doc/a915094316.html,/prosite/ 是蛋白质家族和结构域数据库,包含具有生物学意义的位点、模式、可帮助识别蛋白质家族的统计特征。 PROSITE中涉及的序列模式包括酶的催化位点、配体结合位点、与金属离子结合的残基、二硫键的半胱氨酸、与小分子或其它蛋白质结合的区域等。 PROSITE还包括根据多序列比对而构建的序列统计特征,能更敏感地发现一个(未知)序列是否具有相应的特征。 The functional information of these patterns is primarily based on published literature. PRINTS(蛋白质模体指纹数据库):
蛋白质结构分析方法:X射线晶体衍射分析和核磁共振 x 射线衍射法的分辨率可达到原子的水平,使它可以测定亚基的空间结构、各亚基间的相对拓扑布局,还可清楚的描述配体存在与否对蛋白质的影响。多维核磁共振波谱技术已成为确定蛋白质和核酸等生物分子溶液三维结构的唯一有效手段。NM R技术最大的优点不在于它的分辨率,而在于它能对溶液中和非晶态的蛋白质进行测量。 蛋白质的序列结构测定: 1.到目前为止,最经典的蛋白质的氨基酸序列分析方法是,sarI等人基于Edman降解原理研制的液相蛋白质序列仪,及后来发展的固相和气相的蛋白质序列分析仪。 2.质谱:早期的质谱电离的方式主要是电子轰击电离(EI),它要求样品的挥发性好,一般与气相色谱联用。但使用G C/M S分析,肽的长度受到限制,只能分析小的肽段。近年来,在离子化的技术及仪器方面取得了突破性进展,使得质谱所能测定的分子量的范围大大超出了10k u。因此,软离子化技术、基质辅助的激光解吸/离子化(MALDI)和电喷雾离子化(E SI)显得尤为有前途。通过串联质谱技术(MS/MS)和源后衰减基质辅助的激光解吸/离子化(PSD—MAIDI—MS),人们就可以从质谱分析中获得肽及蛋白质的结构信息。 蛋白质三维结构的研究: 1.X射线单晶衍射分析 2.核磁共振分析 3.蛋白质的二维晶体与三级重构: 蛋白质二维结晶及其电子晶体学的结构分析是目前结构生物学最活跃的领域之一。此法既适用于水溶性蛋白质,也适用于脂溶性膜蛋白的研究。电子晶体学的结构分析源于早期的电子衍射分析。与X射线衍射方法类似,电子衍射数据的实验分析得到的只是结构因子的振幅部分,丢掉了相位信息。但从剑桥MRC分子生物学实验室的Klug和DeRo sier建立了三维重构的方法开始,电子晶体学才真正发展成为一种独立的空间结构的分析方法,并从传统的X射线晶体学中脱胎出来。所谓电镜图像的三维重构是指由样品的一个或多个投影图得到样品中各成分之间的三维关系。这一方法的基本思路是电子显微图像含有振幅和相位的信息,二者可通过数字图像处理的傅立叶变换方法提取出来。蛋白质溶液构想的光谱技术: 紫外-可见差光谱:紫外一可见差光谱也是电子光谱,由电子跃迁产生。而蛋白质在紫外区的光吸收是由于芳香族氨基酸侧链吸收光引起的。可见区的研究则限于蛋白质一蛋白质、酶一辅酶、酶一底物的相互作用等,有时还需引人生色团才能进行。差光谱的产生是基于生色团经受一定的环境变化时,吸收峰发生位移,吸光度和谱带半宽度也有改变。生色团经受的这种环境变化称为微扰作用,变化后和变化前的光谱差称为差光谱。根据差光谱的光谱参数,可以推断这些生色团在大分子中是隐藏的半暴露的还是暴露的。 荧光探针法:荧光光谱法是研究蛋白质分子构象的一种有效方法,它能提供包括激发光谱、发射光谱、斯托克斯位移,荧光强度、总荧光量、量子产率、荧光偏振和荧光寿命等参数,这些参数从各个角度反映了分子的成键和结构情况。通过这些参数的测定,不但可以做一般的定量分析,而且还可以推断蛋白质分子在各种环境下的构象变化,从而阐明蛋白质分子在各种环境下的构象变化,进而阐明蛋白质结构与功能之间的关系。 圆二色谱:圆二色性和旋光色散都可用于测定分子的立体结构。旋光色散利用不对称分子对左、右圆偏振光折射的不同进行结构分析,而圆二色性则利用不对称分子对左、右圆偏振光吸收的不同进行结构分析。在蛋白质分子中,每个氨基酸残基的a碳是不对称碳,再加上主链构象也是不对称结构,因而蛋白质分子具有光学活性。通过圆二色的测定和计算可以了解蛋白质分子在溶液状态下的二级结构。圆二色对构象变化敏感,故它可灵敏的检测一些反应引起的构象变化,特别是用于观测蛋白质的变性是最方便的.
第一章蛋白质的结构与功能 [测试题] 一、名词解释:1.氨基酸 2.肽 3.肽键 4.肽键平面 5.蛋白质一级结构 6.α-螺旋 7.模序 8.次级键 9.结构域 10.亚基 11.协同效应 12.蛋白质等电点 13.蛋白质的变性 14.蛋白质的沉淀 15.电泳 16.透析 17.层析 18.沉降系数 19.双缩脲反应 20.谷胱甘肽 二、填空题 21.在各种蛋白质分子中,含量比较相近的元素是____,测得某蛋白质样品含氮量为15.2克,该样品白质含量应为____克。 22.组成蛋白质的基本单位是____,它们的结构均为____,它们之间靠____键彼此连接而形成的物质称为____。 23.由于氨基酸既含有碱性的氨基和酸性的羧基,可以在酸性溶液中带____电荷,在碱性溶液中带____电荷,因此,氨基酸是____电解质。当所带的正、负电荷相等时,氨基酸成为____离子,此时溶液的pH值称为该氨基酸的____。 24.决定蛋白质的空间构象和生物学功能的是蛋白质的____级结构,该结构是指多肽链中____的排列顺序。25.蛋白质的二级结构是蛋白质分子中某一段肽链的____构象,多肽链的折叠盘绕是以____为基础的,常见的二级结构形式包括____,____,____和____。 26.维持蛋白质二级结构的化学键是____,它们是在肽键平面上的____和____之间形成。 27.稳定蛋白质三级结构的次级键包括____,____,____和____等。 28.构成蛋白质的氨基酸有____种,除____外都有旋光性。其中碱性氨基酸有____,____,____。酸性氨基酸有____,____。 29.电泳法分离蛋白质主要根据在某一pH值条件下,蛋白质所带的净电荷____而达到分离的目的,还和蛋白质的____及____有一定关系。 30.蛋白质在pI时以____离子的形式存在,在pH>pI的溶液中,大部分以____离子形式存在,在pH