
生物化学第一章糖的化学
1.糖的概念及生物学作用
概念:由碳、氢、氧三种元素组成,是多羟基醛或多羟基酮及其聚合物和衍生物的总称。
生物学作用:
1.是人和动物的主要能源物质。淀粉、糖原、葡萄糖等
2.具有结构功能。纤维素、壳聚糖、粘多糖等
3.具有多方面的生物活性及功能。戊糖、FDP、香菇多糖、猪苓多糖、肝素等
2.糖的分类(单糖,寡糖,多糖)**掌握几种二糖中单糖成分,多糖种类
糖的分类(根据含糖单位的数目)
?单糖(monosaccharide):不能被水解成更小分子的糖。
?寡糖(oligosaccharide): 由单糖缩合而成的短链结构(含2~6个单糖)。
?多糖(polysaccharide):由许多单糖分子缩合而成的长链结构,分子量很大,均无甜味
也无还原性。
二糖:两分子单糖以糖苷键连接而成。
蔗糖(sucrose) G+F 麦芽糖(maltose)G+G 乳糖(lactose)G+Gal
多糖:复合糖。
3. 多糖分类(来源分类)
1.植物多糖:水溶性多糖:(如当归、枸杞、大黄、艾叶等)多糖。
水不溶性多糖:淀粉、纤维素等
2.动物多糖:多为水溶性粘多糖。肝素、硫酸软骨素、透明质酸、猪胎盘脂多糖等
3.微生物多糖:香菇、茯苓、银耳等的多糖
4.海洋生物多糖:甲壳素、螺旋藻多糖等。
6. 多糖提取方法分几类来进行?
第一类难溶于水,可溶于稀碱液。主要是胶类,如木聚糖、半乳聚糖
第二类易溶于温水,难溶于冷水的多糖。
第三类黏多糖的提取(组织中黏多糖与蛋白质共价结合)
(1)碱液抽提法:(据糖肽键对碱不稳定) 软骨中提取软骨素即用此法。
(2)蛋白水解酶消化法:组织中释出粘多糖的方法(蛋白水解酶:木瓜蛋白酶及链霉蛋
白酶) 。
**7. 多糖基本纯化方法有几种?原理?
1.分级沉淀法:乙醇分级沉淀分离各种硫酸软骨素。
2.季铵盐络合法:表面活化剂与粘多糖聚阴离子形成络合物,水不溶(低离子强度)。
3.离子交换层析:利用pH及盐浓度梯度分离各种多糖。
4.制备性区带电泳:利用分子大小、形状、电荷区分。
5.固定化凝集素的亲和层析法:特异结合单糖和寡糖(可逆);如刀豆凝集素ConA专一与
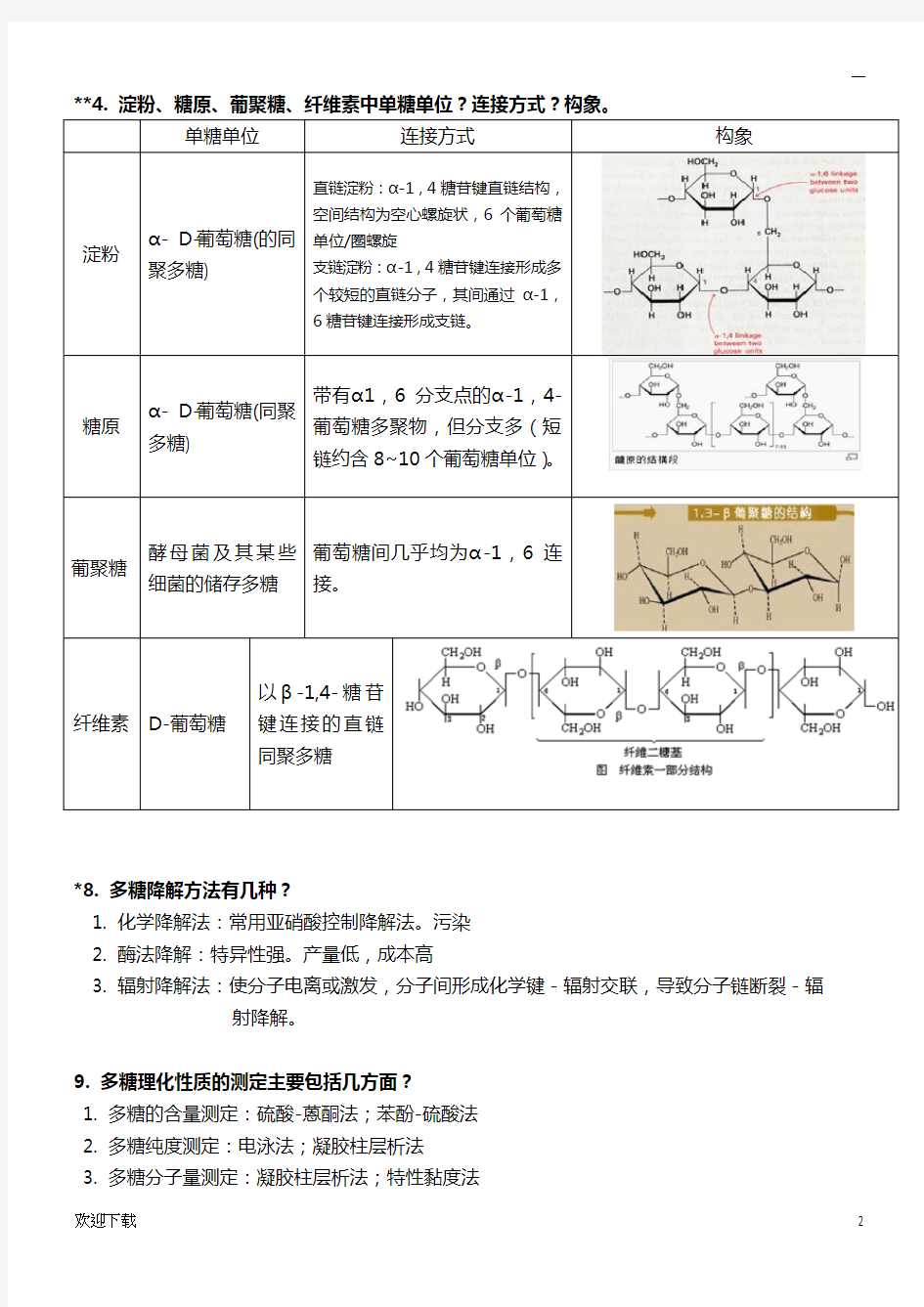
**4. 淀粉、糖原、葡聚糖、纤维素中单糖单位?连接方式?构象。
单糖单位连接方式构象
淀粉α- D-葡萄糖(的同
聚多糖)
直链淀粉:α-1,4糖苷键直链结构,
空间结构为空心螺旋状,6个葡萄糖
单位/圈螺旋
支链淀粉:α-1,4糖苷键连接形成多
个较短的直链分子,其间通过α-1,
6糖苷键连接形成支链。
糖原α- D-葡萄糖(同聚
多糖)
带有α1,6分支点的α-1,4-
葡萄糖多聚物,但分支多(短
链约含8~10个葡萄糖单位)。
葡聚糖酵母菌及其某些
细菌的储存多糖
葡萄糖间几乎均为α-1,6连
接。
纤维素D-葡萄糖以β-1,4-糖苷键连接的直链同聚多糖
*8. 多糖降解方法有几种?
1. 化学降解法:常用亚硝酸控制降解法。污染
2. 酶法降解:特异性强。产量低,成本高
3. 辐射降解法:使分子电离或激发,分子间形成化学键-辐射交联,导致分子链断裂-辐
射降解。
9. 多糖理化性质的测定主要包括几方面?
1. 多糖的含量测定:硫酸-蒽酮法;苯酚-硫酸法
2. 多糖纯度测定:电泳法;凝胶柱层析法
3. 多糖分子量测定:凝胶柱层析法;特性黏度法
第二章脂类的化学
1. 脂类概念及分类
概念:脂肪酸与醇所组成的酯类及其衍生物,低溶于水而高溶于有机溶剂(乙醚、氯仿、丙酮等),并能为机体利用的有机化合物。脂肪、类脂总称。
(一)单纯脂类simple lipid:脂肪酸与醇所形成的酯。
1.三酰甘油(中性脂):3 脂肪酸+ 1 甘油
2.蜡:长链脂肪酸和长链醇或固醇组成
(二)复合脂类compound lipid:除含有脂肪酸和醇外,尚有其它非脂成分
1.磷脂:非脂成分为磷酸和含氮碱。根据含醇不同,又分甘油磷脂和鞘氨醇磷脂(鞘磷脂)
2.糖脂:非脂成分是糖。根据醇成分不同,又分为鞘糖脂和甘油糖脂
(三)衍生脂质derived lipid;单纯脂质和复合脂质衍生而来或与之关系密切,也具有脂质一般性质的物质
1.取代烃
2.固醇类
3.萜
4.其他脂质:维生素A、D、E、K,脂酰CoA,、脂蛋白、脂多糖等
分类:
可皂化脂质saponifiable lipid:能被碱水解而产生皂的。
不可皂化脂质unsaponifiable lipid:不被碱水解生成皂的。类固醇和萜是两类主要的不可皂化
脂质。
非极性脂质
极性脂质
2.脂肪的基本结构
脂肪fat的结构:甘油+三分子脂肪酸(多为偶数)
-三脂酰甘油triacyglycerol
3个R(烃基)可相同或不同,R2多为不饱和脂肪酸
R相同为单纯甘油酯,不同则为混和酯
**3. 必需脂肪酸
必需脂肪酸:动物体内功能必需但自身不能合成,必需依靠食物供给的多不饱和脂肪酸。
亚油酸、亚麻酸、花生四烯酸
亚油酸、亚麻酸分别属于ω-6和ω-3家族,两者不能互变。
二十碳五烯酸(EPA),二十二碳六烯酸(DHA)临床药用。
**4. 甘油磷脂通式及其各种甘油磷脂的基本组成
*5. 鞘磷脂结构特点(组成)
鞘磷脂结构:为不含甘油的磷脂
*6. 糖脂分类及其结构特点
**7. 胆固醇与胆汁酸关系
胆汁酸是肌体内胆固醇的主要代谢终产物。
1.胆汁酸为胆固醇代谢提供了一条重要的排泄途径。三分之一的胆固醇的分解代谢是通过胆汁酸合成实现的。
2.吸收的胆汁酸对胆汁酸自身合成起负反馈调节作用,因而也对胆固醇的分解起负反馈调节
作用。
3.胆汁酸可促进胆汁中胆固醇的分泌,对保持胆固醇的溶解性具有重要作用。
4.胆汁酸可为肠道胆固醇的吸收所必须。
5.肝脏中胆固醇合成的调节与胆汁酸的肠肝循环密切相关。
6.胆汁酸可调节肠道胆固醇的合成。
8. 脂类提取、分离、分析基本原理及常用方法。
脂类混合物的分离是根据它们的极性差别或在非极性溶剂中的溶解度差别进行的。
(一)脂类有机溶剂提取
提取物质:非极性脂类(三酰甘油、蜡和色素等)
溶剂:乙醚、氯仿、苯等。
在此溶剂中不会发生因疏水相互作用引起的脂类聚集
提取物质:膜脂(磷脂、糖脂、固醇等)
溶剂:极性有机溶剂(甲醇、乙醇等)。
此类溶剂既能降低脂类分子间的疏水相互作用,又能减弱膜脂与膜蛋白之间的氢键结合和静电相互作用;
(二)脂类的色谱分离
提取之脂类粗提物可用吸附色谱法分级分离。
原理:脂类通过分离介质时,因其极性的不同,导致与固定相吸附的能力出现差异,在流动相洗脱时移动速度不一而分离。
硅胶柱吸附层析:分非极性、极性、荷电
高效液相色谱
薄层层析等等
(三)脂类的组成与结构分析
混合脂肪酸的气液色谱(GLC)分析:分析分离混合物中挥发性成分。
脂类结构的测定:利用脂类对特异条件下的降解敏感。了解脂的结构。
如确定烃链长度和双键的位置,质谱分析有特效。
第三章维生素与微量元素
*1. Vit概念,分类及食物主要来源
概念:Vitamin是机体维持正常生理功能所必需,但在体内不能合成或合成量很少,必须由食物供给的一组低分子量有机物质。
分类:脂溶性vit:vitA、D、E、K
水溶性vit:B族:vit B1、B2、B6、B12,vit PP,泛酸,叶酸,生物素等
vit C
水溶性
维生素B7,生
物素酵母、肝脏、谷物维生素B4
肝脏、蛋黄、乳制品、大
豆。维生素B6
酵母、谷物、肝脏、蛋类、乳
制品
维生素B3,烟酸
菸碱酸、尼古丁酸酵
母、谷物、肝脏、米糠
维生素B5,泛
酸酵母、谷物、肝脏、蔬菜
维生素B2,核黄素
酵母、肝脏、蔬菜、蛋类
维生素B1
酵母、谷物、肝脏、大豆、肉
类
2.维生素体内代谢状态,哪类易中毒?哪些易缺乏?补充时应注意那些问题?
*3. 下列这些症状是由哪些维生素缺乏所引起?
夜盲症Vit A 干眼病Vit A 佝偻病Vit D 软骨病Vit D 脚气病Vit B1
Vit 缺乏症
Vit A:A1哺乳动物、咸水鱼肝脏;
A2淡水鱼;植物中为胡萝卜素
干眼病、夜盲症;
过量致头痛、恶心腹泻、肝脾大、致畸
B1:硫胺素(含硫的唑噻环和含氨基的嘧啶环组成),在生物体内常以硫胺素焦磷酸(thiamine pyrophosphate, TPP)的辅酶形式存在,是涉及到糖代谢中羰基碳合成与裂解反应的辅酶。
B2:核黄素(核醇与7,8-二甲基异咯嗪的缩合物),在生物体内以黄素单核苷酸(flavin mononucleotide, FMN)和黄素腺嘌呤二核苷酸(flavin adenine dinucleotide, FAD)的
形式存在,是一些氧化还原酶(黄素蛋白)的辅基。
B6:包括吡哆醇、吡哆醛和吡哆胺,皆属于吡啶衍生物。在体内以磷酸酯形式存在,磷酸吡哆醛和磷酸吡哆胺是其活性形式,是氨基酸代谢中多种酶的辅酶。
B12:氢钴胺素。在体内有两种辅酶形式,主要是5'-脱氧腺苷钴胺素,少量的甲基钴胺素。参与分子重排、核苷酸还原和甲基转移。
PP:包括烟酸和烟酰胺,在体内烟酰胺与核糖、磷酸、腺嘌呤组成脱氢酶的辅酶(NAD+、NADP++)。
泛酸:贝塔-丙氨酸通过肽键与阿尔法、伽玛-二羟基贝塔,贝塔-二甲基丁酸缩合而成。是辅酶A 和磷酸泛酰巯基乙胺的组成成分。coA。
叶酸:蝶酰谷氨酸。由2-氨基-4-羟基-6-甲基喋啶、对氨基苯甲酸和L-谷氨酸组成。四氢叶酸是其活性辅酶形式,称coF,是碳原子一碳单位的重要受体和供体。
—5.铁体内吸收形式及运输形式?**在体内参与哪些化合物组成?
Fe2+吸收(十二指肠及空肠上端)络合铁易吸收
Fe3+与Tf结合运输
Hb/Mb/Cyt系统/呼吸链/过氧化物(氢)酶的组成
*6. 碘在体内主要作用?**缺乏导致什么疾病?过多呢?
作用:參與甲狀腺素的形成
缺乏:地方性甲状腺肿、发育停滞、痴呆、呆小病(胎兒期缺碘)
过量:高碘性甲状腺肿
第四章蛋白质的化学
*1. 组成Pr的20种氨基酸的名称、结构通式及结构特点、分类及分类依据。
*2. Pr的一、二、三、四级结构的概念及相应的维持力
蛋白质的一级结构:
是指由不同种类、数量的氨基酸,通过肽键而构成的氨基酸排列顺序。为蛋白质结构与功能的基础。稳定力量--肽键, 二硫键
蛋白质的二级结构:
多肽链中主链骨架中若干肽单位,各自沿一定的轴盘旋或折叠,并以氢键为主要的次级键而形成的有规则的构象。
稳定力量:氢键形式:α-螺旋、β-折叠、β-拐角、无规卷曲
蛋白质的三级结构:
一条多肽链中所有原子或基团在三维空间的整体排布。
稳定三级结构的次级键:疏水键、氢键、盐键等
蛋白质的四级结构:
由两个或两个以上的亚基之间相互作用,彼此以非共价键相连而形成更复杂的构象。
亚基间结合力:疏水键、盐键、氢键、范德华力、二硫键
*5. 简述蛋白质一级结构与功能的关系?
蛋白质的一级结构决定了空间构象,空间构象决定了蛋白质的生物学功能。
1.一级结构不同,生物学功能各异
不同Pr结构间仅有微小的差别就可表现出不同的生物学功能。
2.一级结构中“关键”部分相同,其功能也相同;关键部分变化,其生物活性也改变。其活
性仅需所必需的关键部分。
3.一级结构的变化与疾病的关系
基因突变可以导致Pr一级结构的改变,使Pr的生物学功能降低或丧失,甚至可引起生理功能的改变而发生疾病。(分子病)
3. 简述Pr二级结构的几种形式及结构特点。
形式:α-螺旋、β-折叠、β-折角、无规卷曲
1.α-螺旋(α-helix)
Pr中多个肽平面通过AA- α碳原子的旋转,多肽链的主骨架沿中性轴盘曲成稳定的α-螺旋
构象。
结构特征:
(1)右手螺旋,每3.6个AA旋转一周,螺距为0.54nm,肽平面与螺旋长轴平行。
(2)氢键为主要次级键
相邻(1-4)肽平面上的N-H和C=O生成氢键
(3)AA残基的R基团分布在螺旋外侧
R基团影响螺旋稳定性:酸(碱)性AA连续,或较大的R基团,N原子无H游离(脯)均不能形成螺旋。
2.β-折叠
又称β-片层
结构特征:
(1)肽链的伸展使肽键平面之间折叠成锯齿状。
(2)肽链平行排列,相邻肽链之间的肽键交替形成氢键,维持构象主要次级键。
(3)肽链平行走向有顺式和反式两种,N端同侧为顺式,不在同侧为反式。
(4)AA残基的R基团在片层的上下。
3.β-折角
又称β-转角
结构特点:
(1)伸展的肽链形成180°回折-U型转折结构。
(2)由连续的四个AA残基构成。
(3)第一个AA残基的=O与第四个AA残基的N-H形成氢键。这一段结构往往第二个AA 残基为Pro(亚氨酸)。
4.无规线团(random coil)
又称无规卷曲
结构特点:除上述构象外的不规则构象(自由折叠或无规线团)。
*8. 请列出4种蛋白质分离纯化常用的方法并说明其原理。
(一)根据溶解度不同的方法
1.等电点沉淀法;
2.盐析沉淀法;
3.低温有机溶剂沉淀法
(二)根据分子量大小分离纯化方法
1.透析和超滤法;
2.分子排阻层析:凝胶过滤;
3.密度梯度离心
原理书p95
4.名词解释
肽键(peptide bond):又称酰胺键“-CO-NH”,由一分子AA的α羧基与另一AA的α氨
基缩合脱水而成
?肽单位peptide unit:肽键与相邻的两个α-碳原子所组成的基团(形成构象)
?超二级结构:又称基序,模体或模序(motif),在多肽链内顺序上相邻的二级结构常常在空间
折叠中靠近,彼此相互作用,形成有规则的二级结构聚集体。如:αα、βββ、βαβ等。
?结构域domain:是位于超二级结构与三级结构间的一个层次。在较大的蛋白质分子中,多肽
链上相邻的超二级结构紧密联系,进一步折叠形成一个或多个相对独立的致密三维实体。
?亚基(又称亚单位,subunit):有些蛋白质是由两条或两条以上的多肽链组成的,这种蛋白
质的每条多肽链被称为一个亚基。(寡聚体oligomer:2~10个亚基组成的具有四级结构的Pr。更多的亚基数目则称多聚体(polymer))
?分子病:由遗传突变引起的,使蛋白质的一级结构发生改变而导致的疾病。
?蛋白构象疾病:多肽链折叠发生错误,尽管其一级结构不变,其构象发生改变,仍可影响其功
能,严重时可导致疾病。因蛋白质折叠错误或折叠导致构象异常变化引起的疾病,称蛋白构象疾病(protein conformation disease),如人纹状体脊髓变性病,老年痴呆症,亨丁顿舞蹈病和疯牛病。
?蛋白质的变性作用:(denaturation)物理和化学的因素使蛋白质的空间结构发生改变或破坏,
导致其生物学活性丧失,理化性质改变的现象。
?蛋白质的等电点:Pr在溶液中带电荷的状态主要取决于溶液的pH。当溶液的pH使蛋白质
所带的正负电荷相等,净电荷为零时溶液的pH即为pI。
?Pr的变构现象:一些Pr受某些因素影响,一级结构不变而空间构象变化,导致生物学功能的
改变--称Pr的变构效应(allosteric effect)或别构作用。
*6. 蛋白质空间结构与功能的关系?
1. Pr前体的活化
一些蛋白质以无活性的蛋白质原的前体形式分泌合成。经活化后(如酶解部分片段),使活性升高或具有活性。实质是:特定空间构象的形成。
2.Pr的变构现象
一些Pr受某些因素影响,一级结构不变而空间构象变化,导致生物学功能的改变,称Pr
变构效应或别构作用。酶的变构调节,Hb运输O2。
3.蛋白质构象改变与疾病
多肽链的正确折叠对蛋白质正确构象的形成和功能发挥至关重要。因蛋白质折叠错误或折
叠导致构象异常变化引起的疾病,称蛋白构象疾病(protein conformation disease)。
7. 蛋白质分子量测定常用方法有哪些并说明原理?
1.分子筛层析法:
Pr混合物通过一定大小的凝胶介质,大、小分子流程不同而分离。洗脱体积是分子量对数
的线性函数。以标准Pr对照,可求出分子量。
2.SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)
SDS含丰富的负电荷,与Pr形成复合物后,不同的Pr带有相同的电荷,消除电荷差异使
电泳行为只受分子量大小的影响。
3.生物质谱
测定分子质量和相对应离子电荷,获得样品的分子量、分子式、分子中放射性核素构成和分
子结构。
9. 了解蛋白质纯度鉴定和含量测定的方法。
(一)Pr的纯度鉴定
1.层析法;
2.电泳法;
3.免疫化学法
(二)Pr 含量测定
1.克氏定氮法
2.福林-酚试剂法:Pr中Tyr,Trp可与酚试剂(磷钨酸磷钼酸试剂)生成蓝色化合物。
3.双缩脲法:Pr在碱性溶液中可与Cu++产生紫红色反应(Cu++与肽键上N形成配位复合物)。
4.紫外分光光度法:芳香族AA在280nm有特异吸收峰。
5.BCA比色法
6.Bradford蛋白分析法
第五章核酸的化学
1. 单核苷酸的组成成分,及其各成分之间的连接方式
单核苷酸:核酸的基本结构单位,可分解成核苷和磷酸。
核苷与磷酸通过酯键结合构成核苷酸。
核糖核苷酸脱氧核糖核苷酸。
戊糖和碱基通过糖苷键(C-N)缩合而成,均为β-糖苷
键
2. 真核生物DNA和原核生物DNA的一级结构分别有哪些特点?
(1)真核生物染色质由DNA 、组蛋白、非组蛋白、RNA组成。
特点:①重复顺序:其DNA具有重复排列的核苷酸序列
重复的程度分:高度重复序列(106-7);中度重复序列(102-3);
单拷贝(往往为一个Pr的结构基因)。
②间隔序列与插入序列
间隔序列:基因与基因之间的非编码序列。
插入序列:基因内的非编码序列
DNA中编码蛋白质或RNA的序列--外显子exon
编码序列之间存在一些非编码区--内含子intron
③回文结构:真核细胞DNA中存在特殊的序列。
碱基排列在两条DNA链中顺读与倒读意义一样,(轴转180°两部分可完全相同)
的结构。
(2)原核生物DNA
特点:①基因重叠:即在同一DNA序列中常常包括不同的基因区,重叠在一起的基因编码
组序不同,而翻译出不同蛋白质。
②DNA序列每转录出的一段mRNA,常包含多个顺反子(表达多个功能相关的蛋白
质)。
③结构基因是连续的(即无内含子存在)。
3. DNA 双螺旋结构模型要点有哪些?
Watson-Crick模型(双螺旋结构)(1953)要点:
1.DNA分子由两条多核苷酸链构成,反向平行(一条3’到5’;另一条5’到3’)。为双螺旋结构,右手螺旋。螺旋形成一大沟一小沟。
2.磷酸基与脱氧核糖在外侧,彼此以磷酸二酯键连接,形成DNA骨架;内侧为碱基;糖环平面与碱基平面相互垂直;
3.双螺旋直径为2nm。每隔0.34nm有一个核苷酸。10对核苷酸/圈螺旋,高度为3.4nm。
4.两条链碱基间以氢键连接,A:T(两个氢键),C:G(三个氢键)碱基互补。
5.双螺旋表面由大小沟,对DNA与蛋白质识别重要。
4. DNA分子一级、二级、三级结构概念(注意原核与真核生物的相似与区别)
?DNA的一级结构:
指多核苷酸链中从5’末端到3’末端核苷酸的排列顺序--核苷酸序列,又称碱基序列。(主要差异为碱基)
?DNA的二级结构:
Watson-Crick模型(双螺旋结构)稳定因素:互补碱基间的氢键;
碱基堆积力(最重要):磷酸基负电荷与介质正电荷之间形成离子键。
?DNA的三级结构:
在双螺旋基础上进一步盘绕扭曲构成。超螺旋为其中一种形式,环状DNA为此构型,可压缩成很小体积。(大肠杆菌DNA)
6. 核酸的理化性质包含哪几个方面?
1.分子大小
2.核酸的溶解度与粘度
核酸为极性化合物,微溶于水,钠盐易溶一些。不溶于乙醇、乙醚、氯仿等有机溶剂。
3.核酸的酸碱性质
核酸中磷酸基pK值低,所以核酸作为多元酸,具较强酸性。
碱基的解离与环境pH有关,DNA在pH4.0~11.0最稳定。
4.核酸的紫外吸收
嘌呤、嘧啶具有强烈的紫外吸收,所以核酸有紫外吸收,260nm处最大吸收值。可进行核酸定量测定。
增色效应:核酸变性时,紫外吸收增加的现象。
减色效应:核酸复性时,紫外吸收减少的现象。
5. 参与Pr生物合成的三种RNA(tRNA、rRNA、mRNA)细胞含量、分子大小、稳定性、结构特点。
tRNA结构-----最小的一类RNA,由几十个碱基组成。占总RNA 15%
1.一级结构:70个左右核苷酸组成,较多稀有碱基
2.二级结构:三叶草式结构;3’端-CCA-OH(AA臂…);DHU环;反密码环;
额外环;TΨC环
3.三级结构:倒“L”型
mRNA结构-----分子量大小不一
1.多数真核生物3’末端有200个左右的腺苷酸尾巴(polyA尾)
2.真核生物mRNA的5’端有7-甲基鸟嘌呤核苷三磷酸的帽子(真核)
3. mRNA分子中有编码区和非编码区
4.每分子mRNA可同时结合几十个核糖体(多核糖体)
rRNA的结构-----分子大小不一,多个局部存在茎环结构(局部配对造成)
1.真核细胞的rRNA有5S,5.8S,18S,28S四种,与蛋白质结合存在于核糖体的大小亚基中。
5SRNA与tRNA结构类似
2.其他RNA及病毒RNA由部分双螺旋及部分突环相间排列
7. 核酸变性、核酸复性、核酸杂交Tm值(溶解温度)
(一)变性
理化因素使核酸分子的空间结构改变,引起核酸理化性质、生物学功能改变的现象,变性时核酸双链解开,但一级结构未破坏。
理化因素:加热、过高过低的pH,有机溶剂、酰胺、尿素等
热变性:加热引起DNA的变性。其过程为“跃变”过程
(二)复性renaturation
变性的DNA在适当条件下,可使两条彼此分开的链重新由氢键连接而形成双链的过程。(三)核酸的杂交hybridization
将来源不同的DNA经热变性,冷却,使其复性,在复性时,异源DNA之间在某些区域有相同的序列会形成杂交DNA分子。
第六章酶
1. 何谓酶的专一性?分几类?
2. 酶分类的根据?分几类?
3.B族Vit辅酶形式是什么?一般有何作用?
4. 何谓酶活性中心?酶的必需基团有几种,各有什么作用?
5.写出米氏方程,简述Km和Vm的意义,如何测定?
6. 何谓酶的抑制作用?抑制剂分类?
7.
何谓竞争性抑制,请用竞争性抑制的原理解释磺胺类药物抑菌的机制。
8.三种可逆抑制作用的概念和特点(Km,Vm的变化)
磺胺类药物的作用机理就是竞争性抑制
、
第七章激素及其作用机制(细胞信号转导)
1. 激素的脱敏作用
激素长时间作用于靶细胞时,靶细胞会产生一种降低其自身对激素应答强度的倾向,此现象--激素的脱敏作用。
2. 为什么吃海带可防止粗脖根?
单纯性甲状腺肿。原因:缺碘,药物影响,先天性激素合成障碍。治疗:补碘(碘盐,海带,紫菜等)。
海带内含有人体所需要的微量元素碘,当人体碘缺乏时,甲状腺代偿性增生,形成大脖子-碘缺乏病.
3. 肾上腺素、肾上腺皮质激素(主要是糖皮质激素)、胰岛素和胰高血糖素的生理作用
肾上腺素: 血糖↑,血压↑
①主要促使肝糖原分解,使血糖增加。
②肾上腺素可使血管收缩;并能刺激心脏,使心肌收缩力增加,心跳加快,所以使血压升高。(对心脏作用大)
肾上腺皮质激素:
(1)糖皮质激素
①调节糖代谢,抑制糖的氧化,促使蛋白质转化为糖,升高血糖。
②可减轻过敏反应,减轻炎症。
(2)盐皮质激素
①促使体内保留钠,排出钾(保钠排钾),调节水盐代谢。
胰岛素:
①促进糖原的生物合成以及葡萄糖的氧化,降低血糖。
②促进蛋白质及脂类的合成代谢。
胰高血糖素:
①在许多方面与胰岛素相反。主要促使肝糖原分解,使血糖↑
5. 信号转导信息分子
《生物化学》题库 习题一参考答案 一、填空题 1蛋白质中的苯丙氨酸、酪氨酸和__色氨酸__3种氨基酸具有紫外吸收特性,因而使蛋白质在 280nm处有最大吸收值。 2蛋白质的二级结构最基本的有两种类型,它们是_α-螺旋结构__和___β-折叠结构__。前者的螺距为 0.54nm,每圈螺旋含_3.6__个氨基酸残基,每个氨基酸残基沿轴上升高度为__0.15nm____。天然 蛋白质中的该结构大都属于右手螺旋。 3氨基酸与茚三酮发生氧化脱羧脱氨反应生成__蓝紫色____色化合物,而脯氨酸与茚三酮反应 生成黄色化合物。 4当氨基酸溶液的pH=pI时,氨基酸以两性离子离子形式存在,当pH>pI时,氨基酸以负 离子形式存在。 5维持DNA双螺旋结构的因素有:碱基堆积力;氢键;离子键 6酶的活性中心包括结合部位和催化部位两个功能部位,其中前者直接与底物结合,决定酶的 专一性,后者是发生化学变化的部位,决定催化反应的性质。 72个H+或e经过细胞内的NADH和FADH2呼吸链时,各产生3个和2个ATP。 81分子葡萄糖转化为2分子乳酸净生成______2________分子ATP。 糖酵解过程中有3个不可逆的酶促反应,这些酶是己糖激酶;果糖磷酸激酶;丙酮酸激酶9。 10大肠杆菌RNA聚合酶全酶由σββα'2组成;核心酶的组成是'2ββα。参
与识别起始信号的是σ因子。 11按溶解性将维生素分为水溶性和脂溶性性维生素,其中前者主要包括V B1、V B2、V B6、 V B12、V C,后者主要包括V A、V D、V E、V K(每种类型至少写出三种维生素。) 12蛋白质的生物合成是以mRNA作为模板,tRNA作为运输氨基酸的工具,蛋白质合 成的场所是 核糖体。 13细胞内参与合成嘧啶碱基的氨基酸有:天冬氨酸和谷氨酰胺。 14、原核生物蛋白质合成的延伸阶段,氨基酸是以氨酰tRNA合成酶?GTP?EF-Tu三元复合体的形式进 位的。 15、脂肪酸的β-氧化包括氧化;水化;再氧化和硫解4步化学反应。 二、选择题 1、(E)反密码子GUA,所识别的密码子是: A.CAU B.UG C C.CGU D.UAC E.都不对 2、(C)下列哪一项不是蛋白质的性质之一? A.处于等电状态时溶解度最小 B.加入少量中性盐溶解度增加 C.变性蛋白质的溶解度增加 D.有紫外吸收特性 3.(B)竞争性抑制剂作用特点是:
生物化学实验思考题 Document number:BGCG-0857-BTDO-0089-2022
生物化学实验思考题 1.可用何种颜色反应鉴别酮糖的存在? 间苯二酚反应,在酸的作用下,酮糖脱水生成羟甲基糠醛,后者再与间苯二酚作用生成红色物质。 2.α—萘酚的反应原理是什么? 糖在浓的无机酸(硫酸、盐酸)作用下,脱水生成糠醛及其糠醛的衍生物,后者能与α—萘酚生成紫红色物质。 3.菲林试剂和本尼迪凯特氏法检验糖的原理是什么? O沉淀。它们都是含有Cu2+的碱性溶液,能使还原糖氧化而本身还原成红色或者黄色的Cu 2 4.何谓纸层析法? 用滤纸作为惰性支持物的的分层层析法。 5.何谓Rf值?影响Rf值的主要因素是什么? 纸层析法形成的纸层析图谱上,原点到层析点中心的距离与原点到溶剂前沿的距离的比值;影响Rf值的因素有:物质的结构、性质、溶剂系统、层析滤纸的质量和层析温度等因素有关。 6.怎样制备扩展剂? 扩展剂是4份水饱和的和1份醋酸的混合物。将20ml和5ml冰醋酸放入中,与15ml水混合,充分振荡,静置后分层,放出下层水层,漏斗中的则为扩展剂。 7.层析缸中的平衡剂的作用是什么? 平衡剂起到使纸上吸附的溶剂达到饱和。使物质在展开剂和纸层析上吸附的溶剂中溶解度不同而进行分离。 8.通过蛋白质及氨基酸的呈色反应实验你掌握了几种鉴定蛋白质和氨基酸的方法?他们 的原理是什么?
四种:双缩脲反应;茚三酮反应;黄色反应;考马斯亮蓝反应。 (1)双缩脲在碱性环境中能与Cu2+ 生成紫红色化合物,蛋白质中有肽键,其结构与双缩脲相似,也能发生此反应。(2)除脯氨酸、羟脯氨酸和茚三酮反应产生黄色物质外,所有α—氨基酸及一切蛋白质都能和茚三酮反应产生蓝紫色物质。(3)含有苯环结构的氨基酸,如酪氨酸、和色氨酸,遇硝酸后,可被硝化成黄色物质,该化合物在碱性溶液中进一步形成橙色的硝醌酸钠。(4)考马斯亮蓝G250有红色和蓝色两种色调。在酸性溶液中,其以游离态存在呈现棕红色;当它与蛋白质通过疏水作用结合后变为蓝色。 9.什么是酶的最适温度及其应用的意义? 酶活性最高时的温度称为酶的最适温度。可以利用这一原理指导工农业生产,提高生产效益。 10.什么是酶反应的最适PH?对酶的活性有什么影响? 酶催化活性最高时反应体系的 pH 称为酶促反应的最适 PH。PH过高、过低都会使酶促反应的速率下降。 11.什么是酶的活化剂? 指能够与分子上的一些结合,使酶活力提高的物质。 12.什么是酶的抑制剂?与变性剂有何区别?本实验结果如何证明酶的专一性? 指与分子上的一些结合,使酶活力下降,甚至消失,但不使变性的物质。区别:酶的抑制剂不会使酶发生变性,而酶的变性剂会使酶的结构和性质发生改变。酶的专一性证明:实验结果表明通过在淀粉和蔗糖中分别加入有活性的淀粉酶和蔗糖酶后,两者均产生了还原性的糖,与本尼迪凯特试剂反应产生了砖红色沉淀,而其他的条件下均没有还原性糖的的产生,进而说明了酶的专一性。(答题时可以详尽的描述) 13.何谓碘值?有何意义?
第一章 绪论 1. 什么是手性中心、手性分子,具有手性中心的分子是手性分子吗? 2. 什么是构型?甘油醛的DL 构型如何区分?具有多个手性中心的分子构型如何表示? 3. 什么是旋光性?DL 型与左右旋光性具有相关性吗? 4. 什么是旋光异构?什么是几何异构? 什么是立体异构 5. 什么是构象?构象与构型如何区别? 6. 生物体内单糖一般为D 型、组成蛋白质的氨基酸为L 型,思考生物进化过程中这种构型的选择有何生理学意义? 第二章 氨基酸 1. 什么是氨基酸、什么是α、β或γ氨基酸?生物体内氨基酸都是α氨基酸吗? 2. 组成蛋白质的常见氨基酸的构型通式如何表示?组成蛋白质的常见氨基酸具有哪些结构特性?组成蛋白质的氨基酸都是L 型?都具有旋光性吗? 3. 组成蛋白质的常见20种氨基酸均是极性分子吗?侧链基团的极性情况如何? 4. 什么是氨基酸的等电点?组成蛋白质常见氨基酸的等电点如何计算?计算的原理是什么?在pH 7的溶液中其带点性质如何? 5. 判断题 1) 组成蛋白质的20种氨基酸都有一个不对称性的α-碳原子,所以都有旋光性。 2) 蛋白质分子中因为含有酪氨酸、色氨酸和苯丙氨酸,所以在260nm 处有最大吸收峰。 3) 亮氨酸的疏水性比丙氨酸强。 4) 组成蛋白质的氨基酸均是L-型氨基酸,除甘氨酸外都是左旋的。 5) 自由在很高或很低pH 值时,氨基酸才主要以非离子化形式存在。 ⒍ 溶液的pH 可以影响氨基酸的等电点。 5. 有四种氨基酸,其解离常数分别为: 氨基酸 pK 1 (α-COOH ) pK 2 (α-NH 3 + ) pK 3 (R 基) Cys 1.71 8.33 10.78 Glu 2.19 9.67 4.25 Arg 2.17 9.04 12.48 Tyr 2.20 9.11 10.07 问:⑴ 四种氨基酸的等电点分别是多少?⑵ 四种氨基酸在pH7的电场中如何移动?
生物化学试题库 蛋白质化学 一、填空题 1.构成蛋白质的氨基酸有种,一般可根据氨基酸侧链(R)的大小分为侧链氨基酸和侧链氨基酸两大类。其中前一类氨基酸侧链基团的共同特怔是具有性;而后一类氨基酸侧链(或基团)共有的特征是具有性。碱性氨基酸(pH6~7时荷正电)有两种,它们分别是氨基酸和氨基酸;酸性氨基酸也有两种,分别是氨基酸和氨基酸。 2.紫外吸收法(280nm)定量测定蛋白质时其主要依据是因为大多数可溶性蛋白质分子中含有氨基酸、氨基酸或氨基酸。 3.丝氨酸侧链特征基团是;半胱氨酸的侧链基团是 。这三种氨基酸三字母代表符号分别是 4.氨基酸与水合印三酮反应的基团是,除脯氨酸以外反应产物的颜色是;因为脯氨酸是α—亚氨基酸,它与水合印三酮的反应则显示色。 5.蛋白质结构中主键称为键,次级键有、、 、、;次级键中属于共价键的是键。 6.镰刀状贫血症是最早认识的一种分子病,患者的血红蛋白分子β亚基的第六位 氨酸被氨酸所替代,前一种氨基酸为性侧链氨基酸,后者为性侧链氨基酸,这种微小的差异导致红血蛋白分子在氧分压较低时易于聚集,氧合能力下降,而易引起溶血性贫血。 7.Edman反应的主要试剂是;在寡肽或多肽序列测定中,Edman反应的主要特点是。 8.蛋白质二级结构的基本类型有、、 和。其中维持前三种二级结构稳定键的次级键为 键。此外多肽链中决定这些结构的形成与存在的根本性因与、、 有关。而当我肽链中出现脯氨酸残基的时候,多肽链的α-螺旋往往会。 9.蛋白质水溶液是一种比较稳定的亲水胶体,其稳定性主要因素有两个,分别是 和。 10.蛋白质处于等电点时,所具有的主要特征是、。 11.在适当浓度的β-巯基乙醇和8M脲溶液中,RNase(牛)丧失原有活性。这主要是因为RNA酶的被破坏造成的。其中β-巯基乙醇可使RNA酶分子中的键破坏。而8M脲可使键破坏。当用透析方法去除β-巯基乙醇和脲的情况下,RNA酶又恢复原有催化功能,这种现象称为。 12.细胞色素C,血红蛋白的等电点分别为10和7.1,在pH8.5的溶液中它们分别荷的电性是、。 13.在生理pH条件下,蛋白质分子中氨酸和氨酸残基的侧链几乎完全带负电,而氨酸、氨酸或氨酸残基侧链完全荷正电(假设该蛋白质含有这些氨基酸组分)。 14.包含两个相邻肽键的主肽链原子可表示为,单个肽平面及包含的原子可表示为。 15.当氨基酸溶液的pH=pI时,氨基酸(主要)以离子形式存在;当pH>pI时,氨基酸
生物化学实验理论考试题答案 1.醋酸纤维薄膜电泳时点样端应靠近电极的哪一端,为什么? 答;电泳时点样端应靠近负极,因为血清中各种蛋白质在PH为8.6的环境中均带负电,根据同性相吸,异性相斥原理,点样端在负极时蛋白质向正极泳动从而实现蛋白质分离。 2.用分光光度计测定物质含量时,设置空白对照管的作用,为什么? 答;空白对照是为了排除溶剂对吸光度的影响。溶液的吸光度表示物质对光的吸收程度,但是作为溶剂也能吸收,反射和透射一部分的光,因此必须以相同的溶剂设置对照,排除溶剂对吸光度的影响。 3.简述血清蛋白的醋酸纤维薄膜的电泳原理? 答;血清蛋白中各种蛋白质离子在电场力的作用下向着与自身电荷相反的方向涌动,而各种蛋白质等电点不同,且在PH为8.6时所带电荷不同,分子大小不等,形状各有差异,所以在同一电泳下永动速度不同从而实现分离。 4.何谓Rf值?影响Rf值的因素? 答;Rf是原点到层析中心的距离与原点到溶剂前沿的距离之比。Rf的大小与物质的结构,性质,溶剂系统,层析滤纸的质量和层析温度有关,对同一种物质来讲Rf是一个常量。 5.什么是盐析?盐析会引起蛋白质的变性吗?一般用什么试剂? 答;盐析是指当溶液中的中性盐持续增加时,蛋白质的溶解度下降,当中性盐的浓度达到一定程度的时候,蛋白质从溶液中析出的现象。盐析不会引起蛋白质的变性,因为蛋白质的结构并未发生改变,去掉引起盐析的因素蛋白质仍能溶解;一般用饱和硫酸铵溶液进行盐析 6.简述DNS法测定还原糖浓度的实验原理? 答;还原糖与DNS在碱性条件下加热被氧化成糖酸,而DNS被还原为棕红色的3-氨基-5-硝基水杨酸。在一定范围内还原糖的量与3-氨基-5硝基水杨酸颜色的深浅成正比,用分光光度计测出溶液的吸光度,通过查对标准曲线可计算出3-氨基-5硝基水杨酸的浓度,从而得出还原糖的浓度。 7.影响蛋白质沉淀的因素是什么?沉淀和变性有什么联系? 答;水溶液中的蛋白质分子由于表面形成水化层和双电层从而形成稳定的亲水胶
《生物化学》思考题 蛋白质 一、名词: 氨基酸及蛋白质等电点;蛋白质一级、二级、三级及四级结构;电泳;蛋白质分子病;别构效应;蛋白质变性作用;肽与肽键;N-端与-端;AA殘基; 二、简答题 1、中性、酸性及碱性氨基酸有哪些? 答:20种氨基酸中的精氨酸、赖氨酸和组氨酸为3种碱性氨基酸;酸性氨基酸为天冬氨酸和谷氨酸2种;其他15种为中性氨基酸。 2、稳定蛋白质空间结构的作用力有哪些? 答:氢键、盐键、疏水作用、范德华引力等是稳定空间结构的作用力;一级结构中的化学键有肽键和二硫键。 3、蛋白质在非等电点时不易形成凝集沉淀的的原理; 答:一是水化层,蛋白质表面带有亲水基团,形成水化层,使蛋白质颗粒相互隔开,不易碰撞成大颗粒;二是蛋白质在非等电时带有同种电荷,使蛋白质之间相互排斥,保持一定距离,不致相互凝集沉淀 4、指出下面pH条件下,各蛋白质在电场中向哪个方向移动,即正极,负极,还是保持原点?(1)胃蛋白酶(pI 1.0),在pH 5.0;(2)血清清蛋白(pI 4.9),在pH 6.0;(3)α-脂蛋白(pI 5.8),在pH 5.0和pH 9.0; 答:(1)胃蛋白酶pI 1.0<环境pH 5.0,带负电荷,向正极移动; (2)血清清蛋白pI 4.9<环境pH 6.0,带负电荷,向正极移动; (3)α-脂蛋白pI 5.8>环境pH 5.0,带正电荷,向负极移动; α-脂蛋白pI 5.8<环境pH 9.0,带负电荷,向正极移动。 三、何谓蛋白质的变性与沉淀?二者在本质上有何区别? 答:蛋白质变性的概念:天然蛋白质受物理或化学因素的影响后,使其失去原有的生物活性,并伴随着物理化学性质的改变,这种作用称为蛋白质的变性。 变性的本质:分子中各种次级键断裂,使其空间构象从紧密有序的状态变成松散无序的状态,一级结构不破坏。 蛋白质变性后的表现:①?生物学活性消失;②?理化性质改变:溶解度下降,黏度增加,紫外吸收增加,侧链反应增强,对酶的作用敏感,易被水解。 蛋白质由于带有电荷和水膜,因此在水溶液中形成稳定的胶体。如果在蛋白质溶液中加入适当的试剂,破坏了蛋白质的水膜或中和了蛋白质的电荷,则蛋白质胶体溶液就不稳定而出现沉淀现象。沉淀机理:破坏蛋白质的水化膜,中和表面的净电荷。 蛋白质的沉淀可以分为两类: (1)可逆的沉淀:蛋白质的结构未发生显著的变化,除去引起沉淀的因素,蛋白质仍能溶于原来的溶剂中,并保持天然性质。如盐析或低温下的乙醇(或丙酮)短时间作用蛋白质。 (2)不可逆沉淀:蛋白质分子内部结构发生重大改变,蛋白质变性而沉淀,不再能溶于原溶剂。如加热引起蛋白质沉淀,与重金属或某些酸类的反应都属于此类。
第一章 一。叙述L-α氨基酸的结构特征,比较各种结构异同并分析结构与性质关系 ,自然界氨基酸有300余种,但被生物体直接用于合成的蛋白质仅有20 中,且均属L-α氨基酸(除甘氨酸外),结构特点:α氨基酸是羧酸分 子中的α氢原子被氨基所代替直接形成的有机化合物、简单些说,当氨基酸的氨基与羧基结合在同一碳原子上的,就称为α-氨基酸。 通式如下,R为侧链,连接—COOH的碳为α -碳原子。为不对称碳原子(甘氨酸除外),不同氨基酸起侧脸R结构各异。 根据侧链结构可分为1.含烃链的。非极性脂肪族氨基酸如丙氨酸。 2。含极性不带电荷侧链的极性中性氨基酸。如半胱氨酸。 3.含芳香基的含芳香环氨基酸:如酪氨酸 4.含负性解离基团的酸性氨基酸。如谷氨酸 5.含正性解离截团的碱性氨基酸。如精氨酸。 二。简述蛋白质一级结构,二级结构,三级结构,四级结构基本概念及各结构层次间的内在关系 一级结构:蛋白质分子中从N端到C端,氨基酸分子的排列顺序称为蛋白质的一级结构。(主要化学键是肽键也包括二硫键) 二级结构:蛋白质分子中某一段氨基酸的局部空间构象,也就是该段太链主链骨架原子的相对空间位置。(N 氨基氮,C a碳,C o(羰基碳))3个原子的依次重复排列。主要靠:氢键 三级结构:是指整条太链中全部氨基酸残基的相对空间位置,也就是整条太链所有原子中三维空间的排布位置。(三级结构的形成和稳定性主要依靠次级键如:疏水键,盐键,氢键,范德华力) 四级结构:(体内许多功能性蛋白质含有2条或2条以上多太链,每一条链多太链都有其完整的三级结构,称为亚基) 四级结构:蛋白质分子中各个亚基的空间排布及亚基接触部位的局部和相互作用,称为蛋白质的四级结构。主要靠:氢键和离子键。 结构层次之间的关系:一级结构是空间构象的基础。氨基酸残基影响二级结构的形成,二级结构是以一级结构为基础的,氨基酸残基社和形成a折或者贝塔折叠,就会出现相应的二级结构。 三。解释蛋白质分子中模体和结构域与概念及其二/三级结构的关系
生物化学试题库及其答案——糖类化学 一、填空题 1.纤维素是由________________组成,它们之间通过________________糖苷键相连。 2.常用定量测定还原糖的试剂为________________试剂和 ________________试剂。 3.人血液中含量最丰富的糖是________________,肝脏中含量最丰富的糖是 ________________,肌肉中含量最丰富的糖是________________。 4.乳糖是由一分子________________和一分子________________组成,它们之间通过________________糖苷键相连。 5.鉴别糖的普通方法为________________试验。 6.蛋白聚糖是由________________和________________共价结合形成的复合物。 7.糖苷是指糖的________________和醇、酚等化合物失水而形成的缩醛(或缩酮)等形式的化合物。 8.判断一个糖的D-型和L-型是以________________碳原子上羟基的位置作依据。 9.多糖的构象大致可分为________________、________________、 ________________和________________四种类型,决定其构象的主要因素是 ________________。 二、是非题 1.[ ]果糖是左旋的,因此它属于L-构型。 2.[ ]从热力学上讲,葡萄糖的船式构象比椅式构象更稳 定。 3.[ ]糖原、淀粉和纤维素分子中都有一个还原端,所以它们都有还原性。 4.[ ]同一种单糖的α-型和β-型是对映体。 5.[ ]糖的变旋现象是指糖溶液放置后,旋光方向从右旋变成左旋或从左旋变成右旋。 6.[ ]D-葡萄糖的对映体为L-葡萄糖,后者存在于自然界。 7.[ ]D-葡萄糖,D-甘露糖和D-果糖生成同一种糖脎。 8.[ ]糖链的合成无模板,糖基的顺序由基因编码的转移酶决定。 9.[ ]醛式葡萄糖变成环状后无还原性。 10.[ ]肽聚糖分子中不仅有L-型氨基酸,而且还有D-型氨基酸。 三、选择题
实验一胆固醇的提取2012-11-15 16:20:00 生物师范班题目 1.比色法测定样品的理论基础是什么? 被测样品必须要有颜色。 2. 胆固醇含量在多少范围时,与值呈良好的线性关系? 在400mg/ml范围内。 3.在提取胆固醇的过程中,为什么要加无水乙醇? 促使蛋白质沉淀。 4.在试管中加入1ml磷硫铁试剂,会产生什么现象?(至少写2点) 产生紫红色化合物。产生热量。 5.在无水乙醇中加磷硫铁试剂时,正确的加法是什么?将产生什么现象?请准确描述 该现象。 沿管壁慢慢加入。溶液分层。上层是无水乙醇,下层是磷硫铁试剂。 1. 胆固醇提取过程中,无水乙醇为什么要分两次加入? 目的是使蛋白质以分散很细的沉淀颗粒析出。 2.我们用比色法测定胆固醇含量的仪器名称是什么? 分光光度计 3. P-S-Fe试剂配置时,能用稀硫酸吗?为什么? 不能。因为FeCl3本身是亲水性物质,稀硫酸中含有水,会降低P-S-Fe试剂的浓度,从而导致反应不能发生。 4.请简述移液枪的使用步骤。 根据所要吸取的溶液的体积选定合适量程的移液枪。 调好量程。 插枪头。 吸取液体。 将移液枪的量程调至最大。 5. 请简述0.08mg/ml胆固醇标准溶液的配置方法。 准确称取胆固醇80mg,溶于无水乙醇,定容至100ml 将贮液用无水乙醇准确稀释10倍既得。
实验二总糖和还原糖测定2012-11-15 16:20:00 生物师范班 1. 请写出还愿糖与非还原糖结构的不同之处 拥有自由的醛基和酮基 2. 对没有还原性的糖,用什么方法进行糖含量的测定? 酸水解的方法将非还原性的糖降解呈还原糖。 3. DNS之所以能和还原糖反应,是因为其结构中含有__________? 硝基 4. 如果将DNS和其与还原糖反应的产物同时进行比色,谁的A值更大?为什么? 产物的更大,因为产物生成棕红色,颜色越深,吸光度越高。 5. 还原糖提取过程中,为什么要离心两次? 因为这样可以更好地将还原糖全部提取出来。第二次洗涤沉淀。 海洋技术班 1.单糖都是还原糖吗?为什么? 是的,因为有自由醛基和酮基 2.为什么能用比色法测定还原糖的量? 因为还原糖的量与光吸收值呈线性关系。 3.DNS的全称是? 3,5-二硝基水杨酸 4.总糖提取过程中,碘液的作用是什么? 确认淀粉水解完全。 5.请简述标准曲线的作用。 通过标准曲线来算出未知样品的浓度。
1 绪论 1.生物化学研究的对象和内容是什么? 解答:生物化学主要研究: (1)生物机体的化学组成、生物分子的结构、性质及功能; (2)生物分子分解与合成及反应过程中的能量变化; (3)生物遗传信息的储存、传递和表达; (4)生物体新陈代谢的调节与控制。 2.你已经学过的课程中哪些内容与生物化学有关。 提示:生物化学是生命科学的基础学科,注意从不同的角度,去理解并运用生物化学的知识。 3.说明生物分子的元素组成和分子组成有哪些相似的规侓。 解答:生物大分子在元素组成上有相似的规侓性。碳、氢、氧、氮、磷、硫等6种是蛋白质、核酸、糖和脂的主要组成元素。碳原子具有特殊的成键性质,即碳原子最外层的4个电子可使碳与自身形成共价单键、共价双键和共价三键,碳还可与氮、氧和氢原子形成共价键。碳与被键合原子形成4个共价键的性质,使得碳骨架可形成线性、分支以及环状的多种多性的化合物。特殊的成键性质适应了生物大分子多样性的需要。氮、氧、硫、 磷元素构成了生物分子碳骨架上的氨基(—NH2)、羟基(—OH )、羰基(C O )、羧基(—COOH )、巯基(—SH )、磷酸基(—PO4 )等功能基团。这些功能基团因氮、硫和磷有着可变的氧化数及氮和氧有着较强的电负性而与生命物质的许多关键作用密切相关。 生物大分子在结构上也有着共同的规律性。生物大分子均由相同类型的构件通过一定的共价键聚合成链状,其主链骨架呈现周期性重复。构成蛋白质的构件是20种基本氨基酸。氨基酸之间通过肽键相连。肽链具有方向性(N 端→C 端),蛋白质主链骨架呈“肽单位”重复;核酸的构件是核苷酸,核苷酸通过3′, 5′-磷酸二酯键相连,核酸链也具有方向性(5′、→3′ ),核酸的主链骨架呈“磷酸-核糖(或脱氧核糖)”重复;构成脂质的构件是甘油、脂肪酸和胆碱,其非极性烃长链也是一种重复结构;构成多糖的构件是单糖,单糖间通过糖苷键相连,淀粉、纤维素、糖原的糖链骨架均呈葡萄糖基的重复。 2 蛋白质化学 1.用于测定蛋白质多肽链N 端、C 端的常用方法有哪些?基本原理是什么? 解答:(1) N-末端测定法:常采用2,4―二硝基氟苯法、Edman 降解法、丹磺酰氯法。 ①2,4―二硝基氟苯(DNFB 或FDNB)法:多肽或蛋白质的游离末端氨基与2,4―二硝基氟苯(2,4―DNFB )反应(Sanger 反应),生成DNP ―多肽或DNP ―蛋白质。由于DNFB 与氨基形成的键对酸水解远比肽键稳定,因此DNP ―多肽经酸水解后,只有N ―末端氨基酸为黄色DNP ―氨基酸衍生物,其余的都是游离氨基酸。 ② 丹磺酰氯(DNS)法:多肽或蛋白质的游离末端氨基与与丹磺酰氯(DNS ―Cl )反应生成DNS ―多肽或DNS ―蛋白质。由于DNS 与氨基形成的键对酸水解远比肽键稳定,因此DNS ―多肽经酸水解后,只有N ―末端氨基酸为强烈的荧光物质DNS ―氨基酸,其余的都是游离氨基酸。 ③ 苯异硫氰酸脂(PITC 或Edman 降解)法:多肽或蛋白质的游离末端氨基与异硫氰酸苯酯(PITC )反应(Edman 反应),生成苯氨基硫甲酰多肽或蛋白质。在酸性有机溶剂中加热时,N ―末端的PTC ―氨基酸发生环化,生成苯乙内酰硫脲的衍生物并从肽链上掉下来,除去N ―末端氨基酸后剩下的肽链仍然是完整的。 ④ 氨肽酶法:氨肽酶是一类肽链外切酶或叫外肽酶,能从多肽链的N 端逐个地向里切。根据不同的反应时间测出酶水解释放的氨基酸种类和数量,按反应时间和残基释放量作动力学曲线,就能知道该蛋白质的N 端残基序列。 (2)C ―末端测定法:常采用肼解法、还原法、羧肽酶法。 肼解法:蛋白质或多肽与无水肼加热发生肼解,反应中除C 端氨基酸以游离形式存 在外,其他氨基酸都转变为相应的氨基酸酰肼化物。
生物化学实验习题及参 考答案 HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】
生物化学实验习题及解答 一、名词解释 1、pI; 2、层析; 3、透析; 4、SDS-聚丙烯酰氨凝胶电泳; 5、蛋白质变性; 6、复性; 7、Tm 值; 8、同工酶; 9、Km值; 10、DNA变性;11、退火;12、增色效应 二、基础理论单项选择题 1、用下列方法测定蛋白质含量,哪一种方法需要完整的肽键( ) A、双缩脲反应 B、凯氏定氮 C、紫外吸收 D、羧肽酶法 2、下列哪组反应是错误的() A、葡萄糖——Molish反应 B、胆固醇——Libermann-Burchard反应 C、色氨酸——坂口(Sakaguchi)反应 D、氨基酸——茚三酮反应 3、Sanger试剂是() A、苯异硫氰酸 B、2,4-二硝基氟苯 C、丹磺酰氯 D、-巯基乙醇 4、肽键在下列哪个波长具有最大光吸收() A、215nm B、260nm C、280nm D、340nm 5、下列蛋白质组分中,哪一种在280nm具有最大的光吸收() A、色氨酸的吲哚基 B、酪氨酸的酚环 C、苯丙氨酸的苯环 D、半胱氨酸的硫原子 6、SDS凝胶电泳测定蛋白质的相对分子量是根据各种蛋白质() A、在一定pH值条件下所带的净电荷的不同 B、分子大小不同 C、分子极性不同 D、溶解度不同 7、蛋白质用硫酸铵沉淀后,可选用透析法除去硫酸铵。硫酸铵是否从透析袋中除净,你选用下列哪一种试剂检查() A、茚三酮试剂 B、奈氏试剂 C、双缩脲试剂 D、Folin-酚试剂 8、蛋白质变性是由于() A、一级结构改变 B、亚基解聚 C、空间构象破坏 D、辅基脱落 9、用生牛奶或生蛋清解救重金属盐中毒是依据蛋白质具有() A、胶体性 B、粘性 C、变性作用 D、沉淀作用 10、有关变性的错误描述为()
生物化学(第三版)课后习题详细解答第三章氨基酸 提要α-氨基酸是蛋白质的构件分子,当用酸、碱或蛋白酶水解蛋白质时可获得它们。蛋白质中的氨基酸都是L型的。但碱水解得到的氨基酸是D型和L型的消旋混合物。 参与蛋白质组成的基本氨基酸只有20种。此外还有若干种氨基酸在某些蛋白质中存在,但它们都是在蛋白质生物合成后由相应是基本氨基酸(残基)经化学修饰而成。除参与蛋白质组成的氨基酸外,还有很多种其他氨基酸存在与各种组织和细胞中,有的是β-、γ-或δ-氨基酸,有些是D型氨基酸。 氨基酸是两性电解质。当pH接近1时,氨基酸的可解离基团全部质子化,当pH在13左右时,在这中间的某一pH(因不同氨基酸而异),氨基酸以等电的兼性离子(HNCHRCOO)+-则全部去质子化。 pH称为该氨基酸的等电点,用3状态存在。某一氨基酸处于净电荷为零的兼性离子状态时的介质 pI表示。 所有的α-氨基酸都能与茚三酮发生颜色反应。α-NH与2,4-二硝基氟苯(DNFB)作用产生相应 DNP-氨基酸(Sanger反应);α-NH与苯乙硫氰酸酯(PITC)作用形成相应氨基酸的苯胺基2的 硫甲2酰衍生物( Edman反应)。胱氨酸中的二硫键可用氧化剂(如过甲酸)或还原剂(如巯基乙醇)断裂。半胱氨酸的SH基在空气中氧化则成二硫键。这几个反应在氨基酸荷蛋白质化学中 占有重要地位。 除甘氨酸外α-氨基酸的α-碳是一个手性碳原子,因此α-氨基酸具有光学活性。比旋是α-氨基酸的物理常数之一,它是鉴别各种氨基酸的一种根据。 参与蛋白质组成的氨基酸中色氨酸、酪氨酸和苯丙氨酸在紫外区有光吸收,这是紫外吸收法定量蛋白质的依据。核磁共振(NMR)波谱技术在氨基酸和蛋白质的化学表征方面起重要作用。 氨基酸分析分离方法主要是基于氨基酸的酸碱性质和极性大小。常用方法有离子交换柱层析、高效液相层析(HPLC)等。 习题 1.写出下列氨基酸的单字母和三字母的缩写符号:精氨酸、天冬氨酸、谷氨酰氨、谷氨酸、苯丙氨酸、色氨酸和酪氨酸。[见表3-1] 表3-1 氨基酸的简写符号 三字单字母单字母三字母符母符名称名称符号符号号号L Leu Ala A (leucine) (alanine) 亮氨酸丙氨酸K Arg Lys R (lysine) 精氨酸(arginine) 赖氨酸M N Asn Met )(methionine) 蛋氨酸(asparagines) 甲硫氨酸(天冬酰氨F D Asp Phe (phenylalanine) 苯丙氨酸(aspartic acid) 天冬氨酸 B Asx Asp Asn或和/P C Pro Cys (praline) 脯氨酸半胱氨酸(cysteine) S Q Gln Ser (serine) 丝氨酸(glutamine) 谷氨酰氨T E Glu Thr (threonine) 谷氨酸(glutamic acid) 苏氨酸Z Gls Glu /和Gln或W G Gly Trp (tryptophan) (glycine)
生物化学复习思考题(2009年) 第二章蛋白质 什么是蛋白质?蛋白质有哪些生理功能? 蛋白质有哪些分类方法? 蛋白质中含氮量一般有多少?1克蛋白氮相当于多少蛋白质? 氨基酸有哪些构型?组成蛋白质的氨基酸是什么构型的? 组成蛋白质的氨基酸有哪些?熟记各种氨基酸的代号。 氨基酸有哪些分类方法? 氨基酸在什么情况下带负电和正电?什么叫做氨基酸的等电点? 氨基酸有哪三个重要的反应? 哪些氨基酸可以吸收紫外光? 什么叫做构象?什么叫做构型? 解释名词:肽、肽键、二肽、寡肽、多肽、氨基酸残基、氨基末端、羧基末端 什么叫做蛋白质的一级结构? 什么叫做肽单位?肽单位有哪些性质? 什么叫做α-碳原子的二面角? 什么叫做蛋白质的二级结构?二级结构有哪些类型? 什么叫α-螺旋和β-折叠?平行和反平行β-折叠有何区别? 试述α-角蛋白的结构. 什么叫做超二级结构?超二级结构有哪些类型? 解释名词:结构域、三级结构、四级结构、亚基、亚单位、均一的亚基、不均一的亚基 维持蛋白质高级结构的力有哪些? 什么是二硫键?二硫键是怎样形成的? 蛋白质是生物大分子,为什么在水溶液中还很稳定? 蛋白质在什么情况下带正电和负电?什么叫做蛋白质的等电点? 解释名词:变性、复性、沉淀、可逆沉淀、不可逆沉淀、盐析 蛋白质变性的本质是什么? 第三章酶化学 什么叫酶?与一般的催化剂比较,酶有哪些相同之处和不同点? 酶的反应专一性有哪些种类?什么叫绝对专一性、相对专一性、基团专一性、键专一性、立体异构专一性? 酶的惯用法命名有哪些方式? 国际酶学委员会将酶分为哪几类?水解酶类与裂解酶类有何区别? 什么叫做简单酶和结合酶? 解释名词:酶蛋白、辅因子、辅酶、辅基、全酶、活性中心、结合部位、催化部位。 酶分子活性中心以外的必需基团有什么功能? 解释名词:酶原、致活素、靠近、定向、底物形变、共价催化、亲核催化、亲核剂 什么叫酶促反应初速度? 10. 影响酶促反应的因素有哪些? 底物浓度怎样影响酶促反应?米氏方程表示了什么关系? 米氏常数Km有什么意义? 某一酶促反应的速度从最大速度的10%提高到90%时,底物浓度应是原来的多少倍?
生物化学试题(1) 第一章蛋白质的结构与功能 [测试题] 一、名词解释:1.氨基酸 2.肽 3.肽键 4.肽键平面 5.蛋白质一级结构 6.α-螺旋 7.模序 8.次级键 9.结构域 10.亚基 11.协同效应 12.蛋白质等电点 13.蛋白质的变性 14.蛋白质的沉淀 15.电泳 16.透析 17.层析 18.沉降系数 19.双缩脲反应 20.谷胱甘肽 二、填空题 21.在各种蛋白质分子中,含量比较相近的元素是____,测得某蛋白质样品含氮量为15.2克,该样品白质含量应为____克。 22.组成蛋白质的基本单位是____,它们的结构均为____,它们之间靠____键彼此连接而形成的物质称为____。 23.由于氨基酸既含有碱性的氨基和酸性的羧基,可以在酸性溶液中带____电荷,在碱性溶液中带____电荷,因此,氨基酸是____电解质。当所带的正、负电荷相等时,氨基酸成为____离子,此时溶液的pH值称为该氨基酸的____。 24.决定蛋白质的空间构象和生物学功能的是蛋白质的____级结构,该结构是指多肽链中____的排列顺序。25.蛋白质的二级结构是蛋白质分子中某一段肽链的____构象,多肽链的折叠盘绕是以____为基础的,常见的二级结构形式包括____,____,____和____。 26.维持蛋白质二级结构的化学键是____,它们是在肽键平面上的____和____之间形成。 27.稳定蛋白质三级结构的次级键包括____,____,____和____等。 28.构成蛋白质的氨基酸有____种,除____外都有旋光性。其中碱性氨基酸有____,____,____。酸性氨基酸有____,____。 29.电泳法分离蛋白质主要根据在某一pH值条件下,蛋白质所带的净电荷____而达到分离的目的,还和蛋白质的____及____有一定关系。 30.蛋白质在pI时以____离子的形式存在,在pH>pI的溶液中,大部分以____离子形式存在,在pH 生物化学实验 一、名词解释: 分配层析法电泳同工酶酶活性分光光度法层析技术比活力 二、填空题: 1. 测定蛋白质含量的方法有,,和。 2. CAT能把H2O2分解为H2O和O2,其活性大小以来表示,当CAT与H2O2反应结束,再用测定未分解的H2O2。 3. 聚丙烯酰胺凝胶电泳是以作为载体的一种区带电泳,这种凝胶是由和交联剂在催化剂作用下聚合而成。化学聚合法一般用来制备_____________胶,其自由基的引发剂是,催化剂是______________;光聚合法适于制备大孔径的_________________胶,催化剂是______________。 4.层析技术按分离过程所主要依据的物理化学性质进行分类,可分成以下几种:_______________,_______________,_______________,_______________和________________。 5. 使用离心机离心样品前,必须使离心管__________且对称放入离心机。 6. 米氏常数可近似表示酶和底物亲合力,Km愈小,表示E对S的亲合力愈,Km愈大,表示E对S 的亲合力愈。 7. 分光光度计在使用之前必须预热,注意预热及样品槽空时必须_________(打开、合上)样品池翻盖。 8. CAT是植物体内重要的酶促防御系统之一,其活性高低与植物的密切相关。 9. 纸层析实验中,____________形成固定相,____________流动相。 10. 聚丙烯酰胺凝胶是是由和交联剂在催化剂作用下聚合而成的,在具有自由基团体系时,两者就聚合。引发产生自由基的方法有两种:和。11. 层析技术按按固定相的使用形式进行分类,可分成以下几种:_______________,_______________,_______________和________________。 三、问答题: 1、简述4种测定蛋白质含量的方法及其原理。 2、简述不连续聚丙烯酰胺凝胶电泳中的三个不连续及三种物理效应。 3、试分析影响电泳的主要因素有哪些? 参考答案: 生物化学实验 一、名词解释: 1、电泳:指带电粒子在电场中向与其自身所带电荷相反的电极方向移动的现象。 2、同工酶:指催化同一种化学反应,但其酶蛋白本身的分子结构组成却有所不同的一组酶。 3、分配层析法:用物质在两种或两种以上不同的混合溶剂中的分配系数不同,而达到分离目的的一种实验方法。 年等通过什么实验证明DNA是遗传物质的 答:肺炎球菌转化实验证明DNA是遗传物质。 2.核酸分为哪些类它们的分布和功能是什么 答:(1)核酸分为两大类,即:核糖核酸(RNA)、脱氧核糖核酸(DNA)(2)核酸的分布: DNA的分布:真核生物,98%在核染色体中,核外的线粒体中存在mDNA,叶绿体中存在ctDNA。 原核生物,存在于拟核和核外的质粒中。 病毒:DNA病毒 RNA的分布:分布于细胞质中。有mRNA、rRNA、tRNA (3)功能:的DNA是主要遗传物质 RNA主要参与蛋白质的生物合成。 tRNA:转运氨基酸TrRNA:核糖体的骨架 mRNA:合成蛋白质的模板 RNA的功能多样性。 参与基因表达的调控;催化作用;遗传信息的加工;病毒RNA是遗传信息的载体。 3.说明Watson-Crick建立的DNA双螺旋结构的特点。 答:(1)DNA分子有两条反向平行的多核苷酸链相互盘绕形成双螺旋结构。两条链围绕同一个“中心轴”形成右手螺旋,双螺旋的直径为2nm。 (2)由脱氧核糖和磷酸间隔相连而形成的亲水骨架在双螺旋的外侧,而疏水的碱基对则在双螺旋的内部,碱基平面与中心轴垂直,螺旋旋转一周约为10个碱基对(bp),螺距为,这样相邻碱基平面间隔为,并有一个36o的夹角,糖环平面则于中心轴平行。 (3)两条DNA链借助彼此碱基之间形成的氢键而结合在一起。根据碱基结构的特征,只能形成嘌呤与嘧啶配对。既A与T配对,G与C配对,A-T间有2个氢键,G-C间有3个氢键。 (4)在DNA双螺旋结构中,两条链配对偏向一侧,形成一条大沟和一条小沟。这两条沟特别是大沟对蛋白质识别DNA双螺旋结构上的特定信息非常重要,只 生物化学试题及答案 绪论 一.名词解释 1.生物化学 2.生物大分子 蛋白质 一、名词解释 1、等电点 2、等离子点 3、肽平面 4、蛋白质一级结构 5、蛋白质二级结构 6、超二级结构 7、结构域 8、蛋白质三级结构 9、蛋白质四级结构 10、亚基 11、寡聚蛋白 12、蛋白质变性 13、蛋白质沉淀 14、蛋白质盐析 15、蛋白质盐溶 16、简单蛋白质 17、结合蛋白质 18、必需氨基酸 19、同源蛋白质 二、填空题 1、某蛋白质样品中的氮含量为0.40g,那么此样品中约含蛋白 g。 2、蛋白质水解会导致产物发生消旋。 3、蛋白质的基本化学单位是,其构象的基本单位是。 4、芳香族氨基酸包括、和。 5、常见的蛋白质氨基酸按极性可分为、、和。 6、氨基酸处在pH大于其pI的溶液时,分子带净电,在电场中向极游动。 7、蛋白质的最大吸收峰波长为。 8、构成蛋白质的氨基酸除外,均含有手性α-碳原子。 9、天然蛋白质氨基酸的构型绝大多数为。 10、在近紫外区只有、、和具有吸收光的能力。 11、常用于测定蛋白质N末端的反应有、和。 12、α-氨基酸与茚三酮反应生成色化合物。 13、脯氨酸与羟脯氨酸与茚三酮反应生成色化合物。 14、坂口反应可用于检测,指示现象为出现。 15、肽键中羰基氧和酰胺氢呈式排列。 16、还原型谷胱甘肽的缩写是。 17、蛋白质的一级结构主要靠和维系;空间结构则主要依靠维系。 18、维持蛋白质的空间结构的次级键包括、、和等。 19、常见的蛋白质二级结构包括、、、和等。 20、β-折叠可分和。 21、常见的超二级结构形式有、、和等。 22、蛋白质具有其特异性的功能主要取决于自身的排列顺序。 23、蛋白质按分子轴比可分为和。 24、已知谷氨酸的pK1(α-COOH)为2.19,pK2(γ-COOH)为4.25,其pK3(α-NH3+)为9.67,其pI为。 25、溶液pH等于等电点时,蛋白质的溶解度最。 三、简答题 生化实验讲义思考题参考答案 实验一淀粉的提取和水解 1、实验材料的选择依据是什么? 答:生化实验的材料选择原则是含量高、来源丰富、制备工艺简单、成本低。从科研工作的角度选材,还应当注意具体的情况,如植物的季节性、地理位置和生长环境等,动物材料要注意其年龄、性别、营养状况、遗传素质和生理状态等,微生物材料要注意菌种的代数和培养基成分的差异等。 2、材料的破碎方法有哪些? 答:(1) 机械的方法:包括研磨法、组织捣碎法; (2) 物理法:包括冻融法、超声波处理法、压榨法、冷然交替法等; (3) 化学与生物化学方法:包括溶胀法、酶解法、有机溶剂处理法等。 实验二总糖与还原糖的测定 1、碱性铜试剂法测定还原糖是直接滴定还是间接滴定?两种滴定方法各有何优缺点? 答: 我们采用的是碱性铜试剂法中的间接法测定还原糖的含量。间接法的优点是操作简便、反应条件温和,缺点是在生成单质碘和转移反应产物的过程中容易引入误差;直接法的优点是反应原理直观易懂,缺点是操作较复杂,条件剧烈,不易控制。 实验五粗脂肪的定量测定─索氏提取法 (1)本实验制备得到的是粗脂肪,若要制备单一组分的脂类成分,可用什么方法进一步处理? 答:硅胶柱层析,高效液相色谱,气相色谱等。 (2)本实验样品制备时烘干为什么要避免过热? 答:防止脂质被氧化。 实验六蛋白质等电点测定 1、在等电点时蛋白质溶解度为什么最低? 请结合你的实验结果和蛋白质的胶体性质加以说明。 蛋白质是两性电解质,在等电点时分子所带净电荷为零,分子间因碰撞而聚沉倾向增加,溶液的粘度、渗透压减到最低,溶解度最低。结果中pH约为4.9时,溶液最浑浊,达到等电点。 答: 2、在分离蛋白质的时候,等电点有何实际应用价值? 答: 在等电点时,蛋白质分子与分子间因碰撞而引起聚沉的倾向增加,所以处于等电点的蛋白质最容易沉淀。在分离蛋白质的时候,可以根据待分离的蛋白质的等电点,有目的地调节溶液的pH使该蛋白质沉淀下来,从而与其他处于溶液状态的杂质蛋白质分离。 实验七氨基酸的分离鉴定-纸层析法 1、如何用纸层析对氨基酸进行定性和定量的测定? 答: 将标准的已知氨基酸与待测的未知氨基酸在同一张层析纸上进行纸层析,显色后根据斑点的Rf值,就可以对氨基酸进行初步的定性,因为同一个物质在同一条件下有相同的Rf 值;将点样的未知氨基酸溶液和标准氨基酸溶液的体积恒定,根据显色后的氨基酸斑点的面积与点样的氨基酸质量成正比的原理,通过计算斑点的面积可以对氨基酸溶液进行定量测定。 3、纸层析、柱层析、薄层层析、高效液相层析各有什么特点? 答:生物化学实验练习题及参考答案[1]
生物化学复习题 (1)
生物化学试题及答案 .
生化实验思考题参考答案[1].