
生物化学第一章糖得化学
1.糖得概念及生物学作用
概念:由碳、氢、氧三种元素组成,就是多羟基醛或多羟基酮及其聚合物与衍生物得总称。
生物学作用:
1.就是人与动物得主要能源物质。淀粉、糖原、葡萄糖等
2.具有结构功能。纤维素、壳聚糖、粘多糖等
3.具有多方面得生物活性及功能。戊糖、FDP、香菇多糖、猪苓多糖、肝素等
2.糖得分类(单糖,寡糖,多糖)**掌握几种二糖中单糖成分,多糖种类
糖得分类(根据含糖单位得数目)
?单糖(monosaccharide):不能被水解成更小分子得糖。
?寡糖(oligosaccharide): 由单糖缩合而成得短链结构(含2~6个单糖)。
?多糖(polysaccharide):由许多单糖分子缩合而成得长链结构,分子量很大,均无甜味
也无还原性。
二糖:两分子单糖以糖苷键连接而成。
蔗糖(sucrose) G+F 麦芽糖(maltose)G+G 乳糖(lactose)G+Gal
多糖:复合糖。
3、多糖分类(来源分类)
1、植物多糖:水溶性多糖:(如当归、枸杞、大黄、艾叶等)多糖。
水不溶性多糖:淀粉、纤维素等
2、动物多糖:多为水溶性粘多糖。肝素、硫酸软骨素、透明质酸、猪胎盘脂多糖等
3、微生物多糖:香菇、茯苓、银耳等得多糖
4、海洋生物多糖:甲壳素、螺旋藻多糖等。
6、多糖提取方法分几类来进行?
第一类难溶于水,可溶于稀碱液。主要就是胶类,如木聚糖、半乳聚糖
第二类易溶于温水,难溶于冷水得多糖。
第三类黏多糖得提取(组织中黏多糖与蛋白质共价结合)
(1)碱液抽提法:(据糖肽键对碱不稳定) 软骨中提取软骨素即用此法。
(2)蛋白水解酶消化法:组织中释出粘多糖得方法(蛋白水解酶:木瓜蛋白酶及链霉蛋
白酶) 。
**7、多糖基本纯化方法有几种?原理?
1、分级沉淀法:乙醇分级沉淀分离各种硫酸软骨素。
2、季铵盐络合法:表面活化剂与粘多糖聚阴离子形成络合物,水不溶(低离子强度)。
3、离子交换层析:利用pH及盐浓度梯度分离各种多糖。
4、制备性区带电泳:利用分子大小、形状、电荷区分。
5、固定化凝集素得亲与层析法:特异结合单糖与寡糖(可逆);如刀豆凝集素ConA专一与
甘露糖基结合。
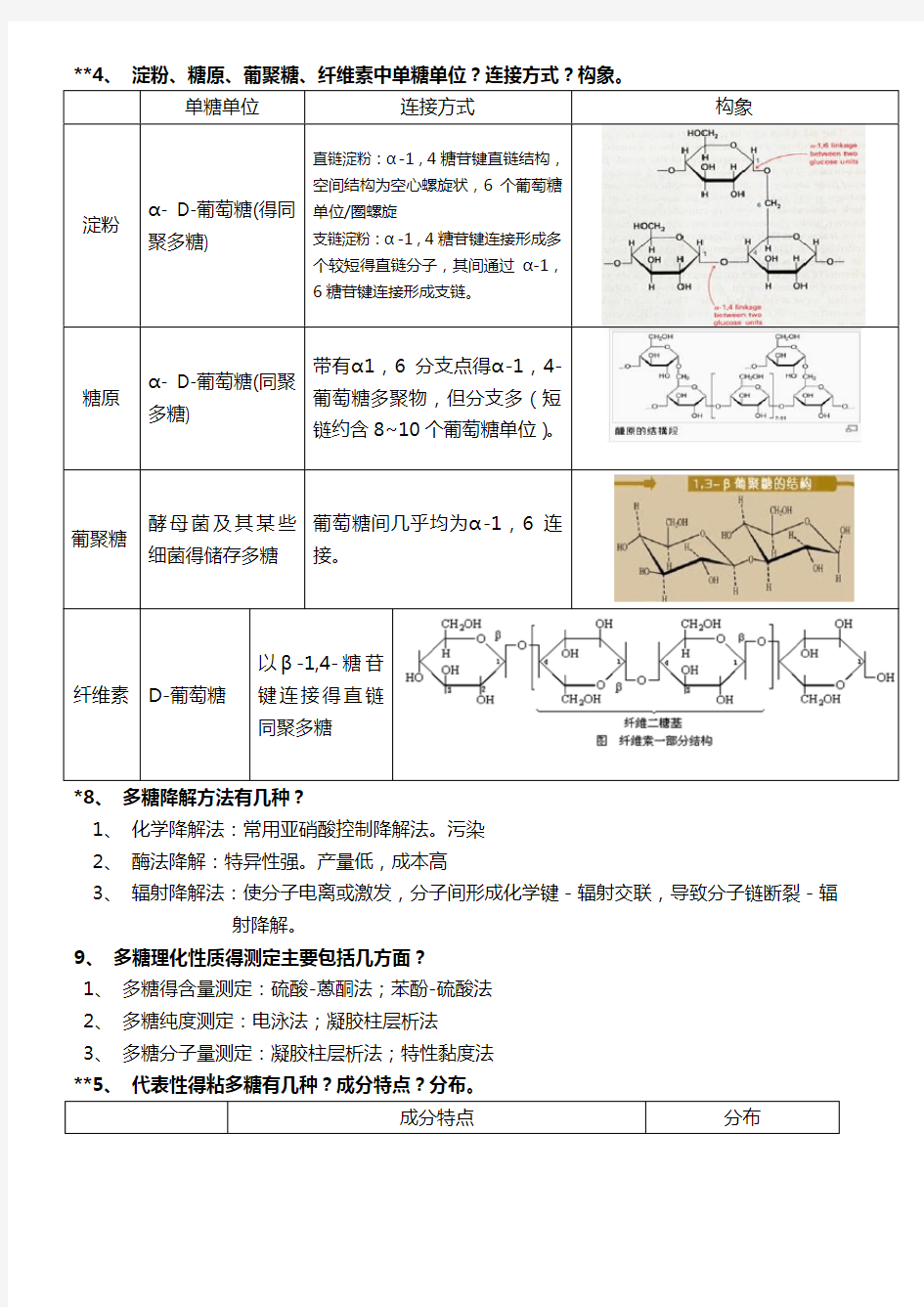
单糖单位连接方式构象
淀粉α- D-葡萄糖(得同
聚多糖)
直链淀粉:α-1,4糖苷键直链结构,
空间结构为空心螺旋状,6个葡萄糖
单位/圈螺旋
支链淀粉:α-1,4糖苷键连接形成多
个较短得直链分子,其间通过α-1,
6糖苷键连接形成支链。
糖原α- D-葡萄糖(同聚
多糖)
带有α1,6分支点得α-1,4-
葡萄糖多聚物,但分支多(短
链约含8~10个葡萄糖单位)。
葡聚糖酵母菌及其某些
细菌得储存多糖
葡萄糖间几乎均为α-1,6连
接。
纤维素D-葡萄糖以β-1,4-糖苷键连接得直链同聚多糖
1、化学降解法:常用亚硝酸控制降解法。污染
2、酶法降解:特异性强。产量低,成本高
3、辐射降解法:使分子电离或激发,分子间形成化学键-辐射交联,导致分子链断裂-辐
射降解。
9、多糖理化性质得测定主要包括几方面?
1、多糖得含量测定:硫酸-蒽酮法;苯酚-硫酸法
2、多糖纯度测定:电泳法;凝胶柱层析法
3、多糖分子量测定:凝胶柱层析法;特性黏度法
**5、代表性得粘多糖有几种?成分特点?分布。
成分特点分布
透明质酸hyaluronic acid D-葡萄糖醛酸与N-乙酰氨基葡萄糖交替组成线
性结构(以β1,3糖苷键连接成二糖单位,再以β1,4
糖苷键同另一二糖单位连接)
存在于动物得结缔组
织、眼球得玻璃体、
角膜、关节液中。
硫酸软骨素chondroitin sulfate 二糖得聚合物(ABC三种)
A:葡萄糖醛酸-1,3-N-乙酰氨基半乳糖-4-硫酸
酯
B:艾杜糖醛酸-1,3-N-乙酰氨基半乳糖-4-硫酸酯
C:葡萄糖醛酸-1,3-N-乙酰氨基半乳糖-6-硫酸酯
硫酸软骨素B-硫酸皮肤素(存在于皮肤得黏多糖)
体内最多得黏多糖,
为软骨主要成分。
肝素heparin 硫酸氨基葡萄糖,葡萄糖醛酸与艾杜糖醛酸得硫酸
酯。氨基葡萄糖苷为α型,糖醛酸糖苷为β型。肝
素中为四糖重复单位。
存在于肝、肺、血管
壁、肠粘膜中天然抗
凝血物质。
第二章脂类得化学
1、脂类概念及分类
概念:脂肪酸与醇所组成得酯类及其衍生物,低溶于水而高溶于有机溶剂(乙醚、氯仿、丙酮等),并能为机体利用得有机化合物。脂肪、类脂总称。
(一)单纯脂类simple lipid:脂肪酸与醇所形成得酯。
1、三酰甘油(中性脂):3 脂肪酸+ 1 甘油
2、蜡:长链脂肪酸与长链醇或固醇组成
(二)复合脂类compound lipid:除含有脂肪酸与醇外,尚有其它非脂成分
1、磷脂:非脂成分为磷酸与含氮碱。根据含醇不同,又分甘油磷脂与鞘氨醇磷脂(鞘磷脂)
2、糖脂:非脂成分就是糖。根据醇成分不同,又分为鞘糖脂与甘油糖脂
(三)衍生脂质derived lipid;单纯脂质与复合脂质衍生而来或与之关系密切,也具有脂质一般性质得物质
1、取代烃
2、固醇类
3、萜
4、其她脂质:维生素A、D、E、K,脂酰CoA,、脂蛋白、脂多糖等
分类:
可皂化脂质saponifiable lipid:能被碱水解而产生皂得。
不可皂化脂质unsaponifiable lipid:不被碱水解生成皂得。类固醇与萜就是两类主要得不可皂
化脂质。
非极性脂质
极性脂质
2.脂肪得基本结构
脂肪fat 得结构:甘油+三分子脂肪酸(多为偶数) -三脂酰甘油 triacyglycerol 3个R (烃基)可相同或不同,R2多为不饱与脂肪酸 R 相同为单纯甘油酯,不同则为混与酯 **3、 必需脂肪酸
必需脂肪酸:动物体内功能必需但自身不能合成,必需依靠食物供给得多不饱与脂肪酸。 亚油酸、亚麻酸、花生四烯酸
亚油酸、亚麻酸分别属于ω-6与ω-3家族,两者不能互变。 二十碳五烯酸(EPA ),二十二碳六烯酸(DHA )临床药用。 **4、 甘油磷脂通式及其各种甘油磷脂得基本组成
*5、 鞘磷脂结构特点(组成) *6、 糖脂分类及其结构特点
**7、 胆固醇与胆汁酸关系
胆汁酸就是肌体内胆固醇得主要代谢终产物。
1、胆汁酸为胆固醇代谢提供了一条重要得排泄途径。三分之一得胆固醇得分解代谢就是通过胆汁酸合成实现得。
2、吸收得胆汁酸对胆汁酸自身合成起负反馈调节作用,因而也对胆固醇得分解起负反馈调节 作用。
3、胆汁酸可促进胆汁中胆固醇得分泌,对保持胆固醇得溶解性具有重要作用。
4、胆汁酸可为肠道胆固醇得吸收所必须。
5、肝脏中胆固醇合成得调节与胆汁酸得肠肝循环密切相关。
6、胆汁酸可调节肠道胆固醇得合成。
8、 脂类提取、分离、分析基本原理及常用方法。
脂类混合物得分离就是根据它们得极性差别或在非极性溶剂中得溶解度差别进行得。 (一)脂类有机溶剂提取
提取物质:非极性脂类(三酰甘油、蜡与色素等) 溶剂:乙醚、氯仿、苯等。
在此溶剂中不会发生因疏水相互作用引起得脂类聚集 提取物质:膜脂(磷脂、糖脂、固醇等) 溶剂:极性有机溶剂(甲醇、乙醇等)。
此类溶剂既能降低脂类分子间得疏水相互作用,又能减弱膜脂与膜蛋白之间得氢键结合与静电相互作用;
(二)脂类得色谱分离
提取之脂类粗提物可用吸附色谱法分级分离。
鞘磷脂结构:为不含甘油得磷脂 鞘磷脂结构特征:
就是甘油醇磷脂得醇就是甘油醇,而神经醇磷脂得醇就是神经氨基醇,此外鞘磷脂中得脂
肪酸与神经氨基醇得氨基相连接,且分子中只含有一个脂肪酸。
原理:脂类通过分离介质时,因其极性得不同,导致与固定相吸附得能力出现差异,在流动相洗脱时移动速度不一而分离。
硅胶柱吸附层析:分非极性、极性、荷电
高效液相色谱
薄层层析等等
(三)脂类得组成与结构分析
混合脂肪酸得气液色谱(GLC)分析:分析分离混合物中挥发性成分。
脂类结构得测定:利用脂类对特异条件下得降解敏感。了解脂得结构。
如确定烃链长度与双键得位置,质谱分析有特效。
第三章维生素与微量元素
*1、Vit概念,分类及食物主要来源
概念:Vitamin就是机体维持正常生理功能所必需,但在体内不能合成或合成量很少,必须由食物供给得一组低分子量有机物质。
分类:脂溶性vit:vitA、D、E、K
水溶性vit:B族:vit B1、B2、B6、B12,vit PP,泛酸,叶酸,生物素等
vit C
主要来源:
维生素B2,核黄素酵母、肝脏、蔬菜、蛋类
维生素B1
酵母、谷物、肝脏、大豆、肉
类
*3、下列这些症状就是由哪些维生素缺乏所引起?
夜盲症Vit A 干眼病Vit A 佝偻病Vit D 软骨病Vit D 脚气病Vit B1 癞皮病Vit PP 巨幼红细胞贫血Vit B12/叶酸坏血病Vit C
Vit 缺乏症
Vit A:A1哺乳动物、咸水鱼肝脏;
A2淡水鱼;植物中为胡萝卜素干眼病、夜盲症;
过量致头痛、恶心腹泻、肝脾大、致畸
Vit D 活性形式:1,25-(OH)2-VD3 佝偻病;软骨病(成人)(使用vitD时应先补
充钙)
Vit E 动物流产,红细胞脆性增加、贫血等
Vit K 易出血
Vit B1 活性形式:TPP 脚气病
Vit B2 口角炎、唇炎、阴囊炎、眼睑炎
Vit PP 癞皮病
Vit C 牙周炎/创伤不愈合
泛酸少见,脚灼热综合征
生物素皮炎
叶酸巨幼红细胞性贫血
Vit B12 巨幼红细胞性贫血
B1:硫胺素(含硫得唑噻环与含氨基得嘧啶环组成),在生物体内常以硫胺素焦磷酸(thiamine pyrophosphate, TPP)得辅酶形式存在,就是涉及到糖代谢中羰基碳合成与裂解反应得辅酶。
B2:核黄素(核醇与7,8-二甲基异咯嗪得缩合物),在生物体内以黄素单核苷酸(flavin mononucleotide, FMN)与黄素腺嘌呤二核苷酸(flavin adenine dinucleotide, FAD)得
形式存在,就是一些氧化还原酶(黄素蛋白)得辅基。
B6:包括吡哆醇、吡哆醛与吡哆胺,皆属于吡啶衍生物。在体内以磷酸酯形式存在,磷酸吡哆醛与磷酸吡哆胺就是其活性形式,就是氨基酸代谢中多种酶得辅酶。
B12:氢钴胺素。在体内有两种辅酶形式,主要就是5'-脱氧腺苷钴胺素,少量得甲基钴胺素。参与分子重排、核苷酸还原与甲基转移。
PP:包括烟酸与烟酰胺,在体内烟酰胺与核糖、磷酸、腺嘌呤组成脱氢酶得辅酶(NAD+、NADP++)。泛酸:贝塔-丙氨酸通过肽键与阿尔法、伽玛-二羟基贝塔,贝塔-二甲基丁酸缩合而成。就是辅酶A与磷酸泛酰巯基乙胺得组成成分。coA。
叶酸:蝶酰谷氨酸。由2-氨基-4-羟基-6-甲基喋啶、对氨基苯甲酸与L-谷氨酸组成。四氢叶酸就是其活性辅酶形式,称coF,就是碳原子一碳单位得重要受体与供体。
5.铁体内吸收形式及运输形式?**在体内参与哪些化合物组成?
Fe2+吸收(十二指肠及空肠上端)络合铁易吸收
Fe3+与Tf结合运输
Hb/Mb/Cyt系统/呼吸链/过氧化物(氢)酶得组成
*6、碘在体内主要作用?**缺乏导致什么疾病?过多呢?
作用:參與甲狀腺素得形成
缺乏:地方性甲状腺肿、发育停滞、痴呆、呆小病(胎兒期缺碘)
过量:高碘性甲状腺肿
第四章蛋白质得化学
*1、组成Pr得20
种氨基酸得名称、结构通式及结构特点、分类及分类依据。
*2、Pr得一、二、三、四级结构得概念及相应得维持力
蛋白质得一级结构:
就是指由不同种类、数量得氨基酸,通过肽键而构成得氨基酸排列顺序。为蛋白质结构与功能得基础。
稳定力量--肽键, 二硫键
蛋白质得二级结构:
多肽链中主链骨架中若干肽单位,各自沿一定得轴盘旋或折叠,并以氢键为主要得次级键而形成得有规则得构象。
稳定力量:氢键形式:α-螺旋、β-折叠、β-拐角、无规卷曲
蛋白质得三级结构:
一条多肽链中所有原子或基团在三维空间得整体排布。
稳定三级结构得次级键:疏水键、氢键、盐键等
蛋白质得四级结构:
由两个或两个以上得亚基之间相互作用,彼此以非共价键相连而形成更复杂得构象。
亚基间结合力:疏水键、盐键、氢键、范德华力、二硫键
*5、简述蛋白质一级结构与功能得关系?
蛋白质得一级结构决定了空间构象,空间构象决定了蛋白质得生物学功能。
1、一级结构不同,生物学功能各异
不同Pr结构间仅有微小得差别就可表现出不同得生物学功能。
2、一级结构中“关键”部分相同,其功能也相同;关键部分变化,其生物活性也改变。其活
性仅需所必需得关键部分。
3、一级结构得变化与疾病得关系
基因突变可以导致Pr一级结构得改变,使Pr得生物学功能降低或丧失,甚至可引起生理功能得改变而发生疾病。(分子病)
3、简述Pr二级结构得几种形式及结构特点。
形式:α-螺旋、β-折叠、β-折角、无规卷曲
1、α-螺旋(α-helix)
Pr中多个肽平面通过AA- α碳原子得旋转,多肽链得主骨架沿中性轴盘曲成稳定得α-螺旋
构象。
结构特征:
(1)右手螺旋,每3、6个AA旋转一周,螺距为0、54nm,肽平面与螺旋长轴平行。
(2)氢键为主要次级键
相邻(1-4)肽平面上得N-H与C=O生成氢键
(3)AA残基得R基团分布在螺旋外侧
R基团影响螺旋稳定性:酸(碱)性AA连续,或较大得R基团,N原子无H游离(脯)均不能形成螺旋。
2、β-折叠
又称β-片层
结构特征:
(1)肽链得伸展使肽键平面之间折叠成锯齿状。
(2)肽链平行排列,相邻肽链之间得肽键交替形成氢键,维持构象主要次级键。
(3)肽链平行走向有顺式与反式两种,N端同侧为顺式,不在同侧为反式。
(4)AA残基得R基团在片层得上下。
3、β-折角
又称β-转角
结构特点:
(1)伸展得肽链形成180°回折-U型转折结构。
(2)由连续得四个AA残基构成。
(3)第一个AA残基得=O与第四个AA残基得N-H形成氢键。这一段结构往往第二个AA 残基为Pro(亚氨酸)。
4、无规线团(random coil)
又称无规卷曲
结构特点:除上述构象外得不规则构象(自由折叠或无规线团)。
*8、请列出4种蛋白质分离纯化常用得方法并说明其原理。
(一)根据溶解度不同得方法
1、等电点沉淀法;
2、盐析沉淀法;
3、低温有机溶剂沉淀法
(二)根据分子量大小分离纯化方法
1、透析与超滤法;
2、分子排阻层析:凝胶过滤;
3、密度梯度离心
原理书p95
4、名词解释
肽键(peptide bond):又称酰胺键“-CO-NH”,由一分子AA得α羧基与另一AA得α氨
基缩合脱水而成
?肽单位peptide unit:肽键与相邻得两个α-碳原子所组成得基团(形成构象)
?超二级结构:又称基序,模体或模序(motif),在多肽链内顺序上相邻得二级结构常常在空间
折叠中靠近,彼此相互作用,形成有规则得二级结构聚集体。如:αα、βββ、βαβ等。
?结构域domain:就是位于超二级结构与三级结构间得一个层次。在较大得蛋白质分子中,多
肽链上相邻得超二级结构紧密联系,进一步折叠形成一个或多个相对独立得致密三维实体。
?亚基(又称亚单位,subunit):有些蛋白质就是由两条或两条以上得多肽链组成得,这种蛋
白质得每条多肽链被称为一个亚基。(寡聚体oligomer:2~10个亚基组成得具有四级结构得Pr。更多得亚基数目则称多聚体(polymer))
?分子病:由遗传突变引起得,使蛋白质得一级结构发生改变而导致得疾病。
?蛋白构象疾病:多肽链折叠发生错误,尽管其一级结构不变,其构象发生改变,仍可影响其功
能,严重时可导致疾病。因蛋白质折叠错误或折叠导致构象异常变化引起得疾病,称蛋白构象疾病(protein conformation disease),如人纹状体脊髓变性病,老年痴呆症,亨丁顿舞蹈病与疯牛病。
?蛋白质得变性作用:(denaturation)物理与化学得因素使蛋白质得空间结构发生改变或破坏,
导致其生物学活性丧失,理化性质改变得现象。
?蛋白质得等电点:Pr在溶液中带电荷得状态主要取决于溶液得pH。当溶液得pH使蛋白质
所带得正负电荷相等,净电荷为零时溶液得pH即为pI。
?Pr得变构现象:一些Pr受某些因素影响,一级结构不变而空间构象变化,导致生物学功能得
改变--称Pr得变构效应(allosteric effect)或别构作用。
*6、蛋白质空间结构与功能得关系?
1、Pr前体得活化
一些蛋白质以无活性得蛋白质原得前体形式分泌合成。经活化后(如酶解部分片段),使活性升高或具有活性。实质就是:特定空间构象得形成。
2、Pr得变构现象
一些Pr受某些因素影响,一级结构不变而空间构象变化,导致生物学功能得改变,称Pr 变构效应或别构作用。酶得变构调节,Hb运输O2。
3、蛋白质构象改变与疾病
多肽链得正确折叠对蛋白质正确构象得形成与功能发挥至关重要。因蛋白质折叠错误或折叠导致构象异常变化引起得疾病,称蛋白构象疾病(protein conformation disease)。
7、蛋白质分子量测定常用方法有哪些并说明原理?
1、分子筛层析法:
Pr混合物通过一定大小得凝胶介质,大、小分子流程不同而分离。洗脱体积就是分子量对数
得线性函数。以标准Pr对照,可求出分子量。
2、SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)
SDS含丰富得负电荷,与Pr形成复合物后,不同得Pr带有相同得电荷,消除电荷差异使
电泳行为只受分子量大小得影响。
3、生物质谱
测定分子质量与相对应离子电荷,获得样品得分子量、分子式、分子中放射性核素构成与分
子结构。
9、了解蛋白质纯度鉴定与含量测定得方法。
(一)Pr得纯度鉴定
1、层析法;
2、电泳法;
3、免疫化学法
(二)Pr 含量测定
1、克氏定氮法
2、福林-酚试剂法:Pr中Tyr,Trp可与酚试剂(磷钨酸磷钼酸试剂)生成蓝色化合物。
3、双缩脲法:Pr在碱性溶液中可与Cu++产生紫红色反应(Cu++与肽键上N形成配位复合物)。
4、紫外分光光度法:芳香族AA在280nm有特异吸收峰。
5、BCA比色法
6、Bradford蛋白分析法
第五章核酸得化学
1、单核苷酸得组成成分,及其各成分之间得连接方式
单核苷酸:核酸得基本结构单位,可分解成核苷与磷酸。
核苷与磷酸通过酯键结合构成核苷酸。
核糖核苷酸脱氧核糖核苷酸。
戊糖与碱基通过糖苷键(C-N)缩合而成,均为β-糖苷
键
2、真核生物DNA与原核生物DNA得一级结构分别有哪些特点?
(1)真核生物染色质由DNA 、组蛋白、非组蛋白、RNA组成。
特点:①重复顺序:其DNA具有重复排列得核苷酸序列
重复得程度分:高度重复序列(106-7);中度重复序列(102-3);
单拷贝(往往为一个Pr得结构基因)。
②间隔序列与插入序列
间隔序列:基因与基因之间得非编码序列。
插入序列:基因内得非编码序列
DNA中编码蛋白质或RNA得序列--外显子exon
编码序列之间存在一些非编码区--内含子intron
③回文结构:真核细胞DNA中存在特殊得序列。
碱基排列在两条DNA链中顺读与倒读意义一样,(轴转180°两部分可完全相同)
得结构。
(2)原核生物DNA
特点:①基因重叠:即在同一DNA序列中常常包括不同得基因区,重叠在一起得基因编码
组序不同,而翻译出不同蛋白质。
②DNA序列每转录出得一段mRNA,常包含多个顺反子(表达多个功能相关得蛋白
质)。
③结构基因就是连续得(即无内含子存在)。
3、DNA 双螺旋结构模型要点有哪些?
Watson-Crick模型(双螺旋结构)(1953)要点:
1、DNA分子由两条多核苷酸链构成,反向平行(一条3’到5’;另一条5’到3’)。为双螺旋结构,右手螺旋。螺旋形成一大沟一小沟。
2、磷酸基与脱氧核糖在外侧,彼此以磷酸二酯键连接,形成DNA骨架;内侧为碱基;糖环平面与碱基平面相互垂直;
3、双螺旋直径为2nm。每隔0、34nm有一个核苷酸。10对核苷酸/圈螺旋,高度为3、4nm。
4、两条链碱基间以氢键连接,A:T(两个氢键),C:G(三个氢键)碱基互补。
5、双螺旋表面由大小沟,对DNA与蛋白质识别重要。
4、DNA分子一级、二级、三级结构概念(注意原核与真核生物得相似与区别)
?DNA得一级结构:
指多核苷酸链中从5’末端到3’末端核苷酸得排列顺序--核苷酸序列,又称碱基序列。(主要差异为碱基)
?DNA得二级结构:
Watson-Crick模型(双螺旋结构)稳定因素:互补碱基间得氢键;
碱基堆积力(最重要):磷酸基负电荷与介质正电荷之间形成离子键。
?DNA得三级结构:
在双螺旋基础上进一步盘绕扭曲构成。超螺旋为其中一种形式,环状DNA为此构型,可压缩成很小体积。(大肠杆菌DNA)
6、核酸得理化性质包含哪几个方面?
1、分子大小
2、核酸得溶解度与粘度
核酸为极性化合物,微溶于水,钠盐易溶一些。不溶于乙醇、乙醚、氯仿等有机溶剂。
3、核酸得酸碱性质
核酸中磷酸基pK值低,所以核酸作为多元酸,具较强酸性。
碱基得解离与环境pH有关,DNA在pH4、0~11、0最稳定。
4、核酸得紫外吸收
嘌呤、嘧啶具有强烈得紫外吸收,所以核酸有紫外吸收,260nm处最大吸收值。可进行核酸定量测定。
增色效应:核酸变性时,紫外吸收增加得现象。
减色效应:核酸复性时,紫外吸收减少得现象。
5、参与Pr生物合成得三种RNA(tRNA、rRNA、mRNA)细胞含量、分子大小、稳定性、结构特点。
tRNA结构-----最小得一类RNA,由几十个碱基组成。占总RNA 15%
1、一级结构:70个左右核苷酸组成,较多稀有碱基
2、二级结构:三叶草式结构;3’端-CCA-OH(AA臂…);DHU环;反密码环;
额外环;TΨC环
3、三级结构:倒“L”型
mRNA结构-----分子量大小不一
1、多数真核生物3’末端有200个左右得腺苷酸尾巴(polyA尾)
2、真核生物mRNA得5’端有7-甲基鸟嘌呤核苷三磷酸得帽子(真核)
3、mRNA分子中有编码区与非编码区
4、每分子mRNA可同时结合几十个核糖体(多核糖体)
rRNA得结构-----分子大小不一,多个局部存在茎环结构(局部配对造成)
1、真核细胞得rRNA有5S,5、8S,18S,28S四种,与蛋白质结合存在于核糖体得大小亚基中。
5SRNA与tRNA结构类似
2、其她RNA及病毒RNA由部分双螺旋及部分突环相间排列
7、核酸变性、核酸复性、核酸杂交Tm值(溶解温度)
(一)变性
理化因素使核酸分子得空间结构改变,引起核酸理化性质、生物学功能改变得现象,变性时核酸双链解开,但一级结构未破坏。
理化因素:加热、过高过低得pH,有机溶剂、酰胺、尿素等
热变性:加热引起DNA得变性。其过程为“跃变”过程
(二)复性renaturation
变性得DNA在适当条件下,可使两条彼此分开得链重新由氢键连接而形成双链得过程。(三)核酸得杂交hybridization
将来源不同得DNA经热变性,冷却,使其复性,在复性时,异源DNA之间在某些区域有相同得序列会形成杂交DNA分子。
第六章酶
1、何谓酶得专一性?分几类?
2、酶分类得根据?分几类?
3、B族
Vit辅酶形
式就是什
么?一般
有何作
用?
4、何谓酶活性中心?酶得必需基团有几种,
各有什么作用?
5、写出米氏方程,简述Km与Vm得意义,如何测定?
6、何谓酶得抑制作用?抑制剂分类?
7、何谓竞争性抑制,请用竞争性抑制得原理解释磺胺类药物抑菌得机制。
8
、三种可逆抑制作用得概念与特点(Km,Vm得变化)
、
第七章激素及其作用机制(细胞信号转导)
1、激素得脱敏作用
激素长时间作用于靶细胞时,靶细胞会产生一种降低其自身对激素应答强度得倾向,此现象--激素得脱敏作用。
2、为什么吃海带可防止粗脖根?
单纯性甲状腺肿。原因:缺碘,药物影响,先天性激素合成障碍。治疗:补碘(碘盐,海带,紫菜等)。
海带内含有人体所需要得微量元素碘,当人体碘缺乏时,甲状腺代偿性增生,形成大脖子-碘缺乏病、3、肾上腺素、肾上腺皮质激素(主要就是糖皮质激素)、胰岛素与胰高血糖素得生理作用
磺胺类药物得作用机理就就是竞争性抑制
肾上腺素: 血糖↑,血压↑
①主要促使肝糖原分解,使血糖增加。
②肾上腺素可使血管收缩;并能刺激心脏,使心肌收缩力增加,心跳加快,所以使血压升高。(对心脏作用大)
肾上腺皮质激素:
(1)糖皮质激素
①调节糖代谢,抑制糖得氧化,促使蛋白质转化为糖,升高血糖。
②可减轻过敏反应,减轻炎症。
(2)盐皮质激素
①促使体内保留钠,排出钾(保钠排钾),调节水盐代谢。
胰岛素:
①促进糖原得生物合成以及葡萄糖得氧化,降低血糖。
②促进蛋白质及脂类得合成代谢。
胰高血糖素:
①在许多方面与胰岛素相反。主要促使肝糖原分解,使血糖↑
5、信号转导信息分子
信号转导:信号分子与受体(膜或胞内)特异结合,将信号转换后,传给相应得细胞内反应系统,使细胞对外界信号作出适当反应,其过程称信号转导。
信号分子:由细胞分泌得调节靶细胞生命活动得化学物质。
作为信号在细胞间传递信息--第一信使
6、受体receptor及其分类
受体:细胞(膜上或胞内)识别信息分子并与之结合,能激发靶细胞产生特异生物效应得特殊蛋白质分子。
(本质-----糖蛋白,脂蛋白Mw15-40万之间(存在
于膜得受体均为跨膜蛋白))
8、肾上腺素、胰高血糖素在体内对糖
代谢得信号调节作用
肾上腺素:
①肾上腺素主要促使肝糖原分解,使
血糖增加。
②肾上腺素可使血管收缩;并能刺激心脏,使心肌收缩力增加,心跳加快,所以使血压升高。(对心脏作用大)
胰高血糖素:
促进糖原分解、糖异生,抑制糖酵解、有氧氧化。
在许多方面与胰岛素相反。主要促使肝糖原分解,使血糖↑。
7、G蛋白偶联受体得信号转导途径
信号转导途径:cAMP-蛋白激酶A(PKA)通路(G蛋白AC cAMP PKA)、
肌醇--磷脂系统
1、cAMP-蛋白激酶A(PKA)通路(就是激素调节物质代谢得主要途径之一)
以靶细胞内蛋白激酶A(protein kinase A, PKA)得激活为主要特征。
逆结合得膜蛋白。
AC作用:除成熟RBC,广泛存在于细胞质膜,正常细胞内cAMP浓度为10-6mol/L。
为胰岛素抑制。
PKA作用:PKA激活后使靶蛋白得特异得Ser/Thr磷酸化,调节靶蛋白得活性。
书p190
2、肌醇--磷脂系统
9、
酪氨
酸蛋
白激
酶(PTK)得分类protein tyrosine kinase
酪氨酸蛋白激酶PTK-----受体酪氨酸激酶PTK、非受体酪氨酸蛋白激酶
根据PTK就是否存在于细胞膜受体可将其分成非受体型与膜受体型。
1、非受体型:以src基因产物为代表,此外还有Yes、Fyn、Lck、Fgr、Lyn、Fps/Fes及Ab1等。
2、膜受体型:根据它们得结构不同,受体型酪氨酸激酶可以分为9种类型。
(1)表皮生长因子受体(EGFR)家族:EGF-R家族成员包括EGF-R、erbB2/neu 及erbB-3基因表达产物。
(2)胰岛素受体家族:胰岛素受体(insulin receptor,IR)、胰岛素样生长因子-1受体(insulin-like growth factor-1 receptor,IGF-1R)以及胰岛素相关受体(insulin related
receptor,IRR)。
(3)PDGF/MCSF/SCF受体家族:包括血小板衍生得生长因子α受体(PDGF-αR)、
PDGF-βR、巨噬细胞集落刺激因子受体(M-CSFR)以及干
细胞生长因子受体(SCFR)。
(4)成纤维细胞生长因子受体(FGFR)家族:FGFR家族成员有FGFR1、FGFR2、FGFR3以
及FGF4。
第八章生物氧化
1、什么就是生物氧化,生物氧化得特点有哪些?
生物氧化biological oxidation:物质在生物体内得氧化分解。它主要就是指糖、脂肪及蛋白质等在
体内氧化分解,最终生成二氧化碳与水,并释放出能量得过程。
生物氧化得特点:
①在细胞内进行,就是在体温、近中性pH与有水得温与环境中,在一系列酶、辅酶与传递体
得作用下逐步进行得。
②产生得能量就是逐步释放出来得。
③体内CO2得生成方式--有机酸脱羧,水得生成--由底物脱氢,经氢或电子传递,最终与氧结
合生成水。
④氧化速率受体内多种因素得影响与调节。
3、电子传递体得种类、特点
电子传递体:传递电子得酶或辅酶
2、名词解释:
高能化合物:
指体内氧化分解中,一些化合物通过能量转移得到了部分能量,把这类储存了较高能量得化合物,如三磷酸腺苷(ATP),称为高能化合物·它们就是生物释放,储存与利用能量得媒介,就是生物界直接得供能物质。
呼吸链(respiratory chain):
该体系进行得一系列连锁反应就是与细胞摄取氧得呼吸过程相关,故又称为呼吸链。
电子传递链(electron transfer chain):
递氢体与电子传递体按一定得顺序排列在线粒体内膜上,组成递氢或递电子体系。
氧化磷酸化:
在呼吸链电子传递过程中偶联ADP磷酸化,生成ATP,因此又称为偶联磷酸化。
底物水平磷酸化(substrate level phosphorylation):
底物分子内部能量重新分布形成高能磷酸键并伴有ADP磷酸化生成ATP得作用之一。(与呼吸链得电子传递无关)
P/O比值:
就是指物质氧化时,每消耗1摩尔氧原子所消耗得无机磷得摩尔数(或ADP摩尔数),即生成ATP 得摩尔数。
经NADH电子传递链氧化产生3ATP 经琥珀酸电子传递链氧化产生2ATP