
陸、多電子原子 6.1 氦原子 6.1.1 氦原子初探 氦原子是氦核與兩電子合成的系統。 122121V V V K K K H n ++++++=. 作近似(設核不動) ,? ()()1221122211V H H V V K V K H ++≡++++=,1H 與2H 為 第一電子與第二電子個別與核組成單電子原子的能量泛函。過渡到量子力學, ?i i e i r e m H 0222422?πε-?-= (i =1, 2),12 201241r e V πε=。 先暫不考慮12V ? 210H H H +=,0?H 的本徵函為)()(),(221121r r r r ψψψ=, 本徵值為 ???? ??+-=???? ??+-=+=2221 222212210114.54226.13n n eV n n eV E E E . ? 基態:-108.8 eV ,第一激發態:-68.0 eV 。 ?「第一電離能」first ionization energy (-++→+e He e i He ..)()4.548.1084.54=---=eV . 但實驗發現:1. 氦的電離能為24.6 eV ? 基態能階為-79.0 eV 。2. 據光譜線分析,第一、二激發態各包含一「獨態」(singlet )與一「三重態」(triplet )。 6.1.2 交換對稱(exchange symmetry ) 電子為不合群粒子 ? ()()1,22,1ψψ-= ──交換反對稱。 上章說過,原子裡電子的態幅包含位宇態幅及儀態幅: ()()()()i i m l n i b r i r i i l i i i ↑≡= ψχψψ或()()i i m l n r i i l i i ↓= ψψ, i =1, 2。 ? 設21b b =,例如s 1,()()()( )2 1 21211112 12,12↑↓-↓↑=r r s s s ψψψ 設21b b ≠,例如s b 11=,s b 22=,()2,121s s ψ可有兩類情形: singlet 獨態(space symmetric, spin anti-symmetric ): ()()()()()( )2 121211222112 121↑↓-↓↑+r r r r s s s s ψψψψ triplet 三重態(space anti-symmetric, spin symmetric ): ()()()()()21211222112 1↑↑-r r r r s s s s ψψψψ ()()()()()( )2 121211222112 121↑↓+↓↑-r r r r s s s s ψψψψ r 12
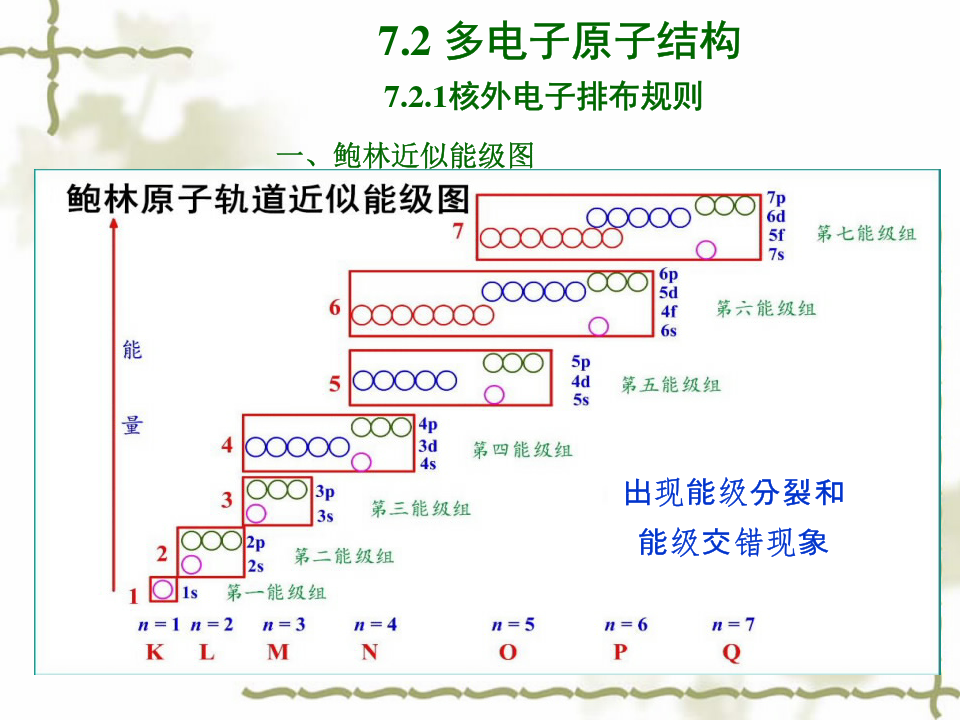
第三节多电子原子的原子结构 外层只有一个电子时,由于该电子仅受到核的吸引如氢原子或类氢原子,可以精确求解出波函数。但多电子原子核外有2个以上的电子,电子除受核的作用外,还受到其他电子对它的排斥作用,情况要复杂得多,只能作近似处理。但上述氢原子结构的某些结论还可用到多电子原子结构中: 在多电子原子中,每个电子都各有其波函数ψi,其具体形式也取决一组量子数n、l、m。多电子原子中的电子在各电子层中可能占据的轨道数,与氢原子中各电子层轨道数相等。 多电子原子中每个电子的波函数的角度部分Y(θ,φ)和氢原子Y(θ,φ)相似,所以多电子原子的各个原子轨道角度分布图与氢原子的各个原子轨道的角度分布图相似。同理两者的Y 2图也相似。 处理多电子原子问题时,认为其他电子对某个电子i的排斥,相当于其他电子屏蔽住原子核,抵消了一部分核电荷对电子i的吸引力,称为其他电子对电子i的屏蔽作用(screening effect),引进屏蔽常数σ(screening constant)表示其他电子所抵消掉的核电荷。这样多电子原子中电子i的能量公式可表示为 式中(Z –σ)= Z′称为有效核电荷(effective nuclear charge)。多电子原子电子的能量和Z、n、σ有关。Z愈大,相同轨道的能量愈低,如基态氟原子1s电子的能量比基态氢原子1s电子的能量低;n愈大,能量愈高;起屏蔽作用的电子愈多,总的屏蔽作用愈强。σ愈大,能量愈高。影响σ有以下因素: 1. 外层电子对内层电子的屏蔽作用可以不考虑,σ=0; 2. 内层 (n-1层)电子对最外层(n层)电子的屏蔽作用较强,σ=,离核更近的内层(n-2层)电子对最外层电子的屏蔽作用更强,σ=; 3. 同层电子之间也有屏蔽作用,但比内层电子的屏蔽作用弱,σ=,1s之间σ=。n相同l 不同时,l愈小的电子,它本身的钻穿能力愈强,离核愈近,它受到其他电子对它的屏蔽作用就愈弱,能量就愈低E n s <E n p <E n d <E n f。 氢原子只有1个电子,无屏蔽作用,其激发态能量与l无关。 4. l相同,n不同时,n愈大的电子受到的屏蔽作用愈强,能量愈高: E n s <E(n+1)s <E(n+2)s <… E n p <E(n+1)p <E(n+2)p <… 5. n 、l都不同时,情况较复杂。比如3d和4s,会出现n小的反而能量高的现象,E4s<E3d,称为能级交错。 美国科学家鲍林(Pauling L C)根据大量的光谱数据计算出多电子原子的原子轨道的近似能级顺序,如下图
第五章多电子原子 一、学习要点 1.氦原子和碱土金属原子: (1)氦原子光谱和能级(正氦(三重态)、仲氦(单态))(2)镁原子光谱和能级 2.重点掌握L-S耦合,了解j-j耦合 3.洪特定则、朗德间隔定则、泡利不相容原理; 4.两个价电子原子的电偶极辐射跃迁选择定则; 5.复杂原子光谱的一般规律:位移律、交替律、三个电子的角动量耦合、普用选择定则(电子组态的跃迁选择定则,又称宇称跃迁选择定则,或拉波特定则;L-S耦合选择定则等) 6.氦氖激光器 二、基本练习 1.褚书P168-169习题1. 2. 3. 4.6.7. 2.选择题 (1)关于氦原子光谱下列说法错误的是: A.第一激发态不能自发的跃迁到基态; B.1s2p 3P2,1,0能级是正常顺序; C.基态与第一激发态能量相差很大; D.三重态与单态之间没有跃迁 (2)氦原子由状态1s2p 3P2,1,0向1s2s 3S1跃迁,可产生的谱线条数为: A.0; B.2; C.3; D.1 (3)氦原子由状态1s3d 3D3,2,1向1s2p3P2,1,0跃迁时可产生的谱线条数为: A.3; B.4; C.6; D.5 (4)氦原子有单态和三重态两套能级,从而它们产生的光谱特点是: A.单能级各线系皆为单线,三重能级各线皆为三线; B.单重能级各线系皆为双线,三重能级各线系皆为三线; C.单重能级各线系皆为单线,三重能级各线系皆为双线; D.单重能级各线系皆为单线,三重能级各线系较为复杂,不一定是三线. (5)下列原子状态中哪一个是氦原子的基态? A.1P1; B.3P1 ; C.3S1; D.1S0; (6)氦原子的电子组态为n1pn2s,则可能的原子态: A.由于n不确定不能给出确定的J值,不能决定原子态; B.为n1pn2s 3D2,1,0和n1pn2s 1D1; C.由于违背泡利原理只存单态不存在三重态; D.为n1pn2s 3P2,1,0和n1pn2s 1P1. (7)C++离子由2s3p 3P2,1,0到2s3s 3S1两能级的跃迁,可产生几条光谱线? A.6条;B.3条;C.2条;D.1条. (8)氦原子有单态和三重态,但1s1s3S1并不存在,其原因是: A.因为自旋为1/2,l1=l2=0 故J=1/2 ; B.泡利不相容原理限制了1s1s3S1的存在; C..因为三重态能量最低的是1s2s3S1; D.因为1s1s3S1和1s2s3S1是简并态 (9)泡利不相容原理说: A.自旋为整数的粒子不能处于同一量子态中; B.自旋为整数的粒子能处于同一量子态中; C.自旋为半整数的粒子能处于同一量子态中; D.自旋为半整数的粒子不能处于同一量子态中. (10)若某原子的两个价电子处于2s2p组态,利用L-S耦合可得到其原子态的个数是:
第五章 多电子原子 5.1 e H 原子的两个电子处在2p3d 电子组态。问可能组成哪几种原子态?用原子态的符号表示之。已知电子间是LS 耦合。 解:因为2 1,2,12121====s s l l , 1 ,2,3;1,0,,1,; 2121212121==∴-?-++=-+=L S l l l l l l L s s s s S ,或 所以可以有如下12个组态: 4 ,3,23313,2,13212,1,0311,1,3,0,3,1,2,0,2,1,1,0,1F S L F S L D S L D S L P S L P S L ============ 5.2 已知e H 原子的两个电子被分别激发到2p 和3d 轨道,器所构成的原子态为D 3,问这两电子的轨道角动量21l l p p 与之间的夹角,自旋角动量21s s p p 与之间的夹角分别为多少? 解:(1)已知原子态为D 3,电子组态为2p3d 2,1,1,221====∴l l S L 因此,
' 212 22 12 212 22 12 222111461063 212/)(cos cos 26)1(6)1(22)1(οθθθπ =- =--=∴++==+==+==+=L l l l l L L L l l l l L L l l p p p p P p p p p P L L P l l p h l l p (2) 1212122S s s p p P ==∴===== 而 ' 212 22 12 212 22 12 32703 12/)(cos cos 2οθθθ== --=∴++=S s s s s S s s s s s s S p p p p P p p p p P 5.3 锌原子(Z=30)的最外层电子有两个,基态时的组态是4s4s 。当其中有一个被激发,考虑两种情况:(1)那电子被激发到5s 态;(2)它被激发到4p 态。试求出LS 耦合情况下这两种电子组态分别组成的原子状态。画出相应的能级图。从(1)和(2)情况形成的激发态向低能级跃迁分别发生几种光谱跃迁? 解:(1)组态为4s5s 时 2 1,02121====s s l l , 1 301,1;1,001 ,0,0S J S S L J S S L 三重态时单重态时,=======∴ 根据洪特定则可画出相应的能级图,有选择定则能够判断出能级间可以发生的5种跃迁:
第五章 多电子原子 1 分别按LS 耦合和jj 耦合写出 pd 电子组态可以构成的原子态 解答: p 电子的轨道角动量和自旋角动量量子数 l 1 = 1 s 1 =1/ 2 d 电子的轨道角动量和自旋角动量量子数l 2 = 2 s 2 = 1/2 (1) LS 耦合情况: 总轨道角动量量子数 L = l 1 + l 2;l 1 + l 2 ? 1;…… | l 1 ? l 2| = 3,2,1 总自旋角动量量子数 S = s 1 + s 2;s 1 + s 2 ? 1;…… |s 1 ? s 2| = 1,0 总角动量量子数 J = L + S ,L + S ? 1,…… |L ?S| 可耦合出的原子态2S+1L J 有:3F 4,3,2、3D 3,2,1、3P 2,1,0、1F 3、1D 2、1P 1 (2) jj 耦合情况: p 电子的总角动量量子数 j 1 = l 1 + s 1,l 1 + s 1 ? 1,……,| l 1 ? s 1| = 3/2,1/2 d 电子的总角动量量子数 j 2 = l 2 + s 2,l 2 + s 2 ? 1,……,| l 2 ? s 2| = 5/2,3/2 总角动量量子数 J = j 1 + j 2,j 1 + j 2 ? 1,…… | j 1 ? j 2| 可耦合出的原子态 (j 1, j 2)J 有 (3/2, 5/2)4,3,2,1 、(3/2, 3/2)3,2,1,0 、(1/2, 5/2)3,2 、(1/2, 3/2)2,1 2 求4I 15/2 态的总角动量、总轨道角动量、总自旋角动量,并求总轨道角动量与总总角动量之间的夹角。 解答:由题中原子态符号可知: 总自旋角动量量子数 S 满足 2S+1 = 4,即 S = 3/2 总轨道角动量量子数 L = 6 总角动量量子数 J = 15/2 总自旋角动量:P S = )1(+S S ? = 2 15 总轨道角动量:P L = 42)1(=+L L 总角动量:P J = 2 255 )1(= +J J 三个角动量满足三角关系。 ),cos(22 22J L J L J L S P P P P P P P ???-+= 代入各角动量数值后计算得 cos (P L , P J ) = 9856.010710 102= 所以夹角为 arc cos (0.9856) = 9.7 ? 3 写出 15P 、16S 、17Cl 、18Ar 的基态 电子组态, 并确定基态原子态。 解答:各元素基态电子组态如下 15P :1s 22s 22p 63s 23p 3 16S :1s 22s 22p 63s 23p 4 17Cl :1s 22s 22p 63s 2 3p5 18Ar :1s 22s 22p 63s 23p 6 根据轨道方框图法直接确定各元素的基态原子态。轨道填充规则为:(1)尽量使各电子自旋
第五章 多电子原子 一、选择题 1.关于氦原子光谱,下列说法错误的是: A. 第一激发态不能自发地跃迁到基态 B. 1s2p 3P 2,1,0 能级是正常顺序 C. 基态与激发态能量相差很大 D. 三重态与单态之间没有跃迁 2.对氦原子由状态1s2p 3P 2,1,0 向1s2s 3S 1跃迁可产生的谱线条数为: A. 0 B. 2 C. 3 D. 1 3.对氦原子由状态1s3d 3D 3,2,1 向1s2p 3P 2,1,0 跃迁可产生的谱线条数为: A. 3 B. 4 C. 6 D. 1 4. 氦原子有单重和三重两套能级,从而它们产生的光谱特点是: A. 单重能级各线系皆为单线,三重能级各线系皆为三线; B. 单重能级各线系皆为双线,三重能级各线系皆为三线; C. 单重能级各线系皆为单线,三重能级各线系皆为双线; D. 单重能级各线系皆为单线,三重能级各线系比较复杂,不一定为三线; 5.下列原子状态哪一个是氦原子的基态? A. 11P B. 03P C. 13S D. 01S 6. Li +离子的能级和光谱特点应该与下列那种情况相同? A. 氢原子 B. 碱金属原子 C. 氦原子 D. 类氢原子 7.若某原子的两个价电子处于2s2p 组态,利用L —S 耦合,可得到其原子态的个数是: A. 1 B. 3 C. 6 D. 4 8.设原子的两个价电子是p 电子和d 电子,在L —S 耦合情况下,可能有原子态: A. 4个 B. 9个 C. 12个 D. 15个 9.利用L —S 耦合得到的能级分裂间隔,应该是: A. S 、L 分裂大于J 分裂 B. J 分裂大于L 分裂 C. L 分裂大于S 分裂 D. J 分裂大于S, L 分裂 10.如果两个价电子处于相同的pd 组态,利用L —S 耦合和j —j 耦合分别求出的原子态中 A. 状态数和能级间隔相同 B. 量子数J 和能级间隔相同 C. 状态数和量子数J 相同 D. 状态数和量子数S 相同 11.若镁原子(Mg )处于基态,它的价电子的电子组态应该是: A. 2s2s B. 2s2p C. 3s3s D. 3s3p 12. 根据能基多重性交替规律,铷原子(Z=37)能级多重结构应为: A. 单重 B. 一、三重 C. 双重 D. 二、四重 13. 氦原子的电子组态为n 1pn 2s,则可能的原子态: A. 由于n 不确定不能给出确定的J 值, 不能决定原子态; B. 为n 1pn 2s 3D 2,1,0和n 1pn 2s 1D 1; C. 由于违背泡利原理只存单态不存在三重态;
第8节 多电子原子的结构 第一部分 上节课复习内容: 1、主量子数n :22 22048n Z h e E n ?-=εμ .....),,n ()eV (n Z .E n 3215951322 =?-= 2、 角量子数l )n .....,,,l (h )l (l M 1321021-=? ? ? ??+=π e l l βμ)1(+= 3、磁量子数 )l ,......,,m (,h m M z ±±±==2102π )l ,......,,m (,m e z ±±±=-=210βμ 4、自旋运动 )s (h )s (s M s 2 1 21= ? ?? ??+=π )m (,h m M s sz 2 12±==π e e s )s (s g βμ1+= e s e sz m g βμ-= 5、 总量子数 π 21h ) j (j M j += s l ,......s l ,s l j --++=1 π 2h m M j jx = j ,......,,,m j ±±±±=2 5 2321 6、径向分布 第二部分 本节课授课内容:
1、多电子原子的Schrodinger 方程及其近似解 2、原子轨道能和电子结合能 3、电子互斥能 4、原子的电离能和电子亲和能 引言:由单电子体系转移到多电子体系 第四节 多电子原子的Schrodinger 方程及其近似解 一、原子单位 下面引入原子单位(自然单位)来描述方程 自然单位中所有的物理量都用符号au 或是a.u.来表示,但对于不同的物理量,它的物理意义与数值大小是不一样的,如 长度:m .a au 110102917751-?== 质量:kg .m au e 31101191-?== 电荷:C .e au 1910611-?-== 能量:eV .a e au 227410 02== πε,能量的自然单位也经常写作hartree (2个电子相距Bohr 半径时的势能) 从中也可得出:04πε=1au 角动量:s J .h au ??==-34100546121π 例:对于氢原子及类氢离子体系,它的1s 和2s 波函数为: ??? ? ??-??? ? ??=r a z s e a z 0 2 1303 1πψ ???? ? ? -???? ? ?-??? ? ????? ??=r a 2z s e r a z a z 002 1303 22241πψ 所以,上二式根据自然单位可以写成: ()zr s e z -??? ? ??=2 13 1πψ
第二章 自由离子和原子的电子结构 1.单电子体系定态薛定谔方程及其解 氢原子及类氢离子是单核单电子体系,假定核处于质心不动,在 Born-Oppenheimer 近似下电子运动的薛定谔方程为 (xyz)E )(H φφ=∧ xyz ……(2-1) 哈密顿算符r Ze m V 2 2 2 2T H - ?- =+=∧∧ ∧ 2 ? 是Laplacian 算符,2 22 22 22 z y x ?? + ?? + ?? ? = ,氢原子序数1=Z , 变换坐标解方程(2-1),得本征值:)(6 .1322 22 4 2 eV n Z n me Z E -=- = , 本征函数:)()()(θ?θ?φlm nl nlm Y r R r = ……(2-2), 径向函数)(r R nl 只与r 有关,球谐函数:)()()(?θθ?m lm lm Y ΦΘ=, m l n 、、为主量子数、角量子数和磁量子数; ∞ 、、、= 21n , 1210-n l 、、、、= , l m ±±±=、、、、 210。 单电子原子波函数)()()(θ?θ?φlm nl nlm Y r R r =,即原子轨道,若再考 虑电子自旋)(σηs m (其中s m 为)(或σβσα)(): )()()(σηθ?φθ?σψr r nlm m nlm s l =,称为自旋-轨道。 ∧ ∧ z s s 、 只与自旋坐标σ有关,∧ ∧ z l l 、2 只与空间坐标有关;故 ∧ ∧∧ ∧ ∧ z z s s l l H 、、、、2 2 彼此对易,有共同本证函数 )(θ?σψ r s l m nlm ,例如 )2 1 123θ?σψ r (、 、-、,2 11 322 11 32-=-∧ E H ,本征值:9 6 .132 Z E -=, 2 11 32)12(22 11 322 2 -+=-∧ l ,本征值:26 ,
1.电子 学 习目标知识脉络 1.知道阴极射线的概念, 了解汤姆孙对阴极射线的 研究方法及电子发现的意 义.(重点) 2.知道比荷的概念,知道 电子是原子的组成部 分.(重点) 3.知道电子的电荷量的测 量方法——密立根油滴实 验,知道电子的电荷 量.(重点) 带负电的微粒 [先填空] 1.阴极射线 由阴极发出撞击到玻璃壁上产生荧光的射线,称为阴极射线. 2.汤姆孙实验结论 实验表明:阴极射线在磁场和电场中产生偏转,说明阴极射线是带负电的粒子流.[再判断] 1.阴极射线是由真空玻璃管中的感应圈发出的.(×) 2.阴极射线撞击玻璃管壁会发出荧光.(√) 3.阴极射线在真空中沿直线传播.(√) [后思考] 产生阴极射线的玻璃管为什么是真空的? 【提示】在高度真空的放电管中,阴极射线中的粒子主要来自阴极,对于真空度不高的放电管,粒子还有可能来自管中的气体,为了使射线主要来自阴极,一定要把玻璃管抽成
真空. 1.阴极射线带电性质的判断方法 (1)方法一:在阴极射线所经区域加磁场,根据射线的偏转情况确定其带电的性质. (2)方法二:在阴极射线所经区域加一电场,根据射线的偏转情况确定其带电的性质. 2.结论 根据阴极射线在磁场中和电场中的偏转情况,判断出阴极射线是带负电的粒子流. 1.如图2-1-1所示,在阴极射线管正下方平行放置一根通有足够强直流电流的长直导线,且导线中电流方向水平向右,则阴极射线将会向________偏转. 图2-1-1 【解析】阴极射线方向水平向右,说明其等效电流的方向水平向左,与导线中的电流方向相反,由左手定则,两者相互排斥,阴极射线向上偏转. 【答案】上 2.如图2-1-2是电子射线管示意图.接通电源后,电子射线由阴极沿x轴方向射出,在荧光屏上会看到一条亮线.要使荧光屏上的亮线向下(z轴负方向)偏转,可采用加磁场或电场的方法. 【导学号:11010016】 图2-1-2 若加一磁场,磁场方向沿________方向,若加一电场,电场方向沿________方向.【解析】若加磁场,由左手定则可判定其方向应沿y轴正方向;若加电场,根据受力情况可知其方向应沿z轴正方向. 【答案】y轴正z轴正 注意阴极射线电子从电源的负极射出,用左手定则判断其受力方向时四指的指向和射线的运动方向相反.
L S θ 5.1氦原子中电子的结合能为24.5eV ,试问:欲使这个原子的两个电逐一电离,外界必须提供多少能量? 解题要点 处于基态的氦原子中电子结合能为24.5eV ;而经一次电离的处于基态的氦离子(类氢离子)的结合能为 (式中 为基态氢原子的结合能) 所以,使氦原子中电子产生一次电离须供能24.5eV ,产生二次电离须供能54.4eV 。欲使两个电子逐一电离,外界须提供能量为24.5eV+54.4eV =78.9eV 。 5.2计算 态的 解题要点 由原子态 知:L =2,S =3/2,J =3/2 5.3对于S =1/2和L =2,试计算 的可能值。 解题要点 量子数J 的取值: 5.4试求 态总角动量和轨道角动量之间的夹角。 解题要点 对于 态,有L =3,S =1,J =2 依题意作图如右示 eV eV E Z E 4.546.1342=?=='∞∞eV E 6.13 =∞2/34 D S L ?2/34D ?????===???? ????=+==+==+=∴22 222 24/254/2564/25)1(4/25)1(6)1( J S L J J J S S S L L L 2222 2223)(2 12 -=--= ???++=S L J S L S L S L J S L ????==??? ???=+==+=∴2 2 2264/36)1(4/3)1( L S L L L S S S ?? ?=--++=2 /32 /5,,1,S L S L S L J ???=+=→+=∴ 4/154/35)1()1(2J J J J J J ???-=--=??222 222/3)(21 S L J S L 2 3F 23 F ???? ???=+==+==+= 6)1(2)1(12)1(J J J S S S L L L 0 12 2 2 1 2 2247.199428.0cos 2cos cos 2==-+=∴-+=--LS S J L LS J L S θθJ
中学化学竞赛试题资源库——原子电子结构 A组 1.氢原子的电子云图中的小黑点表示的意义是 A 一个小黑点表示一个电子 B 黑点的多少表示电子个数的多少 C 表示电子运动的轨迹 D 电子在核外空间出现机会的多少 2.在化学反应中,会发生变化的是 A 质子数 B 中子数 C 电子数 D 质量数 3.某元素原子L层电子数是K层电子数的2倍,那么此元素是 A F B C C O D N 4.某元素原子L层电子数是K层电子数的2倍,那么此元素是 A F B C C O D N 5.在第n电子层中,当它作为原子的最外层时,容纳电子数最多与n-1层相同;当它作为原子的次外层时,其电子数比n+1层最多容纳电子数多10个,则此电子层是 A K层 B L层 C M层 D N层 6.按照核外电子排布规律:各电子层最多容纳电子数为2n2(n为电子层数);最外层电子数不超过8个;次外层电子数不超过18个,预测核电荷数为118的元素的原子核外电子层排布是 A 2,8,18,32,32,18,8 B 2,8,18,32,50,8 C 2,8,18,32,18,8 D 2,8,18,32,50,18,8 7.在下列分子中,电子总数最少的是 A H2S B O2 C CO D NO 8.下列离子中,所带电荷数与该离子的核外电子层数相等的是 A Al3+ B Mg2+ C Be2+ D H+ 9.下列离子中,电子数大于质子数且质子数大于中子数的是 A D3O+ B Li+ C ODˉ D OHˉ 10.下列各组微粒中,核外电子总数相等的是 A K+和Na+ B CO2和NO2 C CO和CO2 D N2和CO 11.下列各组粒子中,含有相同的电子总数的是 A S2-与HF B H2O与F- C H2O与NH4+ D Na+与K+ 12.下列各组微粒中,核外电子总数相等的是 A K+和Na+ B CO2和NO2 C CO和CO2 D N2和CO 13.下列四组物质中,两种分子不具有相同核外电子总数的是 A H2O2和HCl B CO和NO C H2O和CH4 D H2S和F2 14.下列各组粒子中,核外电子排布相同的是 A Al和Al3+ B Na和F- C Na+和Ne D S2-和Cl 15.已知硼化物B x H y z-与B10C2H12的电子总数相同,则B x H y z-的正确表达式为 A B9H152- B B10H142- C B11H132- D B12H122- 16.A元素的离子A n-,其核外共有x个电子,该原子的质量数为y,则原子核内含有的中子数为