
100种有机化学反应
集锦
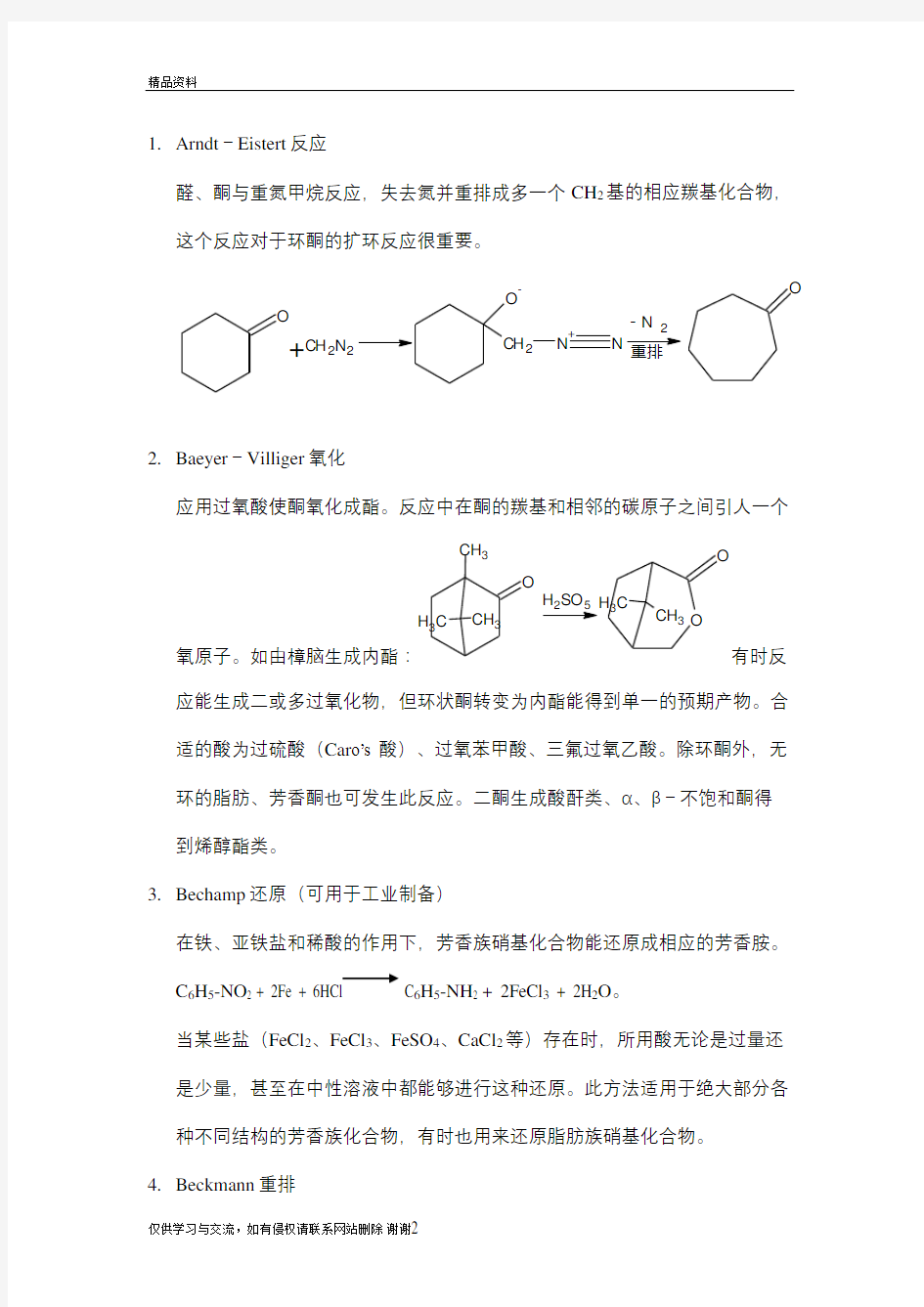
1.Arndt-Eistert反应
醛、酮与重氮甲烷反应,失去氮并重排成多一个CH2基的相应羰基化合物,这个反应对于环酮的扩环反应很重要。
O
+CH2N2
-
2
N+N
-N
2
重排
O
2.Baeyer-Villiger氧化
应用过氧酸使酮氧化成酯。反应中在酮的羰基和相邻的碳原子之间引人一个
氧原子。如由樟脑生成内酯:
O
CH3
C
H3CH3O
O
C
H3
CH3
H SO
有时反
应能生成二或多过氧化物,但环状酮转变为内酯能得到单一的预期产物。合适的酸为过硫酸(Car o’s 酸)、过氧苯甲酸、三氟过氧乙酸。除环酮外,无环的脂肪、芳香酮也可发生此反应。二酮生成酸酐类、α、β-不饱和酮得到烯醇酯类。
3.Bechamp还原(可用于工业制备)
在铁、亚铁盐和稀酸的作用下,芳香族硝基化合物能还原成相应的芳香胺。
C6H5-NO2 + 2Fe + 6HCl C6H5-NH2 + 2FeCl3 + 2H2O。
当某些盐(FeCl2、FeCl3、FeSO4、CaCl2等)存在时,所用酸无论是过量还是少量,甚至在中性溶液中都能够进行这种还原。此方法适用于绝大部分各种不同结构的芳香族化合物,有时也用来还原脂肪族硝基化合物。
4.Beckmann重排
醛肟、酮肟用酸或路易斯酸处理后,最终产物得酰胺类。单酮肟重排仅得一种酰胺,混酮肟重排得两种混合酰胺。但一般质子化羟基的裂解和基团R 的转移是从相反的位置同时进行的。
OH
R'
R
R
O
N R'
R
R'
NHR O
无论酯酮肟和芳酮肟都会发生此反应。环酮肟重排得内酰胺,这在工业生产上很重要,利用此反应可帮助决定异构酮肟的结构。 5. Beyer 喹啉类合成法
芳香伯胺与一分子醛及一分子甲基酮在浓盐酸或ZnCl 2存在下,反应生成喹啉类化合物。
NH 2
H
+
+
R'CHO
RCOCH
这是对Doebner-Miller 喹啉合成法的改进。Doebner-Miller 合成法由芳胺和不饱和醛或酮反应得到喹啉衍生物。
NH
2
H
3
+
C
H 32(CH 3CHO)
6. Blanc 氯甲基化反应
芳香族化合物苯、萘、蒽、菲、联苯及衍生物,在ZnCl 2(或NH 4Cl 、AlCl 3、SnCl 4、H 2SO 4、H 3PO 4 )存在下,用甲醛和极浓盐酸处理,发生芳香化合物的氯甲基化反应。
+++HCHO HCl
ZnCl 2
H 2O
CH 2Cl
对于取代烃类,取
代基的性质对反应能力影响很 亲电取代,烷基,烷氧基一般使反应速度增加,而卤素、羧基特别是硝基 用乙醛得到氯乙基化。在某些情况下用相应当醛可有氯丙基 代替HCl ,溴甲基化以及在特殊情况下的碘甲基化都可发生。氯甲基化试剂除HCHO/HCl 外,也可用H 2C(OMe)2/HCl 或MeOCH 2Cl 来代替。这个反应在有机合成上甚为重要,因导入氯甲基后进一步可转化为-CH 2OH,-CHO,-CH 2CN,-CH 2NH 2及-CH 3等基团。 7. Bouvealt 合成法
N,N-二烷基甲酰胺与一分子格氏试剂在干醚的存在下发生作用,生成的中间产物再经水解,可得醛类化合物,R’MgX 中R’基团越大,醛的产率越高。
R 2N
H
O
R'M gX
干醚
R 2N
OM gX
H
R'CHO
++M gX 2R 2NH
+
8. Bouvealt -Blanc 还原法
酯用金属钠和乙醇还原得到伯醇,脂肪酸酯类易被还原,α、β-不饱和酯
类产生相应的饱和醇类。
R
OR '
O
C 2H 5OH Na
RCH 2OH
R'OH
+常用乙醇作溶
剂,但要维持较高沸点,可用丁醇。也可用LiAlH 4来还原。 9. Bucherer 反应
在亚硫酸盐或酸式亚硫酸盐水溶液存在下,萘、酚、萘胺中的羟基在加热加压时,能发生可逆的交换作用。
OH
NH 2
(NH 4)2SO 3, NH 3, 150℃, 6atm
Na 2SO 3, H 2O
10. Cannizzaro 反应(见P291-292) 11. Chichibabin 吡啶类合成法
醛、酮类与氨或胺类在Al 2O 3等催化剂存在下,加压加热,脱氢脱水,生成
吡啶类化合物。
N
CH 3
3CH 3CHO
+++NH 3
3H 2O H 2
此法
不易得纯产物,还有其他化合物生成。 12. Chichibabin 对称合成法
碳酸二乙酯与三分子格氏试剂反应,中间产物经水解得到对称叔醇类。
H 5C 2O
2H 5
O
+3RM gX
R
OH
R
如果格氏试剂用量不足,与
一分子RMgX 反应生成酸,与二分子RMgX 反应生成酮。
H 5C 2O
2H 5
O
+
RM gX R H 5C 2H 5C 2O
OM gX
R
2H 5
O
H 2O
RCOOH
+C 2H 5OH
R
R O
RM gX R
H 5C 2R
OMgX
R
2H 5
O
-M gXOC
2H 5
13. Chichibabin 胺化反应
含氮杂环碱类,如吡啶,喹啉或其衍生物与金属胺基化物在一起加热,则起胺化反应,生成氨基衍生物。产率一般为50%~100%。
N
N
NHNa
N
NH 2
NaNH 2 溶剂
105- 110℃, 66- 76%H 2O 水解
反应中副产物很多:4-氨基吡啶,2,6-二氨基吡啶,2,4,6-三氨基吡啶,2,2’-联吡啶等。产物随温度、溶剂性质、氨基钠用量而异。Bechamp 还原法不适用于制备氨基吡啶类,因为吡啶类在一般情况下很难硝化,所以此反应是吡啶环中直接引入氨基的有效方法。 14. Chugaev 反应
该反应制备烯烃类。黄原酸酯在120~200℃时热解,顺利产生烯烃,相应 醇和氧硫化碳。黄原酸酯在热解前制备不须离析 除黄原酸酯外,其他的酯氨基甲酸酯,碳酸酯和羧酸酯 热解。特别是使用大分子量的羧酸酯(棕榈酸酯)的烯烃提供了有利条件。因为这些酯本身沸点高,而热解温度较低(约300℃),在液相中简单加热即可。 15. Claisen 重排
烯醇或酚类的烯丙醚在加热时,易起重排反应。烯丙基由氧原子上转移到碳原子上,这与弗利斯重排有相似之处。
CH 2CH=CH
2
OH
OC H 2CH=CH
2
200℃
OC H 2CH=CH
2
OH
CH 2CH=CH
2
200℃
;
Cl
OC H 2CH=CH
2
OH
CH 2CH=CH
2
250℃
醚分子
中,如临位未被取代则不起重排反应,产生复杂的热分解作用。此反应是在苯环引入丙基的简易方法,因为烯丙基可还原成丙基。 16. Claisen 缩合反应(P352~354) 17. Claisen -Schmidt 反应(P287) 18. Clemmensen 还原(P291) 19. Cope 消除反应
这个反应是由氧化叔胺消除羟胺来产生烯烃。反应在低温进行且产量较高,当加热到120℃时,具有光学活性的纯氧化叔胺1-(N,N-二甲氨基)-3-苯基丁烷就得到具有旋光性的纯3-苯基丁烯-1,而且总是定量进行。
CH
-
65
3
C
H 3CH 2
H 56
+(CH 3)2NOH
*△
20. Criegee 氧化法
乙二醇类在稀醋酸或苯溶液中,室温时用四乙酸铅进行很温和的氧化,两个相连的各带有游离羟基的碳原子之间的碳链就断裂,得到定量的醛酮类。此法用于研究醇类结构及制备醛酮类且产率很高。
R 2C
R '2
OH OH ++
+P b(AcO)4
R
R O
R '
R 'O
R H C
H R '
OH OH +P b(AcO)4
R C H O
R 'C H O
21. Curtius 降解
库尔修斯降解是羧酸的迭氮化合物经加热脱氮重排成异氰酸酯,再经水解得伯胺类。若反应在惰性溶剂中进行,可以得到异氰酸酯,并能将它分离出来。
常见的化学反应及现象综合 1.澄清石灰水中通入二氧化碳气体(复分解反应) Ca(OH)2 + CO2 = CaCO3↓ + H2O 现象:石灰水由澄清变浑浊。 相关知识点:这个反应可用来检验二氧化碳气体的存在。 2.镁带在空气中燃烧(化合反应) 2Mg + O2 = 2MgO 现象:镁在空气中剧烈燃烧,放热,发出耀眼的白光,生成白色粉末。 相关知识点:(1)这个反应中,镁元素从游离态转变成化合态;(2)物质的颜色由银白色转变成白色。 (3)镁可做照明弹;(4)镁条的着火点高,火柴放热少,不能达到镁的着火点,不能用火柴点燃;(5)镁很活泼,为了保护镁,在镁表面涂上一层黑色保护膜,点燃前要用砂纸打磨干净。 3.水通电分解(分解反应) 2H2O = 2H2↑ + O2↑ 现象:通电后,电极上出现气泡,气体体积比约为1:2 相关知识点:(1)正极产生氧气,负极产生氢气;(2)氢气和氧气的体积比为2:1,质量比为1:8; (3)电解水时,在水中预先加入少量氢氧化钠溶液或稀硫酸,增强水的导电性;(4)电源为直流电 4.生石灰和水反应(化合反应) CaO + H2O = Ca(OH)2 现象:白色粉末溶解
相关知识点:(1)最终所获得的溶液名称为氢氧化钙溶液,俗称澄清石灰水;(2)在其中滴入无色酚酞,酚酞会变成红色;(3)生石灰是氧化钙,熟石灰是氢氧化钙。(4)发出大量的热 5.实验室制取氧气 ①加热氯酸钾和二氧化锰的混合物制氧气(分解反应) 2KClO3MnO2催化2KCl + 3O2↑ 相关知识点:(1)二氧化锰在其中作为催化剂,加快氯酸钾的分解速度或氧气的生成速度;(2)二氧化锰的质量和化学性质在化学反应前后没有改变;(3)反应完全后,试管中的残余固体是氯化钾和二氧化锰的混合物,进行分离的方法是:洗净、干燥、称量。 ②加热高锰酸钾制氧气(分解反应) 2KMnO4 = K2MnO4 + MnO2 + O2↑ 相关知识点:在试管口要堵上棉花,避免高锰酸钾粉末滑落堵塞导管。 ③过氧化氢和二氧化锰制氧气(分解反应) 2H2O2 MnO2催化2H2O + O2↑ 共同知识点:(1)向上排空气法收集时导管要伸到集气瓶下方,收集好后要正放在桌面上;(2)实验结束要先撤导管,后撤酒精灯,避免水槽中水倒流炸裂试管;(3)加热时试管要略向下倾斜,避免冷凝水回流炸裂试管;(4)用排水集气法收集氧气要等到气泡连续均匀地冒出再收集;(5)用带火星的小木条放在瓶口验满,伸入瓶中检验是否是氧气。 6.木炭在空气中燃烧(化合反应) 充分燃烧:C + O2 = CO2 不充分燃烧:2C + O2 = 2CO 现象:在空气中发出红光;在氧气中发出白光,放热,生成一种使澄清石灰水变浑浊的无色气体。 相关知识点:反应后的产物可用澄清的石灰水来进行检验。
基础有机化学反应总结 一、烯烃 1、卤化氢加成 (1) CH CH 2 R HX CH CH 3R X 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。 【机理】 CH 2 C H 3+ CH 3 C H 3X + CH 3 C H 3 X +H + CH 2 +C 3X + C H 3X 主 次 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。 【注】碳正离子的重排 (2) CH CH 2 R CH 2CH 2 R Br HBr ROOR 【特点】反马氏规则 【机理】 自由基机理(略) 【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。 【本质】不对称烯烃加成时生成稳定的自由基中间体。 【例】 CH 2 C H 3Br CH CH 2Br C H 3CH + CH 3 C H 3HBr Br CH 3CH 2CH 2Br CH CH 3 C H 3 2、硼氢化—氧化 CH CH 2 R CH 2CH 2R OH 1)B 2H 62)H 2O 2/OH -
【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。 【机理】 CH 2 C H 33H 32 3H 32 CH CH 2C H 3 2 CH CH=CH (CH 3CH 2CH 2)3 - H 3CH 2CH 2C 22CH 3 CH 2B O CH 2CH 2CH 3 H 3CH 2CH 2C 2CH 2CH 3 + O H - O H B - OC H 2CH 2CH 3CH 2CH 2CH 3 H 3CH 2CH 2B OC H 2CH 2CH 3 CH 2CH 2CH 3H 2CH 2CH 3 HOO -B(OCH 2CH 2CH 3)3 B(OCH 2CH 2CH 3)3 + 3NaOH 3NaOH 3HOC H 2CH 2CH 33 + Na 3BO 3 2 【例】 CH 3 1)BH 32)H 2O 2/OH -CH 3 H H OH 3、X 2加成 C C Br /CCl C C Br 【机理】
1.Arbuzov 反应 卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。 本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得: 一般认为是按 S N2 进行的分子内重排反应: 2.Arndt-Eister 反应 酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。 重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。 3.Baeyer----Villiger 反应
过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。因此,这是一个重排反应 具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排: 不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为: 4.Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
有机化学 一、烯烃 1、卤化氢加成 (1) CH CH 2 R HX CH CH 3R X 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。 【机理】 CH 2 C H 3+ CH 3 C H 3X + CH 3 C H 3 +H + CH 2 +C 3X + C H 3X 主 次 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。 【注】碳正离子的重排 (2) CH CH 2 R CH 2CH 2 R Br HBr ROOR 【特点】反马氏规则 【机理】 自由基机理(略) 【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。 【本质】不对称烯烃加成时生成稳定的自由基中间体。 【例】 CH 2 C H 3Br CH CH 2Br C H 3CH + CH 3 C H 3HBr Br CH 3CH 2CH 2Br CH CH 3 C H 3 2、硼氢化—氧化 CH CH 2 R CH 2CH 2R OH 1)B 2H 62)H 2O 2/OH - 【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。 【机理】
2 C H3 3 H3 2 3 H3 2 CH CH2 C H3 2 CH CH=CH (CH3CH2CH2)3 - H3CH2CH2C 22 CH3 CH2 B O CH2CH2CH3 3 CH2CH2C 2 CH2CH3 +O H- O H B-OCH2CH2CH3 CH2CH2CH3 H3CH2CH2 B OCH2CH2CH3 CH2CH2CH3 2 CH2CH3 HOO- B(OCH2CH2CH3)3 B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO3 2 【例】 CH3 1)BH 3 2)H 2 O 2 /OH- CH3 H H OH 3、X2加成 C C Br 2 /CCl 4 C C Br Br 【机理】 C C C C Br Br C Br +C C Br O H2+ -H+ C C Br O H
氨基酸的常见化学反应 ? -氨基的反应 ?亚硝酸反应 ?范围:可用于Aa定量和蛋白质水解程度的测定(Van slyke法) ?注意:生成的氮气只有一半来自于Aa,ε氨基酸也可反应,速度较 慢. ?与酰化试剂的反应 ?Aa+酰氯,酸酐-→Aa被酰基化 ?丹磺酰氯用于多肽链末端Aa的标记和微量Aa的定量测量. ?烃基化反应 ?Aa的氨基的一个氢原子可被羟基(包括环烃及其衍生物)取代. ?与2,4-二硝基氟苯(DNFB,FDNB)反应 ?最早Sanger用来鉴定多肽或蛋白质的氨基末端的Aa ?与苯异硫氰酸酯(PITC)的反应 ?Edman用于鉴定多肽或蛋白质的N末端Aa.在多肽和蛋 白质的Aa顺序分析方面占有重要地位(Edman降解法) ?形成西佛碱反应 ?Aa的α-NH2能与醛类化合物反应生成弱碱,即西佛碱(schiff ‘s base) ?前述甲醛滴定:甲醛与H2N-CH2-COO-结合,有效地减低了后者的 浓度,所以对于加入任何量的碱, [H2N-CH2-COO- ]/ [+H3N-CH2-COO- ]的比值总要比不存在甲醛的情况下小得多。加入 甲醛的甘氨酸溶液用标准盐酸滴定时,滴定曲线B并不发生改变。 ?脱氨基反应 ?Aa在生物体内经Aa氧化酶催化即脱去α-NH2而转变成酮酸 ?α-COOH参加的反应 ?成盐和成酯反应 ?Aa + 碱-→盐 ?Aa + NaOH -→氨基酸钠盐(重金属盐不溶于水) ?Aa-COOH + 醇-→酯 ?Aa+ EtOH ---→氨基酸乙酯的盐酸盐 ?当Aa的COOH变成甲酯,乙酯或钠盐后,COOH的化学反 应性能被掩蔽或者说COOH被保护,NH2的化学性能得到 了加强或活化,易与酰基结合。Aa酯是制备Aa的酰氨or 酰肼的中间物 ? ?成酰氯反应 ?当氨基酸的氨基用适当的保护基保护以后,其羧基可与二氯亚砜作 用生成酰氯 ?用于多肽人工合成中的羧基激活 ?叠氮反应 ?氨基酸的氨基通过酰化保护后,羧基经酯化转变为甲酯,然后与肼
第一部分:烯烃 1. 2hv 2. 2 3.Br 4.2 5. 2 6. Cl -H O 7. ICl H ICl H 8. 9. CH 3CHCH CH 2 3 D 2 Pt 10. 11. 4 12. (1)OsO 4 吡啶 (2)NaHSO 3 (1) (2) 13. CF 3CO 3H H 3O + (1) (2) 14. CF 3CO 3H H 3O + (1) (2) 15. F 3C H 2SO 4 浓 H 2O 16. 17. HBr ROOR 18.
(1) (2)19. B 2H 6 H 2O 2/OH (1) (2) 20. O 3 Zn/H 2O 21. KMnO 4 + 22. CF CO H 23. CF CO H 24. CF CO H 第二部分:炔烃和二烯烃 1. Na NH 3(l) 2. H 2 Lindlar 3. H O HgSO 4/H 2SO 4 4. (1) B 2H 6 (2) H 2O 2/OH 5. HCN 6. (1) B 2H 6 (2) CH 3COOH - 7.3OH 3 C 2H 5ONa 8. 9. Br 10. 11. 12.H Lindlar KMnO 13. H 2
14. Br 3 15. Br 2 16.2 Cu Cl / NH Cl 17. 2NH 3(l) 25 18. 19. 2低温 20. 2 高 温 Br Cl 21. 22. CN CN + 23. COOCH 3 + H 3COOC 24. + 25.+ O O 26. (1)O 32 +Cl 2 27. 第三部分:脂环烃 NBS 1. 2. 2 Ni 3. HBr 4. (1)(2) H 2 SO 4 浓 H 2O
常见的化学反应及现象综合 1、澄清石灰水中通入二氧化碳气体(复分解反应) Ca(OH)2 + CO2 = CaCO3↓ + H2O 现象:石灰水由澄清变浑浊。 相关知识点:这个反应可用来检验二氧化碳气体的存在。 2、镁带在空气中燃烧(化合反应) 2Mg + O2 = 2MgO 现象:镁在空气中剧烈燃烧,放热,发出耀眼的白光,生成白色粉末。 相关知识点:(1)这个反应中,镁元素从游离态转变成化合态;(2)物质的颜色由银白色转变成白色。(3)镁可做照明弹;(4)镁条的着火点高,火柴放热少,不能达到镁的着火点,不能用火柴点燃 ;(5)镁很活泼,为了保护镁,在镁表面涂上一层黑色保护膜,点燃前要用砂纸打磨干净。 3、水通电分解(分解反应) 2H2O = 2H2↑ + O2↑ 现象:通电后,电极上出现气泡,气体体积比约为1:2 相关知识点:(1)正极产生氧气,负极产生氢气;(2)氢气与氧气的体积比为2:1,质量比为1:8;(3)电解水时,在水中预先加入少量氢氧化钠溶液或稀硫酸,增强水的导电性;(4)电源为直流电 4、生石灰与水反应(化合反应) CaO + H2O = Ca(OH)2 现象:白色粉末溶解 相关知识点:(1)最终所获得的溶液名称为氢氧化钙溶液,俗称澄清石灰水;(2)在其中滴入无色酚酞,酚酞会变成红色;(3)生石灰就是氧化钙,熟石灰就是氢氧化钙。(4)发出大量的热 5、实验室制取氧气 ①加热氯酸钾与二氧化锰的混合物制氧气(分解反应) 2KClO3MnO2催化2KCl + 3O2↑ 相关知识点:(1)二氧化锰在其中作为催化剂,加快氯酸钾的分解速度或氧气的生成速度;(2)二氧化锰的质量与化学性质在化学反应前后没有改变;(3)反应完全后,试管中的残余固体就是氯化钾与二氧化锰的混合物,进行分离的方法就是:洗净、干燥、称量。
有机化学反应类型全总结一、取代反应 定义:有机物分子里的某些原子或原子团被其它原子或原子团 所代替的反应称为取代反应. 取代反应的类型很多, 中学化学中主要有下面几类: 1.卤代反应烷烃、芳香烃、苯酚等均能发生卤代反应如: 2.硝化反应苯及其同系物、苯酚、烷烃等均能发生硝化反应如:
3.磺化反应苯、苯的衍生物, 几乎均可磺化.如: (邻、对位产物为主)4. 酯化反应 (1)羧酸和醇的反应.如: (2)无机含氧酸和醇的反应.如: 5.水解反应: 卤代烃、酯、多糖、二糖、蛋白质都能在一定条件下发生水解反应.如: 6. 与活泼金属的反应: 醇、酚、羧酸等均能与活泼金属如钠反应生成氢气.如:
7.醇与卤化氢(HX)的反应.如: 8.羧酸或醇的分子间脱水. 如:? 二、加成反应 定义有机物分子里不饱和的碳原子跟其它原子或原子团直接结合,生成别的 物质的反应, 叫加成反应分子结构中含有双键或叁键的化合物, 一般能与H 2、X 2 (X为Cl、Br、I)、HX、H 2 O、HCN等小分子物质起加成反应. 如烯烃、二烯烃、炔烃、苯及其同系物、醛、酮、不饱和高级脂肪酸及其甘油脂、单糖等. 说明: 1.羧基和酯基中的碳氧双键不能发生加成反应。 2.醛、酮的羰基只能与H 2 发生加成反应。 3.共轭二烯有两种不同的加成形式。 1.和氢气加成. 2.和卤素加成
3.和卤化氢加成 4.和水加成 三、消去反应 定义:有机化合物在适当条件下, 从一个分子相邻两个碳原子上脱去一个小分子(如O、HX等)而生成不饱和(双键或叁键)化合物的反应称为消去反应, 又称消除H 2 反应 发生消去反应的化合物需具备以下两个条件: (1)是连有一OH(或一X)的碳原子有相邻的碳原子; (2)是该相邻的碳原子上还必须连有H原子. 1.醇的消去反应.如: 2.卤代烃的消去反应.如: 四、聚合反应 定义:由许多单个分子互相结合生成高分子化合物的反应叫聚合反应. 聚合反应有两个基本类型:加聚反应和缩聚反应. 1.加聚反应. 由许多单个分子互相加成, 又不缩掉其它小分子的聚合反应称为加成聚合反应简称加聚反应. 烯烃、二烯烃及含的物质均能发生加聚反应.如: 2.缩聚反应
有机化学十种反应类型详细小结 复习方法提示: 1、全面了解有机物所具有得反应类型有哪些?熟记相关名词,确保表达准确。 2、把握准每一类反应得概念,牢牢掌握反应中得结构变化特点。这就是分析判断得依据! 3、认识相似得同一种反应类型得“归属”关系,如取代反应可以包括什么?区分相近得不同反应类型在结构变化上得“差异”性及规律,如消去反应与氧化反应,加成反应与加聚反应等等。 以下概要回顾有机得五大反应,包括:取代反应、加成反应、消去反应、聚合反应(包括加聚反应与缩聚反应),以及氧化-还原反应。 一、取代反应 定义:有机物分子里得某些原子或原子团被其它原子或原子团所代替得反应称为取代反应。 在中学化学中,取代反应包括卤代、酯化、水解、硝化与磺化等很多具体得类型。分例如下: 1、与卤素单质得取代------发生该类反应得有机物包括:烷烃、烯烃、芳香烃、醇、酚等。例如: (1).(在适当得条件下,烷烃得取代反应就是可以逐步进行得,得到一系列得混合物)。 (2). (3).CH 2=C H-CH 3 + Cl 2CH 2=CH-CH 2-Cl + HCl (4). (5).+ 2HCl 2、与混酸得硝化反应(苯及其同系物、苯酚、烷烃等均能发生硝化反应)。如: (1). + HNO 2 -NO 2 + H 2O (2). (3). 环己烷对酸、碱比较稳定,与中等浓度得硝酸或混酸在低温下不发生反应,与稀硝酸在100℃以上得封管中发生硝化反应,生成硝基环己烷。在铂或钯催化下,350℃以上发生脱氢反应生成苯。环己烷与氧化铝、硫化钼、古、镍-铝一起于高温下发生异构化,生成甲基戌烷。与三氯化铝在温与条件下则异构化为甲基环戊烷。 低碳硝基烷得工业应用日益广泛。在使用原料上,以丙烷硝化来制取就是合理得途径。在工艺方面,国外较多得就是以硝酸为硝化剂得气相硝化工艺,已积累了较丰富得工业经验。有代表性得反应器则就是多室斯登该尔反应器。国内迄今有关硝基烷得生产与应用研究均进行得不多,这就是应该引起我们充分注意得。 (4).CH 3-CH 2-CH 3(气) + H NO 3(气) CH 3-CH2-CH 2-N O2 + H 2O 3、与硫酸得磺化反应(苯、苯得衍生物, 几乎均可磺化)。如: (1). (2). (邻、对位产物为主) 4、羧酸与醇得酯化反应 (1).羧酸与醇:CH 3COOH + CH 3CH 2OH CH 3C OOCH 2C H3 + H 2O + 浓硫酸 △ + 100℃ 浓硫酸 △ 光照
常见反应的现象 CO 2 SO 2 2P 2 2H 2 Fe 2 2Al 2 2 2CuO 2 2 2 2HgO
CO 2 2H 2H 2 3 +CuO C+2CuO
CO+CuO 描述实验现象时要注意不能说出生成物的名称,但可以根据生成物的化学性质来描述生成物。
常见物质的颜色、气味 固体 ●红色:红磷P、铜Cu、氧化铁Fe2O3、氧化汞HgO ●红褐色:氢氧化铁Fe(OH)3 ●黄色:金Au、硫S ●绿色:碱式碳酸铜Cu2(OH)2CO3 ●紫黑色:高锰酸钾晶体KMnO4 ●淡蓝色:固态氧O2 ●蓝色:氢氧化铜Cu(OH)2、硫酸铜晶体CuSO4·5H2O ●银白色:大多数金属(铁Fe、银Ag、铝Al、锌Zn、镁Mg……) ●黑色:木炭C、铁粉Fe、氧化铜CuO、二氧化锰MnO2、四氧化三铁Fe3O4、氧化亚铁FeO等●深灰色:石墨C ●灰白色:大多数磷肥 ●无色:金刚石C、干冰CO2、冰H2O ●白色:除了上述固体之外,我们学过的其他固体、固体粉末或晶体基本上都是白色的。 ●有刺激性气味的固体:碳酸氢铵NH4HCO3 液体 ●淡蓝色:液态氧O2 ●蓝色:含有Cu2+的溶液 ●浅绿色:含有Fe2+的溶液 ●黄色:含有Fe3+的溶液 ●银白色:汞Hg ●我们学过的大多数液体都是无色的。 ●有特殊气味的液体:乙醇C2H5OH ●有刺激性气味的液体:醋酸CH3COOH 气体 ●红棕色气体:二氧化氮NO2 ●有毒的气体:一氧化碳CO、氯化氢HCl、氨气NH3、二氧化硫SO2、二氧化氮NO2等 ●有刺激性气味的气体:氯化氢HCl、氨气NH3、二氧化硫SO2、二氧化氮NO2等 ●我们学过的大多数气体都是无色无味的。 ●计入空气污染指数的项目:二氧化硫SO2、一氧化碳CO、二氧化氮NO2、可吸入颗粒物和臭氧 O3等 ●能产生温室效应的气体:二氧化碳O2、臭氧O3、甲烷CH4、氟氯代烷等
常见有机化学方程式归纳 物质类别性质反应方程式 一、烷烃 1、燃烧 CH4 + 2O2CO2 + 2H2O 2、取代反应 CH4 + Cl2CH3Cl + HCl CH3Cl + Cl2CH2Cl2 + HCl(或CH4 + 2Cl2CH2Cl2 + 2HCl) CH2Cl2 + Cl2CHCl3 + HCl(或CH4 + 3Cl2CHCl3 + 3HCl) CHCl3 + Cl2CCl4 + HCl(或CH4 + 4Cl2CCl4 + 4HCl) CH3CH3 + Br2CH3CH2Br + HBr 3、高温分解CH4 C + 2H2↑ 二、烯烃 1、燃烧 C2H4 + 3O22CO2 + 2H2O 2、加成反应
3、加聚反应 4、氧化反应 三、炔烃 1、燃烧 2C2H2 + 5O24CO2 + 2H2O 2、加成反应 四、芳香烃 1、卤代 2、硝化
3、加成 4、氧化 五、醇 1、与活泼金属反应2CH3CH2OH +2 Na2CH3CH2ONa + H2↑ 2、消去反应 3、脱水成醚 4、取代反应 5、氧化
6、酯化反应 六、醛1、氧化 2C2H4O + 5O24CO2 + 4H2O
2、还原 七、酮1、加氢还原 八、羧酸 1、酸性 2CH3COOH + 2Na = 2CH3COONa + H2↑ CH3COOH + NaOH = CHCOONa + H2O 2CH3COOH + Na2CO3 = 2CH3COONa + H2O + CO2↑ CH3COOH + NaHCO3 = CH3COONa + H2O + CO2↑ 2、酯化反应参考醇的性质 九、酯1、水解 十一、卤代烃 1、水解反应 2、消去反应 十二、酚1、弱酸性
高中化学常见物质颜色、反应火焰规律总结 以红色为基色的物质 红色:难溶于水的Cu,Cu2O,Fe2O3,HgO等。 碱液中的酚酞、酸液中甲基橙、石蕊及pH试纸遇到较强酸时及品红溶液。 橙红色:浓溴水、甲基橙溶液、氧化汞等。 棕红色:Fe(OH)3固体、Fe(OH)3水溶胶体等。 ②以黄色为基色的物质 黄色:难溶于水的金、碘化银、磷酸银、硫磺、黄铁矿、黄铜矿(CuFeS2)等。 溶于水的FeCl3、甲基橙在碱液中、钠离子焰色及TNT等。 浅黄色:溴化银、碳酦银、硫沉淀、硫在CS2中的溶液,还有黄磷、Na2O2、氟气。 棕黄色:铜在氯气中燃烧生成CuCl2的烟。 ③以棕或褐色为基色的物质 碘水浅棕色、碘酒棕褐色、铁在氯气中燃烧生成FeCl3的烟等 ④以蓝色为基色的物质 蓝色:新制Cu(OH)2固体、胆矾、硝酸铜、溶液中淀粉与碘变蓝、石蕊试液碱变蓝、pH试纸与弱碱变蓝等。 浅蓝色:臭氧、液氧等 蓝色火焰:硫、硫化氢、一氧化碳的火焰。甲烷、氢气火焰(蓝色易受干扰)。 ⑤以绿色为色的物质 浅绿色:Cu2(OH)2CO3,FeCl2,FeSO4•7H2O。 绿色:浓CuCl2溶液、pH试纸在约pH=8时的颜色。 深黑绿色:K2MnO4。 黄绿色:Cl2及其CCl4的萃取液。 ⑥以紫色为基色的物质 KMnO4为深紫色、其溶液为红紫色、碘在CCl4萃取液、碘蒸气、中性pH试纸的颜色、K+离子的焰色等。 ⑦以黑色为基色的物质 黑色:碳粉、活性碳、木碳、烟怠、氧化铜、四氧化三铁、硫化亚铜(Cu2S)、硫化铅、硫化汞、硫化银、硫化亚铁、氧化银(Ag2O)。 浅黑色:铁粉。 棕黑色:二氧化锰。 ⑧白色物质 无色晶体的粉末或烟尘; 与水强烈反应的P2O5; 难溶于水和稀酸的:AgCl,BaSO3,PbSO4; 难溶于水的但易溶于稀酸:BaSO3,Ba3(PO4)2,BaCO3,CaCO3,Ca3(PO4)2,CaHPO4,Al(OH)3,Al2O3,ZnO,Zn(OH)2,ZnS,Fe(OH)2,Ag2SO3,CaSO3等; 微溶于水的:CaSO4,Ca(OH)2,PbCl2,MgCO3,Ag2SO4; 与水反应的氧化物:完全反应的:BaO,CaO,Na2O; 不完全反应的:MgO。 ⑨灰色物质 石墨灰色鳞片状、砷、硒(有时灰红色)、锗等。
一、取代反应 定义:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应称为取代反应。在中学化学中,取代反应包括卤代、酯化、水解、硝化和磺化等很多具体的类型。 分例如下:1、与卤素单质的取代------发生该类反应的有机物包括:烷烃、烯烃、芳香烃、醇、酚等。例如: 2、与混酸的硝化反应(苯及其同系物、苯酚、烷烃等均能发生硝化反应)。如: (3)注:环己烷对酸、碱比较稳定,与中等浓度的硝酸或混酸在低温下不发生反应,与稀硝酸在100℃以上的封管中发生硝化反应,生成硝基环己烷。在铂或钯催化下,350℃以上发生脱氢反应生成苯。环己烷与氧化铝、硫化钼、古、镍-铝一起于高温下发生异构化,生成甲基戌烷。与三氯化铝在温和条件下则异构化为甲基环戊烷。 低碳硝基烷的工业应用日益广泛。在使用原料上,以丙烷硝化来制取是合理的途径。在工艺方面,国外较多的是以硝酸为硝化剂的气相硝化工艺,已积累了较丰富的工业经验。有代表性的反应器则是多室斯登该尔反应器。国内迄今有关硝基烷的生产和应用研究均进行得不多,这是应该引起我们充分注意的。 3、与硫酸的磺化反应(苯、苯的衍生物, 几乎均可磺化)。如:
4、羧酸和醇的酯化反应 5、水解反应(卤代烃、酯、多糖、二糖、蛋白质都能在一定条件下发生水解反应)。如: 6、与活泼金属的反应:(醇、酚、羧酸等均能与活泼金属如钠反应生成氢气)。如: 7、醇与卤化氢(HX)的反应。如: 8、羧酸或醇的分子间脱水。如:
二、加成反应定义:有机物分子里不饱和碳原子跟其它原子或原子团直接结合生成化合物的反应叫加成反应。 在中学化学中,分子结构中含有“双键”或“叁键”的化合物均能发生加成反应。如烯烃、二烯烃、炔烃、苯及其同系物、醛、酮、不饱和高级脂肪酸及其甘油脂、单糖等。通常参与加成反应的无机试剂包括H 2 、 X 2(X为Cl、Br、I)、HX、H 2 O、HCN等小分子(对称或不对称试剂) 起加成反应。 说明:i.羧基和酯基中的碳氧双键不能发生加成反应。 ii.醛、酮的羰基只能与H 2 发生加成反应。iii.共轭二烯有两种不同的加成形式。 1、和氢气加成 2、和卤素加成 3、和卤化氢加成 4、和水加成 三、消去反应定义:有机化合物在适当条件下,从一个分子相邻两个碳 原子上脱去一个小分子(如:H 2 O、HX等)而生成不饱和(双键或叁键)化合物的反应称为消去反应, 又称消除反应。 发生消去反应的化合物需具备以下两个条件: i.是连有一OH(或一X)的碳原子有相邻的碳原子;ii.是该相邻的碳原子上还必须连有H原子。中学里常见的两类有机物是醇和卤代烃。1、
光照 光照 光照 光照 高温 CaO △ 催化剂 加热、加压 催化剂 △ 催化剂 有机化学方程式汇总 1. CH 4 + Cl 2 CH 3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl 3. CH 2Cl + Cl 2 CHCl 3 + HCl 4. CHCl 3 + Cl 2 CCl 4+ HCl 5. CH 4 C +2H 2 6. C 16H 34 C 8H 18 + C 8H 16 7. CH 3COONa + NaOH CH 4↑+ Na 2CO 3 8. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9. CH 2 = CH 2OH 10. CH 2 = CH 2—CH 2Br 11. CH 2 = CH 23 12. nCH 2 = CH 2 ] n 13. nCH 22] n 14. 2CH 2CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 2 17. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO 20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 2 +H 2O H+H 2O
NaOH H 2 O 醇 △ 催化剂 △ 浓硫酸 170℃ 浓硫酸 140℃ 催化剂 △ 24. + 3H 2 -NO 22O 26. 3CH ≡CH 27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr 28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr 29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O 30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑ 31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O 32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 2O 2O O 3O + 2O+CO 3 37 38. CH 339. 2CH 340. CH 34+2Ag ↓+3NH 3+H 2O 41CH 3O 42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑
化学反应类型 1、化学反应四种基本反应类型 ①化合反应:由两种或两种以上物质生成另一种物质的反应 ②分解反应:由一种反应物生成两种或两种以上其他物质的反应 ③置换反应:一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应 ④复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应 2、氧化还原反应 氧化反应:物质得到氧的反应 还原反应:物质失去氧的反应 氧化剂:提供氧的物质 还原剂:夺取氧的物质(常见还原剂:H2、C、CO) 3、中和反应:酸与碱作用生成盐和水的反应 精品
精品
氧化反应 精品
氧化还原反应 定义有得、失氧的反应是氧化还原反应。氧化还原反应不属于基本反应类型。 区分物质得到氧的反应物质失去氧的反应 氧化反应还原反应 物质得到氧的反应,得到氧的物质被氧化,发生氧化反应;是还原剂,具有还原性。失去氧的物质被还原,发生还原反应。是氧化剂, 具有氧化性。 还原剂:夺取氧的物质氧化剂:提供氧的物质 常见还原剂:H2、C、CO常见氧化剂: 物质反应化学方程式伴随现象 氢气还原氧化铜H2+CuO Cu+H2O 木炭还原氧化铜C+2CuO 2Cu+CO2↑黑色粉未变成红色,澄清石灰水变浑浊。 焦炭还原氧化铁3C+2Fe2O34Fe+3CO2↑ 木炭还原氧化铁3C+2Fe2O34Fe+3CO2↑ 精品
精品 焦炭还原四氧化三铁 2C+Fe3O4高温3Fe+2CO2↑ 一氧化碳还原氧化铜(检验一氧化碳的反应原理) CO+CuO Cu+CO 2 黑色粉未变成红色,澄清石灰水变浑浊。 一氧化碳还原氧化铁(冶炼铁的主要反应原理) (用赤铁矿炼铁、高炉炼铁的反应原理) 3CO+Fe 2O 32Fe+3CO 2 红色粉未变成黑色,澄清石灰水变浑浊。 一氧化碳还原四氧化三铁(用磁铁矿炼铁) 4CO+Fe 3O 43Fe+4CO 2 一氧化碳还原四氧化三铁(用磁铁矿炼铁) 一氧化碳还原氧化亚铁 CO+FeO Fe+CO 2 四种基本反应类型 ①化合反应:由两种或两种以上物质生成另一种物质的反应。 如:A + B = AB ②分解反应:由一种反应物生成两种或两种以上其他物质的反应。 如:AB = A + B 2Mg+O 2 2MgO CO 2+H 2O=H 2CO 3 有 参加时,化合价改变 2CO+O 2 2CO 2 2H 2O 2H 2↑+O 2↑ CaCO 3 CaO+CO 2↑ 有 生成时,化合价改变 2KMnO 4 △ 2K 2MnO 4+MnO 2+O 2↑
-氨基的反应 亚硝酸反应 范围:可用于Aa定量和蛋白质水解程度的测定(Van slyke法) 注意:生成的氮气只有一半来自于Aa,ε氨基酸也可反应,速度较 慢. 与酰化试剂的反应 Aa+酰氯,酸酐-→Aa被酰基化 丹磺酰氯用于多肽链末端Aa的标记和微量Aa的定量测量.烃基化反应 Aa的氨基的一个氢原子可被羟基(包括环烃及其衍生物)取代. 与2,4-二硝基氟苯(DNFB,FDNB)反应 最早Sanger用来鉴定多肽或蛋白质的氨基末端的Aa 与苯异硫氰酸酯(PITC)的反应 Edman用于鉴定多肽或蛋白质的N末端Aa.在多肽和蛋白 质的Aa顺序分析方面占有重要地位( Edman降解法)形成西佛碱反应 Aa的α-NH2能与醛类化合物反应生成弱碱,即西佛碱(schiff ‘s base) 前述甲醛滴定:甲醛与H2N-CH2-COO-结合,有效地减低了后者的浓 度,所以对于加入任何量的碱, [H2N-CH2-COO- ]/ [+H3N-CH2-COO- ] 的比值总要比不存在甲醛的情况下小得多。加入甲醛的甘氨酸溶液 用标准盐酸滴定时,滴定曲线B并不发生改变。 脱氨基反应 Aa在生物体内经Aa氧化酶催化即脱去α-NH2而转变成酮酸 α-COOH参加的反应 成盐和成酯反应 Aa + 碱-→盐 Aa + NaOH -→氨基酸钠盐(重金属盐不溶于水) Aa-COOH + 醇-→酯 Aa+ EtOH ---→氨基酸乙酯的盐酸盐 当Aa的COOH变成甲酯,乙酯或钠盐后,COOH的化学反应性 能被掩蔽或者说COOH被保护,NH2的化学性能得到了加强或 活化,易与酰基结合。Aa酯是制备Aa的酰氨or酰肼的中间 物 成酰氯反应 当氨基酸的氨基用适当的保护基保护以后,其羧基可与二氯亚砜作 用生成酰氯 用于多肽人工合成中的羧基激活 叠氮反应 氨基酸的氨基通过酰化保护后,羧基经酯化转变为甲酯,然后与肼 和亚硝酸变成叠氮化合物
有机化学10种反应类型 一、取代反应 定义:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应称为取代反应。在中学化学中,取代反应包括卤代、酯化、水解、硝化和磺化等很多具体的类型。 分例如下: 1、与卤素单质的取代------发生该类反应的有机物包括:烷烃、烯烃、芳香烃、醇、酚等。例如: 2、与混酸的硝化反应(苯及其同系物、苯酚、烷烃等均能发生硝化反应)。如: (3)注:环己烷对酸、碱比较稳定,与中等浓度的硝酸或混酸在低温下不发生反应,与稀硝酸在100℃以上的封管中发生硝化反应,生成硝基环己烷。在铂或钯催化下,350℃以上发生脱氢反应生成苯。环己烷与氧化铝、硫化钼、古、镍-铝一起于高温下发生异构化,生成甲基戌烷。与三氯化铝在温和条件下则异构化为甲基环戊烷。 低碳硝基烷的工业应用日益广泛。在使用原料上,以丙烷硝化来制取是合理的途径。在工艺方面,国外较多的是以硝酸为硝化剂的气相硝化工艺,已积累了较丰富的工业经验。有代表性的反应器则是多室斯登该尔反应器。国内迄今有关硝基烷的生产和应用研究均进行得不多,这是应该引起我们充分注意的。
3、与硫酸的磺化反应(苯、苯的衍生物,几乎均可磺化)。如: 4、羧酸和醇的酯化反应 5、水解反应(卤代烃、酯、多糖、二糖、蛋白质都能在一定条件下发生水解反应)。如: 6、与活泼金属的反应:(醇、酚、羧酸等均能与活泼金属如钠反应生成氢气)。如: 7、醇与卤化氢(H X)的反应。如: 8、羧酸或醇的分子间脱水。如:
二、加成反应 定义:有机物分子里不饱和碳原子跟其它原子或原子团直接结合生成化合物的反应叫加成反应。 在中学化学中,分子结构中含有“双键”或“叁键”的化合物均能发生加成反应。如烯烃、二烯烃、炔烃、苯及其同系物、醛、酮、不饱和高级脂肪酸及其甘油脂、单糖等。通常参与加成反应的无机试剂包括H2、X2(X为C l、B r、I)、H X、H2O、H C N等小分子(对称或不对称试剂)起加成反应。 说明:i.羧基和酯基中的碳氧双键不能发生加成反应。i i.醛、酮的羰基只能与H2发生加成反应。i i i.共轭二烯有两种不同的加成形式。 1、和氢气加成 2、和卤素加成 3、和卤化氢加成 4、和水加成 三、消去反应 定义:有机化合物在适当条件下,从一个分子相邻两个碳原子上脱去一个小分子(如:H2O、H X等)而生成不饱和(双键或叁键)化合物的反应称为消去反应,又称消除反应。 发生消去反应的化合物需具备以下两个条件: i.是连有一O H(或一X)的碳原子有相邻的碳原子;i i.是该相邻的碳原子上还必须连有H原子。中学里常见的两类有机物是醇和卤代烃。1、醇的消去反应
初中常见的化学式 (1)单质类 氢气氧气氮气 氯气溴碘氦 气氖气碳磷 硫硅 (2)金属单质 钠:镁:铝:钾: 钙:铁:锌:铜: 钡 : 银: 汞: 锰: (3)化合物类: 1、氧化物: 水: 过氧化氢: 一氧化碳: 二氧化碳: 二氧化氮: 二氧化硫: 三氧化硫: 氧化镁: 氧化铜: 氧化亚铁: 氧化铁: 四氧化铁: 氧化铝: 二氧化锰: 氧化镁: 氧化钠: 2、常见的酸类: 盐酸:硝酸:硫酸: 磷酸:碳酸:硫化氢: 3、常见的碱: 氢氧化钠:氢氧化铜:氢氧化铁 氢氧化亚铁:氢氧化钙:氢氧化钾:
氢氧化钡:氢氧化镁:氢氧化锌: 氢氧化铝: 4、盐类 硝酸钠:硝酸钾:硝酸铜: 硝酸铁:硝酸亚铁:硝酸钙: 硝酸钡:硝酸镁:硝酸锌: 硝酸铝:硝酸铵:碳酸钠: 碳酸钾:碳酸铜:碳酸钙: 碳酸锌:碳酸镁:碳酸铵: 硫酸钠:硫酸钾:硫酸铜: 硫酸铁:硫酸亚铁:硫酸钙: 硫酸钡:硫酸锌:硫酸镁: 硫酸铝:硫酸铵:氯酸钾: 氯化钠:氯化铵:氯化铁: 氯化亚铁:氯化铜:氯化锌: 高锰酸钾:碳酸氢钠:碳酸氢铵:碱式碳酸铜: (4)常见有机物 甲烷:乙炔:甲醇: 乙醇:乙酸: (5)常见的化肥 尿素:硝酸铵:硫酸铵: 碳酸氢铵:氯化铵: (6)常见的结晶水合物 碱式碳酸铜:明矾:
蓝矾: 常见的化学反应现象及其反应方程式 两种物质生成另一种物质的反应) 燃烧:(1)在空气中燃烧:发出,放出,。 (2)在氧气中燃烧:发出,放出。 共同点:都能生成使变浑浊的气体是:。 反应方程式:(1)充分燃烧: (2)不充分燃烧: 2、硫燃烧:(1)在空气中燃烧:发出微弱的火焰,生成 的气体。这气体是。放出,。 (2)在氧气中燃烧:发出火焰,生成 的气体。这气体是。放出。 反应方程式:。 3、磷在氧气中燃烧:产生大量的,这白是:。 放出。(注:是白烟而不是白雾,白烟是固体,雾是液 体) 反应方程式:。 4、铁在氧气中燃烧(铁在空气中不能燃烧)现象:剧烈燃烧, ,生成黑色固体叫同时放出。
三、常见的有机化学反应类型: 1、取代反应:有机分子里的某些原子或原子团被其它原子或原子团所代替的反应,即原子或原子团“有进有出”。 常见取代反应: ①烷烃的卤代 ②苯的卤代、硝化、磺化 ③卤代烃的水解 ④醇和钠反应 ⑤醇分子间脱水 ⑥酚和浓溴水反应 ⑦羧酸和醇的酯化反应 ⑧ 酯的水解反应 发生取代反应的基/官能团 2、加成反应:有机分子里的不饱和碳原子跟其它原子或原子团直接结合成一种新有机物的反应,即原子或原子团“只进不出”。 目前学习到的不饱和碳原子主要存在于碳碳双键、碳碳三键、苯环、碳氧双键等基团中,发生加成反应的物质主要有烯烃、炔烃、芳香族化合物、醛等物质。其中烯、炔常见的加成物质是氢气、卤素单质、卤化氢和水。 醛常见的加成物质是氢气,而羧酸、酯、肽键中的碳氧双键一般不能加成。 3、消去反应:有机化合物在适当条件下,从一分子中脱去一个小分子(如水、卤化氢),而生成不饱和(含双链或叁键)化合物的反应,即原子或原子团“只出不进”。 能发生消去反应的有机物有:卤代烃、醇。 发生消去的结构要求:有机物分子中与官能团(—OH ,—X )相连碳原子的邻碳原子必须要有氢原子。 4、聚合反应 加聚反应:含有碳碳双链等的不饱和有机物,以加成的方式相互结合,生成高分子化合物的反应。发生加聚反应的有烯烃以及它们的衍生物如:丙烯酸、甲基丙烯酸甲酯等。 缩聚反应:单体间的相互反应生成高分子,同时还生成小分子副产物(如H 2O 、 有机物 无机物/有机物 反应名称 烷,芳烃,酚 X 2 卤代反应 苯的同系物 HNO 3 硝化反应 苯的同系物 H 2SO 4 磺化反应 醇 醇 脱水反应 醇 HX 取代反应 酸 醇 酯化反应 酯 醇 酯交换反应 酯/卤代烃 酸溶液或碱溶液 水解反应 二糖、多糖 H 2O 水解反应 蛋白质 H 2O 水解反应 羧 酸 盐 碱石灰 脱羧反应
常见的有机反应机理 Arbuzov 反应 亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷: 卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。 本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得: 如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则 Arbuzov 反应如下: 这是制备烷基膦酸酯的常用方法。 除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如: 反应机理 一般认为是按 S N2 进行的分子内重排反应: 反应实例
Arndt-Eister 反应 酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。 反应机理 重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。 反应实例 Baeyer----Villiger 反应 反应机理 过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。因此,这是一个重排反应 具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:
不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为: 醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。 反应实例 酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。这类氧化剂的特点是反应速率快,反应温度一般在 10~40℃之间,产率高。 Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。