
1. Arndt -Eistert 反应
醛、酮与重氮甲烷反应,失去氮并重排成多一个CH 2基的相应羰基化合物,这个反应对于环酮的扩环反应很重要。 2. Baeyer -Villiger 氧化
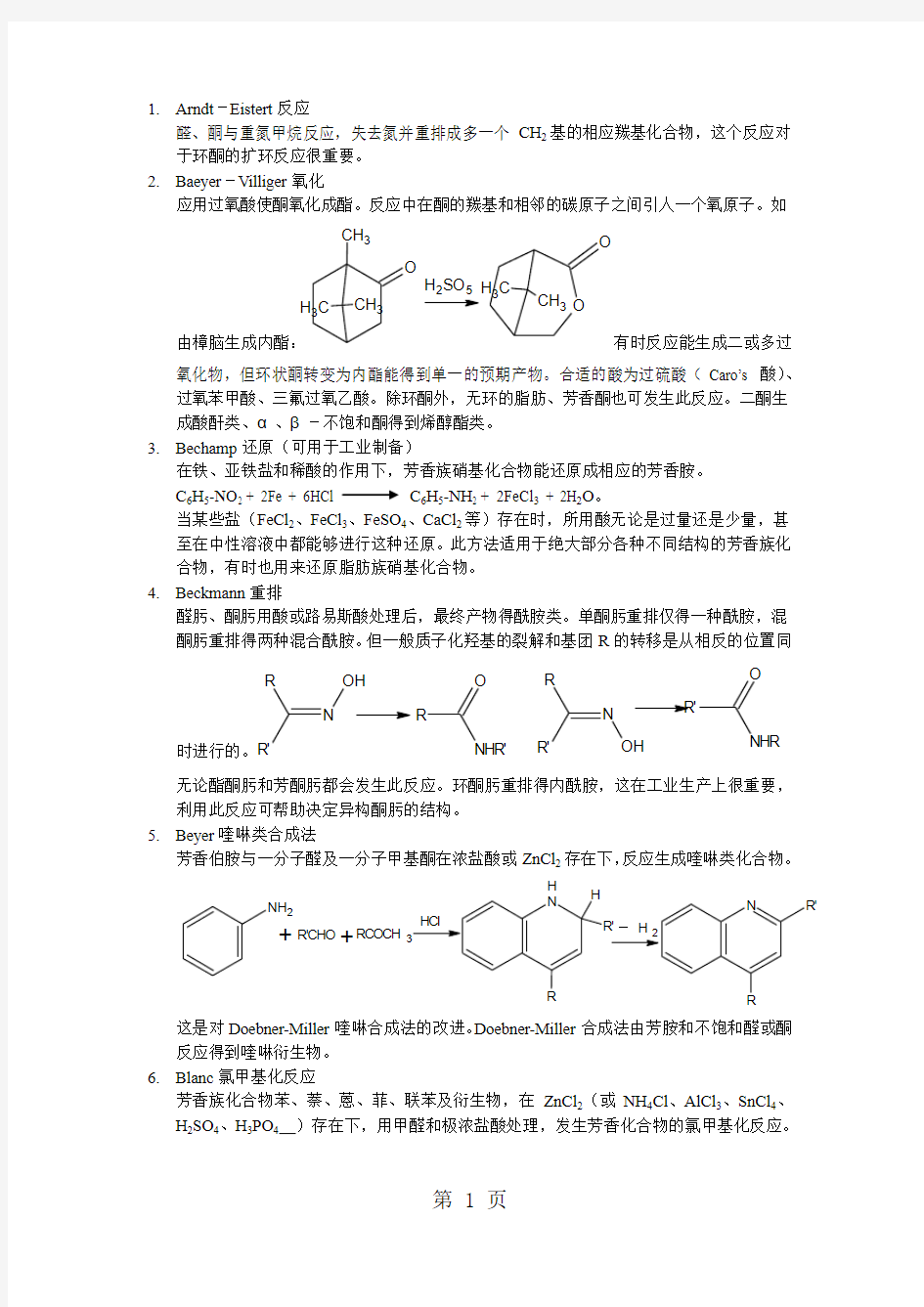
应用过氧酸使酮氧化成酯。反应中在酮的羰基和相邻的碳原子之间引人一个氧原子。如
由樟脑生成内酯:O
CH 3
C
H 3CH 3
O
O
C
H 3CH 3H SO 有时反应能生成二或多过
氧化物,但环状酮转变为内酯能得到单一的预期产物。合适的酸为过硫酸(Caro’s 酸)、过氧苯甲酸、三氟过氧乙酸。除环酮外,无环的脂肪、芳香酮也可发生此反应。二酮生成酸酐类、α、β-不饱和酮得到烯醇酯类。 3. Bechamp 还原(可用于工业制备)
在铁、亚铁盐和稀酸的作用下,芳香族硝基化合物能还原成相应的芳香胺。 C 6H 5-NO 2
+ 2Fe + 6HCl C 6H 5-NH 2 + 2FeCl 3 + 2H 2O 。
当某些盐(FeCl 2、FeCl 3、FeSO 4、CaCl 2等)存在时,所用酸无论是过量还是少量,甚至在中性溶液中都能够进行这种还原。此方法适用于绝大部分各种不同结构的芳香族化合物,有时也用来还原脂肪族硝基化合物。 4. Beckmann 重排
醛肟、酮肟用酸或路易斯酸处理后,最终产物得酰胺类。单酮肟重排仅得一种酰胺,混酮肟重排得两种混合酰胺。但一般质子化羟基的裂解和基团R 的转移是从相反的位置同
时进行的。OH
R'
R
R
NHR'
O
N R'
R
R'
NHR O
无论酯酮肟和芳酮肟都会发生此反应。环酮肟重排得内酰胺,这在工业生产上很重要,利用此反应可帮助决定异构酮肟的结构。 5. Beyer 喹啉类合成法
芳香伯胺与一分子醛及一分子甲基酮在浓盐酸或ZnCl 2存在下,反应生成喹啉类化合物。
NH 2
H
+
+
R'CHO
RCOCH
这是对Doebner-Miller 喹啉合成法的改进。Doebner-Miller 合成法由芳胺和不饱和醛或酮反应得到喹啉衍生物。 6. Blanc 氯甲基化反应
芳香族化合物苯、萘、蒽、菲、联苯及衍生物,在ZnCl 2(或NH 4Cl 、AlCl 3、SnCl 4、H 2SO 4、H 3PO 4 )存在下,用甲醛和极浓盐酸处理,发生芳香化合物的氯甲基化反应。
+++HCHO HCl
ZnCl 2
H 2O
CH 2Cl
对于取代烃类,取代基
的性质对反应能力影响很 亲电取代,烷基,烷氧基一般使反应速度增加,而卤素、
羧基特别是硝基 用乙醛得到氯乙基化。在某些情况下用相应当醛可有氯丙基 代替HCl ,溴甲基化以及在特殊情况下的碘甲基化都可发生。氯甲基化试剂除HCHO/HCl 外,也可用H 2C(OMe)2/HCl 或MeOCH 2Cl 来代替。这个反应在有机合成上甚为重要,因导入氯甲基后进一步可转化为-CH 2OH,-CHO,-CH 2CN,-CH 2NH 2及-CH 3等基团。 7. Bouvealt 合成法
N,N-二烷基甲酰胺与一分子格氏试剂在干醚的存在下发生作用,生成的中间产物再经水解,可得醛类化合物,R’MgX 中R’基团越大,醛的产率越高。 8. Bouvealt -Blanc 还原法
酯用金属钠和乙醇还原得到伯醇,脂肪酸酯类易被还原,α、β-不饱和酯类产生相应
的饱和醇类。R 'O
C 2H 5OH
Na RCH 2OH R'OH
+
常用乙醇作溶剂,但要维持较高沸点,
可用丁醇。也可用LiAlH 4来还原。
9. Bucherer 反应
在亚硫酸盐或酸式亚硫酸盐水溶液存在下,萘、酚、萘胺中的羟基在加热加压时,能发生可逆的交换作用。
10. Cannizzaro 反应(见P291-292) 11. Chichibabin 吡啶类合成法
醛、酮类与氨或胺类在Al 2O 3等催化剂存在下,加压加热,脱氢脱水,生成吡啶类化合
物。
N
CH 3
3CH 3CHO
+++NH 3
3H 2O H 2
此法不易得纯产物,
还有其他化合物生成。 12. Chichibabin 对称合成法
碳酸二乙酯与三分子格氏试剂反应,中间产物经水解得到对称叔醇类。
H 5C 2O
2H 5
O
+3RM gX
R
OH
R
如果格氏试剂用量不足,与一分
子RMgX 反应生成酸,与二分子RMgX 反应生成酮。 13. Chichibabin 胺化反应
含氮杂环碱类,如吡啶,喹啉或其衍生物与金属胺基化物在一起加热,则起胺化反应,生成氨基衍生物。产率一般为50%~100%。
N
N
NHNa
N
NH 2
NaNH 2 溶剂
105- 110℃, 66- 76%H 2O 水解
反应中副产物很多:4-氨基吡啶,2,6-二氨基吡啶,2,4,6-三氨基吡啶,2,2’-联吡啶等。产物随温度、溶剂性质、氨基钠用量而异。Bechamp 还原法不适用于制备氨基吡啶类,因为吡啶类在一般情况下很难硝化,所以此反应是吡啶环中直接引入氨基的有效方法。
14. Chugaev 反应
该反应制备烯烃类。黄原酸酯在120~200℃时热解,顺利产生烯烃,相应 醇和氧硫化碳。黄原酸酯在热解前制备不须离析 除黄原酸酯外,其他的酯氨基甲酸酯,碳酸酯和羧酸酯 热解。特别是使用大分子量的羧酸酯(棕榈酸酯)的烯烃提供了有利条件。因为这些酯本身沸点高,而热解温度较低(约300℃),在液相中简单加热即可。 15. Claisen 重排
烯醇或酚类的烯丙醚在加热时,易起重排反应。烯丙基由氧原子上转移到碳原子上,这与弗利斯重排有相似之处。
CH 2CH=CH
2
OH
OC H 2CH=CH
2
200℃
OC H 2CH=CH
2
OH
CH 2CH=CH
2
200℃
;
Cl
OC H 2CH=CH
2
OH
CH 2CH=CH
2
250℃
醚分子中,
如临位未被取代则不起重排反应,产生复杂的热分解作用。此反应是在苯环引入丙基的简易方法,因为烯丙基可还原成丙基。 16. Claisen 缩合反应(P352~354) 17. Claisen -Schmidt 反应(P287) 18. Clemmensen 还原(P291) 19. Cope 消除反应
这个反应是由氧化叔胺消除羟胺来产生烯烃。反应在低温进行且产量较高,当加热到120℃时,具有光学活性的纯氧化叔胺1-(N,N-二甲氨基)-3-苯基丁烷就得到具有旋光性的纯3-苯基丁烯-1,而且总是定量进行。 20. Criegee 氧化法
乙二醇类在稀醋酸或苯溶液中,室温时用四乙酸铅进行很温和的氧化,两个相连的各带有游离羟基的碳原子之间的碳链就断裂,得到定量的醛酮类。此法用于研究醇类结构及制备醛酮类且产率很高。 21. Curtius 降解
库尔修斯降解是羧酸的迭氮化合物经加热脱氮重排成异氰酸酯,再经水解得伯胺类。若反应在惰性溶剂中进行,可以得到异氰酸酯,并能将它分离出来。
22.Darzens-Claisen反应
在无水惰性溶剂中,在碱性缩合剂的作用下,酸性强的α-卤代脂肪酸酯作为亚甲基部分和醛、酮反应,首先生成氯代醇酸酯,随即裂解放出氯化氢得到2,3-环氧酸酯,其再经水解脱羧便得到醛:
O
+H2C
Cl
C
OH
H
C
Cl
COOR
-HCl
C CH
COOR C CH
COOH
CH CHO
-CO2
除α-氯代酸酯外,其他的C-H酸性化合物如邻和对硝基甲苯,环戊二烯等也能作为亚甲基部分与醛、酮反应。无水惰性溶剂为醚、苯或二甲苯。醛、酮可以是脂肪族、芳香族,也可以是α、β-不饱和醛酮,此反应对于形成C-C键的制备上很重要。23.Delepine反应
六亚甲基四胺与卤代烷反应,生成季胺盐。在稀酸作用下,其水解为伯胺。
C6H12N4 + RCH2[ RCH2-NC6H12N3 ] I
3HCl, C
2
H5OH
22
-NH3I + 6HCHO + 3NH4Cl
RCH2-NH2NH2
溶剂为氯仿。卤代烷的反应活性为:RI>RBr>RCl,水解用95%乙醇和稀盐酸,最后能得到纯伯胺。
24.Dieckmann缩合
含有δ或ε位活泼亚甲基的二羧酸二酯在碱性催化剂存在下,分子内起“Claisen缩合”
反应,环化成β-酮酸酯类,其再经水解、脱羧而生成环酮类,当n=2,3时收率最高,高级二羧酸酯的缩合产率很低。
25.Diels-Alder反应P83-84
26.Etard反应
具有侧链的芳烃,特别是甲基芳烃,在CS2中用二分子铬酰氯氧化,中间产物经水解得
芳醛。CH3CHO
CrO2Cl2
如果分子中有多个甲基,只可氧
化一个,这是本反应的特征。
27.Favorskii重排
α-卤代酮用碱处理,消除卤素重排得羧酸:
X-CH2-COR + NaOH2-COOH + NaX环状α-卤代酮也可得到羧酸,
同时缩环:
O H
H COOH
NaOH -NaC l 环氧醚类和羟基缩酮类为副产
物。在此条件下,二卤代酮也可发生重排,产生α、β-不饱和酸 28. Feist -Benary 合成法
此法用来合成呋喃类化合物,在吡啶或氨存在下,α-氯化羰基化合物或α,β-氯醚类与1,3-二羰基化合物发生缩合反应,生成呋喃类化合物。 29. Fischer 吲哚类合成法
醛和酮的苯腙类与ZnCl 2一起加热,发生重排,分子内缩合,脱氨环化等作用,最后生成吲哚类化合物。
N H
CH H 2C
R HC
R 2C
CH R C R
大量脂肪醛酮和醛酸、酮酸及其酯的芳腙都能发生这个反应。但用这个方法,由乙醛的苯腙不能制得吲哚。通常,β-酮酯的苯腙的能得到吡唑啉酮。ZnCl 2、CuCl 和溴代物或其他重金属卤代物,H 2SO 4、HCl-酒精溶液或冰醋酸都可用作催化剂。 30. Friedel -Crafts 酰基化反应P276, P131-132 31. Friedel -Crafts 烷基化反应P130-131
芳烃与烷基卤试剂在路易斯酸存在下,生成烷基芳烃。
RCl
+AlCl 3
R
+HCl
烷基化试剂除卤代烷外,醇类、烯烃、甲
苯磺酸烷基酯亦可。各种路易斯酸的催化效应:AlCl 3>FeCl 3> SbCl 5>SnCl 4>BF 3>TiCl 4>ZnCl 2。醇类至少需1mol 路易斯酸作催化剂。因为反应中生成的水使等摩尔的催化剂失去活性,对于卤代烷和烯烃来说,催化量就已足够。酚类的反应较令人满意(P258~259),而低碱度的芳烃如硝基苯、吡啶都不能反应。 32. Fries 重排
在当量数AlCl 3存在下,加热脂肪或芳香羧酸苯基酯,酰基发生重排反应,脂肪酸苯基酯比芳香酸苯基酯更易进行。根据反应条件,重排可以到邻位,也可以到对位。在低温(100℃以下)时主要形成对位产物,在高温时一般得到邻位产物。
催化剂除AlCl 3外,也可用BF 3、ZnCl 2、FeCl 3。催化剂不同,生成邻、对位异构体的比例也不同。用硝基苯作溶剂有利于重排,可在低温时进行。氯苯、CS 2、CCl 4可用作溶剂。但没有溶剂反应也可以进行。原料结构影响异构体的相对比例。此反应对于合成酰基酚类很重要。
33. Gabriel 氨基酸合成法P454
邻苯二甲酰亚胺钾与α-卤代脂肪酸作用,生成物经水解得到氨基酸。
34.Gabriel伯胺合成法P372-373
35.Gattermann醛类合成法
酚类或酚醚类与无水HCN和HCl混合物在无水AlCl3或ZnCl2存在下发生反应,生成的中间物经水解,醛基便导入羟基、烷氧基的邻位或对位。
Gattermann合成法不仅适用于酚类和酚醚类,也适用于某些杂环化合物,如呋喃、吡咯和吲哚的衍生物(但未经取代的不能反应),也适用于噻吩。醛基总是优先进入活化基团的对位,具有明显的选择性,只有对位被占据才发生邻位取代。
36.Gattermann-Adams合成法
这是Gattermann醛类合成法的改进。由盐酸作用于Zn(CN)2,从而释放出HCN,避免使用无水氰化氢。
37.Gattermann-Koch合成法P276
38.Grignard反应P185-186
39.Hantzsch吡咯类合成法
在氨或伯胺类作用下,α-卤代甲基酮和乙酰乙酸乙酯进行环化反应,再消除HCl和H2O,产生吡咯羧酸酯。
40.Hantzsch吡啶类合成法
CH2 ROOC
H3C R'
O
H
H
N
H
H
COOR
CH2
CH3
O
COOR
CH
3
C NH2
R'H
COOR
O CH3
N
H N
R'H
ROOC COOR
CH3 H3C
R'
ROOC COOR
CH3 H3C
2
++
+
乙酰乙酸酯和氨或伯胺及醛类反应,可得到二氢吡啶,其再用亚硝酸脱氢,产生吡啶类衍生物。此反应对吡啶类衍生物的合成是非常有用的。
41.Hinsberg反应P378
42.Hoesch合成法
这是Gattermann醛类合成法的改进。Hoesch用腈代替氢氰酸,便得到酮。
43.Hoffmann胺降解
胺类经过彻底甲基化后,生成季胺盐。其再经AgOH作用,生成相应的季胺氢氧化物。
将此在100~200℃时加热分解,产生叔胺、烯烃。反应中通过亲核羟基离子的作用,使带有最少数烷基的β-碳原子上失去一个质子而生成水,裂解出叔胺得到烯烃。
H3C
H2
C
H2
C
C
H2
3
CH3
H3C
2
C CH2H3C
CH3
CH2CH2CH3H2O
OH++
在各种取代的季胺化合物中,甲基比具有两个或多个碳原子的烷基有较大的韧性。因此一般不能被消除。对于没有β-者也不发生消除,而是取代。
(CH 3)4NOH 3)3N + CH 3OH 130~135℃
44. Hoffmann 烷基化反应
卤代烷与氨或胺的反应。反应最后产物是一个复杂的混合物。如果混合物的沸点有一点的差距,可用分馏的方法将其一一分离,这适用于工业上大规模的制备。
H
3N + RX H 3NR + X RNH 3 + NH RNH 2 + NH 4RNH 22NH 2 + X R 2NH 2 + NH 2NH + NH 4R 2NH + RX
3NH + X R 3NH + NH 3
R 3N + NH 4
也可利用原料摩尔比不同,控制反应温度、时间和其他条件,使其中某一个胺为主要产物。脂肪卤代烷的反应速度:RI>RBr>RCl 。仲、叔卤代烷易与氨作用失去一分子卤化氢成为烯。芳香卤代物一般不易与氨或胺发生反应,只有在高温高压及催化剂存在时或卤素的邻、对位有一个或多个强吸电子基团存在时,才可发生此反应。
C 6H 5Cl
NH C 6H 5NH 2
Cl
NO 2
NHC H
3
NO 2
+
+
CH 3NH 2
CU O, 200℃C H OH 此法可制备一级、二级、三级胺,但不易得到纯化合物。 45. Hoffmann 酰胺降解P339 46. Hoffmann 消除反应
仲烷基、叔烷基进行消除反应时,被消除对质子系来自带有最少烷基的β-碳原子上,产生的烯烃在其双键上具有最少数目的烷基。
这种消除叫Hofmann 消除或Hofmann 定向。这种烯烃叫Hofmann 烯烃。 47. Knoevenagel 反应P354 48. Kolbe 烃合成法
此法通过电解羧酸盐制备烷烃。一般使用高浓度羧酸钠盐,在中性或弱酸性溶液中进行电解。用铂电极于较高的分解电压和较低的温度下进行反应,阳极处产生烷烃和二氧化碳,阴极处产生NaOH 和H 2。羧酸原子数不宜太多或太少,最好在10个左右。
2CH 3COONa + 2H 22H 6 + 2CO 2 + 2NaOH + H 2如果用两种羧酸钠的混
合溶液进行反应,生成三种不同的烷烃,其性质相近,难以分离,故无制备意义。用二元羧酸酯盐的水溶液进行电解,可得到二元羧酸酯,这在制备上是可行的。H 2C
H 2C
COONa COONa
H 2C H 2C
H 2C COOR
H 2C
COOR
2
+ 2CO 2
49. Kolbe 腈合成法
碱性氰化物与卤代烷的无水醇溶液在一起加热,便生成腈。通常利用此反应合成多一个
碳原子的羧酸。RCN + NaX 反应中异腈为副产物,可由其特殊
气味识别。形成异腈的量取决于所用金属氰化物的性质。如AgCN 得到100%异腈,
CuCN :56%,Ca(CN)2:11%,Zn(CN)2:2.6%,用KCN 、NaCN 仅有少量的异腈产生。烷基化试剂反应速度:RI>RBr>RCl ,伯烷基>仲烷基,叔烷基易发生异构反应,一般不用。
50. Kolbe -Schmitt 反应
在绝对无水的情况下,干燥的CO 2和苯酚钠在压热器中加热180~200℃,生成大约25%水杨酸钠盐,其再酸化即得水杨酸。
ON a
ON a
COONa
OH
OH
COOH
H
+
CO 2
2
++
Schmitt 对此反应进行改良,在低温125℃、4~7atm 时反应,几乎可得理论量的水杨酸。 51. Kucherov 反应
乙炔在Hg 2+盐和稀硫酸存在下直接水合生成乙醛,单取代乙炔可生成甲基酮。
C
H CH
++H 2O
CH 3CHO
RC CH
Hg ++
/ H 2SO 4
Hg ++
/ H SO H 2O
RCOCH 3
52. Lebedeff 合成法
在高温下(400~500℃)乙醇与特种催化剂硅酸盐、Al 2O 3、ZnO 混合物作用,脱氢脱
水得1,3-丁二烯。
++2CH 3CH 2C
2CH 2
H 2H 2O
丁二烯的产
率大约为20%,其他副产物如戊烷、己烷、己烯、己二烯、丁醇、醛、酮都有,所以此反应制备意义不大。 53. Leuckart 反应
在甲酸(甲酰胺、甲酸铵)作还原剂的情况下,加热胺和羰基化合物,就发生胺的烷基
化反应。
R
NH '
O
R '"
R "
N
R R '
'"
R "++++H C OOH
C O 2H 2O
通过
这种反应可使伯胺、仲胺及氨发生烷基化反应,但以叔胺为最妥。因为伯胺、仲胺总是
有多烷基化副产物形成。特别是很活泼的甲醛,同时总是生成完全甲基化的胺。高沸点芳香醛和酮产物为40~90%,低分子量脂肪醛和酮不能得到满意大结果。反应中由少量MgSO 4或MgCl 2催化,起还原作用的甲酸经常是过量,每摩尔羰基化合物需2~4mol 甲酸。
54. Lieben 碘仿试验P289 55. Lossen 降解
氧肟酸或其酰基衍生物,在惰性溶剂或最好在亚硫酰氯、乙酸酐、P 2O 5存在下加热分解
而得到异氰酸酯。O
R
O
N
R
H OH +NH 2OH
=C =O
(Ac)
56. Mannich 反应
这是具有α-活泼氢化合物的胺甲基化反应。一般是甲醛与胺及具有α-活泼氢化合物
同时反应,胺甲基取代一个α-活泼氢:反应一般在水、醇或醋酸溶液中进行。
N
H CH 3
CH 3
H 3CCOCH 2CH 2N
3
CH 3
2CH 2COCH 3C
CH 3
CH 3
CH 3COCH 3
++HCHO .HCl
NaOH
.HCl 甲醛可以是甲醛溶液、三聚或多聚甲醛,胺一般是仲胺盐酸盐,如二甲胺、六氢吡啶等等盐酸盐,反应中生成单一产物。伯胺或氨副产物多不常使用。此反应合成范围广,不但醛和酮的活泼氢可以进行反应,其他化合物如羧酸、酯、酚或其他杂环化合物(如噻吩、吡咯、吲哚等)的活泼氢也都可以,特别值得注意的是在合成体系及氨基酸方面的应用。
57. Meerwein -Ponndorf -Veriey 还原
醛、酮与醇镁或醇铝反应,醛酮被还原成醇,而醇盐则被氧化成相应的羰基化合物。
O R
O
R'
H
Al
O
R
R
H
Al O
R'
R'
+
_3
/3
3
+
反应中,醇盐与加入的醇处于平衡状态,当催化量的醇盐存在时,用醇作还原剂也可发生反应,醇铝溶于有机溶剂,在蒸馏时不被分解。它的螯合倾向较大,所以醇铝特别适合Meerwein -Ponndorf -V eriey 还原。仲醇盐比伯醇盐更好,产生的副反应当可能性更小。上式为平衡反应,要得到好的收率必须不断从平衡中出去由醇铝所生成的羰基化合物。丙酮易挥发,可以蒸出,使平衡破坏,促使反应向右移动,所以用异丙醇作还原剂。如果用乙醇作还原剂,最好用氮气流把生成的乙醛从反应混合物中带走。此反应特点:(1)双键(即使是与羰基共轭的双键)能够保留而不被还原;(2)硝基与卤素不被还原;(3)β-二羰基化合物通常不能进行此反应,因为会生成酸性较强的铝化物沉淀。 58. Meyer 合成法
卤代烷与金属亚硝酸盐反应,合成硝基烷。亚硝酸酯为副产物。用碘代甲烷、乙烷、正丙烷、异丙烷反应很顺利。但用高分子量卤代物容易发生副反应。伯、仲、叔烷基不同,
得到不同的主要产物:+R C H 2X
N aN O C H 2N O 2
N aX (主要产物硝基烷)
,
+
+
R 2CHX NaNO NaX
2CHONO (亚硝酸酯较多), ++
NaNO 2
NaX
R 3CONO R 3CX
(全为亚硝酸酯)。
59. Meyer -Schuster 重排
在酸性催化剂存在下,乙炔甲醇类重排成α、β-不饱和酮类。芳基取代的乙炔甲醇最
易重排:H 56
C C C 6H H 5C 6C CH H 5C 6
H 5C 6
C C 6H 5+
60. Michael 加成
在碱性催化剂(哌啶、二乙胺、NaOR 等)存在下,活泼酸性CH 2基与活泼碳碳双键(α、β-不饱和羰基化合物、酯、腈)发生亲核加成。
H 5C 6
CH
CH
COOR
5C 6
HC
CH 2COOR
COOR COOR
+
H 2C
COOR
COOR
H 5C 6
2COOH
CH 2COOH
活泼CH 2基化合物可用通式
R
A
B 来表示。其中A ,B 可以是-COOR 、-COR 、-
CN 、-CONH 2、―NO 2、―SO 2R 、―CHO 等。亚甲基越容易放出质子,就越容易发生加成反应。活泼碳碳双键化合物可用通式-RC =CH -来表示。R 为-COOR 、-COR 、-CN 、-CONH 2、―NO 2、―SO 2R 。乙炔类和醌类也可以发生这种反应。反应活性随双键极性增加而增大,在反应中常发生醇醛缩合和Claisen 缩合,使反应复杂。若使用相应的烯胺作为酸性亚甲基部分,反应中由碱性引起的副反应便可预先避免。 61. Nef 合成法
乙炔钠与羰基双键加成,水解即得乙炔醇类:
苯乙酮和苯基乙炔钠在醚溶液中作用能发生相似的反应。 62. Oppenauer 氧化P274
在叔丁醇铝存在下,伯、仲醇用过量的酮或醌类使之氧化成相应的醛或酮。
R
OH
++
(H 3C)2C [(CH )C-O]Al
(CH 3)2CHOH R O 常用的酮为丙
酮、2-丁酮、环己酮。在特殊情况下可同时加入适量的苯、甲苯或1,4-二氧六环作为稀
释剂,以减少生成物发生缩合反应的机会。本法也适用于氧化不饱和甾族醇类及由不饱和醇制备不饱和酮。 63. Pechmann 反应
在浓硫酸、AlCl 3、P 2O 5等脱水剂存在下,酚类与β-酮酸酯类进行缩合反应,产生香
豆素类。
O
H OH
OH
O
H OH
O
O
H O
3
O
O
H OH
3
O
O
CH
RO C O
H 3
+
CH COCH COOC H 225改变酚为酮酯的结构可以合成具有各种取代基地香豆素类。取代基可以在苯环上、杂环上,也可同时在二者之上。酚间位有给电子基团能加速缩合,相反,吸电子基团则减缓反应进行。
64. Perkin 脂环化合物合成法
在乙醇钠存在下,含有活泼亚甲基化合物与二卤代物反应,生成环状羧酸酯,再经水解、加热、脱羧即得环烷烃及其衍生物。
H 2C H 2C
Br
Br
H 2C
+除三元环外,也可制得四、五、六、七元环,产率高低取决于环的大小。 65. Perkin 反应
芳香醛和酸酐,在此酸的碱性盐存在下,发生醇醛缩合反应,生成α、β-不饱和羧酸。
C 6H 5-CH O
(CH 3CO)23C 6H 5-CH =CH-COOH
+除简单芳香醛外,某些取代
芳香杂环醛也可用作羰基组分。甚至二芳基、芳基烷基酮与强活性亚甲基化合物也能够反应。脂肪醛反应产率很低。酸酐的α-碳原子上有两个氢原子方可作为亚甲基组分。高分子量比低分子量酸酐好。 66. Prileschajew 反应
烯烃与有机过氧酸作用,发生双键的过氧化作用。最常用的氧化剂为过氧苯甲酸,过氧苯乙酸。通常反应在丙酮、乙醚。氯仿中进行。反应条件温和,对于制备很有用。
R R
O
R H
R H
OOH
O
COOH
O
CH
C
2+
+
CH 2=CH-C H=CH 反应活性:R 2C=CR 2>RHC=CR 2>R 2C=CH 2≈RCH=CHR>RCH=CH 2>H 2C=CH 2.羧基和羰基起相反作用。反应如在水溶液中进行,环氧化物将进一步水解成1,2-二醇类。 67. Prins 反应
在酸催化下,甲醛与烯烃加成,生成m -二噁烷类和1,3-二醇类。反应中也可生成不饱
和醇。C
H 3
CH CH 2C
H 3C 3CH 2CH 2CH 22
C H 3C
H 3+
2CH 2O, H
稀硫酸是最好的催化剂。
磷酸、BF 3也可用。叔基取代烯烃和不对称烯烃,如丙烯或1-丁烯最容易反应,m -二噁烷通过酸解可以转变成1,3-二醇类,再经脱水即可形成共轭二烯类。 68. Reformatsky 合成法P322 69. Reimer -Tiemann 合成法
在碱性水溶液中,苯酚与氯仿作用,产生邻、对位取代醛类。两种产物的比例取决于取代基和溶剂,如果在吡啶中进行,仅产生邻位醛,产率20~30%,很少超过50%。酚本
身可得到60%水杨醛。
OH
OH
CHO
CHC l
HO
+
苯环上有吸电
子取代基,如-SO 3H 、-CN 、-COOH 、-NO 2能使苯环钝化,产率大约降为25%。只有含有游离酚式羟基的化合物,才能转变成醛。溴仿、碘仿及三氯乙酸同氯仿一样,容易进行反应。此法产率虽低,但操作简单,仍为合成酚醛的重要方法。 70. Riley 氧化法
活泼甲基或亚甲基化合物用二氧化硒氧化,甲基或亚甲基被氧化成羰基。羧酸为进一步氧化副产物。溶剂为乙醇、冰醋酸、乙酸酐、苯、二甲苯等,活泼甲基、亚甲基化合物除一般醛、酮(R(H)COCH 3)外,酯环酮、杂环重键结构及稠环体系也可以。
RCH 2CHO
2
2
RCOCHO CH 3COCH
CH 3COCHO
SeO 2
本氧化剂具有选择性,广泛用于有机合成和有机物结构研究方面。 71. Rosenmund 还原
纯的芳香或脂肪类酰氯在Pa -BaSO 4催化剂存在下,常压氢化得到相应醛类。 RCOCl
RCHO
H 2(P d-BaSO 4)气相或液相
本法主要缺点是生成的醛类易进一步被还原成醇或烃类。
为了防止这个副反应的发生,在反应体系中可加入适量“抑制剂”,硫脲、异氰酸苯酯、喹啉-硫等最为适用。它既能防止副反应发生,又使酰氯的氢化不受到阻抑。本法广泛用于制备醛类,收率可达50~80%,有时达90%以上,但还原二酰氯制二元醛结果不好。在还原的化合物中,如有双键结构、硝基、卤素及酯基存在时不发生影响。但若有羟基存在,应预先酰化加以保护。 72. Rosenmund -Braun 芳腈合成法
芳香族溴化物和CuCN 在高温下反应,溴原子被氰基取代,生成芳腈类化合物。用稍过量的氰化物可获得极高产率的芳腈。加入少量的苄腈或CuSO 4能增进反应速度,对苯二
酚能抑制反应。Br
CN
CuBr
+
+
73. Sandmeyer 反应
芳香族重氮盐在亚铜盐催化剂存在下,重氮基(-N 2X )被-Br 、-Cl 、-CN 等置换,生成芳香族取代物。反应副产物为二苯基衍生物。由于铜阳离子只起给予或接受电子的作用,所以当用容易氧化或还原
N +
R
的取代基时便不需要使用亚铜盐作催化剂。如用碘化物阴离子时,碘离子本身即成为催化剂。此反应产率高,范围广。其重要性在于可以通过硝基使不能直接引入或不能引入预期位置的取代基到苯环上。 74. Saytzeff 消除反应
就仲烷基和叔烷基而言,消除反应可能按两种方向进行,导致双键位置不同的烯烃。双键上具有最多数目烷基的烯烃称为Saytzeff 烯烃。在Saytzeff 消除时,也有Hofmann 消除产物。一般来说,单分子消除反应主要产生Saytzeff 产物,如仲卤代烷和叔卤代烷以
C
C C C H X
H
C C C C H
C C C
C
H
αβ
βCH 3CH 2
CH 3
CH 3
OH
H 3C
C H
CH 3CH 3
CH 3CH 2
CH 2
CH 3
+87.5%
12.5%
15%H 2SO 4
2
甲苯磺酸酯作溶剂脱卤化氢,以及仲醇和叔醇的脱水反应。在双分子消除反应中,反应取向主要取决于α位和β-位上取代基地性质以及脱去基团X 的性质。一般规则是:容易消去的基团有利于Saytzeff 倾向。 75. Schiemann 反应
Schiemann 反应是芳环上导入氟原子的反应。反应分两步进行,首先,芳香伯胺制成氟硼酸重氮盐,然后将其干燥后在适当条件下加热分解,生成芳香族氟化物。
++++++++C 6H 5-NH
2
2HCl NaNO 2C 6H 5-N 2Cl
NaCl 2H 2O
HBF 4
C 6H 5N 24
HCl
C 6H 5-F
N 2BF 3
重氮化
C 6H 5-N 2Cl
C 6H 5N 2△
氟硼酸重氮盐极
为安定,在大量制备时无危险。它大都具有一定的分解温度,分解速度很容易控制。氟化物收率一般为65%,有时达80~90%。 76. Schmidt 反应
在苯中,含羰基的化合物能被叠氮酸降解。一元羧基降解为胺,在两个羧基之间具有一个以上亚甲基的二元酸得到二元胺,醛类产生腈和胺的甲酰基衍生物,酮产生酰胺。
RCOOH ++
+
++
+
++
+
+
HN H SO R-N H 2CO 2N 2HOOCC H 2CH 2COOH 2HN 32NCH 2CH 2NH 22CO 22N 2
RCH O RCN RNH CHO
RCOR RCONHR 24H 2SO 4H 2SO
4HN 3HN 3N 2
77. Schotten -Baumann 反应
在碱性化合物存在下,酰氯类使醇、酚等活泼氢化合物的酰化作用称为Schotten -
Baumann 反应。芳香酰氯一般不如脂肪酰氯活泼,不易发生反应,对于易水解的酰氯类不适用于此法。上述反应中,生成的苯甲酸酯(分子量较高者)一般稍溶于水,结晶良好,具有固定熔点,所以Schotten -Baumann 反应常用来分离、鉴定醇和酚。
C 6H 5COCl
++
+
++
+
NaCl H 2O +
+NaCl H 2O ++
NaCl H 2O +
+
NaCl H 2O NaOH NaOH NaOH NaOH C 6H 5COCl C 6H 5COCl C 6H 5COCl ROH A r OH RNH C 6H 5
COOR C 6H 5COOAr 6H 5CONHR 6H 5COSR
78. Skraup 反应
在浓硫酸和氧化剂(硝基苯、As 2O 5、Fe 2O 3、苦味酸等)的存在下,苯胺和甘油反应合
成喹啉。NH 2
2
CH CH
O
H
+
式中丙烯醛是甘油由硫酸脱水而形成的,所用苯胺只要邻位无取代基者均可进行此反应。苯胺和甲基乙烯基酮缩合,生成4-甲基喹啉。
NH 2
CH 2
CH C
O
+
此反应对于制备取代喹啉类应用范
围极其广泛。 79. Sommelet 反应
卤代烷和六次甲基四胺作用,生成的季胺盐不需分离,再用60%稀醇液水解,生成醛类。
RCH 2X + (CH 2)6N H 2O
△
3 + CH 3NH 2
C 6H 5CH 2X + (CH 2)6N 4
6H 5CHO + NH 3H 2
O
△
[RCH 2(CH 2)6N 4]X
6H 5CH 2(CH 2)6N 4]X
80. Stephen 合成法
将干燥的HCl 气体通入腈类及无水SnCl 2的干醚饱和溶液中,氰基还原得到醛。
RCH + HCl
SnCl 2
反应结果好坏取决于腈的结构,邻甲苯腈和邻硝基苯甲腈
得到相应醛的收率都很低。
81. Stobbe 缩合反应
在醇钠作用下,丁二酸酯与醛酮缩合,得到烷叉丁二酸酯。丙酮和丁二酸酯缩合,产生
异丙叉丁二酸单酯:H 3C
H 3O COOR H 2C
H 2C
C C
H 3H 3C
COOR
CH 2COOH
+
NaOR'
亚甲基组分为丁二酸二甲(乙,t -丁)酯及其芳基、烷基、烷叉基衍生物。羰基组分除醛、酮氰酮外,在某些情况下,α、β-不饱和醛和酮、酮酯及二苯基乙二酮也可应用。
82. Stvecker 氨基酸合成法
在氨存在下,无水HCN 与醛的羰基加成,生成的α-氨基腈再经水解,产生α-氨基酸,产率75%。为方便起见也可用NaCN 代替HCN ,此法的缺点是氰化物剧毒,而且许多醛类难以得到。 83. Thorpe 反应
在乙醇钠催化下,腈与活泼亚甲基化合物加成,生成亚胺化合物。如果一个分子内具有二个所需的官能团则发生环化反应。 84. Tollens 缩合
在Na 2CO 3或Ca(OH)2催化剂存在下,甲醛与含有α-H 的醛和酮反应,生成多元醇类。
HCHO + CH 3CHO + H 2O
2OH)4 + HCOOH 此反应实际上是醇醛缩
合与交叉Cannizzaro 反应的合并,利用此反应可制备多元醇类。 85. Ulmann 反应
芳基卤代物在高温下(100~360℃)用铜粉处理,发生二芳基缩合反应。反应活性:ArI>ArBr>ArCl 。碘化物特别适合。应用此法可制备对称和不对称二芳基类。
I
I
++
+Cu
CuI 2
为
调节反应,可用硝基苯、甲苯、苯或DMF 作溶剂。 86. Ultee 羟腈合成法
在微量KCN 存在下,低温(0℃)时,醛、酮与无水HCN 作用,产生羟腈化合物。
O R
R'
OH
CN R'
R
+ HCN
87. Urech 羟腈合成法
金属氰化物在乙酸存在下,生成的氰化氢与醛、酮的羰基起加成反应生成羟腈。
O R
R'
OH
R'
R
+ KCN + CH 3+ CH 3COOK
丙酮的羟腈
产物可得78%。利用此反应可制得氨基酸、羟基酸。 88. Vilsmeier 反应
芳香化合物、杂环化合物及活性烯烃化合物用取代甲酰胺和磷酰氯处理,发生甲酰化作用得到醛类。常用的甲酰化试剂为N -甲基甲酰替苯胺。但DMF 和甲酰哌啶也可应用。
N
CHO
CH 3
CH 3
3)2
N
+
P OC l
在某些情况下,可用光气来代替磷酰氯,如烷基苯胺用N -甲基甲酰替苯胺和磷酰氯等
克分子混合物处理,形成烷基氨基苯甲醛。该合成法应用范围较广,使用插烯的酰胺也可进行甲酰化,生成不饱和醛。常用溶剂为苯、氯苯和邻二氯苯,也可使用过量的DMF。
89.V olhard-Erdmann噻吩类合成法
丁二酸二钠盐衍生物在硫化磷的作用下,环化成噻吩类:此法可用来合成芳烷基噻吩,
并可控制取代位置,产率25~30%。
ON a
ON a
O
R
R'
R
R' P S
90.Wagner-Meerwein重排
此重排好像是片那酮重排的逆转。醇、卤代烷等进行消除反应时,位于季碳原子α-位的取代基(如羟基、卤素等)发生消除,同时烷基进行重排,生成Saytzeff烯烃。如仲
醇的脱水反应:
H
C CH3
OH
H3C
H3C
H3
H
C CH
H3C
3
C
H3
H
C CH3
CH3
H3C
H3
H3
H3C CH3
3
+
CH3-重排
-H+
91.Willaruson合成法P236~237
92.Willgerodt-Kindler反应
在高压下,烷基芳基酮被多硫化铵溶液氧化成碳原子数相同的ω-芳基烷基羧酸。
ArCO(CH2)nCH3(NH4)2Sx H2Ar(CH2)n+1COOH
++式中甲基被氧化成羧基,羰基被还原成次甲基。Rindler进行改良,不用加压,用硫磺和仲胺(一般是吗啉)
Ar C CH3
O
Ar
H2
C C NR2
S
Ar
H2
C C OH
O
+ H2S + R2NH S, R2NH2H
2
O
代替多硫化物溶液,此法甚为重要,特别是用于从芳基甲基酮制备芳基乙酸,因为所用原料很容易由傅氏酰基化制得。
93.Wittig反应P478~481
94.Wold-Ziegler反应
在CCl4中,不饱和化合物与N-溴代丁二酰亚胺一起加热,发生烯丙基溴代,而不发生
双键加成:C
H
C
H
H2
C N C
H
C
H
H
C
Br
+
N-溴代丁二酰亚胺是烯丙基型溴代的特种试剂。一般来说,亚甲基比甲基反应更快。
本法适用于含有孤立的或共轭双键的单烯烃类、脂肪和脂环烯烃类、异戊二烯衍生物,甾族化合物等。另外羰基化合物、芳环侧链及杂环化合物都可以烯丙基溴代。
95.Wolff-Kishner-黄鸣龙还原法P291
96.Wurtz合成法P185
97.Wurtz-Fittig反应P185
98.Ziegler环酮合成法
二腈类在高度稀释下,用N-甲基苯胺钠作缩合剂,发生环化形成大环环酮:
CN (CH2)n-1 CH2CN C
2
)n-1
NNa
CN
水解2
C
(CH2)n-1
HC
O
COOH
(CH2)n C=O
常用溶剂为乙醚、正丙醚、异丙醚。产率高低取决于环的大小:五、六、七元环可得100%,八元环产率较高,九、十元环产率很低,最后到十八元环时产率又较高。
99.Zincke反应
卤代酚用亚硝酸或亚硝酸盐与乙酸处理,酚羟基地邻位或对位溴原子(或碘原子)被硝基取代,发生硝化反应:
Br OH
Br Br
OH
NO2
++++ NaNO2CH3COOH CH3COOH NaBr
氟和氯不能被取代:Cl
OH
Br Cl
OH
NO2
假如邻位和对位都有溴原
子,则得到的是邻位和对位-硝基溴酚异构体。
100.Zincke-Suhl重排
在AlCl3存在下,四氯化碳与对甲酚加成,生成4-甲基-4-三氯甲基环己二烯-2,5-酮:若
O
H CH3
O
CH3
CCl3 ++
CCl4AlCl3
用CS2作溶剂,使用过量的AlCl3,产率为60%。
第三章有机化学知识点总结 有机化合物:含有碳元素的化合物。常有氢和氧,还含有氮、磷、硫、卤素等元素。【注意】(碳的氧化物、碳酸及其盐、碳的金属化合物是无机化合物)。烃:只含有碳和氢两种元素的有机物,甲烷是最简单的烃。 ) 2、物理性质:甲烷是一种没有颜色,没有气味的气体。密度比空气小,极难溶 于水。(可以用排水法和向下排空气法收集甲烷) 3、化学性质:通常情况下,甲烷比较稳定,与酸性高锰酸钾等强氧化剂不反应, 与强酸、强碱也不反应。但在一定条件下,甲烷也会发生某些反 应。 1)燃烧反应:CH4+2O2CO2+2H2O 。(纯净的甲烷在空气中安静地燃烧, 火焰呈淡蓝色) 2)取代反应:(有机化合物分子里的原子或原子团被其它原子或原子团所代替的反应) 甲烷与氯气的反应方程式 ①。 ②。。 ③。 ④。★(条件:光照) 五种产物(两种气体:一氯甲烷和氯化氢,其他三种均为液体) 甲烷与氯气取代反应实验现象:气体颜色逐渐变浅,试管壁有油状液滴出现,同时试管上方有白雾生成,试管内液面逐渐降低。 二、烷烃:(烃分子中碳原子之间都以碳碳单键结合成链状,剩余价键均与氢原子结合,使每个碳原子的化合价都达到“饱和”,这样的烃叫做饱和烃,也称为烷烃)。分子通式为C n H2n+2 1、烷烃的命名:烷烃碳原子数在十以内时,以甲、乙、丙、丁、戊、己、庚、辛、壬、癸依次代表碳原子数,其后加“烷”字,碳原子数在十以上时,以“汉字数字”代表。例如:十一烷。 2、烷烃的物理性质:常温下的状态(设碳原子数为n),当n ≤4 时为气态;随着碳原子数的增加,烷烃的熔沸点依次升高,烷烃的密度依次增大。 3. 烷烃的化学性质:
1.Arbuzov 反应 卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。 本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得: 一般认为是按 S N2 进行的分子内重排反应: 2.Arndt-Eister 反应 酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。 重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。 3.Baeyer----Villiger 反应
过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。因此,这是一个重排反应 具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排: 不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为: 4.Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
重要的反应 1.能使溴水(Br 2/H 2O )褪色的物质 (1)有机物① 通过加成反应使之褪色:含有 、—C ≡C —的不饱和化合物 ② 通过取代反应使之褪色:酚类 注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀。 ③ 通过氧化反应使之褪色:含有—CHO (醛基)的有机物(有水参加反应)注意:纯净的只含有—CHO (醛基)的有机物不能使溴的四氯化碳溶液褪色 ④ 通过萃取使之褪色:液态烷烃、环烷烃、苯及其同系物、饱和卤代烃、饱和酯 (2)无机物① 通过与碱发生歧化反应 3Br 2 + 6OH - == 5Br - + BrO 3- + 3H 2O 或Br 2 + 2OH - == Br - + BrO - + H 2O ② 与还原性物质发生氧化还原反应,如H 2S 、S 2-、SO 2、SO 32-、I -、Fe 2+ 2.能使酸性高锰酸钾溶液KMnO4/H+褪色的物质 1)有机物:含有、—C≡C —、—OH (较慢)、—CHO 的物质 苯环相连的侧链碳上有氢原子的苯的同系物 (但苯不反应) 2)无机物:与还原性物质发生氧化还原反应,如H 2S 、S 2-、SO 2、SO 32-、Br -、I -、Fe 2+ 3.与Na 反应的有机物:含有—OH 、—COOH 的有机物 与NaOH 反应的有机物:常温下,易与含有酚羟基... 、—COOH 的有机物反应 加热时,能与卤代烃、酯反应(取代反应) 与Na 2CO 3反应的有机物:含有酚. 羟基的有机物反应生成酚钠和NaHCO 3; 含有—COOH 的有机物反应生成羧酸钠,并放出CO 2气体; 含有—SO 3H 的有机物反应生成磺酸钠并放出CO 2气体。 与NaHCO 3反应的有机物:含有—COOH 、—SO 3H 的有机物反应生成羧酸钠、磺酸钠并放出等物质的量的CO 2气体。 4.既能与强酸,又能与强碱反应的物质 (1)2Al + 6H + == 2 Al 3+ + 3H 2↑ 2Al + 2OH - + 2H 2O == 2 AlO 2- + 3H 2↑ (2)Al 2O 3 + 6H + == 2 Al 3+ + 3H 2O Al 2O 3 + 2OH - == 2 AlO 2- + H 2O (3)Al(OH)3 + 3H + == Al 3+ + 3H 2O Al(OH)3 + OH - == AlO 2- + 2H 2O (4)弱酸的酸式盐,如NaHCO 3、NaHS 等等 NaHCO 3 + HCl == NaCl + CO 2↑ + H 2O NaHCO 3 + NaOH == Na 2CO 3 + H 2O NaHS + HCl == NaCl + H 2S ↑ NaHS + NaOH == Na 2S + H 2O (5)弱酸弱碱盐,如CH 3COONH 4、(NH 4)2S 等等 2CH 3COONH 4 + H 2SO 4 == (NH 4)2SO 4 + 2CH 3COOH CH 3COONH 4 + NaOH == CH 3COONa + NH 3↑+ H 2O (NH 4)2S + H 2SO 4 == (NH 4)2SO 4 + H 2S ↑ (NH 4)2S +2NaOH == Na 2S + 2NH 3↑+ 2H 2O (6)氨基酸,如甘氨酸等 H 2NCH 2COOH + HCl → HOOCCH 2NH 3Cl H 2NCH 2COOH + NaOH → H 2NCH 2COONa + H 2O (7)蛋白质分子中的肽链的链端或支链上仍有呈酸性的—COOH 和呈碱性的—NH 2,故蛋白质仍能与碱和酸反应。 5.银镜反应的有机物 (1)发生银镜反应的有机物:含有—CHO 的物质:醛、甲酸、甲酸盐、甲酸酯、还原性糖(葡萄糖、麦芽糖等) (2)银氨溶液[Ag(NH 3)2OH](多伦试剂)的配制: 向一定量2%的AgNO 3溶液中逐滴加入2%的稀氨水至刚刚产生的沉淀恰好完全溶解消失。 (3)反应条件:碱性、水浴加热....... 酸性条件下,则有Ag(NH 3)2+ + OH - + 3H + == Ag + + 2NH 4+ + H 2O 而被破坏。 (4)实验现象:①反应液由澄清变成灰黑色浑浊;②试管内壁有银白色金属析出 (5)有关反应方程式:AgNO 3 + NH 3·H 2O == AgOH↓ + NH 4NO 3 AgOH + 2NH 3·H 2O == Ag(NH 3)2OH + 2H 2O 银镜反应的一般通式: RCHO + 2Ag(NH 3)2OH 2 A g ↓+ RCOONH 4 + 3NH 3 + H 2O
化学:2.1有机化学反应类型教案
————————————————————————————————作者:————————————————————————————————日期:
有机化学反应类型教学案 课标研读: 1、根据有机化合物组成和结构的特点,认识加成、取代和消去反应; 2、学习有机化学研究的基本方法。 考纲解读: 1、了解加成、取代和消去反应; 2、运用科学的方法,初步了解化学变化规律。 教材分析: 有机化学反应的数目繁多,但其主要类型有加成反应、取代反应、消去反应等几种。认识这些有机化学反应的主要类型,将有助于学生深入学习研究有机化合物的性质和有机化学反应。本节课的知识是建立在《化学2(必修)》和本模块教材第一章第3节以烃为载体的具体反应事实,以及本模块教材第一章第2节有关有机化合物的结构讨论的基础上的。本节的理论知识和思想方法为后面三节有关烃的衍生物的性质的学习提供了很好的理论和方法平台。本节教材在全书中处于非常重要的地位,可谓本模块教材的学习枢纽。 教学重点、难点:对主要有机化学反应类型的特点的认识;根据有机化合物结构特点分析它能与何种试剂发生何种类型的反应生成何种产物。 学情分析: 通过对《化学2(必修)》第三章及本模块第一章的学习,已经对取代反应和加成反应有了初步的了解,对各类有机化合物的基本结构和各种官能团有了初步的认识。这些都为本节课的学习奠定了基础。 教学策略: 1、结合已经学习过的有机反应,根据有机化合物组成和结构的特点,认识加成、取代和消去反应,初步形成根据有机化合物结构特点分析它能与何种试剂发生何种类型的反应生成何种产物的思路,能够判断给定化学方程式的反应的类型,也能书写给定反应物和反应类型的反应的化学方程式。 2、分别从加(脱)氧、脱(加)氢和碳原子氧化数变化的角度来认识氧化反应(还原反应),并能够根据氧化数(给定)预测有机化合物能否发生氧化反应或还原反应。 3、从不同的视角来分析有机化学反应,了解研究有机化合物的化学性质的一般程序。教学计划: 第一课时:有机化学反应的主要类型 第二课时:有机化学中的氧化反应和还原反应 第三课时:典型题目训练,落实知识 导学提纲: 第一课时 课堂引入: 写出下列化学方程式,并注明化学反应类型。 乙烯与氯化氢反 应:; 丙烯通入溴的四氯化碳溶 液:; 乙炔通入溴的四氯化碳溶液: ;
有机化学 一、烯烃 1、卤化氢加成 (1) CH CH 2 R HX CH CH 3R X 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。 【机理】 CH 2 C H 3+ CH 3 C H 3X + CH 3 C H 3 +H + CH 2 +C 3X + C H 3X 主 次 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。 【注】碳正离子的重排 (2) CH CH 2 R CH 2CH 2 R Br HBr ROOR 【特点】反马氏规则 【机理】 自由基机理(略) 【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。 【本质】不对称烯烃加成时生成稳定的自由基中间体。 【例】 CH 2 C H 3Br CH CH 2Br C H 3CH + CH 3 C H 3HBr Br CH 3CH 2CH 2Br CH CH 3 C H 3 2、硼氢化—氧化 CH CH 2 R CH 2CH 2R OH 1)B 2H 62)H 2O 2/OH - 【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。 【机理】
2 C H3 3 H3 2 3 H3 2 CH CH2 C H3 2 CH CH=CH (CH3CH2CH2)3 - H3CH2CH2C 22 CH3 CH2 B O CH2CH2CH3 3 CH2CH2C 2 CH2CH3 +O H- O H B-OCH2CH2CH3 CH2CH2CH3 H3CH2CH2 B OCH2CH2CH3 CH2CH2CH3 2 CH2CH3 HOO- B(OCH2CH2CH3)3 B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO3 2 【例】 CH3 1)BH 3 2)H 2 O 2 /OH- CH3 H H OH 3、X2加成 C C Br 2 /CCl 4 C C Br Br 【机理】 C C C C Br Br C Br +C C Br O H2+ -H+ C C Br O H
常见有机反应的十大类型 1. 取代反应 有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。(1)卤代: (2)硝化: (3)磺化: (4)卤代烃水解: (5)酯水解: (6)羟基()取代: (7)分子间脱水:
2. 加成反应 有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。 (1)碳碳双键的加成: (2)碳碳三键的加成: (3)醛基的加成: (4)苯环的加成: 3. 加成聚合(加聚)反应 相对分子质量小的不饱和化合物聚合成相对分子质量大的高分子化合物的反应。 (1)丙烯加聚: (2)二烯烃加聚:
4. 缩合聚合(缩聚)反应 单体间相互反应而生成高分子化合物,同时还生成小分子(如水、氨、氯化氢等)的反应(又叫逐步聚合反应)。 (1)制酚醛树脂: (2)缩聚制酯: (3)氨基酸缩聚: 5. 消去反应 有机化合物在一定条件下,从一个分子中脱去一个小分子(如水、卤化氢等)而生成不饱和(含双键或三键)化合物的反应。 6. 氧化还原反应 在有机化学中,通常把有机物得氧或去氢的反应称为氧化反应;反之,加氢或去氧的反应称为还原反应。 (1)氧化反应:
(2)还原反应: 7. 酯化反应(亦是取代反应) 酸和醇起作用,生成酯和水的反应 8. 水解反应(亦是取代反应,其中卤代烃、酯的水解见取代反应部分) 化合物和水反应生成两种或多种物质的反应(有卤代烃、酯、酰胺、糖等)。 麦芽糖葡萄糖 9. 脱水反应(又叫碳化) 有机物分子脱去相当于水的组成的反应。
10. 裂化反应 在一定条件下,把相对分子质量大、沸点高的长链烃,断裂为相对分子质量小、沸点低的短链烃的反应。 (责任编辑:化学自习室)
1.A rndt-Eister 反应 酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。 反应机理 重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。 反应实例
2.Baeyer----Villiger 反应 反应机理 过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。因此,这是一个重排反应 具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排: 不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为: 醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。 反应实例
酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。 3.Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:
反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。 迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如: 反应实例
《有机化学基础》知识梳理 第三章烃的含氧衍生物 第一节醇酚 一、醇 1、定义和分类 定义:羟基与烃基或苯环侧链上的碳原子相连的化合物。 分类: (1)根据分子中所含羟基的数目,可以分为一元醇、二元醇和多元醇。 (2)根据烃基饱和与否,分为饱和醇与不饱和醇。 饱和一元醇通式:C n H2n+2O(n>=1) 2、命名 (1)将含有与羟基相连的碳原子的最长碳链作主链,根据碳原子数目称为某醇。 (2)从距离羟基最近的一端给主链上的碳原子依次编号定位。 (3)羟基的位置用阿拉伯数字表示,羟基的个数用“二”、“三”等表示。 如:(CH3)3CCH2OH 2,2-二甲基-1-丙醇 3、物理性质 (1)沸点:随着碳原子数和羟基数的增加而升高;醇的沸点高于相同碳原子数的卤代烃或相对分子质量相近的烷烃; (2)密度:比水小 (3)溶解性:甲醇、乙醇、乙二醇等可与水任意比混溶。一般地,随着醇分子中烃基碳原子数的增加,溶解度降低。 4、化学性质(以乙醇为例) (1)与金属反应 乙醇与钠反应较钠与水反应缓和,钠块在乙醇溶液下,有气泡冒出。 (2)酯化反应(取代反应) 在浓硫酸作催化剂并加热条件下与含氧酸发生酯化反应。是可逆反应。 反应原理:酸脱羟基醇脱氢 饱和碳酸钠溶液作用:中和乙酸;溶解乙醇;降低乙酸乙酯的溶解度。 浓硫酸作用:催化剂、吸水剂。 长导管作用:导气兼冷凝作用。导管末端不能伸入液面以下,以防止倒吸。 (3)氧化反应 ①燃烧:淡蓝色火焰 ②催化氧化反应:铜或银作催化剂,加热 结构要求:与羟基相连的碳原子上有氢原子。 反应原理:第一步反应2Cu+O2=(加热)2CuO 第二步反应CH3CH2OH+CuO→CH3CHO+H2O+Cu(该步反应机理为去氢氧化:羟基上的氢原子和与羟基相连碳原子上的一个氢原子脱去,与CUO中的O结合成H2O)总反应为:2 CH3CH2OH+O2→(Cu或Ag,加热)2 CH3CHO+2H2O) ③强氧化剂氧化:能被酸性高锰酸钾溶液或酸性重铬酸钾溶液氧化,最终生成乙酸。 说明:乙醇与酸性重铬酸钾的反应被应用于检验司机酒后驾车,现象为橙色变为绿色。 (4)取代反应 与浓氢溴酸混合加热发生取代反应,(可用浓硫酸和溴化钠代替HBr)。该反应用于制取
第一部分:烯烃 1. 2hv 2. 2 3.Br 4.2 5. 2 6. Cl -H O 7. ICl H ICl H 8. 9. CH 3CHCH CH 2 3 D 2 Pt 10. 11. 4 12. (1)OsO 4 吡啶 (2)NaHSO 3 (1) (2) 13. CF 3CO 3H H 3O + (1) (2) 14. CF 3CO 3H H 3O + (1) (2) 15. F 3C H 2SO 4 浓 H 2O 16. 17. HBr ROOR 18.
(1) (2)19. B 2H 6 H 2O 2/OH (1) (2) 20. O 3 Zn/H 2O 21. KMnO 4 + 22. CF CO H 23. CF CO H 24. CF CO H 第二部分:炔烃和二烯烃 1. Na NH 3(l) 2. H 2 Lindlar 3. H O HgSO 4/H 2SO 4 4. (1) B 2H 6 (2) H 2O 2/OH 5. HCN 6. (1) B 2H 6 (2) CH 3COOH - 7.3OH 3 C 2H 5ONa 8. 9. Br 10. 11. 12.H Lindlar KMnO 13. H 2
14. Br 3 15. Br 2 16.2 Cu Cl / NH Cl 17. 2NH 3(l) 25 18. 19. 2低温 20. 2 高 温 Br Cl 21. 22. CN CN + 23. COOCH 3 + H 3COOC 24. + 25.+ O O 26. (1)O 32 +Cl 2 27. 第三部分:脂环烃 NBS 1. 2. 2 Ni 3. HBr 4. (1)(2) H 2 SO 4 浓 H 2O
基础有机化学人名反应 第四章 狄尔斯–阿尔德反应(Diels–Alder reaction)(140) 1921年,狄尔斯和其研究生巴克(Back)研究偶氮二羧酸二乙酯(半个世纪后因光延反应而在有机合成中大放光芒的试剂)与胺发生的酯变胺的反应,当他们用2-萘胺做反应的时候,根据元素分析,得到的产物是一个加成物而不是期待的取代物。狄尔斯敏锐地意识到这个反应与十几年前阿尔布莱希特做过的古怪反应的共同之处。这使他开始以为产物是类似阿尔布莱希特提出的双键加成产物。狄尔斯很自然地仿造阿尔布莱希特用环戊二烯替代萘胺与偶氮二羧酸乙酯作用,结果又得到第三种加成物。通过计量加氢实验,狄尔斯发现加成物中只含有一个双键。如果产物的结构是如阿尔布莱希特提出的,那么势必要有两个双键才对。这个现象深深地吸引了狄尔斯,他与另一个研究生阿尔德一起提出了正确的双烯加成物的结构。1928年他们将结果发表。这标志着狄尔斯-阿德尔反应的正式发现。他们也因此获得1950年的诺贝尔化学奖。 含有一个活泼的双键或叁键的化合物(亲双烯体)与共轭二烯类化合物(双烯体)发生1,4-加成,生成六员环状化合物: 这个反应极易进行并且反应速度快,应用范围极广泛,是合成环状化合物的一个非常重要的方法。
带有吸电子取代基的亲双烯体和带有给电子取代基的双烯体对反应有利。常用的亲双烯体有: 下列基团也能作为亲双烯体发生反应: 常用的双烯体有: a.反应机理 这是一个协同反应,反应时,双烯体和亲双烯体彼此靠近,互相作用,形成一个环状过渡态,然后逐渐转化为产物分子:
反应是按顺式加成方式进行的,反应物原来的构型关系仍保留在环加成产物中。例如: 正常的Diels-Alder反应主要是由双烯体的HOMO(最高已占轨道)与亲双烯体的LUMO(最低未占轨道)发生作用。反应过程中,电子从双烯体的HOMO“流入”亲双烯体的LUMO。也有由双烯体的LUMO与亲双烯体的HOMO作用发生反应的。 b.反应实例
有机专题五——有机反应类型 1.取代反应 (1)定义:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。 (2)能发生取代反应的物质:烷烃、芳香烃、醇、酚、酯、羧酸、卤代烃。 (3)典型反应 2.加成反应
(1)定义:有机物分子里不饱和的碳原子跟其他原子或原子团直接结合生成别的物质。 (2)能发生加成反应的物质:烯烃、炔烃、苯及同系物、芳香烃、醛、酮、单糖、不饱和高级脂肪酸的甘油脂及不饱和烃的衍生物等。 (3)典型反应 3.加聚反应 (1)定义:通过加成聚合反应形成高分子化合物。 (2)特征: ①是含C=C双键或叁键物质的性质。 ②生成物只有高分子化合物,因此其组成与单体相同。
(3)能发生加聚反应的物质:烯、二烯、含C=C的其他类物质。 (4)典型反应 4.缩聚反应* (1)定义:通过缩合反应生成高分子化合物,同时还生成小分子(如H2O、NH3等)的反应。 (2)特征:有小分子生成,因此高分子化合物的组成与单体不同。 (3)能发生缩聚反应的物质 ①苯酚与甲醛 ②二元醇与二元酸 ③羟基羧酸 ④氨基酸 ⑤葡萄糖 (4)典型反应
5.加聚反应与缩聚反应的区别 (1)加聚反应与缩聚反应,虽是合成高分子化合物的两大反应,但区别很大。 (2)加聚反应是由不饱和的单体聚合成高分子的反应,其产物只有—种高分子化合物。 (3)参加缩聚反应的单体一般含有两种或两种以上能相互作用的官能团(两个或两个以上易断裂的共价键)的化合物,产物中除一种高分子化合物外,还生成有小分子。如H2O、HCl、NH3等。产物的组成与参加反应的任何一种单体均不相同。 (4)从反应机理上看,加聚反应是不饱和分子中的双键或叁键发生的,实质还是加成反应。所以,双键、叁键是发生加聚反应的内因。缩聚反应是通过单体中的官能团相互作用经缩合生成小分子,同时又聚合成大分子的双线反应。发生缩聚反应的内因是相互能作用的官能团(或较活动的原子)。 (5)发生加聚反应的单体不一定是一种物质,也可以是两种或两种以上。如丁苯橡胶就是由单体1,3-丁二烯和苯乙烯加聚而成,缩聚反应的单体不一定就是两种,也有一种的,如单糖缩聚成多糖、氨基酸缩聚成多肽,也可以是两种以上的。
《有机化学》(第四版)第三章-不饱和烃(习题答案)
第三章不饱和烃 思考题 习题3.1 写出含有六个碳原子的烯烃和炔烃的构造异构体的构造式。其中含有六个碳原子的烯烃,哪些有顺反异构?写出其顺反异构体的构型式(结构式)。(P69) 解:C6H12有13个构造异构体,其中4个有顺反异构体: CH2=CHCH2CH2CH2CH3CH3CH=CHCH2CH2CH3CH3CH2CH=CHCH2CH3 (Z,E) (Z,E) CH2=CCH2CH2CH3 CH3CH2=CHCHCH2CH3 CH3 CH2=CHCH2CHCH3 CH3 CH3C=CHCH2CH3 3CH3CH=CCH2CH3 CH3 CH3CH=CH2CHCH3 3 (Z,E) (Z,E) CH2=CHCCH3 CH3 CH3CH2=CCHCH3 CH3 CH3 CH3C=CCH3 CH3 CH3 CH22CH3 CH2CH3 C6H10有7个构造异构体: CH CCH2CH2CH2CH3CH3C CCH2CH2CH3CH3CH2C CCH2CH3 CH CCHCH2CH3 3CH CCH2CHCH3 3 CH CC(CH3)3CH3C CCHCH3 3 习题3.2 用衍生物命名法或系统命名法命名下列各化合物:(P74) (1) (CH3)2CHCH=CHCH(CH3)2对称二异丙基乙烯
or 2,5-二甲基-3-己烯 (2) (CH 3)2CHCH 2CH=CHCHCH 2CH 3 CH 3 1234567 8 2,6-二甲基-4-辛烯 (3) CH 3CH 2C CCH 2CH 3 1 2 3 45 6 二乙基乙炔 or 3-己炔 (4) CH 3CH 2C(CH 3)2C CH 1 2 3 4 5 3,3-二甲基-1-戊炔 (5) CH 2=CHCH 2C CH 12345 1-戊烯-4-炔 (6) HC C C=C CH=CH 2 CH 2CH 2CH 3CH 2CH 2CH 3 1 2 3 4 5 6 3,4-二丙基-1,3-己二烯 -5-炔 (7) CH 3 CH 3 2,3-二甲基环己烯 (8) CH 3CH 3 5,6-二甲基-1,3-环己二烯 习题3.3 用Z,E-命名法命名下列各化合物:(P74) (1) ↑C=C CH 2CH 3 H Cl Br ↑ (Z)-1-氯-1-溴 -1-丁烯 (2) ↓C=C F CH 3Cl CH 3 CH 2 ↑ (E)-2-氟-3-氯-2- 戊烯
有机化学十种反应类型详细小结 复习方法提示: 1、全面了解有机物所具有得反应类型有哪些?熟记相关名词,确保表达准确。 2、把握准每一类反应得概念,牢牢掌握反应中得结构变化特点。这就是分析判断得依据! 3、认识相似得同一种反应类型得“归属”关系,如取代反应可以包括什么?区分相近得不同反应类型在结构变化上得“差异”性及规律,如消去反应与氧化反应,加成反应与加聚反应等等。 以下概要回顾有机得五大反应,包括:取代反应、加成反应、消去反应、聚合反应(包括加聚反应与缩聚反应),以及氧化-还原反应。 一、取代反应 定义:有机物分子里得某些原子或原子团被其它原子或原子团所代替得反应称为取代反应。 在中学化学中,取代反应包括卤代、酯化、水解、硝化与磺化等很多具体得类型。分例如下: 1、与卤素单质得取代------发生该类反应得有机物包括:烷烃、烯烃、芳香烃、醇、酚等。例如: (1).(在适当得条件下,烷烃得取代反应就是可以逐步进行得,得到一系列得混合物)。 (2). (3).CH 2=C H-CH 3 + Cl 2CH 2=CH-CH 2-Cl + HCl (4). (5).+ 2HCl 2、与混酸得硝化反应(苯及其同系物、苯酚、烷烃等均能发生硝化反应)。如: (1). + HNO 2 -NO 2 + H 2O (2). (3). 环己烷对酸、碱比较稳定,与中等浓度得硝酸或混酸在低温下不发生反应,与稀硝酸在100℃以上得封管中发生硝化反应,生成硝基环己烷。在铂或钯催化下,350℃以上发生脱氢反应生成苯。环己烷与氧化铝、硫化钼、古、镍-铝一起于高温下发生异构化,生成甲基戌烷。与三氯化铝在温与条件下则异构化为甲基环戊烷。 低碳硝基烷得工业应用日益广泛。在使用原料上,以丙烷硝化来制取就是合理得途径。在工艺方面,国外较多得就是以硝酸为硝化剂得气相硝化工艺,已积累了较丰富得工业经验。有代表性得反应器则就是多室斯登该尔反应器。国内迄今有关硝基烷得生产与应用研究均进行得不多,这就是应该引起我们充分注意得。 (4).CH 3-CH 2-CH 3(气) + H NO 3(气) CH 3-CH2-CH 2-N O2 + H 2O 3、与硫酸得磺化反应(苯、苯得衍生物, 几乎均可磺化)。如: (1). (2). (邻、对位产物为主) 4、羧酸与醇得酯化反应 (1).羧酸与醇:CH 3COOH + CH 3CH 2OH CH 3C OOCH 2C H3 + H 2O + 浓硫酸 △ + 100℃ 浓硫酸 △ 光照
有机化学重要方程式汇总1.CH4与Cl2光照 2.实验室制CH2=CH2 3.CH2=CH2与H2O催化加成 4.CH2=CH2与HCl催化加成 5.CH2=CH2催化氧化制CH3CHO 6.氯乙烯制聚氯乙烯 7.苯乙烯加聚 8.1,3—丁二烯与Br2水加成(三种情况) 9.合成天然橡胶(聚2—甲基—1,3—丁二烯) 10.实验室制CH≡CH 11.CH≡CH与H2O催化加成(1︰1) 12.CH≡CH与HBr催化加成(1︰1、1︰2) 13.CH3C≡CH与HCl催化加成(1︰2 两种情况) 14.苯制溴苯 15.苯制硝基苯 16.甲苯与液Br2取代(Fe催化、光照两种情况)
17.甲苯与浓HNO3加热 18.对二甲苯与足量Cl2催化加成19.丁烷催化裂化 20.CH3CH2Br水解 21.CH3CH2Br消去 22.2,3—二溴丁烷消去 23.CH3CH2OH与Na反应 24.CH3CH2ONa溶于水 25.CH3CH2OH分子间脱水 26.CH3CH2OH催化氧化 27.CH3CH2OH与HBr共热 28.CH3CH(OH)CH2OH与Na反应29.CH3CH(OH)CH2OH分子间脱水成环30.CH3CH(OH)CH2OH催化氧化31.C6H5OH与Na反应 32.C6H5OH与NaOH溶液 33.C6H5OH与Na2CO3溶液反应34.C6H5ONa溶于水 35.CO2通入C6H5ONa溶液 36.C6H5OH与浓Br2水 37.CH3CHO催化氧化
38.CH3CHO的银镜反应 39.CH3CHO与新制Cu(OH)2悬浊液40.HCHO的银镜反应 41.HCHO与新制Cu(OH)2悬浊液42.OHCCHO的银镜反应 43.OHCCHO与新制Cu(OH)2悬浊液 44.CH3COOH与NaHCO3溶液45.HCOOH溶解鸡蛋壳 46.CH3COOH与CH3CH2OH酯化47.HNO3与CH3CH2OH酯化 48.CH3COOCH2CH3与NaOH溶液49.HCOOH与HOCH2CH2OH酯化(2︰1) 50.乙二酸与乙二醇酯化:(1)1︰1成链 (2)2︰1成链 (3)1︰2成链 (4)1︰1成环 (5)成聚酯 51.乳酸(1)两分子酯化成链 (2)两分子酯化成环
一、取代反应 定义:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应称为取代反应。在中学化学中,取代反应包括卤代、酯化、水解、硝化和磺化等很多具体的类型。 分例如下:1、与卤素单质的取代------发生该类反应的有机物包括:烷烃、烯烃、芳香烃、醇、酚等。例如: 2、与混酸的硝化反应(苯及其同系物、苯酚、烷烃等均能发生硝化反应)。如: (3)注:环己烷对酸、碱比较稳定,与中等浓度的硝酸或混酸在低温下不发生反应,与稀硝酸在100℃以上的封管中发生硝化反应,生成硝基环己烷。在铂或钯催化下,350℃以上发生脱氢反应生成苯。环己烷与氧化铝、硫化钼、古、镍-铝一起于高温下发生异构化,生成甲基戌烷。与三氯化铝在温和条件下则异构化为甲基环戊烷。 低碳硝基烷的工业应用日益广泛。在使用原料上,以丙烷硝化来制取是合理的途径。在工艺方面,国外较多的是以硝酸为硝化剂的气相硝化工艺,已积累了较丰富的工业经验。有代表性的反应器则是多室斯登该尔反应器。国内迄今有关硝基烷的生产和应用研究均进行得不多,这是应该引起我们充分注意的。 3、与硫酸的磺化反应(苯、苯的衍生物, 几乎均可磺化)。如:
4、羧酸和醇的酯化反应 5、水解反应(卤代烃、酯、多糖、二糖、蛋白质都能在一定条件下发生水解反应)。如: 6、与活泼金属的反应:(醇、酚、羧酸等均能与活泼金属如钠反应生成氢气)。如: 7、醇与卤化氢(HX)的反应。如: 8、羧酸或醇的分子间脱水。如:
二、加成反应定义:有机物分子里不饱和碳原子跟其它原子或原子团直接结合生成化合物的反应叫加成反应。 在中学化学中,分子结构中含有“双键”或“叁键”的化合物均能发生加成反应。如烯烃、二烯烃、炔烃、苯及其同系物、醛、酮、不饱和高级脂肪酸及其甘油脂、单糖等。通常参与加成反应的无机试剂包括H 2 、 X 2(X为Cl、Br、I)、HX、H 2 O、HCN等小分子(对称或不对称试剂) 起加成反应。 说明:i.羧基和酯基中的碳氧双键不能发生加成反应。 ii.醛、酮的羰基只能与H 2 发生加成反应。iii.共轭二烯有两种不同的加成形式。 1、和氢气加成 2、和卤素加成 3、和卤化氢加成 4、和水加成 三、消去反应定义:有机化合物在适当条件下,从一个分子相邻两个碳 原子上脱去一个小分子(如:H 2 O、HX等)而生成不饱和(双键或叁键)化合物的反应称为消去反应, 又称消除反应。 发生消去反应的化合物需具备以下两个条件: i.是连有一OH(或一X)的碳原子有相邻的碳原子;ii.是该相邻的碳原子上还必须连有H原子。中学里常见的两类有机物是醇和卤代烃。1、
★取代反应 烷:CH4+Cl2→(光)CH3Cl+HCl 苯:苯+Br2→(Fe)苯-Br+HBr(液溴) 苯+HO-NO2→(浓H2SO4;△)苯-NO2+H2O(硝化反应) 甲苯:苯-CH3+3HO-NO2→(浓H2SO4;△)三硝基甲苯(TNT)+3H2O 苯-CH3+Cl2→(光)苯-CH2Cl+HCl 醇:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ 卤代烃:CH3CH2Br+NaOH→(△)CH3CH2OH+NaBr(水解反应) 另有酯化,硫化,水解等 ★加成反应 烯:CH2=CH2+Br2→CH2BrCH2Br CH2=CH2+H2O→(催化剂;△)CH3CH2OH CH2=CH2+H2→(Ni)CH3CH3 炔:CH≡CH+2Br2→CHBr2CHBr2 苯:苯+3H2→(Ni)C6H6(环已烷) 苯+3Cl2→C6H6Cl6(六六六) 醛:CH3CHO+H2→(Ni;△)CH3CH2OH(加氢还原) 另有加聚 ★消去反应 卤代烃:CH3CH2Br+NaOH→(醇;△)CH2=CH2↑+NaBr+N2O 醇:CH3CH2OH→(浓H2SO4;△)CH2=CH2↑+H2O (乙醇为170℃,其它醇不用记) ★水解反应(取代反应)
卤代烃:CH3CH2Br+H2O→(NaOH)CH3CH2OH+HBr 酯:CH3COOC2H5+H2O(可逆;稀H2SO4;△)CH3COOH+C2H5OH 另有多糖二糖蛋白质的水解 ★氧化反应 1 燃烧:CxHyOz+(x+y/4-z/2)O2→(点燃)xCO2+y/2H2O (有机物燃烧通式) 2 催化反应 醇:2CH3CH2OH+O2→(Cu;△)2CH3CHO+2H2O CH3CH2OH+CuO→(△)CH3CHO+H2O+Cu 醛:2CH3CHO+O2→(催化剂;△)2CH3CHO 烯:2CH2=CH2+O2→(催化剂)2CH3CHO 烷:2CH3CH2CH2CH3+5O2→(催化剂)4CH3COOH+2H2O 3 被酸性KMnO4氧化 烯炔苯的同系物(与苯环相连的C上要有H)醇醛 4 与新制Cu(OH)2反应 醛:CH3CHO+2Cu(OH)2→(△)CH3COOH+Cu2O↓+2H2O 5 银镜反应 (1)甲醛甲醛过量时:HCHO+2[Ag(NH3)2]OH→(△)HCOONH4+2Ag↓+3NH3+H2O 银氨溶液过量:HCHO+4[Ag(NH3)2]OH→(△)(NH4)2CO3+4Ag↓+6NH3↑+2H2O (2)乙醛 CH3CHO+2[Ag(nh3)2]OH→(△)CH3COONH4+2Ag↓+3NH3+H2O 另有HCOOR(甲酸盐甲酯某酯)葡萄糖麦芽糖果糖 ★还原反应 1 加H2加成:醛:CH3CHO+H2→(Ni;△)CH3CH2OH
一、教学内容: 专题一重要有机化学反应类型 1、取代反应 ①定义:有机分子里的某些原子或原子团被其它原子或原子团所代替的反应叫取代反应。 ②能发生取代反应的物质:、苯、、苯酚、甲苯 ③典型反应 2、加成反应 ①定义:有机分子里不饱与的碳原子跟其它原子或原子团直接结合生成别的物质。加成反应就是不饱与键(主要为,)重要性质。 ②能发生加成反应的物质有:烯烃、炔烃、苯环、醛、酮、油脂等。 ③典型反应 (水溶液)(溴水褪色) (制取塑料用) (1,2加成) (1,4加成) (工业制乙醇) 3、加聚反应 ①本质:通过自身加成反应形成高分子化合物。 特征:生成物只有高分子化合物,且其组成与单体相同,如聚乙烯与乙烯的比相同。 ②能发生加聚反应的物质有:乙烯、丙烯、1,3—丁二烯、异戊二烯、氯乙烯等。 ③典型反应
塑料 天然橡胶 4、缩聚反应 ①定义:单体间通过缩合反应而生成高分子化合物,同时还生成小分子(如水、氨等)的 反应。 ②特征:有小分子生成,所以高分子化合物的组成与单体不同。 ③能发生缩聚反应的物质:苯酚与甲醛;葡萄糖,氨基酸,乙二醇与乙二酸等。 ④典型反应 (的确良) 5、消去反应 ①定义:从一个有机分子中脱去一个小分子(如水、卤化氢等分子),而生成不饱与(双 键或叁键)化合物的反应。 ②能发生消去反应的物质:某些醇与卤代烃。 ③典型反应 6、脱水反应 ①本质与类型:脱水反应就是含羟基的化合物非常可能具有的性质,通常就是两个羟 基之间可脱去一分子水,也可以就是一个羟基与另一个非羟基氢结合脱去一分子水。脱水可 以在一个分子内进行,也可在分子之间进行。 ②能脱水的物质有:醇、羧酸、蔗糖、氨基酸、无机含氧酸等。
第三章有机化合物知识点总结绝大多数含碳的化合物称为有机化合物,简称有机物。像CO、CO2、碳酸、碳酸盐、金属碳化物等少数化合物,它们属于无机化合物。 一、烃 1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。 2、甲烷、乙烯和苯的性质比较:
(聚乙烯)(溴苯)+ Br 2 FeBr 3 +HBr 反应条件:液溴(纯溴);FeBr 反应物必须是液溴,不能是溴水。+ HO -NO 2 浓H 2SO 455℃~60℃ -NO 2 + H 2O 反应条件:加热(水浴加热)、浓硫酸(作用:浓硫酸和浓硝酸的混合:将浓硫酸沿烧杯内壁慢慢倒入浓硝酸中,边加边搅拌+ 3H 2 Ni 4、同系物、同分异构体、同素异形体、同位素比较。同系物
1、乙醇和乙酸的性质比较 2CH 现象:红亮的铜丝在酒精灯上加热后变为 反应断键情况: ,作催化剂,反应前后质量保持不变。 乙醇可以使紫红色的酸性高锰酸钾溶液褪色,与之相似的物质有
CH 5 CH 酯化反应,属于取代反应;是可逆反应2 mL 中的液体发生暴沸,加热前应采取的措施是:加碎瓷片(或沸三、烷烃 1、烷烃的概念:碳原子间都以碳碳单键结合成链状,剩余价键均与氢原子结合,使每个碳原子的化合价都达到“饱和”的饱和链烃,或称烷烃。呈锯齿状。 2、烷烃物理性质: 状态:一般情况下,1-4个碳原子烷烃为气态,5-16个碳原子为液态,16个碳原子以上为固态。 溶解性:烷烃都难溶于水,易溶于有机溶剂。 熔沸点:随着碳原子数的递增,熔沸点逐渐逐渐升高;相同碳原子数时,支链越多,熔沸点越低。 密度:随着碳原子数的递增,密度逐渐增大,但都比水的密度小。 3、烷烃的化学性质 ①一般比较稳定,在通常情况下跟酸、碱和高锰酸钾等都不反应。②氧化反应:在点燃条件下,烷烃能燃烧;③取代反应(烷烃特征反应):在光照条件下能跟卤素发生取代反应。
Beckmann重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。 迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如: 反应实例
Cannizzaro 反应 凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇: 脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。 具有α-活泼氢原子的醛和甲醛首先发生羟醛缩合反应,得到无α-活泼氢原子的β-羟基醛,然后再与甲醛进行交叉Cannizzaro反应,如乙醛和甲醛反应得到季戊四醇: 反应机理 醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
反应实例 Claisen 酯缩合反应 含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。 二元羧酸酯的分子内酯缩合见Dieckmann缩合反应。 反应机理 乙酸乙酯的α-氢酸性很弱(pK a-24.5),而乙醇钠又是一个相对较弱的碱(乙醇的pK a~15.9),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。但由于最后产物乙酰乙酸乙酯是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝产物方向移动。所以,尽管反应体系中的乙酸乙酯负离子浓度很低,但一形成后,就不断地反应,结果反应还是可以顺利完成。