“热力学第一定律”教学设计金山中学高二物理张祥勇
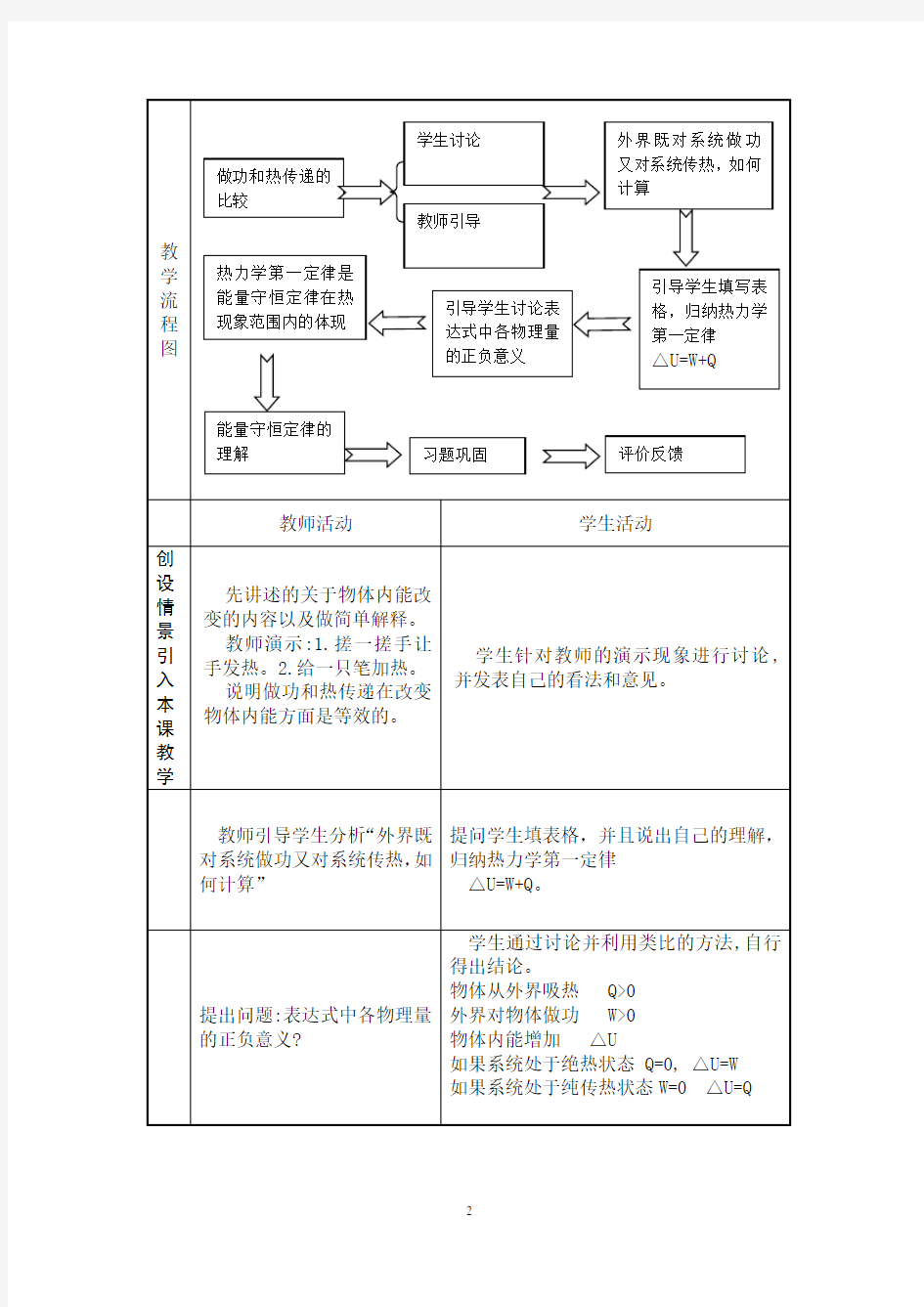
第2节热力学第一定律 一、改变物体内能的两种方式 1.改变内能的两种方式:做功和热传递。 2.做功:外力对物体做功,可以使物体的内能增加。 3.热传递:没有做功而使物体内能改变的物理过程。 4.做功和热传递对物体内能的改变是等效的,但本质不同。 二、热力学第一定律 1.定义:功、热量跟内能改变之间的定量关系。 2.数学表达式:ΔU=Q+W。 1.判断:(1)物体吸收热量,内能一定增大。() (2)物体对外做功,内能一定减小。() (3)物体吸收热量,同时对外做功,内能可能不变。() (4)物体放出热量,同时对外做功,内能可能不变。() 答案:(1)×(2)×(3)√(4)× 2.思考:运用所学物理知识分析古代人“钻木取火”的原理是什么? 提示:“钻木取火”即人对木头做功,使木头的内能增大,温度升高,当温度达到木头的着火点时,木头便开始燃烧,即利用做功的方式改变木头的内能。 1.
内能是由系统的状态决定的,状态确定,系统的内能也随之确定。要使系统的内能发生变化,可以通过热传递或做功两种方式来完成。热量是热传递过程中的特征物理量,和功一样,热量只是反映物体在状态变化过程中所迁移的能量,是用来衡量物体内能变化的。有过程,才有变化,离开过程则毫无意义。就某一状态而言,只有“内能”,不能谈到“热量”或“功”。 (1)内能是状态量,热量、功是过程量。 (2)热量、功、内能本质是不同的。 1.物体的内能增加了20 J,下列说法中正确的是() A.一定是外界对物体做了20 J的功 B.一定是物体吸收了20 J的热量 C.一定是物体分子动能增加了20 J D.物体分子的平均动能可能不变 解析:选D做功和热传递都可以改变物体内能,物体内能改变20 J,其方式是不确定的,因此A、B错误;物体内能包括所有分子的平均动能和分子势能,内能由分子数、分子平均动能、分子势能三者决定,故C错误。 1. (1)对ΔU=Q+W的理解:热力学第一定律将单纯的绝热过程和单纯的热传递过程中内能改变的定量表述推广到一般情况,既有做功又有热传递的过程,其中ΔU表示内能改变的数量,W表示做功的数量,Q表示外界与物体间传递的热量。 (2)与热力学第一定律相对应的符号法则:
热力学第一定律教案 LG GROUP system office room 【LGA16H-LGYY-LGUA8Q8-LGA162】
热力学第一定律 信丰县第六中学朱永辉教学目标 1、理解物体跟外界做功和热传递的过程中W、Q、△U的物理意义。 2、会确定W、Q、△U的正负号。 3、理解、掌握热力学第一定律,从能量转化和转移的观点理解热力学第一定律。 4、会用△U = W + Q分析和计算问题。 5、理解、掌握能量守恒定律及其重要性。 6、要有能量意识,会用能量守恒的观点分析、解决有关问题,明确它的优越性。 7、知道第一类永动机不可能成功的原因。 8、人类对自然规律的认识是不断深入的。 重点、难点分析 重点:能量守恒定律 难点:热力学第一定律△U = W + Q中各物理量的意义及正负号的确定,这对学生是很困难的,要用收入、支出和结存的观点去分析,要抓住研究对象。 另一难点是用能量守恒的观点去分析和解决问题,它的优越性是不管中间过程细节问题,要逐渐培养学生用能量观点解题。 课时安排:一课时 课前准备: 教师:柴油机模型、电动机、电炉子、灯泡、电池、打气筒、投影仪、胶片、多媒体 学生:电动玩具、利用机械能守恒定律制成的小玩具、植物标本(如玉米粒)教学设计(教学过程) 引入新课 我们在前面学习了改变内能的两种方式:做功和热传递,即通过对物体做功或者经过热传递的过程都能改变物体内能,那么它们之间有什么数量关系呢以前我们还学
习过电能、化学能等各中形式的能,它们在相互转化的过程中遵守什么样的规律呢今天我们就来研究这些问题。 板书:第六节热力学第一定律能量守恒定律 同学们带着下列问题看课本,看到△U = W + Q 板书:(投影片) 1、一个物体,如果它跟外界不发生热交换,那么外界对它做功与物体对外做功,会引起物体内能怎样的变化? 2、一个物体,如果外界与物体之间没有做功,那么物体吸热与放热会引起物体内能的怎样的变化? 3、如果物体跟外界同时发生做功和热传递的过程,W、Q、△U的正负号如何确定? 4、W、Q、△U三者都有正负,它们的关系怎样? 让同学们前后座四人为一小组,互相交流一下,得出正确结论。 让同学举手发言,代表自己小组发言,其他小组补充,老师给以适当点拨。 答案:(胶片给出) 1、外界对物体做功,物体的内能增加;物体对外界做功,物体的内能减少。 2、物体吸热,物体的内能增加;物体放热,物体的内能减少。 3、外界对物体做功W为正,物体对外做功W为负;物体吸热Q为正,物体放热Q 为负;物体内能增加△U为正,物体内能减少△U为负。 4、△U = W + Q 这就是热力学第一定律,它表示了功、热量跟内能改变之间的定量关系。 例:一定量的气体从外界吸收了×105J的热量,内能增加了×105J。是气体对外界做了功,还是外界对气体做了功做了多少焦耳的功如果气体吸收的热量仍为×105J 不变,但是内能只增加了×105J,这一过程做功情况怎样? 解:根据题意得出:
热力学第一定律及其思考 摘要:在19世纪早期,不少人沉迷于一种神秘机械——第一类永动机的制造,因为这种设想中的机械可以使系统不断的经历状态变化后又回到原来状态,而不消耗系统的内能,同时又不需要外界提供任何能量,但却可以不断地对外界做功。在热力学第一定律提出之前,人们经过无数次尝试后,所有的种种企图最后都以失败而告终。直至热力学第一定律发现后,第一类永动机的神话才不攻自破。本文就这一伟大的应用于生产生活多方面的定律的建立过程、具体表述、及生活中的应用——热机,进行简单展开。 关键字:内能;热力学;效率;热机 1.热力学第一定律的产生 1.1历史渊源与科学背景 火的发明和利用是人类支配自然力的伟大开端,是人类文明进步的里程碑。18世纪中期,苏格兰科学家布莱克等人提出了热质说。这种理论认为,热是由一种特殊的没有重量的流体物质,即热质(热素)所组成,并用以较圆满地解释了诸如由热传导从而导致热平衡、相变潜热和量热学等热现象,因而这种学说为当时一些著名科学家所接受,成为十八世纪热力学占统治地位的理论。 十九世纪以来热之唯动说渐渐地为更多的人们所注意。特别是英国化学家和物理学家克鲁克斯(M.Crookes,1832—1919),所做的风车叶轮旋转实验,证明了热的本质就是分子无规则运动的结论。热动说较好地解释了热质说无法解释的现象,如摩擦生热等。使人们对热的本质的认识大大地进了一步。戴维以冰块摩擦生热融化为例而写成的名为《论热、光及光的复合》的论文,为热功提供了有相当说服力的实例,激励着更多的人去探讨这一问题。 1.2热力学第一定律的建立过程 19世纪初,由于蒸汽机的进一步发展,迫切需要研究热和功的关系,对蒸汽机“出力”作出理论上的分析。所以热与机械功的相互转化得到了广泛的研究。1836年,俄国的赫斯:“不论用什么方式完成化合,由此发出的热总是恒定的”。1830年,法国萨迪·卡诺:“准确地说,它既不会创生也不会消灭,实际上,它只改变了它的形式”。这时能量转化与守恒思想的已经开始萌发,但卡诺的这一思想,在1878年才公开发表,此时热力学第一定律已建立了。 德国医生、物理学家迈尔在1841-1843年间提出了热与机械运动之间相互转化的观点,这是热力学第一定律的第一次提出。迈尔在一次驶往印度尼西亚的航行中,给生病的船员做手术时,发现血的颜色比温带地区的新鲜红亮,这引起了迈尔的沉思。他认为,食物中含有的化学能,可转化为热能,在热带情况下,机体中燃烧过程减慢,因而留下了较多的氧。迈尔的结论是:“因此力(能量)是不灭的,而是可转化的,不可称量的客体”。并在1841年、1842年撰文发表了他的观点,在1845年的论文中,更明确写道:“无不能生有,有不能变无。”“在死的或活的自然界中,这个力(能)永远处于循环和转化之中。” 焦耳设计了实验测定了电热当量和热功当量,用实验确定了热力学第一定律,补充了迈尔的论证。1845年,焦耳为测定机械功和热之间的转换关系,设计了“热功当量实验仪”,并反复改进,反复实验。1849年发表《论热功当量》,1878年发表《热功当量的新测定》,最后得到的数值为423.85公斤·米/千卡,焦耳测热功当量用了三十多年,实验了400多次,
随堂练习 一.选择题(共10小题) 1.(2016秋?浦东新区校级期中)下述改变物体内能的方法中,属于做功的是()A.冷的物体接触热的物体后变热 B.物体在火炉旁被烤热 C.电流通过灯丝使灯丝发热 D.热的物体放在通风地方凉下来 2.(2016秋?浦东新区校级期中)下列例子中通过热传递改变物体内能的是()A.用锤子锤击金属块后,锤子和金属块都变热 B.灼热的火炉使周围物体的温度升高 C.手感到冷时,搓搓手就会觉得暖和些 D.摩擦冰块使其熔解 3.(2016秋?浦东新区期中)两个相互接触的物体没有发生热传递,这是因为它们具有相同的()A.质量B.温度C.内能D.体积 4.(2015?船营区校级学业考试)在下述现象中没有做功而使物体内能改变的是()A.电流通过点炉丝使温度生高 B.流星进入大气层运动温度升高 C.铁锤打铁块使铁块温度升高 D.在炉火上的水被烧开 5.(2014春?新疆校级月考)一定质量的0℃的冰,全部变成0℃的水的过程中()A.分子的平均动能增大,吸收热量,内能不变 B.分子的平均动能减小,放出热量,内能增大 C.分子的平均动能不变,吸收热量,内能增大 D.分子的平均动能不变,放出热量,内能减小 6.(2014秋?南京校级月考)将一杯热水倒入盛有冷水的容器中,冷水的温度升高了10℃,再向容器内倒入一杯相同质量和温度的热水,容器中的水温又升高了6℃.如果继续向容器中倒入一杯同样的热水,则容器中的水温会升高() A.5℃B.4℃C.3℃D.2℃ 7.(2014?奉贤区二模)关于热现象的描述正确的是() A.满足能量守恒定律的宏观过程都可以自发进行 B.做功和热传递都通过能量转化的方式改变系统内能 C.一个系统与另一个系统达到热平衡时两系统温度相同 D.物体内单个分子的运动是无规则的,大量分子的运动也是无规律的
第3节热力学第一定律 目标导航 1?知道热力学第一定律的内容及其表达式 2?理解能量守恒定律的内容 3?了解第一类永动机不可能制成的原因 诱思导学 1.热力学第一定律 (1).一个热力学系统的内能增量等于外界向它传递的热量与外界对它所做的功的和。这个关系叫做 热力学第一定律。 其数学表达式为:AUnW+Q (2).与热力学第一定律相匹配的符号法则 能量的转化或转移,同时也进一步揭示了能量守恒定律。 (4)应用热力学第一定律解题的一般步骤: ①根据符号法则写出各已知量( W、Q、AU)的正、负; ②根据方程AJ=W+Q求出未知量; ③再根据未知量结果的正、负来确定吸热、放热情况或做功情况。 2.能量守恒定律 ⑴.自然界存在着多种不同形式的运动,每种运动对应着一种形式的能量。如机械运动对应机械能; 分子热运动对应内能;电磁运动对应电磁能。 ⑵.不同形式的能量之间可以相互转化。摩擦可以将机械能转化为内能;炽热电灯发光可以将电能转化为光能。 ⑶.能量既不会凭空产生,也不会凭空消失,它只能从一种形式转化为另一种形式,或者从一个物体转移到别的物体,在转化或转移的过程中其总量不变。这就是能量守恒定律。 (4).热力学第一定律、机械能守恒定律都是能量守恒定律的具体体现。 (5).能量守恒定律适用于任何物理现象和物理过程。 (6).能量守恒定律的重要意义 第一,能量守恒定律是支配整个自然界运动、发展、变化的普遍规律,学习这个定律,不能满足一 般理解其内容,更重要的是,从能量形式的多样化及其相互联系,互相转化的事实岀发去认识物质世界的多样性及其普遍联系,并切实树立能量既不会凭空产生,也不会凭空消失的观点,作为以后学习和生产实践中处理一切实际问题的基本指导思想之一。第二,宣告了第一类永动机的失败。 3.第一类永动机不可能制成 任何机器运动时只能将能量从一种形式转化为另一种形式,而不可能无中生有地创造能量,即第一类永动机是不可能制造出来的。 典例探究 例1.一定量的气体在某一过程中,外界对气体做了8X104J的功,气体的内能减少了 1.2和5J,则下列 各式中正确的是() 4 5 4 A.W=8X 104J,AJ =1.2 XO5J,Q=4X104J 4 5 5
热力学第二定律的建立
热力学第二定律的建立 1850年克劳修斯提出热力学第二定律以后,至20世纪初,一直被作为与热力学第一定律并列的热力学两大基本定律,引起学术界特别是物理学界的极大重视。这两个基本定律的发现,使热力学在19世纪50年代初时起,被看作近代物理学中的一个新兴的学科,和物理学家们极其热衷的重要领域,得到物理学家和化学家们的关注。 1、热力学第二定律产生的历史背景 18世纪末惠更斯和巴本(Dents Papin,1647~1714)实验研究的燃气汽缸,塞维利(Thomas Savery,1650~1715)于1798年制成的“矿工之友”,及纽可门(Newcomen Thomas,1663~1729)于1712年发明的“大气机”等早期的蒸汽机,都是利用两个不同温度的热源(锅炉和水)并使部分热量耗散的方法使蒸汽机作功的,也可以说不自觉地运用热力学第二定律的思想,进行设计的。瓦特改进纽可门蒸汽机的关键,是以冷凝器取代大气作为第二热源,因而使耗散的热量大大降低。为了进一步减少热的耗散量和
提高热效率与功率,18世纪末和19世纪40年代又先后研制成中低压和高低压二级膨胀式蒸汽机。热机的整个发展史说明,它的热效率可以不断提高和耗散的热量可以逐渐减少。但是,热机的热效率至今虽然逐渐有所提高,但耗散的热量永远也不可能消除。因此,卡诺的可逆循环只可趋近而永远也无法达到。这就提出了一个十分重要的问题,就是卡诺提出的“在蒸汽机内,动力的产生不是由于热质的实际消耗,而是由热体传到冷体,也就是重新建立了平衡”的论断中,最后的话是不正确的,这不仅因为他相信热质说引起的,而且因为在无数事实中,这种热平衡在一个实际热机中是不可达到的。事实说明,机械功可以完全转化为热,但在不引起其他变化的条件下,热却不可能完全转化为机械功。 人们设想,如果出现一个制成这样永动机的先例,即一个孤立热力学系统会从低温热源取热而永恒地做功,那么大地和海洋几乎可以作为无尽的低温热源,做功将是取之不尽的。事实上这与热力学原理相矛盾的,这就意味着可能有一个新的热力学基本定律在起着作用。综上可见,虽然有的事件是不违背热力学第一定律的但也不可
第一章 热力学第一定律练习题 一、判断题(说法对否): 1.道尔顿分压定律,对理想气体和实际混合气体来说关系式PB=Nb(RT/V)都成立。 2.在两个封闭的容器中,装有同一种理想气体,压力、体积相同,那么温度也相同。 3.物质的温度越高,则热量越多;天气预报:今天很热。其热的概念与热力学相同。 4.恒压过程也就是恒外压过程,恒外压过程也就是恒过程。 5.实际气体在恒温膨胀时所做的功等于所吸收的热。 6.凡是温度升高的过程体系一定吸热;而恒温过程体系不吸热也不放热。 7.当系统的状态一定时,所有的状态函数都有一定的数值。当系统的状态发生变化时, 所有的状态函数的数值也随之发生变化。 8.体积是广度性质的状态函数;在有过剩NaCl(s) 存在的饱和水溶液中,当温度、压力 一定时;系统的体积与系统中水和NaCl 的总量成正比。 9.在101.325kPa 、100℃下有lmol 的水和水蒸气共存的系统,该系统的状态完全确定。 10.一定量的理想气体,当热力学能与温度确定之后,则所有的状态函数也完全确定。 11.系统温度升高则一定从环境吸热,系统温度不变就不与环境换热。 12.从同一始态经不同的过程到达同一终态,则Q 和W 的值一般不同,Q + W 的值一般也 不相同。 13.因Q P = ΔH ,Q V = ΔU ,所以Q P 与Q V 都是状态函数。 14.封闭系统在压力恒定的过程中吸收的热等于该系统的焓。 15.对于一定量的理想气体,当温度一定时热力学能与焓的值一定,其差值也一定。 16.在101.325kPa 下,1mol l00℃的水恒温蒸发为100℃的水蒸气。若水蒸气可视为理想 气体,那么由于过程等温,所以该过程ΔU = 0。 17.1mol ,80.1℃、101.325kPa 的液态苯向真空蒸发为80.1℃、101.325kPa 的气态苯。已 知该过程的焓变为30.87kJ ,所以此过程的Q = 30.87kJ 。 18.1mol 水在l01.325kPa 下由25℃升温至120℃,其ΔH = ∑C P ,m d T 。 19.因焓是温度、压力的函数,即H = f (T ,p ),所以在恒温、恒压下发生相变时,由于 d T = 0,d p = 0,故可得ΔH = 0。 20.因Q p = ΔH ,Q V = ΔU ,所以Q p - Q V = ΔH - ΔU = Δ(p V) = -W 。 21.卡诺循环是可逆循环,当系统经一个卡诺循环后,不仅系统复原了,环境也会复原。 22.一个系统经历了一个无限小的过程,则此过程是可逆过程。 23.若一个过程中每一步都无限接近平衡态,则此过程一定是可逆过程。 24.若一个过程是可逆过程,则该过程中的每一步都是可逆的。 25.1mol 理想气体经绝热不可逆过程由p 1、V 1变到p 2、V 2, 则系统所做的功为 V p C C V p V p W =--=γγ,11122。 26.气体经绝热自由膨胀后,因Q = 0,W = 0,所以ΔU = 0,气体温度不变。 27.(?U /?V )T = 0 的气体一定是理想气体。 28.因理想气体的热力学能与体积压力无关,所以(?U /?p )V = 0,(?U /?V )p = 0。 29.若规定温度T 时,处于标准态的稳定态单质的标准摩尔生成焓为零,那么该温度下
{复习提问} 1、什么是热力学第一定律? 2、什么事准平衡过程和可逆过程?举例描述。 3、系统储存能包括及部分,各是什么,表示符号和表达式是什么? {导入新课} 第三节系统与外界传递的能量 上一节课我们学习了系统的总储存能,这一节我们来学你系统与外界传递的能量。 在热力过程中,热力系与外界交换的能量包括三部分,分别是功量、热量和工质通过边界时所携带的能量。下面我们分别来学习这三种能量: 一、热量 1、定义:系统和外界之间仅仅由于温度不同(温差)而通过边界传递的能量称 为热量。符号:Q , 单位为J或kJ 2、单位质量工质与外界交换的热量用q表示,单位为J/kg或kJ/kg 。 微元过程中热力系与外界交换的微小热量用δQ或δq表示。 3、热量为在热传递中物体能量改变的量度,是过程量。其数值大小与过程有关, 所以不是状态参数。 4、热量正负规定: 系统吸热,热量取正值,Q(q)>0 ;系统放热,热量取 负值,Q(q)<0 。 5、热量的记算式(推导): 引入新概念【熵】 熵:指热能除以温度所得的商,标志热量转化为功的程度。有温差便有热量的传递,可用熵的变化量作为热力系与外界间有无热量传递以及热量传递方向的标志。 1、符号: S , 单位为J/K 或kJ/K 。 2、单位质量工质所具有的熵称为比熵, 用s 表示, 单位为J/(kg?K) 或kJ/(kg?K)。 用熵计算热量
在微元可逆过程中,系统与外界传递的热量可表示为: δq =Tds δQ =TdS 在可逆过程1-2中,系统吸收的热量可写为: q =?21Tds Q=?2 1TdS 根据熵的变化判断一个可逆过程中系统与外界之 间热量交换的方向:ds >0,δq >0,系统吸热; ds <0,δq <0,系统放热; ds =0,δq =0,系统与外界没有热量交换,是绝热(定熵)过程。 3. 温熵图 (T -s 图) 在可逆过程中单位质量工质与外界交换的热量 q =?21 Tds , 大小等于T -s 图(温熵图)上过程曲线下的面积,因此温熵图也称示热图。对于分析热力过程和热力循环很有用处。 二、功量 我们知道热量是由于温差的作用使系统与外界发生能量交换,顾名思义,功量是在力差作用下,系统与外界发生的能量交换。 1、功量亦为过程量,不是状态参数。 2、有各种形式的功,如电功、磁功、膨胀功、轴功等。工程热力学主要研究 两种功量形式: ⑴体积变化功,⑵轴功。 ⑴体积变化功——由于热力系体积发生变化(增大或缩小)而通过边 界向外界传递的机械功称为体积变化功(膨胀功或压缩功)。 ①符号: W , 单位为J 或kJ 。 ②1kg 工质传递的体积变化功用符号w 表示,单位为J/kg 或kJ/kg 。 ③正负规定: d v > 0 , w > 0 , 热力系对外作膨胀功; d v < 0 , w < 0 , 热力系对外作压缩功。 ④体积变化功的计算式(推导) 课本图2-4 假设质量为1kg 的气体工质在汽缸中进行一个可逆膨胀过程,缸内气体压力p ,活塞截面积A ,活塞在某一瞬间移动微小位移dx 。则整个热力过程工质对活塞所作功量为 : 1→2为可逆过程 (pdv pAdx w ==δ)
10.3、热力学第一定律能量守恒定律 教学目的 1.认识物质的运动形式有多种,对应不同运动形式的运动有不同形式的能,各种形式 的能在一定条件下可以相互转化 2. 进一步掌握能的转化和守恒定律,并了解能的转化和守恒定律的意义 3.运用公式△U=W+Q分析有关问题并具体进行计算 教学重点热力第一定律 教学难点能量守恒 教具多媒体课件 教学过程 复习提问 问:物体做什么样的运动具有机械能?机械能转化和守恒定律的内容是什么? 新课教学 一、热力学第一定律 分析下列特殊情况: ①如果物体只与外有热交换,没有做功,外界传给物体4J热量物体的内能增加了 多少?物体若向外界传出了4J热量,物体内能如何变化? 结论:在没有做功情况下,物体与外界间传递热量Q,物体内能变化为△U,则△U=Q,为了在此表达式中能反映物体对外界是吸热不是放热,作出规定:吸热Q 取正值,放热Q取负值,由此可知:物体吸热,内能增加,放热,内能减少。 ②如果物体和外界不发生热交换,当外界对物体做了10J功,物体内能增加了多 少?当物体对外做了10J功,物体内能又如何变化? 结论:在无热交换情况下,△U=W(对外做功时,W取负值) ③如果物体内能在改变的过程中,既有热传递又有做功,例如外界对物体做了10J 的功,同时物体吸收4J热量,物体的内能如何变化? ④又如,外界对物体做10J功,物体放热4J物体内能又如何变化?又物体对外界 做了10J功,物体吸热4J,物体放热4J物体内能又如何变化? 综上所述: 在能的转化转移过程中,一个物体,如果没有吸收热量也没有放出热量,那么外界对它做多少功它的内能就增加多少;如果它既没有对外做功,外界也没有对其做功,则它从外界吸收多少热量,它的内能就增加多少。 用△U表示物体内能的增量,用Q表示吸收的热量,用W表示外界对物体所做的功,那么:△U=Q+W 上式就是热力学第一定律。 [例]一定量的气体从外界吸收了2.6×105J的热量,内能增加了4.2×105J,外界对物体做了多少功?
2.2热力学第一定律的建立 2.2.1准备阶段 19世纪40年代以前,自然科学的发展为能量转化与守恒原理奠定了基础。主要从以下几个方面作了准备。 1.力学方面的准备 机械能守恒是能量守恒定律在机械运动中的一个特殊情况。早在力学初步形成时就已有了能量守恒思想的萌芽。例如,伽利略研究斜面问题和摆的运动,斯梯芬(Stevin,1548—1620)研究杠杆原理,惠更斯研究完全弹性碰撞等都涉及能量守恒问题。17世纪法国哲学家笛卡儿已经明确提出了运动不灭的思想。以后德国哲学家莱布尼兹(Leibniz,1646—1716)引进活力(Vis viva)的概念,首先提出活力守恒原理,他认为用mv2度量的活力在力学过程中是守恒的,宇宙间的“活力”的总和是守恒的。D.伯努利(Daniel Bernoulli,1700—1782)的流体运动方程实际上就是流体运动中的机械能守恒定律。 永动机不可能实现的历史教训,从反面提供了能量守恒的例证,成为导致建立能量守恒原理的重要线索。 至19世纪20年代,力学的理论著作强调“功”的概念,把它定义成力对距离的积分,并澄清了它和“活力”概念之间的数学关系,提供了一种机械“能”的度量,这为能量转换建立了定量基础。1835年哈密顿(W.R.Hamilton,1805—1865)发表了《论动力学的普遍方法》一文,提出了哈密顿原理。至此能量守恒定律及其应用已经成为力学中的基本内容。 2.化学、生物学方面的准备 法国的拉瓦锡(https://www.doczj.com/doc/8d1322634.html,voisier,1743—1794)和拉普拉斯(https://www.doczj.com/doc/8d1322634.html,place,1749—1827)曾经研究过一个重要的生理现象,他们证明豚鼠吃过食物后发出动物热与等量的食物直接经化学过程燃烧所发的热接近相等。德国化学家李比希(J.Liebig,1803—1873)的学生莫尔(F.Mohr,1806—1879)则进一步认为不同形式的“力”(即能量)都是机械“力”的表现,他写道: “除了54种化学元素外,自然界还有一种动因,叫做力。力在适当的条件下可以表现为运动、化学亲和力、凝聚、电、光、热和磁,从这些运动形式中的每一种可以得出一切其余形式。” 他明确地表述了运动不同形式的统一性和相互转化的可能性。 3.热学方面的准备
第一章热力学第一定律 一、单选题 1) 如图,在绝热盛水容器中,浸入电阻丝,通电一段时间,通电后水及电阻丝的温度均略有升高,今以电阻丝为体系有:( ) A.W =0,Q <0,?U <0 B.W <0,Q<0,?U >0 C.W<0,Q<0,?U >0 D.W<0,Q=0,?U>0 2) 如图,用隔板将刚性绝热壁容器分成两半,两边充入压力不等的空气(视为理想气体),已 知p 右> p 左, 将隔板抽去后: ( ) A.Q=0, W=0, ?U=0 B.Q=0, W <0, ?U >0 C.Q >0, W <0, ?U >0 D.?U=0, Q=W≠0 3)对于理想气体,下列关系中哪个是不正确的:( ) A. (?U/?T)V=0 B. (?U/?V)T=0 C. (?H/?p)T=0 D. (?U/?p)T=0 4)凡是在孤立孤体系中进行的变化,其?U和?H的值一定是:( ) A.?U >0, ?H >0 B.?U=0, ?H=0 C.?U <0, ?H <0 D.?U=0,?H大于、小于或等于零不能确定。 5)在实际气体的节流膨胀过程中,哪一组描述是正确的: ( ) A.Q >0, ?H=0, ?p < 0 B.Q=0, ?H <0, ?p >0 C.Q=0, ?H=0, ?p <0 D.Q <0, ?H=0, ?p <0 6)如图,叙述不正确的是:( ) A.曲线上任一点均表示对应浓度时积分溶解热大小 B.?H1表示无限稀释积分溶解热 C.?H2表示两浓度n1和n2之间的积分稀释热 D.曲线上任一点的斜率均表示对应浓度时HCl的微分溶解热 7)?H=Q p此式适用于哪一个过程: ( ) A.理想气体从101325Pa反抗恒定的10132.5Pa膨胀到10132.5sPa B.在0℃、101325Pa下,冰融化成水 C.电解CuSO4的水溶液 D.气体从(298K,101325Pa)可逆变化到(373K,10132.5Pa ) 8) 一定量的理想气体,从同一初态分别经历等温可逆膨胀、绝热可逆膨胀到具有相同压力的终态,终态体积分别为V1、V2。( ) A.V1 < V2 B.V1 = V2 C.V1> V2 D.无法确定 9) 某化学反应在恒压、绝热和只作体积功的条件下进行,体系温度由T1升高到T2,则此过程的焓变?H:( )
第四讲化学反应进行的方向 子?新课标?高三化学〔人教版〕第一轮复习选修〔4〕单元讲座 第二章化学反应速率和化学平稳 第四讲化学反应进行的方向 复习目标:能用焓变和熵变讲明化学反应的方向。 复习重点、难点:熵判据 科学家依照体系的存在着使体系总能量趋向于,也确实是⊿H 0的趋势,也存在使体系由有序向无序转化〔⊿S 0〕的自然现象,提出了焓判据和熵判据。 一、焓变与自发反应的关系 焓变〔ΔH〕作为判定反应自发性的依据:假设ΔH<0,___能自发进行;假设ΔH >0,___不能自发进行,而___能自发进行。 能自发进行,但当温度升高时却能自发进行。 二、熵变与自发反应的关系 熵指的是,用表示。作为固液气三态的熵值比较大小顺序为。 摸索:为何物质的溶解是自发过程?〔请用熵变来讲明〕〔通过分子扩散自发形成平均混合物。物质溶于水自发地向水中扩散,形成平均的溶液,体系有由有序自发地变为无序的倾向〕。 行。 三、自发反应的判定依据 焓变〔焓判据〕只能判定,熵变〔熵判据〕只能判定。
结论:二者的复合判据才是自以反应的判定标准。二者对反应方向的阻碍存在着关系:⊿H正反应自发进行;⊿H—T⊿S>0 逆反应自发过行。 疑难点拨 焓的概念是依照热力学第一定律引入的,规定在等温等压且不做非体积功的条件下,反应的热效应就等于反应的焓变,关于一定压且不做非体积功条件下的化学反应的热效应也等于产物的是焓值〔末态〕减去反应物的总焓值〔始态〕。在研究各种体系的变化过程时,人们发觉自然界的自发过程一样都朝着能量降低的方向进行。明显,能量越低,体系的状态就越稳固。化学反应一样亦符合上述能量最低原理。的确,专门多放热反应,在298K、标准态下是自发的。例如: 3Fe(s) + 2O2(g)=Fe3O4(s);△H (298 K)= -1118.4 kJ·mol-1 C(s) + O2(g)=CO2(g);△H(298 K) =-393.509 kJ·mol-1 CH4(g) + 2O2(g)=CO2(g) + 2H2O(l);△H(298 K) = -890.36 kJ·mol-1 此有人曾试图以298K、标准态下反应的焓变作为反应自发性的判据。认为在等温等压条件下,当 △H < 0时:化学反应自发进行 △H > 0时:化学反应不能自发进行 然而,实践讲明:有些吸热过程(△H >0)亦能自发进行。例如,水的蒸发,NH4Cl溶于水以及Ag2O的分解等差不多上吸热过程,但在298K、标准态下均能自发进行:NH4Cl(s) = NH4+(aq) + Cl-(aq);△H (298 K)= 14.7 kJ·mol-1 Ag2O(s) = 2Ag(s) + 1/2O2(g);△H (298 K)= 31.05 kJ·mol-1 CaCO3(s) = CaO(s) + CO2(g);△H (298 K)= 178.32 kJ·mol-1 关于CaCO3的分解反应在298K、标准态下反应是非自发的。但当温度升高到约1123K 时,CaCO3的分解反应就变成自发过程,而现在反应的焓变仍近似等于178.32kJ·mol-1,(温度对焓变阻碍甚小)。由此可见,把焓变作为反应自发性的普遍判据是不准确、不全面的。因为除了反应焓变以外,体系纷乱度的增加和温度的改变,也是许多化学和物理过程自发进行的阻碍因素。 二、如何利用〝△H-T△S〞判定化学反应的自发性 通过教材学习,我们明白反应的自发性不仅与焓变和熵变有关,而且还与温度条件有关。化学反应的方向是焓变和熵变共同阻碍的结果,判定依据为△H-T△S,即依据△H-T△S的值的大小判定。△H-T△S又称自由能,符号△G,△G=△H-T△S,在等温等压下,自由能变化(△G)的正负决定着化学反应进行的方向和程度。而△G又与△H、△S及T紧密相关。关系如下: 现在我们利用△H-T△S对中学化学中的两个咨询题探讨。 关于C还原CuO所发生的反应有以下两种可能情形: 1、假如反应为:2CuO+C=2Cu+CO2↑,直截了当依照各物质的△G运算,那么: 那么△G°1=(-394.4+2×0)-[2×(-127.2)+0]=- △H-T△S= -140.0(kJ)<0 2、假如反应为:CuO+C=Cu+CO↑,依照各物质的△G运算,那么: △G°2=(-137.3+0)-(127.2+0)= △H-T△S =-10.1(kJ)<0
第四章思考题 4-1 容器被闸板分割为A、B两部分。A中气体参数为P A、T A,B为真空。现将隔板抽去,气体作绝热自由膨胀,终压将为P2,试问终了温 度T2是否可用下式计算?为什么? 1 2 2 () k k A A p T T p -= 答:气体作绝热自由膨胀是不可逆绝热过程,因此终了温度T2不可用上式计算。 4-2 今有任意两过程a-b,b-c,b、c两点在同一定熵线上,如图所示。试问:Δuab、Δuac哪个大?再设b、c 两点在同一条定温线上,结果又如何? 答:由题可知,因b、c两点在同一定熵 线上T b>T c, ub>uc. Δuab>Δuac。若b、 c两点在同一条定温线上,T b=T c, ub=u c. Δuab=Δuac。 4-3将满足下列要求的多变过程表示在p-v图和T-s图上(工质为空气)。
(1)工质又升压、又升温、又放热;(2)工质又膨胀、又降温、又放热; (3)n=1.6的膨胀过程,判 断q,w,Δu的正负; 答:n=1.6的压缩过程在p-v 图和T-s图上表示为1→2 过程。在此过程中q>0, w<0,Δu>0 (4)n=1.3的压缩过程,判断q,w,Δu的正负。
答:n=1.3的压缩过程在p-v图和T-s图上表示为1→2过程。在此过程中q<0,w<0,Δu>0 4-4将p-v图表示的循环,如图所示,表示在T-s图上。图中:2-3,5-1,为定容过程;1-2,4-5为定熵过程;3-4为定压过程。 答:T-s图如图 所示
4-5 以空气为工质进行的某过程中,加热量的一半转变为功,试问过程的多变指数n 为多少?试在p-v 图和T-s 图上画出该过程的大概位置(比热容比可视为定值)。 答:多变过程中,遵循热力学第一定律q u w =?+,由题可知12q u =?,由于v 21()1n -k q c T T n =--,所以() v 21v 21()()21n -k c T T c T T n -=--即: () 121n -k n =-,0.6n = 4-6如果采用了有效的冷却方法后,使气体在压气机汽缸中实现了定温压缩,这时是否还需要采用多级压缩?为什么?(6分) 答:还需要采用多级压缩,由余隙效率可知, 12111n v p c p λ??????=-- ????????? ,余隙使一部分气缸容积不能被有效利用,压力比越大越不利。因此,当需要获得较高压力时,必须采用多级压缩。
热力学定律 【知识点一】热力学第一定律及其应用 1.公式:ΔU=Q+W. 2.注意各物理量符号和理想气体的特点 (1)各物理量符合的意义 ①只有绝热过程Q=0,ΔU=W,用做功可判断内能的变化. ②只有在气体体积不变时,W=0,ΔU=Q,用吸热、放热情况可判断内能的变化. ③若物体内能不变,即ΔU=0,W和Q不一定等于零,而是W+Q=0,功和热量符号相反.大小相等,因此判断内能变化问题一定要全面考虑. ④对于气体,做功W的正负一般要看气体体积变化,气体体积缩小,W>0;气体体积增大,W<0. 【知识点二】热力学第二定律及其应用 1.热力学第二定律的几种表现形式 (1)热传递具有方向性 两个温度不同的物体进行接触时,热量会自发地从高温物体传给低温物体,而低温物体不可能自发地将热量传给高温物体.要实现低温物体向高温物体传递热量,必须借助外界的帮助,来产生其他影响或引起其他变化. (2)气体的扩散现象具有方向性 两种不同的气体可以自发地进入对方,最后成为均匀的混合气体,但这种均匀的混合气体,绝不会自发地分开,成为两种不同的气体. (3)机械能和内能的转化过程具有方向性 物体在水平面上运动,因摩擦而逐渐停下来,但绝不可能出现物体吸收原来传递出去的热量后,在地面上重新运动起来.
(4)气体向真空膨胀具有方向性 气体可自发地向真空容器膨胀,但绝不可能出现气体自发地再从容器中流回,使容器变为真空. 2.深刻理解热力学第二定律的内涵 掌握热力学第二定律时,要注意理解其本质,即热力学第二定律是对宏观自然过程进行方向的说明.凡是对这种宏观自然过程进行方向的说明,都可以作为热力学第二定律的表述.本章对热力学第二定律的表述很多,这些不同形式的表述都是等价的. 【知识点三】能源与可持续发展 (1)能量耗散:一切能量最终要转化成不可回收的能量. (2)环境污染:温室效应,酸雨,光化学烟雾. (3)开发新能源:太阳能,生物质能,风能,水能等. 【例1】(多选)对于一定质量的理想气体,下列说法正确的是( ) A.若气体的压强和体积都不变,其内能也一定不变 B.若气体的温度不断升高,其压强也一定不断增大 C.若气体温度升高 1 K,其等容过程所吸收的热量一定小于等压过程所吸收的热量 D.在完全失重状态下,气体的压强为零 E.当气体温度升高时,气体的内能一定增大 ACE[一定质量的理想气体的内能与温度有关,若气体的压强和体积都不变, 则温度不变,其内能也一定不变,A正确;由pV T =C知,气体的温度不断升高, 压强不一定增大,B错误;根据热力学第一定律有ΔU=Q+W,气体温度升高1 K,ΔU相同,等容过程W=0,等压过程,体积增大,则W<0,故等容过程所吸收的热量一定小于等压过程所吸收的热量,C正确;气体的压强是由于分子频繁撞击器壁而产生的,与是否失重无关,D错误;温度升高,理想气体的内能一定增大,E正确.]
第一章 热力学练习题参考答案 一、判断题解答: 1.错。对实际气体不适应。 2.错。数量不同,温度可能不同。 3.错。没有与环境交换能量,无热可言;天气预报的“热”不是热力学概念,它是指温度,天气很热,指气温很高。 4.错。恒压(等压)过程是体系压力不变并与外压相等,恒外压过程是指外压不变化,体系压力并不一定与外压相等。 5.错。一般吸收的热大于功的绝对值,多出部分增加分子势能(内能)。 6.错。例如理想气体绝热压缩,升温但不吸热;理想气体恒温膨胀,温度不变但吸热。 7.第一句话对,第二句话错,如理想气体的等温过程ΔU = 0,ΔH = 0,U 、H 不变。 8.错,两个独立变数可确定系统的状态只对组成一定的均相组成不变系统才成立。 9.错,理想气体U = f (T ),U 与T 不是独立的。描述一定量理想气体要两个独立变量。 10.第一个结论正确,第二个结论错,因Q+W =ΔU ,与途径无关。 11.错,Q V 、Q p 是过程变化的量、不是由状态决定的量,该式仅是数值相关而已。在一定条件下,可以利用ΔU ,ΔH 来计算Q V 、Q p ,但不能改变其本性。 12.错,(1)未说明该过程的非体积功W '是否为零; (2)若W ' = 0,该过程的热也只等于系统的焓变,而不是体系的焓。 13.对。因为理想气体热力学能、焓是温度的单值函数。 14.错,这是水的相变过程,不是理想气体的单纯状态变化,ΔU > 0。 15.错,该过程的p 环 = 0,不是恒压过程,也不是可逆相变,吸的热,增加体系的热力学能。吸的热少于30.87 kJ 。 16.错,在25℃到120℃中间,水发生相变,不能直接计算。 17.错,H = f (T ,p )只对组成不变的均相封闭系统成立,该题有相变。 18.错,Δ(pV )是状态函数的增量,与途径无关,不一定等于功。 19.错,环境并没有复原,卡诺循环不是原途径逆向返回的。 20.错,无限小过程不是可逆过程的充分条件。如有摩擦的谆静态过程。 21.错,若有摩擦力(广义)存在,有能量消耗则不可逆过程,只是准静态过程。 22.对。只有每一步都是可逆的才组成可逆过程。 23.对。() ()()12m ,121122n n 1T T C C C C T T R V p V p W V V V p -=--=--= γ。该公式对理想气体可逆、 不可逆过程都适用。 24.错,若是非理想气体的温度会变化的,如范德华气体。 25.错,该条件对服从pV m = RT + bp 的气体(钢球模型气体)也成立。 26.错,(?U /?V )p ≠(?U/?V )T ;(?U /?P )V ≠(?U/?V )T ,因此不等于零。 27.错,U = H -pV 。PV 不可能为零的。 28.错。CO 2在1000K 的标准摩尔生成焓可以由298K 标准摩尔生成焓计算出:由基尔霍夫定律得出的计算公式:
第四章热力学第一定律 4-1 0.020Kg的氦气温度由升为,若在升温过程中:(1)体积保持不变;(2)压强保持不变;(3)不与外界交换热量,试分别求出气体内能的改 变,吸收的热量,外界对气体所作的功,设氦气可看作理想气体,且, 解:理想气体内能是温度的单值函数,一过程中气体温度的改变相同,所以内能的改变也相同,为: 热量和功因过程而异,分别求之如下: (1)等容过程: V=常量A=0 由热力学第一定律, (2)等压过程: 由热力学第一定律, 负号表示气体对外作功, (3)绝热过程 Q=0 由热力学第一定律 4-2分别通过下列过程把标准状态下的0.014Kg氮气压缩为原体积的一半;(1)等温过程;(2)绝热过程;(3)等压过程,试分别求出在这些过程中气体内能的改变,传递的热量和外界对气体所作的功,设氮气可看作理想气体,且 ,
解:把上述三过程分别表示在P-V图上, (1)等温过程 理想气体内能是温度的单值函数,过程中温度不变,故 由热一、 负号表示系统向外界放热 (2)绝热过程 由或 得 由热力学第一定律 另外,也可以由 及 先求得A
(3)等压过程,有 或 而 所以= = = 由热力学第一定律, 求之 也可以由 另外,由计算结果可见,等压压缩过程,外界作功,系统放热,内能减少,数量关系为,系统放的热等于其内能的减少和外界作的功。 4-3 在标准状态下的0.016Kg的氧气,分别经过下列过程从外界吸收了80cal 的热量。(1)若为等温过程,求终态体积。(2)若为等容过程,求终态压强。 (3)若为等压过程,求气体内能的变化。设氧气可看作理想气体,且 解:(1)等温过程
8kT m v 2 l l 一. 基础知识 第四讲 热 学 部 分 1. 分子运动论的基本内容 2. 物态的微观解释 3. 理想气体的压强 设任意分子 a 的速度为 v ,在 x 、y 、z 三个方向的分量为 v x 、v y 、v z ,所以分子 a 在单位时间里与左右壁碰撞的冲量为: v mv 2 I = f ? ?t = 2mv ? x = x 2l 1 l 1 mv 2 mv 2 m N F = I + I + = 1x + 2x + = ∑v 2 1 2 1 1 1 ix i =1 F m N mN v 2 + v 2 + v 2 + v 2 mN P = = ∑v 2 = ? 1x 2 x 3x Nx = ? v 2 = nmv 2 l 2l 3 l 1l 2l 3 ix i =1 l 1l 2l 3 N l 1l 2l 3 v 2 + v 2 + v 2 = v 2 ∴ v 2 = 1 v 2 x y z x 3 ∴ P = 2 n ? 1 mv 2 = 2 ne A 3 2 3 k 4. 分子平均动能: PV = RT ? e = 3P = 3RT = 3RT = 3RT = 3 kT (k =R/N A ,为玻尔兹曼常数) k 2n 2nV 2N 2N A 2 5. 阿伏伽德罗定律: P = nkT (n 为单位体积的分子数) ① 分子的平均速率: v = = ② 分子的方均根速率: = (μ为 mol 质量,可分子平均自由程推导) = 二. 物体的内能 1. 自由度:即确定一个物体的位置所需要的独立坐标参数,如自由运动的质点 需要三个独立坐标来描述其运动,故它有三个自由度。 2. 例:He 三个平动自由度 H 2 三个平动自由度,二个转动自由度 CO 2 三个平动自由度,二个转动自由度,一个振动自由度。 3. 理想气体的内能: E = N i kT = m 2 M ? i RT (i =3 或 i =5) 2 4. 物体的势能 8RT 3kT m 3RT 1 x l A x x