
电化学复习讲义
一、原电池
1.原电池装置考查变迁
(1)盐桥的作用:原电池装置由装置①到装置②的变化是由盐桥连接两个“半电池装置”,其中盐桥的作用有三种:a.隔绝正负极反应物,避免直接接触,导致电流不稳定;b.通过离子的定向移动,构成闭合回路;c.平衡电极区的电荷。
(2)离子交换膜作用:由装置②到装置③的变化是“盐桥”变成“质子交换膜”。离子交换膜是一种选择性透过膜,允许相应离子通过,离子迁移方向遵循电池中离子迁移方向。
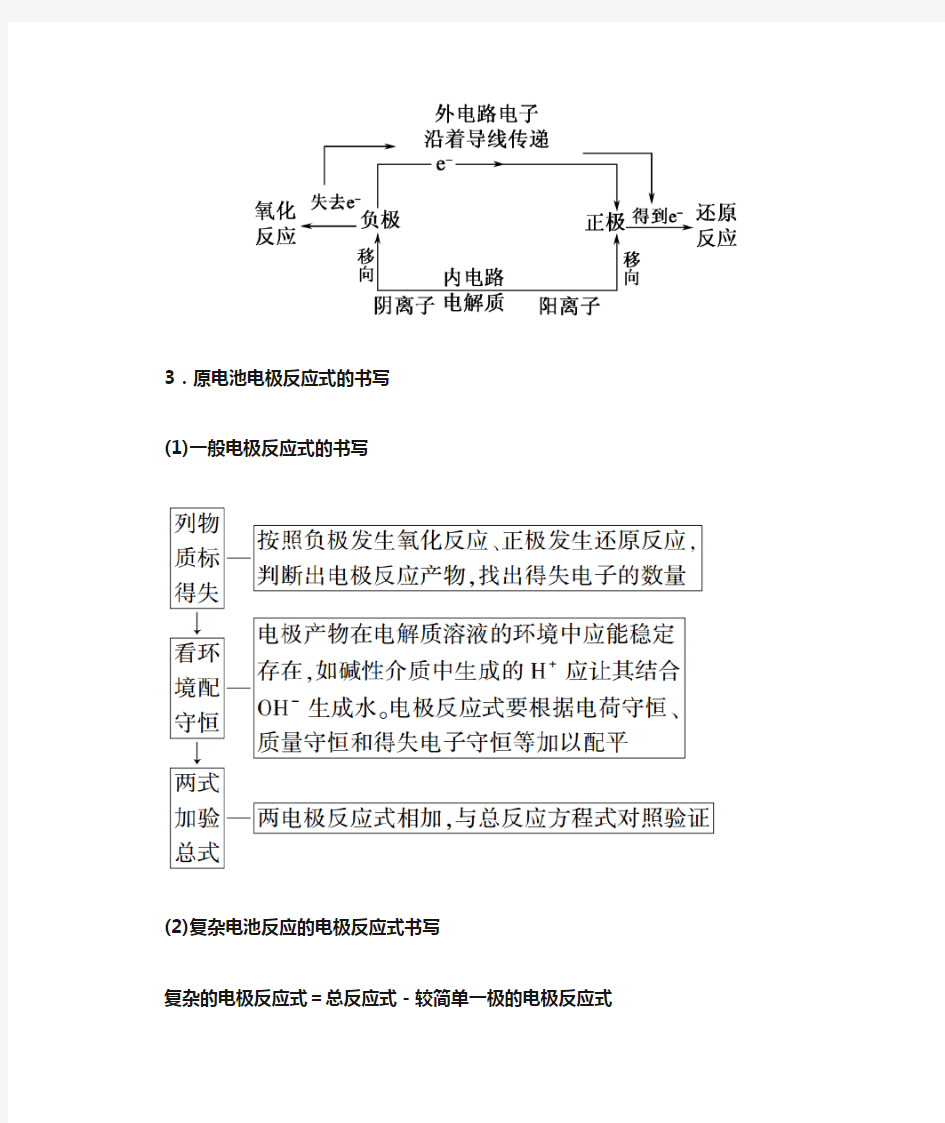
2.图解原电池中闭合回路的形成
3.原电池电极反应式的书写
(1)一般电极反应式的书写
(2)复杂电池反应的电极反应式书写
复杂的电极反应式=总反应式-较简单一极的电极反应式如CH4碱性燃料电池负极反应式的书写:
CH4+2O2+2OH-===CO2-3+3H2O……总反应式
2O2+4H2O+8e-===8OH-……正极反应式
CH4+10OH--8e-===7H2O+CO2-3……负极反应式4.两类常考的新型电池
(一)可充电电池
可充电电池的放电过程遵循原电池的工作原理,充电过程遵循电解池的工作原理。
(1)充电时电极的连接:充电的目的是使电池恢复其供电能力,因此负极应与电源的负极相连以获得电子,可简记为正正负负。即:负接负后作阴极,正接正后做阳极。
(2)工作时的反应式:同一电极上的电极反应式,电池的总反应方程式在充电与放电时,形式上恰好是相反的。
①充电时阴极的电极反应式是该电池放电时的负极反应式的“逆反应”。
②充电时阳极的电极反应式是该电池放电时的正极反应式的“逆反应”。
(3)同一电极周围,充电与放电时pH的变化趋势也恰好相反。OH-生成区或H+消耗区,pH增大;OH-消耗区或H+生成区,pH 减小。
(二)燃料电池
(1)燃料电池中,通入O2的一极为正极,书写方法是:
①首先书写正极反应式:
酸性介质:4H++O2+4e-===2H2O;
碱性介质:2H2O+O2+4e-===4OH-。
②然后用总反应式减去正极反应式得到负极反应式,相减时要求两极得失电子总数相等(即将总反应式中的O2按比例消去)。
(2)下面以CH3OH、O2燃料电池为例,分析电极反应式的书写。
①酸性介质,如H2SO4。
CH3OH在负极上失去电子生成CO2气体,O2在正极上得到电
子,在H+作用下生成H2O。电极反应式为负极:CH3OH-6e-+H2O===CO2↑+6H+
正极:3
2O2+6e
-+6H+===3H2O
②碱性介质,如KOH溶液。
CH3OH在负极上失去电子,在碱性条件下生成CO2-3,1 mol CH3OH失去6 mol e-,O2在正极上得到电子生成OH-,电极反应式为
负极:CH3OH-6e-+8OH-===CO2-3+6H2O
正极:3
2O2+6e
-+3H
2
O===6OH-
③熔融盐介质,如K2CO3。
在电池工作时,CO2-3移向负极。CH3OH在负极上失去电子,在CO2-3的作用下生成CO2气体,O2在正极上得到电子,在CO2的作用下生成CO2-3,其电极反应式为
负极:CH3OH-6e-+3CO2-3===4CO2↑+2H2O
正极:3
2O2+6e
-+3CO
2
===3CO2-3
④掺杂Y2O3的ZrO3固体作电解质,在高温下能传导正极生成的O2-。
根据O2-移向负极,在负极上CH3OH失电子生成CO2气体,而O2在正极上得电子生成O2-,电极反应式为
负极:CH3OH-6e-+3O2-===CO2↑+2H2O
正极:3
2O2+6e
-===3O2-
【可逆反应与原电池中可变电极】
例题1.控制适合的条件,将反应2Fe3++2I- ? 2Fe2++I2
设计成如图所示的原电池。下列判断不正确的是(D)
A.反应开始时,乙中发生氧化反应
B.反应开始时,甲中Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
解析:因乙中I-失去电子放电,元素的化合价升高,则发生氧化反应,故A正确;由总反应方程式知,Fe3+被还原成Fe2+,则发生还原反应,故B正确;当电流计读数为零时,说明没有电子发生转移,则反应达到平衡,故C正确;当加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作负极,而乙中石墨作正极,故D 错误。
2.已知反应AsO3-4+2I-+2H+ ? AsO3-3+I2+H2O是可逆反应。设计如图所示装置(C1、C2均为石墨电极),分别进行下述操作:Ⅰ.向B烧杯中逐滴加入浓盐酸;Ⅱ.向B烧杯中逐滴加入40% NaOH 溶液。结果发现电流表指针均发生偏转。据此,下列判断正确的是(C)
A.操作Ⅰ过程中,C1为正极
B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液
C.Ⅰ操作过程中,C2棒上发生的反应为AsO3-4+2H++2e-
===AsO3-3+H2O
D.Ⅱ操作过程中,C1棒上发生的反应为2I--2e-===I2
解析:操作Ⅰ过程中,在烧杯B中发生反应AsO3-4+2e-+2H+===AsO3-3+H2O,C2为正极,C1为负极,A错误;操作Ⅱ过程中,由于加入NaOH溶液,反应消耗H+,平衡逆向移动,AsO3-3失去电子变为AsO3-4,所以C2为负极,C1为正极,在原电池中,阳离子移向正极,即移向A烧杯溶液,B错误;Ⅰ操作过程中,C2棒上发生还原反应,电极反应为AsO3-4+2H++2e-===AsO3-3+H2O,C正确;Ⅱ操作过程中,C1棒上发生的反应为I2+2e-===2I-,D错误。
3.(2017·湖南郴州一模)乙醇燃料电池中采用磺酸类质子溶剂,
在200 ℃左右时供电,电池总反应为C2H5OH+3O2===2CO2+
3H2O,电池示意图如下所示。下列说法中正确的是(D)
A.电池工作时,质子向电池的负极迁移
B.电池工作时,电子由b极沿导线流向a极
C.a极上发生的电极反应是:C2H5OH+3H2O+12e-===2CO2+12H+
D.b极上发生的电极反应是:4H++O2+4e-===2H2O
解析:原电池中,阳离子向正极移动,所以质子向电池的正极迁移,故A错误;电池工作时,电子由负极经外电路流向正极,在该电池中由a极沿导线流向b极,故B错误;a极上是乙醇失电子发生氧化反应,乙醇被氧化生成CO2和H+,电极反应式为C2H5OH+3H2O-12e-===2CO2+12H+,故C错误;b极氧气得到电子被还原,电极反应式为4H++O2+4e-===2H2O,故D正确。
二、电解池
1.惰性电极电解过程的分析方法
(1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。
(2)再分析电解质水溶液的组成,找全离子并分阴、阳两组(不要忘记水溶液中的H+和OH-)。
(3)然后排出阴、阳两极的放电顺序
阴极:阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电。最常用、最重要的阳离子放电顺序是:Ag+>Cu2+>H+。
电解水溶液时,K+~Al3+不可能在阴极放电,即不可能用电解水溶液的方法得到K、Ca、Na、Mg、Al等金属。
阳极:活泼电极>S2->I->Br->Cl->OH->含氧酸根离子。
(4)分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。
(5)最后写出电解反应的总化学方程式或离子方程式。
[特别提醒1]在电镀和电解精炼金属时,阳极材料和电解质溶液都有特殊要求,阴极上的阳离子可以不遵循放电顺序。
[特别提醒2]恢复原态措施
电解后有关电解质溶液恢复原态的问题应该用质量守恒法分析。一般是加入阳极产物和阴极产物的化合物,但也有特殊情况,如用惰性电极电解CuSO4溶液,Cu2+完全放电之前,可加入CuO或CuCO3复原,而Cu2+完全放电之后继续电解,则应加入Cu(OH)2或Cu2(OH)2CO3复原。
题组1:电解原理的分析与判断
1.(2017·山西重点中学联考)如图所示,甲池的总反应为:N2H4+O2===N2+2H2O。下列关于该电池工作时说法正确的是(C)
A.甲池中负极反应为:N2H4-4e-===N2+4H+
B.甲池溶液pH不变,乙池溶液pH减小
C.反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗2.24 L O2,此时乙池中理论上最多产生12.8 g固体
2.(2017·贵阳一中适应性考试)工业上用惰性电极电解NaHSO3溶液可制得硫酸,装置如图所示,下列说法正确的是(D)
A.A溶液为Na2SO4溶液
B.阴极区消耗1 mol NaHSO3时,同时生成1 mol A
C.当阴极上生成标准状况下1.12 L H2时,阳极区溶液pH降低1
D.阳极电极反应式为HSO-3+H2O-2e-===SO2-4+3H+
解析:由题图分析知,阴极HSO-3得到电子生成H2,电极反应式为2HSO-3+2e-===2SO2-3+H2↑,A溶液为Na2SO3溶液,A错误;阴极区除了电极上消耗NaHSO3,还有HSO-3离子通过阴离子交换膜进入阳极区,发生氧化反应,所以当生成1 mol A时,消耗的NaHSO3大于1 mol,B错误;阳极区溶液体积未知,当阴极上生成标准状况下1.12 L H2时,无法计算阳极区c(H+)的变化,C错误;阳极区H2SO4溶液浓度增大,由HSO-3离子通过阴离子交换膜进入阳极区失去电子得到SO2-4和H+,所以电极反应式为HSO-3+H2O-2e-===SO2-4+3H +,D正确。
题组2:电解原理的创新应用
(2017·湖北武汉4月调研)厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子)。下列说法正确的是(C)
A.通电后,阳极附近pH增大
B.电子从负极经电解质溶液回到正极
C.通电后,A-通过阴离子交换膜从阴极进入浓缩室
D.当电路中通过2 mol电子的电量时,会有1 mol的O2生成
解析:由图示判断左侧为阳极,右侧为阴极,阳极电极反应式为4OH
--4e-===O2↑+2H2O,氢离子浓度增大,pH减小,A错误;电子从电源的负极到电解池的阴极,由阳极回到电源的正极,电子不能进入电解质溶液,电解质溶液中靠离子传递电荷,B错误;氢离子由阳极室进入浓缩室,A-由阴极室进入浓缩室,得到乳酸,C正确;由电极反应式4OH--4e-===O2↑+2H2O可知,当电路中通过2 mol 电子的电量时,会有0.5 mol的O2生成,D错误。
三、金属的腐蚀与防护
1.金属腐蚀快慢的判断方法
(1)根据构成原电池的材料判断。
两极材料的活泼性相差越大,氧化还原反应的速率越快,金属被腐蚀的速率就越快。
(2)根据金属所接触的电解质强弱判断。
活泼金属在电解质溶液中的腐蚀快于在非电解质溶液中的腐蚀,在强电解质溶液中的腐蚀快于在弱电解质溶液中的腐蚀。
(3)一般来说金属的腐蚀快慢顺序为电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极。
(4)对同一种电解质溶液来说,电解质溶液的浓度越大,腐蚀越快。
2.金属的防护方法
(1)两种保护方法
①加防护层
如在金属表面加上油漆、搪瓷、沥青、塑料、橡胶等耐腐蚀的非金属材料;采用电镀或表面钝化等方法在金属表面镀上一层不易被腐
蚀的金属或生成一层致密的薄膜。
②电化学防护
牺牲阳极的阴极保护法——原电池原理:正极为被保护的金属,负极为比被保护的金属活泼的金属;
外加电流的阴极保护法——电解原理:阴极为被保护的金属,阳极为惰性电极。
(2)防腐效果的比较
外接电源的阴极保护法>牺牲阳极的阴极保护法>一般保护层防护法>未加措施防护。
1.用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下图,分析图象,以下结论错误的是(C)
A.溶液pH≤2时,生铁发生析氢腐蚀
B.在酸性溶液中生铁可能发生吸氧腐蚀
C.析氢腐蚀和吸氧腐蚀的速率一样快
D.两溶液中负极反应均为Fe-2e-===Fe2+
解析:根据pH=2的醋酸溶液中压强与时间的关系知,压强随着反应的进行而逐渐增大,说明该装置发生析氢腐蚀,则溶液pH≤2时,生铁发生析氢腐蚀,A正确;pH=4的醋酸溶液中压强随着反应的进行而逐渐减小,说明发生吸氧腐蚀,pH=4的醋酸溶液呈酸性,所以在酸性溶液中生铁可能发生吸氧腐蚀,B正确;根据压强与时间关系图知,pH=2的溶液和pH=4的溶液中,变化相同的压强时所用时间不同,前者比后者所用时间长,说明吸氧腐蚀速率大于析氢腐蚀速率,C错误;两个溶液中都发生电化学腐蚀,铁均作负极,电极反应式为Fe-2e-===Fe2+,D正确。
2.用如图装置研究电化学原理,下列分析中错误的是(D)
解析:在中性条件下,铁作负极失电子,石墨作正极,正极上氧气得电子生成氢氧根离子,则Fe发生吸氧腐蚀,A正确;Zn、Fe 形成原电池,Zn作负极被腐蚀,Fe作正极被保护,属于牺牲阳极的阴极保护法,B正确;Fe作阴极,阴极上氢离子得电子,石墨作阳极,阳极上氯离子失电子,电解氯化钠溶液生成氢气、氯气和氢氧化钠,C正确;Fe与正极相连,Fe作阳极,Fe失电子,被腐蚀,Fe
不能被保护,D错误。
2009年高考化学试题分类汇编:电化学基础 1.(09广东理科基础25)钢铁生锈过程发生如下反应: ①2Fe+O2+2H2O=2Fe(OH)2; ②4Fe(OH)2+O2+2H2O=4Fe(OH)3; ③2Fe(OH)3=Fe2O3+3H2O。 下列说法正确的是 A.反应①、②中电子转移数目相等 B.反应①中氧化剂是氧气和水 C.与铜质水龙头连接处的钢质水管不易发生腐蚀 D.钢铁在潮湿的空气中不能发生电化学腐蚀 答案:A 解析: ①②反应中消耗O2的量相等,两个反应也仅有O2作为氧化剂,故转移电子数是相等的,A 项正确。①中H2O的H、O两元素的化合价没有变,故不作氧化剂,B项错;铜和钢构成原电池,腐蚀速度加快,C项错;钢铁是铁和碳的混合物,在潮湿的空气的中易发生吸氧腐蚀,属于电化学腐蚀,故D项错。 2.(09安徽卷12)Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,点解总反应:2Cu+H2O==Cu2O+H2O 。下列说法正确的是 A.石墨电极上产生氢气 B.铜电极发生还原反应 C.铜电极接直流电源的负极 D.当有0.1mol电子转移时,有0.1molCu2O生成。 答案:A 解析: 由电解总反应可知,Cu参加了反应,所以Cu作电解池的阳极,发生氧化反应,B选项错误;石墨作阴极,阴极上是溶液中的H+反应,电极反应为:2H++2e-=H2↑,A选项正确;阳极与电源的正极相连,C选项错误;阳极反应为2Cu+2OH--2e-=Cu2O+H2O,当有0.1mol 电子转移时,有0.05molCu2O生成,D选项错误。 3.(09江苏卷12)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是
电化学实验讲义 浙江树人大学生物与环境工程学院二O 一二年九月编写:李成平实验一皮 蛋的pH 值测定一、实验目的 1. 了解电位法测定pH 的原理 2. 了解pH 计的 使用方法及性能 3. 掌握电位法测定pH 值的实验技术二、实验原理制做皮蛋(松花蛋)的主要原料为:鸭蛋、纯碱、石灰等。在一定条件下 ,经过一定周期即制得皮蛋。此时由于碱的作用,形成了蛋白及蛋清凝胶。测定皮蛋水溶液的pH 值时,由玻璃电极作为氢离子活度的指示电极, 饱和甘汞电极作为参比电极,它们与待测液(皮蛋水溶液)组成工作电池, 其电池可表示为: Ag,AgCl?HCl(0.1mol/L)?玻璃膜?试液?KCl(饱和)?Hg 2 Cl 2 ,Hg 电池电动势在不考虑液体接界电位及不对称电位时,可表示为: E 电池 = E SCE - E G 而E G = E AgCl/Ag + K - 0.0592pH ? E 电池 = E SCE - K - E AgCl/Ag + 0.0592pH令E SCE - K - E AgCl/Ag = K , ,则上式为: E 电池 = K , + 0.0592pH K , 为常数,包括不对称电位,液接电位及内外参比电极电位。这样通过测定电池的电位即可确定溶液的 pH。本实验测定步骤为:先用 pH 已知的标准缓冲溶液定位,使酸度计指示该溶液的pH 值。经过校正定位后的酸度计,即可用来直接测定水样的pH 值。其测定方法可用标准曲线法或 标准加入法。在测试中,pH 范围应用pH 缓冲液定值在5~8。对于干扰元素(Al、Fe、Zr、Th、Mg、Ca、Ti 及稀土)通常可用柠檬酸,EDTA, DCTA,磺基水扬酸等掩蔽。阴离子一般不干扰测定。加入总离子强度调节缓冲剂能控制酸度,掩蔽干扰,调节离子强度。三、仪器与试剂 1. 仪器 pHS-4 型酸度计;甘汞电极、pH 玻璃电极;磁力搅拌器; 组织捣碎机。 2. 试剂 pH 标准缓冲溶液。四、实验操作 1. 试样处理:将皮蛋洗净、去壳。按皮蛋?水的比例2?1 加入水, 在组织捣碎机中捣 成均浆。 2. 测定:称取匀浆样15g(相当于样品10g),加水搅匀,稀释至150ml, 用双层纱布过滤,取此滤液50ml 放到酸度计上测取读数。五、数据处理平均值
电化学知识点测试 1、能用电解原理说明的问题是 ①电解是把电能转化成化学能②电解是化学能转化成电能③电解质溶液导电是化学变化, 金属导电是物理变化④不能自发进行的氧化还原反应,通过电解的原理可以实现 ⑤任何溶液被电解时,必然导致氧化还原反应的发生 A.①②③④B.②③⑤C.③④D.①③④⑤ 2、电化学在日常生活中有广泛的应用,下列说法或做法正确的是 A.暴雨后遭洪水浸泡的铁门生锈是因为发生化学腐蚀 B.白铁皮(铁镀锌)表面有划损时,不能阻止铁被腐蚀 C.废弃的干电池不能随意丢弃,但可以土埋处理 D.不能将铁制自来水管与铜制水龙头连接 3、(2014·锦州模拟)下列图示中关于铜电极的连接错误的是 4、某学生欲完成2HCl+2Ag===2AgCl↓+H2↑反应,设计了如图四个实验,你认为可行的是 5、用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次为升高、不变、 降低的是 A.AgNO3CuCl2Cu(NO3)2B.KCl Na2SO4CuSO4 C.CaCl2KOH NaNO3D.HCl HNO3K2SO4 6、用惰性电极电解下列溶液一段时间后再加入一定量的某种纯净物(方括号内物质),能使溶液恢复到 原来的成分和浓度的是 A.AgNO3[AgNO3] B.NaOH[NaOH] C.KCl[KCl] D.CuSO4[CuO] 7、利用如图装置进行实验,开始时a、b两处液面相平密封好,放置一段时间。下列说法不正确的是
A .a 管发生吸氧腐蚀,b 管发生析氢腐蚀 B .一段时间后,a 管液面高于b 管液面 C .a 处溶液的pH 增大,b 处溶液的pH 减小 D .a 、b 两处具有相同的电极反应式:Fe -2e -===Fe 2+ 8、(2014·河南安阳高三联考)若用如图装置(X 、Y 是直流电源的两极)分别进行下列各组实验,则下表 中所列各项对应关系均正确的一组是 9①~⑧为各装置中的电极编号。下列说法错误的是 A .当K 闭合时,A 装置发生吸氧腐蚀,在电路中作电源 B .当K 断开时,B 装置锌片溶解,有氢气产生 C .当K 闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→② D .当K 闭合后,A 、B 装置中pH 变大,C 、D 装置中pH 不变 10、用a 、b 两个质量相等的Pt 电极电解AlCl 3和CuSO 4的混合溶液[n (AlCl 3)∶n (CuSO 4)=1∶9]。t 1 时刻a 电极得到混合气体,其中Cl 2在标准状况下为224 mL(忽略气体的溶解);t 2时刻Cu 全部在电极上析出。下列判断正确的是 A .a 电极与电源的负极相连 B .t 2时刻,两电极的质量相差3.84 g C .电解过程中, 溶液的pH 不断增大 D .t 2时刻后,b 电极的电极反应是4OH --4e - ===2H 2O +O 2↑
电化学讲义 第一章电解 1 概念 1.1 什么叫电解 电解是使电流通过电解质溶液(或熔融电解质)而在两极上发生氧化还原反应,把电能转化为化学能的过程。其装置叫电解池,常由直流电源、两个电极、导线及电解质溶液(或熔融电解质)构成,如图。 图中是电解CuCl 2 溶液的装置。通电后发生反应: CuCl 2=Cu + Cl 2 ↑ 用离子方程式表示: Cu2++ 2Cl-=Cu + Cl 2 ↑ 1.2 发生电解反应的条件 ①连接直流电源 ②阴阳电极,与电源负极相连为阴极,与电源正极相连为阳极。 ③两级处于电解质溶液或熔融电解质中。 ④两电极形成闭合回路 1.3 电解质在通电前、通电后的关键点 通电前:电解质溶液的电离(它包括了电解质的电离也包括了水的电离)。 通电后:离子才有定向的移动(阴离子移向阳极,阳离子移向阴极)。 2 电极反应 放电是电化学中常用的词,就是电极上发生氧化-还原反应,离子或原子得失电子的过程都叫放电。 2.1 阴极 与电源的负极相连的电极成为阴极。溶液中阳离子在阴极上得到电子,发生还原反应。如上图装置中,Cu2+在阴极是得到电子转化为Cu,阴极反应式: Cu2++2e=Cu 阴极电极材料的本身受到保护,不参与反应,溶液中较易得电子的阳离子在阴极上得电子而被还原,在阴极得电子的难易顺序为:Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。 当此放电顺序适用于阳离子浓度相差不大时,顺序要有相应的变动。当溶液中H+只来自于水电离时,H+的放电顺序介于A13+和Zn2+之间。 规律:铝前(含铝)离子不放电,氢(酸)后离子先放电,氢(酸)前铝后的离子看条件 2.2 阳极: 与电源的正极相连的电极称为阳极。物质在阳极上失去电子,发生氧化反应。如上图装置中, Cl-在阳极上失去电子转化为Cl 2 ,阳极反应式: 2Cl--2e=Cl 2 ↑ 首先看电极,如果是活性电极(金属活动顺序表Ag以前),则电极材料失电子,电极被溶解,溶液中的阴离子不能失电子。如果是惰性电极(Pt、Au、石墨),则要再看溶液中的离子的失电
电位分析 实验七计时电流法 一、实验目的 1、了解计时电流法的特点和基本实验技术; 2.、掌握极限扩散电流的基本理论; 3.、了解采样电流伏安法的原理。 二、基本原理 计时电流法是极谱法和伏安法的基础。它是记录当电极电位从初始电位阶跃到某一指定电位时,电流随时间的变化曲线。计时电流法又分为单电位阶跃,双电位阶跃及多电位阶跃等。计时电流法是研究极限扩散电流的工具,同时它又是常用的电化学暂态分析方法之一。当电流电位从初始电位阶跃至极限电极电位时,不管电极反应是否可逆,电流与时间的关系式均可以表示为Cottrell公式: i d(t)=nFAD o1/2C o*/(лt)1/2 (1) (1)式中i d(t)为极限扩散电流,n为电极反应的电子交换数,F为法拉第常数,A为电极的有效面积,Do为电极反应物(氧化态)的扩散系数,Co*为电极反应物的本体浓度,t为反应时间。当电极的有效面积不变时,(1)式可以简化为: i d(t)=kt-1/2(2) 即极限扩散电流随t-1/2衰减。对(1)式进行积分,得到 Q(t)=∫t0 i d(t)dt=2nFAD o1/2C o*t1/2/л1/2=k’t1/2 (3) 即Q(t) 与t1/2成正比。如果记录Q(t)—t曲线,称为计时电量法。另外,由(1)式可知: i d(t)∝C o*(4) 即极限扩散电流与溶液的本体浓度成正比这也是极谱法定量分析的依据。 三、仪器与试剂 仪器LK98BⅡ型电化学工作站(天津市兰力科公司);三电极系统:玻碳电极为工作电极,Ag/AgCl电极(或饱和甘汞电极)为参比电极,铂电极为对极(铂丝、铂片、铂柱电极均可); 试剂 1.0×10-3mol/L K3[Fe(CN)6]-K4[Fe(CN)6] (铁氰化钾)溶液(含0.2mol/L KNO3)。
《电化学基础》考题分析与解题方法 广州市真光中学化学科王国强 一、课程标准、考试说明的要求 新课程内容标准新课程活动 与探究建议 2010年广东省高考 考试说明要求 1.体验化学能与电能相互转化的探究过程,了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。2.通过查阅资料了解常见化学电源的种类及其工作原理,认识化学能与电能相互转化的实际意义及其重要应用。 3.能解释金属发生电化学腐蚀的原因,认识金属腐蚀的危害,通过实验探究防止金属腐蚀的措施。①实验探究:电能与 化学能的相互转化。 ②调查市场常见化学 电池的种类,讨论它 们的工作原理、生产 工艺和回收价值。 ③查阅资料并交流: 防止钢铁腐蚀的方 法。 1. 了解原电池和电解池 的工作原理,能写出电极 反应和电池反应方程式。 了解常见化学电源的种 类及其工作原理。 2.理解金属发生电化学 腐蚀的原因,金属腐蚀的 危害,防止金属腐蚀的措 施。 二、近三年高考有关电化学知识考题分析 从新课程实验省(如山东、宁夏、广东、海南、江苏、天津等)近三年化学考题分析,其中考查原电池、电解池原理及电化学腐蚀的考题有19题,全国所有省份2009年高考题就有20题之多,可见这部分知识重要性。 (一)原电池及原理其综合考查 1、在书本锌铜原电池原理基础上稍有变化的原电池:从原电池的组成、电极反应(或原电 池反应)、电流方向(或电子流向)、盐桥的作用等多方面来考查原电池的基本原理,在多年来高考题中时有出现,体现了对基础知识和能力的考查。如(09福建卷11)(08年广东化学·5)(07年海南卷第14题)有盐桥的铜银电池;(07年宁夏理综·26)锌银原电池工作原理与阿伏伽德罗常数关系;(07年山东理综·29)简单原电池设计。(见附件1)【复习建议】高考命题的原则是万变不离其宗,无论谁命题考查的都是教材的核心知识内容。必须抓好基础,重视课本,重视主干知识,逐一过关。同样是重点知识内容,复习方法可以有所不同。电化学部分知识是学生易弄错易弄混的难点知识内容。学习和复习的过程中都不能赶进度,也不能搞“题海战术”。要引导学生认真阅读教材,深入思考核心知识内容,最关键的知识内容一定要让学生自己理解记忆,而不是死记硬背。学生把难点真正“消化”了就可以做到一通百通,题目再怎么变换形式,学生也能会答,而不用老师讲个面面俱道。复习
Section 5: Voltammetric Methods
Voltammetric Methods ?Historical ?Electrolysis at DME -1920’s ?Usually 3-electrode cells ?Measurement of current that results from the application of potential. ?Different voltammetric techniques are distinguished primarily by the potential function that is applied to the working electrode and by the material used as the working electrode.
Types of Voltammetry Polarography Linear sweep and Cyclic Voltammetry Hydrodynamic Voltammetry Pulsed methods AC Voltammetry (not here) ip=2.69 x 105n3/2A D O1/2v1/2C O It is instructive to start with Polarography Voltammetry at a dropping mercury electrode
Polarography uses mercury droplet electrode that is regularly renewed during analysis. Applications: Metal ions (especially heavy metal pollutants) -high sensitivity. Organic species able to be oxidized or reduced at electrodes: quinones, reducing sugars and derivatives, thiol and disulphide compounds, oxidation cofactors (coenzymes etc), vitamins, pharmaceuticals. Alternative when spectroscopic methods fail.
电化学阻抗谱的应用及其解析方法 交流阻抗法是电化学测试技术中一类十分重要的方法,是研究电极过程动力学和表面现象的重要手段。特别是近年来,由于频率响应分析仪的快速发展,交流阻抗的测试精度越来越高,超低频信号阻抗谱也具有良好的重现性,再加上计算机技术的进步,对阻抗谱解析的自动化程度越来越高,这就使我们能更好的理解电极表面双电层结构,活化钝化膜转换,孔蚀的诱发、发展、终止以及活性物质的吸脱附过程。 阻抗谱中的基本元件 交流阻抗谱的解析一般是通过等效电路来进行的,其中基本的元件包括:纯电阻R ,纯电容C ,阻抗值为1/j ωC ,纯电感L ,其阻抗值为j ωL 。实际测量中,将某一频率为ω的微扰正弦波信号施加到电解池,这是可把双电层看成一个电容,把电极本身、溶液及电极反应所引起的阻力均视为电阻,则等效电路如图1所示。 图1. 用大面积惰性电极为辅助电极时电解池的等效电路 图中A 、B 分别表示电解池的研究电极和辅助电极两端,Ra 、Rb 分别表示电极材料本身的电阻,Cab 表示研究电极与辅助电极之间的电容,Cd 与Cd ’表示研究电极和辅助电极的双电层电容,Zf 与Zf ’表示研究电极与辅助电极的交流阻抗。通常称为电解阻抗或法拉第阻抗,其数值决定于电极动力学参数及测量信号的频率,Rl 表示辅助电极与工作电极之间的溶液 电阻。一般将双电层电容Cd 与法拉第阻抗的并联称为界面阻抗Z 。 实际测量中,电极本身的内阻很小,且辅助电极与工作电极之间的距离较大,故电容Cab 一般远远小于双电层电容Cd 。如果辅助电极上不发生电化学反映,即Zf ’特别大,又使辅助 电极的面积远大于研究电极的面积(例如用大的铂黑电极),则Cd ’很大,其容抗Xcd ’比串 联电路中的其他元件小得多,因此辅助电极的界面阻抗可忽略,于是图1可简化成图2,这也是比较常见的等效电路。 图2. 用大面积惰性电极为辅助电极时电解池的简化电路 Element Freedom Value Error Error %Rs Free(+)2000N/A N/A Cab Free(+)1E-7N/A N/A Cd Fixed(X)0N/A N/A Zf Fixed(X)0N/A N/A Rt Fixed(X)0N/A N/A Cd'Fixed(X)0N/A N/A Zf'Fixed(X)0N/A N/A Rb Free(+)10000N/A N/A Data File: Circuit Model File:C:\Sai_Demo\ZModels\12861 Dummy Cell.mdl Mode: Run Fitting / All Data Points (1 - 1) Element Freedom Value Error Error %Rs Fixed(X )1500N/A N/A Zf Fixed(X )5000N/A N/A Cd Fixed(X ) 1E-6 N/A N/A Data File: Circuit Model File:C:\Sai_Demo\ZModels\Tutor3 R-C.mdl Mode: Run Simulation / Freq. Range (0.01 - 10000Maximum Iterations: 100 B
2020届高考化学二轮复习热点题型微专题突破 2020届高考化学二轮复习热点题型 微专题突破六十电化学综合 一、单选题 1.某化学兴趣小组设计了如图所示的电化学装置,其中乙池为碳呼吸电池,下列说法正确 的是() A. 乙池正极的电极反应式为2CO2+2e?=C2O42? B. 乙池中随着反应的进行,C2O42?的浓度不断减小 C. 每生成1mol的草酸铝,外电路转移3mol电子 D. 甲池中Fe电极发生的反应式为2Cl??2e?=Cl2↑ 2.我国科学家用乙醇燃料电池作电源,电解CO2与H2O生成CO、H2和O2,其电解原理图如 下。下列有关说法正确的是() A. F口通入的物质是乙醇 B. 溶液中的H+由Y极区通过交换膜移向X极区 C. 负极电极反应式为CH3CH2OH?12e?+3H2O=2CO2↑+12H+ D. 当电路中有0.6mol电子通过时,电解得到O2物质的量为0.3mol 3.如图所示,装置Ⅰ是可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电 的化学方程式为2Na2S2+NaBr3Na2S4+3NaBr。闭合开关K时,b极附近先变红色。 下列说法正确的是
A. 闭合K后,b电极附近的pH变小 B. 当有0.01mol Na+通过离子交换膜时,b电极上析出气体体积为112mL C. N极是负极,电极反应为2Na2S2?2e?=2Na++Na2S4 D. 闭合K后,a电极上产生的气体具有漂白性 4.丙烷(C3H8)熔融盐燃料电池和锌蓄电池均为用途广泛的直流电源,放电时二者的总反应 分别为 C3H8+5O2=3CO2+4H2O,2Zn+O2=2ZnO.用丙烷(C3H8)燃料电池为锌蓄电池充电的装置如图所示,下列说法不正确的是() A. 物质M为CO2 B. 燃料电池消耗1mo1 O2时,理论上有4 mol OH?透过b膜向P电极移动 C. a膜、b膜均适宜选择阴离子交换膜 D. 该装置中,锌蓄电池的正极反应式为Zn+2OH??2e?=ZnO+H2O 5.最近,我国科学家利用如图装置实现了SO2的吸收,同时获得了硫磺、84消毒液。下列有 关说法错误的是
7.1 用铂电极电解CuCl 2溶液。通过的电流为20A ,经过15min 后,问:(1)在阴极上能析出多少质量的Cu?(2)在的27℃,100kPa 下阳极上能析出多少体积的的Cl 2(g )? 解:电极反应为:阴极:Cu 2+ + 2e - → Cu 阳极: 2Cl - -2e - → Cl 2(g ) 则:z= 2 根据:Q = nzF=It ()22015Cu 9.32610mol 296500It n zF -?= ==?? 因此:m (Cu )=n (Cu )× M (Cu )= 9.326×10-2×63.546 =5.927g 又因为:n (Cu )= n (Cl 2) pV (Cl 2)= n (Cl 2)RT 因此: 3 223 Cl 0.093268.314300Cl 2.326dm 10010n RT V p ??= ==?()() 7.3 用银电极电解AgNO 3溶液。通电一定时间后,测知在阴极上析出0.078g 的Ag ,并知阳极区溶液中23.376g ,其中含AgNO 30.236g 。已知通电前溶液浓度为1kg 水中溶有7.39g AgNO 3。求 Ag +和 3 NO -迁移数。 解法1:解法1:解该类问题主要依据电极区的物料守恒(溶液是电中性的)。显然阳极区溶液中Ag +的总量的改变如。 n 电解后(Ag +)= n 电解前(Ag +)+ n 电解(Ag +)- n 迁移(Ag +) 则:n 迁移(Ag +)= n 电解前(Ag +)+ n 电解(Ag +)- n 电解后(Ag +) n 电解(Ag +)= ()()4Ag 0.078 7.22910mol Ag 107.9 m M -==? ()3 323.3760.2367.3910(Ag ) 1.00710mol 169.87 n -+ --??= =?解前电 30.236 () 1.38910169.87n +-= =?Ag mol 电解后 n 迁移(Ag +) = 1.007×10-3+7.229×10-4-1.389×10-3=3.403×10-4mol ()4 4 Ag 3.40310Ag 0.477.22910 n t n +-+ -?==?移解 ()= 迁电 则:t ( 3 NO -)= 1 - t (Ag +)= 1 – 0.471 = 0.53 解法2:解该类问题主要依据电极区的物料守恒(溶液是电中性的)。显然阳极区溶液中 3 NO -的总量的改变如下: n 电解后( 3 NO -)= n 电解前( 3 NO -) + n 迁移( 3 NO -) 则:n 迁移( 3 NO -)=n 电解后( 3 NO -)- n 电解前( 3 NO -)
电化学曲线极化曲线阻抗谱分析 一、极化曲线 1.绘制原理 铁在酸溶液中,将不断被溶解,同时产生H2,即:Fe + 2H+ = Fe2+ + H2 (a) 当电极不与外电路接通时,其净电流I总为零。在稳定状态下,铁溶解的阳极电流I(Fe)和H+还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即:(1) I(Fe)的大小反映Fe在H+中的溶解速率,而维持I(Fe),I(H)相等时的电势称为Fe/H+体系的自腐蚀电势εcor。 图1是Fe在H+中的阳极极化和阴极极化曲线图。图2 铜合金在海水中典型极化曲线 当对电极进行阳极极化(即加更大正电势)时,反应(c)被抑制,反应(b)加快。此时,电化学过程以Fe的溶解为主要倾向。通过测定对应的极化电势和极化电流,就可得到Fe/H+体系的阳极极化曲线rba。 当对电极进行阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。同理,可获得阴极极化曲线rdc。 2.图形分析 (1)斜率 斜率越小,反应阻力越小,腐蚀速率越大,越易腐蚀。斜率越大,反应阻力越大,腐蚀速率越小,越耐腐蚀。 (2)同一曲线上各各段形状变化 如图2,在section2中,电流随电位升高的升高反而减小。这是因为此次发生了钝化现象,产生了致密的氧化膜,阻碍了离子的扩散,导致腐蚀电流下降。 (3)曲线随时间的变动 以7天和0天两曲线为例,对于Y轴,七天后曲线下移(负移),自腐蚀电位降低,说明更容易腐蚀。对于X轴,七天后曲线正移,腐蚀电流增大,亦说明更容易腐蚀。 二、阻抗谱 1.测量原理 它是基于测量对体系施加小幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。从这些数据中可以计算出电化学响应的实部和虚部。阻抗中涉及的参数有阻抗幅模(| Z |)、阻抗实部(Z,)、阻抗虚部(Z,,)、相位移(θ)、频率(ω)等变量,同时还可以计算出导纳(Y)和电容(C)的实部和虚部,因而阻抗谱可以通过多种方式表示。
2019年上海各区化学等级考二模试题分类 汇编-电化学 【2018年上海长宁区二模】14.下列关于钢铁发生吸氧腐蚀的分析正确的是() A.吸氧腐蚀是吸热反应 B.铁作原电池正极 C.正极电极反应为:2H2O+O2+4e→4OH- D. 原电池负极反应为:Fe-3e→Fe3+ 【答案】C 【2018年上海杨浦区二模】19. 对金属腐蚀及防护的表述正确的是() A. 金属腐蚀的本质:金属失电子发生还原反应 B. 牺牲阳极的阴极保护法:被保护的金属应做负极 C. 外加电流阴极保护法:被保护的金属应与电源正极相连 D. 金属表面涂油漆:可避免金属与电解质溶液接触 【答案】D 【2018年上海闵行区二模】3.电解饱和食盐水的阳极产物是()A.NaOH B.H2 C.HCl D.Cl2 【答案】D 【2018年上海闵行区二模】18.“双吸剂”含铁粉、活性炭和氯化钠等,可延长食品保质期。其作用原理正确的是() A.主要发生吸氧腐蚀 B.氯化钠充当正极
C.吸收的气体是O2和CO2 D.负极反应为Fe-3e→Fe3+【答案】A 【2018年上海闵行区二模】15.电解CuCl2溶液的装置如右图所示,下列分析正确的是() A.b电极的质量不变 B.a电极是该装置的负极 C.a电极上发生氧化反应 D.电子由b电极经溶液流向a电极【答案】C 【2018年上海崇明区二模】19.右图装置中X和Y均为石墨电极,电解液为滴有酚酞的某浓 度NaCl溶液,电解一段时间后,X极附近溶液先变红。下列有关说法中正确的是() A.X极连接电源正极 B.X极上产生气体有刺激性气味
C.Y极上发生氧化反应 D.电子从X极经过溶液流向Y极 【答案】C 【2018年上海青浦区二模】8.铁棒与石墨用导线连接后,浸入 0.01mol·L-1的食盐溶液中(如右图所示),下列说法正确的是() A.铁棒是阴极 B. 石墨附近产生OH- C.石墨上有Cl2 放出 D.铁棒上有H2放出 【答案】B 【2018年上海普陀区二模】10、右图是一种铁的电化学保护模拟装置,有关叙述正确的是() A. 此装置属于电解池 B. 电子从铁经导线流向锌 C. 铁电极上发生氧化反应
第8讲电化学基础 [主干知识·数码记忆] 一、小试能力知多少(判断正误) (1)(2013·浙江高考)多孔碳可用作氢氧燃料电池的电极材料(√) (2)(2012·江苏高考)Zn具有还原性和导电性,可用作锌锰干电池的负极材料(√) (3)(2012·广东高考)锂碘电池,该电池反应为:2Li(s)+I2(s)===2LiI(s)则碘电极作该电池的负极(×) (4)(2013·福建高考)以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e- 3+2H2O(√) ===CO2- (5)(2012·海南高考)锌与稀硫酸反应时,要加大反应速率可滴加少量硫酸铜(√) 二、必备知识掌握牢 1.明确原电池构成的条件 2.原电池正负极判断的四种方法 (1)根据构成原电池两极的电极材料判断,一般是较活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极; (2)根据电子流动方向或电流方向判断,电子流动方向:由负极流向正极;电流方向:由正极流向负极。 (3)根据原电池电解质溶液中离子的移动方向判断,阳离子向正极移动,阴离子向负极移动。 (4)根据原电池两极发生的变化判断,原电池的负极发生氧化反应;正极发生还原反应。 [典例](2013·安徽高考)热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本
结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。 下列有关说法正确的是() A.正极反应式:Ca+2Cl--2e-===CaCl2 B.放电过程中,Li+向负极移动 C.每转移0.1 mol电子,理论上生成20.7 g Pb D.常温时,在正负极间接上电流表或检流计,指针不偏转 [解析]正极上发生还原反应,A项错误;放电过程中Li+向正极移动,B项错误;由电池总反应式可知,每转移0.1 mol电子,理论上生成0.05 mol Pb,质量为10.35 g,C项错误;常温下,电解质不是熔融态,离子不能移动,不能产生电流,因此连接电流表或检流计,指针不偏转。 [答案] D —————————————————[探规寻律]——————————————— 明确原电池电极反应式、总反应式书写的三步骤 ———————————————————————————————————— [演练1](2013·江苏高考)Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如图。该电池工作时,下列说法正确的是() A.Mg电极是该电池的正极 B.H2O2在石墨电极上发生氧化反应 C.石墨电极附近溶液的pH增大 D.溶液中Cl-向正极移动 解析:选C本题考查原电池原理,意在考查考生对电
应用电化学实验 本课程安排4个综合实验,每个实验4个学时,共16个学时,按照10人一组分别进行。自编实验讲义。实验仪器有:分析天平;直流稳压稳流电源;电化学工作站;恒温水浴;饱和甘汞电极;鲁金毛细管;H 型电解槽;Pt 电极;电解槽;赫尔槽;电力搅拌器、磁力搅拌器;pH 计。 实验1:极化曲线的测定 实验内容:测定Ni 2+离子、Co 2+离子单金属电沉积、以及Ni-Co 合金共电沉积的稳态阴极极化曲线。 一、 实验目的 1.掌握三电极体系装置和电化学工作站的应用。 2.掌握用线性电位扫描法测量极化曲线的原理和实验方法,学会从极化曲线上分析电极过程特征。 2.测定金属电沉积的阴极极化曲线。 3.学会数据的分析和处理。 二、 实验原理 研究电极过程的基本方法是测定极化曲线。电极上电势随电流密度变化的关系曲线称为极化曲线。极化曲线表示了电极电位与电流密度之间的关系,从极化曲线上可以求得任一电流密度下的过电势(超电势),看出不同电流密度时电势变化的趋势,直观地反映了电极反应速度与电极电势的关系。在某一电流密度下极化曲线的斜率i ???称为极化度(极化率),极化度的大小可以衡量极化的程度,判断电极过程的难易。极化度小,电极过程容易进行;极化度大,电极过程受到较大阻碍而难以进行。从极化曲线还可求电极过程动力学参数,如交换电流密度i 0、电子传递系数α、标准速度常数、以及扩散系数;还可以测定反应级数、电化学反应活化能等。 被控制的变量电极电位是随时间连续线性变化的。随时间连续线性变化的电位可用线性方程表示: Vt i +=??; 其中:?——扫描电位,t ——扫描时间,V ——扫描速度,i ?——扫描起点电位。
电化学 1. pH = a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液 的pH>a,则该电解质可能是( ) A NaOH B、H2SO C、AgNO D N Q SQ 2. 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌一锰碱性电池以 氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnQ(s)+H 20(l)==Zn(OH)2(s)+Mn2Q(s) 下列说法错误的是 ( ) A .电池工作时,锌失去电子 B .电池正极的电极反应式为:2MnQs)+H2O(1)+2e—=M R O(S)+20H—(aq) C .电池工作时,电子由正极通过外电路流向负极 D .外电路中每通过电子,锌的质量理论上减小 3. 下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是() A. a电极是负极 B. b电极的电极反应为:4OH 4e 2H 2O O2 C. 氢氧燃料电池是一种具有应用前景的绿色电源 D. 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型 发电装置 4. 下图中能验证氯化钠溶液(含酚酞)电解产物的装置是D ( ) 5. —种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧 化钇(Y2Q)的氧化锆(ZrO2)晶体,在熔融状态下能传导CT。下列对该燃料电池说法正确的是( ) A .在熔融电解质中,Q—由负极移向正极 B .电池的总反应是:2CH。+ 130 2—8CQ + IOH2O C .通入空气的一极是正极,电极反应为:Q + 4e —= 2O2— D .通入丁烷的一极是正极,电极反应为:GHw + 26e —+ 13O2—== 4CQ + 5HQ 6. 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳 定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO + 8H 2O -放电3Zn(OH) 2 + 2Fe(OH) 3 + 4KOH 0充由 下列叙述不正确的是( ) A. 放电时负极反应为:Zn—2e—+2OH= Zn (OH)2 B. 充电时阳极反应为:Fe(OH)3 —3e—+ 5 OH —= FeO4 + 4H 2O C. 放电时每转移3 mol电子,正极有1mol ?FeQ被氧化 D. 放电时正极附近溶液的碱性增强 7. 金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu Pt等杂质,可用电解法 制备高纯度的镍,下列叙述正确的是(已知:氧化性F『v Ni2+ 锂离子电池的电化学阻抗谱分析 1. 锂离子电池的特点 锂离子电池充电时,正极中的锂离子从基体脱出,嵌入负极;而放电时,锂离子会从负极中脱出,嵌入正极。因此锂离子电池正负极材料的充放电容量、循环稳定性能和充放电倍率等重要特性均与锂离子在嵌合物电极材料中的脱出和嵌入过程密切相关。这些过程可以很好地从电化学阻抗谱(EIS )的测量与解析中体现出来。 2. 电化学阻抗谱的解析 2.1. 高频谱解析 嵌合物电极的EIS 谱的高频区域是与锂离子通过活性材料颗粒表面SEI 膜的扩散迁移相关的半圆(高频区域半圆),可用一个并联电路R SEI /C SEI 表示。 R SEI 和C SEI 是表征锂离子活性材料颗粒表面SEI 膜扩散迁移过程的基本参数,如何理解R SEI 和C SEI 与SEI 膜的厚度、时间、温度的关系,是应用EIS 研究锂离子通过活性材料颗粒表面SEI 膜扩散过程的基础。 2.1.1. 高频谱解析R SEI 和C SEI 与SEI 膜厚度的关系 SEI 膜的电阻R SEI 和电容C SEI 与SEI 膜的电导率、介电常数ε的关系可用简单的金属导线的电阻公式和平行板电容器的电容公式表达出来 S l R SEI ρ = (1) l S C SEI ε= (2) 以上两式中S 为电极的表面积,l 为SEI 膜的厚度。倘若锂离子在嵌合物电极的嵌入和脱出过程中ρ、ε和S 变化较小,那么R SEI 的增大和C SEI 的减小就意味着SEI 厚度的增加。由此根据R SEI 和C SEI 的变化,可以预测SEI 膜的形成和增长情 2.1.2. SEI 膜的生长规律(R SEI 与时间的关系) 嵌合物电极的SEI 膜的生长规律源于对金属锂表面SEI 膜的生长规律的分析 专题17 电化学原理综合应用 1.【2018天津卷】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题: (3)O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。 电池的负极反应式:________。 电池的正极反应式:6O 2+6e?6O2? 6CO 2+6O2?3C2O42? 反应过程中O2的作用是________。 该电池的总反应式:________。 【答案】Al–3e–=Al3+(或2Al–6e–=2Al3+)催化剂 2Al+6CO2=Al2(C2O4)3 【解析】 2.【2018江苏卷】NO x(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NO x是环境保护的重要课题。 (2)用稀硝酸吸收NO x,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:____________________________________。 【答案】(2)HNO2?2e?+H2O3H++NO3? 【解析】 精准分析:(2)根据电解原理,阳极发生失电子的氧化反应,阳极反应为HNO2失去电子生成HNO3,1molHNO2 反应失去2mol电子,结合原子守恒和溶液呈酸性,电解时阳极电极反应式为HNO2-2e-+H2O=NO3-+3H+。3.【2018新课标1卷】焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为_____________。电解后,__________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。 【答案】(3)2H2O-4e-=4H++O2↑ a 【解析】 4.【2018新课标1卷】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示: (4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为______________;沉积锌后的电解液可返回 _______工序继续使用。 【答案】(4)Zn2++2e-=Zn 溶浸 【解析】 精准分析:焙烧时硫元素转化为SO2,然后用稀硫酸溶浸,生成硫酸锌、硫酸亚铁和硫酸镉,二氧化硅与稀硫酸不反应转化为滤渣,由于硫酸铅不溶于水,因此滤渣1中还含有硫酸铅。由于沉淀亚铁离子的pH较大,需要将其氧化为铁离子,通过控制pH得到氢氧化铁沉淀;滤液中加入锌粉置换出Cd,最后将滤液电解得到金属锌。则 实验一恒电流法测定阴极极化曲线 一、实验目的 1、掌握恒电流法测定阴极极化曲线的基本原理和方法; 2、学习分析极化曲线的方法。 二、基本原理 极化是电化学术语,含有偏离的意思,它是以热力学平衡电位为基点的偏离。通常,阴极的电位偏离其自然腐蚀电位向负的方向移动,叫做阴极极化,反之为阳极极化。使之偏离的方式可以不同,借外电路通以电流达到电极电位偏离平衡电位是常见的基本方式,这电流称为极化电流,电极电位与平衡电位之差称为极化过电位。通常实验测量极化电流与极化过电位(或者直接用电极电位)的关系曲线称为电极的极化曲线。它是研究电极过程动力学的基本实验手段。测量极化曲线通常采用两种方法:恒电流法和恒电位法。 本实验是用恒电流方法来测量碳钢在3%NaCl水溶液中的阴极极化曲线。恒电流法是以电流为主变量,既通过调节电路电阻使某一恒定电流通过电极,并在电位达到稳定后读取电位值,然后在改变电流使之恒定在个一新数值,再记下新的电位,并以此类推,便可以得到一系列的电流和电位的对应值。把极化电流密度i对阴极电位ψ作图即得到阴极极化曲线。 通过阴极极化曲线的测定,可以知道金属在该介质中的阴极极化性能,并提供保护电位和保护电流密度的参数数据。 三、实验仪器和线路 1、实验用品 数字万用表一台 滑线变阻器一个 电阻箱一个 直流电源一个 洗耳球一个 鲁金毛细管一个 饱和甘汞电极一个 铂电极一个 微安表、毫安表各一个 自由夹与十字夹各三个 游标卡尺一把 玻璃缸(2000mL)一个 台天平及砝码一套 导线若干 碳钢试样,3%NaCl水溶液,无水乙醇,脱脂棉球,滤纸,饱和氯化钾溶液,金刚纱布(1#、0#、2#各一张)。 2、测量线路: 极化回路由电源B、变阻器R、电流表A、换向开关K、辅助电极和研究电极等组成,电位测量回路由高阻抗电压表D、参比电极、待测电极组成。 实验中用饱和甘汞电极作为参比电极,用铂电极作为辅助电极,铂电极是用铂片烧焊在玻璃管内,由铜导线引出。 四、测量步骤: 1、电极处理:用金钢砂布1#至2/0#打磨试样表面,测量其尺寸,然后用无水乙醇脱脂。 2、按图接好线路。在电解池中加入3%氯化钠水溶液1600mL左右。固定好辅助电极和鲁金毛细管,在盐桥活塞打开的情况下用洗耳球将实验液吸入毛细管内至活塞处,关住活塞,在活塞上部用滴管加入饱和氯化钾溶液后,插入饱和甘汞电极。 3、把试样放入电解池的溶液中,先不接通电源,经指导教师检查后方可进行测量。现测定工作电极的稳定电位,一般在20分钟内可以达到基本稳定。若较长时间以后还不稳定,可以适当通以阴极小电流(大约5μA/cm2)进行活化,然后切断电源,重新测定自然腐蚀电位,使电位在几mV内波动,即可视为稳定,记录所测数据,然后既可进行极化曲线的测量。 4、进行阴极极化测量,调节电阻,使极化电流达到一定值,在一定的时间间隔后(最好等到电流稳定后读数)读取电位值。如此以某一定的电流步进速率每隔几分钟调节一次电流,稳定后读下相应的电位值。直到通入阴极电流很大,而阴极的电位变化不大时即可停止实验。在此过程中,要注意观察实验内容(十三)锂离子电池的电化学阻抗谱分析
三年高考2020高考化学试题分项版解析 专题17 电化学原理综合应用(含解析)
电化学基础实验指导书