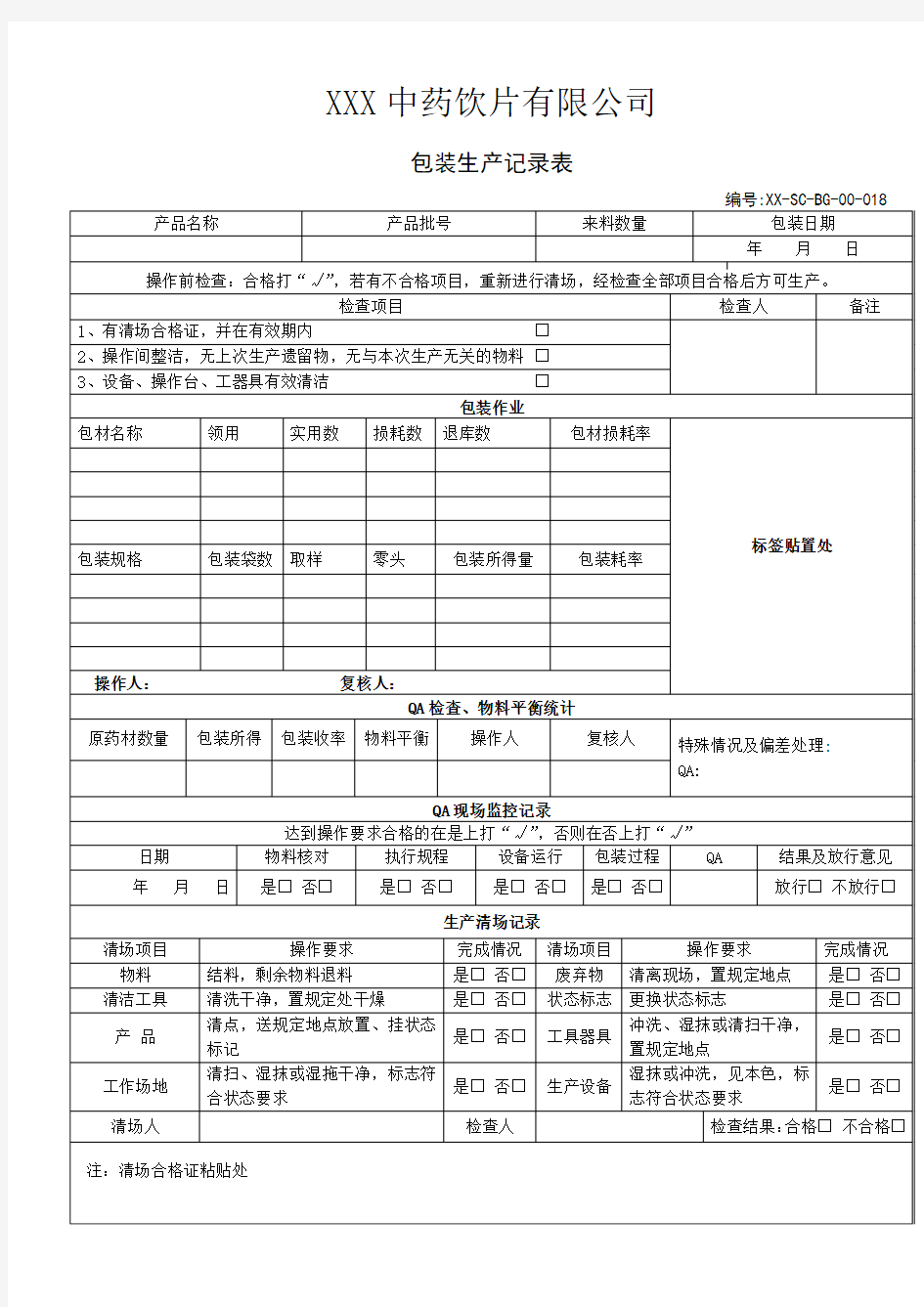
XXX中药饮片有限公司
包装生产记录表
编号:XX-SC-BG-00-018
江西臻药堂药业股份有限公司 1.产品概述 1.1 品名:枯矾,成品代码CP70032。 1.2 性状: 本品呈不规则的块状或粒状。质硬而脆。气微,味酸、微甘而极涩。 1.3 性味与归经: 酸、涩,寒。归肺、脾、肝、大肠经& 1.4 功能与主治:外用解毒杀虫,燥湿止痒;内服止血止泻,祛除风痰。外治用于湿疹,疥癣,脱肛,痔疮,婷耳流脓;内服用于久泻不止,便血,崩漏,癫痫发狂。枯矾收湿敛疮,止血化腐。用于湿疹湿疮,脱肛,痔疮,聘耳流脓,阴痒带下,鼻衄齿衄,鼻癔肉。 1.5 用法用量:0.6?1.5g。外用适量,研末敷或化水洗患处。 1.6 规格与包装规格:3g/6g/9g/10g/15g/0.25kg/0.5kg/1kg/2kg/5kg/30kg/40kg/50kg包。 1.7贮存:置干燥处。 2.处方依据及制法 2.1 依据: 《黑龙江省中药饮片炮制规范》2012年版 2.2 处方 白矾 2.3 批量 每批按100kg进行换算物料消耗定额。 2.4制法 取原药材,净制、锻制。
3.生产工艺流程图 4.饮片生产过程、工艺条件及质量风险控制点和风险控制措施 4.1生产准备 4.1.1 文件准备 4.1.1.1中药饮片批生产指令明确了饮片批品种名称、批号、生产批量、检验单号、投料量等。 4.1.1.2中药饮片批包装指令明确了包装品种名称、规格、批号、包装批量、包装用量等。 4.1.1.3生产品种应有质量标准、工艺规程、岗位标准操作程序。 4.1.1.4生产地点应有卫生要求的文件规定和卫生清洁标准操作程序。 4.1.1.5使用设备应有相应的设备操作、维护保养、清洁标准操作程序。 4.1.1.6容器具清洁应有相应的标准操作程序。 4.1.1.7应有岗位所需生产记录(含清场),工序运行状态标志、设备运行状态标志、物料领料单等空白表格。 4.1.1.8其他有关执行文件。 4.1.1.9上述文件均应为现行文件。 4.1.2物料准备 4.1.2所用物料与中药饮片批生产指令或中药饮片批包装指令或工艺规程相符。 4.1.2.1核对领(配)料单或物料标签等内容,如物料名称、批号、数量等,应准确无误。 4.1.2.2检查物料外包装或容器,应完好、清洁、物料无污染,并称量、复核。 4.1.3现场检查
1.目的
为更好的确保每批订单在生产过程中能顺利完成该产品,特制定本程序进行规范化管理,提前防范。 2.适用范围 适用于本公司制程生产过程中任何订单首件/首批确认流程。 3.职责 3.1生产部负责首件制作及送检,品质IPQC参与制作 3.2品质部.,工程部, 生产部,.负责组织首件确认、生产时质量标准落实监督,确认 包括原材料、尺寸、工艺制作方法、上下道工序组装适配。 3.3工程部负责新产品及配合旧产品异常时首件确认 3.4首件确认不合格或首件未经确认擅自生产,出现质量异常直接由生产责任者负 责 3.5首件确认失误或首件未确认完便生产,造成质量异常由相关确认者负责。 4. 操作说明 4.1 品质收到生产送检首样根据产品图纸、BOM、样品、检验标准等资料标准对照 首检项目逐项进行确认,进行首样确认时必需通知《品质部. 工程部. 生产部》三方一起进行确认。 4.2《品质部. 工程部. 生产部》在进行确认中发生品质异常问题,由工程给出书 面改善意见标准。 4.3如确认首件过程中出现标准不统一或无法判定结果,最后由总经办高层裁决。首 样确认完毕,生产主管要按标准要求来作业。 4.4对通过的型号开始安排进行首批确认,对不合格型号按改善意见重新制作合格样 或返修合格再次送检确认。 4.5生产必须等首件确认合格后方能进行批量生产,以免造成不必要返工浪费。4.6首件确认后,IPQC第一时间到各工位确认生产产品质量与标准要求是否一致、
是否按首样样板生产首批确认。 4.7确认合格首件需先放在首件放置处,直到首批/批量生产完毕后才流入下工序或 包装 4.8 每批订单首件需生产4-8个箱体作为首批确认对象。 5.相关支持文件 5.1《IPC-610-D》 6.相关记录 6.1 《装配首件样机确认表》 6.2 《品质异常单》
中药饮片生产检查要点 一、检查应重点关注五大方面内容 1、中药材质量:中药材是否符合药用标准,产地是否相对稳定。 2、中药饮片标准:中药饮片是否执行国家药品标准,或省、自治区、直辖市食品药品监督管理部门制定的炮制规范或批准的标准。 3、中药饮片炮制:中药饮片是否按标准或规范制定相应的工艺规程;是否按照品种工艺规程生产;中药饮片生产条件是否与生产许可范围相适应,是否有外购中药饮片的中间产品或成品进行分包装或改换包装标签。 4、人员履职能力:企业相关岗位人员是否具有中药炮制和质量控制的专业知识和实际操作技能,是否具备鉴别中药材和中药饮片真伪优劣的能力。 5、诚实守信原则:是否有虚假、欺骗行为,是否有伪造批生产记录、检验记录以及关键人员冒名顶替或兼职等。 二、检查项目、检查方法及要点 (一)机构与人员 检查项目 1、组织机构 2、质量管理部门 3、关键人员(企业负责人、生产管理负责人、质量管理负责人、质量受权人)和质量保证、质量控制、生产、仓储等人员 4、培训管理 5、卫生 检查方法及要点 1、检查企业的组织机构图,质量管理部门是否独立设立,职责权限是否建立,组织机构的各个岗位是否履行自己的职责,从而保证整个组织机构的有效运行。 2、检查过程中通过谈话了解企业负责人是否参与企业生产、质量管理,实际履职能力是否符合要求,是否为保证产品质量提供足够的资源。
3、检查生产负责人、质量负责人(质量受权人)的档案,通过查看学历及相关证书的原件,必要时通过网络查询,以判断其真实性以及资质是否符合要求;是否存在兼职;通过谈话交流了解是否能履行实际职能。 4、检查工资发放、社保缴费等财务单据以及通过谈话判断企业的关键人员以及质量保证、质量控制、生产、仓储等人员是否为企业的全职在岗人员。 5、通过谈话交流以及实际检验操作判断中药材、中药饮片检验人员是否具备中药学知识、中药分析检验知识和实际检验操作技能,是否具备鉴别中药材和中药饮片真伪优劣的能力。 6、通过谈话交流以及实际炮制操作判断从事中药材炮制操作人员是否具有中药炮制专业知识和实际操作技能;从事毒性中药材等有特殊要求的生产操作人员,是否具有相关专业知识和技能,并熟知相关的劳动保护要求。 7、通过谈话交流和现场考核判断负责中药材采购及验收的人员是否具备鉴别中药材真伪优劣的能力;从事养护、仓储保管人员是否掌握中药材、中药饮片贮存养护知识与技能。 8、抽查员工的培训档案,检查企业实施培训的内容是否与岗位的需要相适应,通过谈话交流和实际操作考核,评价培训实施的效果。 9、检查企业是否有厂房卫生、工艺卫生、人员卫生等管理制度以及各项卫生措施,是否能防止污染与交叉污染;直接接触药品的生产人员是否每年至少进行一次健康检查;从事对人体有毒、有害的操作人员是否按规定着装防护。 (二)厂房与设施 检查项目 1、生产、行政、辅助和生活区总体布局 2、生产与仓储面积与生产规模的匹配性 3、直接口服饮片生产环境 4、毒性中药材的加工炮制 5、防虫、防鼠措施 6、仓库温湿度控制 检查方法及要点 1、检查时结合企业申报的平面布局图,实地查看企业厂区内所有建筑物(每层)的用途,确认企业是否有独立的生产厂区,生产区与生活区是否严格分开,用于其它生产经营的物品没有放在中药饮片生产厂区内,识别是否有认证车间外的生产场地或仓库。
皖食药监药化生〔2015〕62号 各市、县(市、区)食品药品监督管理局: 根据《药品生产质量管理规范(2010年修订)》及中药饮片附录的要求,为规范中药饮片生产监督检查和认证工作,保证中药饮片生产检查工作质量,省局制定了《中药饮片生产检查要点》,现印发你们,以进一步指导检查人员检查和认证工作。 附件:中药饮片生产检查要点 安徽省食品药品监督管理局 2015年10月13日 附件:
中药饮片生产检查要点 一、检查应重点关注五大方面内容 1、中药材质量:中药材是否符合药用标准,产地是否相对稳定。 2、中药饮片标准:中药饮片是否执行国家药品标准,或省、自治区、直辖市食品药品监督管理部门制定的炮制规范或批准的标准。 3、中药饮片炮制:中药饮片是否按标准或规范制定相应的工艺规程;是否按照品种工艺规程生产;中药饮片生产条件是否与生产许可范围相适应,是否有外购中药饮片的中间产品或成品进行分包装或改换包装标签。 4、人员履职能力:企业相关岗位人员是否具有中药炮制和质量控制的专业知识和实际操作技能,是否具备鉴别中药材和中药饮片真伪优劣的能力。 5、诚实守信原则:是否有虚假、欺骗行为,是否有伪造批生产记录、检验记录以及关键人员冒名顶替或兼职等。 二、检查项目、检查方法及要点 (一)机构与人员 检查项目 1、组织机构 2、质量管理部门 3、关键人员(企业负责人、生产管理负责人、质量管理负责人、质量受权人)和质量保证、质量控制、生产、仓储等人员 4、培训管理 5、卫生 检查方法及要点
1、检查企业的组织机构图,质量管理部门是否独立设立,职责权限是否建立,组织机构的各个岗位是否履行自己的职责,从而保证整个组织机构的有效运行。 2、检查过程中通过谈话了解企业负责人是否参与企业生产、质量管理,实际履职能力是否符合要求,是否为保证产品质量提供足够的资源。 3、检查生产负责人、质量负责人(质量受权人)的档案,通过查看学历及相关证书的原件,必要时通过网络查询,以判断其真实性以及资质是否符合要求;是否存在兼职;通过谈话交流了解是否能履行实际职能。 4、检查工资发放、社保缴费等财务单据以及通过谈话判断企业的关键人员以及质量保证、质量控制、生产、仓储等人员是否为企业的全职在岗人员。 5、通过谈话交流以及实际检验操作判断中药材、中药饮片检验人员是否具备中药学知识、中药分析检验知识和实际检验操作技能,是否具备鉴别中药材和中药饮片真伪优劣的能力。 6、通过谈话交流以及实际炮制操作判断从事中药材炮制操作人员是否具有中药炮制专业知识和实际操作技能;从事毒性中药材等有特殊要求的生产操作人员,是否具有相关专业知识和技能,并熟知相关的劳动保护要求。 7、通过谈话交流和现场考核判断负责中药材采购及验收的人员是否具备鉴别中药材真伪优劣的能力;从事养护、仓储保管人员是否掌握中药材、中药饮片贮存养护知识与技能。 8、抽查员工的培训档案,检查企业实施培训的内容是否与岗位的需要相适应,通过谈话交流和实际操作考核,评价培训实施的效果。 9、检查企业是否有厂房卫生、工艺卫生、人员卫生等管理制度以及各项卫生措施,是否能防止污染与交叉污染;直接接触药品的生产人员是否每年至少进行一次健康检查;从事对人体有毒、有害的操作人员是否按规定着装防护。
附件1 中药饮片 第一章范围 第一条本附录适用于中药饮片生产管理和质量控制的全过程。 第二条产地趁鲜加工中药饮片的,按照本附录执行。 第三条民族药参照本附录执行。 第二章原则 第四条中药饮片的质量与中药材质量、炮制工艺密切相关,应当对中药材质量、炮制工艺严格控制;在炮制、贮存和运输过程中,应当采取措施控制污染,防止变质,避免交叉污染、混淆、差错;生产直接口服中药饮片的,应对生产环境及产品微生物进行控制。 第五条中药材的来源应符合标准,产地应相对稳定。 第六条中药饮片必须按照国家药品标准炮制;国家药品标准没有规定的,必须按照省、自治区、直辖市食品药品监督管理部门制定的炮制规范或审批的标准炮制。 第七条中药饮片应按照品种工艺规程生产。中药饮片生产条件应与生产许可范围相适应,不得外购中药饮片的中间产品或成品进行分包装或改换包装标签。
第三章人员 第八条企业的生产管理负责人应具有药学或相关专业大专以上学历(或中级专业技术职称或执业药师资格)、三年以上从事中药饮片生产管理的实践经验,或药学或相关专业中专以上学历、八年以上从事中药饮片生产管理的实践经验。 第九条企业的质量管理负责人、质量受权人应当具备药学或相关专业大专以上学历(或中级专业技术职称或执业药师资格),并有中药饮片生产或质量管理五年以上的实践经验,其中至少有一年的质量管理经验。 第十条企业的关键人员以及质量保证、质量控制等人员均应为企业的全职在岗人员。 第十一条质量保证和质量控制人员应具备中药材和中药饮片质量控制的实际能力,具备鉴别中药材和中药饮片真伪优劣的能力。 第十二条从事中药材炮制操作人员应具有中药炮制专业知识和实际操作技能;从事毒性中药材等有特殊要求的生产操作人员,应具有相关专业知识和技能,并熟知相关的劳动保护要求。 第十三条负责中药材采购及验收的人员应具备鉴别中药材真伪优劣的能力。 第十四条从事养护、仓储保管人员应掌握中药材、中药饮片贮存养护知识与技能。 第十五条企业应由专人负责培训管理工作,培训的内容应包括中药专业知识、岗位技能和药品GMP相关法规知识等。 第十六条进入生产区的人员应进行更衣、洗手;进入洁净区的工作服的选材、式样及穿戴方式应符合通则的要求;从事对人体
2010版GMP附录中药饮片 第一章范围 第一条本附录适用于中药饮片生产管理和质量控制的全过程。 第二条产地趁鲜加工中药饮片的,按照本附录执行。 第三条民族药参照本附录执行。 第二章原则 第四条中药饮片的质量与中药材质量、炮制工艺密切相关,应当对中药材质量、炮制工艺严格控制;在炮制、贮存和运输过程中,应当采取措施控制污染,防止变质,避免交叉污染、混淆、差错;生产直接口服中药饮片的,应对生产环境及产品微生物进行控制。 第五条中药材的来源应符合标准,产地应相对稳定。 第六条中药饮片必须按照国家药品标准炮制;国家药品标准没有规定的,必须按照省、自治区、直辖市食品药品监督管理部门制定的炮制规范或审批的标准炮制。 第七条中药饮片应按照品种工艺规程生产。中药饮片生产条件应与生产许可范围相适应,不得外购中药饮片的中间产品或成品进行分包装或改换包装标签。 第三章人员 第八条企业的生产管理负责人应具有药学或相关专业大专以上学历(或中级专业技术职称或执业药师资格)、三年以上从事中药饮片生产管理的实践经验,或药学或相关专业中专以上学历、八年以上从事中药饮片生产管理的实践经验。 第九条企业的质量管理负责人、质量受权人应当具备药学或相关专业大专以上学历(或中级专业技术职称或执业药师资格),并有中药饮片生产或质量管理五年以上的实践经验,其中至少有一年的质量管理经验。 第十条企业的关键人员以及质量保证、质量控制等人员均应为企业的全职在岗人员。 第十一条质量保证和质量控制人员应具备中药材和中药饮片质量控制的实际能力,具备鉴别中药材和中药饮片真伪优劣的能力。 第十二条从事中药材炮制操作人员应具有中药炮制专业知识和实际操作技能;从事毒性中药材等有特殊要求的生产操作人员,应具有相关专业知识和技能,并熟知相关的劳动保护要求。 第十三条负责中药材采购及验收的人员应具备鉴别中药材真伪优劣的能力。 第十四条从事养护、仓储保管人员应掌握中药材、中药饮片贮存养护知识与技能。 第十五条企业应由专人负责培训管理工作,培训的内容应包括中药专业知识、岗位技能和药品GMP相关法规知识等。 第十六条进入生产区的人员应进行更衣、洗手;进入洁净区的工作服的选材、式样及穿戴方式应符合通则的要求;从事对人体有毒、有害操作的人员应按规定着装防护,其专用工作服与其他操作人员的工作服应分别洗涤、整理,并避免交叉污染。 第四章厂房与设施 第十七条生产区应与生活区严格分开,不得设在同一建筑物内。 第十八条厂房与设施应按生产工艺流程合理布局,并设置与其生产规模相适应的净制、切制、炮炙等操作间。同一厂房内的生产操作之间和相邻厂房之间的生产操作不得互相妨碍。第十九条直接口服饮片的粉碎、过筛、内包装等生产区域应按照D级洁净区的要求设置,企业应根据产品的标准和特性对该区域采取适当的微生物监控措施。 第二十条毒性中药材加工、炮制应使用专用设施和设备,并与其他饮片生产区严格分开,
《药品生产质量管理规范(2016年修订)》附录——中药饮 片【最新资料】 附件1 中药饮片 第一章范围 第一条本附录适用于中药饮片生产管理和质量控制的全过程。 第二条产地趁鲜加工中药饮片的~按照本附录执行。 第三条民族药参照本附录执行。 第二章原则 第四条中药饮片的质量与中药材质量、炮制工艺密切相关~应当对中药材质量、炮制工艺严格控制,在炮制、贮存和运输过程中~应当采取措施控制污染~防止变质~避免交叉污染、混淆、差错,生产直接口服中药饮片的~应对生产环境及产品微生物进行控制。 第五条中药材的来源应符合标准~产地应相对稳定。 第六条中药饮片必须按照国家药品标准炮制,国家药品标准没有规定的~必须按照省、自治区、直辖市食品药品监督管理部门制定的炮制规范或审批的标准炮制。 第七条中药饮片应按照品种工艺规程生产。中药饮片生产条件应与生产许可范围相适应~不得外购中药饮片的中间产品或成品进行分包装或改换包装标签。 — 3 — 第三章人员
第八条企业的生产管理负责人应具有药学或相关专业大专以上学历,或中级专业技术职称或执业药师资格,、三年以上从事中药饮片生产管理的实践经验~或药学或相关专业中专以上学历、八年以上从事中药饮片生产管理的实践经验。 第九条企业的质量管理负责人、质量受权人应当具备药学或相关专业大专以上学历,或中级专业技术职称或执业药师资格,~并有中药饮片生产或质量管理五年以上的实践经验~其中至少有一年的质量管理经验。 第十条企业的关键人员以及质量保证、质量控制等人员均应为企业的全职在岗人员。 第十一条质量保证和质量控制人员应具备中药材和中药饮片质量控制的实际能力~具备鉴别中药材和中药饮片真伪优劣的能力。 第十二条从事中药材炮制操作人员应具有中药炮制专业知识和实际操作技能,从事毒性中药材等有特殊要求的生产操作人员~应具有相关专业知识和技能~并熟知相关的劳动保护要求。 第十三条负责中药材采购及验收的人员应具备鉴别中药材真伪优劣的能力。 第十四条从事养护、仓储保管人员应掌握中药材、中药饮片贮存养护知识与技能。 第十五条企业应由专人负责培训管理工作~培训的内容应包括中药专业知识、岗位技能和药品GMP相关法规知识等。 第十六条进入生产区的人员应进行更衣、洗手,进入洁净区的工作服的选材、式样及穿戴方式应符合通则的要求,从事对人体 — 4 — 有毒、有害操作的人员应按规定着装防护~其专用工作服与其他操作人员的工作服应分别洗涤、整理~并避免交叉污染。 第四章厂房与设施
中药饮片生产人员GMP培训综合考试卷 (考前复习资料) ★以上复习试卷,请参训人员认真按本资料复习。最终考题内容和体型将在以上复习资料中随机、适量选出。 一、填空题:(请在划线处填写正确答案) 1、GMP的中文全称是:药品生产质量经管规范。 2、进入生产区的操作人员必须更鞋、更衣、更帽、洗手后进人生产区。 3、药材凡经净制、切制或炮炙等处理,均称为饮片。 4、中药饮片的原料是符合质量规范的中药材。须按国家药品规范进行主要工程(至少真伪鉴别)的检验。 5、中药材的浸润原则是药透水尽。 6、印刷包装材料应当设置专门区域妥善存放,未经批准人员不得进入。 7、药材软化是要分别规定温度、水量、时间等条件,应少泡多润,防止有效成分流失。 8、从事药材炮制操作人员应该具有中药炮制专业知识和实际操作技能两方面素质。 9、从事中药饮片生产的各级人员应该按要求进行培训和考核后方可上岗。 10、中药饮片生产涉及用火时,有文火和武火之分。 11、炙法是炮制中炮炙项下的一种方法,包括了酒炙、醋炙、盐炙、姜炙、蜜炙、油炙。其中蜜炙时需要炼蜜。 12、中药饮片生产时,辅料有药用规范的应使用药用规范执行,没有药用规范的应按食用或其它相关规范执行。 13、制炭时应存性,并防止灰化,更要避免复燃。 14、物料使用时应按批发放,并按入库时间顺序先进先出。 15、生产时须在生产状态牌上填写好生产产品的名称、批号和日期。 16、在生产过程中,进行每项操作时应当及时记录,操作结束后,应当由生产操作人员确认并签注姓名和日期。 17、每次生产结束后应当清场,确保设备和工作场所没有遗留与本次
生产有关的物料和文件记录。 18、饮片生产岗位操作人员应按操作规程操作,不得任意更改。 19、中药材必须先经筛、拣、选、洗等净化处理后再浸润。 20、有中药饮片生产的企业,仓库人员必须掌握中药材、中药饮片贮存、养护的知识与技能。 21、库存中药材、中药饮片的保管必须按规定方法定期养护,防止害虫、霉菌的污染,并有详细记录。 22、原料、辅料要按品种、规格、批号分开存放。 23、物料应该按规定的使用期限储存,期满后必须按规定复验;储存期内如有特殊情况也要及时复验。 二、单选题(请在括号内填写字母序号) 1、中药饮片生产用水应当适合其用途,最低要求应当采用(B)。 A.自来水 B.饮用水 C.纯化水 D.注射用水 2、中药饮片零头包装合箱外要标明全部批号,并建立合箱记录。可以几个批号为—个合箱?(B) A.一个 B.二个 C.三个 D. 四个 3、药材炮炙中,蒸、煮、炖时,除另有规定外,一般每100kg待炮炙品,用水或规定的辅料(C)。 A.5~10kg B.10~20kg C. 20~30kg D. 30~40kg E.与待炮炙品等量 4、洗涤某个拣选后的药材时,对水的使用要求是(C) A.流动水重复使用 B.使用静止水 C.使用流动水,且用过的水不能用于洗涤其它药材。 5、下列哪一项不是实施GMP的目标要素:(D) A. 将人为的差错控制在最低的限度 B. 防止对药品的污染、交叉污染以及混淆、差错等风险 C. 建立严格的质量保证体系,确保产品质量 D. 与国际药品市场全面接轨 6、在蒸或炖中药材时,密封指将容器或器具用适宜的方式封闭,以防止外部(B)侵入。 A.微生物 B.水分 C.粉尘 D.空气 7、下述活动中应当有相应的操作规程,其过程和结果应当有记录的
中药饮片 第一章范围 第一条本附录适用于中药饮片生产管理和质量控制的全过程。 第二条产地趁鲜加工中药饮片的,按照本附录执行。 第三条民族药参照本附录执行。 第二章原则 第四条中药饮片的质量与中药材质量、炮制工艺密切相关,应当对中药材质量、炮制工艺严格控制;在炮制、贮存和运输过程中,应当采取措施控制污染,防止变质,避免交叉污染、混淆、差错;生产直接口服中药饮片的,应对生产环境及产品微生物进行控制。 第五条中药材的来源应符合标准,产地应相对稳定。 第六条中药饮片必须按照国家药品标准炮制;国家药品标准没有规定的,必须按照省、自治区、直辖市食品药品监督管理部门制定的炮制规范或审批的标准炮制。 第七条中药饮片应按照品种工艺规程生产。中药饮片生产条件应与生产许可范围相适应,不得外购中药饮片的中间产品或成品进行分包装或改换包装标签。 第三章人员
第八条企业的生产管理负责人应具有药学或相关专业大专以上学历(或中级专业技术职称或执业药师资格)、三年以上从事中药饮片生产管理的实践经验,或药学或相关专业中专以上学历、八年以上从事中药饮片生产管理的实践经验。 第九条企业的质量管理负责人、质量受权人应当具备药学或相关专业大专以上学历(或中级专业技术职称或执业药师资格),并有中药饮片生产或质量管理五年以上的实践经验,其中至少有一年的质量管理经验。 第十条企业的关键人员以及质量保证、质量控制等人员均应为企业的全职在岗人员。 第十一条质量保证和质量控制人员应具备中药材和中药饮片质量控制的实际能力,具备鉴别中药材和中药饮片真伪优劣的能力。 第十二条从事中药材炮制操作人员应具有中药炮制专业知识和实际操作技能;从事毒性中药材等有特殊要求的生产操作人员,应具有相关专业知识和技能,并熟知相关的劳动保护要求。 第十三条负责中药材采购及验收的人员应具备鉴别中药材真伪优劣的能力。 第十四条从事养护、仓储保管人员应掌握中药材、中药饮片贮存养护知识与技能。 第十五条企业应由专人负责培训管理工作,培训的内容应包括中药专业知识、岗位技能和药品GMP相关法规知识等。