
空气中二氧化碳含量的测定实验教案
化学一班申伟静郝冬丽张冬冬徐亚辉
一,教学目标
知识目标:
1、了解测定二氧化碳含量的简单方法;
2、掌握二氧化碳的基本性质和生活中的应用;
3、通过老师讲解理解二氧化碳在整个环境中作用。
技能目标:
1、通过观看教师的演示实验提高对实验的观察、比较能力。
2、学习掌握如何使用针筒和使用玻璃仪器要注意事项;
3、感悟用分类、对比的学习方法来学习化学的重要作用。
情感目标:
1、通过实验探究来激发学生学习的积极性和主动性,
2、实验初步养成严谨求实的科学态度。
3、通过对课程的学习可以让同学认识到环境保护重要性。
二,教材分析
本节主要围绕探究测定空气中二氧化碳含量的实验,学习定量测定混合气体中某种气体含量的方法,认识空气中二氧化碳组成及表示方法,增进对二氧化碳的理解。增加学生爱护环境的意识。
三,学情分析
已知
1、学生通过前面的学习,已了解和初步掌握了关于二氧化碳的基本性质。
2、学生通过对实验前的预习掌握了空气中二氧化碳含量测定的基本原理和操作方法。
3、学生在学习中,知道了二氧化碳在我们生活中的作用和在生活中应用。
4、学生在生活中知道保护环境重要意义。
未知
1、学生在实际操作中会出现不规范操作,对实验的结果造成影响。还可能损坏仪器。
2、学生在生活中虽然知道环保知识,但付诸实践上仍然不知如何做。
3、学生缺少实验中观察实验现象变化能力。在实验过程中都需要一直观察严谨的态度。
四,重点难点
重点:空气中二氧化碳含量测定的实验步骤
难点:实验的原理
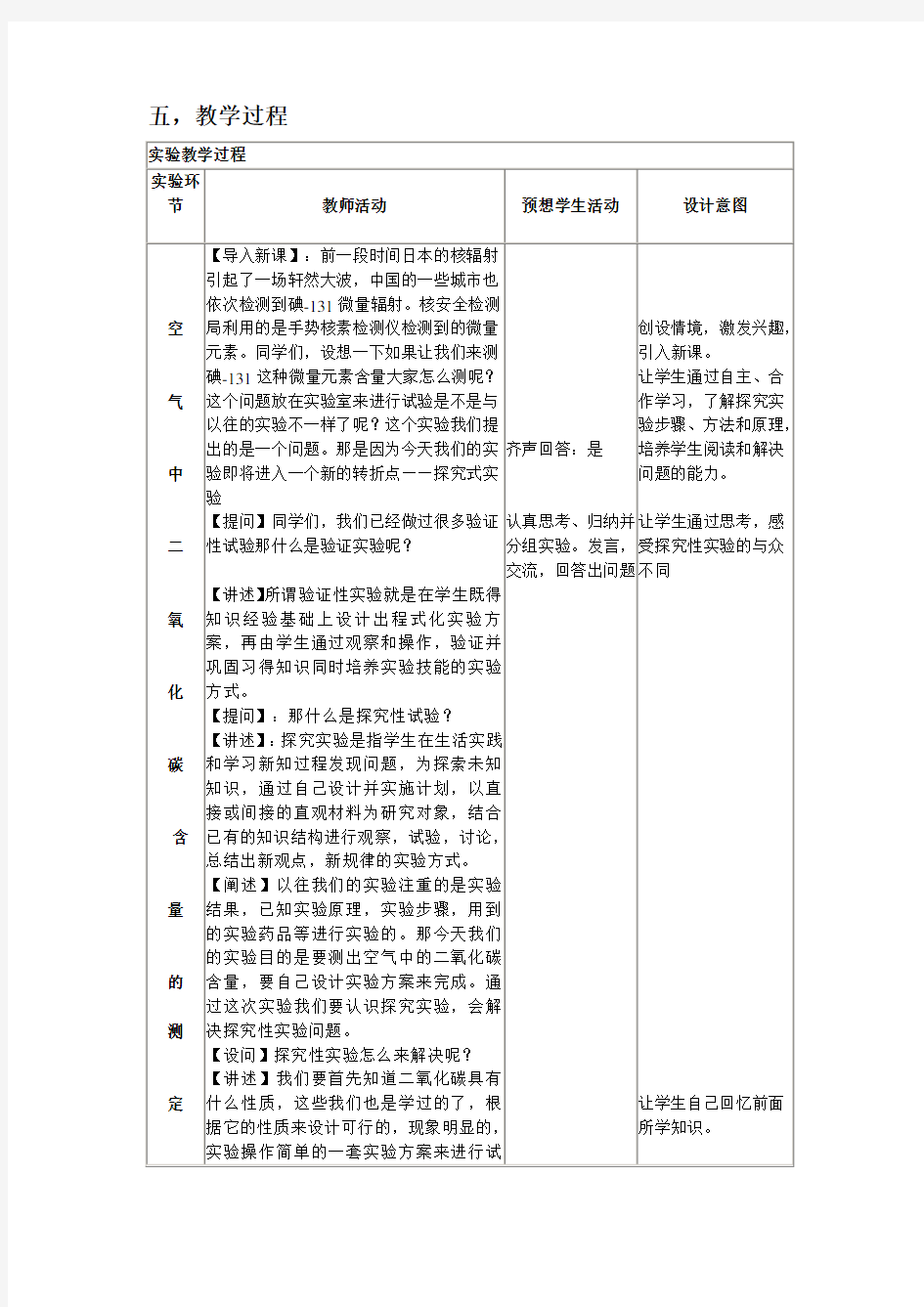
五,教学过程
六,板书设计
一、教学目标
1、 让同学们通过实验学会测量空气中二氧化碳的含量
2、 通过教学讲解实验操作知道测量二氧化碳含量的原理
二,实验原理
向滴有酚酞的氨水中通入CO 2 : CO 2 + 2NH 3H 2O === (NH 4)2CO 3
CO 2 + (NH 4)2CO 3 + H 2O === 2NH 4HCO 3
pH==8
溶液 红色 无色
计算公式
N 1x ==0.033%N 2
三,实验步骤:
1,
,2,装药品:10ml 带有酚酞的稀氨水溶液(已配好) 3,抽气
4,排气,重复操作,记录次数N ,记录在下表内 N 1是实验室内抽气的次数 N 2是空旷地点抽气的次数
四,注意事项:
1、取气地段的选择:取其地点必须是除二氧化碳以外没有其他酸性气体如二氧化硫等排放的地方。因此取其地点可以是学校操场、海边、山顶、学校通风较好的课室、刚下课后门窗紧闭的教室、通风不好的长时间开会的场所等;
2、以上各地点空气中二氧化碳的提及含量需测定者在同一取样时间段重复测定三次以上,取平均值(当然也可以是几个人同时测定,取平均值)。
3、试验中所用酚酞和氨水的混合物必须取自统一瓶中。
龙源期刊网 https://www.doczj.com/doc/767630598.html, 警报!大气中二氧化碳浓度达人类史上最高作者: 来源:《学生导报·中职周刊》2019年第14期 日前,美国国家海洋和大气管理局(NOAA)莫纳罗亚气象台的传感器监测到一个惊人数据。大气中的二氧化碳(CO2)浓度已经超过415ppm,即CO2质量超过整个大气质量的万分之4.15,创造了有史以来的最高纪录。 當地时间11日上午,斯克里普斯海洋研究所的科研人员在位于夏威夷的莫纳罗亚气象台记录下这一历史性数据415.26ppm。 气象学家埃里克·霍尔萨斯在社交网站“推特”上表示,人类历史上地球大气中的CO2浓度首次超过415ppm,“这不仅是有记录的历史中的第一次,也不仅是一万年前农业文明出现后的第一次,而是数百万年前人类出现后的第一次。我们从未见识过这样的地球。” 事实上,早在4月,德国波茨坦气候影响研究所的威利特等人就在《科学》杂志上撰文指出,大气中CO2浓度已经达到了300万年前的水平。而直立行走的人类,200万年前才刚刚出现。 近年来,大气中的CO2浓度仍在迅速上升。一直跟踪CO2浓度变化的斯克里普斯海洋研究所项目负责人拉尔夫·基林表示,其平均增长率仍处于历史高位。今年与去年相比增长了 3ppm,而近些年的平均增长率为每年2.5ppm。密歇根大学的一项研究认为,到下世纪中叶,大气中的CO2浓度或飙升至5600万年前的水平。 NOAA把CO2比作“砖”,将地球比作散发热量的壁炉。大气中过量的CO2等温室气体将吸收陆地和海洋散发的热量,使地球的热量循环失去了平衡,令平均气温上升。 更可怕的是,随着气温升高的还有地球的“脾气”。2014年发表在《自然》杂志上的一项研究认为,温室气体导致的气候变化将使地球表面的大气波动更为剧烈,高温、干旱、酷寒等极端天气的出现将更加频繁。 (来源:《科技日报》)
实验:水中亚硝酸盐的测定 学号: 姓名: 班级: 【实验方法】 偶合分光光度法 【实验原理】 在PH 以下,水中亚硝酸盐与对氨基苯磺酰胺重氮化,再与盐酸N-(1-萘)-乙二胺产生偶合反应,生成紫红色的偶氮染料,比色定量。 【实验试剂】 1、对氨基苯磺酰胺溶液(10g/L):称取5g对氨基苯磺酰胺(H2NC6H4SO3NH2),溶于350 mL盐 酸溶液中。用纯水稀释至500 mL。 2、盐酸N-(1-萘)-乙二胺溶液(1.0g/L):又名NEDD溶液,称取0.2g盐酸N-(1-萘基)- 乙二胺(C10H7NH2CHCH2·NH2·2HCl),溶于200 mL纯水中。储存于冰箱中。可稳定数周,如试剂颜色变深,应弃去重配。 3、亚硝酸盐氮标准使用溶液【ρ(NO2-N)=μg/mL】 【实验仪器】 1、分光光度计 2、50 mL具塞比色管: 30支 3、5 mL刻度吸管:10支 4、1mL比色皿:1个 【分析步骤】 1、取50mL水样置于比色管中。 2、取50mL比色管7支,分别加入亚硝酸盐氮标准液0mL、、、、、、,用纯水稀释至50mL。 3、向水样及标准色列管中分别加入1 mL对氨基苯磺酰胺溶液,摇匀后放置2min~8min。加 入 mL盐酸N-(1-萘基)-乙二胺溶液,立即混匀。 4、于540nm波长,用1cm比色皿,以纯水作参比,在10min至2h内,测定吸光度。
5、绘制标准曲线,从曲线上查出水样中亚硝酸盐氮的含量。 【数据分析】 ρ(NO2-N)=m/V 注:ρ(NO2-N)——水样中亚硝酸盐氮的质量浓度,单位为mg/L m——从标准曲线上查得样品管中亚硝酸盐氮的质量,单位为微克(μg)V——水样体积,单位为毫升(mL)
空气比热容比的测量 实验目的: 1.用绝热膨胀法测定空气的比热容比。 2.观测热力学过程中状态变化及基本物理规律。 3.学习气体压力传感器和电流型集成温度传感器的原理及使用方法。实验原理: 对理想气体的定压比热容C p和定容比热容C v 之关系由下式表示: C p —C v =R(1) (1) 式中,R为气体普适常数。气体的比热容比r值为: r= C p /C v (2) 气体的比热容比现称为气体的绝热系数,它是一个重要的物理量,r值经常出现在热力学方程中。 测量r值的仪器如图〈一〉所示。实验时先关闭活塞C 2 ,将原处于环境大气 压强P 0、室温θ 的空气从活塞C 1 ,处把空气送入贮气瓶B内,这时瓶内空气压 强增大。温度升高。关闭活塞C 1,待稳定后瓶内空气达到状态I(P ,θ ,V 1 ),V 1 为贮气瓶容积。 然后突然打开阀门C 2,使瓶内空气与大气相通,到达状态II(P 1 ,θ ,V 1 )后, 迅速关闭活塞C 2 ,由于放气过程很短,可认为是一个绝热膨胀过程,瓶内气体压强减小,温度降低,绝热膨胀过程应满足方程: P1V1’=P0V2’(3) 在关闭活塞C 2之后,贮气瓶内气体温度将升高,当升到温度θ 0 时,原状态为 I(P 1,θ ,V 1 )体系改变为状态III(P 2 ,θ ,V 2 ),应满足: P1V1=P0V2(4) 由(3)式和(4)式可得到: r=(log P0-log P1)/(logP2-log P1) 利用(5)式可以通过测量P 0、P 1 和P 2 值,求得空气的比热容比r值。 实验装置:
图〈一〉实验装置中1为进气活塞塞C 1,2为放气活塞C 2 ,3为电流型集成温 度传感器AD590,它是新型半导体温度传感器,温度测量灵敏度高,线性好,测温 范围为-50℃至150℃。AD590接6V直流电源后组成一个稳流源,见图〈二〉,它的测温灵敏度为1μA/℃,若串接5KΩ电阻后,可产生5mv/℃的信号电压,接0~2V量程四位半数字电压表,可检测到最小0.02℃温度变化。4为气体压力传感器探头,由同轴电缆线输出信号,与仪器内的放大器及三位半数字电压表相接。当待测气体压强为环境大气压P 0 时,数字电压表显示为0;当待测气体压强为 P +10.00KPa时,数字电压表显示为200mv;仪器测量气体压强灵敏度为20mv/KPa,测量精度为5Pa。 实验内容: 1.按图〈一〉接好仪器的电路,AD590的正负极请勿接错。用Forton式 气压计测定大气压强P 0,用水银温度计测环境室温θ 。开启电源,将 电子仪器部分预热20分钟,然后用调零电位器调节零点,把三位半数字电压表表示值调到0。 2.把活塞C 2关闭,活塞C 1 打开,用打气球把空气稳定地徐徐进入贮气瓶
空气加热器性能测定实验台使用说明书 一、 概述: 空气加热器是暖通空调系统中常用的换热设备。它的类型很多,按其肋片加工方法不同,可分为:串片式、绕片式、轧片式等。按其热媒的种类不同,可分为蒸汽加热器或热水加热器。 本实验的目的是,测定空气加热器的传热系数和空气阻力,以鉴定其热工性能的优劣。 本实验以蒸气加热器传热为具体对象。 其蒸汽加热器为铜管串铝片。其参数为: 换热面积: F = 2.93m 2; 流通截面积:f = 0.08875m 2。 二、 实验原理: 空气加热器的传热系数由下式确定: p t F Q k ??= w/(m 2 ℃) (1) 式中:F ——传热面积,m 2。。 Q ——蒸汽与空气通过间壁交换的热量(W )。必须注意,蒸汽加热器蒸汽的放热量Q 1等于空气通过蒸汽加热器所得到的热量Q 2。 p t ?—空气与蒸汽间算术平均温差,℃。 p t ?= 2 2 1t t t q +- ℃ (2) 其中:t q —蒸汽的温度, (℃),取决于蒸汽的压力。 21,t t — 加热前、后空气温度,℃。 蒸汽加热器内蒸汽的放热量Q 1按下式计算: Q 1=G E (i ″- i ′)kw (3) 其中:G Z 蒸汽量,kg/s ; i ″— 入口蒸汽比焓,kJ/kg ; i ′— 出口凝结水比焓,kJ/kg ; - 1 –
空气通过蒸汽加热器所得到的热量Q2,按下列计算。 Q 2 = G k C p (t 2 -t 1 ), kw (4) 其中:G k—被加热的空气量,kg/s; C p —空气定压比热,C p = 1.01 (kJ/kg℃); 空气通过空气加热器的阻力H,可由测量空气加热器前后的静压差直接得出。 三、实验装置: 空气加热器实验装置如图1、图2所示。它由蒸汽置备输送系统、空气系 统和测试系统组成。 蒸汽由蒸汽发生器26产生,经阀门13,汽水分离器12,过热器11进入蒸汽加热器,一般情况下,暖通空调用低压饱和蒸汽。因此,实验中,蒸汽不带水时,可不用过热器11(即不通电)。蒸汽加热空气后,其凝结水经过冷却器22,使凝结水过冷,以防护产生二次汽。空气经调节阀门2,由风机1吸送,并通过风道送出,经整流孔板3,进入蒸汽加热器,经加热后由孔板25排出。 –2 –
体成分测试实验报告 一、实验目的 1.掌握身体成分测定的电阻抗测定法、皮质厚度测定方法; 2.了解和熟悉体成分的分析评价方法和适用范围。 二、实验原理 1.电阻抗测定法 利用非脂肪组织比脂肪组织有更高的电荷容量,更易导电的特性测试。电流传导速度越慢,表示身体所含脂肪越多。因此本测量通过无害的交流电通过身体脂肪和非脂肪组织时的差别来估算体成分。 2.皮脂厚度测定法 用皮质厚度推算人的身体密度,并将估算的身体密度带入公式预测公式,计算出体质百分比。 三、实验步骤 1.电阻抗测定法 使用仪器:体成分测试仪 测试步骤:a、测量身高、体重b、将受试者的基本信息:姓名、年龄、体重、身高等输入体成分分析仪才c、受试者赤足,两手、两足分别接触四肢电极,按操作步骤开始测量d体成分分析仪显示(打印)测试报告。 2.皮质厚度测定法 使用仪器:皮脂厚度计 测试步骤:a、估算身体密度:分别测试右上臂肱三头肌和肩胛角下(1cm 处)的皮脂厚度,代入体密度估算公式: 身体密度(男)=1.0913-0.00116x 身体密度(女)=1.0897-0.00133x(x=肩胛角下+上臂皮质) 四、注意事项 1.测试之前正常饮食,不要过饱或过饥。 2.测试前4小时内不饮用任何含有咖啡因等利尿的饮料,可在测试前2小时饮适量的水。 3.测试中尽量少穿衣物,勿带金属物品。
4.测试中保持直立、放松、稳定的姿势。 5.测试过程中不接触周围的人或其他物体,正常室温环境下测量。 6.皮脂厚度测试时赤裸测试部位,捏起皮脂时注意捏起部位的松紧度和深浅程度尽量保持一致。 五、实验结果 1.电阻抗法 体脂肪率为28.3% 2.皮质厚度测法 右上臂肱三头肌皮脂厚度为13.5mm,肩胛角下(1cm)处皮质厚度为13.5mm。 根据公式:身体密度(女)D=1.0897-0.00133x(x=肩胛角下+上臂皮脂)体脂百分比Fat%=(4.570/D-4.142)*100% 可得:Fat=19.47% 六、实验结果分析与评价 1.电阻抗法 根据体成分评定报告可得:体脂肪率为28.3%,为标准值;BMI为21.7,在正常值(18.5-23.9)范围内;腹部肥胖为正常,肥胖分布正常;基础代谢1201kcal,总能量代谢为1783kcal;体重控制需减掉0.9kg,脂肪需减掉0.9kg;综合评分为79分。 2.皮脂厚度法 肩胛下区:皮肤褶皱厚度男性为9.1-14.3mm,平均13.1mm;女性为9-12mm,平均为11.5mm,如超过14厘米可诊断为肥胖。 上臂部:男性均为18.1mm,如男性超过23mm,女性超过30mm为肥胖。 右上臂肱三头肌皮脂厚度为13.5mm,肩胛角下(1cm)处皮质厚度为13.5mm。因此,本人测试结果为正常。 由皮脂厚度测出的数据计算可得的体脂肪率(19.47%)与电阻抗法测出来的值(28.3%)有所差距,原因应为:a.皮脂厚度测试部位较为局限;b.两种测试方法均存在一定的误差。
空气中二氧化碳含量的测定实验教案 化学一班申伟静郝冬丽张冬冬徐亚辉 一,教学目标 知识目标: 1、了解测定二氧化碳含量的简单方法; 2、掌握二氧化碳的基本性质和生活中的应用; 3、通过老师讲解理解二氧化碳在整个环境中作用。 技能目标: 1、通过观看教师的演示实验提高对实验的观察、比较能力。 2、学习掌握如何使用针筒和使用玻璃仪器要注意事项; 3、感悟用分类、对比的学习方法来学习化学的重要作用。 情感目标: 1、通过实验探究来激发学生学习的积极性和主动性, 2、实验初步养成严谨求实的科学态度。 3、通过对课程的学习可以让同学认识到环境保护重要性。 二,教材分析 本节主要围绕探究测定空气中二氧化碳含量的实验,学习定量测定混合气体中某种气体含量的方法,认识空气中二氧化碳组成及表示方法,增进对二氧化碳的理解。增加学生爱护环境的意识。 三,学情分析 已知 1、学生通过前面的学习,已了解和初步掌握了关于二氧化碳的基本性质。 2、学生通过对实验前的预习掌握了空气中二氧化碳含量测定的基本原理和操作方法。 3、学生在学习中,知道了二氧化碳在我们生活中的作用和在生活中应用。 4、学生在生活中知道保护环境重要意义。 未知 1、学生在实际操作中会出现不规范操作,对实验的结果造成影响。还可能损坏仪器。 2、学生在生活中虽然知道环保知识,但付诸实践上仍然不知如何做。 3、学生缺少实验中观察实验现象变化能力。在实验过程中都需要一直观察严谨的态度。 四,重点难点 重点:空气中二氧化碳含量测定的实验步骤 难点:实验的原理
五,教学过程 实验教学过程 实验环 节教师活动预想学生活动设计意图 【导入新课】:前一段时间日本的核辐射 引起了一场轩然大波,中国的一些城市也 依次检测到碘 -131 微量辐射。核安全检测 空局利用的是手势核素检测仪检测到的微量创设情境,激发兴趣,元素。同学们,设想一下如果让我们来测引入新课。 碘 -131 这种微量元素含量大家怎么测呢这让学生通过自主、合气个问题放在实验室来进行试验是不是与以作学习,了解探究实往的实验不一样了呢这个实验我们提出的验步骤、方法和原理,是一个问题。那是因为今天我们的实验即齐声回答:是培养学生阅读和解决中将进入一个新的转折点——探究式实验问题的能力。 【提问】同学们,我们已经做过很多验证 性试验那什么是验证实验呢认真思考、归纳并让学生通过思考,感二分组实验。发言,受探究性实验的与众【讲述】所谓验证性实验就是在学生既得交流,回答出问题不同 知识经验基础上设计出程式化实验方 氧案,再由学生通过观察和操作,验证并 巩固习得知识同时培养实验技能的实验 方式。 化【提问】:那什么是探究性试验 【讲述】: 探究实验是指学生在生活实践 和学习新知过程发现问题,为探索未知 碳知识,通过自己设计并实施计划,以直 接或间接的直观材料为研究对象,结合 已有的知识结构进行观察,试验,讨论, 含总结出新观点,新规律的实验方式。 【阐述】以往我们的实验注重的是实验 结果,已知实验原理,实验步骤,用到 量的实验药品等进行实验的。那今天我们 的实验目的是要测出空气中的二氧化碳 含量,要自己设计实验方案来完成。通 的过这次实验我们要认识探究实验,会解 决探究性实验问题。 测【设问】探究性实验怎么来解决呢 【讲述】我们要首先知道二氧化碳具有 什么性质,这些我们也是学过的了,根 定据它的性质来设计可行的,现象明显的,让学生自己回忆前面实验操作简单的一套实验方案来进行试所学知识。 验。
实验二氧化碳分子量的 测定 TTA standardization office【TTA 5AB- TTAK 08- TTA 2C】
实验二氧化碳相对分子量的测定 实验目的 1、学习气体相对密度法测定分子量的原理、加深理解理想气体状态方程式和阿佛加德罗定律。 2、掌握二氧化碳分子量的测定和计算方法 3、进一步练习使用启普气体发生器和电子天平称量的操作。 实验原理 1、阿佛加得罗定律:同温、同压、同体积的气体含有相同的分子数,即摩尔数相同。根据阿佛加德罗定 律,只要在同温、同压下,比较同体积的两种气体(设其中之一的分子量为巳知)的质量,即可测定气态 物质的分子量。 本实验是把同体积的二氧化碳气体与空气(其平均分子量为相比,此时有: m空气/ M空气 = m CO2 / M CO2, 即 M CO2= m CO2·M空气/ m空气其中, M空气= 2、理想气体状态方程 PV=n R T 3、制备二氧化碳 反应方程式: CaCO3+2HCl=CaCl2+CO2+H2O 因为大理石中含有硫,所以在气体发生过程中有硫化氢、酸雾、水汽产生。此时可通过硫酸铜溶液,碳酸氢钠溶液以及无水氯化钙除去硫化氢,酸雾和水汽。 实验内容 1、二氧化碳的制取、收集和净化 2、第一次称量 取一个洁净而干燥的锥形瓶,选一个合适的瓶塞塞入瓶口,并在塞子上做一记号,以固定塞子塞入瓶口的位置,在电子天平上称量质量m A:m A=m空气+m锥形瓶+m瓶塞 3、收集二氧化碳 在启普发生器中产生二氧化碳气体,经过净化、干燥后导入锥形瓶中。由于二氧化碳气体略重于空气,所以必须把导管伸入瓶底。收集满气体后,轻轻取出导气管,用塞子塞住瓶口(应与原来塞入瓶 口的位置相同)。 4、第二次称量: 在电子天平上称量二氧化碳、锥形瓶、瓶塞总质量m1: m1=m co2+m锥形瓶+m瓶塞 5、平行称量重复3、4步操作,得m2 m2=m co2+m锥形瓶+m瓶塞 6、将4、5的称量值即m1、m2求平均值m B。 m B= m co2平均+m锥形瓶+m瓶塞 7、在锥形瓶内装满水,塞好瓶塞,注意橡皮塞进入的高度与记号相齐。 8、第四次称量 在台秤上称取水+锥形瓶+瓶塞的质量为 m c: m c=m水+m锥形瓶+m瓶塞 数据处理 根据阿佛加得罗定律: m空气/ M空气 = m CO2 / M CO2, 即 M CO2=m CO2·M空气/ m空气 其中, M空气= 即 M CO2= .m CO2/ m空气 (1) 那么, m空气=?
007 实验报告 评分: 课程: ******** 学期: ***** 指导老师: **** 年级专业: ***** 学号:****** 姓名:!习惯一个人007 实验3-5空气比热容比的测定 一、实验目的 1. 用绝热膨胀法测定空气的比热容。 2. 观察热力学过程中状态变化及基本物理规律。 3. 学习气体压力传感器和电流型集成温度传感器的原理及使用方法。 二、实验原理 测量仪器如图4-6-1所示。1为进气活塞C 1,2 为放气活塞C 2,3为电流型集成温度传感器,4为气体压力传感器探头。实验时先关闭活塞C 2,将原处于环境大气压强为P 0、室温为T 0的空气经活塞C 1送入贮气瓶B 内,这时瓶内空气压强增大,温度升高。关闭活塞C 1,待瓶内空气稳定后,瓶内空气达到状态Ⅰ(101,,V T P ) ,V 1为贮气瓶容积。 然后突然打开阀门C 2,使瓶内空气与周围大气相通,到达状态Ⅱ(),,220V T P 后,迅速关闭活塞C 2。由于放气过程很短,可认为气体经历了一个绝热膨胀过程,瓶内气体压强减小,温度降低。绝热膨胀过程应满足下述方程 r r o r o r T p T p 1 1 11 --= (3-5-2) 在关闭活塞C 2之后,贮气瓶内气体温度将升高,当升到温度T 0时,原气体的状态为Ⅰ(101,,V T P )改变为状态Ⅲ(202,,V T P ) ,两个状态应满足如下关系: 0 21T p T p o = (3-5-3) 由(3-5-2)式和(3-5-3)式,可得 )lg /(lg )lg (lg 1210P P P P --=γ (3-5-4) 利用(3-5-4)式可以通过测量P 0、P 1和P 2值,求得空气的比热容比γ值。
测定空气成分的实验专题 一、知识点 二百多年前,法国化学家拉瓦锡通过实验,得出了空气由氧气和氮气组成,其中氧气约占空气总体积的1/5的结论。 测定空气中氧气含量的实验 【实验原理】红磷在空气中燃烧消耗氧气生成五氧 【实验装置】如右图所示。弹簧夹关闭。集气瓶内加入少量水,并做上记号。亞【实验步骤】 ①连接装置,并检查装置的气密性。1 ②点燃燃烧匙内的红磷,立即伸入集气瓶中,并塞紧塞子。建三 ③待红磷熄灭并冷却后,打开弹簧夹。 【实验现象】① 红磷燃烧,产生大量白烟;② 放热;③ 冷却后打开弹簧夹,水沿着导管 进入集气瓶中,进入集气瓶内水的体积约占集气瓶空气总体积的1/5。 【实验结论】① 红磷燃烧消耗空气中的氧气,生成五氧化二磷固体;② 占空气总体积 的1/5。 【注意事项】 1. 红磷必须过量。如果红磷的量不足,集气瓶内的氧气没有被完全消耗,测量结果会偏小。 2. 装置气密性要好。如果装置的气密性不好,集气瓶外的空气进入集气瓶,测量结果会偏 小。 3. 导管中要注满水。否则当红磷燃烧并冷却后,进入的水会有一部分残留在试管中,导致 测量结果偏小。 4. 冷却后再打开弹簧夹,否则测量结果偏小。 5. 如果弹簧夹未夹紧,或者塞塞子的动作太慢,测量结果会偏大。 6. 在集气瓶底加水的目的:吸收有毒的五氧化二磷。 7. 不要用木炭或硫代替红磷!原因:木炭和硫燃烧尽管消耗气体,但是产生了新的气体,气体体积不变,容器内 压强几乎不变,水面不会有变化。 8. 如果预先在集气瓶内放入氢氧化钠溶液,就可以用木炭或硫代替红磷进行实验。 9. 不要用镁代替红磷!原因:镁在空气中燃烧时能与氮气和二氧化碳发生反应,这样不仅 消耗氧气,还消耗了氮气和二氧化碳,使测量结果偏大。 练习: 1. 用燃烧法除去密闭容器中空气成分里的氧气,应选择下列物质中的 F列说法不正确的是() B .点燃红磷前先用弹簧夹夹紧乳胶管 D.最终进入瓶中水的体积约为氧气的体积 3. 小明用右图装置来测定空气中氧气的含量,对该实验认识正确的是() 空气中氧气的体积约 A.细铁丝 B.红磷 C.硫粉 D.木炭 2. 如图所示装置可用于测定空气中氧气的含量, 实验前在集气瓶内加入少量水,并做上记号。 A.实验时红磷一定要过量 C.红磷熄灭后立刻打开弹簧夹
中华人民共和国国家标准 GB/T 17904—???? 室内空气中二氧化碳卫生标准 Hygienic standard for carbon dioxide in indoor air (征求意见稿) 前言 为控制和改善室内二氧化碳的污染,保障人民身体健康,修订本标准。 本标准为《室内空气中二氧化碳卫生标准》(GB/T 17904-1997)的修订标准。 本修订标准由中华人民共和国卫生部提出。 本修订标准起草单位:中国疾病预防控制中心环境与健康相关产品安全所、安徽省疾病预防控制中心、华中师范大学。 本修订标准主要起草人:徐东群、王秦、徐业林、王志强、杨旭。 本标准由卫生部委托技术归口单位中国疾病预防控制中心环境与健康相关产品安全所负责解释。 1、范围 本标准规定了室内空气中二氧化碳标准值和检验方法。 本标准适用于室内空气的监测和评价,不适用于生产性场所的室内环境。 2、标准内容 室内空气中二氧化碳日平均最高容许浓度规定为≤0.09%(1800mg/ m3)。 3、规范性引用文件 下列文件中的条款,通过在本标准中引用而构成为本标准的条款。本标准出版时,所示版本均为有效。所用标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可能性。
GB/T18204.24 《公共场所空气中二氧化碳测定方法》 4、监测检验方法 本标准的监测检验方法见GB/T 18204.24。
室内空气中二氧化碳卫生标准 编制说明 1、任务来源 中国疾病预防控制中心环境与健康相关产品安全所受卫生部政策法规司/卫生标准专业委员会/环境卫生标准委员会委托,对现行的《室内空气中二氧化碳卫生标准》(GB/T 17904-1997)进行修订。 2、标准修订的目的意义 室内二氧化碳浓度受居室容积、吸烟和燃料燃烧等因素影响,与室内通风和人员的密集程度密切相关常,常用来表征室内新鲜空气多少或通风程度强弱,同时也反映了室内可能存在的其他有毒有害污染物的浓度水平近年来,随着我国经济的迅猛发展和人民生活水平的日益提高,居民人均居住面积有了普遍提高,居室的燃料结构也发生了一定的变化。但是为了节约能源,现代建筑物密闭化程度增加。 近年来国内的监测资料表明,各类不同房屋的通风条件、单位面积人口差异很大,直接与之相关的室内二氧化碳浓度水平因此会显示出相当大的差异。在通风或排风良好的房屋,无论是住房还是公共场所,其室内空气中CO2浓度都比较容易达到540~1080mg/m3这样的较低水平[1, 2]。 广东、贵州、湖南、浙江、辽宁、宁夏、甘肃等省[3-13]的一些地市环保、卫生等部门也进行了针对居室和宾馆、图书馆、商场等公共场所室内二氧化碳浓度的监测资料,已有的资料表明虽然室内空气中二氧化碳浓度范围很大,但基本都在1800mg/m3以下,较高浓度多出现在大型商场等人群密集场所。 本次修订该标准,除了查阅文献资料外,我们选择了地处暖温带与亚热带过渡地带的安徽省,进行了集中资料收集和现场调查工作。资料收集为2004年至2008年,从统计结果来看,室内二氧化碳浓度共测定794次,均值为0.061%,其中超过《室内空气中二氧化碳卫生标准GB/T 17904-1997》标准值38份,超标率为4.79%。2008年进行的现场监测结果表明,不同场所室内二氧化碳浓度差别不大,其中办公场所测定270次,均值为0.057%、城市居民居室内测定176次,均值为0.056%,城镇居民居室内测定180次,均值为0.052%,各监测值均未超标。本次现场监测安徽省内城市居民居室空气中二氧化碳的浓度低于1980年代调查
水中溶解二氧化碳溶解量和总量的测量方法 1适用范围 1.1 本标准用于指导测定如二氧化碳(CO2)、碳酸、碳酸氢根离子、碳酸根离子在水中的总量和溶量: 测量范围章节范围 方法A(气体感应电极) 2-800 毫克/升8-15 方法B(CO2发生库仑滴定) 5-800毫克/升16-24 1.2 本标准也可用于对样品微粒中的碳酸盐进行二氧化碳含量测定 1.3方法A适用于各种天然水和盐水 1.4方法B适用于天然水、盐水以及在16.4节中所描述的各种工业水 1.5使用者有责任确保采用这些水体测试方法对未测试母体水样所得到的结果的有效性。 1.6几种标准测量方法1988年被废止,其历史信息见附录X1。 1.7该标准不支持所有安全考虑的表述,如果有的话,应该与它的使用联系起来。本标准的使用者有责任建立一套适当的安全和健康实施程序并可以在使用前预先做一些相应、局部的调整。 2参考文献 2.1 ASTM标准: D1066 蒸汽取样的实施标准 D1129 与水相关的专用术语 D1192 密闭管蒸汽取样与水取样设备指南 D1193 试剂用水规格说明 D1293 水PH的测定方法 D2777可行的测试标准D19对水的测量的精确度和偏差的判断实施标准 D3370 密闭管水取样的实施标准 D5847 采用标准方法进行水质分析,书面质量控制规格实施标准 E200 化学分析中试剂溶液的配制、贮存的标准化及实施标准 3 专用术语 3.1 注释参照专用术语D1129,对这些测量方法中所用的术语进行定义
4 用途及重要性 4.1 二氧化碳是动植物呼吸最主要的产物,有机物质和部分矿物质分解也产生二氧化碳,大气中二氧化碳的平均含量约为0.04体积%,除去在异常的有机物质和矿物质分解区的地方外,地表水二氧化碳的含量通常都低于10毫克/升,但是地下水,尤其是深层地下水二氧化碳的含量有可能达到几百毫克/升。 4.2当水中溶解有二氧化碳时,它会对水处理系统产生很强的腐蚀作用,尤其在蒸汽冷凝系统这特别是一项麻烦,水处理系统中部分CO2的溢出,将破坏碳酸盐的溶解平衡,从而导致局部表面产生方解石覆盖物。热水器就是一个很好的例子写照,由于存在有微弱的侵蚀和覆盖平衡,水处理系统中一定要重视控制好CO2及其相类似的气体含量。城市供应中蒸汽冷凝的最后阶段进行水软化和胺中和时,采用再碳酸化也就是这一目的。 5 试剂的纯度 5.1在所有测试中使用标准化学试剂。除非有别的说明,所有的试剂都应遵守美国化学委员会 分析试剂委员会的规范,这些规范可以从中得到5别的等级的试剂可使用,但首先必须弄清楚试 剂必须具有足够的纯度才允许使用,从而不会降低测试精度。 5.2除非有别的说明,参考的水应当被认为是平均试剂水,遵守D1193规程,类型Ⅰ。另外在其它的测定方法中需要的去CO2水,可以参考规程E200中的第8.2章。 6注意事项 6.1注意――二氧化碳气体在样品运输和贮存过程中很容易从溶液中逃溢,由于碳酸钙微弱的分解,导致溶液中温度和压力发生改变,所以样品中CO2浓度增加是可能的。 7 取样 7.1 根据规程D1066、D1192和规程D3370上说明进行取样。 7.2 如果过滤样品微粒中含有碳酸盐,那么仅测量CO2溶量。当从试验瓶中取出部分含有微粒的 样品时,试剂瓶应该先摇晃或者让微粒均匀分布来保证所取的样品有代表性。取样后,样品中的微粒形态随温度、pH等变化而改变。这些微粒再样品测试时必须包括在内。样品过滤均质化过程中需小心防止CO2损失.如果不是要求除掉潜在的干扰微粒,样品不要过滤。 7.3用一种坚固的、抗化学作用的玻璃瓶子来取样。 7.4 将取样瓶完全灌满,使其在瓶盖下不留任何空间,将样品在低于取样温度下存放,直至检测。 测试方法A—气体感应电极法
化学测定 姓名:_________ 班级:__________ 1、非金属元素N可以形成多种氧化物,N2O、NO、NO2、N2O3、N2O5。按氮元素在这些氧化物中的质量分数由大到小的顺序排列的是() A.N2O、NO、NO2、N2O3、N2O5 B.N2O5、N2O3、NO2、NO、N2O C.N2O、NO、N2O3、NO2、N2O5 D.N2O、NO2、N2O3、NO、N2O5 2、t ℃时,将10 gA物质溶解在40 g水中,30 g溶液中含溶质B10 g,C溶液的质量分数为30%,A、B、C三种溶液均恰好为饱和溶液,则三种物质在t ℃时的溶解度大小顺序为()A.B>C>A B.B>A>C C.C>B>A D.A>B>C 3、震后灾区预防某类病毒的方法是消毒,常见的碱类物质、甲醛等都有较好的杀死病毒的作用。其中NaOH 溶液因消毒效果好且廉价易得被广泛使用,从而使工业烧碱用量增加。但工业烧碱中含有杂质碳酸钠,为了测定氢氧化钠的质量分数,某工厂甲、乙两实验员分别设计了实验方案: Ⅰ甲的方案是:准确称量一定质量的烧碱样品于烧杯中加蒸馏水溶解,再加入过量氯化钡溶液至沉淀完全,过滤、洗涤、烘干、称量。 (1)甲实验员洗涤沉淀的具体操作是:向沉淀中加入蒸馏水,然后过滤,重复2~3次。确认沉淀已洗涤干净的依据 是 。 (2)氯化钡溶液和氯化钙溶液都能与该样品溶液反应生成沉淀,但使用氯化钡溶液比氯化钙溶液所得的结果具有更高的精确度,原因 是。 Ⅱ乙的方案如下图所示: (1)根据乙的实验装置图分析,浓硫酸的作用是,碱石灰的作用 是。小明认为按照乙的方案进行测定,会导致不可避免的误差,例如:装置内空气中的CO2没有排出;反应产生的CO2未被完全吸收等。该设计中还有一个因素也会导致不可避免的误差,你认为是下列因素中的(填序号)。 ①装置的气密性不好②加入的稀硫酸量不足③干燥管与空气直接相通 (2)经测定知,该工业烧碱中氢氧化钠的质量分数为80%,某养殖户需配制2000g 2%的氢氧化钠溶液对禽舍进行杀菌消毒,需要这种工业烧碱 g。 4.某班同学测定空气里氧气的含量。小组同学共同设计了如图4的两套装置,你认为合理的是(填编号)。
气体比热容比的测定实验报告及数据课气体比热容比的测定 1、学习测定空气比热容比的方法。题 教学目 2、熟练掌握物理天平和螺旋测微器的使用方的 法。 3、熟练掌握直接测量值和间接测量值不确定度 重难 1、物理天平的调节和使用。的计算。 点 2、各物理量不确定度的计算。 教学方讲授、演示、提问、讨论、操作相结合。 学 3学时。法 时 一、前言 气体的定压比热容和定体比热容的比值称为比热容比。气体的值在许多热力学过程特别是绝热过程中是一个很重要的参数。由气体动理论可知,理想气体的值为: (1) 式中为气体分子的自由度,对于单原子分子 ;对于双原子刚性分子, ;对于多原子刚性分子,。实验中气体的比热容比常通过绝热膨胀法、绝热压缩法等方法来测定。本实验将采用一种比较新颖的方法,即通过测定小球在储气瓶玻璃管中的振动周期来计算空气的值。 二、实验仪器 FB212型气体比热容比测定仪、支撑架、小型气泵、TW-1型物理天平、0-25mm 外径千分尺等。
三、实验原理 如图1所示,钢球A位于精密细玻璃管B中,其直径仅仅比玻璃管直径小 0.01-0.02mm,使之能在玻璃管中上下移动,瓶上有一小孔C,可以通过导管将 待测气体注入到玻璃瓶中。 图1 设小球质量为m,半径为r,当瓶内气压P满足下式时,小球处于平衡位置: (2) 设小球从平衡位置出发,向上产生微小正位移x,则瓶内气体的体积有一 微小增量: (3) 与此同时瓶内气体压强将降低一微小值,此时小球所受合外力为: (4) 小球在玻璃管中运动时,瓶内气体将进行一准静态绝热过程,有绝热方程: (5) 两边微分,得 (6) 将(3)、(4)两式代入(6)式,得: (7) 由牛顿第二定律,可得小球的运动方程为: (8) 可知小球在玻璃管中作简谐振动,其振动周期为: (9) 最后得气体的值为: (10)
空气参数测定实验 一、实验目的 空气调节的任务在于采用人工的方法,创造并保持一种能满足人的健康舒适要求以及满足生产过程和科学实验要求的空气环境。通常把影响人的冷热和舒适感觉的四个因素称为气象条件。即:空气温度、空气相对湿度、空气流动速度及物体表面温度。而空气的气象条件是可以用各种仪表进行测量的。本实验的目的就是要掌握这些仪表的基本特性及测定方法。 二、实验原理及方法 (一):空气温度的测量 用于测量室内空气温度的仪表很多。如:玻璃液体温度计、热电偶温度计和电阻温度计等。本实验主要采用玻璃液体温度计进行测量。 室内空气温度通常在离地1.5米的高度上进行测量,并将温度读书记录下来。使用玻璃温度计时应注意下列各点: 1、读数时应手持温度计的上端,使眼睛、刻度线和液面相平进行读数。 若眼睛偏高,读数值偏低。眼睛偏低,读数偏高。 2、人体应稍许离开温度计,不得用手接触温包。 3、温度计放在测点需液柱处于稳定后方能进行读数。读数要尽量快,先 读小数后读整数,以防人体靠近后产生误差。 4、温度计不应放在受强烈辐射的地点进行测量。 (二):空气湿度的测量 本实验主要测量仪表:干湿球温度计、电子温湿度仪、毛发温湿度表。 1、干湿球温度计 读出干球温度计读数及湿球温度计读数,根据其差值查出相对湿度,也可根据焓湿图查出相对湿度。 2、电子温湿度仪 注意事项:黄线为温度测线、蓝线为相对湿度测线。 3、毛发温湿度计 毛发温湿度计利用脱脂人发在周围空气湿度发生变化时,其本身长度伸长或缩短的特性来测量空气相对湿度。在使用过程中应避免受到震动和撞击。(三):空气流动速度的测量 本实验使用仪器为:热球风速仪。 热球风速仪是根据电阻丝在气流中被冷却的原理而设计。 注意事项:1、调零时若调不到零位则电池电量不足。2、本仪器为精密仪器,在使用过程中特别是对风速探头,应避免受到震动和撞击。3、仪器承受的负载不能超过40M/S。 三、实验结果的记录与整理 在讨论空气的温度、相对湿度和空气流速时,建议以水银温度计、电子
大物实验报告撰写模板2 空气比热容比的测定 在热学中比热容比是一个基本物理量。过去,由于实验测量手段的原因使得对它的测量误差较大。现在通过先进的传感器技术使得测量便得简单而准确。本实验通过压力传感器和温度传感器来测量空气的比热容比。 一、实验目的 1. 用绝热膨胀法测定空气的比热容。 2. 观察热力学过程中状态变化及基本物理规律。 3. 学习气体压力传感器和电流型集成温度传感器的原理及使用方法。 二、实验原理 理想气体定压摩尔热容量和定体摩尔热容量之间的关系由下式表示 R C C v p =- (4-6-1) 其中, R 为普适气体常数。气体的比热容比γ定义为 v p C C = γ (4-6-2) 气体的比热容比也称气体的绝热系数,它是一个重要的物理量,其值经常出现在热力学方程中。 测量仪器如图4-6-1所示。1为进气活塞C 1,2 为放气活塞C 2,3为电流型集成温度传感器,4为气体压力传感器探头。实验时先关闭活塞C 2,将原处于环境大气压强为P 0、室温为T 0的空气经活塞C 1送入贮气瓶B 内,这时瓶内空气压强增大,温度升高。关闭活塞C 1,待瓶内空气稳定后,瓶内空气达到状态Ⅰ(101,,V T P ) ,V 1为贮气瓶容积。 然后突然打开阀门C 2,使瓶内空气与周围大气相通,到达状态Ⅱ(),,220V T P 后,迅速关闭活塞C 2。由于放气过程很短,可认为气体经历了一个绝热膨胀过程,瓶内气体压强减小,温度降低。绝热膨胀过程应满足下述方程 γ γ2011V P V P = (4-6-3) 在关闭活塞C 2之后,贮气瓶内气体温度将升高,当升到温度T 0时,原气体的状态为Ⅰ(101,,V T P )改变为状态Ⅲ(202,,V T P ) ,两个状态应满足如下关系:
实验一 空气定压比热容测定 一、实验目的 1.增强热物性实验研究方面的感性认识,促进理论联系实际,了解气体比热容测定的基本原理和构思。 2.学习本实验中所涉及的各种参数的测量方法,掌握由实验数据计算出比热容数值和比热容关系式的方法。 3.学会实验中所用各种仪表的正确使用方法。 二、实验原理 由热力学可知,气体定压比热容的定义式为 ( )p p h c T ?=? (1) 在没有对外界作功的气体定压流动过程中,p dQ dh M =, 此时气体的定压比热容可表示 为 p p T Q M c )(1??= (2) 当气体在此定压过程中由温度t 1被加热至t 2时,气体在此温度范围内的平均定压比热容可由下式确定 ) (1221 t t M Q c p t t pm -= (kJ/kg ℃) (3) 式中,M —气体的质量流量,kg/s; Q p —气体在定压流动过程中吸收的热量,kJ/s 。 大气是含有水蒸汽的湿空气。当湿空气由温度t 1被加热至t 2时,其中的水蒸汽也要吸收热量,这部分热量要根据湿空气的相对湿度来确定。如果计算干空气的比热容,必须从加热给湿空气的热量中扣除这部分热量,剩余的才是干空气的吸热量。 低压气体的比热容通常用温度的多项式表示,例如空气比热容的实验关系式为 3 16 2 7 4 10 87268.410 02402.410 76019.102319.1T T T c p ---?-?+?-=(kJ/kgK) 式中T 为绝对温度,单位为K 。该式可用于250~600K 范围的空气,平均偏差为0.03%,最大偏差为0.28%。 在距室温不远的温度范围内,空气的定压比热容与温度的关系可近似认为是线性的,即可近似的表示为 Bt A c p += (4) 由t 1加热到t 2的平均定压比热容则为 m t t t t pm Bt A t t B A dt t t Bt A c +=++=-+= ? 2 2 11 22 1 2 1 (5) 这说明,此时气体的平均比热容等于平均温度t m = ( t 1 + t 2 ) / 2时的定压比热容。因此,可以对某一气体在n 个不同的平均温度t m i 下测出其定压比热容c p m i ,然后根据最小二乘法原理,确定
空气中二氧化碳含量的测定实验 空气中二氧化碳含量的测定实验教案 化学一班申伟静郝冬丽张冬冬徐亚辉一,教学目标 知识目标: 1、了解测定二氧化碳含量的简单方法; 2、掌握二氧化碳的基本性质和生活中的应用; 3、通过老师讲解理解二氧化碳在整个环境中作用。 技能目标: 1、通过观看教师的演示实验提高对实验的观察、比较能力。 2、学习掌握如何使用针筒和使用玻璃仪器要注意事项; 3、感悟用分类、对比的学习方法来学习化学的重要作用。 情感目标: 1、通过实验探究来激发学生学习的积极性和主动性, 2、实验初步养成严谨求实的科学态度。 3、通过对课程的学习可以让同学认识到环境保护重要性。 二,教材分析 本节主要围绕探究测定空气中二氧化碳含量的实验,学习定量测定混合气体中某种气体含量的方法,认识空气中二氧化碳组成及表示方法,增进对二氧化碳的理解。增加学生爱护环境的意识。 三,学情分析 已知 1、学生通过前面的学习,已了解和初步掌握了关于二氧化碳的基本性质。 2、学生通过对实验前的预习掌握了空气中二氧化碳含量测定的基本原理和操作方
法。 3、学生在学习中,知道了二氧化碳在我们生活中的作用和在生活中应用。 4、学生在生活中知道保护环境重要意义。 未知 1、学生在实际操作中会出现不规范操作,对实验的结果造成影响。还可能损坏仪器。 2、学生在生活中虽然知道环保知识,但付诸实践上仍然不知如何做。 3、学生缺少实验中观察实验现象变化能力。在实验过程中都需要一直观察严谨的态度。四,重点难点 重点:空气中二氧化碳含量测定的实验步骤 难点:实验的原理 五,教学过程 实验教学过程 实验环 节教师活动预想学生活动设计意图 【导入新课】:前一段时间日本的核辐射 引起了一场轩然大波,中国的一些城市也 依次检测到碘-131微量辐射。核安全检测空局利用的是手势核素检测仪检测到的微量创设情境,激发兴趣, 元素。同学们,设想一下如果让我们来测引入新课。 碘-131这种微量元素含量大家怎么测呢,让学生通过自主、合 气这个问题放在实验室来进行试验是不是与作学习,了解探究实 以往的实验不一样了呢,这个实验我们提验步骤、方法和原理, 出的是一个问题。那是因为今天我们的实齐声回答:是培养学生阅读和解决中验即将进入一个新的转折点——探究式实问题的能力。 验
测定空气成分的实验专题
测定空气成分的实验专 一、知识点 二百多年前,法国化学家拉瓦锡通过实验,得出了空气由氧气和氮气组成,其中氧气约占空气总体积的1/5的结论。 测定空气中氧气含量的实验 【实验原理】红磷在空气中燃烧消耗氧气生成五 氧集气瓶内加入少量水,并做上记号。 【实验装置】如右图所示。弹簧夹关闭 【实验步骤】 ①连接装置,并检杳装置的气密性。 ②点燃燃烧匙内的红磷,立即伸入集气瓶中, 并塞紧塞子。 ③待红磷熄灭并冷却后,打开弹簧夹。 【实验现象】① 红磷燃烧,产生大量白烟;② 放热; ③冷却后打开弹簧夹,水沿着导管进入集气瓶中,进入集气瓶内水的体积约占集气瓶空气总体积的1/5。 【实验结论】① 红磷燃烧消耗空气中的氧气,生成五氧化二磷固体;② 空气中氧气的体积约占空气总体积的1/5。 【注意事项】 1.红磷必须过量。如果红磷的量不足,集气瓶内的氧气
没有被完全消耗,测量结果会偏小。 2.装置气密性要好。如果装置的气密性不好,集气瓶外 的空气进入集气瓶,测量结果会偏小。 3.导管中要注满水。否则当红磷燃烧并冷却后, 进入的水会有一部分残留在试管中,导致测量结果偏小。 4.冷却后再打开弹簧夹,否则测量结果偏小。 5.如果弹簧夹未夹紧,或者塞塞子的动作太慢,测量结 果会偏大。 6.在集气瓶底加水的目的:吸收有毒的五氧化二磷。 7.不要用木炭或硫代替红磷!原因:木炭和硫燃烧尽管 消耗气体,但是产生了新的气体,气体体积不变,容器内压强几乎不变,水面不会有变化。 8.如果预先在集气瓶内放入氢氧化钠溶液,就可以用木 炭或硫代替红磷进行实验。 9.不要用镁代替红磷!原因:镁在空气中燃烧时能与氮 气和二氧化碳发生反应,这样不仅消耗氧气,还消耗了氮气和二氧化碳,使测量结果偏大。 练习: 1.用燃烧法除去密闭容器中空气成分里的氧气,应选择下列物质中的 A.细铁丝 B.红磷 C.硫粉