
1.、在逆流连续操作的塔内,以水为萃取剂从丙酮--苯混合液内提取丙酮。苯与水可视作完全不互溶。在操作条件下,丙酮在水和苯中以质量比为基准的分配系数为0.65,即:Y= 0.65X,原料的流率为1200kg/h,其中含丙酮0.35(质量分率,下同),要求萃余相中丙酮含量不大于0.06。若用水量为最小量的1.6倍,试求水的实际用量kg/h。
解:Z F=0.35/(1-0.35)=0.54
Z N=0.06/(1-0.06)=0.064
Ymax=0.65×0.54=0.351
(B/S)min=(Ymax-Z)/(Z F-Z N)=(0.351-0)/(0.54-0.064)=0.74
(S/B)min=1/0.74=1.35
Smin=1.35×1200=1620
实际用水量S=1.6×1620=2592 kg/h
2、在B-S部分互溶物系的单级萃取中,料液中溶质A与稀释剂B的质量比为40:60。采用纯溶剂S=200kg,溶剂比为1,脱除溶剂后萃余液浓度X A°=0.3(质量分率),选择性系数β=8。试求萃取液量E°为多少kg?
解:萃取液浓度y A°=(βX A°)/[1+(β-1)X A°]=8×0.3/(1+7×0.3)=0.774
X F=40/(40+60)=0.4 又S=F=200 kg
据物料衡算(杠杆法则):
E°=F×(X F-X A°)/(Y A°-X A°)=200×(0.4-0.3)/(0.774-0.3)=42.2
3、使用纯溶剂S对A、B混合液作萃取分离。在操作范围内,S-B不互溶,平衡关系Y A= 1.2X A(Y、X均为比质量分率),要求最终萃余相中萃余分率φR=0.05。试求用单级萃取时,每kg稀释剂B中,溶剂S消耗量kg。
解:φR=(BX)/(BX F)=X/X F∴X=X FφR Y=KX=KφR X F
物料衡算:SY=B(X F-X)
∴
S/B=(X F-X)/Y=X F(1-φR)/(KφR X F)
=(1-0.05)/(1.2×0.05)=15.83
kgS/kgB
4、用纯溶剂S进行单级萃
取,X F=0.15(质量分率,下同)。萃取相中A的浓度与萃
余相中A 的浓度相同。采用溶剂比为1。试求:
⑴选择性系数β;
⑵当溶剂用量为最少时, 求萃取液浓度y A°。(设
所涉及范围内分配系数K A均相同)
解:(1) ∵y A=x A∴k A= y A/x A= 1 又S/F = 1
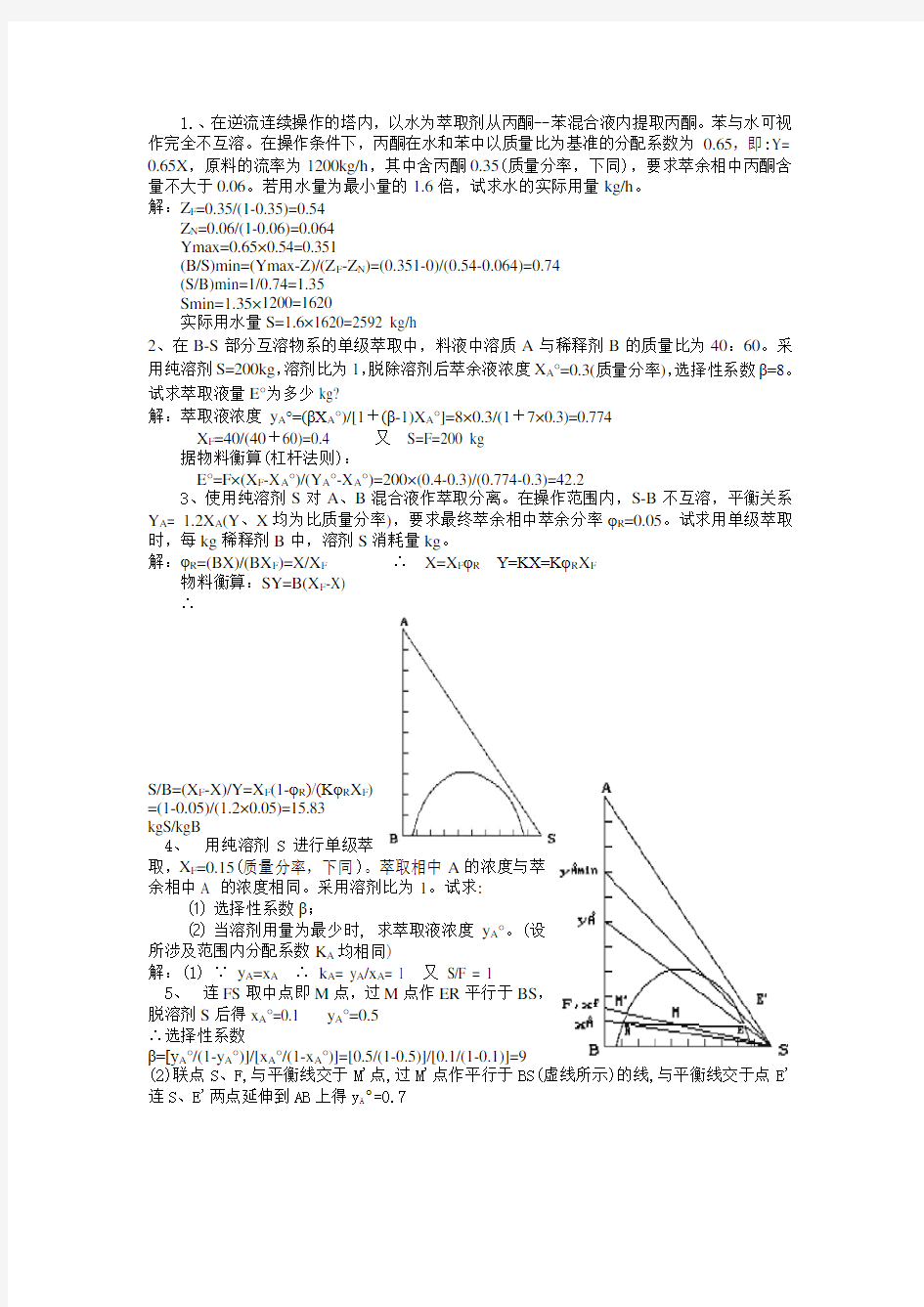
5、连FS取中点即M点,过M点作ER平行于BS,
脱溶剂S后得x A°=0.1 y A°=0.5
∴选择性系数
β=[y A°/(1-y A°)]/[x A°/(1-x A°)]=[0.5/(1-0.5)]/[0.1/(1-0.1)]=9
(2)联点S、F,与平衡线交于M'点,过M'点作平行于BS(虚线所示)的线,与平衡线交于点E'连S、E'两点延伸到AB上得y A°=0.7
6、已知AB混合液组成如图中F点所示。用纯溶剂单级萃取。萃余液的组成在R°点,物系的分配系数k A=1。试求:⑴选择性系数β;⑵当(S/F)min时,萃取液组成y A°。
解:(1) 连R°、S得R点,作RE平行于BS(∵k A=1)
得E点,连ES延伸到AB边得E°,其组成为0.6
∴β=[0.6/(1-0.6)]/[0.2/(1-0.2)]=6
(2) 过M'点(该点满足(S/F)min条件),作M'E'
平行于BS,过E'点脱溶剂得y A°=0.75
7、采用纯溶剂S进行单级萃取中,已知X F=0.3(质量分率),萃取相浓度为y A/y B=1.5,图中P点为临界互溶点,并知分配系数k A=2。试求:溶剂比S/F为多少?
解:y A/y B=y A°/(1-y A°)=1.5
解知:y A°=0.6。连y A°,S得E
点,E点y A=0.08
由k A=y A/x A=2,定x A→R点。
连E、R与F、S,交点M=F
+S=E+R
S/F=FM/SM=45/15=3(倍)
8、现有含A组分30%(质量%)的A+B混合物,采
用溶剂S进行萃取,A、B、S三元混合物的溶解度曲
线如图示。试求用单级萃取器时,萃取液中A组分最
大浓度可达多少? (质量) 此时溶剂用量为多少? (用线
段比及符号注明即可)
解:最大浓度y A°=55%;S=(MF/MS)×F。
9、有A、B、S三种有机液体,A与B、A与S完
全互溶,B与S部分互溶。其溶解度曲线与辅助曲线如
图,进料量为100Kg/h。试求:
①若采用单级萃取,萃取液可达到最大浓度为多
少?
②当进料为含A30%的AB混合液,萃取液的浓度达到了最大值,此时溶剂用量为多少?解:①从S点做溶解度曲线的切线和AB交于E'点,其Y' 即为最大浓度Y' =86%。
②从E点作AB平行线和辅助线交于P点,从P点对BS画平行线与溶解度线交点为R,S和R联线的延长线与AB交点R',X'=7%。
FM×F=MS×S
∴S=MF/MS×F=(41/59)×100=69.5 Kg/h
10、一混合液由A、B组成,现用溶剂S对A进行单级萃取,已知XF=0.3(质量分率,下同),要求萃余液的组成不大于0.1。试用图解法计算该物系S与B有互溶性变化时, 溶剂
用量与萃取液组成的变化。(可认为互溶性变化时,A的分配系数基本不变,K A=2)附:该物系在不同温度下的溶解度曲线。
解:S=F×18.5/25.5=0.725F
Y1'=0.78
S' =21.F/23=0.935F
S' =0.935S/0.725=1.29S
Y2'=0.42
Y1'=0.78/0.42×Y2'=1.86Y2'。
11、有一实验室装置将含A10%的AB50公斤和含A80%的AB20kg混合后,用溶剂S 进行单级萃取,所得萃取相和萃余相脱溶剂后又能得到原来的10%A和80%A的溶液。问此工作状态下的选择性系数β=?
解:β=(y A/x A)/(y B/x B) = (y A'/x A')/(y B'/x B') = (0.1/0.8)/(0.9/0.2) = 1/36
12、某A、B混合液用纯溶剂S单级萃取。已知:F=100kg/h,X F=0.4(质量分率,下同)。k A=1,萃余相的组成X A/X B=1/3。试求: ⑴萃余液量;⑵
溶剂量。
解:(1) x A/x B=x A°/x B°=x A°/(1-x A°)=1/3
解知萃余液组成x A°=0.25,连R1°S得R点。作RE
平行于BS,连SE延长与AB边交于点E',得萃取液组成
y A°=0.75。据杠杆法则:
E°=F×(x F-x A)/(y A-x A)=100×(0.4-0.25)/(0.75-0.25) =
30 kg/h
(2) RE与FS交点M。S=F×FM/SM=100×24/24 = 100
kg/h
以上答案由于在查图中会因人而有所出入,因此评
分标准着重思路与概念,作图步骤说明从简。凡萃取作
图题解均依此为准,以后不再重复说明了。
13、已知:单级萃取中采用纯溶剂。料液组成X F = 0.3(质量分率,下同),选择性系数为6,在萃余相中X A/X B=0.25,k A<1。试求:
⑴萃取液量与萃余液量的比值;
⑵溶剂比S/F是最小溶剂比(S/F)min的倍数(用线段表示)。
解:(1)
y A/y B=β×x A/x B=6×0.25=1.5
∴y A°/(1-y A°)=1.5 →
y A°= 0.6
又
x A°/(1-x A°)=0.25→x A°=0.2
连R°、S及E°、S得R点及E点(使k A<1满足)
E°/R°=(x F-x A°)/(y A°-x F)=(0.3-0.2)/(0.6-0.3)=1/3
(2) S/F=FM/SM (S/F)min=FM'/SM'
∴(S/F)/(S/F)min=FM/SM×SM'/FM'
14在两个理论级的逆流萃取设备中,B-S完全不互溶。已知分配系数K=Y A/X A=1,(Y、X--均为比质量分率),料液F=100kg/h,其中含A20%(质量%),使用40kg/h纯溶剂S 进行萃取。试求:最终萃余液中A的浓度X2(kgA/kgB)。
解:对第二级作物料衡算: B(X1-X2)=S(Y1-Z) Z=0
相平衡方程: Y2=KX2
两式联解得: X2=X1/(1+SK/B)=X1/(1+1/A)
对整个系统(两级)作物料衡算: B(X F-X2)=S(Y1-Z) Z=0
相平衡方程: Y1=KX1
经整理得: X2=X F/(1+1/A+1/A2)
萃取因数1/A=SK/B=40×1/80=0.5 A=2
∴X F=x F/(1-x F)=0.2/(1-0.2)=0.25 kgA/kgB
B=F/(1+X F)=100/(1+0.25)=80
∴X2=0.25/(1+0.5+1/22=0.25/1.75=0.1428
15拟设计一个多级逆流接触萃取塔。在操作范围内所用纯溶剂S与料液中稀释剂B完全不互溶;以质量比表示的分配系数为2。已知入塔顶F=100kg/h,其中含溶质A 为0.2(质量分率),要求出塔底的萃余相中A的浓度降为0.02(质量分率)。
试求:⑴最小的萃取剂用量Smin;
(2) 取S=60kg/h,则离开第二块理论板(理论级)的液相组成X2 kgA/kgB。(塔序由塔顶算起)。
解:(1) X F=x F/(1-x F)=0.2/(1-0.2)=0.25
X N =x N/(1-x N)=0.02/(1-0.02)=0.02041
B =F/(1+X F)=100/(1+0.25)=80
Smin=B(X F-X N)/Y1(Z=0)
Y1=2X F=2×0.25=0.5
∴Smin=80×(0.25-0.02041)/0.5=36.73 kg/h
(2) Y1=(B/S)(X F-X N)=(80/60)(0.25-0.02041)=0.306
X1=Y1/K=0.306/2=0.153
Y2=(B/S)(X1-X N)=(80/60)(0.153-0.02041)=0.177
X2=Y2/K=0.177/2=0.0884
16 在单级萃取操作中B-S部分互溶,进料中含A50kg,含B50kg.用纯溶剂萃取.已知萃取相浓度y A/y B=11/5,萃余相浓度x A/x B=1/3,试求:⑴选择性系数β;⑵萃取液量与萃余液量之比值E°/R°。
解:(1) β=(y A/y B)/(x A/x B)=(11/5)/(1/3)=6.6
(2) 进料中溶质A的组成x F=50/(50+50)=0.5 (质量分率,下同)
x A/x B=x A°/x B°=x A°/(1-x A°)=1/3 → x A°=0.25
y A/y B=y A°/(1-y A°)=11/5 → y A°=0.6875
∴E°/R°=(x F-x A°)/(y A°-x F)=(0.5-0.25)/(0.6875-0.5)=1.33
17 已知在最小溶剂比(S/F)min时操作点Δmin的位置如下图所示。今以S/F=1.2(S/F)min 进行逆流多级萃取,试求此时操作点Δ的位置。
解:连F、Δmin两点交E'点,R N E'与FS两线交点M',则(S/F)min=FM'/SM'=31/31=1 当S/F=1.2(S/F)min时,M'点延伸至M点。设延伸长度为Xmin,则:
S/F=(FM'+X)/(SM'-X)=(31+X)/(31-X)=1.2×1 解知:X=2.82 mm
确定了M点,连R N、M两点延伸至E点,连F、E两点延长交于Δ点。
18、某混合液含溶质A30%(质量%,下同)
原溶剂B70%,用纯溶剂S进行单级萃取,要求
萃余液中A的浓度不超过10%,此时A组分的分
配系数k A=1.5。试求:
1.所需溶剂比;
2.所得萃取液中A的浓度;
3.过程的选择性系数。
物系的溶解度曲线如图所示。
解:1.在相图上找到R'点,连R',S,交平衡线
于R点。由图读出R中溶质浓度约为9%。
∵kA=Y A/X A∴Y A=kA X A=
1.5×9%=13.5%
由此知E如图。
联S、E并延长交于AB于E',联R及E,与
SF线交于M点,由此知:
所需溶剂比为S/F=MF/SM=0.6/0.4=3/2
2.由E' 知,萃取液中A的浓度为Y A' =53%
3.β=(y A/y B)/(x A/x B) =(y A'/y B')/(x A'/x B')=[0.53/(1-0.53)]/(0.1/0.9)β=10.1
19、溶质A,原溶剂B,萃取剂S所构成的三元系统的溶解度曲线如图所示。原溶液含A35%、B65%,采用单级萃取。所用萃取剂为含A为5%,S为95%的回收溶剂。求:(1)当萃取相中A的浓度为30%时,每处理100Kg原料液需用多少Kg回收溶剂?
(2)在此原料条件下,单级萃取能达到的萃余相中A的最低浓度为多少?
解:(1) X F=0.35,Y A=0.3,X A=0.2
作图FM/MS' =34/67=S'/F=0.507
S' =100×0.507=50.7 Kg
(2) 如图,Xmin =0.06
20含40%(质量,下同)丙酮的水溶液,用甲基异丁基酮进行单级萃取。欲使萃余相中丙酮的含量不超过10%,求:
⑴处理每吨料液所需的溶剂量;⑵萃取相与萃余相的量;
⑶脱溶剂后萃取相的量;⑷丙酮的回收率。
解:⑴S/F=MF/MS=63/45=1.4 S=1.4 F=1.4吨
⑵R+E=S+F=1.4+1=2.4吨R/E=ME/MR=20/54=0.37
解得: E=1.75 R=0.65
⑶R°+E°=F=1 R°/E°=FE°/FR°=45/30=1.5
解得: E°=0.4吨R°=0.6吨
⑷Y°=0.83 回收率η=(E°y°)/(FX F)=(0.4×0.83)/(1×0.4)=0.83
21、用一单级接触式萃取器以S为溶剂,由A、B溶液中萃取出A。若原料液的质量组成为45%。质量为120kg,萃取后所得萃余相中A的含量为10%(质量百分数),求:
⑴所需萃取剂用量;
⑵所得萃取相的质量和组成;
⑶若将萃取相溶剂全部回收后,所得萃取液的质量和组成。
解:⑴S/F=MF/MS=56/51=1.098 S=120×1.098=131.8 kg
⑵M=S+F=131.8+120=251.8 kg E/M=MR/RE=49/65=0.754
E=0.754×251.8=189.8 kg 其中A=23%S=66%B=11%
⑶Y A°=75%Y B°=25%
E°/F=FR°/R°E°=35/65=0.538
E°=120×0.538=64.56 kg
22、某混合物含溶质A20%,稀释剂B80%,拟用纯
溶剂S进行单级萃取,要求萃余液中A的含量为10%,
溶解度曲线如图示。在操作范围内溶质A的分配系数
K A=1,试求:
⑴当处理100kg原混合液时,需溶剂用量为多少
kg?
⑵所得萃取液中A的浓度为多少?
⑶过程的选择性系数为多少?
⑷用什么办法在不影响萃取液中A的含量的条件
下,减少萃余液中A的含量。
解:⑴S=F×MF/MS=100×48/38=126 kg
⑵y°=30%
⑶β=(y A°/y B°)/(x A°/x B°)=(0.3/0.1)/(0.7/0.9)
= 3.857
⑷用多级逆流萃取
23用溶剂S萃取A、B二组分混合液中的A。操
作条件下A-B-S系统的相图见本题附图。已知料液处
理量为1000kg/h,其中含A35%(质量)。今欲通过连
续逆流萃取获得最高浓度的萃取液,且要求萃余相中
含A不超过5%(质量),求溶剂用量、萃取液浓度及
所需理论级数。
解:S/F=MF/MS=40/65=0.615
S=0.615×1000=615 kg/h
由S作曲线的切线得
Y1°max = 0.8 N T=2
流量计的种类很多,本实验是研究差压式(速度式)流量计的校正,这类差压式流量计是用测定流体的压差来确定流体流量(或流速)常用的有孔板流量计、文丘里流量计和毕托管等。实验装置用孔板流量计如同2。a)所示,是在管道法兰向装有一中心开孔的不诱钢板。 孔板流量计的缺点是阻力损失大,流体流过孔板流量计,由于流体与孔板有摩擦,流道突然收缩和扩大,形成涡流产生阻力,使部分压力损失,因此流体流过流量计后压力不能完全恢复,这种损失称为永久压力损失(局部阻力损失)。流量计的永久压力损失可以用实验方法测出。如下图所示,实验中测定3、4两个截面的压力差,即为永久压力损失。对孔板流量计,测定孔板前为d1的地方和孔板后6d1的地方两个截面压差 工厂生产的流量计大都是按标准规范生产的。出厂时一般都在标准技术状况下(101325Pa,20℃)以水或空气为介质进行标定,给出流量曲线或按规定的流量计算公式给出指定的流量系数,然而在使用时,往往由于所处温度、压强、介质的性质同标定时不同,因此为了测定准确和使用方便,应在现场进行流量计的校正。即使已校正过的流量计,由于在长时间使用中被磨损较大时,也需要再一次校正。 量体法和称重法都是以通过一定时间间隔内排出的流体体积或质量的测量来实现的 《化工原理实验指导》李发永 流量计原理 工厂生产的流量计,大都是按标准规范制造的。流量计出厂前要经过校核,并作出流量曲线,或按规定的流量计算公式给出指定的流量系数,或将流量系数直接刻在显示仪表刻度盘上供用户使用。 如果用户丢失原厂的流量曲线图;或者流量计经长期使用,由于磨损造成较大的计量误差;或者用户自行制造非标准形式的流量计;或者被测量流体与标定的流体成分或状态不同,则必须对流量计进行校核(或称为标定)。也就是用实验的方法测定流量计的指示值与实际流量的关系,作出流量曲线或确定流量的计算公式。因此,流量计的校核在生产、科研中都具有很重要的实际意义。 Φ16×2.5 Ф:是表示外径 DN:公称直径(近似内径) “Φ”标识普通圆钢管的直径,或管材的外径乘以壁厚,如:Φ25×3标识外径25mm,壁厚为3mm的管材; 以孔板流量计为例进行说明,文丘里流量计的原理与此完全一样,只是流量系数不同。
化工原理试题库3 试题1 一:填充题(20分) 1、直接水蒸汽加热的精馏塔适用于_________________,与间接蒸汽相比, 相同要求下,所需理论塔板数将____________。 2、平衡线表示塔的任一截面上气、液两相的___________________,操作线表示了_______________________________ 3、溶液中各组分之挥发度可用它在___________________和与之平衡的液相___________之比来表示,若是理想溶液,则__________________。 4、对拉乌尔定律产生正偏差是由于_______________________________。 5、对拉乌尔定律产生负偏差是由于_______________________________。 6、在板式塔的设计中,为了减少雾沫夹带,我们可以适当地_________塔径 以_______空塔气速,也可以适当地___________板间距。, 7、实验室用水吸收空气中的20C ,基本属于_________控制,其气膜中的浓度梯度________液膜中的浓度梯度,气膜阻力______液膜阻力。 8、在吸收操作时,若解吸因素L mV 增加,而气、液进料组成不变,则 溶质 的回收率将_________。 9、组分A 、B 的分配糸数之比值1 β,能否________萃取分离。 10、理论干燥过程是指 ____________________________________________. 11、 总压为0.1Mpa 的空气温度小于C 0100时,空气中水蒸汽分压的最大值应为_________________________________________. 12、 单级萃取操作中,料液为F ,若溶剂用量愈大,则混合物的点愈_______ S 点,当达到__________,溶液变为均一相。 二:问答题(30分) 1、何谓理论板?为什么说一个三角形梯级代表一块理论块? 2、何谓塔的漏液现象?如何防止? 3、填料可分为哪几类?对填料有何要求? 4、写出任意一种求温度的方法? 5、叙述多级逆流萃取操作是如何求理论级数的? 三:计算题(50分) 1、用一精馏塔分离二元理想混合物,已知3=α,进料浓度为3.0=F x ,进 料量为h Kmol 2000 ,泡点进料。要求塔 顶浓度为0.9,塔釜浓度为
《化工原理》课程设计 水吸收氨气过程填料塔的设计学院 专业制药工程 班级 姓名 学号 指导教师 2013 年 1 月 15 日 目录 设计任务书 (4)
参考文献 (15) 对本设计的评述及心得 (15)
附表:附表附表
设计任务书 (一)、设计题目:水吸收氨气过程填料吸收塔的设计 试设计一座填料吸收塔,用于脱除混于空气中的氨气。混合气体的处理量为7500 m3/h,其中含氨气为5%(体积分数),要求塔顶排放气体中含氨低于%(体积分数)。采用清水进行吸收,吸收剂的用量为最小用量的倍。 (二)、操作条件 (1)操作压力常压 (2)操作温度 20℃. (三)填料类型 选用聚丙烯阶梯环填料,填料规格自选。 (四)工作日 每年300天,每天24小时连续进行。 (五)厂址 厂址为衡阳地区 (六)设计内容 1.吸收塔的物料衡算; 2.吸收塔的工艺尺寸计算;
3.填料层压降的计算; 4.液体分布器简要设计 5.吸收塔接管尺寸计算; 6.绘制吸收塔设计条件图; 7.对设计过程的评述和有关问题的讨论。 (七)操作条件 20℃氨气在水中的溶解度系数为H=(m3kPa)。 第一节前言 填料塔的有关介绍 填料塔洗涤吸收净化工艺不单应用在化工领域 ,在低浓度工业废气净化方面也能很好地发挥作用。工程实践表明 ,合理的系统工艺和塔体设计 ,是保证净化效果的前提。本文简述聚丙烯阶梯填料应用于水吸收氨过程的工艺设计以及工程问题。 填料塔是以塔内的填料作为气液两相间接触构件的传质设备,它是化工类企业中最常用的气液传质设备之一。 填料塔的主体结构如下图所示: 图1 填料塔结构图 填料塔不但结构简单,且流体通过填料层的压降较小,易于用耐腐蚀材料制造,所以它特别适用于处理量小、有腐蚀性的物料及要求压降小的场合。液体自塔顶经液体分布器喷洒于填料顶部,并在填料的表面呈膜状流下,气体从塔底的气体口送入,流过填料的空隙,在填料层中与液体逆流接触进行传质。因气液两相组成沿塔高连续变化,所
1.、在逆流连续操作的塔内,以水为萃取剂从丙酮--苯混合液内提取丙酮。苯与水可视作完全不互溶。在操作条件下,丙酮在水和苯中以质量比为基准的分配系数为0.65,即:Y= 0.65X,原料的流率为1200kg/h,其中含丙酮0.35(质量分率,下同),要求萃余相中丙酮含量不大于0.06。若用水量为最小量的1.6倍,试求水的实际用量kg/h。 解:Z F=0.35/(1-0.35)=0.54 Z N=0.06/(1-0.06)=0.064 Ymax=0.65×0.54=0.351 (B/S)min=(Ymax-Z)/(Z F-Z N)=(0.351-0)/(0.54-0.064)=0.74 (S/B)min=1/0.74=1.35 Smin=1.35×1200=1620 实际用水量S=1.6×1620=2592 kg/h 2、在B-S部分互溶物系的单级萃取中,料液中溶质A与稀释剂B的质量比为40:60。采用纯溶剂S=200kg,溶剂比为1,脱除溶剂后萃余液浓度X A°=0.3(质量分率),选择性系数β=8。试求萃取液量E°为多少kg? 解:萃取液浓度y A°=(βX A°)/[1+(β-1)X A°]=8×0.3/(1+7×0.3)=0.774 X F=40/(40+60)=0.4 又S=F=200 kg 据物料衡算(杠杆法则): E°=F×(X F-X A°)/(Y A°-X A°)=200×(0.4-0.3)/(0.774-0.3)=42.2 3、使用纯溶剂S对A、B混合液作萃取分离。在操作范围内,S-B不互溶,平衡关系Y A= 1.2X A(Y、X均为比质量分率),要求最终萃余相中萃余分率φR=0.05。试求用单级萃取时,每kg稀释剂B中,溶剂S消耗量kg。 解:φR=(BX)/(BX F)=X/X F∴X=X FφR Y=KX=KφR X F 物料衡算:SY=B(X F-X) ∴ S/B=(X F-X)/Y=X F(1-φR)/(KφR X F)=(1-0.05)/(1.2×0.05)=15.83 kgS/kgB 4、用纯溶剂S进行单级萃取,X F=0.15(质量分率,下同)。 萃取相中A的浓度与萃余相中A 的浓度相同。采用溶剂比为1。 试求: ⑴选择性系数β; ⑵当溶剂用量为最少时, 求萃取液浓度y A°。(设所涉及范 围内分配系数K A均相同) 解:(1) ∵y A=x A∴k A= y A/x A= 1 又S/F = 1 5、连FS取中点即M点, 过M点作ER平行于BS,脱溶 剂S后得x A°=0.1 y A°=0.5 ∴选择性系数 β=[y A°/(1-y A°)]/[x A°/(1-x A°)]=[0.5/(1-0.5)]/[0.1/(1-0.1)]=9 (2)联点S、F,与平衡线交于M'点,过M'点作平行于BS(虚线所示)的线,与平衡线交于点E'连S、E'两点延伸到AB上得y A°=0.7
化工2004/02 化工原理实验 福州大学化工原理实验室 二〇〇四年二月
前言 实施科教兴国战略和可持续发展战略,迎接知识经济时代的到来,建设面向知识经济时代的国家创新体系,要求造就一支庞大的高素质的创造性人才队伍。因此,作为高级人才的培养基地,高等院校应当把创造力的教育和培养贯穿于各门课程教学及实践性教学环节中。实践性教学环节相对于课堂理论教学环节,更能贯穿对学生创造力的开发,其教学内容、方法、手段如何能适应创造性人才的培养要求尤为重要。传统的大学实验教学,其内容是以验证前人知识为主的验证型实验,其方法是教师手把手地教,这些都不利于培养学生的主动性和创造性。当今,大学实验教学改革中,普遍开设综合型、设计型、研究型实验,是对学生进行创造教育的重要思路和做法。在“211工程”重点建设的大学必须通过的本科教学评优工作指标中就明确要求综合型、设计型、研究型实验应占70%以上。 《化工原理实验》是一门技术基础实验课,在培养化工类及相关专业的高级人才中起举足轻重的作用,被学校确定为我校参加本科教学评优工作重点建设的基础课程之一。福州大学投入247万元用于建设以“三型”实验为主的现代化的具有国内先进水平的化工原理实验室。目前,第一期投入100万元的化工原理实验室建设工作已经完成,第二期投入147万元的建设工作正在进行中。已建成具有国内先进水平的实验装置18套,其中有6套是我校与北京化工大学、天津大学共同联合研制的,有2套是我们自行研制的。这些装置将化工知识与计算机技术紧密地结合起来,同时还融合了化学、电工电子、数学、物理及机械等多学科的知识,具有计算机数据采集、处理和控制等功能,能够针对不同专业的要求开出不同类型的“三型”实验。有了这些高新技术装备的实验装置,我们还必须花大力气进行化工原理实验内容、方法的改革,必须以当代教育思想、教育方法论及教育心理学为指导,研究以学生自主学习为主的启发式、交互式、研讨式、动手式的实验教学方法,从实验方案拟定、实验步骤设计、实验流程装配、实验现象观察、实验数据处理和实验结果讨论等方面有效地培养学生的创造性思维和实践动手能力。《化工原理实验讲义》就是为了适应化工原理实验教学内容、方法、手段的改革要求而编写的。 《化工原理实验讲义》由施小芳高级实验师执笔主编,李微高级实验师、林述英实验师参与编写工作,阮奇教授主审。叶长燊等老师参加了编写讲义的讨论,并提出许多宝贵意见。在此,对本讲义在编写过程中给予热心帮助和支持的老师,表示衷心的感谢。 本讲义在编写过程中,参阅了有关书籍、杂志、兄弟院校的讲义等大量资料,由于篇幅所限,未能一一列举,谨此说明。本讲义难免存在不妥之处,衷心地希望读者给予指教,使本讲义日臻完善。 福州大学化工原理实验室 2004.2.5
《化工原理》课程设计 课题: 设计水吸收半水煤气体混合物中的二氧化碳的填料吸收塔设计者:王涛 学号:1043082002 指导老师:曹丽淑
目录 第一章设计任务????????????????????????????????????????????????????????????????????????????????????????????3 1.1设计题目????????????????????????????????????????????????????????????????????????????????????????????3 1.2设计任务及操作条件???????????????????????????????????????????????????????????????????????????3 1.3设计内容???????????????????????????????????????????????????????????????????????????????????????????????3 第二章设计方案???????????????????????????????????????????????????????????????????????????????????????????4 2.1设计流程的选择及流程图??????????????????????????????????????????????????????????????????????4 第三章填料塔的工艺设计??????????????????????????????????????????????????????????????????????????????4 3.1气液平衡关系????????????????????????????????????????????????????????????????????????????????????????4 3.2吸收剂用量???????????????????????????????????????????????????????????????????????????????????????????5 3.3计算热效应???????????????????????????????????????????????????????????????????????????????????????????5 3.4定塔径??????????????????????????????????????????????????????????????????????????????????????????????????6 3.5喷淋密度的校核?????????????????????????????????????????????????????????????????????????????????????6 3.6体积传质系数的计算??????????????????????????????????????????????????????????????????????????????7 3.7填料层高度的计算??????????????????????????????????????????????????????????????????????????????????8 3.8附属设备的选择???????????????????????????????????????????????????????????????????????????????????9第四章设计结果概要??????????????????????????????????????????????????????????????????????????????????15第五章设计评价 ?????????????????????????????????????????????????????????????????????????????????? 17
摘要 在化工生产中,气体吸收过程是利用气体混合物中,各组分在液体中溶解度或化学反应活性的差异,在气液两相接触是发生传质,实现气液混合物的分离。在化学工业中,经常需将气体混合物中的各个组分加以分离,其目的是: ①回收或捕获气体混合物中的有用物质,以制取产品; ②除去工艺气体中的有害成分,使气体净化,以便进一步加工处理;或除去工业放空尾气中的有害物,以免污染大气。根据不同性质上的差异,可以开发出不同的分离方法。吸收操作仅为其中之一,它利用混合物中各组分在液体中溶解度或化学反应活性的差异,在气液两相接触时发生传质,实现气液混合物的分离。 一般说来,完整的吸收过程应包括吸收和解吸两部分。在化工生产过程中,原料气的净化,气体产品的精制,治理有害气体,保护环境等方面都要用到气体吸收过程。填料塔作为主要设备之一,越来越受到青睐。二氧化硫填料吸收塔,以水为溶剂,经济合理,净化度高,污染小。此外,由于水和二氧化硫反应生成硫酸,具有很大的利用。 本次化工原理课程设计,我设计的题目是:炉气处理量为m3 4200炉气吸过程填料吸收塔设计。本次任务为用水吸收二氧化硫常压填料塔。具体设计条件如下: 1、混合物成分:空气和二氧化硫; 2、二氧化硫的含量:0.05(摩尔分率) 3、操作压强;常压操作 4、进塔炉气流量:h 4200 m3 5、二氧化硫气体回收率:95% 吸收过程视为等温吸收过程。
目录 摘要 .................................................................................................................................................. I 第一章 设计方案的确定 (1) 1.1流程方案 (1) 1.2设备方案 (1) 1.3流程布置 (1) 1.4吸收剂的选择 (1) 第二章 填料的选择 (2) 2.1对填料的要求 (2) 2.2填料的种类和特性 (2) 2.3填料尺寸 (3) 2.4填料材质的选择 (3) 第三章 工艺计算 (4) 3.1气液平衡的关系 (4) 3.2吸收剂用量及操作线的确定 (4) 3.2.1吸收剂用量的确定 (4) 3.2.2操作线的确定 (5) 3.3塔径计算 (5) 3.3.1采用Eckert 通用关联图法计算泛点速率f u : (5) 3.3.2操作气速 (7) 3.3.3塔径计算 (7) 3.3.4喷淋密度U 校核 (7) 3.3.5单位高度填料层压降(Z P )的校核 (8) 3.4填料层高度计算 (9) 3.4.1传质系数的计算 (9) 3.4.2填料高度的计算 (12) 第四章 填料塔内件的类型与设计 (13) 4.1 塔内件的类型 (13) 第五章 辅助设备的选型 (16) 5.1管径的选择 (16) 5.2泵的选取: (17) 5.3风机的选型: (17) 第六章 填料塔附属高度计算 (17) 第七章 分布器简要计算 (18) 第八章 关于填料塔设计的选材 (18) 参考文献 (19) 附录 (20) 附图 (21) 致谢 (22)
实验1 雷诺实验 一、实验目的 1、观察液体在不同流动状态时的流体质点的运动规律。 2、观察液体由层流变紊流及由紊流变层流的过渡过程。 3、测定液体在园管中流动时的上临界雷诺数Rec1和下临界雷诺数Rec2。 二、实验要求 1、实验前认真阅读实验教材,掌握与实验相关的基本理论知识。 2、熟练掌握实验内容、方法和步骤,按规定进行实验操作。 3、仔细观察实验现象,记录实验数据。 4、分析计算实验数据,提交实验报告。 三、实验仪器 1、雷诺实验装置(套), 2、蓝、红墨水各一瓶, 3、秒表、温度计各一只, 4、 卷尺。 四、实验原理 流体在管道中流动,有两种不同的流动状态,其阻力性质也不同。在实验过程中,保持水箱中的水位恒定,即水头H不变。如果管路中出口阀门开启较小,在管路中就有稳定的平均流速u,这时候如果微启带色水阀门,带色水就会和无色水在管路中沿轴线同步向前流动,带色水成一条带色直线,其流动质点没有垂直于主流方向的横向运动,带色水线没有与周围的液体混杂,层次分明的在管道中流动。此时,在速度较小而粘性较大和惯性力较小的情况下运动,为层流运动。如果将出口阀门逐渐开大,管路中的带色直线出现脉动,流体质点还没有出现相互交换的现象,流体的运动成临界状态。如果将出口阀门继续开大,出现流体质点的横向脉动,使色线完全扩散与无色水混合,此时流体的流动状态为紊流运动。
雷诺数:γ d u ?= Re 连续性方程:A ?u=Q u=Q/A 流量Q 用体积法测出,即在时间t 内流入计量水箱中流体的体积ΔV 。 t V Q ?= 4 2 d A ?=π 式中:A-管路的横截面积 u-流速 d-管路直径 γ-水的粘度 五、实验步骤 1、连接水管,将下水箱注满水。 2、连接电源,启动潜水泵向上水箱注水至水位恒定。 3、将蓝墨水注入带色水箱,微启水阀,观察带色水的流动从直线状态至脉动临界状态。 4、通过计量水箱,记录30秒内流体的体积,测试记录水温。 5、调整水阀至带色水直线消失,再微调水阀至带色水直线重新出现,重复步骤4。 6、层流到紊流;紊流到层流各重复实验三次。 六、数据记录与计算 d= mm T (水温)= 0C 七、实验分析与总结(可添加页) 1、描述层流向紊流转化以及紊流向层流转化的实验现象。 2、计算下临界雷诺数以及上临界雷诺数的平均值。
化工原理《液-液萃取》概念题 一、单项选择题 1、单级萃取中,若增加纯溶剂S得加入量,则萃取液得浓度y A 将。 A、不变 B、减小 C、增大 D、不确定 2、单级萃取操作时,若降低操作温度,其她条件不变,则溶剂得选择性将。 A、变差 B、变好 C、不变 D、不确定 3、选用溶剂进行萃取操作时,其必要条件为。 A、分配系数k A <1 B、萃取相含量y A ≤萃余相含量x A C、选择性系数β>1 D、分配系数k B =1 4、单级萃取中,若升高操作温度,则萃取液中溶质得浓度y A 将。 A、不变 B、减小 C、增大 D、不确定 5、对于萃取过程,若溶剂得选择性好,则溶剂得溶解度也将。 A、变大 B、变小 C、不变 D、不确定 6、当萃取过程溶剂比S/F减小时,萃取液中溶质A得浓度,所需理论级数。 A、不变,减小 B、减小,减小 C、增大,减小 D、减小,增大 7、萃取过程得能耗主要集中在。 A、萃取操作时溶剂得输送 B、萃取操作时原溶液得输送 C、萃取操作时溶剂得回收 D、萃取操作时温度得升高 8、以下说法错误得就是。 A、临界混溶点位于溶解度曲线最高点 B、临界混溶点左方曲线表达式为: C、临界混溶点右方曲线表达式为: D、溶解度曲线内得平衡联结线两端得表达式为: 9、一般情况下,稀释剂B组分得分配系数k B 值。 A、大于1 B、小于1 C、等于1 D、难以判断,都有可能 10、单级(理论)萃取中,在维持进料组成与萃取相浓度不变得条件下,若用含有少量溶质得萃取剂代替纯溶剂所得萃余相浓度将。 A、增加 B、减少 C、不变 D、不一定 11、单级(理论)萃取操作中,在维持相同萃余相浓度下,用含有少量溶质得萃取剂代替纯溶剂,则萃取相量与萃余相量之比将。 A、增加 B、不变 C、降低 D、不定 12、单级(理论)萃取操作中,在维持相同萃余相浓度下,用含有少量溶质得萃取剂代替纯溶剂,萃取液得浓度(指溶质)将。 A、增加 B、不变 C、降低 D、不定 13、萃取剂加入量应使原料与萃取剂得与点M位于。 A、溶解度曲线之上方区 B、溶解度曲线上 C、溶解度曲线之下方区 D、座标线上 14、萃取就是利用各组分间得差异来分离液体混合物得。 A、挥发度 B、离散度 C、溶解度 D、密度 15、采用多级逆流萃取与单级萃取相比较,如果溶剂比、萃取相浓度一样,则多级逆流萃取可使萃余相分率。 A、增大 B、减少 C、基本不变 D、增大、减少都有可能
《化工原理》课程设计水吸收氨气过程填料塔的设计 学院 专业制药工程 班级 姓名 学号 指导教师 2013 年 1 月 15 日
目录 设计任务书 (4) 第一节前言 (3) 1.1 填料塔的有关介绍 (4) 1.2 塔内填料的有关介绍............................. 错误!未定义书签。第二节填料塔主体设计方案的确定 .. (5) 2.1 装置流程的确定 (5) 2.2 吸收剂的选择 (5) 2.3 填料的类型与选择 (7) 2.4 液相物性数据 (6) 2.5 气相物性数据 (8) 2.6 气液相平衡数据 (7) 2.7 物料横算 (7) 第三节填料塔工艺尺寸的计算 (8) 3.1 塔径的计算 (8) 3.2 填料层高度的计算及分段 (9) 3.2.1 传质单元数的计算 (10) 3.2.2 传质单元高度的计算 (10) 3.2.3 填料层的分段 (11) 第四节填料层压降的计算 (12) 第五节填料塔内件的类型及设计 (13) 第六节填料塔液体分布器的简要设计 (13) 参考文献 (15) 对本设计的评述及心得 (15) 附表: 附表1填料塔设计结果一览表 (15) 附表2 填料塔设计数据一览 (15) 附件一:塔设备流程图 (17)
设计任务书 (一)、设计题目:水吸收氨气过程填料吸收塔的设计 试设计一座填料吸收塔,用于脱除混于空气中的氨气。混合气体的处理量为7500 m3/h,其中含氨气为5%(体积分数),要求塔顶排放气体中含氨低于0.02%(体积分数)。采用清水进行吸收,吸收剂的用量为最小用量的1.5倍。 (二)、操作条件 (1)操作压力常压 (2)操作温度 20℃. (三)填料类型 选用聚丙烯阶梯环填料,填料规格自选。 (四)工作日 每年300天,每天24小时连续进行。 (五)厂址 厂址为衡阳地区 (六)设计内容 1.吸收塔的物料衡算; 2.吸收塔的工艺尺寸计算; 3.填料层压降的计算; 4.液体分布器简要设计 5.吸收塔接管尺寸计算; 6.绘制吸收塔设计条件图; 7.对设计过程的评述和有关问题的讨论。 (七)操作条件 20℃氨气在水中的溶解度系数为H=0.725kmol/(m3?kPa)。
篇一:化工原理实验报告吸收实验 姓名 专业月实验内容吸收实验指导教师 一、实验名称: 吸收实验 二、实验目的: 1.学习填料塔的操作; 2. 测定填料塔体积吸收系数kya. 三、实验原理: 对填料吸收塔的要求,既希望它的传质效率高,又希望它的压降低以省能耗。但两者往往是矛盾的,故面对一台吸收塔应摸索它的适宜操作条件。 (一)、空塔气速与填料层压降关系 气体通过填料层压降△p与填料特性及气、液流量大小等有关,常通过实验测定。 若以空塔气速uo[m/s]为横坐标,单位填料层压降?p[mmh20/m]为纵坐标,在z ?p~uo关系z双对数坐标纸上标绘如图2-2-7-1所示。当液体喷淋量l0=0时,可知 为一直线,其斜率约1.0—2,当喷淋量为l1时,?p~uo为一折线,若喷淋量越大,z ?p值较小时为恒持z折线位置越向左移动,图中l2>l1。每条折线分为三个区段, 液区,?p?p?p~uo关系曲线斜率与干塔的相同。值为中间时叫截液区,~uo曲zzz ?p值较大时叫液泛区,z线斜率大于2,持液区与截液区之间的转折点叫截点a。 姓名 专业月实验内容指导教师?p~uo曲线斜率大于10,截液区与液泛区之间的转折点叫泛点b。在液泛区塔已z 无法操作。塔的最适宜操作条件是在截点与泛点之间,此时塔效率最高。 图2-2-7-1 填料塔层的?p~uo关系图 z 图2-2-7-2 吸收塔物料衡算 (二)、吸收系数与吸收效率 本实验用水吸收空气与氨混合气体中的氨,氨易溶于水,故此操作属气膜控制。若气相中氨的浓度较小,则氨溶于水后的气液平衡关系可认为符合亨利定律,吸收姓名 专业月实验内容指导教师平均推动力可用对数平均浓度差法进行计算。其吸收速率方程可用下式表示: na?kya???h??ym(1)式中:na——被吸收的氨量[kmolnh3/h];?——塔的截面积[m2] h——填料层高度[m] ?ym——气相对数平均推动力 kya——气相体积吸收系数[kmolnh3/m3·h] 被吸收氨量的计算,对全塔进行物料衡算(见图2-2-7-2): na?v(y1?y2)?l(x1?x2) (2)式中:v——空气的流量[kmol空气/h] l——吸收剂(水)的流量[kmolh20/h] y1——塔底气相浓度[kmolnh3/kmol空气] y2——塔顶气相浓度[kmolnh3/kmol空气] x1,x2——分别为塔底、塔顶液相浓度[kmolnh3/kmolh20] 由式(1)和式(2)联解得: kya?v(y1?y2)(3) ??h??ym 为求得kya必须先求出y1、y2和?ym之值。 1、y1值的计算:
1.洞道干燥实验及干燥特性曲线的测定 (1)什么是恒定干燥条件?本实验装置中采用了哪些措施来保持干燥过程在恒定干燥条件下进行? 答:恒定干燥条件指干燥介质的温度、湿度、流速及与物料的接触方式,都在整个干燥过程中均保持恒定。 本实验中所采取的措施:干燥室其侧面及底面均外包绝缘材料、用电加热器加热空气再通入干燥室且流速保持恒定、湿物的放置要与气流保持平行。 (2)控制恒速干燥速率阶段的因素是什么?降速的又是什么? 答:①恒速干燥阶段的干燥速率的大小取决于物料表面水分的汽化速率,亦取决定于物料外部的干燥条件,所以恒定干燥阶段又称为表面汽化控制阶段。 ②降速阶段的干燥速率取决于物料本身结构、形状和尺寸,而与干燥介质的状态参数关系不大,故降速阶段又称物料内部迁移控制阶段。 (3)为什么要先启动风机,再启动加热器?实验过程中干湿球温度计是否变化?为什么?如何判断实验已经结束? 答:①让加热器通过风冷慢慢加热,避免损坏加热器,反之如果先启动加热器,通过风机的吹风会出现急冷,高温极冷,损坏加热器; ②理论上干、湿球温度是不变的,但实验过程中干球温度不变,但湿球温度缓慢上升,估计是因为干燥的速率不断降低,使得气体湿度降低,从而温度变化。 ③湿毛毡恒重时,即为实验结束。 (4)若加大热空气流量,干燥速率曲线有何变化?恒速干燥速率,临界湿含量又如何变化?为什么?
答:干燥曲线起始点上升,下降幅度增大,达到临界点时间缩短,临界点含水量降低。因为加快了热空气排湿能力。 (5)毛毡含水是什么性质的水分? 毛毡含水有自由水和平衡水,其中干燥为了除去自由水。 (6)实验过程中干、湿球温度计是否变化?为什么? 答:实验结果表明干、湿球温度计都有变化,但变化不大。 理论上用大量的湿空气干燥少量物料可认为符合定态空气条件。定态空气条件:空气状态不变(气流的温度t、相对湿度φ)等。干球温度不变,湿球温度不变。 绝热增湿过程,则干球温度变小,湿球温度不变。 (7)什么是恒定干燥条件?本实验装置中采用了哪些措施来保持干燥过程在恒定干燥条件下进行? 答:①指干燥介质的温度、湿度、流速及与物料的接触方式,均在整个干燥过程中保持恒定;②本实验中本实验用大量空气干燥少量物料,则可以认为湿空气在干燥过程温度。湿度均不变,再加上气流速度以及气流与物料的接触方式不变。所以这个过程可视为实验在在恒定干燥条件下进行。
填料吸收塔的操作及吸收传质系数的测定 一、实验目的 1.了解填料吸收塔的结构和流程; 2.了解吸收剂进口条件的变化对吸收操作结果的影响; 3.掌握吸收总传质系数K y a 的测定方法 4. 学会使用GC 二、实验原理 吸收操作是分离气体混合物的方法之一,在实际操作过程中往往同时具有净化与回收双重目的。因而,气体出口浓度y 2是度量该吸收塔性能的重要指标,但影响y 2的因素很多,因为吸收传质速率N A 由吸收速率方程式决定。 (一). 吸收速率方程式: 吸收传质速率由吸收速率方程决定 : m y A y aV K N ?=填 或 m y A y A K N ?= 式中: Ky 气相总传系数,mol/m 3.s ; A 填料的有效接触面积,m 2; Δy m 塔顶、塔底气相平均推动力, V 填 填料层堆积体积,m 3; K y a 气相总容积吸收传质系数,mol/m 2.s 。
从前所述可知,N A 的大小既与设备因素有关,又有操作因素有关。 (二).影响因素: 1.设备因素: V 填与填料层高度H 、填料特性及放置方式有关。然而,一旦填料塔制成,V 填就为一定值。 2.操作因素: a .气相总容积吸收传质系数K y a 根据双膜理论,在一定的气温下,吸收总容积吸收传质系数K y a 可表示成: a k m a k a K x y y +=11 又有文献可知:a y G A a k ?=和b x L B a k ?=,综合可得b a y L G C a K ?=,显然K y a 与气体流量及液体流量均有密切关系。比较a 、b 大小,可讨论气膜控制或液膜控制。 b .气相平均推动力Δy m 将操作线方程为:22)(y x x G L y +-= 的吸收操作线和平衡线方程为:y =mx 的平衡线在方格纸上作图,从图5-1中可得知: 2 12 1ln y y y y y m ???-?= ?
化工原理实验指导书
目录 实验一流体流动阻力的测定 (1) 实验二离心泵特性曲线的测定 (5) 实验三传热系数测定实验 (7) 实验四筛板式精馏塔的操作及塔板效率测定 (9) 实验五填料塔吸收实验 (12) 演示实验柏努利方程实验 (14)
雷诺实验 (16)
实验一流体流动阻力的测定 、实验目的 1、 了解流体在管道内摩擦阻力的测定方法; 2、 确定摩擦系数入与雷诺数 Re 的关系。 二、基本原理 由于流体具有粘性, 在管内流动时必须克服内摩擦力。 当流体呈湍流流动时, 质点间不 断相互碰撞,弓I 起质点间动量交换,从而产生了湍动阻力,消耗了流体能量。流体的粘性和 流体 的涡流产生了流体流动的阻力。 在被侧直管段的两取压口之间列出柏努力方程式, 可得: △ P f = △ P ’ P f L u 2 h f d 2 L —两侧压点间直管长度(m ) 2d P f d —直管内径(m ) 入一摩擦阻力系数 u —流体流速(m/s ) △ P f —直管阻力引起的压降(N/m 2 ) 厂流体粘度(Pa.s ) p — 流体密度(kg/m 3 ) 本实验在管壁粗糙度、管长、管径、一定的条件下用水做实验,改变水流量,测得一系 列流量下的△ P f 值,将已知尺寸和所测数据代入各式,分别求出入和 Re ,在双对数坐标纸 上绘出入?Re 曲线。 三、实验装置简要说明 水泵将储水糟中的水抽出, 送入实验系统,首先经玻璃转子流量计测量流量, 然后送入 被测直管段测量流体流动的阻力,经回流管流回储水槽,水循环使用。 被测直管段流体流 动阻力△ P 可根据其数值大小分别采用变压器或空气一水倒置 U 型管来测量。 四、实验步骤: 1、 向储水槽内注蒸馏水,直到水满为止。 2、 大流量状态下的压差测量系统 ,应先接电预热10-15分钟,观擦数字仪表的初始值并 记 录后方可启动泵做实验。 3、 检查导压系统内有无气泡存在 .当流量为0时打开B1、B2两阀门,若空气一水倒置 U 型管内两液柱的高度差不为 0,则说明系统内有气泡存在,需要排净气泡方可测取数据。 排气方法:将流量调至较大,排除导压管内的气泡,直至排净为止。 4、 测取数据的顺序可从大流量至小流量,反之也可,一般测 15?20组数,建议当流量 读数 小于300L/h 时,用空气一水倒置 U 型管测压差△ P 。 5、待数据测量完毕,关闭流量调节阀,切断电源。 Re du
化工原理课程设计任务书设计题目填料吸收塔设计—15 主要内容1、设计方案简介:对给定或选定的工艺流程、主要设备进行简要 论述; 2、主要设备的工艺设计计算:物料衡算、能量衡算、工艺参数的 选定、填料塔结构设计和工艺尺寸的设计计算; 3、辅助设备的选型 4、绘流程图:以单线图的形式描绘,标出主体设备和辅助设备的 物料方向、物流量、能流量。 5、吸收塔的设备工艺条件图 6、编写设计计算说明书 设计参数用清水吸收空气中的NH 3 气体,混合气体处理量5000m3/h,其中NH 3 含量为0.14kg/m3干空气(标态),干空气温度为25℃,相对湿度为 70%,要求净化气中NH 3 含量不超过0.07%(体积分数),气体入口温 度40℃,入塔吸收剂中不含NH 3 ,水入口温度30℃。 设计计划进度布置任务,学习课程设计指导书,其它准备……………0.5天主要工艺设计计算…………………………………………2.5天辅助设备选型计算/绘制工艺流程图……………………1.0天绘制主要设备工艺条件图…………………………………1.0天编写设计计算说明书(考核)……………………………1.0天合计:(1周)………………………………………………6.0天 主要参考文献1. 《化工原理课程设计》,贾绍义等编,天津大学出版社,2002.08 2.《化工原理》(上、下册),夏清,陈常贵主编,天津大学出版社, 2005.01 3. 《化工原理课程设计》,大连理工大学编,大连理工大学出版社, 1994.07 4.《化工工艺设计手册》(第三版)(上、下册),化学工业出版社, 2003.08 5.《化学工程手册》(第二版)(上、下卷),时钧等主编,化学工 业出版社,1998.11 6.《化工设备机械基础》,董大勤编,化学工业出版社,2003.01 7.《化工数据导引》,王福安主编,化工出版社,1995.10 8.《化工工程制图》,魏崇光等主编,化学工业出版社1994.05 9.《现代填料塔技术指南》,王树楹主编,中国石化出版社,1998.08 设计文件要求1.设计说明书不得少于7000字,A4幅面; 2.工艺流程图为A2幅面; 3.设备工艺条件图为A3幅面; 备注
1流体阻力测定实验 实验目的 1)掌握流体流经直管和阀门时阻力损失的测定方法,通过实验了解流体流动中能量损失的变化规律。 2 )测定直管摩擦系数入与雷诺准数Re的关系,将所得的入~Re方程与经验公式比较。 3 )测定流体流经阀门时的局部阻力系数E。 4 )学会倒U形差压计、差压传感器、涡轮流量计的使用方法。 5 )观察组成管路的各种管件、阀门,并了解其作用。 基本原理 流体在管内流动时,由于粘性剪应力和涡流的存在,不可避免地要消耗一定的机械能,这种机械能的消耗包括流体流经直管的沿程阻力和因流体运动方向改变所引起的局部阻力。 1)沿程阻力 流体在水平等径圆管中稳定流动时,阻力损失表现为压力降低,即 h f 仏上厘(1 —1) 影响阻力损失的因素很多,尤其对湍流流体,目前尚不能完全用理论方法求解,必须通 过实验研究其规律。为了减少实验工作量,使实验结果具有普遍意义,必须采用因次分析方法将各变量组合成准数关联式。根据因次分析,影响阻力损失的因素有, (1)流体性质:密度P、粘度卩; (2)管路的几何尺寸:管径d、管长I、管壁粗糙度£; (3)流动条件:流速卩。 可表示为: p f (d,l,,,u,)(1—2)组合成如下的无因次式: p 2 (du I J d ,—)(1—3) u d p du I u2 (,—)? d d 2 du 令( , d )/ (1 — 4) 则式(1 —1)变为: 2 h f P 1u(1 - 5) d2 式中,入称为摩擦系数。层流(滞流)时,入=64/R e;湍流时入是雷诺准数R e和相对粗糙度的函数,须由实验确定。
2) 局部阻力 局部阻力通常有两种表示方法,即当量长度法和阻力系数法。 (1)当量长度法 流体流过某管件或阀门时,因局部阻力造成的损失,相当于流体流过与其具有相当管径 长度的直管阻力损失,这个直管长度称为当量长度,用符号le表示。这样,就可以用直管 阻力的公式来计算局部阻力损失,而且在管路计算时.可将管路中的直管长度与管件、阀门的当量长度合并在一起计算,如管路中直管长度为I,各种局部阻力的当量长度之和为le,则流体在管路中流动时的总阻力损失h f为 I leu2 h f(1 —6) d 2 (2)阻力系数法\ 流体通过某一管件或阀门时的阻力损失用流体在管路中的动能系数来表示,这种计算局 部阻力的方法,称为阻力系数法。 即 2 . u h f (1 —7) 2 式中,E――局部阻力系数,无因次;u 在小截面管中流体的平均流速,m/ s。 由于管件两侧距测压孔间的直管长度很短?引起的摩擦阻力与局部阻力相比,可以忽略不计。因此h f'直可应用柏努利方程由压差计读数求取。 实验装置与流程 1)实验装置 实验装置如图1 —1所示。主要由水箱、管道泵,不同管径、材质的管子,各种阀门和管件,转子流量计等组成。第一根为粗糙管,第二根为光滑管。第三根不锈钢管,装有待测闸阀,用于局部阻力的测定。 1、水箱 2、管道泵 3、5、6、球阀 4、均压环7、系统排水阀8闸阀9、流量调节阀 10、排污水阀11倒U形差压计12、不锈钢管13、粗糙管14、光滑管15、转子流量计16、导压管17、温度计18、进水阀
化工原理课程设计填料吸收塔的设计
课程设计 题目:填料吸收塔的设计 教学院:化学与材料工程学院 专业:化学工程与工艺(精细化工方向) 学号: 学生姓名: 指导教师:
年5月31日 《化工原理课程设计》任务书 ~年第2学期 学生姓名:专业班级:化学工程与工艺( ) 指导教师:工作部门:化工教研室 一、课程设计题目:填料吸收塔的设计 二、课程设计内容(含技术指标) 1. 工艺条件与数据 煤气中含苯2%(摩尔分数),煤气分子量为19;吸收塔底溶液含苯≥0.15%(质量分数);吸收塔气-液平衡y*=0.125x;解吸塔气-液平衡为y*=3.16x;吸收回收率≥95%;吸收剂为洗油,分子量260,相对密度0.8;生产能力为每小时处理含苯煤气m3;冷却水进口温度<25℃,出口温度≤50℃。 2. 操作条件 吸收操作条件为:1atm、27℃,解吸操作条件为:1atm、120℃;连续操作;解吸气流为过热水蒸气;经解吸后的液体直接用作吸收剂,正常操作下不再补充新鲜吸收剂;过程中热效应忽略不计。 3. 设计内容 ① 吸收塔、解吸塔填料层的高度计算和设计;
② 塔径的计算; ③ 其它工艺尺寸的计算。 三、进度安排 1.5月14日:分配任务; 2.5月14日-5月20日:查询资料、初步设计; 3.5月21日-5月27日:设计计算,完成报告。 四、基本要求 1. 设计计算书1份:设计说明书是将本设计进行综合介绍和说明。设计说明书应根据设计指导思想阐明设计特点,列出设计主要技术数据,对有关工艺流程和设备选型作出技术上和经济上的论证和评价。应按设计程序列出计算公式和计算结果,对所选用的物性数据和使用的经验公式、图表应注明来历。 设计说明书应附有带控制点的工艺流程图。 设计说明书具体包括以下内容:封面;目录;绪论;工艺流程、设备及操作条件;塔工艺和设备设计计算;塔机械结构和塔体附件及附属设备选型和计算;设计结果概览;附录;参考文献等。 2. 图纸1套:包括工艺流程图(3号图纸)。 教研室主任签名: 年月日