
第四章炔烃和二烯烃
一、教学目的及要求
1.了解不饱和烃的化学性质
2.使学生了解共轭二烯烃的结构特征和性质
3.掌握离域键,电子离域及共轭效应等重要概念
二、教学重点与难点
1.使学生了解共轭二烯烃的结构特征和性质
2.掌握离域键,电子离域及共轭效应等重要概念
三、教学方法
启发式
炔烃和二烯烃都是通式为C n H2n-2的不饱和烃,炔烃是分子中含有-C≡C-的不饱和烃,二烯烃是含有两个碳碳双键的不饱和烃,它们是同分异构体,但结构不同,性质各异。
第一节炔烃
一、炔烃的结构
最简单的炔烃是乙炔,现代物理方法证明,乙炔分子是一个线型分子,分子中四个原子排在一条直线上
H
C C H
180°
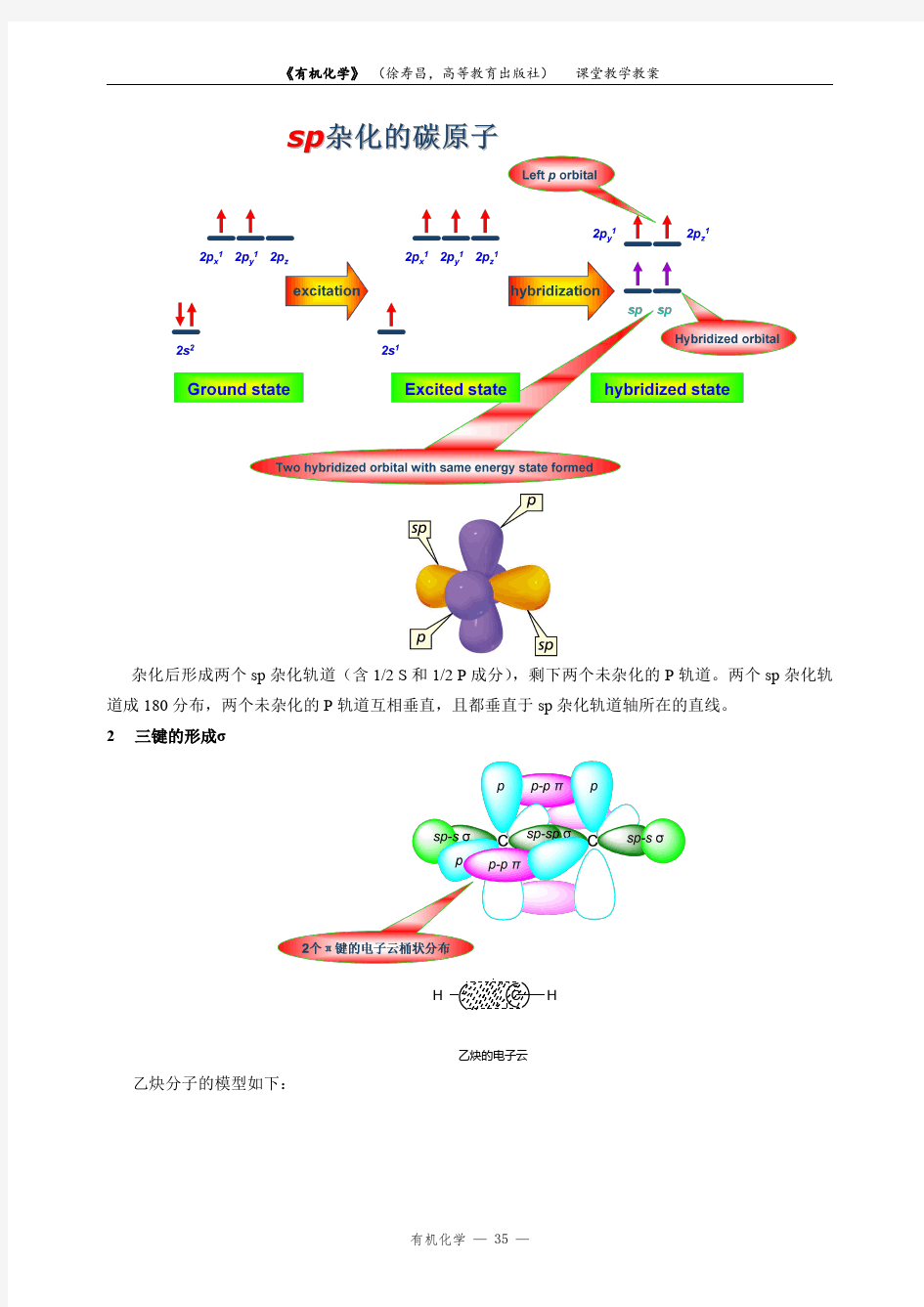
0.106nm0.120nm 1sp杂化轨道
杂化后形成两个sp杂化轨道(含1/2S和1/2P成分),剩下两个未杂化的P轨道。两个sp杂化轨道成180分布,两个未杂化的P轨道互相垂直,且都垂直于sp杂化轨道轴所在的直线。
2三键的形成σ
H
C H
乙炔的电子云
乙炔分子的模型如下:
二炔烃的命名
1炔烃的系统命名法和烯烃相似,只是将“烯”字改为“炔”字。2
烯炔(同时含有三键和双键的分子)的命名:(1)选择含有三键和双键的最长碳链为主链。
(2)主链的编号遵循链中双、三键位次最低系列原则。
(3)通常使双键具有最小的位次(但两种编号中一种较高时,宜采取较低一种)
例如:CH 2-CH =CH -C≡CH ,应命名为3-戊烯-1-炔(而非2-戊烯-4-炔)。
实例:
CH 3
CH
CH 3
C
CH
CH 3
C CH 3
CH 3
C
C
CH
CH 3CH 3
3-甲基-1-丁炔异丙基乙炔
3-methyl-1-butyne iso -propylethyne
2,2,5-三甲基-3-己炔异丙基叔定基己炔
2,2,5-trimethyl-3-hexyne
iso -propylbutylethyne
CH 3C
CCHCH 2CH
CH 2
CH 3
CH 2
CHCH CHC CH
4-甲基-1-庚烯-5-炔
4-methyl-1-hepten-5-yne
1,3-己二烯-5-炔1,3-hexadien-5-yne
三
炔烃的化学性质
R C C H
亲电加成
氧化
还原
炔化物生成
亲核加成
1
亲电加成
(1)与卤素或卤化氢的加成
B r 2
R -C =C
R '
B r
B r
C =C R B r
B r
R 'B r 2
R C
C R B r
B r
B r
B r ≡R -
C C -R '
≡R -C C -R 'H X R -C H =C -R '
X
H X
R C C R '
X
X
H H 特点1.反式加成
+C C
C H 3B r 2
B r
C C
C H 3
+
B r
-
C
C B r
B r
C H 3
+C 2H 5C C C 2H 5H C l
C C
H
C 2H 5
C l
C 2H 5
C C
H
C 2H 5
C l
C 2H 5+
99%1%特点2.与HX 的加成遵守马氏规则
R
C
C H
H X
H X
R
C C H
X
H
R
C C H X
H X H
C H 3C
C C H 3
H C l C H 3C O O H
C H 3C
C C H 3
C l
H
H C l C H 3C O O H
C H 3C
C C H 3C l
H C l H
特点3.反应活性不如烯烃,加Cl 2或HCl 时必须要催化。
可控制反应产物的加成的第一阶段。
HC CH
Cl 2FeCl 3
ClCH CHCl
Cl 2FeCl 3
Cl 2CHCHCl 2
HC CH HCl
+HgCl 2/C, 120~180?
or Cu 2Cl 2
or HgSO 4H 2C
CH Cl
特点4.溴化不需要催化剂,但可控制加成反应在第一阶段。
CH 3
C
C
CH 3
Br 2/Et 2O
-20℃CH 3
C C
CH 3Br
Br 2Br 225℃
CH 3CBr 2
CBr 2CH 3特点5.烯炔的加成首先发生在双键上,即双键活性较叁键高。
H 2C
CH
CH 2
C
CH +Br 2
低温
H 2C CH
CH 2
C
CH
Br
Br
原因:1.叁键的强吸电子性;
2.形成烯基碳正离子,不稳定。
R C
CH E +
+R
C
CH E
+sp 2R CH CH 2E +
+R CH CH 2
E
+sp 3
(2)水化反应
在炔烃加水反应中,先生成一个很不稳定的烯醇,烯醇很快转变为稳定的羰基化合物(酮式结构)。
C C
OH
C C
O
烯醇式(不稳定)
酮式(稳定)
这种异构现象称为酮醇互变异构。
R C CH H
O H H
++R
C
CH 2++H 2O
R
C
CH 2OH 2
++H 2O
R
C CH 2OH +H 3+O
R
C
CH 2+
+H 2O
R C
CH 2
OH 2
+烯醇
R C CH 2
O H R C CH 3
O
酮(羰基化合物)
烯醇
与水的加成—库切洛夫反应:
CH
CH +H 2O
HgSO 4/H 2SO 4
~100℃CH 2
CH
OH
CH 3CHO
CH 3
C
CH +H 2O
HgSO 4/H 2SO 4
CH 3
C CH
2
OH
CH 3
C CH 3
O
C CH 2
OH
+H 2O
HgSO 4/H 2SO 4
C
CH C CH 3
O
库切洛夫反应是由烯烃制备醛酮(乙炔得到乙醛,其他炔烃得到酮)的好方法,但汞盐会污染环境。(3)与乙硼烷的加成
CH 3CH 2C
CH
(CH 3CH 2C H CH)3B
CH 3CH 2C
CH
B 2H 6THF
CH 3CH 2C H CH BH 2
CH 3CH 2C
CH
(CH
3CH 2C H CH)2BH
H 2O 2OH -CH 3CH 2C H CH BH 2(CH 3CH 2C H CH)2BH (CH 3CH 2C H
CH)3B
CH 3CH 2C H
CH
O
H
CH 3CH 2CH 2C
O H
末端炔烃得到醛,非末端炔烃得到酮。2
氧化反应
(1)KMnO 4氧化
3CH 3COOH + 3CO 2 + 8KOH + 8MnO 2
8KMnO 44H 20
++CH 3C
CH 10KMnO 42H 20++HC CH 6CO 2 + 10KOH + 10MnO 2
(2)O 3氧化
O 3氧化,叁键断裂,生成两个羧酸
R
C
C
R'
O 3CCl 4
RCOOH R'COOH
+由此反应,可以推测原炔烃的结构。(3)CrO 3氧化
HC
C(CH 2)7CH
C(CH 3)2
CrO 3
HC
C(CH 2)7CHO CH 3COCH 3
+
烯炔的氧化首先发生在双键上。3
还原反应
催化氢化—林德拉催化剂(得到顺式烯烃)
R
C
CH
H 2catalyst
R
CH
CH 2
H 2
R
CH 2
CH
3
烯烃和烷烃的混合物
需降低催化剂活性
C 6H 5C CC 6H 5
H 2
Pd-CaCO 3/quioline C C
C 6H 5H
C 6H 5
H
(Lindlar's catalyst)
用喹啉或醋酸铅部分“毒化”而降低了活性
得到顺式烯烃
液氨中的Na 或Li 还原(得到反式烯烃)
CH 3CH 2CH 2C
CCH 2CH 2CH 3
Na or Li liq. NH 3
C
C CH 2CH 2CH 3H
H
CH 3CH 2CH 2
97%
CH 3CH 2C CCH 2CH 2CH 3
Na NH 3(l )
C C Et
H
H
Pr -i 98%反应体系不能有水,因为钠与水会发生反应。4
亲核加成反应—与醇反应
CH
CH CH 3OH
+KOH 加热,加压
CH 2
CH O
CH 3
甲基乙烯基醚(非常有用的聚合单体)
反应历程如下:
CH 3OH KOH
++H 2O CH 3O
K +-CH CH OCH 3
-+
CH
CH
OCH 3
-
CH 3O H
CH
CH
OCH 3-
+CH CH
OCH 3
H 5炔化物的生产成—末端炔烃的性质
三键碳上的氢原子具有微弱酸性(pK a =25),可被金属取代,生成炔化物。
生成炔银、炔铜的反应很灵敏,现象明显,可用来鉴定乙炔和端基炔烃。干燥的炔银或炔铜受热或震动时易发生爆炸生成金属和碳。
Ag-C≡C-Ag
2Ag +
2C +364KJ/mol
所以,实验完毕,应立即加盐酸将炔化物分解,以免发生危险。
Ag-C≡C-Ag +2HCl
H-C≡C-H
+2AgCl
乙炔和RC≡C-H 在液态氨中与氨基钠作用生成炔化钠。
炔化钠是很有用的有机合成中间体,可用来合成炔烃的同系物。例如:
CH 3CH 2C≡CNa +CH 3CH 2CH 2Br
CH 3CH 2C≡CCH 2CH 2CH 3+NaBr
R-X=1°RX
CH 3CH 2C
CH NaNH 2
+NH 3(l )
CH 3CH 2C
C -Na
CH 3CH 2C
C -
Na H
C
H
H
X
+d
+
d
-CH 3CH 2C
C
CH 3
说明:炔氢较活泼的原因是因≡C-H 键是sp-s 键,其电负性Csp >Hs(Csp=3.29,Hs=2.2),因而显极性,具有微弱的酸性。四、乙炔(自学)
要求:掌握乙却的制法,重要性质[氧化、加成、聚合(特别是二聚),及主要用途。五、炔烃的制备1
邻二卤代烷脱卤化氢
H-C C-H ≡
2AgNO 3 + 2NH 4OH
2Cu 2Cl 2+ 2NH 4OH
Ag-C C-Ag ≡Cu-C C-Cu ≡
2NH 4NO 3 + 2H 2O 2NH 4Cl + 2H 2O
R-C C-H ≡
R-C C-Ag ≡
R-C C-Cu ≡
Cu(NH 3)2+
Ag(NH 3)2
+
乙炔银(白色)
乙炔亚铜(棕红色)
炔铜(棕红 )
炔银(白 )
2H-C C-H ≡2NaNH 2H-C C-Na ≡NH 3R-C C-Na ≡
R-C C-H ≡
NaNH 2
NH 3
NH 3(L)
液态氨
CH 3CH 2CH
CH 2Br
Br
KOH/C 2H 5OH CH 3CH 2CH CH 2
CH 3CH 2CH CH 2
KOH/C 2H 5OH
CH 3C
CCH 3
NaNH 2
CH 3CH 3C
CH
使叁键移向链中
使叁键移向末端
2
由炔化外物制备
第二节二烯烃
分子中含有两个碳碳双键的烃类化合物称为二烯烃。
一、二烯烃的分类和命名1
分类(根据两个双键的相对位置可把二烯烃分为三类)
累积二烯烃
-C=C=C-二烯烃
共轭二烯烃-C=CH-CH=CH-孤立二烯烃
-C=CH(CH 2)n CH=C-n ≥1
孤立二烯烃的性质和单烯烃相似,累积二烯烃的数量少且实际应用的也不多。共轭二烯烃有不同于共轭二烯烃的一些特性,在理论和实际应用上都很重要。下面我们主要讨论共轭二烯烃。2
命名
(1)和烯烃的命名一样称为某几烯
CH 3CH=CH-C=CH 2
CH 3
甲基 戊二烯
2--1,3-(2)多烯烃的顺反异构的标出(每一个双键的构型均应标出)。例如:
C C
CH 3
H 3C H
C C CH 3CH 2CH 3
H
(Z),(Z)-2,5-= -2,4-甲基庚二烯
实例:
≡
R-C C-Na ≡
R-C C-R'R' X
Na X
( Li )
Li X
CH 2
C CH 3
CH
CH 2
1,3-cyclopentadiene
2-甲基-1,3-丁二烯CH
CH
CH CH 2
CH 1,3-环戊二烯2-methyl -1,3-butadiene
CH 2
CH CH CH CH
CH 2
1,3,5-己三烯1,3,5-hexatriene
(2Z, 4Z )-2,4-己二烯(2Z,4Z)-2,4-hexadiene
C C
CH 3
H
C CH 3
H
H
1
2
3
4
5
6
s -顺-1,3-丁二烯
s -(Z)-1,3-丁二烯
s -反-1,3-丁二烯s -(E)-1,3-丁二烯
二、二烯烃结构
1.丙二烯烃(累积二烯烃)结构
H
C C
C
sp2
sp sp2
H H H
C H H
C
C H
H
2.共轭二烯烃结构(以1,3-丁二烯为例)
丁二烯分子中碳原子都以杂化轨道相互重叠或与氢的轨道重叠,形成三个C-Cσ键和6个C-H σ键,所有的原子都在同一平面上,键角都接近于120o。此外,每个碳原子上未参与杂化的轨道均垂直于上述平面,四个轨道的对称轴互相平行侧面重叠,形成了包含四个碳原子的四电子共轭体系。
丁二烯分子中的单、双键已经没有了他们特有的特征,而是介于单、双键之间的一种状态,其原因是分子中双键离域作用的影响。
三、共轭二烯烃的反应
共轭二烯烃具有烯烃的通性,但由于是共轭体系,故又具有共轭二烯烃的特有性质。
1.1,4-加成反应
共轭二烯烃进行加成时,既可1,2加成,也可1,4加成,
1,2-加成和1,4-加成是同时发升的,哪一反应占优,决定于反应的温度,反应物的结构,产物的稳定性和溶剂的极性。
极性溶剂,较高温度有利于1,4-加成;非极性溶剂较低温度,有利于1,2-加成。
CH2=CH-CH=CH2
Br2CHCl3
-15℃
CH2-CH-CH=CH2CH2-CH=CH-CH2
Br Br
Br Br
37%63%
54%46%
Br2
-15℃
正己烷
CH2=CH-CH=CH2
CH2-CH-CH=CH2CH2-CH=CH-CH2
H Br
H Br
醚
醚
-80
40
℃
℃
80%
20%
20%
80%
为什么即有1,2-加成,又有1,4-加成:
这是由反应历程决定的(其加成反应为亲电加成历程)
CH2CH CH CH2
δ+δ+
δ-δ-
+H+CH2CH CH CH2
+
CH2CH CH CH2
+
δ+δ+
δ-
CH2CH CH CH2
+
p
π
δ+δ+
δ-
CH2CH CH CH2+Cl-
①
②
1,4-加成
1,2-加成
①
②CH2CH CH CH2
Cl
CH2CH CH CH2
Cl
所以Br-既可加到C2上,也可加到C4上。加到C2得1,2-加成产物,加到C4上得1,4-加成产物。反应条件不同,产率不同的原因:
1°速度控制与平衡控制
1,2-加成反应的活化能低,为速度控制(动力学控制)产物,故低温主要为1,2-加成。1,4-加成反应的活化能较高,但逆反应的活化能更高,一但生成,不易逆转,故在高温时为平衡控制(热力学控制)的产物,主要生成1,4-加成产物。见位能曲线图。
在有机反应中,一种反应物可以向多种产物方向转变时,在反应未达到平衡前,利用反应快速的特点来控制产物组成比例的即为速度控制。速度控制往往是通过缩短反应时间或降低反应温度来达到目的。利用平衡到达来控制产物组成比例的反应即平衡控制,平衡控制一般是通过延长反应时间或提高反应温度使反应达到平衡点的。
CH 2 CH CH CH 2
H
E 1'
E 2
E 2'
1, 2-加成
1,4-加成
E 1
1,2-加成产物1,4-加成产物
1,2-加成反应进程
1,4-
加成反应进程
E
1,2-加成和 1,4-
加成反应进程中的位能曲线图
Br
2°产物结构的稳定性:
1,4-加成产物的稳定性大于1,2-加成产物。
CH
2
C CH=CH 2
H
Br
H H
C H
H
CH=CH CH H
Br
1,2-加成产物
一个C-Hσ
键与π 共轭1,4-加成产物
五个C-Hσ键与π 共轭
2.狄尔斯(Diels )-阿德尔(Alder )反应(双烯合成反应)
共轭二烯烃和某些具有碳碳双键、三键的不饱和化合物进行1,
4-加成,生成环状化合物的反应称为双烯合成反应。例如:
200℃高压
+
要明确几点:
A.Diels-Alder 反应是合成六元环状化合物的好方法(Nobel prize,1950)
+
B.Diels-Alder 反应是可逆反应(检验或提纯共轭二烯烃)
+
25℃
C.Diels-Alder 反应中,双烯体上具有供电子基团,亲双烯体上有吸电子基团时,有利于反应。
OCH 2CH 3
O
+
160℃, 15h
C
O
OCH 2CH
3
H
O +
100℃, 3h
H
O
供电子基团:烷基,烷氧基等;
吸电子基团:—CHO,—COOR,—COR,—CN,—NO2等。D.Diels-Alder 反应具有很强的区域选择性。
OCH 3
O
+
O OCH 3+
OCH 3
CHO 100%
0%
70%
30%
H 3C
O
+
+
H 3C
CHO
H 3C
CHO
以邻位和对位产物为主。
E.Diels-Alder 反应产物具有立体专一性的特点。
+
COOCH 3COOCH 3H
H
H
H
C O
OCH 3C O OCH 3
150~160℃, 20h
cis-
cis-trans-
trans-200~205℃
, 3.5h
H
C C
O
OCH 3
H
O
CH 3O
COOCH 3H
H COOCH 3
+
CH 3CH 3H H NC
CN
NC
CN
+
CN CN CN CN
H 3C
H 3C H
H
trans-trans-(两甲基处于顺式)
(两甲基处于反式)H CH 3
CH 3
H NC
CN
NC
CN
+
trans-cis-CN
CN CN CN
H
H 3C
CH 3
H
F.Diels-Alder 反应遵循“内式(endo-vs exo-)规则”。
H H H H
COOCH 3COOCH 3
外式加成(exo -addition )
COOCH 3COOCH 3H H
H
H
H H
CH 3OOC CH 3
OOC
内式加成
(endo -addition )
H
H
COOCH 3
COOCH 3
H
H
G.双烯体自身可发生Diels-Alder 反应。
COOCH 3
180℃, 2h
COOCH 3
H
COOCH 3
H
+
65%
35%
+
25℃
+
3.聚合反应(用于高分子工业中)
CH 2
CH CH
CH 2
Ziegle-Natta's catalyst
H
H
CH 2H 2C 顺丁橡胶
n
CH 2
CH
CH
CH 2
CH
CH 2
+
过氧化物
丁苯橡胶
CH 2
CH CH
CH 2
CH
CH 2
n
有机化学习题(炔烃和二烯烃) 班级 学号 姓名 一、命名下列化合物或写出其结构 1、 2、 3、 4、反-4-庚烯-1-炔 5、(2E,4E)-3-叔丁基-2,4-己二烯 6、(Z,E, Z)- 2,4,6-辛三烯 7、丁苯橡胶 8、PVC 9、异戊二烯 二、完成下列反应 1、 CH 3CH=CH 2C=CHCH 2CH 3C C
C C CH 3CH 2CH 2CH 3+H 2Pd/CaCO 3 喹 啉2、 C C CH 3CH 2CH 2CH 3Na 液 氨 3、 CH 3CH=CHCH 2CH C +H Pd/CaCO 3喹 啉4、 CH 3CH=CHCH 2CH C +1mol ( )Br 25、 6、 CH 3 CH 3C C 7、 8、 9、 10、 11、 CH 2=C(CH 3)CH=CH 2+HOOC C C 加 热 12、 + CH 2=C(CH 3加 热 13、 CH 3CH=CH CH C +H 2H +2+(CH 3)2C=CHCH 2CH=CH 2+Br 2( )1mol CH 3CH=CHCH=CH 2+( ) Br 21mol CH 3CH 2C CH Ag(NH 3)2NO 3+CH 3CH(CH 3)C CH +NaNH 2
14、 15、 CH 2=CHCOOCH 3+ 加 热 16、 CH 3C ≡CCH 3 17、C=C 3C C=C CH 3CH 2CH 2CH 3H H H H H 3C CH 3CH 3 三、完成1,3-丁二烯与下列各化合物反应的方程式 1、1mol H 2 (Ni 作催化剂) 2、2mol H 2 (Ni 作催化剂) 3、1mol HBr 4、2mol HBr 5、1mol Br 2 6、2mol Br 2 C 6H 5C CH +H 2O HgSO 4 H 2SO 4 CH 3C CH +HCN
第四章炔烃和二烯烃 1、写出C6H10的所有炔烃异构体的构造式,并用系统命名法命名之。 答案: 2、命名下列化合物。 答案: (1)2,2,6,6-四甲基-3-庚炔(2)4-甲基-2-庚烯-5-炔(3)1-己烯-3,5-二炔(4)5-异丙基-5-壬烯-1-炔(5)(E),(Z)-3-叔丁基-2,4-己二烯 3.写出下列化合物的构造式和键线式,并用系统命名法命名。
⑴烯丙基乙炔⑵丙烯基乙炔⑶二叔丁基乙炔⑷异丙基仲丁基乙炔 答案: (1)CH2=CHCH2C≡CH 1-戊炔-4-炔 (2)CH3CH=CH-C≡CH 3-戊 烯-1-炔 (3)(CH3)3CC≡CC(CH3)3 2,2,5,5-四甲基-3-已炔 (4)2,5-二甲基-3-庚炔 4、写出下列化合物的构造式,并用系统命名法命名。 (1)5-ethyl-2-methyl-3-heptyne (2)(Z)-3,4-dimethyl-4-hexen-1-yne (3)(2E,4E)-hexadiene (4)2,2,5-trimethyl-3-hexyne 答案: (1)(CH3)2CH C CCH(C2H5)CH2CH3 2-甲基-5-乙基-3-庚炔 (2) CH3 C C C CH CH3 C2H5 (Z)-3,4-二甲基-3-己烯-1-炔 (3) H C C C H CH3 H CH3 C (2E,4E)-2,4-己二烯 (4) C CH3 CH3 CH3 C C CH CH3 CH32,2,5-三甲基-3-己炔 5.下列化合物是否存在顺反异构体,如存在则写出其构型式 ⑴CH3CH=CHC2H5(2)CH3CH=C=CHCH3(3) CH3C CCH3 ⑷CH C-CH=CH-CH3 答案: (1) (2)无顺反异构体(3)无顺反异构体
第七章 炔烃和二烯烃 一.选择题 1. 比较CH 4(I),NH 3(II),CH 3C ≡CH(III),H 2O(IV)四种化合物中氢原子的酸性大小: (A) I>II>III>IV (B) III>IV>II>I (C) I>III>IV>II (D) IV>III>II>I 2. 2-戊炔 顺-2-戊烯应采用下列哪一种反应条件 H 2,Pd/BaSO 4,喹啉 (B) Na,液氨 (C) B 2H 6 (D) H 2,Ni 3. 已知RC ≡CH + NaNH 2 ──> RC ≡CNa + NH 3,炔钠加水又能恢复成炔烃, RC ≡CNa + H 2O ──> RC ≡CH + NaOH,据此可推测酸性大小为: (A) NH 3>RC ≡CH>H 2O (B) H 2O>RC ≡CH>NH 3 (C) H 2O>NH 3>RC ≡CH (D) HN 3>H 2O>RC ≡CH 4. 制造维尼纶的原料醋酸乙烯酯由下式合成, 这种加成反应属于: (A) 亲电加成反应 (B) 亲核加成反应 (C) 自由基加成 (D) 协同 CH 23 O CH 3O + CH CH
加成 5. 区别丙烯、丙炔、环丙烷时鉴别丙炔最好的办法是采用: (A) Br 2,CCl 4 (B) KMnO 4,H + (C) 臭氧化 (D) Cu 2Cl 2,NH 3溶液 6. Ag(NH 3)2NO 3处理下列各化合物,生成白色沉淀的是: 7. 产物应是: 8. Lindlar 试剂的组成是什么 A B C D CrO 3P d -BaSO 4Hg(OAc)2/THF HCl+ZnCl 2 / / N N 9. 反应 C C 24HgSO 4 CH C O 的名称 (A ) 克莱-门森反应 (B )库格尔反应(C ) 科佩奇尼反应 (D ) 库切罗夫反应 (B)CH 3CH 2C CH (D) (C)CH 3C CCH 3 (A) +H 2Hg + ,H + 2(B) (CH 3)2CH CH 2CH 2CHO (A) (CH 3)2CHCH 2COCH 3(CH 3)2CHCH 2C CH (C) (CH 3)2CHCH 2C(OH) CH 2 (D) CH 3)2CHCH 2CH CHOH
第6章 炔烃和二烯烃问题参考答案 1.炔烃没有顺反异构体。因为三键碳是sp 杂化,为直线形构型,故无顺反异构现象。 2. HC CCH 2CH 2CH 2CH 3 H 3CC CCH 2CH 2CH 3 H 3CH 2CC CCH 2CH 2CH 3 HC CCHCH 2CH 3HC CCH 2CHCH 3 HC CCCH 3H 3CC CCHCH 3CH 3 CH 3CH 3 CH 3 CH 3 1-己炔2-己炔3-己炔3-甲基-1-戊炔 4-甲基-1-戊炔 3,3-二甲基-1-丁炔 4-甲基-2-戊炔 3. 化) 4. 表面上看来,碳碳三键更具不饱和性,那末怎样来理解这些事实呢? 解释烯烃比炔烃更容易亲电加成的原因,有以下三点: (1).由于三键和双键的碳原子的杂化状态不同 三键碳原子的杂化状态为sp ,较双键(sp 2)的s 成份为多,由于s 成份的增加,使sp 杂化轨道比sp 2杂化轨道的直径短,因而造成碳碳三键较双键为短。所以在炔烃中形成π键的两个p 轨道的重叠程度较烯烃为大,使炔烃中的π键更强些。而且由于不同杂化状态的电负 性为sp >sp 2>sp 3,炔烃分子中的sp 碳原子和外层电子(π电子)结合得更加紧密,使其不易给出电子,因而使快烃不易发生亲电加成反应。 (2).由于电子的屏蔽效应不同 炔烃和烯烃分子中,都存在着σ电子和π电子,可以近似地看成π电子是在σ电子的外围。σ电子受原子核的吸引而π电子除受原子核的吸引外还受内层电子的排斥作用,因而就减弱了受核的束缚力,即为电子的屏蔽效应。乙烯分子中有五个σ键,即有五对σ电子,而乙炔分子中只有三个σ键即只有三对σ电子,因而乙烯分子中的电子的屏蔽效应大于乙炔分子,所以乙烯分子中的π电子受原子核的吸引力小,易给出电子,也就容易发生亲电加成反心,而乙炔则较难。 (3).炔烃比烯烃的加成较难的原因,还可以从形成的中间体碳正离子的稳定性不同来
第六章炔烃和二烯烃 基本要求: 1、了解炔烃的结构与物理性质,掌握其命名方法; 2、掌握炔烃的加成、氧化、聚合以及端基炔烃的弱酸性与偶联等反应。 3、了解共轭二烯烃结构、物理性质以及化学性质。掌握共轭加成与简单加成,Diels-Alder 反应等。了解速度控制与平衡控制的概念。 4、掌握炔烃和二烯烃的制备方法。 内容提要: 1、炔烃碳原子的sp杂化形式使炔烃具有线性结构。 2、炔烃与烯烃相似,也有加成、氧化和聚合。但由于sp碳原子的电负性比sp2碳原子的电负性强,因而,尽管三键比双键多一对电子,也不容易给出电子与亲电试剂结合,致使三键的亲电加成反应比双键的加成反应活性比较低,如加氢缓慢,在林德拉催化剂存在和适当条件下可以停留在加一分子氢,且表现为顺式加成;若用金属钠在液氨中还原则得到反式烯烃。炔烃的亲电加成活性低,需要汞盐催化,炔烃加成也遵守马氏规则,有过氧化物效应,高温下与卤素发生α-H的取代和硼氢化—氧化反应等。如果分子中同时存在三键和双键,在它发生亲电加成反应时,首先进行的是双键的加成。炔烃和氢、卤素和卤化氢等进行的加成反应是分两步进行的,先是与一分子试剂反应,生成烯烃的衍生物,然后再与另一分子试剂反应,生成饱和的化合物。 炔烃还可以发生烯烃所不能发生的反应,如:与HCN加成。炔烃氧化只生成酸。末端炔烃有酸性,能生成炔化金属,进而与卤代烃和醛酮反应等。氢氧化钠的醇溶液常使末端炔键向中间位移,而氨基钠使三键移向末端。 3、炔烃可以通过邻二卤代烃脱或偕二卤代烃脱卤化氢制得,通常则有乙炔出发合成高级炔烃。 4、共轭二烯烃加成时,既发生正常加成(简单加成),又有共轭加成,这是共轭效应引起的。简单加成与共加成产物的比例随反应条件而变。一般地,反应初期简单加成产物较多,温度高、时间长将使稳定性较高的共轭加成产物的比例增加,前者称为速度控制产物,后者称为平衡控制产物。共轭二烯烃(双烯试剂)和亲双烯试剂发生Diels-Alder(狄尔斯-阿尔德)反应是制备环己烯衍生物的重要方法。亲双烯试剂上有拉电基团时反应活性大大提高。但要求双烯体系必须是S-顺,或者至少能够转化成为S-顺,否则,若由于空间位阻或结构因素是不能够成为S-顺,则不能发生Diels-Alder反应。
第四章 炔烃和二烯烃 1.写出C 6H 10的所有炔烃异构体的构造式,并用系统命名法命名之 。 解: (1)(2)(6) (5)(4) (3)CH 3CH 2CH 2CH 2C CH CH 3CH 2CH 2C CCH 3CH 3CH 2C CCH 2CH 3 CH 3CH 2CHC CH CH 3 CH 3CHCH 2C CH CH 3 CH 3CHC CCH 3CH 3 CH 3CC CH CH 3 CH 3 (7) 1-己炔 2-己炔 3-己炔 3-甲基-1-戊炔4-甲基-1-戊炔4-甲基-2-戊炔 3,3-二甲基-1-丁炔 2.命名下列化合物。 (1)(2)(5) (4) (3)(CH 3)3CC CCH 2C(CH 3)3CH 3CH CHCH(CH 3)C CCH 3HC CC CCH CH 2 解: (1)2,2,6,6-四甲基-3-庚炔 (2)4-甲基-2-庚烯-5-炔 (3)1-己烯-3,5-二炔 (4)(Z )-5-异丙基-5-壬烯-1-炔 (5)(2E,4Z)-3-叔丁基-2,4-己二烯 3.写出下列化合物的构造式和键线式,并用系统命名法命名。 ⑴ 烯丙基乙炔 ⑵ 丙烯基乙炔 ⑶ 二叔丁基乙炔 ⑷ 异丙基仲丁基乙炔 解: (1)(2)(4)(3)(CH 3)3CC CC(CH 3)3 1-戊烯-4-炔 2,2,5,5-四甲基-3-己炔 CH CCH 2CH CH 2CH CCH CHCH 3 (CH 3)2CHC CCHCH 2CH 3 3 3-戊烯-1-炔 2,5-二甲基-3-庚炔
4.写出下列化合物的构造式,并用系统命名法命名。 (1)5-ethyl-2-methyl-3-heptyne (2)(Z)-3,4-dimethyl-4-hexen-1-yne (3)(2E,4E)-hexadiene (4)2,2,5-trimethyl-3-hexyne 解: 2-甲基-5-乙基-3-庚炔 (Z )-3,4-二甲基-4-己烯-1-炔 (2E,4E )-2,4-己二烯 2,2,5-三甲基-3-己炔 5.下列化合物是否存在顺反异构体,如存在则写出其构型式。 (1)(2)(4)(3)CH 3C CCH 3 CH 3CH CHC 2H 5CH 3CH C CHCH 3CH C CH CHCH 3 解: (1) (2)无顺反异构体 (3 )无顺反异构体 (4) 6.利用共价键的键能计算如下反应在2500C 气态下的反应热。 (2) (1) (3)CH CH +Br 2CHBr CHBr H=?2CH CH CH 2 CH C CH CH 3C CH HBr CH 3 C CH 2+ 解: H φ=E C C Br Br C H +-2E +E (C C C H +2E E +Br Br 2E )=E C C Br Br +-E (C C +E Br Br 2E ) =835.1+188.3-610-2(284.5)=-155.6KJ/mol (1) (2) (4) (3)
第三章 炔烃和二烯烃(习题和答案) 一、给出下列化合物的名称 1. H C CH 3H C CH 3C C H H 2. CH CH CH 2CH 2C (2Z ,4E)-2,4-己二烯 1-戊烯-4-炔 3. CH CH 2CH 3C 2H 5CH 3C C C 4. (CH 3)2CH C(CH 3)3C C 4-乙基-4-庚烯-2-炔 2,2,5-三甲基-3-己炔 5. CH CH CH CH 2CH C 6. CH CH CH CH 3C C C 1,3-己二烯-5-炔 5-庚烯-1,3-二炔 7. (CH 3)2CH H C C 2H 5 C H C C 8. CH 2CH 2CH=CH 2CH 3CH 2CH 3 CH C C (E)-2-甲基-3-辛烯-5-炔 3-乙基-1-辛烯-6-炔 9. H H C C 2H 5 C CH 3C C H H 10. CH H C CH CH 3 C CH 3CH 3C (2Z ,4Z)-2,4-庚二烯 3,5-二甲基-4-己烯-1-炔 二、写出下列化合物的结构 1. 丙烯基乙炔 2. 环戊基乙炔 CH CH CH CH 3C CH C 3.(E)-2-庚烯-4-炔 4.3-乙基-4-己烯-1-炔 CH 2CH 3H C CH 3C H C C CH CH 2CH 3CH CH 3CH C 5.(Z)-3-甲基-4-乙基-1,3-己二烯-1-炔 6.1-己烯-5-炔 CH CH 2CH 3 CH CH 2C CH 3C C CH CH CH 2CH 2CH 2C 7.(Z ,E)-6-甲基-2,5-辛二烯 8.3-甲基-5-戊烯-1-炔 H H C C 2H 5CH 2 CH 3 C CH 3C C H 9.甲基异丙基乙炔 10.3-戊烯-1-炔 CH (CH 3)2CH 3C C CHCH 3CH CH C 三、完成下列反应式 1.Cl 2 CH 2CH 2CH CH C Cl CH 2CH 2CH CH C 2. 稀H 2SO 4 CH 3CH 2CH C HgSO 4 O CH 3CH 3CH 2 3. + CH CH CH CH 3O CH=CH 2C C CH O O O CH 3 C C O O
第三章 炔烃和二烯烃习题及解答 一、命名下列化合物 1. 2. 3.CH 2=CHCH 2C CH H C CH 3H C CH 3 C C H H CH 3 CH 3CH 2CH=C C C CH 2CH 3 4.CHCH 3 C C CH 3 CH 3C CH 3 CH 3 5. 6.CH 3CH=CH C C C CH CH 2=CHCH=CH C CH 8.9. 7. (CH 3)2CH H C C 2H 5 C H C C CH 2CH 2CH=CH 2 CH 3 CH 2CH 3 CH C C H H C C 2H 5 C CH 3 C C H H 10. CH H C CH CH 3C CH 3CH 3 C 答案: 1.(Z ,E)-2,4-己二烯; 2. 1-戊烯-4-炔; 3. 4-乙基-4-庚烯-2-炔; 4. 2,2,,5-三甲基-3-己炔; 5.1,3-己二烯-5-炔,6. 5-庚烯-1,3-二炔; 7. (E)-2-甲基-3-辛烯-5-炔; 8. 3-乙基-1-辛烯-6-炔 9. (Z,Z)-2,4-庚二烯; 10. 3,5-二甲基-4-己烯-1-炔 二、写出下列化合物的结构 1. 丙烯基乙炔; 2. 环戊基乙炔; 3.(E)-2-庚烯-4-炔; 4. 3-乙基-4-己烯-1-炔 5.(Z)-3-甲基-4-乙基-1,3-己二烯-1-炔; 6.1-己烯-5-炔; 7.(Z ,E)-6-甲基-2,5-辛二烯; 8.3-甲基-3-戊烯-1-炔;9.甲基异丙基乙炔;10.3-戊烯-1-炔 答案: 1. 2. 3. 4.CH 3CH=CHC CH C CH C=C CH 3H C CCH 2CH 3 H CH 3CH=CHCH C CH CH 2CH 3 5. 6.7. CH 2=CHCH 2CH 2C CH C=C CH 3 CH 2CH 3C CH CH 2=CH C=C CH 2H CH 3 H C=C H CH 2CH 3CH 3 8.9.10.CH 3CH=C C CH CH 3 CH 3C CCHCH 3 CH 3 CH 3CH=CH C CH 三、完成下列反应式 1.CH 2=CHCH 2C 2 ( ) 2.( ) CH 3CH 2C HgSO 4/H 2SO 4 H 2O
7--炔烃和二烯烃 炔烃是含有(triple bond)。二烯烃是含有两个C=C的不饱烃。两 者都比碳原子数目相同的单烯烃少两个氢原子,通式C n H 2n-2 。 §1 炔烃的结构、异构和物理性质一、炔烃的结构 乙炔的分子式是C 2H 4 ,构造式碳原子为sp杂化。 两个sp杂化轨道向碳原子核的两边伸展,它们的对称轴在一条直线上,互成180o。 在乙炔分子中,两个碳原子各以一个sp轨道互相重叠,形成一个C-Cσ键,每个碳原子又各以一个sp轨道分别与一个氢原子的1s轨道重叠形成C-Hσ键。 此外,每个碳原子还有两个互相垂直的未杂化的p轨道(p x ,p y ),它们与 另一碳的两个p轨道两两相互侧面重叠形成两个互相垂直的π键。 两个正交p轨道的总和,其电子云呈环形的面包圈。 故乙炔的叁键是由一个σ键和两个相互垂直的π键组成。两个π键的电子云分布好象是围绕两个碳原子核心的圆柱状的π电子云。
乙炔分子中两个碳原子的sp轨道,有s性质,s轨道中的电子较接近了核。因此被约束得较牢,sp轨道比sp2轨道要小,因此sp杂化的碳所形成的键比sp2杂化的碳要短,它的p电子云有较多的重叠。 现代物理方法证明:乙炔中所有的原子都在一条直线上,键的键长为0.12nm,比C=C键的键长短。就是说乙炔分子中两个碳原子较乙烯的距离短,原子核对于电子的吸引力增强了。键能为835KJ/mol.(第一个π键能 225 835-610=225) (C=C 610KJ/mol, π键能264.4 610-345.6=264.4; C-C 345.6KJ/mol) 二、炔烃的异构和命名 1. 炔烃的异构 炔烃的异构是由于碳架不同或散件位置不同而引起的。在碳链分支的地方不可能有三键,炔烃也没有顺反异构体,因此,炔烃的异构比烯烃简单。 2.炔烃的命名 炔烃的命名法和烯烃相似,只将“烯”字改为“炔”。 如: 若同时含有叁键和双键,这类化合物称为烯炔。它的命名首先选取含双键和叁键最长的碳链为主链。位次的编号通常使双键具有最小的位次。 三、炔烃的物理性质
1.Cl 2 CH 2CH 2CH CH C 2. 稀H 2SO 4 CH 3CH 2CH C HgSO 4 3. +CH CH CH CH 3O CH=CH 2C C CH O O 4.Na CH 2CH 3 NH 3 O s O 4H 2O 2 CH 3C C 液 5.CH CH 3Br 24 CH 3 C C CH 6.H 2 催化剂 Lindlar CH 3CH C C 7. 2CH C 8. Na 2CH 2CH C 9. H 2O CH 稀H 2SO 4 +CH CH 3CH C HgSO 4 10. KMnO 4CH KOH CH 3CH 2C 11.CH 2CH 2CH F +C C Ag(NH 3) 12.CH CH 3CH 2C 13. Na I NH 3 CH 3CH CH 3C 液H 2Pt /Pb 14. H 2O COOH KMnO 4C 2H 5CH 3CH +B 2H C 15.CH 2CH 2CH HBr CH + C (1mol) 16. CH 2C CH 3+CH=CH 2 17.CH C 6H 5+CH CH=CH 2
18. CH 3CH C C 19. O 3C H 2O CH 3CH 2CH 3 C 20. △Cl Na NH 2 CH 3Cl C 1.以乙烯及其它有机试剂为原料合成:CH 3CH O CH 3 CH 2.以苯及C 4以下有机物为原料合成:C 6H 5 H H C C CH 3 3.用甲烷做唯一碳来源合成:CH 3 CH 2CH O C 4.以乙炔、丙烯为原料合成:Br Br CHO , 5.以1,3-丁二烯,丙烯,乙炔等为原料合成: CH 2CH 2CH 2OH , 6.由乙炔和丙烯为原料合成正戊醛(CH 3(CH 2)3CHO ) 7.由乙烯和乙炔为原料合成内消旋体3,4-己二醇。 ; 8.由甲苯和C3以下有机物为原料合成:C 6H 5O(CH 2)3CH 3。
第四章炔烃和二烯烃 一、教学目的及要求 1.了解不饱和烃的化学性质 2.使学生了解共轭二烯烃的结构特征和性质 3.掌握离域键,电子离域及共轭效应等重要概念 二、教学重点与难点 1.使学生了解共轭二烯烃的结构特征和性质 2.掌握离域键,电子离域及共轭效应等重要概念 三、教学方法 启发式 炔烃和二烯烃都是通式为C n H2n-2的不饱和烃,炔烃是分子中含有-C≡C-的不饱和烃,二烯烃是含有两个碳碳双键的不饱和烃,它们是同分异构体,但结构不同,性质各异。 第一节炔烃 一、炔烃的结构 最简单的炔烃是乙炔,现代物理方法证明,乙炔分子是一个线型分子,分子中四个原子排在一条直线上 H C C H 180° 0.106nm0.120nm 1sp杂化轨道
杂化后形成两个sp杂化轨道(含1/2S和1/2P成分),剩下两个未杂化的P轨道。两个sp杂化轨道成180分布,两个未杂化的P轨道互相垂直,且都垂直于sp杂化轨道轴所在的直线。 2三键的形成σ H C H 乙炔的电子云 乙炔分子的模型如下:
二炔烃的命名 1炔烃的系统命名法和烯烃相似,只是将“烯”字改为“炔”字。2 烯炔(同时含有三键和双键的分子)的命名:(1)选择含有三键和双键的最长碳链为主链。 (2)主链的编号遵循链中双、三键位次最低系列原则。 (3)通常使双键具有最小的位次(但两种编号中一种较高时,宜采取较低一种) 例如:CH 2-CH =CH -C≡CH ,应命名为3-戊烯-1-炔(而非2-戊烯-4-炔)。 实例: CH 3 CH CH 3 C CH CH 3 C CH 3 CH 3 C C CH CH 3CH 3 3-甲基-1-丁炔异丙基乙炔 3-methyl-1-butyne iso -propylethyne 2,2,5-三甲基-3-己炔异丙基叔定基己炔 2,2,5-trimethyl-3-hexyne iso -propylbutylethyne CH 3C CCHCH 2CH CH 2 CH 3 CH 2 CHCH CHC CH 4-甲基-1-庚烯-5-炔 4-methyl-1-hepten-5-yne 1,3-己二烯-5-炔1,3-hexadien-5-yne 三 炔烃的化学性质
3 炔烃与二烯烃 3-1 用系统命名法命名下列化合物或根据下列化合物的命名写出相应的结构式。 1. (CH 3)2CHC CC(CH 3)3 2. CH 2CHCH CHC CH 3. CH 3CH CHC CC CH 4.(E )-2-庚烯-4-炔 【主要提示】 炔烃的命名与烯烃类似,命名时首先选取含C ≡C 最长的碳链为主链,编号从离C ≡C 最近的一端开始;式子中既含双键,又含三键的化合物称为烯炔,编号时应离不饱和键最近的一端开始,但如果双键和三键的编号相同时,则优先从双键最近的一端编号。 【参考答案】 1. 2,2,5-三甲基-3-己炔 2. 1,3-己二烯-5-炔 3. 5-庚烯-1,3-二炔 4. H 3C C C H C C CH 2CH 3 【相关题目】 (1) (2) (3) (4) (Z )-1,3-戊二烯 (5) (2Z ,4E )-3-甲基-2,4-庚二烯 3-2. 完成下列反应式. 1. 2. 3. 4. 5. 6. C H 3C H C H 2C C C H C H 3 C H 3C H 3 C H 3C H C H C H 2C C l C H 3C C H 3 H 3C C C H H C C H 3H 3H C H 3C C C H 3 + H 2L in d la r 催化剂 ( )C H 3C C C H 3N a /N H 3(l)( )C H 3C C C H 3+ H 2 O H g 2+/H + ( )+ H C N H C N ( ) C H 3C C C H 3+ H 2O + ( )C H 3C C H + N a N H 2 N H 3(l)( )C H 3C H 2C l ( )
第三章烯烃和炔烃 授课对象:应用化学、制药工程、化学工程与工艺、药学 学时安排:5-6h 一、教学目的与要求: 1、掌握烯烃和炔烃的结构特征和命名;烯烃的顺反异构。 2、掌握烯炔的化学性质的异同点;烯烃的亲电加成反应和氧化反应; 3、熟悉烯炔的系统命名规则; 4、了解立体选择反应和立体专一反应; 5、了解烯炔烃的物理性质;反应过渡态及反应活化能与反应速率的关系; 二、教学重点 1、烯烃的结构特征:π键的形成和特点;顺反异构的构型标记及次序规则; 2、烯烃亲电加成反应和反应机理,马氏规则及理论解释;烯烃的氧化反应; 3、炔氢的活性; 三、教学难点: 1、烯烃亲电加成反应机理; 2、立体选择反应和立体专一反应的区别; 3、反应过渡态及反应活化能与反应速率的关系; 四、教学方法 讲授法。为突出重点,突破难点,拟采用如下教学方法: 1、关于烃的命名法则因中学的基础较好,应精选例题,边讲边练。 2、对于碳碳双键和叁键的形成和特点,应充分利用模型和课件动画,帮助学生树立立体形象。 3、从实验现象或实验数据出发,引导学生理解亲电加成反应机理,运用诱导效应和共轭效应解释马氏规则。 5、用模型对照说明溴与顺、反-2-丁烯加成的立体化学产物;举例说明立体选择反应和立体专一反应的区别。 五、教具 电脑、投影仪、Powerpoint课件、球棒模型,教鞭。 六、教学步骤及时间分配 导言:烷烃分子中各原子均以σ键相连,而烯炔烃分子中分别含有碳碳双键和叁键官能团,均为不饱和烃,双键和叁键均σ键和π键组成。 介绍本章学习的重点要求。 1.1 烯烃 一、结构特征 以乙烯的形成为例,讲解:π键和π电子的概念。 演示:乙烯分子模型,结合键长、键角等参数 强调:双键C——sp2杂化,平面构型;叁键C——sp杂化
第七章炔烃和二烯烃学习要求 1 掌握炔烃的结构和命名。 2 掌握炔烃的的化学性质,比较烯烃和炔烃化学性质的异同。 3 掌握共轭二烯烃的结构特点及其重要性质。 4 掌握共轭体系的分类、共轭效应及其应用。 炔烃和二烯烃都是通式为C n H2n-2的不饱和烃,炔烃是分子中含有-C≡C-的不 饱和烃,二烯烃是含有两个碳碳双键的不饱和烃,它们是同分异构体,但结构不 同,性质各异。 §7.1 炔烃 7.1.1 炔烃的结构 最简单的炔烃是乙炔,我们以乙炔来讨论三键的结构。现代物理方法证明,乙炔 分子是一个线型分子,分之中四个原子排在一条直线上 C C H 0.106nm0.12nm 180°杂化轨道理论认为三键碳原子既满足8电子结构 结构和碳的四价,又形成直线型分子,故三键碳原子 成键时采用了SP杂化方式 . 1 sp杂化轨道 2s 2p 2s 2p sp p 激发杂化 杂化后形成两个sp杂化轨道(含1/2 S和1/2 P成分),剩下两个未杂化的P轨
道。两个sp 杂化轨道成180分布,两个未杂化的P 轨道互相垂直,且都垂直于sp 杂 化轨道轴所在的直线。 180° sp z 两个 的空间分布sp 三键碳原子的轨道分布图 2 三键的形成σ 乙烯分子的成键情况 H 乙炔的电子云 7.1.2 炔烃的命名 1 炔烃的系统命名法和烯烃相似,只是将“烯”字改为“炔”字。 2 烯炔(同时含有三键和双键的分子)的命名: (1)选择含有三键和双键的最长碳链为主链。 (2)主链的编号遵循链中双、三键位次最低系列原则。 (3)通常使双键具有最小的位次。 7.1.3 炔烃的化学性质 1 亲电加成 Br 2 C=C R Br Br R'R C C R Br Br Br Br ≡ R-C C-R' ≡R-C C-R'HX R-CH=C-R' X HX R C C R' X H H (1) R-C ≡C-H 与HX 等加成时,遵循马氏规则。
第6章 炔烃和二烯烃的问题1-7的答案 1.炔烃没有顺反异构体。因为三键碳是sp 杂化,为直线形构型,故无顺反异构现象。 2. HC CCH 2CH 2CH 2CH 3 H 3CC CCH 2CH 2CH 3 H 3CH 2CC CCH 2CH 2CH 3 HC CCHCH 2CH 3HC CCH 2CHCH 3 HC CCCH 3H 3CC CCHCH 3CH 3 CH 3CH 3 CH 3 CH 3 1-己炔2-己炔3-己炔3-甲基-1-戊炔 4-甲基-1-戊炔 3,3-二甲基-1-丁炔 4-甲基-2-戊炔 3. 化) 4. 表面上看来,碳碳三键更具不饱和性,那末怎样来理解这些事实呢? 解释烯烃比炔烃更容易亲电加成的原因,可以包括以下三点: (1).由于三键和双键的碳原子的杂化状态不同 三键碳原子的杂化状态为sp ,较双键(sp 2)的s 成份为多,由于s 成份的增加,使sp 杂化轨道比sp 2杂化轨道的直径短,因而造成碳碳三键较双键为短。所以在炔烃中形成π键的两个p 轨道的重叠程度较烯烃为大,使炔烃中的π键更强些。而且由于不同杂化状态的电负 性为sp >sp 2>sp 3,炔烃分子中的sp 碳原子和外层电子(π电子)结合得更加紧密,使其不易给出电子,因而使快烃不易发生亲电加成反应。 (2).由于电子的屏蔽效应不同 炔烃和烯烃分子中,都存在着σ电子和π电子,可以近似地看成σ电子是在π电子的外围。σ电子受原子核的吸引而π电子除受原子核的吸引外还受内层电子的排斥作用,因而就减弱了受核的束缚力,即为电子的屏蔽效应。乙烯分子中有五个σ键,即有五对σ电子,而乙炔分子中只有三个σ键即只有三对σ电子,因而乙烯分子中的电子的屏蔽效应大于乙炔分子,所以乙烯分子中的π电子受原子核的吸引力小,易给出电子,也就容易发生亲电加成反心,而乙炔则较难。 (3).炔烃比烯烃的加成较难的原因,还可以从形成的中间体碳正离子的稳定性不同来
炔烃和二烯烃
第四章 炔烃和二烯烃 Chapter four Alkynes And Dienes 第一节 炔烃(Alkynes) 一、炔烃的结构 、同分异构和命名: 1. 结构(Structure ): 乙炔的构造式 分子式: C 2H 4 [讨论]:1、键角:角H-C-C=180O 2、键长:三键 < 双键 < 单键 3、键能:EC-H:乙炔 > 乙烯 > 乙烷 LC≡C=1.21? 自由基稳定性: 4、酸性: PKa 25 36.5 42 电负性 SP > SP2 >SP3 5、碳原子正电性:乙炔>乙烯 二、 异构现象 一、位置异构: 二、碳架异构: C C H H H CH 3CH 2>CH 2 CH >CH C C H 3 C H 2 C H C H >C H H >C H 2 H C C C C C 与C C C C C C C 与C C C C C
[注]:无顺反异构现象。 三、炔烃的命名 1、最多不饱和链 2、最长碳链 3、最多双键 4、最小序数 (1)总和最小 (2)有选择时,烯键最小。 四、炔烃的物理性质 一、沸点:C1-C4气体,C4以上为液体。 二、直链烃的沸点:烯<烷<炔 [原因]: (1)偶极矩:炔>烯>烷 (2)分子量:烷>烯>炔 HC C C CH 2 CH 2 CH 3 CH 2 CH 2 CH 3 C CH CH 2 3,4二丙基1,3己二烯5炔 CH CH 2 5炔CH 3 C C C H CH 2 C H CH241 乙烯基庚烯 CH 2 CH CH C CH CH CH CH 2 C
(3)分子形状:烷>炔>烯 综合结果:烯<烷<炔 五、 炔烃的化学性质 一、催化加氢 部分还原: [讨论]: 反应活性: (1)单独加氢 烯>炔 (2)同时存在 炔 >烯 二、亲电加成 1、加卤素 [说明]: 1、实际意义 (1)制备四卤化物 (2)定性鉴定 2、反应活性:烯>炔 CH CH CH CH +Cl 2 FeCl 3催化剂 Cl Cl Cl 2 Cl 2CH CHCl 2
第三章 炔烃和二烯烃(习题) 一、给出下列化合物的名称 1. H C CH 3H C CH 3C C H H 2. CH CH CH 2CH 2C 3. CH CH 2CH 3C 2H 5 CH 3C C C 4. (CH 3)2CH C(CH 3)3C C 5. CH CH CH CH 2CH C 6. CH CH CH CH 3C C C 7. (CH 3)2CH H C C 2H 5 C H C C 8. CH 2CH 2CH=CH 2 CH 3CH 2CH 3 CH C C 9. H H C C 2H 5 C CH 3C C H H 10. CH H C CH CH 3 C CH CH 3C 二、写出下列化合物的结构 1. 丙烯基乙炔 2. 环戊基乙炔 3.(E)-2-庚烯-4-炔 4.3-乙基-4-己烯-1-炔 5.(Z)-3-甲基-4-乙基-1,3-己二烯-1-炔 6.1-己烯-5-炔 7.(Z ,E)-6-甲基-2,5-辛二烯 8.3-甲基-5-戊烯-1-炔 9.甲基异丙基乙炔 10.3-戊烯-1-炔 三、完成下列反应式 1.CH 2CH 2CH CH C 2. 稀H 2SO 4 CH 3CH 2CH C HgSO 4 3.+ CH CH CH CH 3O CH=CH 2C C CH O O 4. Na CH 2CH NH 3 O s O 4H 2O 2 CH 3C C 液 5. CH CH 34 CH 3 C C CH 6. CH 3CH 3 C C 7.2CH C 8. 2CH 2 9. H 2O CH 稀H 2SO 4 +CH CH 3CH C HgSO 4
第5章炔烃和二烯烃
第一节 炔烃的命名 C H 3 C H 2 C C C H C H 2 C H 3 C H 3 5 - 甲 基 - 3 - 庚 炔 炔烃系统命名法和烯烃相似。 编号从最靠近双键或叁键开始,若有选择,应使双键位次最小。 C H 3 C H C H C C H 1 2 3 4 5 3 - 戊 烯 - 1 - 炔 C H 2 C H C H 2 C C H 1 - 戊 烯 - 4 - 炔 烯炔
C C H ππH 乙炔分子中两个π键 C sp sp p p 相互垂直的2个p 轨道 呈线形的2个sp 杂化轨道 以乙炔为例: 第二节 炔烃的结构
第三节炔烃的物理性质 炔烃的物理性质与相应的烯烃、烷烃相似。 CH3CH2CH2CH3 CH3CH2CH CH2 CH3CH2C CH bp: -0.5 -6.5 8.1 mp: -135 -185.4 -125.7 密度: 0.579 0.6255 0.6784 炔烃的沸点、熔点和密度比相应的烷烃、烯烃略高。
第四节 炔烃的化学性质 一、炔氢的反应 二、加成反应 1、催化加氢 2、亲电加成 3、亲核加成 4、硼氢化反应 三、氧化反应 C C H 碳碳π键(电子云 密度大,易发生亲 电反应) 连在电负性较强的原子上的氢
一、炔氢的酸性 pka ~50 ~40 34 25 15.7 1、炔氢的酸性比水弱,比氨强 CH 3CH 2H CH 2=CH H - 第三章 炔烃和二烯烃习题及解答 一、命名下列化合物 1. 2. 3.CH 2=CHCH 2C CH CH 3 CH 3CH 2CH=C C C CH 2CH 3 C=C CH 3 H C=C H CH 3 H H 4.CHCH 3 C C CH 3 CH 3C CH 3 CH 3 5. 6.CH 3CH=CH C C C CH CH 2=CHCH=CH C CH 8.9. 7. (CH 3)2CH H C C 2H 5C H C C CH 2CH 2CH=CH 2 CH 3 CH 2CH 3 CH C C H H C C 2H 5C CH 3 C C H H 10. CH H C CH CH 3C CH 3CH 3 C 答案: 1.(Z ,E)-2,4-己二烯; 2. 1-戊烯-4-炔; 3. 4-乙基-4-庚烯-2-炔; 4. 2,2,,5-三甲基-3-己炔; 《 5.1,3-己二烯-5-炔,6. 5-庚烯-1,3-二炔; 7. (E)-2-甲基-3-辛烯-5-炔; 8. 3-乙基-1-辛烯-6-炔 9. (Z,Z)-2,4-庚二烯; 10. 3,5-二甲基-4-己烯-1-炔 二、写出下列化合物的结构式 1. 丙烯基乙炔;2.3-戊烯-1-炔 3.(E)-2-庚烯-4-炔; 4. 3-乙基-4-己烯-1-炔;5.(Z)-3-甲基-4-乙基-1,3-己二烯-1-炔; 6.甲基异丙基乙炔; 7.(Z ,E)-6-甲基-2,5-辛二烯;8.3-甲基-3-戊烯-1-炔; 答案: 1. 2. 3. 4.CH 3CH=CHC CH C=C CH 3H C CCH 2CH 3 H CH 3CH=CHCH C CH CH 2CH 3 CH 3CH=CH C CH 8.CH 3CH=C C CH CH 3 CH 3C CCHCH 3 CH 3 5. 6.7. C=C CH 3 CH 2CH 3C CH CH 2=CH C=C CH 2H CH 3 H C=C H CH 2CH 3CH 3 三、完成下列反应式 < 第三章烯烃和炔烃 1.试比较σ键和π键的主要特征。 2.写出C5H8的所有同分异构体(不包括立体异构体和环状化合物),并用系统命名法命名。 3.写出C5H10烯烃的构造异构体。 4.在上述练习的烯烃中,哪个有顺反异构体? 5.指出下列烯烃是否有顺反异构体,若有,试写出其两种异构体。 (1)CH3CH2CH=CHCH2CH3(2)(CH3)2CHCH=CHCH3 (3)(CH3CH2)2C=CHCH(CH3)2 6.下面是丁烯的质谱数据: m/z 15 20 26 28 37.5 41 52 56 相对丰度% 2 0.1 8 27 0.1 100 1 39 你认为何种质荷比是其特征离子峰?据此能否确定该烯烃是1-丁烯或2-丁烯? 7.用系统命名法命名下列化合物。 8.写出下列化合物的结构式。 ⑴顺-4-甲基-2-戊烯⑵(Z)-3,4-二甲基-2-己烯 ⑶-氯环己烯⑷环戊二烯 3 2,2 ⑹-己烯-4-炔 ⑸-二甲基-3-己炔 2 9.写出下列反应的主要产物 10.用简便的化学方法区别下列各组化合物。 ⑴己烷、1-己炔、3-己炔 ⑵-戊烯、2-戊烯、环戊烷 1 11.下面是单烯烃经高锰酸钾氧化所得的产物,试根据这些产物写出烯烃的结构。 12.比较下列各对烯烃加硫酸反应的活泼性大小。 ⑵-戊烯和2-甲基-1-丁烯 ⑴丙烯和2-丁烯 1 ⑶-丁烯和2-甲基丙烯⑷丙烯和3,3,3-三氯丙烯 2 13.指出下列化合物有无顺反异构体,若有,则写出它们的异构体,并用顺、反法和Z、E法表示其构型。 ⑶-苯基-3-甲基-2-戊烯 ⑵-甲基-3-溴-2-己烯 2 ⑴-丁烯酸 2 2 14.分子式为C4H6的链状化合物A和B,A能使高锰酸钾水溶液和溴的四氯化碳溶液褪色,也能与硝酸银的氨溶液发生反应,B能使高锰酸钾溶液褪色,但不能与硝酸银的氨溶液发生反应。写出A和B可能的结构式。 15.一个碳氢化合物C5H8,能使高锰酸钾水溶液和溴的四氯化碳溶液褪色,与银氨溶液生成白色沉淀,与HgSO4的稀H2SO4溶液反应生成一个含氧的化合物。写出该化合物所有可能的结构式。 16.具有降血脂作用的花生四烯酸是由20个碳原子构成的直链不饱和脂肪酸,其结构式中有四个双键,分别位于5、8、11、14位上,而且双键均为顺式结构,试写出花生四烯酸的结构。 17.某化合物A的分子式为C15H24,催化加氢可吸收4mol的氢气,生成烷烃的结构为:(CH3)2CHCH2CH2CH2CH(CH3)CH2CH2CH2CH(CH3)CH2CH3。A经臭氧氧化-还原水解后得到2分子HCHO,1分子CH3COCH3,1分子CH3COCH2CH2CHO和1分子OHCCH2CH2COCHO。试推出化合物A的结构(不考虑构型)。 18.写出1-戊烯和异丁烯加HBr的主要产物,哪一个烯烃的加成速率较快,并给以解释。 19.写出反-3-己烯与溴加成产物的结构式。 20.反-2-丁烯与Br2加成若经碳正离子中间体,将会产生什么样的立体化学结果? 21.异戊烯加溴化氢的产物是否有构型异构体,反应是否有立体选择性,并给以解释。 22.环己烯与Br2加成,得外消旋产物,用反应历程说明此立体化学结果。 23.写出1-丁烯与溴在乙醇溶液中反应的产物及其反应机理。 24.烯烃(1)和(2)用KMnO4氧化,(1)得到一种产物丙酸,而(2)的氧化产物为戊酸和二氧化碳,试写出(1)和(2)的结构式。若(1)和(2)用臭氧氧化,再用锌水处理将得到什么产物? 25.写出2-甲基-1-丁烯与下列试剂反应的主要产物: (1) Br2/CCl4(2) KMnO4/5% (3) HBr (4) HBr(过氧化物) (5) 臭氧化、还原水解(6) 浓H2SO4,然后水解(7) HOCl (8) F3CCO2H (9) 硼氢化-氧化(10) Br2+NaCl溶液(11) H2O , H+ (12) ICl 26.试比较下列烯烃与H2SO4加成反应的速度。 (1)CH2=CHCCl (2)(CH3)2=CH2 (3)CH3CH = CH2(4)CH2=CH2 27.预言下列烯烃与氯化氢反应的活泼性次序。炔烃和二烯烃习题及解答
第三章 烯烃和炔烃