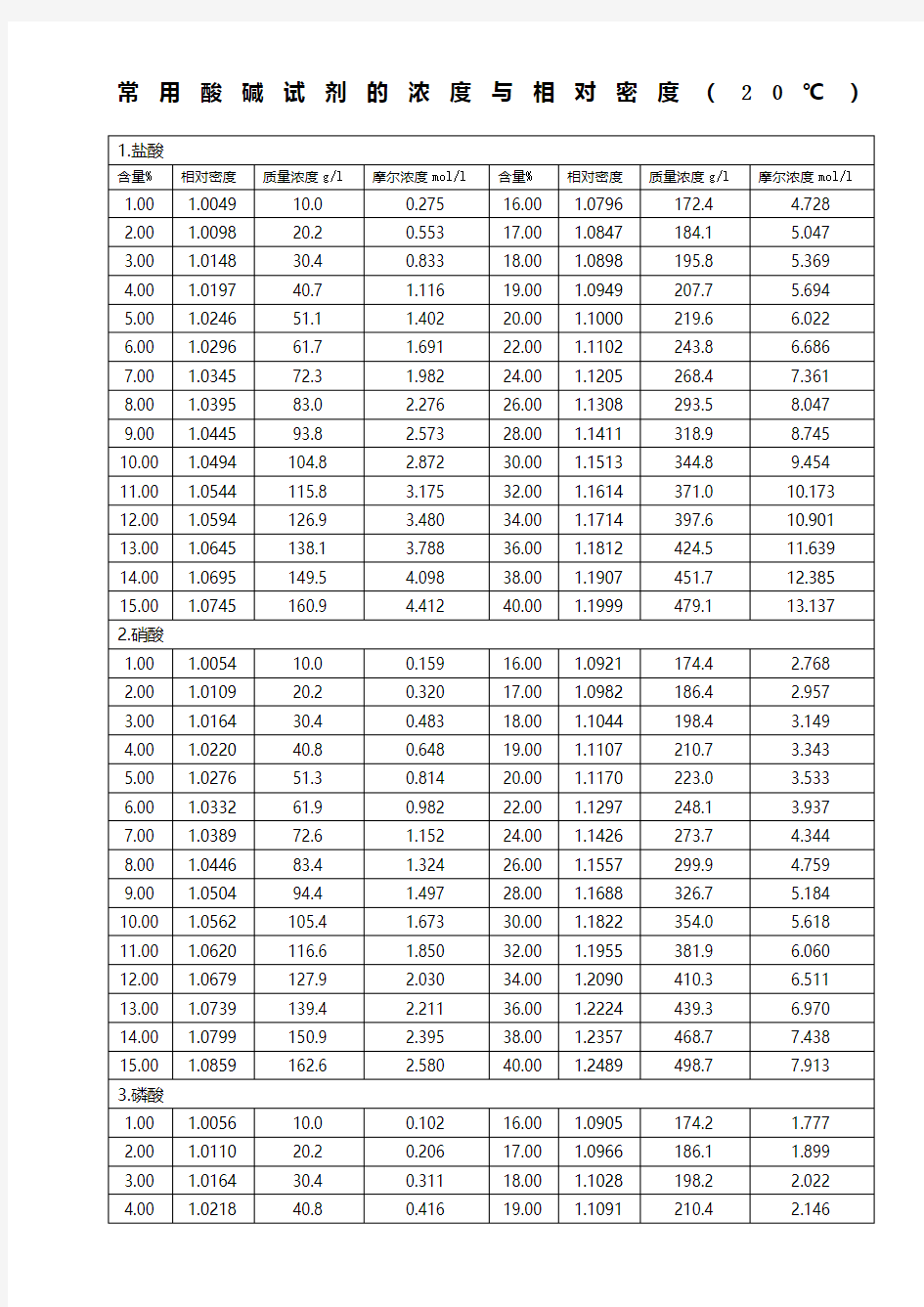
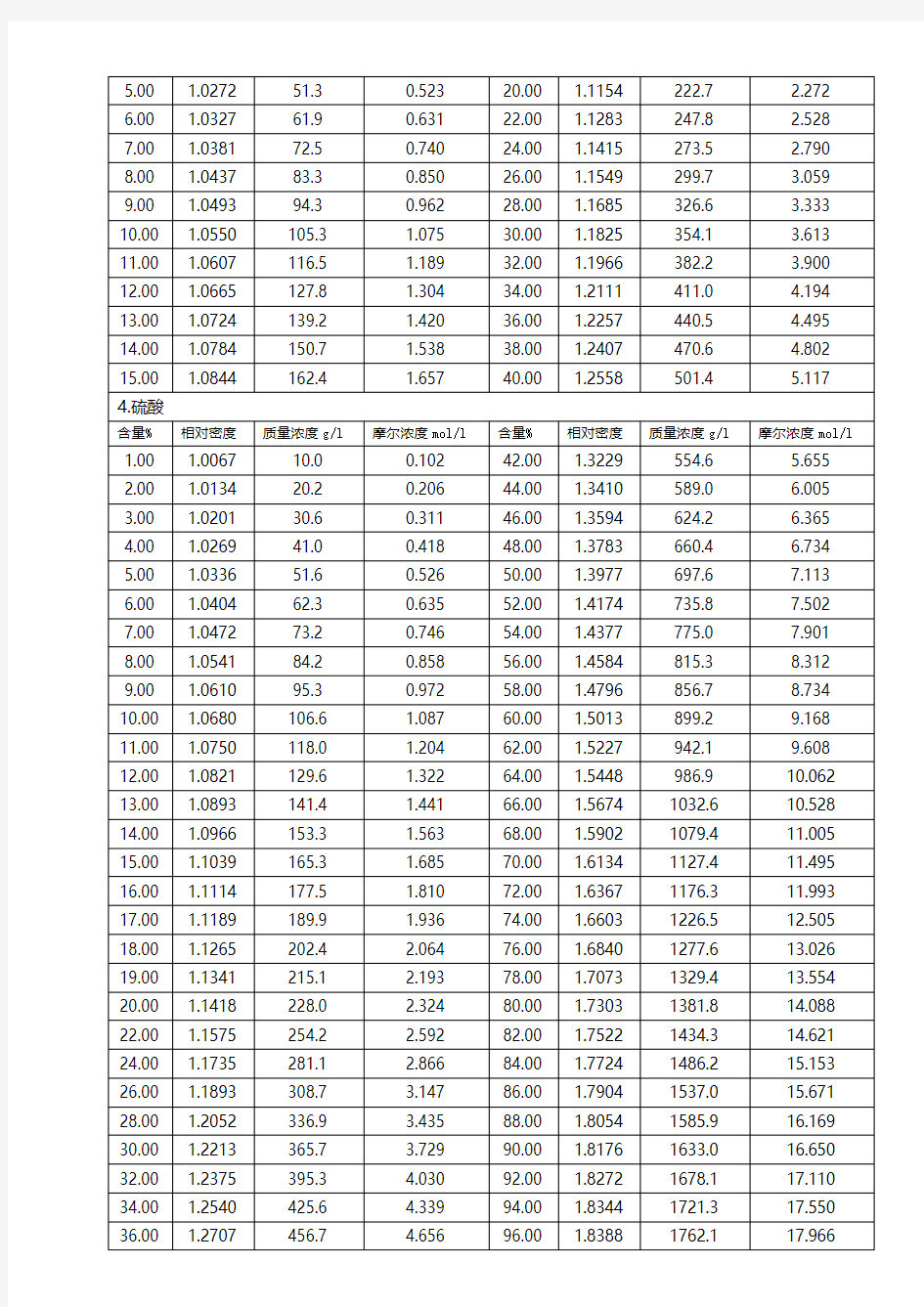
常用酸碱试剂的浓度与相对密度(20℃)
常见的酸和碱 一、选择题:本题共12小题.每小题只有一个正确选项,每小题2分,共24分. 1、盐酸能使紫色石蕊试液变红色,这是因为盐酸中含有大量的() A.氢原子 B.氢分子 C.氢离子 D.氯离子 2、下列物质属于碱类的是() A.纯碱 B.熟石灰 C.生石灰 D.石灰石 3、下列物质敞口放置在空气中较长时间后,质量会增加且变质的是() A.浓硫酸 B.酒精 C.烧碱 D.浓盐酸 4、下列说法正确的是() A.pH=0的溶液既不显酸性,也不显碱性,呈中性 B.碱类物质一定能使酚酞试液变红 C.有盐和水生成的反应不一定是中和反应 D.现要测定某溶液的pH,若事先用水把pH试纸润湿再测,则实际测得值与真实值比较将偏大5.(宿迁市)小李在学习酸碱指示剂与常见酸、碱溶液作用时,归纳成如右图所示的关系。图中A、B、C、D是两圆相交的部分,分别表示指示剂与酸、碱溶液作用时所显示出的颜色,则其中表示不正确 ...的是() A.紫色 B.蓝色 C.红色 D.无色6、聪明的小红同学在烧水是发现壶中有许多水垢[水垢的主要成分是CaC O3和Mg(OH)2],她设计了下列方法除去水垢,你认为可行的是 A、用食醋浸泡后冲洗 B、用洗涤剂溶液浸泡后冲洗 C、用食盐水浸泡后冲洗 D、用热的纯碱溶液浸泡扣冲洗 7.如图所示装置中,夹子处在关闭状态。现将NaOH溶液滴入广口瓶中,待充分反应后,打开夹子,试管中刚停止沸腾的水又重新沸腾了。对上述现象解释正确的是 A、试管内的气压减小,沸点升高 B、试管内的气压增大,沸点升高 C、试管内的气压减小,沸点降低 D、试管内的气压增大,沸点降低 8、氢氧化钠、氢氧化钙都是实验室常用的碱。要鉴别氢氧化钠稀溶液和饱和氢氧化钙溶液,下列方法不能够达到目的的是() A.分别滴加碳酸钠溶液 B.分别通入二氧化碳 C.分别滴加稀盐酸 D.分别长期露置于空气中 9、甲、乙、丙、丁分别是HNO 3、Ba(OH) 2 、Na 2 CO 3 、NaOH四种溶液中的一种。 已知乙和丙可以反应。乙和丁也可以反应,则下列说法正确的是() A.乙一定是HNO 3 B.丁一定是Na 2 CO 3 C.丙不可能是Ba(OH) 2 D.甲不
硫酸浓度与比重对照表
硝酸的百分比浓度、当量浓度及比重对照表 1.0036 1.1609 1.0152 1.1733 1.0543 1.2213 1.0661 1.2335 盐酸浓度与比重对照表 HCL含量( 克 ) 比重20/4℃HCL含量( 克 ) 比重 20/4℃ 100g中含 量 1升中含量100g中含量1升中含量
1 10.03 1.003 2 2 243.8 1.108 2 20.16 1.008 24 268.5 1.119 4 40.72 1.018 26 293. 5 1.129 6 61.6 7 1. 02 8 28 319.0 1.139 8 83.01 1.038 30 344.8 1.149 10 104.7 1.047 32 371.0 1.159 12 126.9 1.057 34 397.5 1.169 14 149.5 1.068 36 424.4 1.179 16 172.4 1.078 38 451.6 1.189 18 195.8 1.088 40 479.2 1.198 20 219.6 1.098 磷酸浓度与比重对照表 H3PO含量( 克 ) 比重 20/4 ℃H3PO含量( 克 ) 比重 20/4 ℃ 100g中含量1升中含量100g中含量1升中含量 1 10.04 1.004 55 758.5 1.379 3 30.49 1.01 4 60 855.6 1.426 5 51.37 1.025 65 958.8 1.475 8 83.36 1.042 70 1068 1.526 10 105.3 1.053 75 1184 1.579 15 162.4 1.082 80 1306 1.633 20 222.7 1.113 85 1436 1.689 25 286.6 1.146 90 1571 1.746 30 354.2 1.180 96 1746 1.819 35 425.6 1.216 98 1807 1.844
1.在做酸和碱中和反应的实验时,有时需借助指示剂颜色的变化判断反应是否发生、完成。向含有酚酞的NaOH溶液的烧杯中,不断滴入稀盐酸。此过程烧杯中溶液颜色的变化是A.由红色变为蓝色 B.由蓝色变为红色 C.由红色变为无色 D.由无色变成红色 在没有除锈剂的情况下,可以用来代替除锈剂的是 A.厕所清洁剂 B.洗发精 C.洗衣液 D.厨房清洁剂 4. 生活离不开化学,应用所学知识选出表中酸性最强的物质() 5. 因“对核糖体结构和功能的研究”而获得2009年诺贝尔化学奖。核糖体是进行蛋白质合成的重要细胞器,蛋白质在酸、碱或酶的作用下能发生水解反应生成氨基酸,氨基酸分子中含有氨基(一NH2,具有碱的性质)和羧基(一COOH,具有酸的性质)。氨基酸分子具有的性质是 A.只能与硫酸反应,不能与氢氧化钠反应 B.只能与氢氧化钠反应,不能与硫酸反应 C.既能与硫酸反应,又能与氢氧化钠反应 D.既不能与硫酸反应,又不能与氢氧化钠反应 6. 物质X可发生下列所示的两个反应,则X可能是() ①X+碱→盐+H2O ②X+金属氧化物→盐+ H2O A CaO B CO2 C NaOH D H2SO4 7. 白蚁能分泌出蚁酸。蚁酸的化学性质与盐酸相似,能腐蚀很多物质。下列最不容易被蚁 酸腐蚀的是 A.镀锌水管 B.铜制塑像 C.大理石栏杆 D.铝合金门窗 8. 从物质的组成角度解释酸具有酸的通性的原因是 A.酸都能电离出H+B.酸都含有酸根 C.酸中都含有氢元素D.酸中都含有氧元素 9. 有一食品包装说明书中注明防腐剂是苯甲酸(C6H5COOH),张华同学查资料得知苯甲 酸的酸性比醋酸强,可用做食品防腐剂。下列对苯甲酸性质的推测中不合理的是 A. 苯甲酸溶液的pH小于7 B. 相同浓度的苯甲酸溶液的pH比醋酸的pH大 C. 苯甲酸溶液能使紫色石蕊试液变红 D. 苯甲酸溶液不能使无色酚酞试液变色 10. 氢氧化钠是一种重要的化工原料,俗称______。氢氧化钠易吸收水分可用作某些气体的____剂,它的水溶液倒入充满CO2气体的矿泉水瓶中,密闭、振荡,可以看到,发生化学反应的方程式为,因此,氢氧化钠应密封保存。 11. 制作馒头时,需加入面碱(主要含碳酸钠),如果面碱放多了,蒸出的馒头会发黄,且口感不好。为除去过多的面碱,做馒头时可加入适量的() A、食醋 B、食盐 C、料酒 D、味精 12. 下列家庭小实验不能成功的是
液碱密度和浓度对照表密度浓度% 1 0.159 1.005 0.602 1.01 1.04 1.02 1.94 1.03 2.84 1.04 3.74 1.05 4.65 1.06 5.56 1.07 6.47 1.08 7.38 1.09 8.28 1.1 9.19 1.11 10.1 1.12 11.01 1.13 11.92 1.14 1 2.83 1.15 13.73 1.16 14.64 1.17 15.54 1.18 16.44 1.19 17.34 1.2 18.25 1.21 19.16 1.22 20.07 1.23 20.98 1.24 21.9 1.25 2 2.82 1.26 23.73 1.27 24.64 1.28 25.56 1.29 26.48 1.3 27.41 1.31 28.33 1.32 29.26
1.33 30.2 1.34 31.14 1.35 3 2.1 1.36 3 3.06 1.37 3 4.03 1.38 3 5.01 1.39 36 1.4 3 6.99 1.41 3 7.99 1.42 3 8.99 1.43 40 1.44 41.03 1.45 42.07 1.46 43.12 1.47 44.17 1.48 45.22 1.49 46.27 1.5 47.33 1.51 48.38 1.52 4 9.44 1.53 50.5
液碱温度密度对照表 温度分别是0℃10℃15℃18℃20℃30℃40℃50℃60℃70℃80℃90℃100℃时在不同比例下的密度分别如下 1% 1.01240 1.01150 1.01065 1.01003 1.00950 1.00690 1.00330 0.99900 0.99410 0.98840 0.98240 0.97600 0.96930 5% 1.05980 1.05710 1.05554 1.05454 1.05380 1.05010 1.04580 1.04120 1.03590 1.03020 1.02430 1.01790 1.01150 10% 1.11710 1.11320 1.11107 1.10977 1.10890 1.10430 1.09950 1.09420 1.08890 1.08310 1.07710 1.07080 1.06430 12% 1.13990 1.13550 1.13327 1.13188 1.13090 1.12610 1.12100 1.11570 1.11010 1.10430 1.09830 1.09200 1.08550 14% 1.16240 1.15780 1.15545 1.15400 1.15300 1.14800 1.14280 1.13730 1.13160 1.12570 1.11950 1.11320 1.10660 16% 1.18490 1.18010 1.17761 1.17610 1.17510 1.16990 1.16450 1.15880 1.15310 1.14710 1.14080 1.13430 1.12770 18% 1.20730 1.20230 1.19973 1.19810 1.19720 1.19180 1.18630 1.18050 1.17460 1.16850 1.16210 1.15560 1.14890 20% 1.22960 1.22440 1.22183 1.22022 1.21910 1.21360 1.20790 1.20200 1.19600 1.18980 1.18330 1.17680 1.17000 22% 1.25190 1.24650 1.24386 1.24220 1.24110 1.23540 1.22960 1.22360 1.21740 1.21110 1.20460 1.19800 1.19120 24% 1.27410 1.26860 1.26582 1.26412 1.26290 1.25710 1.25120 1.24510 1.23880 1.23240 1.22590 1.21920 1.21240 26% 1.29630 1.29060 1.28770 1.28600 1.28480 1.27890 1.27280 1.26660 1.26030
工业盐酸密度(g/cm3),质量分数(100%)与摩尔浓度(mol/L)对应密度质量分数摩尔浓度 1 0.4 0.109589041 1.005 1.4 0.385479452 1.01 2.4 0.664109589 1.015 3.4 0.945479452 1.02 4.4 1.229589041 1.025 5.4 1.516438356 1.03 6.4 1.806027397 1.035 7.5 2.126712329 1.04 8.5 2.421917808 1.045 9.5 2.719863014 1.05 10.5 3.020547945 1.055 11.5 3.323972603 1.06 1 2.5 3.630136986 1.065 13.5 3.939041096 1.07 14.5 4.250684932 1.075 15.5 4.565068493 1.08 16.5 4.882191781 1.085 17.4 5.172328767 1.09 18.4 5.494794521 1.095 19.4 5.82 1.1 20.4 6.147945205 1.105 21.4 6.478630137 1.11 2 2.3 6.781643836 1.115 23.3 7.117671233 1.12 24.2 7.425753425 1.125 25.2 7.767123288 1.13 26.2 8.111232877 1.135 27.2 8.458082192 1.14 28.2 8.807671233 1.145 29.2 9.16 1.15 30.2 9.515068493 1.155 31.2 9.872876712 1.16 3 2.2 10.23342466 1.165 33.2 10.59671233 1.17 34.2 10.96273973 1.175 35.2 11.33150685 1.18 36.2 11.7030137 1.185 37.2 1 2.07726027 1.19 38.3 1 2.48684932 1.195 39.4 1 2.89945205
常用酸碱溶液的浓度及配制 溶液 密度 /(g·cm-3) 质量分数 /% 物质的量浓度 /(mol·L-1) 配制 浓盐酸 1.19 38 12 稀盐酸 1.10 20 6 浓盐酸:水=1:1(体积比) 稀盐酸 1.0 7 2 6 mol·L-1盐酸:水=1:2(体积比) 浓硫酸 1.84 98 18 稀硫酸 1.18 25 3 稀硫酸:水=1:5(体积比) 稀硫酸 1.06 9 1 3 mol·L-1硫酸:水=1:2(体积比) 浓硝酸 1.41 68 16 稀硝酸 1.2 32 6 浓硝酸:水=8:9(体积比) 稀硝酸 1.1 12 2 6 mol·L-1硝酸:水=3:5(体积比) 冰醋酸 1.05 99.8 17.5 稀乙酸 1.04 35 6 冰醋酸:水=27:50(体积比) 稀乙酸 1.02 12 2 6 mol·L-1醋酸:水=1:2(体积比) 浓氨水0.91 28 15 稀氨水0.96 11 6 浓氨水:水=2:3(体积比) 稀氨水 1.0 3.5 2 6 mol·L-1氨水:水=1:2(体积比) 浓氢氧化钠 1.44 41 14.4 稀氢氧化钠 1.1 8 2 氢氧化钠80g/L 石灰水0.15 0.02 饱和石灰水澄清液 几种常见的气体干燥剂 干燥剂可干燥气体 气体在水中的溶解度 气体T 溶解度气体T 溶解度气体T 溶解度
/o C /(mL·100mL-1H2O) /o C /(m L·100mL-1H2O) /o C /(m L·100mL-1H2O) H20 2.14 N20 2.33 O20 4.89 20 0.85 40 1.42 25 3.16 CO 0 3.5 NO 0 7.34 H2S 0 437 20 2.32 60 2.37 40 186 CO20 171.3 NH30 89.9 Cl210 310 20 90.1 100 7.4 30 177 SO20 22.8 常用的气体净化剂 气体所含杂质净化剂气体所含杂质净化剂 O2Cl2NaOH溶液CO CO2石灰水 H2H2S CuSO4溶液N2O2加热铜网 CO2HCl 饱和NaHCO3溶液CO2CO或H2CuO CH4C2H2溴水H2S HCl 饱和NaHS Cl2HCl 饱和食盐水NO NO2水 常见化合物的俗名 类别俗名主要化学成分 硅化合物石英SiO2 水晶SiO2 打火石、燧石SiO2 玻璃SiO2 砂石SiO2 橄榄石Mg SiO4硅锌石Zn SiO4硅胶SiO2 钠化合物食盐NaCl 硼砂Na2B4O7·10H2O 苏打、纯碱Na2CO3 小苏打NaHCO3 海波Na2S2O3·5H2O 红矾钠Na2Cr2O7·2H2O 苛性钠、烧碱、苛性碱、火碱NaOH 芒硝Na2SO4·10H2O 硫化碱Na2S 水玻璃Na2SiO3·nH2O 钾盐、碱砂K2CO3 黄血盐K4Fe(CN)6·2H2O
第五单元常见的酸和碱 第一节生活中的酸和碱 一.溶液酸碱性 1.酸:电离时生成的阳离子全部是氢离子的化合物。H2SO4=2 H++SO42-;HCl= H++Cl-;HNO3= H++NO3-。一般命名为“某酸” 2.碱:电离时生成的阴离子全部是氢氧根离子的化合物。NaOH=Na++OH-;Ca(OH)2=Ca2++2OH-。一般命名为“氢氧化某”。 3.酸性溶液:含大量氢离子(H+)的溶液,有酸味。如食醋、柠檬汁、西红柿等 4.碱性溶液:含大量氢氧根离子(OH-)的溶液,有滑腻感和涩味。如肥皂、洗衣粉等洗涤剂 5.中性溶液:〔H+〕浓度和〔OH-〕浓度相等,溶液既不显酸性也不显碱性。如食盐氯化钠溶液,蔗糖溶液等 【知识解读】 (1)酸:①电离出的阳离子只有H+,电离出的阴离子叫做酸根,氯离子(Cl-)又叫盐酸根;②酸是由H+和酸根阴离子构成的;③酸一般命名为“xx酸”:H2SO4-硫酸;HCl-盐酸;HNO3-硝酸。 (2)碱:①电离出的阴离子只有OH-,叫做氢氧根离子;②碱是由金属阳离子和OH-离子构成的;③碱一般命名为“氢氧化x”。NaOH-氢氧化钠;Ca(OH)2-氢氧化钙;Cu(OH)2-氢氧化铜。 (3)酸(碱)的溶液,一定显酸(碱)性;但是,酸(碱)性的溶液不一定是酸(碱)的溶液。如纯碱碳酸氢钠的溶液显碱性,但是纯碱不是碱而是盐。 二.溶液酸碱性的检验 1.尝味道:有酸味的溶液显酸性;有滑腻感和涩味的溶液显碱性。 注意:只能用于鉴别生活中的可食用的物质, 2.酸碱指示剂 (1)酸碱指示剂:能检验溶液酸碱性的试液。常用的酸碱指示剂有石蕊和酚酞。 (2)紫色石蕊试液遇酸变红,遇碱变蓝,中性不变色仍为紫色; 无色酚酞试液遇酸和中性不变色仍为无色,遇碱变为红色。 注意:酸碱指示剂变色的原因,是因为酸碱指示剂与酸(或碱)电离出的H+(或OH-)发生作用,导致其存在的形式发生了变化,而出现指示剂的颜色变化。所以,①溶液变色时酸碱指示剂变色,而不是酸或碱变色;②不是所有的酸或碱都能使酸碱指示剂变色。只有溶解后能电离出H+(或OH-)的酸或碱的溶液,才能使酸碱指示剂变色;不溶性酸或碱,不能使酸碱指示剂变色。 3.石蕊试纸 蓝色石蕊试纸专用于检测酸性溶液(遇酸变红) 红色石蕊试纸专用于检测碱性溶液(遇碱变蓝)。 注意:①不能将石蕊试纸直接浸入待测液中测量。否则,会污染待测液;②测试前,不能用蒸馏水将石蕊试纸润湿,否则,所测得溶液的酸碱性要偏弱。 三.酸碱度 1.酸碱度:溶液酸碱性的强弱程度 2.表示方法:溶液的酸碱度通常用pH表示(p表示负对数,H表示H+浓度) (1)pH的取值范围:0—14 (2)pH值与溶液酸碱性的关系 ①pH<7的——酸性 pH=7的——中性
第十单元酸和碱 课时1 常见的酸和碱 1、食醋中含有的属于酸。石灰水中含有的、炉具清洁剂中含有的都属于碱。 2、二氧化碳通入紫色石蕊试液后变成色,原因是(写化学方程式)。 3、3、填写下表 一、常见的酸 (一)知识要点 1、几种常见的酸:盐酸、硫酸的物理性质与用途 2、浓硫酸的腐蚀性、浓硫酸的稀释 3、酸的化学性质 (二)配备练习 1、下列溶液,能使无色酚酞试液变红的是() A、石灰水 B、氢氧化钠溶液 C、食醋 D、汽水 2、现有NaOH 溶液、稀硫酸、蒸馏水,若将它们一次鉴别出来,可选用的试剂是() A、无色酚酞试液 B、紫色石蕊试液 C、稀盐酸 D、Na2CO3溶液 3、下列有关盐酸的叙述中错误的是() A、浓盐酸是有刺激性气味的液体 B、浓盐酸具有挥发性,在空气中会形成白烟 C、人的胃液中含有少量盐酸,可帮助消化 D、盐酸是氯化氢气体的水溶液 4、下列用途中盐酸和硫酸都具有的是() A、金属表面除锈 B、生产化肥 C、制火药 D、干燥剂 5、在4个小烧杯里分别盛有等质量的下列物质,在空气中放置一段时间后,烧杯内物质的总质量显著增加且溶质质量分数减小的是() A、浓盐酸 B、浓硫酸 C、石灰水 D、蔗糖溶液
6、将浓硫酸滴在滤纸上,滤纸很快变黑。这说明浓硫酸具有的特性是() A、酸性B、吸水性C、脱水性D、氧化性 7、小明想除去自己白衬衫上的铁锈痕迹,在用清水洗涤前,他从家中选择的最合适的物质是 A.汽油B.食盐水C.白醋D.红醋 8、等质量的锌分别与足量的稀盐酸、稀硫酸充分反应,产生氢气的质量关系是() A、相等 B、与稀盐酸反应的多 C、与稀硫酸反应的多 D、不能确定 9、下列溶液跟铁片充分反应后,所得溶液质量比反应前溶液质量减轻的是() A、稀盐酸 B、稀硫酸 C、FeSO4 溶液 D、CuSO4溶液 10、酒厂用发酵法生产白酒时,需加入适量硫酸来控制酸度,发酵完成后进行蒸馏,即可得到白酒,但不能用盐酸代替硫酸,因为。 (三)链接中考与竞赛 1、(02·北京西城区中考)下列物质中,属于碱的是( ) A、Ca(OH)2 B、Cu2(OH)2CO3 C、C2H5OH D、Na2CO3 2、(03·江苏省预赛)20世纪初,一些化学家提出了酸碱质子理论。这种理论认为,凡能放出质子(H+)的分子或离子都是酸;凡能结合质子的分子或离子都是碱。根据这一理论,下列物质中不属于碱的是 A、HNO3 B、HCO3– C、NH4+ D、SO42- 3、下列物质中可除去二氧化碳中的水蒸气的是() A、浓硫酸 B、稀硫酸 C、浓盐酸 D、石灰水 4、(03·全国复赛)50g镁、锌、铁的混合物与足量的稀硫酸反应得到混合溶液,蒸发后得到218g固体(已 换算成硫酸盐),则反应生成氢气的质量( ) A、2g B、3g C、3.5g D、4.5g 5、(04·四川中考)胃溃疡严重的病人的胃酸(盐酸)过多,可内服含有能跟盐酸起反应的物质成分的胃药,减少胃中盐酸的含量而又不造成胃穿孔。下列物质中,最适宜作为胃药成分的是()A.CuCO3B.Al(OH)3C.NaHCO3D.Ca(OH)2 6、在杠杆的两端分别挂着质量和体积都相同的铁球和铝球,这时杠杆平衡。将 两球分别浸泡在质量相同、溶质的质量分数也相同的稀硫酸中(如右图),直至 两个烧杯中均没有气泡产生为止。两球的外形变化不大且无孔洞出现。下列推测 中,正确的是() A、铁球一定是空心的 B、拿掉烧杯后,杠杆仍然平衡(金属球上附着的液体忽略不计,下同)
密度溶质的质量分数氢氧化钠溶液的浓度 密度(20℃ )g/cm3 NaOH的质量分数/(g/100g溶液) 物质的量浓度(mol/L) 1 0.159 0.0393 1.0050.6020.151 1.01 1.0450.264 1.015 1.490.378 1.02 1.940.494 1.025 2.390.611 1.03 2.840.731 1.035 3.290.851 1.04 3.7450.971 1.045 4.2 1.097 1.05 4.655 1.222 1.055 5.11 1.347 1.06 5.56 1.474 1.065 6.02 1.602 1.07 6.47 1.731 1.075 6.93 1.862 1.087.38 1.992 1.0857.83 2.123 1.098.28 2.257 1.0958.74 2.391 1.19.19 2.527 1.1059.645 2.664 1.1110.1 2.802 1.11510.555 2.942 1.1211.01 3.082 1.12511.46 3.224 1.1311.92 3.367 1.1351 2.37 3.51 1.141 2.83 3.655 1.14513.28 3.801 1.1513.73 3.947 1.15514.18 4.095 1.1614.64 4.244 1.16515.09 4.395 1.1715.54 4.545 1.17515.99 4.697 1.1816.44 4.85 1.18516.89 5.004 1.1917.345 5.16 1.19517.8 5.317
盐酸浓度/密度 1/1.0032 2/1.0082 4/1.0181 6/1.0279 8/1.0376 10/1.0474 12/1.0574 14/1.0675 16/1.0776 18/1.0878 20/1.0980 22/1.1083 24/1.1187 26/1.1290 28/1.1392 30/1.1492 32/1.1593 34/1.1691 36/1.1789 38/1.1885 40/1.1980
浊点的测定 将样品在烧杯中用蒸馏水配成1%的溶液,然后慢慢加热,边加热边搅动,并用温度计测其温度,等溶液由澄清变成浑浊时读取温度值。然后将样品溶液边搅动边自然降温,等溶液由浑浊变澄清时读取温度值。重复几次,取平均值即为浊点温度。浊点是非离子表面活性剂的特性指标,对于阴离子或阳离子表面活性剂以及乳液类样品不适用。 起泡性的测定:在一具塞的刻度试管(最好选用20mL以上的试管)中,加入一定量(比如10mL)被测样品,盖好塞子(保证不会漏液体),用力上下摇晃20次,试管中泡沫达到的高度即作为起泡性的标准。泡沫越高,说明起泡性越好。 消泡性能测定:取两个同样大小的具塞试管(最好20mL以上),分别加入同样量(比如10mL)的被测样品,上下用力摇晃20次,泡沫由最多到完全破灭所需的时间即为消泡时间,消泡时间越短,消泡越快,消泡性能越好。 抑泡性能测定:取两个同样大小的具塞试管(最好20mL以上),分别加入同样量(比如10mL)的被测样品,用力上下摇晃20次,读取泡沫达到的高度,泡沫少的说明抑泡性能好。 耐酸性能测定:取同样大小的烧杯数个,分别加入同样量(比如100克)的被测样品,然后以5克为增加量依次向烧杯中加入冰醋酸并搅拌均匀,观察有无浑浊或分层现象,发生浑浊或分层的烧杯中的醋酸加入量即为耐酸量。 为了更精确地表示耐酸性,可以以发生浑浊或分层的加入量为中间值,把增加量减少,重复前面的操作。 耐碱性能测定:取同样大小的烧杯数个,分别加入同样量(比如100克)的被测样品,然后以5克为增加量依次向烧杯中加入烧碱(或纯碱)溶液并搅拌均匀,观察有无浑浊或分层现象,发生浑浊或分层的烧杯中的烧碱(或纯碱)溶液加入量即为耐碱量。同样,可以以发生浑浊或分层的加入量为中间值,把增加量减少,重复前面的操作,来得到更准确的耐碱量。
工业盐酸密度,质量分数与摩尔浓度对应密度质量分数摩尔浓度 1 0.4 0.109589041 1.005 1.4 0.385479452 1.01 2.4 0.664109589 1.015 3.4 0.945479452 1.02 4.4 1.229589041 1.025 5.4 1.516438356 1.03 6.4 1.806027397 1.035 7.5 2.126712329 1.04 8.5 2.421917808 1.045 9.5 2.719863014 1.05 10.5 3.020547945 1.055 11.5 3.323972603 1.06 1 2.5 3.630136986 密度质量分数摩尔浓度 1.065 13.5 3.939041096 1.07 14.5 4.250684932 1.075 15.5 4.565068493 1.08 16.5 4.882191781 1.085 17.4 5.172328767 1.09 18.4 5.494794521
1.095 19.4 5.82 1.1 20.4 6.147945205 1.105 21.4 6.478630137 1.055 11.5 3.323972603 1.06 1 2.5 3.630136986 1.065 13.5 3.939041096 1.07 14.5 4.250684932 1.075 15.5 4.565068493 1.08 16.5 4.882191781 1.085 17.4 5.172328767 1.09 18.4 5.494794521 密度质量分数摩尔浓度 1.095 19.4 5.82 1.1 20.4 6.147945205 1.105 21.4 6.478630137 1.11 2 2.3 6.781643836 1.115 2 3.3 7.117671233 1.12 2 4.2 7.425753425 1.125 2 5.2 7.767123288 1.13 2 6.2 8.111232877 1.135 2 7.2 8.458082192 1.14 28.2 8.807671233
质量分数-摩尔浓度换算 溶液质量分数-摩尔浓度换算公式: C=10ρW M C代表溶液摩尔浓度,ρ代表溶液密度,W%代表溶液质量分数,M代表溶质相对分子质量。
密度ρ(g/ml) 质量分数W(%) 摩尔浓度C(mol/L) 密度ρ(g/ml) 质量分数W(%) 摩尔浓度C(mol/L) 1 0.4 0.11 1.100 20.4 6.15 1.005 1.4 0.39 1.105 21.4 6.48 1.010 2.4 0.66 1.110 22.3 6.78 1.015 3.4 0.95 1.115 23.3 7.12 1.020 4.4 1.23 1.120 24.2 7.43 1.025 5.4 1.52 1.125 25.2 7.77 1.030 6.4 1.81 1.130 26.2 8.11 1.035 7.5 2.13 1.135 27.2 8.46 1.040 8.5 2.42 1.140 28.2 8.81 1.045 9.5 2.72 1.145 29.2 9.16 1.050 10.5 3.02 1.150 31.2 9.52 1.055 11.5 3.32 1.155 31.2 9.87 1.060 1 2.5 3.63 1.160 32.2 10.23 1.065 13.5 3.94 1.165 33.2 10.60 1.070 14.5 4.25 1.170 34.2 10.96 1.075 15.5 4.57 1.175 35.2 11.33 1.080 16.5 4.88 1.180 36.2 11.70 1.085 17.4 5.17 1.185 37.2 1 2.08 1.090 18.4 5.49 1.190 38.3 1 2.49 1.095 19.4 5.82 1.195 39.4 1 2.90
盐酸的密度对照表 密度质量分数摩尔浓度1 0.4 0.109589041 1.005 1.4 0.385479452 1.01 2.4 0.664109589 1.015 3.4 0.945479452 1.02 4.4 1.229589041 1.025 5.4 1.516438356 1.03 6.4 1.806027397 1.035 7.5 2.126712329 1.04 8.5 2.421917808 1.045 9.5 2.719863014 1.05 10.5 3.020547945 1.055 11.5 3.323972603 1.06 12.5 3.630136986 密度质量分数摩尔浓度1.065 13.5 3.939041096 1.07 14.5 4.250684932 1.075 15.5 4.565068493 1.08 16.5 4.882191781 1.085 17.4 5.172328767 1.09 18.4 5.494794521
1.1 20.4 6.147945205 1.105 21.4 6.478630137 1.055 11.5 3.323972603 1.06 1 2.5 3.630136986 1.065 13.5 3.939041096 1.07 1 4.5 4.250684932 1.075 1 5.5 4.565068493 1.08 1 6.5 4.882191781 1.085 1 7.4 5.172328767 1.09 1 8.4 5.494794521 密度质量分数摩尔浓度1.095 1 9.4 5.82 1.1 20.4 6.147945205 1.105 21.4 6.478630137 1.11 2 2.3 6.781643836 1.115 2 3.3 7.117671233 1.12 2 4.2 7.425753425 1.125 2 5.2 7.767123288 1.13 2 6.2 8.111232877 1.135 2 7.2 8.458082192 1.14 28.2 8.807671233
。液碱密度和浓度对照表 密度浓度% 1 0.159 1.005 0.602 1.01 1.04 1.02 1.94 1.03 2.84 1.04 3.74 1.05 4.65 1.06 5.56 1.07 6.47 1.08 7.38 1.09 8.28 1.1 9.19 1.11 10.1 1.12 11.01 1.13 11.92 1.14 1 2.83 1.15 13.73
1.17 15.54 1.18 16.44 1.19 17.34 1.2 18.25 1.21 19.16 1.22 20.07 1.23 20.98 1.24 21.9 1.25 2 2.82 1.26 2 3.73 1.27 2 4.64 1.28 2 5.56 1.29 2 6.48 1.3 2 7.41 1.31 2 8.33 1.32 2 9.26 1.33 30.2 1.34 31.14
1.36 33.06 1.37 34.03 1.38 35.01 1.39 36 1.4 36.99 1.41 37.99 1.42 38.99 1.43 40 1.44 41.03 1.45 4 2.07 1.46 4 3.12 1.47 4 4.17 1.48 4 5.22 1.49 4 6.27 1.5 4 7.33 1.51 4 8.38 1.52 4 9.44 1.53 50.5
。液碱温度密度对照表
。 温度分别是 0℃ 10℃ 15℃ 18℃ 20℃ 30℃ 40℃ 50℃ 60℃ 70℃ 80℃ 90℃ 100℃时在不同比例下的密度分别如下 1% 1.01240 1.01150 1.01065 1.01003 1.00950 1.00690 1.00330 0.99900 0.99410 0. 98840 0.98240 0.97600 0.96930 5% 1.05980 1.05710 1.05554 1.05454 1.05380 1.05010 1.04580 1.04120 1.03590 1. 03020 1.02430 1.01790 1.01150 10% 1.11710 1.11320 1.11107 1.10977 1.10890 1.10430 1.09950 1.09420 1.08890 1. 08310 1.07710 1.07080 1.06430 12% 1.13990 1.13550 1.13327 1.13188 1.13090 1.12610 1.12100 1.11570 1.11010 1. 10430 1.09830 1.09200 1.08550 14% 1.16240 1.15780 1.15545 1.15400 1.15300 1.14800 1.14280 1.13730 1.13160 1. 12570 1.11950 1.11320 1.10660 16% 1.18490 1.18010 1.17761 1.17610 1.17510 1.16990 1.16450 1.15880 1.15310 1. 14710 1.14080 1.13430 1.12770 18% 1.20730 1.20230 1.19973 1.19810 1.19720 1.19180 1.18630 1.18050 1.17460 1. 16850 1.16210 1.15560 1.14890 20% 1.22960 1.22440 1.22183 1.22022 1.21910 1.21360 1.20790 1.20200 1.19600 1. 18980 1.18330 1.17680 1.17000 22% 1.25190 1.24650 1.24386 1.24220 1.24110 1.23540 1.22960 1.22360 1.21740 1. 21110 1.20460 1.19800 1.19120 24% 1.27410 1.26860 1.26582 1.26412 1.26290 1.25710 1.25120 1.24510 1.23880 1. 23240 1.22590 1.21920 1.21240 26% 1.29630 1.29060 1.28770 1.28600 1.28480 1.27890 1.27280 1.26660 1.26030 1. 25380 1.24720 1.24050 1.23360 28% 1.31820 1.31240 1.30940 1.30760 1.30640 1.30020 1.29420 1.28780 1.28140 1.
工业用盐酸——盐酸浓度的密度测量法》 《工业用盐酸——盐酸浓度的密度测量法》(补充件) A.1范围和应用场合 本国际标准规定了密度测量法测定工业用盐酸的近似盐酸(HCl)浓度。 A.2原理 用比重计测定20℃时的密度,以评定相应盐酸(HCl)的浓度。 A.3仪器设备 比重计(在20℃时校准,见ISO/R649,每刻度0.005g/ml)。 玻璃试管(容积最少为500ml;直径最少为25mm,大于比重计;高最少为25mm,高于比重计的浸入水平)。 A.4测定步骤 表1 盐酸水溶液密度和浓度之间的关系① 20℃时的密度 g/mg HCl %(质 量) 20℃时的密 度 g/mg HCl %(质 量) 20℃时的密 度 g/mg HCl %(质 量) 20℃时的密 度 g/mg HCl %(质 量) 1.000 0.4 1.055 11.5 1.110 2 2.3 1.165 3 3.2 1.005 1.4 1.060 1 2.5 1.115 2 3.3 1.170 3 4.2 1.010 2.4 1.065 1 3.5 1.120 2 4.2 1.175 3 5.2 1.015 3.4 1.070 14.5 1.125 25.2 1.180 36.2 1.020 4.4 1.075 15.5 1.130 26.2 1.185 37.2 1.025 5.4 1.080 16.5 1.135 27.2 1.190 38.3 1.030 6.4 1.085 17.4 1.140 28.2 1.195 39.4 1.035 7.5 1.090 18.4 1.145 29.2 1.198 40.0② 1.040 8.5 1.095 19.4 1.150 30.2 1.045 9.5 1.100 20.4 1.155 31.2 1.050 10.5 1.105 21.4 1.160 3 2.2 ①表中所列出的数据是根据国际判定表(International Critical Tables,Vol.3.p.54.)用图示内插法给出,四舍五入到小数第一位。 ②在20℃时的饱和值。 A.4.1 密度的测定 在玻璃试管内放入约500ml试样,调节试管内容物到20±0.5℃。 浸入比重计,当达到静态平衡后,立刻再校准酸的温度为20±0.5℃,读出比重计表盘上所指出的密度。 A.4.2盐酸(HCl)含量的测定 从表1中读出与比重计所指出的密度相应的浓度。 A.5结果的表示 从比重计读数得知密度,用g/ml表示,而相应的盐酸(HCl)浓度从表中得出。 附注:GB320-83。
1.460 56.41 1.465 56.89
盐酸密度关系表
氢氧化钠溶液的浓度、溶质的质量分数和密度 密度20℃质量分数物质的量浓度密度20℃质量分数物质的量浓度密度20℃质量分数物质的量浓度g/cm3 (g/100g溶液) (mol/L) g/cm3 (g/100g溶液) (mol/L) g/cm3 (g/100g溶液) (mol/L) 1.000 0.159 0.0393 1.180 16.44 4.850 1.360 33.06 11.24 1.005 0.602 0.151 1.185 16.89 5.004 1.365 33.54 11.45 1.010 1.045 0.264 1.190 17.345 5.160 1.370 34.03 11.65 1.015 1.49 0.378 1.195 17.80 5.317 1.375 34.52 11.86 1.020 1.94 0.494 1.200 18.255 5.476 1.380 35.01 1 2.08 1.025 2.39 0.611 1.205 18.71 5.636 1.385 35.50 12.29 1.030 2.84 0.731 1.210 19.16 5.796 1.390 36.00 12.51 1.035 3.29 0.851 1.215 19.62 5.958 1.395 36.495 12.73 1.040 3.745 0.971 1.220 20.07 6.122 1.400 36.99 12.95 1.045 4.20 1.097 1.225 20.53 6.286 1.405 37.49 13.17 1.050 4.655 1.222 1.230 20.98 6.451 1.410 37.99 13.30 1.055 5.11 1.347 1.235 21.44 6.619 1.415 38.49 13.61 1.060 5.56 1.474 1.240 21.90 6.788 1.420 38.99 13.84 1.065 6.02 1.602 1.245 22.30 6.958 1.425 39.495 14.07 1.070 6.47 1.731 1.250 22.82 7.129 1.430 40.00 14.30 1.075 6.93 1.862 1.255 23.275 7.302 1.435 40.515 14.53 1.080 7.38 1.992 1.260 23.73 7.475 1.440 41.03 14.77 1.085 7.83 2.123 1.265 24.19 7.650 1.445 41.55 15.01 1.090 8.28 2.257 1.270 24.645 7.824 1.450 42.07 15.25 1.095 8.74 2.391 1.275 25.10 8.000 1.455 42.59 15.49 1.100 9.19 2.527 1.280 25.56 8.178 1.460 43.12 15.74 1.105 9.645 2.664 1.285 26.02 8.357 1.465 43.64 15.98 1.110 10.10 2.802 1.290 26.48 8.0539 1.470 44.17 16.23 1.115 10.555 2.942 1.295 26.94 8.722 1.475 44.695 16.48 1.120 11.01 3.082 1.300 27.41 8.906 1.480 45.22 16.73 1.125 11.46 3.224 1.305 27.87 9.092 1.485 45.75 16.98 1.130 11.92 3.367 1.310 28.33 9.278 1.490 46.27 17.28 1.135 12.37 3.510 1.315 28.80 9.466 1.495 46.80 17.49 1.140 12.83 3.655 1.320 29.26 9.656 1.500 47.23 17.75 1.145 13.28 3.801 1.325 29.73 9.847 1.505 47.85 18.00 1.150 13.73 3.947 1.330 30.20 10.04 1.510 48.88 18.20 1.155 14.18 4.095 1.335 30.67 10.23 1.515 48.905 18.52 1.160 14.64 4.244 1.340 31.14 10.43 1.520 49.44 18.78 1.165 15.09 4.395 1.345 31.62 10.63 1.525 49.97 19.05 1.170 15.54 4.545 1.350 32.10 10.83 1.530 50.50 19.31 1.175 15.99 4.697 1.355 32.58 11.03