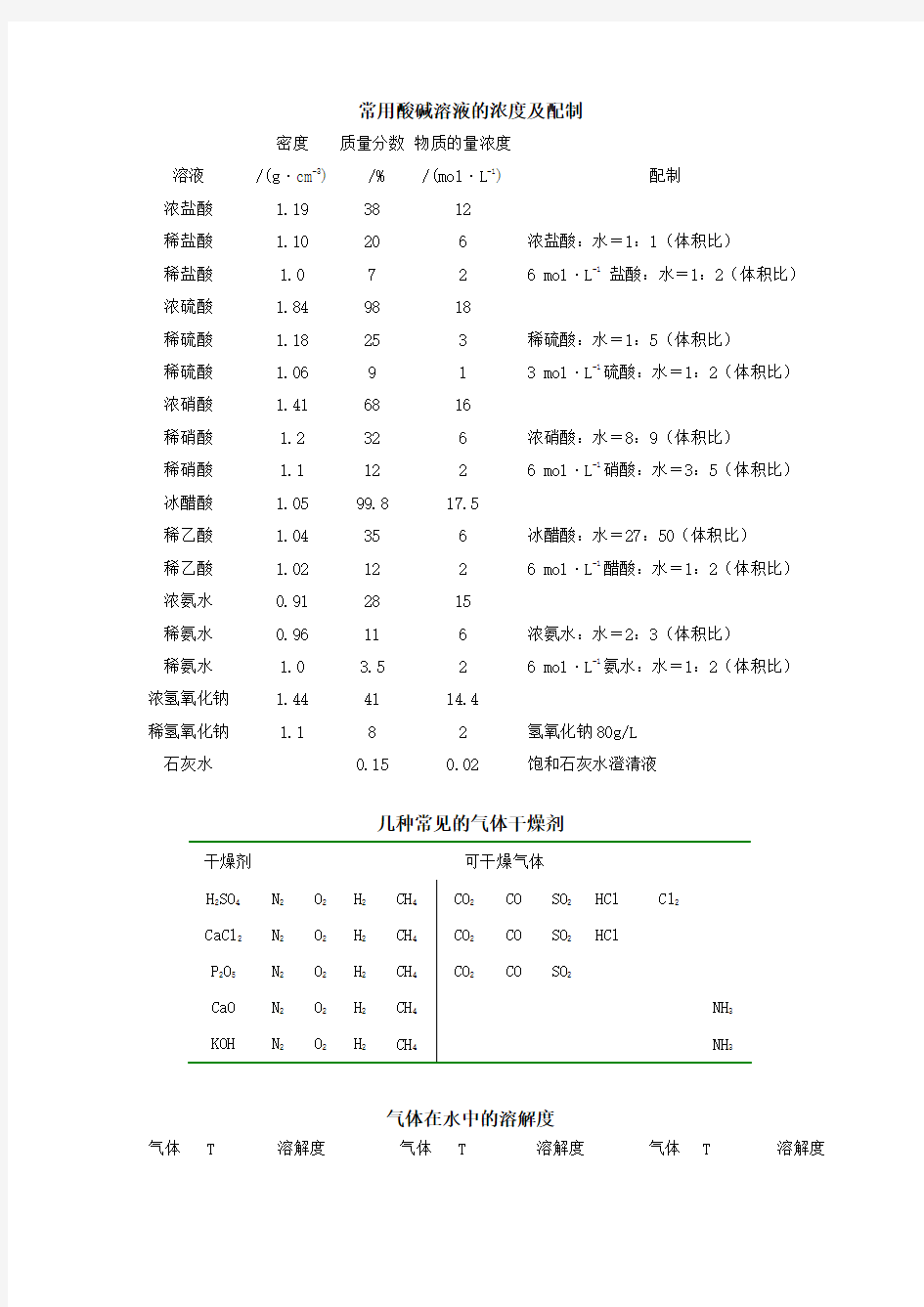

常用酸碱溶液的浓度及配制
溶液
密度
/(g·cm-3)
质量分数
/%
物质的量浓度
/(mol·L-1) 配制
浓盐酸 1.19 38 12
稀盐酸 1.10 20 6 浓盐酸:水=1:1(体积比)
稀盐酸 1.0 7 2 6 mol·L-1盐酸:水=1:2(体积比)
浓硫酸 1.84 98 18
稀硫酸 1.18 25 3 稀硫酸:水=1:5(体积比)
稀硫酸 1.06 9 1 3 mol·L-1硫酸:水=1:2(体积比)
浓硝酸 1.41 68 16
稀硝酸 1.2 32 6 浓硝酸:水=8:9(体积比)
稀硝酸 1.1 12 2 6 mol·L-1硝酸:水=3:5(体积比)
冰醋酸 1.05 99.8 17.5
稀乙酸 1.04 35 6 冰醋酸:水=27:50(体积比)
稀乙酸 1.02 12 2 6 mol·L-1醋酸:水=1:2(体积比)
浓氨水0.91 28 15
稀氨水0.96 11 6 浓氨水:水=2:3(体积比)
稀氨水 1.0 3.5 2 6 mol·L-1氨水:水=1:2(体积比)
浓氢氧化钠 1.44 41 14.4
稀氢氧化钠 1.1 8 2 氢氧化钠80g/L
石灰水0.15 0.02 饱和石灰水澄清液
几种常见的气体干燥剂
干燥剂可干燥气体
气体在水中的溶解度
气体T 溶解度气体T 溶解度气体T 溶解度
/o C /(mL·100mL-1H2O) /o C /(m L·100mL-1H2O) /o C /(m L·100mL-1H2O) H20 2.14 N20 2.33 O20 4.89
20 0.85 40 1.42 25 3.16
CO 0 3.5 NO 0 7.34 H2S 0 437
20 2.32 60 2.37 40 186
CO20 171.3 NH30 89.9 Cl210 310
20 90.1 100 7.4 30 177
SO20 22.8
常用的气体净化剂
气体所含杂质净化剂气体所含杂质净化剂
O2Cl2NaOH溶液CO CO2石灰水
H2H2S CuSO4溶液N2O2加热铜网
CO2HCl 饱和NaHCO3溶液CO2CO或H2CuO
CH4C2H2溴水H2S HCl 饱和NaHS
Cl2HCl 饱和食盐水NO NO2水
常见化合物的俗名
类别俗名主要化学成分
硅化合物石英SiO2
水晶SiO2
打火石、燧石SiO2
玻璃SiO2
砂石SiO2
橄榄石Mg SiO4硅锌石Zn SiO4硅胶SiO2
钠化合物食盐NaCl
硼砂Na2B4O7·10H2O 苏打、纯碱Na2CO3
小苏打NaHCO3
海波Na2S2O3·5H2O
红矾钠Na2Cr2O7·2H2O 苛性钠、烧碱、苛性碱、火碱NaOH
芒硝Na2SO4·10H2O 硫化碱Na2S
水玻璃Na2SiO3·nH2O 钾盐、碱砂K2CO3
黄血盐K4Fe(CN)6·2H2O
钾化合物赤血盐K3Fe(CN)6
苛性钾KOH
灰锰氧KMnO4
钾硝石、火硝KNO3
吐酒石K(SbO)C4H4O6
铵化合物硝铵、钠硝石NH4NO3
硫铵(NH4)2SO4卤砂NH4Cl
钡化合物重晶石BaSO4钡石BaSO4钡垩石BaCO3
锶化合物天青石SrSO4锶垩石SrCO3
铬化合物铬绿Cr2O3
铬矾Cr2K2(SO4)4·24H2O
铵铬矾Cr2(NH4)2(SO4)4·24H2O 红矾K2Cr2O7
铬黄PbCrO4
钙化合物电石CaC2
白垩CaCO3
石灰石CaCO3
大理石CaCO3
文石、霞石CaCO3
方解石CaCO3
萤石、氟石CaF2
熟石灰、消石灰Ca(OH)2
漂白粉、氯化石灰Ca(OHCl)·Cl 生石灰CaO
无水石膏、硬石膏CaSO4
烘石膏、熟石膏、
巴黎石膏
2CaSO4·H2O
重石CaWO4
白云石CaCO3·MgCO3
锰化合物硫锰矿MnS 软锰矿MnO2黑石子MnO2
铝化合物矾土Al2O3
刚玉Al2O3
铝胶Al2O3
红宝石Al2O3
明矾、铝矾K2Al2(SO4)4·2H2O
高岭土Al2O3·2SiO2·2H2O
铵矾(NH4)2Al2(SO4)4·24H2O
明矾石K2SO4·Al2(SO4)3·2 Al2O3·6H2O
群青、佛青Na2Al4Si6S4O33
或Na X Al4Si6S4O23
绿宝石3BeO,Al2O3,6SiO2
铁化合物铁丹Fe2O3
赤铁矿Fe2O3
磁铁矿Fe3O4
菱铁矿FeCO3
滕氏盐Fe3[Fe(CN)6]2
普鲁氏盐Fe4[Fe(CN)6]3
绿矾FeSO4·7H2O
铁矾Fe2K2(SO4)4·24H2O
毒砂FeAsS
磁黄铁矿FeS
黄铁矿FeS2
摩尔盐(NH4)2SO4·FeSO4·6H2O
镁化合物白苦土、烧苦土MgO
卤盐MgCl2
泻利盐MgSO4·7H2O
菱苦土MgCO3
光卤石KCl·MgCl2·6H2O 滑石3MgO·4SiO2·H2O
锌化合物锌白ZnO
红锌矿ZnO
闪锌矿ZnS
炉甘石ZnCO3
锌矾、白矾ZnSO4·7H2O 锌钡白、立德粉ZnS+BaSO4
铅化合物黄丹、密陀僧PbO
红铅、铅丹Pb3O4
方铅矿PbS
铅白2PbCO3·Pb(OH)2
汞化合物甘汞Hg2Cl2
升汞HgCl2
三仙丹HgO
辰砂米砂HgS
雷汞Hg(CNO)2·1/2H2O
铜化合物铜绿CuCO3·Cu(OH)2孔雀石CuCO3·Cu(OH)2胆矾、铜矾CuSO4·5H2O 赤铜矿Cu2O
方黑铜矿CuO
黄铜矿CuFeS2
砷化合物砒霜As2O3
雄黄As2S2或As4S4
雌黄As2S3
锑化合物锑白Sb2O3或Sb4O6辉锑矿Sb2S3
闪锑矿Sb2S3
有机化合物电石气C2H2
蚁醇、木醇、木精CH3OH
酒精、火酒CH3CH2OH
福尔马林、福马林HCHO
蚁酸HCOOH
醋、醋精、乙酸CH3COOH
石炭酸C6H5OH
玫瑰油苯乙醇
火棉胶硝化纤维
石油醚汽油的一种(沸程30-70o C)凡士林液体和固体石蜡烃混合物
常见无机离子的颜色
颜
色
离子
红[Fe(NCS)n]3-n,[Co (H2O)6]2+,[Co(NH3)5(H2O)6]2+,[Cr (NH3)3 (H2O)3]3+
橙Cr2O72-,,[Co(NH3)6]3+,[Cr (NH3)4 (H2O)2]3+,[Cr (NH3)5 (H2O)]2+,[Fe(CN)6]3-
肉[Mn(H2O)6]2+
黄[CuCl4]2-,[Cr(NH3)6]3+,CrO42-,[Fe(CN)6]4-,[Co(NH3)6]2+、I3-
绿[Cr (H2O)5Cl]2+,[Cr (H2O)4Cl2]+,CrO2-,MnO42-,[Fe(H2O)6]2+,[Ni(H2O)6]2+
蓝[Cu(H2O)4]2+,[Cu(NH3)4]2+, [Cr (H2O)6]2+,[Co(SCN)4]2-,[Ni (NH3)6]2+
紫[Cr (H2O)6]3+,[Cr (NH3)2 (H2O)4]3+,MnO4-,[Fe(H2O)6]3+,[CoCl(NH3)5]2+,[Co(NH3)4CO3]+,[Co(CN)6]3-
常见无机化合物的颜色
颜
色
化合物
黑Ag2S,Hg2S,HgS,PbS,Cu2S,CuS,FeS,CoS,NiS,CuO,NiO,Fe3O4,FeO,MnO2,金属的沉淀,碳
褐Bi2S3,SnS,Bi2O3,PbO2,Ag2O,CdO,CuBr
红HgS,Sb2S3,Fe2O3,HgO,Pb3O4,HgI2,FeCl3(无水物),K3Fe(CN)6,Ag2Cr2O7,某些重铬酸盐,碘化物和钴盐
粉
红
亚锰盐,水合钴盐
黄As2S3,As2S5,SnS2,CdS,HgO,AgI,PbO,多数铬酸盐、铁盐,某些碘化物
绿镍盐,水合亚铁盐,某些铜盐如CuCO3,CuCl2,某些铬盐
蓝水合铜盐,无水钴盐
紫高锰酸盐,一些铬盐
桔
红
Sb2S5,Sb2S3,多数重铬酸盐
几种元素的焰色反应
元素火焰颜色元素火焰颜色
Na 黄Ba 黄绿
K 紫Cu 绿
Sr 猩红 B 绿
Ca 砖红Pb、Sb 淡蓝
特殊化学药品的保存
试剂类型常见试剂保存
易挥发浓盐酸、浓氨水、丙酮、乙醇、乙醚、甲醇、
甲醛、苯等严密盖紧,置阴凉处
易潮解或易水解氯化钙、氯化锌、氯化亚铁、氯化铁、硝酸铵、
硝酸钠、硫化钠、五氧化二磷、无水氯化铝等严密盖紧,蜡密封
见光易分解浓硝酸、硝酸银、双氧水、碘化钾、溴化钾、
绿化亚汞、亚铁盐、亚硝酸盐、氯水等用棕色瓶盛放,置阴凉、避光处
易燃液体石油醚、氯乙烷、乙醚、乙醛、汽油、松节油、二硫化碳、甲醇、乙醇、苯、甲苯等
阴凉通风处,与其它可燃物、易发生火花的器物和氧化剂(氯酸钾、高锰酸钾、过氧化钠等)隔离存放
易燃易爆
固体钾、钠、钙、氢化钠、磷化钙、碳化钙、硅化
镁等
钾、钠放在盛煤油的瓶里,其它装
瓶后密封放在干燥器里
硝化纤维、火药棉、苦味酸、雷汞等保存在阴凉干燥处
白磷瓶装,浸没在水里
红磷、硫、镁粉、锌粉、铝粉、萘、樟脑等保存在阴凉处并和氧化剂分开存放
剧毒品氰化钾、氰化钠、氧化砷、白磷、氯化汞
保存在阴凉干燥处,跟酸类隔离,专柜加锁、专人负责
强氧化剂过氧化钠、过氧化钾、过硫酸盐、硝酸铵硝酸
钠、硝酸钾、硝酸铅、高锰酸钾、重铬酸钾、
氯酸钾等
保存在阴凉通风处,跟酸类、木屑、
硫粉、金属粉、硫化物、糖类等易燃物
分开存放
强腐蚀剂
浓硫酸、发烟硝酸、浓盐酸、氢氟酸、氢溴酸、
醋酐、液溴等液体;氢氧化钠、氢氧化钾、硫
化钠、无水氯化铝、三氯化磷、苯酚等固体
保存在阴凉通风处,跟其它药品隔
离放置。用抗腐蚀材料做器架,其中发
烟硝酸和液溴的瓶外垫沙放置
实验室常用的灭火器及其使用范围
灭火器类型药液成分适用范围
泡沫灭火器Al2(SO4)3和NaHCO3适用于油类起火
二氧化碳
灭火器液态CO2
适用于扑灭电器设备、小范围油类及忌水的化学物品着火
四氯化碳
灭火器液态CCl4
适用于扑灭电器设备、小范围的汽油、丙酮等失火。不能用于扑灭活泼金属钾、钠的失火,因CCl4会强烈的分解,甚至爆炸。电石、CS2的失火也不能使用它,因为会产生光气一类的毒气
干粉灭火器
主要成分是碳酸氢
钠等盐类物质与适量的润
滑剂和防潮剂
扑救油类、可燃性气体,电器设备、精密
仪器、图书资料和遇水易燃烧物品的初期火灾
1211灭火器CF2ClBr液化气体
特别适用于扑灭油类、有机溶剂、精密仪器、高压电器设备的失火
常见化学毒物的急性致毒作用及救治方法分
类
名称主要致毒作用与症状救治方法
酸硫酸、
盐酸、硝酸
接触:硫酸局部红肿
痛,重者起水泡、呈烫伤
症状;硝酸、盐酸腐蚀性
小于硫酸
吞服:强烈腐蚀口腔、
食道、胃粘膜
先用布将酸液擦净,再用大量水冲洗,
然后用2%碳酸氢钠水溶液冲洗,最后清水冲
洗
初服可洗胃,时间长忌洗胃以防穿孔;
应立即服7.5%碳酸氢镁悬液60mL,鸡蛋清
调水或牛奶200mL
碱氢氧化钠、
氢氧化钾
接触:强烈腐蚀性,
化学烧伤
吞服:口腔、食道、
迅速用水、柠檬汁、稀乙酸或2%硼酸水
溶液洗涤
禁洗胃或催吐,给服稀乙酸或柠檬汁
胃粘膜糜烂500mL,或0.5%盐酸100-500mL,再服蛋清
水、牛奶、淀粉糊、植物油等
有
机
化合物石油烃类
吸入高浓度汽油蒸
汽、出现头痛、头晕、心
悸、神志不清等
汽油对皮肤有脂溶性
和刺激性,皮肤干燥、皲
裂、个别引起红斑、水疱
石油烃能引起呼吸、
造血、神经系统慢性中毒
症状
某些润滑油和石油残
渣长期刺激皮肤可能引起
皮肤癌
移至新鲜空气处,重症可给与吸氧
温水清洗
医生治疗
涂5%炉甘石洗剂
苯及其同
系物
吸入蒸汽及皮肤渗透
急性:头晕、头痛、
恶心,重者昏迷抽搐甚至
死亡
慢性中毒:肝、心、
肾损害
皮肤接触用清水洗涤
人工呼吸、输氧、医生处置
气体氮氧化物
呼吸系统急性损害
急性中毒:口腔、咽
喉粘膜、眼结膜充血、头
晕、支气管炎、肺炎、肺
水肿
慢性:呼吸道病变
移至新鲜空气处,必要时吸氧
二氧化硫、
三氧化硫
对上呼吸道及眼结膜有刺
激作用;结膜炎、支气管
炎、胸痛、胸闷
移至新鲜空气处,必要时吸氧,用2%碳
酸氢钠洗眼
硫化氢眼结膜、呼吸及中枢
神经系统损害
急性:头晕、头痛甚
至抽搐昏迷;久闻不觉其
气味更具危险性
移至新鲜空气处,必要时吸氧;生理盐
水洗眼
一定物质的量浓度溶液的配制步骤 高考频度:★★★★☆ 难易程度:★★★☆☆典例在线 Ⅰ.配制480 mL 0.3 mol/L NaOH溶液。具体如下: (1)需 g NaOH。 (2)配制过程中,下列仪器不会用到的是___________(填字母) ,尚缺少的玻璃仪器有 _____________。 A.托盘天平 B.250 mL容量瓶C.玻璃棒D.胶头滴管 (3)实验过程中两次用到玻璃棒,其作用分别是: _______________________、 _____________________。 (4)定容操作:将蒸馏水注入所选的容器中,直到其中液面接近其刻度线______处时,改用 ______滴加蒸馏水至溶液的______正好与刻度线______。将瓶塞子盖好,反复______摇匀。 (5)下列操作的正确顺序是:B→______→______→______→______→______→G (用字母表示) 。 A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.转移 G.摇匀Ⅱ.乙同学用18.4 mol/L浓硫酸配制100 mL 3.6 mol/L的稀硫酸。 用100 mL量筒量取20 mL浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 mL刻度线,再搅拌均匀。 你认为此法是否正确?若不正确,指出其中错误之 处。 Ⅲ.在配制物质的量浓度溶液时,判断下列操作出现的后果。(填“溶液浓度不准确”、“偏低”、“偏高”或“无影响”) (1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体:_____________。 (2)配制氢氧化钠溶液时,容量瓶中有少量水:______________。 (3)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度:____________。 (4)转移时不慎将溶液倒在瓶外:; (5)定容时俯视容量瓶刻度线:。
常见的酸和碱 一、选择题:本题共12小题.每小题只有一个正确选项,每小题2分,共24分. 1、盐酸能使紫色石蕊试液变红色,这是因为盐酸中含有大量的() A.氢原子 B.氢分子 C.氢离子 D.氯离子 2、下列物质属于碱类的是() A.纯碱 B.熟石灰 C.生石灰 D.石灰石 3、下列物质敞口放置在空气中较长时间后,质量会增加且变质的是() A.浓硫酸 B.酒精 C.烧碱 D.浓盐酸 4、下列说法正确的是() A.pH=0的溶液既不显酸性,也不显碱性,呈中性 B.碱类物质一定能使酚酞试液变红 C.有盐和水生成的反应不一定是中和反应 D.现要测定某溶液的pH,若事先用水把pH试纸润湿再测,则实际测得值与真实值比较将偏大5.(宿迁市)小李在学习酸碱指示剂与常见酸、碱溶液作用时,归纳成如右图所示的关系。图中A、B、C、D是两圆相交的部分,分别表示指示剂与酸、碱溶液作用时所显示出的颜色,则其中表示不正确 ...的是() A.紫色 B.蓝色 C.红色 D.无色6、聪明的小红同学在烧水是发现壶中有许多水垢[水垢的主要成分是CaC O3和Mg(OH)2],她设计了下列方法除去水垢,你认为可行的是 A、用食醋浸泡后冲洗 B、用洗涤剂溶液浸泡后冲洗 C、用食盐水浸泡后冲洗 D、用热的纯碱溶液浸泡扣冲洗 7.如图所示装置中,夹子处在关闭状态。现将NaOH溶液滴入广口瓶中,待充分反应后,打开夹子,试管中刚停止沸腾的水又重新沸腾了。对上述现象解释正确的是 A、试管内的气压减小,沸点升高 B、试管内的气压增大,沸点升高 C、试管内的气压减小,沸点降低 D、试管内的气压增大,沸点降低 8、氢氧化钠、氢氧化钙都是实验室常用的碱。要鉴别氢氧化钠稀溶液和饱和氢氧化钙溶液,下列方法不能够达到目的的是() A.分别滴加碳酸钠溶液 B.分别通入二氧化碳 C.分别滴加稀盐酸 D.分别长期露置于空气中 9、甲、乙、丙、丁分别是HNO 3、Ba(OH) 2 、Na 2 CO 3 、NaOH四种溶液中的一种。 已知乙和丙可以反应。乙和丁也可以反应,则下列说法正确的是() A.乙一定是HNO 3 B.丁一定是Na 2 CO 3 C.丙不可能是Ba(OH) 2 D.甲不
例 1 判断下列叙述正确的是 任何物质的体积都约为A.标准状况下,1mol 22.4L B.1mol 任何气体所含分子数都相同,体积也都约为22.4L 24 转移电子数为1.204 ×.在常温常压下金属从盐酸中置换出 1molH10C2 D.在同温同压下,相同体积的任何气体单质所含原子数目相同例 2 在一密闭气缸中,用一不漏气可滑动的活塞隔开,左边充有N,右边充有H和O的混合气222体,在20℃时,将右边混合气体点燃,反应后冷却到原来温度,若活塞原来离气缸1 ,反应后静止于气缸的正中(忽略水蒸气),则原来H和O 的体积比左端的距离为总长的 224
为() (B)5:4(C)7:2(D(A)4:5)2:1 例 3 如果ag某气体中含有的分子数为b,则cg 该气体在标准状况下的体积是 22.4ab22.4ac22.4bc 22.4b LL A.L L D.C. B. cN acN bN aN AAAA 例 4 按体积比为4:2:3 所组成的N、O、CO,混合气体100g 在标况下体积为___L。222 例 5 体积为1L干燥容器中充入1.082。气体后,测得容器中气体对氧气的相对密度为HCl 将此气体倒扣在水中,进入容器中液体的体积是() 0.75L(C)0.5L)(A0.25L(B)(D)1L 例 6 相同质量的钠、镁、铝分别跟足量稀硫酸反应,在同温、同压下产生气体的体积比 为__________;如果这三种金属各取等物质的量,也分别跟足量稀硫酸反应,在同温同压下产生气体的体积比为 _________________ 。若Na、Mg、Al 分别和足量的稀硫酸作用,产生相同
一定物质的量浓度溶液的配制 知识复习: 配置50g质量分数为6%的氯化钠溶液所需要的仪器有托盘天平、药匙、烧杯、量筒、胶头滴管、玻棒。步骤为①计算②称量③溶解。 2.物质的量浓度的概念和计算公式。 3.10%的NaCl溶液是指什么?每100克NaCl溶液含溶质10g 1mol/L的NaCl 溶液是指什么?1LNaCl溶液含溶质1mol 知识学习: 一.一定物质的量浓度溶液的配制(配制100mL1.00mol/LNaCl溶液) 【1】原理:由物质的量浓度的表达式可知,配制一定物质的量浓度溶液所需确定的量为溶质和溶剂。 思考:我们根据题中条件能否算出水的量(质量或体积)。如何确定溶液的体积? 【2】所用的仪器:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管 专用仪器:容量瓶 容量瓶的体积固定,有不同规格(100 mL、250 mL、500 mL、1000 mL等 (1)构造:梨形、平底、细颈玻璃瓶,瓶口配有磨口玻璃塞或塑料塞 (有一个塞子,且用绳子钓着,说明每个都有自己的原配) (2). 特点:①容量瓶上标有温度和容积 ②容量瓶上有刻线而无刻度 (3). 使用范围:用来配制一定体积、浓度准确的溶液 (4). 容量瓶的使用注意事项: ①溶解或稀释的操作不能在容量瓶中进行 ②溶液温度与容量瓶上标定温度一致时,所取液体的体积最标准 ③不能长期存放溶液或进行化学反应 ④使用前须检验容量瓶是否漏水。 【3】容量瓶的使用:容量瓶是用来的仪器,常用的规格有 。上面标有:、、。容量瓶在使用前要先查漏。其方法是加入适量水,盖好玻璃塞,倒转180°,查看是否漏水;再旋转塞子,再重复。【4】步骤: ①计算:计算所需NaCl固体的质量g。 ②称量:用称量NaCl固体。(固体称量用天平,液体则用量筒) 称量的注意事项: ①使用前要调零 ②两个托盘上各放一张大小相同的称量纸 ③称量时遵循左物右码的原则 ④镊子夹取砝码应按照从大到小的顺序 ⑤称量完毕应将砝码放回盒中,游码归零 ③溶解:将称好的NaCl固体放入烧杯中,加适量蒸馏水溶解,用玻璃棒搅拌,目的是加快溶解。 溶解中应注意事项:(固体要先溶解,液体要先稀释;都要却至室温再移液) a)在烧杯中溶解,不能在容量瓶中溶解,溶解时加水不要太多 b)应当注意搅拌时沿着一定的方向 c)玻璃棒不要碰烧杯底和烧杯壁 d)不要把玻璃棒放在实验台上,以免引入其他杂质 ④转移:(溶液冷却后,用玻璃棒引流)
配制一定物质的量浓度的溶液实验报告 实验目的 1、练习配制一定物质的量浓度的溶液。 2、加深对物质的量浓度概念的理解。 3、练习容量瓶、胶头滴管的使用方法。 实验原理 n=C V,配制标准浓度的溶液 实验用品 烧杯、容量瓶(100mL)、胶头滴管、量筒、玻璃棒、药匙、滤纸、托盘天平、NaCl(s)、蒸馏水。 实验步骤 (1)计算所需溶质的量 (2)称量:固体用托盘天平,液体用量筒(或滴定管/移液管)移取。 (3)溶解或稀释(用玻璃棒搅拌) (4)移液:把烧杯液体引流入容量瓶(用玻璃棒引流)。 (5)洗涤:洗涤烧杯和玻璃棒2~3次,洗涤液一并移入容量瓶,振荡摇匀。 (6)定容:向容量瓶中注入蒸馏水至距离刻度线2~3 cm处改用胶头滴管滴蒸馏水至溶液凹液面与刻度线正好相切。(要求平视) (7)盖好瓶塞,反复上下颠倒,摇匀。 实验结果 计算出溶质的质量 实验结论 (1)配制一定物质的量浓度的溶液是将一定质量或体积的溶质按所配溶液的体积在选定的容量瓶中定容,因而不需要计算水的用量。 (2)不能配制任意体积的一定物质的量浓度的溶液。这是因为在配制的过程中是用容量瓶来定容的,而容量瓶的规格又是有限的,常用的有50 mL、100 mL、250 mL、500 mL、和1000 mL等。所以只能配制体积与容量瓶容积相同的一定物质的量浓度的溶液。 备注 重点注意事项: (1)容量瓶使用之前一定要检查瓶塞是否漏水; (2)配制一定体积的溶液时,容量瓶的规格必须与要配制的溶液的体积相同; (3)不能把溶质直接放入容量瓶中溶解或稀释; (4)溶解时放热的必须冷却至室温后才能移液; (5)定容后,经反复颠倒,摇匀后会出现容量瓶中的液面低于容量瓶刻度线的情况,这时不能再向容量瓶中加入蒸馏水。因为定容后液体的体积刚好为容量瓶标定容积。上述情况的出现主要是部分溶液在润湿容量瓶磨口时有所损失; (6)如果加水定容时超过了刻度线,不能将
1.在做酸和碱中和反应的实验时,有时需借助指示剂颜色的变化判断反应是否发生、完成。向含有酚酞的NaOH溶液的烧杯中,不断滴入稀盐酸。此过程烧杯中溶液颜色的变化是A.由红色变为蓝色 B.由蓝色变为红色 C.由红色变为无色 D.由无色变成红色 在没有除锈剂的情况下,可以用来代替除锈剂的是 A.厕所清洁剂 B.洗发精 C.洗衣液 D.厨房清洁剂 4. 生活离不开化学,应用所学知识选出表中酸性最强的物质() 5. 因“对核糖体结构和功能的研究”而获得2009年诺贝尔化学奖。核糖体是进行蛋白质合成的重要细胞器,蛋白质在酸、碱或酶的作用下能发生水解反应生成氨基酸,氨基酸分子中含有氨基(一NH2,具有碱的性质)和羧基(一COOH,具有酸的性质)。氨基酸分子具有的性质是 A.只能与硫酸反应,不能与氢氧化钠反应 B.只能与氢氧化钠反应,不能与硫酸反应 C.既能与硫酸反应,又能与氢氧化钠反应 D.既不能与硫酸反应,又不能与氢氧化钠反应 6. 物质X可发生下列所示的两个反应,则X可能是() ①X+碱→盐+H2O ②X+金属氧化物→盐+ H2O A CaO B CO2 C NaOH D H2SO4 7. 白蚁能分泌出蚁酸。蚁酸的化学性质与盐酸相似,能腐蚀很多物质。下列最不容易被蚁 酸腐蚀的是 A.镀锌水管 B.铜制塑像 C.大理石栏杆 D.铝合金门窗 8. 从物质的组成角度解释酸具有酸的通性的原因是 A.酸都能电离出H+B.酸都含有酸根 C.酸中都含有氢元素D.酸中都含有氧元素 9. 有一食品包装说明书中注明防腐剂是苯甲酸(C6H5COOH),张华同学查资料得知苯甲 酸的酸性比醋酸强,可用做食品防腐剂。下列对苯甲酸性质的推测中不合理的是 A. 苯甲酸溶液的pH小于7 B. 相同浓度的苯甲酸溶液的pH比醋酸的pH大 C. 苯甲酸溶液能使紫色石蕊试液变红 D. 苯甲酸溶液不能使无色酚酞试液变色 10. 氢氧化钠是一种重要的化工原料,俗称______。氢氧化钠易吸收水分可用作某些气体的____剂,它的水溶液倒入充满CO2气体的矿泉水瓶中,密闭、振荡,可以看到,发生化学反应的方程式为,因此,氢氧化钠应密封保存。 11. 制作馒头时,需加入面碱(主要含碳酸钠),如果面碱放多了,蒸出的馒头会发黄,且口感不好。为除去过多的面碱,做馒头时可加入适量的() A、食醋 B、食盐 C、料酒 D、味精 12. 下列家庭小实验不能成功的是
液碱密度和浓度对照表密度浓度% 1 0.159 1.005 0.602 1.01 1.04 1.02 1.94 1.03 2.84 1.04 3.74 1.05 4.65 1.06 5.56 1.07 6.47 1.08 7.38 1.09 8.28 1.1 9.19 1.11 10.1 1.12 11.01 1.13 11.92 1.14 1 2.83 1.15 13.73 1.16 14.64 1.17 15.54 1.18 16.44 1.19 17.34 1.2 18.25 1.21 19.16 1.22 20.07 1.23 20.98 1.24 21.9 1.25 2 2.82 1.26 23.73 1.27 24.64 1.28 25.56 1.29 26.48 1.3 27.41 1.31 28.33 1.32 29.26
1.33 30.2 1.34 31.14 1.35 3 2.1 1.36 3 3.06 1.37 3 4.03 1.38 3 5.01 1.39 36 1.4 3 6.99 1.41 3 7.99 1.42 3 8.99 1.43 40 1.44 41.03 1.45 42.07 1.46 43.12 1.47 44.17 1.48 45.22 1.49 46.27 1.5 47.33 1.51 48.38 1.52 4 9.44 1.53 50.5
液碱温度密度对照表 温度分别是0℃10℃15℃18℃20℃30℃40℃50℃60℃70℃80℃90℃100℃时在不同比例下的密度分别如下 1% 1.01240 1.01150 1.01065 1.01003 1.00950 1.00690 1.00330 0.99900 0.99410 0.98840 0.98240 0.97600 0.96930 5% 1.05980 1.05710 1.05554 1.05454 1.05380 1.05010 1.04580 1.04120 1.03590 1.03020 1.02430 1.01790 1.01150 10% 1.11710 1.11320 1.11107 1.10977 1.10890 1.10430 1.09950 1.09420 1.08890 1.08310 1.07710 1.07080 1.06430 12% 1.13990 1.13550 1.13327 1.13188 1.13090 1.12610 1.12100 1.11570 1.11010 1.10430 1.09830 1.09200 1.08550 14% 1.16240 1.15780 1.15545 1.15400 1.15300 1.14800 1.14280 1.13730 1.13160 1.12570 1.11950 1.11320 1.10660 16% 1.18490 1.18010 1.17761 1.17610 1.17510 1.16990 1.16450 1.15880 1.15310 1.14710 1.14080 1.13430 1.12770 18% 1.20730 1.20230 1.19973 1.19810 1.19720 1.19180 1.18630 1.18050 1.17460 1.16850 1.16210 1.15560 1.14890 20% 1.22960 1.22440 1.22183 1.22022 1.21910 1.21360 1.20790 1.20200 1.19600 1.18980 1.18330 1.17680 1.17000 22% 1.25190 1.24650 1.24386 1.24220 1.24110 1.23540 1.22960 1.22360 1.21740 1.21110 1.20460 1.19800 1.19120 24% 1.27410 1.26860 1.26582 1.26412 1.26290 1.25710 1.25120 1.24510 1.23880 1.23240 1.22590 1.21920 1.21240 26% 1.29630 1.29060 1.28770 1.28600 1.28480 1.27890 1.27280 1.26660 1.26030
常用酸碱溶液的浓度及配制 溶液 密度 /(g·cm-3) 质量分数 /% 物质的量浓度 /(mol·L-1) 配制 浓盐酸 1.19 38 12 稀盐酸 1.10 20 6 浓盐酸:水=1:1(体积比) 稀盐酸 1.0 7 2 6 mol·L-1盐酸:水=1:2(体积比) 浓硫酸 1.84 98 18 稀硫酸 1.18 25 3 稀硫酸:水=1:5(体积比) 稀硫酸 1.06 9 1 3 mol·L-1硫酸:水=1:2(体积比) 浓硝酸 1.41 68 16 稀硝酸 1.2 32 6 浓硝酸:水=8:9(体积比) 稀硝酸 1.1 12 2 6 mol·L-1硝酸:水=3:5(体积比) 冰醋酸 1.05 99.8 17.5 稀乙酸 1.04 35 6 冰醋酸:水=27:50(体积比) 稀乙酸 1.02 12 2 6 mol·L-1醋酸:水=1:2(体积比) 浓氨水0.91 28 15 稀氨水0.96 11 6 浓氨水:水=2:3(体积比) 稀氨水 1.0 3.5 2 6 mol·L-1氨水:水=1:2(体积比) 浓氢氧化钠 1.44 41 14.4 稀氢氧化钠 1.1 8 2 氢氧化钠80g/L 石灰水0.15 0.02 饱和石灰水澄清液 几种常见的气体干燥剂 干燥剂可干燥气体 气体在水中的溶解度 气体T 溶解度气体T 溶解度气体T 溶解度
/o C /(mL·100mL-1H2O) /o C /(m L·100mL-1H2O) /o C /(m L·100mL-1H2O) H20 2.14 N20 2.33 O20 4.89 20 0.85 40 1.42 25 3.16 CO 0 3.5 NO 0 7.34 H2S 0 437 20 2.32 60 2.37 40 186 CO20 171.3 NH30 89.9 Cl210 310 20 90.1 100 7.4 30 177 SO20 22.8 常用的气体净化剂 气体所含杂质净化剂气体所含杂质净化剂 O2Cl2NaOH溶液CO CO2石灰水 H2H2S CuSO4溶液N2O2加热铜网 CO2HCl 饱和NaHCO3溶液CO2CO或H2CuO CH4C2H2溴水H2S HCl 饱和NaHS Cl2HCl 饱和食盐水NO NO2水 常见化合物的俗名 类别俗名主要化学成分 硅化合物石英SiO2 水晶SiO2 打火石、燧石SiO2 玻璃SiO2 砂石SiO2 橄榄石Mg SiO4硅锌石Zn SiO4硅胶SiO2 钠化合物食盐NaCl 硼砂Na2B4O7·10H2O 苏打、纯碱Na2CO3 小苏打NaHCO3 海波Na2S2O3·5H2O 红矾钠Na2Cr2O7·2H2O 苛性钠、烧碱、苛性碱、火碱NaOH 芒硝Na2SO4·10H2O 硫化碱Na2S 水玻璃Na2SiO3·nH2O 钾盐、碱砂K2CO3 黄血盐K4Fe(CN)6·2H2O
配制一定物质的量浓度的溶液练习题及答案 【典型例题】 类型一、一定物质的量浓度溶液配制的注意事项 例1.欲配制250mL 1mol/L 稀硫酸,用量筒量取______mL 98%密度为1.84g/cm3的浓硫酸,再用______取适量蒸馏水,将______缓慢注入到______中,并用______不断搅拌,待溶液______后,将溶液沿玻璃棒移入______中,用少量蒸馏水洗涤______和______ 2-3次,将洗涤液移入______中。向容量瓶中注入蒸馏水至距刻度线______ 时,改用______小心加水至溶液液面最低处与刻度线相切。最后盖好瓶塞,将配好的溶液转移到______中并贴好贴签。 【答案】13.6烧杯浓硫酸水玻璃棒冷至室温容量瓶烧杯玻璃棒 容量瓶1-2 cm 胶头滴管试剂瓶 【解析】V =0. 25L×1mol/L× 98g /mol÷98% ÷1.84g /cm3 =13.6 mL 【总结升华】掌握配制溶液的注意事项 举一反三: 【变式1】实验室中需要配制2 mol/L的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是() A.950 mL 111.2 g B.500 mL 117 g C.1000 mL 117 g D.任意规格111.2 g 【答案】C 类型二:一定物质的量浓度的溶液配制方法 例2.(2015 广东培正期中考)实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,填空并请回答下列问题: (1)配制时必须的玻璃仪器有:烧杯、玻璃棒、、。 (2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次); A、用30mL水洗涤烧杯2﹣3次,洗涤液均注入容量瓶,振荡 B、用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中 D、将容量瓶盖紧,颠倒摇匀 E、改用胶头滴管加水,使溶液凹面恰好与刻度相切 F、继续往容量瓶内小心加水,直到液面接近刻度1﹣2cm处 (3)下列配制的溶液浓度偏低的是; A、称量NaOH时,砝码错放在左盘 B、向容量瓶中转移溶液时(实验步骤C)不慎有液滴洒在容量瓶外面 C、加蒸馏水时不慎超过了刻度线 D、定容时俯视刻度线
第五单元常见的酸和碱 第一节生活中的酸和碱 一.溶液酸碱性 1.酸:电离时生成的阳离子全部是氢离子的化合物。H2SO4=2 H++SO42-;HCl= H++Cl-;HNO3= H++NO3-。一般命名为“某酸” 2.碱:电离时生成的阴离子全部是氢氧根离子的化合物。NaOH=Na++OH-;Ca(OH)2=Ca2++2OH-。一般命名为“氢氧化某”。 3.酸性溶液:含大量氢离子(H+)的溶液,有酸味。如食醋、柠檬汁、西红柿等 4.碱性溶液:含大量氢氧根离子(OH-)的溶液,有滑腻感和涩味。如肥皂、洗衣粉等洗涤剂 5.中性溶液:〔H+〕浓度和〔OH-〕浓度相等,溶液既不显酸性也不显碱性。如食盐氯化钠溶液,蔗糖溶液等 【知识解读】 (1)酸:①电离出的阳离子只有H+,电离出的阴离子叫做酸根,氯离子(Cl-)又叫盐酸根;②酸是由H+和酸根阴离子构成的;③酸一般命名为“xx酸”:H2SO4-硫酸;HCl-盐酸;HNO3-硝酸。 (2)碱:①电离出的阴离子只有OH-,叫做氢氧根离子;②碱是由金属阳离子和OH-离子构成的;③碱一般命名为“氢氧化x”。NaOH-氢氧化钠;Ca(OH)2-氢氧化钙;Cu(OH)2-氢氧化铜。 (3)酸(碱)的溶液,一定显酸(碱)性;但是,酸(碱)性的溶液不一定是酸(碱)的溶液。如纯碱碳酸氢钠的溶液显碱性,但是纯碱不是碱而是盐。 二.溶液酸碱性的检验 1.尝味道:有酸味的溶液显酸性;有滑腻感和涩味的溶液显碱性。 注意:只能用于鉴别生活中的可食用的物质, 2.酸碱指示剂 (1)酸碱指示剂:能检验溶液酸碱性的试液。常用的酸碱指示剂有石蕊和酚酞。 (2)紫色石蕊试液遇酸变红,遇碱变蓝,中性不变色仍为紫色; 无色酚酞试液遇酸和中性不变色仍为无色,遇碱变为红色。 注意:酸碱指示剂变色的原因,是因为酸碱指示剂与酸(或碱)电离出的H+(或OH-)发生作用,导致其存在的形式发生了变化,而出现指示剂的颜色变化。所以,①溶液变色时酸碱指示剂变色,而不是酸或碱变色;②不是所有的酸或碱都能使酸碱指示剂变色。只有溶解后能电离出H+(或OH-)的酸或碱的溶液,才能使酸碱指示剂变色;不溶性酸或碱,不能使酸碱指示剂变色。 3.石蕊试纸 蓝色石蕊试纸专用于检测酸性溶液(遇酸变红) 红色石蕊试纸专用于检测碱性溶液(遇碱变蓝)。 注意:①不能将石蕊试纸直接浸入待测液中测量。否则,会污染待测液;②测试前,不能用蒸馏水将石蕊试纸润湿,否则,所测得溶液的酸碱性要偏弱。 三.酸碱度 1.酸碱度:溶液酸碱性的强弱程度 2.表示方法:溶液的酸碱度通常用pH表示(p表示负对数,H表示H+浓度) (1)pH的取值范围:0—14 (2)pH值与溶液酸碱性的关系 ①pH<7的——酸性 pH=7的——中性
配制一定物质的量浓度溶液 编稿:宋杰责编:闫玲玲 【学习目标】 1.掌握一定物质的量浓度溶液的配制方法和应用; 2.了解容量瓶使用注意事项; 3.配制一定物质的量浓度溶液的误差分析。 【要点梳理】 要点一、一定物质的量浓度溶液配制的注意事项 由固体配制溶液(需确定溶质的质量)和由浓溶液配制稀溶液(需确定要量取的浓溶液体积)。整个过程可细化为八个步骤:计算、称量、溶解或稀释、转移、洗涤、转移、定容、摇匀。 1.仪器通常有: 容量瓶(注意规格)、托盘天平(固体配制溶液)或滴定管(用浓溶液配制稀溶液)、量筒(用于量取溶剂)、烧杯(溶解)、玻璃棒(搅拌、引流)、胶头滴管(用于定容)、药匙(溶质是固体时使用)。 2.容量瓶为细颈、梨形玻璃容器,带有磨口玻璃塞。 容量瓶上标有刻度线、适用温度、容量。使用前一定要检查容量瓶是否漏液,方法是:向瓶内加一定量水,塞好瓶塞,用左手食指顶住瓶塞,右手托住瓶底,将容量瓶倒置,看是否有水漏出。如不漏水,再将瓶塞旋转180°,重复上述操作,两次均不漏水的容量瓶才能使用。 3.注意事项: (1)称量时一般用托盘天平,量取时一般用量筒,它们只能准确到小数点后一位(0.1 g或0.1 mL),因此计算所用溶质的质量或体积时保留到小数点后一位。 (2)称量时左物右码,有吸湿性和腐蚀性的药品放在烧杯中快速称量;用量筒量取的液体倒入烧杯后,量筒内壁附着的溶质不要洗涤到烧杯中。 (3)溶解时一般先在烧杯中加入溶质,后加溶剂进行溶解。浓硫酸的稀释一定要注意将浓硫酸沿烧杯内壁慢慢倒入水中,且边加边用玻璃棒搅拌。 (4)配制一定物质的量浓度的溶液,是将一定质量或体积的溶质按溶液的体积在选定的容量瓶中定容,因而完全不需要计算水的用量。 (5)不能配制任意体积的溶液,因为配制过程中是用容量瓶来定容的,而容量瓶的规格又是特定值。常用容量瓶的规格有100 mL、250 mL、500 mL、1000 mL等。 (6)不能用容量瓶溶解、稀释或久贮溶液(尤其碱性溶液),更不可在容量瓶中进行化学反应。配制完溶液后,应将溶液倒入干燥、洁净的试剂瓶中。 (7)溶液注入容量瓶前要使其温度恢复到室温,这是因为热的溶液转入容量瓶会使所配的溶液的体积偏小(玻璃的膨胀系数小于液体),所配溶液浓度偏大。 (8)溶液转移至容量瓶时,要用玻璃棒引流,并用蒸馏水洗涤烧杯及玻璃棒(上面粘有少量溶质)2~3次,将洗涤液移入容量瓶。 (9)当容量瓶中液面上升到离刻度线1~2 cm处,要改用胶头滴管加入蒸馏水,防止液面超过刻度线。若加水定容时超过刻度线,必须重新配制。 (10)定容后的溶液要注意反复摇匀。静置后若发现液面下降,稍低于标线,不要再加蒸馏水,否则会引起结果偏低。如果摇匀后洒出几滴,溶液的浓度不变。
第十单元酸和碱 课时1 常见的酸和碱 1、食醋中含有的属于酸。石灰水中含有的、炉具清洁剂中含有的都属于碱。 2、二氧化碳通入紫色石蕊试液后变成色,原因是(写化学方程式)。 3、3、填写下表 一、常见的酸 (一)知识要点 1、几种常见的酸:盐酸、硫酸的物理性质与用途 2、浓硫酸的腐蚀性、浓硫酸的稀释 3、酸的化学性质 (二)配备练习 1、下列溶液,能使无色酚酞试液变红的是() A、石灰水 B、氢氧化钠溶液 C、食醋 D、汽水 2、现有NaOH 溶液、稀硫酸、蒸馏水,若将它们一次鉴别出来,可选用的试剂是() A、无色酚酞试液 B、紫色石蕊试液 C、稀盐酸 D、Na2CO3溶液 3、下列有关盐酸的叙述中错误的是() A、浓盐酸是有刺激性气味的液体 B、浓盐酸具有挥发性,在空气中会形成白烟 C、人的胃液中含有少量盐酸,可帮助消化 D、盐酸是氯化氢气体的水溶液 4、下列用途中盐酸和硫酸都具有的是() A、金属表面除锈 B、生产化肥 C、制火药 D、干燥剂 5、在4个小烧杯里分别盛有等质量的下列物质,在空气中放置一段时间后,烧杯内物质的总质量显著增加且溶质质量分数减小的是() A、浓盐酸 B、浓硫酸 C、石灰水 D、蔗糖溶液
6、将浓硫酸滴在滤纸上,滤纸很快变黑。这说明浓硫酸具有的特性是() A、酸性B、吸水性C、脱水性D、氧化性 7、小明想除去自己白衬衫上的铁锈痕迹,在用清水洗涤前,他从家中选择的最合适的物质是 A.汽油B.食盐水C.白醋D.红醋 8、等质量的锌分别与足量的稀盐酸、稀硫酸充分反应,产生氢气的质量关系是() A、相等 B、与稀盐酸反应的多 C、与稀硫酸反应的多 D、不能确定 9、下列溶液跟铁片充分反应后,所得溶液质量比反应前溶液质量减轻的是() A、稀盐酸 B、稀硫酸 C、FeSO4 溶液 D、CuSO4溶液 10、酒厂用发酵法生产白酒时,需加入适量硫酸来控制酸度,发酵完成后进行蒸馏,即可得到白酒,但不能用盐酸代替硫酸,因为。 (三)链接中考与竞赛 1、(02·北京西城区中考)下列物质中,属于碱的是( ) A、Ca(OH)2 B、Cu2(OH)2CO3 C、C2H5OH D、Na2CO3 2、(03·江苏省预赛)20世纪初,一些化学家提出了酸碱质子理论。这种理论认为,凡能放出质子(H+)的分子或离子都是酸;凡能结合质子的分子或离子都是碱。根据这一理论,下列物质中不属于碱的是 A、HNO3 B、HCO3– C、NH4+ D、SO42- 3、下列物质中可除去二氧化碳中的水蒸气的是() A、浓硫酸 B、稀硫酸 C、浓盐酸 D、石灰水 4、(03·全国复赛)50g镁、锌、铁的混合物与足量的稀硫酸反应得到混合溶液,蒸发后得到218g固体(已 换算成硫酸盐),则反应生成氢气的质量( ) A、2g B、3g C、3.5g D、4.5g 5、(04·四川中考)胃溃疡严重的病人的胃酸(盐酸)过多,可内服含有能跟盐酸起反应的物质成分的胃药,减少胃中盐酸的含量而又不造成胃穿孔。下列物质中,最适宜作为胃药成分的是()A.CuCO3B.Al(OH)3C.NaHCO3D.Ca(OH)2 6、在杠杆的两端分别挂着质量和体积都相同的铁球和铝球,这时杠杆平衡。将 两球分别浸泡在质量相同、溶质的质量分数也相同的稀硫酸中(如右图),直至 两个烧杯中均没有气泡产生为止。两球的外形变化不大且无孔洞出现。下列推测 中,正确的是() A、铁球一定是空心的 B、拿掉烧杯后,杠杆仍然平衡(金属球上附着的液体忽略不计,下同)
密度溶质的质量分数氢氧化钠溶液的浓度 密度(20℃ )g/cm3 NaOH的质量分数/(g/100g溶液) 物质的量浓度(mol/L) 1 0.159 0.0393 1.0050.6020.151 1.01 1.0450.264 1.015 1.490.378 1.02 1.940.494 1.025 2.390.611 1.03 2.840.731 1.035 3.290.851 1.04 3.7450.971 1.045 4.2 1.097 1.05 4.655 1.222 1.055 5.11 1.347 1.06 5.56 1.474 1.065 6.02 1.602 1.07 6.47 1.731 1.075 6.93 1.862 1.087.38 1.992 1.0857.83 2.123 1.098.28 2.257 1.0958.74 2.391 1.19.19 2.527 1.1059.645 2.664 1.1110.1 2.802 1.11510.555 2.942 1.1211.01 3.082 1.12511.46 3.224 1.1311.92 3.367 1.1351 2.37 3.51 1.141 2.83 3.655 1.14513.28 3.801 1.1513.73 3.947 1.15514.18 4.095 1.1614.64 4.244 1.16515.09 4.395 1.1715.54 4.545 1.17515.99 4.697 1.1816.44 4.85 1.18516.89 5.004 1.1917.345 5.16 1.19517.8 5.317
初中化学配制一定物质的量浓度溶液练习 题 【巩固练习】 一.选择题(每小题有1-2个选项符合题意) 1.下列说法中,正确的是( )。 A .1 L 水中溶解了40 g NaOH 后,所得溶液浓度为1 mol/L B .从1 L 2 mol/L 的NaCl 溶液中取出0.5 L ,该溶液的浓度为1 mol/L C .将标准状况下的HCl 气体2.24 L 通入水中制成100 mL 溶液,所得溶液的物质的量浓度为1 mol/L D .配制1 L 0.2 mol/L 的CuSO 4溶液,需用25 g 胆矾 2.(2017秋?启东市校级月考)下列实验操作中,所用仪器合理的是( ) A .在蒸发皿中放入NaCl 溶液,加热、蒸发得到NaCl 晶体 B .用10 mL 的量筒量取5.2 mL 的盐酸 C .用托盘天平称取25.20 g NaCl D .用1 000 mL 容量瓶配制450 mL 0.1 mol?L ﹣1的盐酸 3.(2016 广西南宁八中期末考)实验室中需要配制2mol/L 的NaCl 溶液950mL ,配制时应选用的容量瓶的规格和称取的NaCl 质量分别是( )。 A . 950 mL ,111.2 g B . 500 mL ,117 g C . 1 000 mL ,117 g D . 任意规格,111.2 g 4.用已准确称量过的氯化钠固体配制1.00mol ?L ﹣1 的氯化钠溶液0.5L ,要用到的仪器是( )。 ①500mL 容量瓶 ②试管 ③烧瓶 ④胶头滴管 ⑤烧杯 ⑥玻璃棒 ⑦托盘天平 ⑧药匙. A . ①④⑤⑥⑦⑧ B . ①②④⑤ C . ①④⑤⑥ D .全部 5.等质量的CuO 和MgO 粉末分别溶于相同体积的硝酸中,得到的Cu(NO 3)2和Mg(NO 3)2溶液的浓度分别为a mol·L —1和 b mol·L —1,则a 与b 的关系为( )。 A .a =b B. a =2b C. 2a =b D. a =5b 6.某温度下100 g 饱和氯化钠溶液中含有氯化钠26.5 g 。若向此溶液中添加3.5 g 氯化钠和 6.5 g 水,则所得溶液的溶质质量分数是( )。 A. 30% B. 5.61005.35.26++×100% C. 26.5% D. 5.35.61005.35.26+++×100% 7.(2016 河南省信阳市第一职业高中期中考)某温度下向100g 澄清的饱和石灰水中加入 5.6g 生石灰,充分反应后恢复到原来的温度。下列叙述正确的是 ( )。 A .沉淀物的质量为5.6g B .沉淀物的质量为7.4g
所谓的光辉岁月,并不是以后,闪耀的日子,而是无人问津时,你对梦想的偏执。《配制一定物质的量浓度的溶液》教案 教学目的: 知识目标 1、使学生初步学会配制一定物质的量浓度溶液的方法。 2、进一步学会容量瓶的使用。 能力目标: 培养学生以事实为依据,分析解决实际问题的能力。 态度目标: 1、培养学生实事求是的精神。 2、培养学生精诚合作的态度。 教学重难点: 1、一定物质的量浓度溶液的配制方法。 2、误差分析 教学方法: 对比教学法,演示实验法,多媒体教学 仪器药品: 容量瓶(150毫升)烧杯(100毫升)玻璃棒胶头滴管药匙滤纸托盘天平 NaCl(固体)蒸馏水 教学过程: 一、复习提问: 如何配制100g质量分数为5%的NaCl溶液?计算溶质的质量和量取水的体积。用天平称量5gNaCl。用量筒量取95mL水。在烧杯中溶解(把水的密度近似看作1g/cm3)。 [引言]如何配制一定物质的量浓度的溶液?
所谓的光辉岁月,并不是以后,闪耀的日子,而是无人问津时,你对梦想的偏执。[复习思考] 物质的量浓度计算公式是: C B = n B / V 二、一定物质的量浓度溶液的配制 在实验室用NaCl固体配制250mL0.1mol/L NaCl溶液 ∵n(NaCl)=c(NaCl) ×V(NaCl) =0.1mol/L×0.25L=0.025mol ∴m(NaCl)=n(NaCl) ×M(NaCl) =0.025mol×58.5g/mol=1.46g [学生活动]计算氯化钠质量,熟悉演示实验[3-1] [详细讲解] 配制一定物质的量浓度的溶液步骤 ?计算: NaCl的质量 ?称量:(复习天平的使用) ?溶解:在烧杯中用100毫升蒸馏水使之完全溶解(注意:应冷却,不可在容量瓶中溶解,为什么?) ?转移:移入250mL容量瓶。(需要使用到什么仪器?) ?洗涤:洗涤烧杯和玻璃棒两至三次。(思考:为什么?)?定容:加水到接近刻度1-2厘米时,改用胶头滴管加水到刻度。(为什么?) ?摇匀、贮存:存放于试剂瓶。(溶液能否保持在容量瓶中?)[模拟实验]
实验二酸碱标准溶液的配制与浓度比较 一、实验目的 1.巩固滴定管的使用,学习移液管的使用方法。 2.掌握NaOH、HCI标准溶液的配制、浓度的比较滴定。 3.初步掌握半滴操作与用甲基橙、酚酞指示剂确定终点的方法。 4.掌握滴定结果的数据记录与数据处理方法。 二、实验原理 酸碱滴定中常用盐酸与氢氧化钠溶液作为标准溶液。但由于浓盐酸易挥发,氢氧化钠易吸收空气中的水份与二氧化碳,不符合直接法配制的条件,因此只能用间接法配制盐酸与氢氧化钠标准溶液:即先配制近似浓度的溶液,然后用基准物质标定其准确浓度。也可用酸碱溶液中已知其中之一的准确浓度,通过滴定得到它们的体积比,然后根据它们的体积比求得另一标准溶液的准确浓度。 强酸与强碱相互滴定,其pH突跃范围为4、30~9、70 (化学计量点时pH=7、00),因此甲基橙(3、1~4、4)、甲基红(4、4~6、2)、中性红(6、8~8、0)、酚酞(8、0~9、6)等指示剂都可指示终点。当指示剂一定时,用一定浓度的HCl与NaOH 相互滴定,指示剂变色时,所消耗的体积比V HCl/V NaOH不变,与被滴定溶液的体积无关。借此可检验滴定操作技术与判断终点的能力。 三、主要试剂与仪器 1、HCI溶液:6mol、L-1。 2、固体NaOH 。 3、甲基橙指示剂:1g、L-1。 4、酚酞指示剂:1g、L-1 90%乙醇溶液。 5、500 ml试剂瓶2个(一个带玻璃塞, 另一个带橡胶塞)。 6.酸、碱滴定管(50ml),锥形瓶等 四、实验步骤 1、0、1 mol、L-1HCl溶液(500ml)的配制 用10 ml的洁净量筒量取约6 mol、L-1HCl ml,倒入盛有400 ml水的试剂瓶中,加蒸馏水至500 ml,盖上玻璃塞,充分摇匀。 2、0、1mol、L-1NaOH溶液( 500ml)的配制
质量分数-摩尔浓度换算 溶液质量分数-摩尔浓度换算公式: C=10ρW M C代表溶液摩尔浓度,ρ代表溶液密度,W%代表溶液质量分数,M代表溶质相对分子质量。
密度ρ(g/ml) 质量分数W(%) 摩尔浓度C(mol/L) 密度ρ(g/ml) 质量分数W(%) 摩尔浓度C(mol/L) 1 0.4 0.11 1.100 20.4 6.15 1.005 1.4 0.39 1.105 21.4 6.48 1.010 2.4 0.66 1.110 22.3 6.78 1.015 3.4 0.95 1.115 23.3 7.12 1.020 4.4 1.23 1.120 24.2 7.43 1.025 5.4 1.52 1.125 25.2 7.77 1.030 6.4 1.81 1.130 26.2 8.11 1.035 7.5 2.13 1.135 27.2 8.46 1.040 8.5 2.42 1.140 28.2 8.81 1.045 9.5 2.72 1.145 29.2 9.16 1.050 10.5 3.02 1.150 31.2 9.52 1.055 11.5 3.32 1.155 31.2 9.87 1.060 1 2.5 3.63 1.160 32.2 10.23 1.065 13.5 3.94 1.165 33.2 10.60 1.070 14.5 4.25 1.170 34.2 10.96 1.075 15.5 4.57 1.175 35.2 11.33 1.080 16.5 4.88 1.180 36.2 11.70 1.085 17.4 5.17 1.185 37.2 1 2.08 1.090 18.4 5.49 1.190 38.3 1 2.49 1.095 19.4 5.82 1.195 39.4 1 2.90
(实验预习报告样板) 实验滴定操作练习及酸碱溶液浓度比较 一、实验目的 1. 掌握标准溶液的两种配制方法; 2. 熟悉甲基橙和酚酞指示剂的使用和终点的颜色变化; 3. 学习正确记录数据和结果处理的方法 二、原理 标准溶液一般有两种方法配制:直接配制法、间接配制法。 本实验是用间接法配制酸碱标准溶液。 反应方程式: HCl + NaOH →NaCl +H2O 以酚酞或甲基橙为指示剂,指示滴定终点的到达。 三、实验内容 1. 0.1mo1·L-1HCl溶液的配制 量取浓盐酸,倾入洗净的溶液瓶中,用蒸馏水稀释到500mL,摇匀,贴上标签。 2. 0.1mo1·L-1NaOH溶液的配制 用小烧杯称取固体NaOH 4g,加蒸馏水使NaOH全部溶解后倾入洗净的溶液瓶中,用蒸馏水稀释至1000mL,以橡皮塞塞住瓶口,充分摇匀,贴上标签。 3. 酸碱标准溶液浓度的比较 操作步骤: (1)酚酞作指示剂 自滴定管放出20~·L-1 HCl于锥形瓶 1 ???→ 滴酚酞-1 0.1mo1L NaOH ? ??????→ 滴定 终 点(粉红色),半分钟不褪色。 平行滴定3份,计算每份滴定V HCl/V NaOH,并求出其相对平均偏差。 (2)甲基橙作指示剂 放出约20~30mL ·L-1NaOH于锥形瓶 1 ????→ 滴甲基橙-1 0.1mo1L HCl ? ??????→ 滴定 终点 (橙黄色),半分钟不褪色。计算V HCl/V NaOH。
四、数据记录和结果处理 (注:表格不要分页) 1. 酸碱标准溶液浓度的比较(以酚酞作指示剂) 相对平均偏差计算式: 123100%3x x x x x x x -+-+-= ??相对平均偏差 (正式报告必须包括下面内容,但预习报告中不需要写) 五、讨论和思考题 要求:对本次实验进行结果讨论或自选2题实验书上的思考题。