
蛋白类药物生产工艺
蛋白质类药物是生化药物中非常活跃的一个领域,目前的生化产品主要是从动物脏器或组织包括人的血液中分离而得。20世纪70年代后,人们开始应用基因工程技术生产一些蛋白质药物,已实现工业化生产的产品如胰岛素、干扰素、白细胞介素、生长素、EPO、tPA、TNF等,现正从微生物和动物细胞的表达转向基因动植物发展。
第一节主要蛋白质类药物的制备
蛋白质类药物主要包括蛋白质类激素、蛋白质细胞生长调节因子、血浆蛋白质类、黏蛋白、胶原蛋白及蛋白酶抑制剂等,其作用方式包括对机体各系统和细胞生长的调节、被动免疫、替代疗法等。
一、蛋白质激素类
蛋白质类激素主要包括垂体蛋白质激素、促性腺激素和其他蛋白质激素。其中垂体蛋白质激素包括生长素(GH)、催乳激素(PRL)、促甲状腺素(TSH)、促卵泡激素(FSH)等。促性腺激素包括人绒毛膜促性腺激素(HCG)、血清促性腺激素( SGH )等。其他蛋白质激素包括胰岛素、胰抗脂肝素、尿抑胃素等。
(一) 生长素(growthhormone,GH)
生长素是动物脑垂体前叶外侧的特异分泌细胞分泌的一种促进生长的蛋白质激素,具有调节生长与发育的功能,对多种人类疾病有很好的疗效。
人生长素(human growth hormone,hGH)由一条191个氨基酸的多肽构成的一链多肽的球形蛋白质,分子中含两条二硫键,分子量为21700,等电点4.9,沉降系数S20
2.179,
,W
其活性不需要整个分子结构,N端1~134氨基酸为活性所必需,C端的肽链起到保护作用,其化学结构与催乳素近似,故生长素有弱催乳素作用,而催乳素有弱生长素作用。生长素包含大小两个环,以亲水球蛋白的形式存在。不同种类动物的生长素,其化学结构与免疫
264
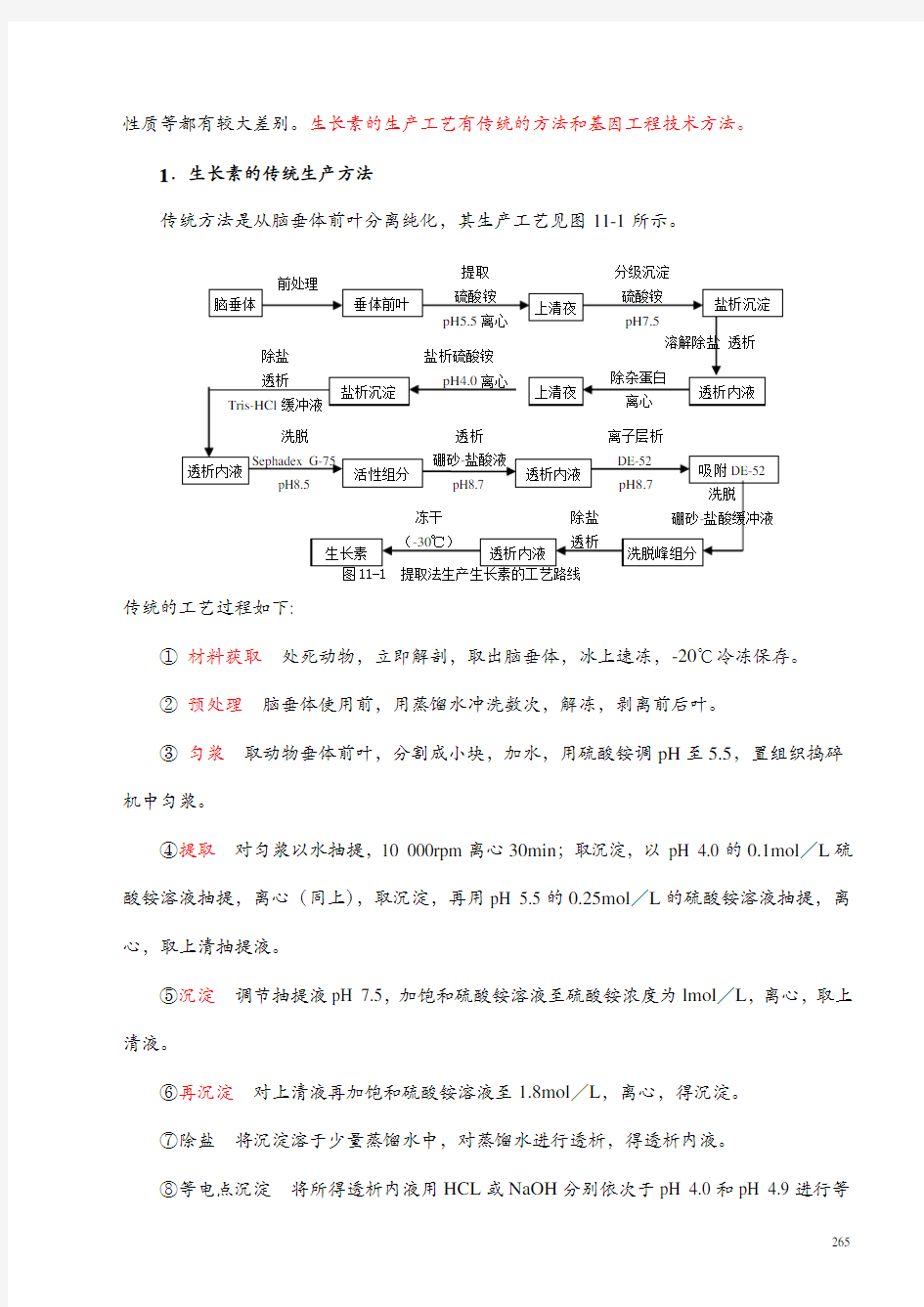
性质等都有较大差别。生长素的生产工艺有传统的方法和基因工程技术方法。
1.生长素的传统生产方法
传统方法是从脑垂体前叶分离纯化,其生产工艺见图11-1所示。
提取分级沉淀
传统的工艺过程如下:
①材料获取处死动物,立即解剖,取出脑垂体,冰上速冻,-20℃冷冻保存。
②预处理脑垂体使用前,用蒸馏水冲洗数次,解冻,剥离前后叶。
③匀浆取动物垂体前叶,分割成小块,加水,用硫酸铵调pH至5.5,臵组织捣碎机中匀浆。
④提取对匀浆以水抽提,10 000rpm离心30min;取沉淀,以pH 4.0的0.1mol/L硫酸铵溶液抽提,离心(同上),取沉淀,再用pH 5.5的0.25mol/L的硫酸铵溶液抽提,离心,取上清抽提液。
⑤沉淀调节抽提液pH 7.5,加饱和硫酸铵溶液至硫酸铵浓度为lmol/L,离心,取上清液。
⑥再沉淀对上清液再加饱和硫酸铵溶液至1.8mol/L,离心,得沉淀。
⑦除盐将沉淀溶于少量蒸馏水中,对蒸馏水进行透析,得透析内液。
⑧等电点沉淀将所得透析内液用HCL或NaOH分别依次于pH 4.0和pH 4.9进行等
265
电点沉淀以除去杂蛋白,离心、取上清液。
⑨盐析调上清液pH为4.0,加饱和硫酸铵溶液至浓度为1.25mol/L盐析,离心,得沉淀物。
⑩除盐将沉淀物溶于少量蒸馏水中,对含0.1mol/L氯化钠的Tris-HCL (pH 8.5) 缓冲溶液进行透析,得透析内液。
⑩凝胶过滤透析内液上Sephades G-75凝胶柱,用含0.1 mol/L氯化钠的50mmol/L Tris-HCL (pH 8.5 )缓冲溶液进行洗脱,分步收集,活性GH存在于第Ⅱ峰中。
⑩透析将活性峰部分对6.5mmol/L的硼砂-盐酸(pH 8.7)缓冲溶液进行透析,得透析内液。
⑩层析将透析内液上DEAE-C(DE-52)柱,用含0~0.3mol/L氯化钠的6.5mmol/L 硼砂-盐酸( pH 8.0 ) 缓冲溶液进行梯度洗脱,合并活性峰,脱盐,冻干得GH。
2.人生长素的基因工程法
hGH的种属特异性很强,动物生长激素不能用于人,所以开始时hGH的惟一来源是从人尸体的脑垂体中取得,来源困难,价格昂贵,应用受到限制。目前已利用基因工程技术生产出hGH,美国的Genentech公司利用枯草杆菌系统表达的hGH产量高达1.5g/L,这也是第一代重组人生长激素,商品名称为Protropin.
生产路线如图11-2所示。
图11-2 利用基因工程菌生产生长素的工艺路线()
(1)工艺过程如下:
266
①工程菌的构建利用基因工程技术构建高效分泌型基因工程菌株,在生长激素的N-端增加分泌信号肽序列,使表达合成的重组人生长激素结构和天然人生长激素完全一致。
②菌种繁殖采用M9培养基,添加CAA(酪蛋白氨基酸),调节pH 至7.0,臵于摇床上,30℃,进行菌种培养繁殖。
③发酵培养基同菌种繁殖培养基,种子培养过夜,开始进行发酵,时间一般为16~18h,温度为37℃,pH7.0~7.5,溶解氧不能低于20%。
④补料发酵在发酵进行5~7 h后,需要适量补充葡萄糖、酵母浸出物、氮源、CAA、无机盐和微量无素,如PO43-、Fe2-、Co2-等离子,通过添加补料,可使菌体生长的对数期延,发酵菌体产量增加了一倍。其余的发酵条件与上述条件相同,菌体生长至稳定期放罐。。
⑤离心将发酵菌体进行冻融破碎,按一定比例,加入预冷的由10 mmol/L Tris和1mmol/L EDTA组成的缓冲溶液(pH 7.5),80rpm搅拌1h,离心,收集上清液。
⑥粗提在上清液中加入硫酸铵至饱和浓度45%,4℃放臵2h,10000rpm离心30min,收集沉淀。
⑦脱盐沉淀用10 mmol/L Tris和1mmol/LEDTA组成的pH值为8.0的缓冲溶液溶解,用Sephadex -G25脱盐。
⑧纯化采用Phenyl-Sepharose,DEAE-Sepharose进行色谱,再加入固体硫酸铵达到饱和浓度45%,沉淀2h,离心,收集沉淀,溶解沉淀,再通过sephacryl S-11HR及DEAE-Sepharose进行纯化,得到人生长激素原料药半成品.。
(2)质量检验:质量必须符合<中华人民共和国药典>2005年版二部附录规定。
目前,人和动物生长素基因都已在大肠杆菌中表达成功,重组人生长激素将会得到大规模的生产,从而造福人类。
(二) 胰岛素( insulin )
胰岛素是胰脏中胰岛β细胞分泌的一种蛋白质激素,它是促进合成代谢的激素,在调
267
节机体糖代谢、脂肪代谢、核蛋白质代谢方面都有重要作用,是维持血糖在正常水平的主要激素之一。广泛存在于人和动物的胰脏中,正常人的胰脏约含有200万个胰岛,占胰脏总质量的1.5%。胰岛由α、β和δ三种细胞组成,其中α细胞制造胰高血糖素和胰抗脂肝素,β细胞制造胰岛素,δ细胞制造生长激素抑制因子。胰岛素在β细胞中开始时是以活性很弱的前体胰岛素原存在,进而分解为胰岛素进入血液循环,能使血糖降低,起到调节血糖作用。临床上主要用于治疗胰岛素依赖性糖尿病及糖尿病昏迷和酮症酸中毒、精神分裂症、休克等。
胰岛素由A、B两条链组成,A链含21个氨基酸残基,B链含30个氨基酸残基,两链之间由两个二硫键相连,在A链内部含有一个二硫键。不同种属动物的胰岛素分子结构大致相同,主要差别在A链二硫桥中间的第8位、9位和10位上的三个氨基酸及B链C末端的一个氨基酸上,随种属而异,但其生理功能是相同的。生产胰岛素的方法较多,有传统的方法和基因工程技术方法。
1.动物胰脏制胰岛素
由动物胰脏生产胰岛素的方法较多,目前被普遍采用的是酸醇法和锌沉淀法。现以酸醇法为例,介绍胰岛素的生产工艺。其工艺路线如图11-3所示。
提取碱化
图11-3 酸醇法生产胰岛素的工艺路线
(1)工艺过程如下:
268
①提取冻胰块用刨胰机刨碎,加入2.3~2.6倍的86%~88%乙醇(质量分数)和5%草酸,在12±2℃搅拌提取3h,离心。滤渣再用1倍量68%~70%乙醇和0.4%草酸提取2h,离心,合并乙醇提取液。沉淀用于回收胰岛素。
②碱化、酸化边搅拌提取液边加入浓氨水调pH 8.0~8.4 (12±2℃),立即过滤,除去碱性蛋白,滤液应澄清,并及时用硫酸酸化至pH 3.6~3.8,降温至5℃,静臵4h以上,使酸性蛋白充分沉淀。
③减压浓缩吸取上清液至减压浓缩锅内,下层用帆布过滤,沉淀物弃去,取上清液,30℃以下减压蒸去乙醇,浓缩至浓缩液相对密度为1.04~1.06 (约为原体积的1/10~1/9为止)。
④去脂、盐析浓缩液转入去脂锅内,5min内加热至50℃后,立即用冰盐水降温至5℃,静臵3~4h,分离下层清液(脂层用于回收胰岛素)。用盐酸调pH 2.3~2.5,于22±2℃搅拌加入27%(质量体积分数)固体氯化钠,保温静臵数小时。析出物即为胰岛素粗品。
⑤精制盐析物按干重计算,加入7倍量蒸馏水溶解,再加入3倍量的冷丙酮,用4mol/L氨水调pH 4.2~4.3,然后补加丙酮,使溶液中水和丙酮的比例为7∶3。充分搅拌后,低温5℃以下放臵过夜,次日在低温下离心分离,取上清夜,在上清夜中加入4mol/L 氨水使pH 6.2~6.4,加入3.6%(体积分数)的醋酸锌溶液(浓度为20%),再用4mol/L氨水调节pH 6.0,低温放臵过夜,次日过滤,分离沉淀。
⑥结晶将沉淀用冷丙酮洗涤,得干品,再按干品质量每克加冷2%柠檬酸50mL、
6.5%醋酸锌溶液2mL、丙酮16mL,并用冰水稀释至100mL,使其充分溶解,5℃以下,用4mol/L氨水调pH 8.0,迅速过滤。滤液立即用10%柠檬酸溶液调pH 6.0,补加丙酮,使整个溶液体系保持丙酮含量为16%。慢速搅拌3~5h使结晶析出。在显微镜下观察,外形为正方形或扁斜形六面体结晶,再转入5℃左右低温室放臵3~4d,使结晶完全。离心收集结晶,并小心刷去上层灰黄色无定形沉淀,用蒸馏水或醋酸铵缓冲液洗涤,再用丙酮、乙
269
醚脱水,离心后,在五氧化二磷真空干燥箱中干燥,即得结晶胰岛素。
(2)质量检验测定胰岛素效价,各国药典规定有家兔血糖降低法和小鼠血糖降低法。
(3)在整个生产过程中,为提高胰岛素的质量和产量,应注意以下几个方面:
①胰脏质量是胰岛素生产中的关键,在我国是一个薄弱环节。工业生产用的原料主要是猪、牛的胰脏。不同种类和年龄的动物,其胰脏中胰岛素量有所差别,牛胰含量一般高于猪胰。采摘胰脏要注意保持腺体组织的完整,避免摘断,并且离体后要立即深冻,先在-30℃以下急冻后转入-20℃保存备用,如用液氮速冻,效果更好。在胰脏中,胰尾部分胰岛素含量较高,如单独使用可提高收率10%。
②浓缩浓缩工序的条件,对胰岛素收率影响很大。如采用离心薄膜蒸发器,在第一次浓缩后,浓缩液用有机溶剂去脂,再进行第二次浓缩,被浓缩溶液受热时间极短,避免了胰岛素效价的损失。
③产品纯度在常规的结晶胰岛素中,除了胰岛素主成分外,还含有其他一些杂蛋白抗原成份,如胰岛素原、精氨酸胰岛素、胰多肽等。因此要对结晶胰岛素进一步纯化,胰岛素原的含量显著降低。
2.人胰岛素的制备
(1)酶促半合成法
猪与人的胰岛素差别仅是B30位上的一个氨基酸,猪的是丙氨酸,人的则是苏氨酸。利用胰蛋白酶的转酰胺作用,将猪胰岛素转化为人胰岛素B30苏氨酸(丁酰基)丁酸,通过硅胶柱层析,然后用三氟乙酸处理,断裂保护基团,再用离子交换层析纯化,得到高纯度人胰岛素。
(2)利用基因工程技术制备
目前,国际上生产医用重组人胰岛素( recombinant human insulin, rhI)的方法主要有3种:
1)用基因工程大肠杆菌( Escherichia coli, E.coli)分别发酵生产人胰岛素( human insulin,
270
hI)的A、B链。然后经化学再氧化法,使两条链在一定条件下重新形成二硫键,得到hI。这一方法缺点较多,目前已较少使用。
2)用基因工程E. coli发酵生产人胰岛素原( human proinsulin, hP I) ,后经加工形成h I。这种方法,E. coli系统表达量高,但缺点是不利于表达hI这样的小蛋白,产物易降解,故常采用融和蛋白形式将hPI连接在一个较大的蛋白质后,表达产物需经过一系列复杂的后加工才能形成有活性的hI。
3)通过基因工程酵母菌发酵生产hP I,经后加工形成hI。酵母系统下游后加工比细菌表达系统简单,但缺点是生产慢,生产周期长,且重组蛋白分泌量少(1~50 mg/L) ,产量低。
工艺生产过程见图11-4。
①菌种
RRhP I/pQE-40 E.coli M15菌株
②培养基
培养基组成为:5g/L 胰蛋白胨,2g/L谷氨酸,7g/L酵母浸膏,0.5 g/L硫酸铵, 2.5 g/L葡萄糖, 2.7 g/L甘油,100mg/L 氨苄青霉素, 50mg/L卡那霉素, pH 7.2。
③一次发酵
将10 ml经过活化的RRhP I/ pQE-40 E.coliM15转移至100 ml培养基中进行培养, 活化菌种。
④发酵罐培养
将一次发酵液转移至含有1.5 L 培养基的发酵罐中进行发酵罐培养(转速为300 r/min,通气量为1∶1. 5~1∶1.8) ,一段时间后加入一定量新鲜的培养基并用NaOH 调节pH。在对数生长中期加入0.5mmol /L IPTG并升温诱导RRhPI表达4 h,转速随即调为400~500 r /min,增大通气量至1∶1.8~1∶2.0,继续培养一段时间后,收集菌体。
⑤包涵体的收集和洗涤
271
将收集的湿菌体冻存于-20℃,然后悬浮于缓冲液A(50 mmol/L Tris-HCl, 0. 5 mmol/L EDTA,50 mmol/L NaCl, 5%甘油, 0.1~0.5 mmol/LDTT,pH7.9) ( 5~6 ml/g湿菌)中,加入溶菌酶( 5 mg/g湿菌体) ,室温或37℃振荡2 h。冰浴超声10 s×30次,其间每次间隔20 s,功率为200W。10℃条件下1000 g离心5 min去除细胞碎片。上清液中的包涵体( Inclusion body, IB)在4 ℃条件下27000 g离心15 min收集,然后用含2 mol/L 尿素的缓冲液A充分悬浮,室温静臵30 min后4 ℃条件下17000 g离心15 min,收集沉淀。沉淀再用含2%脱氧胆酸钠的缓冲液A充分悬浮, 4 ℃条件下17000 g离心15min,收集沉淀。最后沉淀用10 mmol/L Tris-HCl,pH
7.3洗涤两次(4℃,17000 g离心15 min ) 。
⑥ RRhPI的初步纯化
将收集的IB用含有0.1%~0.3%β-巯基乙醇的缓冲液B( 30 mmol/L Tris-HCl, 8 mol/L尿素, pH 8.0)溶解,上于已用缓冲液B平衡的DEAE-Sepharose FF柱,用合适的氯化钠梯度洗脱,收集含RRhPI的洗脱液。
⑦ RRhPI的重组复性
将初步纯化后的RRhPI通过Sephadex G-25脱尿素,转换缓冲液为不同pH的50 mmol/L Gly-NaOH重组液,或含有适量GSSG的Gly-NaOH缓冲液中,使蛋白终浓度为0.1~0.6 mg/ml,收集趋于正确折叠的RRhPI单体组分,加入适量GSH 和GSSG,4℃放臵24 h。
⑧酶切转化
向RRhPI复性液中加入一定量的胰蛋白酶和羧肽酶, 37℃酶切一段时间,然后用0.1 mol/L ZnCl2终止反应并沉淀生成的hI。
⑨ hI的纯化
将0.6g IB分别用含0.1%, 0.2%, 0.3%β-巯基乙醇的30 mmol/L Tris-HCl, 8 mol/L尿素, pH8.0 溶解,进行DEAE-Sepharose FF 离子交换层析,然后将收集得到的RRhPI组分通过Sephadex G-25脱尿素以使RRhPI复性。
272
图11-4 利用基因工程菌生产人胰岛素的工艺路线(仿自李晓红,2007)
二、蛋白质类细胞生长调节因子
蛋白质类细胞生长调节因子包括干扰素(IF)α、β,γ、白细胞介素1-18 (IL),神经生长因子(NGF)、肝细胞生长因子(HGF),血小板衍生的生长因子(PDGF),肿瘤坏死因子(TNF),集落刺激因子(CSF),组织纤溶酶原激活因子(t-PA),促红细胞生成素(EPO),骨发生蛋白(BMP)等。
(一) 干扰素(Interferon ,IFN)
干扰素指由干扰素诱生剂诱导有关生物细胞所产生的一类高活性、多功能的诱生蛋白质。这类诱生蛋白质从细胞中产生和释放之后,作用于相应的其它同种生物细胞,并使其获得抗病毒和抗肿瘤等多方面的“免疫力”,具有广泛的抗病毒、抗肿瘤和免疫调节活性的作用,是人体防御系统的重要组成。人干扰素根据其来源细胞不同,分为白细胞干扰素(IFN-α)、类淋巴细胞干扰素(IFN-α与IFN-β的混合物)、成纤维细胞干扰素(IFN-β)、T细胞干扰素(IFN-γ)等几类。按其抗原性的不同,分为α型、β型和γ型三种,同一型别,根据氨基酸序列的差异,又分为许多亚型,如常用的IFN-α包括IFN-αⅡa、IFN-αIb和IFN-αⅡb 等亚型。干扰素具有沉降率低,不能透析,可被胃蛋白酶、胰蛋白酶和木瓜蛋白酶破坏,不被DNase和RNase水解破坏等特性。
干扰素的生产方法有传统的体外诱生法和基因工程法。
1.传统的体外诱生法
传统的方法是通过体外诱生的方法获得干扰素。干扰素具有高度的种属特异性,临床使用的干扰素都用人的细胞制备,α-干扰素用人血白细胞或淋巴细胞制备;β-干扰素用人成
纤维细胞制备。目前我国已完善了利用血库血大量制备人血细胞干扰素的方法,达到106U
273
/mg蛋白的水平。其工艺路线见图11-5。
图11-5 诱生法生产干扰素的工艺路线
(1)工艺过程如下:
①分离灰黄层取新鲜血液400mL/份,加入ACD抗凝剂,离心,分离出血浆,小心抽取灰黄层。每份血可抽取13~15mL,放臵4℃冰箱中过夜。
②氯化铵处理每份灰黄层加入30mL缓冲盐水,再加入9倍体积量的0.83%冷氯化铵,混匀,4℃放臵10min,4℃离心(8000 r/min) 20min。弃上清液,加入适量缓冲盐水,收集沉淀细胞,制备悬浮液,重复上次处理,溶解残存的红细胞。取沉淀的白细胞悬于培养液中,冰浴保存,取样作活细胞计数。
③启动诱生于白细胞悬浮液加入白细胞干扰素,使其浓度为100μg/mL,37℃水浴搅拌培养2h。
④正式诱生启动后的白细胞加入仙台病毒(在10天龄鸡胚中培养48~72h,收获尿囊液)使其最后浓度为100~150血凝单位/mL,在37℃搅拌培养过夜。仙台病毒诱导人白细胞产生。
⑤收集将培养物离心(2500 r/min) 30min,吸取上清液即得粗制干扰素。
⑥纯化在粗制干扰素中加入硫氰化钾到0.5mol/L,用盐酸调pH为3.5,离心,得
274
沉淀l。沉淀1加入原体积1/5量的冷乙醇( 94%),离心,得上清液1。上清液1用盐酸调节pH 5.5,离心弃去沉淀,再调至pH 5.8,离心,得上清液2和沉淀2。沉淀2加入原体积1/50量的甘氨酸-盐酸缓冲液(pH 2)溶解,得IFNl。上清液2用NaOH调节pH值至8.0,离心,弃上清液,得沉淀3。沉淀3加原体积1/50量的0.lmol/L PBS和0. 5mol/L硫氰化钾(pH 8)溶解,pH值降至5.2,离心,得上清液3和沉淀4。沉淀4加原体积1/25000量pH 为8.0的0.1mol/L PBS溶解,调至pH为7~7.5,对PBS ( pH 7.3)透析,过夜,离心,收集上清液,检测,得IFN-β。调节上清液3 pH值为3.0,离心,得沉淀5。沉淀5加入原体积1/5000量的pH 8.0,0.1mol/L PBS,加NaOH调节pH 7~7.5,对PBS ( pH7.3)透析过夜,离心,收集上清液,检测,得IFN-α。
(2)质量检验我国用微量板染色的病变抑制法测定。国际上规定,能保护50%细胞免受病毒攻击的浓度即为一个IFN活性单位。
该法特点是一次纯化量大,回收率高于60%;经济,简便,易于普及,效价可达1.2×108U /mL,比活2.2×106 U/mg(蛋白)。IFN-α中干扰素含量占回收干扰素的82%,比活也比较高。
2.基因工程法
随着生物技术的发展,运用基因工程技术,已能在人体外大规模地生产人干扰素即基因工程干扰素。
目前,编码干扰素的基因已能在大肠杆菌、酵母菌和哺乳动物细胞中得到表达。α、β、γ三型基因工程干扰素都已研制成功,并投放市场,用于治疗的病种达20多种。我国卫生部已批准生产的干扰素品种有IFN-αlb、IFN-αⅡa、IFN-αⅡb和IFN-r四种。目前,人们在利用蛋白质工程技术研制活性更高,更适于临床应用的干扰素类似物和干扰素杂合体等各种新型干扰素。生产技术路线如图11-6所示。
275
图11-6 利用基因工程生产干扰素的工艺路线
①基因工程菌的构建
首先从产生干扰素的白细胞中提取干扰素mRNA,对其进行分级分离。通过蟾蜍卵母细胞找出活性最高的mRNA,并用此mRNA合成cDNA。将cDNA与含四环素和氨苄抗性基因的质粒pBR322重组,转化大肠杆菌K12,得到重组子质粒。对每个重组子用粗提的干扰素mRNA进行杂交,把得到的杂交阳性克隆中的重组质粒DNA放到无细胞合成系统中进行翻译。对翻译体系的产物进行干扰素活性检测。再将干扰素的cDNA转入大肠杆菌表达载体中,转化大肠杆菌在特定条件下进行高效表达。其生产流程如图11-7所示。
图11-7 构建干扰素工程菌的一般流程
②工程菌的发酵
a.种子制备将构建的基因工程菌传代后于-70℃下甘油管中保存。如构建的人干扰素-αⅡb基因工程菌SW-IFN-aⅡb/E.coli-DHSa。质粒用PL启动子,含氨苄西林抗性基因。使用时进行活化。
b.种子罐培养将菌种按1%种量接种到种子培养基,种子培养基的配方:1%蛋白胨、
276
0.5%酵母提取物、0.5%NaCl;30℃摇床培养10h,作为发酵罐种子使用。
c.发酵罐培养发酵培养基的配方:1%蛋白胨、0.5%酵母提取物、0.01%NH4Cl、0.05%NaCl、0.6%Na2HP04、0.001%CaCl2、0.3%KH2P04、0.01%MgS04、0.4%葡萄糖、50mg/mL氨苄西林、少量防泡剂。用15 L发酵罐进行发酵,发酵培养基的装量为10 L,pH 6.8,搅拌500 r/min,通风比为1:1/(m3·min),溶氧为50%。30℃发酵8h,然后在42℃诱导2~3h完成发酵。同时每隔不同时间取2mL发酵液,在10 000 r/min离心除去上清液,称量菌体湿重。
在整个发酵过程中,要注意:(1)不同发酵阶段培养基的成分有差异;(2)培养液中要有足够的溶解氧,不同的培养阶段需要的溶解氧量也不同,通常通过增大搅拌速度,增加空气流量或者通入纯氧来满足条件;(3)发酵过程中在不同的阶段应控制不同的pH,发酵后期要降低pH,减少干扰素的水解;(4)要控制适当的温度,既要保证菌体细胞膜的完整和细胞中酶的活性,又要有利于提高干扰素的产量。
③产物的提取与纯化
a.提取发酵结束后,冷却,离心(4000 r/min),30min,收集沉淀,得湿菌体。取湿菌体悬浮于20mmol/L 的磷酸缓冲液(pH 7.0)中,冰浴中进行超声破碎,释放干扰素蛋白。4000 r/min离心30min,得沉淀,用含8mol/L尿素、20mmol磷酸缓冲液(pH 7.0)、0.5mmol /L二巯基苏糖醇溶液,室温搅拌抽提2h,然后15000 r/min离心30min。取上清液,用20mmol /L磷酸缓冲液(pH 7.0)稀释至尿素浓度为0.5mol/L,加二巯基苏糖醇至0.1mmol/L,4℃搅拌15h,15000 r/min离心30min,除去不溶物。上清液经截流量为104相对分子质量的中空纤维超滤器浓缩,将浓缩的人干扰素αⅡb溶液经过SephadexG-50分离,层析柱(2cm×l00cm)先用20mmol/L磷酸缓冲液(pH 7.0)平衡,上柱后用同一缓冲液洗脱分离,收集人干扰素αⅡb部分,经SDS-PAGE检查。
b.纯化将Sephadex G-50柱分离的人干扰素αⅡb组分,再经DE-52柱(2cm×50cm)
277
纯化,人干扰素αⅡb组分上柱后用含0.05mol/L、0.1mol/L、0.15mol/L NaCl的20mmol /L磷酸缓冲液(pH 7.0)分别洗涤,收集含人干扰素αⅡb的洗脱液。全过程蛋白质回收率为20%~25%,产品不含杂蛋白、DNA及热原质。干扰素αⅡb含量符合要求。
3.干扰素质量检验
基因工程干扰素半成品和成品均应作检测,包括干扰素效价、蛋白质含量及比活性、纯度测定、相对分子质量、残余外源性DNA含量、残余血清IgG含量、残余抗生素活性、干扰素效价测定、无菌试验、热原质试验。
成品检测:①物理性状冻干制品外观应为白色或微黄色疏松体,加入注射水后,不得含有肉眼可见的不溶物;②鉴别试验应用EIASA或中和试验鉴定,结果为阳性;③水分测定用卡氏法,水分含量应低于3%。半成品也要进行无菌试验、热原质试验、干扰素效价;④安全试验取体重350~400g豚鼠3只,每只腹侧皮下注射剂量为人每千克体重临床使用最大量的3倍,观察7天,若豚鼠局部无红肿、坏死、总体重不下降,则说明成品合格。
(二) 人红细胞生成素( rhEPO)
1.结构与性质
红细胞生成素(EPO)是一种糖蛋白,是调节红系祖细胞,对红细胞生成有特异刺激作用的细胞因子,在胎儿体内由肾脏及肝脏产生,在成人体内主要由肾脏分泌,在病理状态下,与多种贫血尤其与终末期肾脏疾病贫血密切相关。红细胞生成素有两种,天然人红细胞生成素和重组人红细胞生成素。天然人红细胞生成素是以人的尿、血等为原料,经生物化学方法纯化得到。重组人红细胞生成素是以重组DNA技术生产的红细胞生成素,将人红细胞生成素的基因连接到表达载体上,转化CHO细胞,从细胞培养上清夜中纯化红细胞生成素。两种人红细胞生成素具有相同的体内体外活性,根据其糖基的不同,可以分为rhEPO-α和rhEPO-β两种。
278
2.生产工艺
图11-8 利用基因工程菌生产人红细胞生成素的工艺路线
工艺路线如图11-8所示。
①克隆并筛选人红细胞生成素基因获得人红细胞生成素基因的方式有两种,一种提取人胚胎mRNA,逆转录合成cDNA文库,筛选文库,得到人红细胞生成素基因,也可以通过筛选人胚胎基因组文库获得。另一种是提取胚胎染色体DNA,通过PCR扩增获得基因片段,再体外拼接。
②构建红细胞生成素基因表达载体与编码红细胞生成素基因片段相连的表达载体有pDSVL、pSV2 和pD11。以构建携带编码人红细胞生成素基因的核苷酸序列(prEP)的质粒为例进行说明。从人胚胎中提取总RNA,逆转录合成cDNA, 进行文库筛选,得到人红细胞生成素基因,将该基因与载体在连接体系中过夜, 加入T4 DNA连接酶。挑取单菌落接种于5mL培养基,37℃过夜。
③建立红细胞生成素表达的细胞株将重组质粒导入哺乳动物细胞,经筛选得到所需要的细胞系,冻存备用。
④重组细胞株的培养将冻存的细胞株取出,37℃水浴解冻,离心,弃去冻存液。采用转瓶培养细胞,将解冻的细胞株接种于适量的DMEM培养基,37℃、CO2培养箱中培
279
养,连续传代三次。采用消化酶将细胞消化,使细胞浓度为2.5×106个/mL,接种。采用生物反应器培养重组细胞株,采用DMEM培养基,加含小牛血清,控制条件pH 7.0、搅拌速度小于50 r/min, 37℃、D O为50%~80%,使细胞贴壁;细胞贴壁后提高转速80~100 r/min,培养10d;更换无血清培养基在进行灌流培养,在此过程中,连续收获培养液,在4℃~8℃保存。
⑤红细胞生成素的分离纯化采用三步法纯化红细胞生成素,将培养液通过滤膜过滤,上CM-Sephrose亲和色谱柱,CM柱预先用Na-HAc-异丙醇活化,20mmol/L Tris-HCL 平衡缓冲液平衡,然后用0~2mol/L Tris洗脱液洗脱,收集洗脱峰,10mmol/L Tris透析液中透析过夜。透析过程中,透析液的体积为蛋白液体积的15倍,换液4次,0.22um滤膜过滤。活性组分上平衡过的DEAE离子交换柱,0~1mol/L NaCL-HCL洗脱液洗脱,收集活性洗脱峰,再上10%乙腈平衡的RP-HPLC柱,10%~70%的乙腈洗脱液洗脱,收集活性洗脱峰,再用20mmol/L柠檬酸盐缓冲液平衡凝胶柱,并进行洗脱,收集活性洗脱峰,即为红细胞生成素。
⑥红细胞生成素的活性检测红细胞生成素的活性可以通过放射免疫分析和体内生物活性分析,体内生物活性的测定可以采用网织红细胞计数法。
在生产过程中,重组细胞株的培养必须要注意是无菌条件、温度37℃、气体交换可靠、pH稳定7.0~7.2、葡萄糖是必不可少的碳源,另外采用生物反应器时要能及时添加培养液保证连续培养、载体要有足够的表面积,使得细胞株得以高密度、高表达连续培养。(三)白细胞介素-2(Interleukin-2,IL-2)
白细胞介素(interleukin,IL) 由白细胞或其他体细胞产生的又在白细胞间起调节作用和介导作用的一类细胞因子,是淋巴因子家族的一员。目前已有IL-1~18。许多白细胞介素不仅介导白细胞的相互作用,还参与其他细胞如造血干细胞、血管内皮细胞、纤维母细胞、神经细胞、成骨细胞和破骨细胞等的相互作用。IL-2主要由T细胞或T细胞系产生,脾脏、
280
淋巴结和扁桃腺中的T细胞受到刺激后都能产生IL-2,人和动物某些T细胞白血病细胞系或肿瘤细胞在有丝分裂原、钙离子载体(如A23187) 或PMA刺激下可产生高水平的IL-2。
白细胞介素的生产方法有传统的体外诱生法和基因工程法。
1.白细胞介素-2的传统生产方法
IL-2是由辅助T细胞经抗原或有丝分裂原等刺激,在巨噬细胞或单核细胞分泌的IL-1参与下,产生并分泌的含133个氨基酸的糖蛋白,分子量为15420。在pH为2~9范围内稳定,56℃ 1h内仍具有活性。临床上主要用于治疗一些免疫功能不全及癌症的综合治疗。白细胞介素-2的传统生产方法是通过诱生的方法获得。工艺路线如图11-9所示。
图11-9 诱生法生产白细胞介素-2的工艺路线
①诱生用加入鸡瘟病毒和PHA的培养液培养人外周血白细胞,这两种物质起到联合刺激的作用,37℃培养。
②除变性蛋白用6mol/L HCl调节pH2.0~2.5,再用6mol/L NaOH调回到pH7.2~
7.4,离心除去变性杂蛋白。
③硫酸铵分级沉淀取上述离心后的培养上清液,加饱和硫酸铵至35%饱和度,4℃静臵24h,离心弃去沉淀。上清液补加固体硫酸铵至85%饱和度,4℃静臵24h,离心,收集沉淀。
④透析将沉淀溶于pH 6.5、10mmol/L PBS中(内含2%正丁醇和0.15mol/L NaCL)。
281
对pH 6.5、10mmol/L PBS透析24h(更换5次透析外液)。
⑤蓝色琼脂糖层析将上述透析内液通过Sepharose4B层析柱,用PBS洗去不吸附的蛋白,再用含0.4mol/L NaCl的PBS洗涤亲和柱,最后用含1.0mol/L NaCL的PBS解吸IL-2活性组分。
⑥凝胶层析将解吸的IL-2活性组分经分子量为6000的PEG浓缩,再上ACA44U1-trogel层析柱。柱用含0.1%PEG、2%正丁醇和pH7.6的0.5mol/L甘氨酸的0.2mol/L Tris-HCL洗脱,得IL-2。
2.基因工程IL-2的制备
目前国内用酵母、动物细胞培养和用大肠杆菌基因重组的IL-2都已批准生产,并用于临床。重组IL-2的获得过程中,已成功地利用大肠杆菌、酵母和哺乳动物细胞来表达重组人IL-2,但在大量生产重组IL-2中主要是使用大肠杆菌。
①基因工程菌的构建
从ConA激活的人白血病T细胞株提取高活性IL-2的mRNA作为模板,逆转录单链cDNA,经末端脱氧核苷酸转移酶催化,在cDNA末端连接若干dCMP残基,再以寡聚(dG)12~18为引物,利用DNA聚合酶I成双链cDNA,经蔗糖密度梯度离心法分离出此cDNA片段。通过GC加尾法将此cDNA片段插入到pBR322质粒的PstI位点,用重组质粒转化大肠杆菌K12株X1776,得到IL-2的cDNA文库。利用mRNA杂交试验筛选IL-2 cDNA文库得到含IL-2 cDNA质粒的菌株。已有一些携带人突变型白细胞介素2 ( IL-2) 的质粒,如pPIC9K等。
②基因工程菌的发酵
将IL-2 工程菌接种于含氨苄青霉素的2 mL YPD 培养基中, 过夜培养, 以1 %接种入含100 mL BMGY的500 mL 三角瓶。30℃ 300 r/ min 培养至OD600 = 3~6 (大约16~18 h)。弃上清液并将菌体细胞沉淀悬浮在1/ 5 到1/ 10 原初始培养液体积的BMMY培养基中,0.5 %
282
到5 %甲醇诱导。在此过程中优化表达条件, 如通气状况、诱导时间(表达量随时间延长逐渐增加,培养48 h 达到高峰值)、初始pH 值、甲醇终浓度(目的蛋白量在甲醇浓度为1%时达到最高)等。外源蛋白在甲醇酵母中的表达分2步, 即菌体生长和蛋白诱导表达。先在以甘油为碳源的培养基上培养菌体, 达到一定OD 值后, 离心, 弃去上清液, 菌体悬浮于以甲醇为碳源的培养基中诱导表达, 每隔24 h 加1次甲醇, 以弥补甲醇的损失。
③ IL-2的分离
IL-2基因工程菌经发酵培养和诱导表达后,发酵液离心,收集菌体。菌体悬浮于PBS 溶液中,超声破碎,离心沉淀,用PBS洗3次,尽量去除杂蛋白及核酸,离心粗制包涵体,包涵体主要含由IL-2单体分子聚合而成的多聚体,不溶于水,且其中的重组IL-2无生物活性。
④蛋白溶解
包涵体经常出现不溶解现象,使用高性能分散机,瞬间打开分子间的化学键,有利于变性剂继续打开蛋白质分子间和分子内的化学键,使蛋白完全溶解。可用6mol/L盐酸胍或8mol/L脲或尿素使包涵体变性解聚成单分子(变性后仍无生物学活性)。
⑤ IL-2的复性
采用50μmol/L CuSO4的含有PBS的溶液与IL-2粗品以1:50体积混合后, 臵室温过夜。。也可利用空气氧化,或还原型谷胱甘肽复性,恢复IL-2二硫键和正常分子结构,获得生物学活性。
⑥提高IL-2的复性率
在复性过程中,只有60%~70%的IL-2 能正确配对,另有30%~40%的IL-2 则会形成错配体和二聚体,收集生产过程中经高效液相色谱洗脱下来的错配体和二聚体(色谱峰的左部分)进行重新氧化复性,可以使IL-2的回收率提高20%以上。
⑦IL-2的纯化
283
目录 摘要 (1) 1 引文 (2) 2 蛋白质药物口服吸收的机制及途径 (2) 2.1 载体转运 (2) 2.2 胞饮作用和M 细胞途径 (2) 3 蛋白质药物吸收的主要屏障 (3) 3.1酸屏障 (3) 3.2酶屏障 (3) 3.3膜屏障 (3) 4 保护口服蛋白质药物活性的方法 (4) 参考文献 (5)
蛋白质药物口服机制及方法研究摘要:由于蛋白质药物的无损伤性传输系统以及作用位点专一等特点,已成为临床治疗疾病的重要药物,但受到酸屏障、酶屏障和膜屏障的影响,限制了这类药物的口服吸收。但蛋白质药物口服给药方便、可提高患者依从性。所以目前世界上对蛋白质口服药物研究很多。本文对蛋白质药物口服的吸收机制以及影响因素,通过查阅中外文资料,寻找一种保护口服蛋白质药物活性的方法。 关键词:蛋白质类药物,纳米脂质体,口服 1.引言 生物技术药物在人类疾病的治疗中正发挥着越来越重要的作用,而生物技术药物大多数为蛋白质类药物。该类药物在胃肠道中不稳定,易被胃肠道苛刻的pH环境和丰富的酶系统破坏,同时由于其具有分子量大、对胃肠道黏膜的渗透性低的特点,导致该类药物的胃肠道用药生物利用度极低。为了避免蛋白质在胃肠道中的降解及吸收困难的问题,蛋白质类药物主要采用注射的方式给药,给患者带来了极大不便。因而开发该类药物的无损伤性传输系统已成为药剂领域的研究热点。以往人们已投入大量的精力开发蛋白质类药物的非注射给药剂型,其中口服剂型以其良好的患者依从性吸引了大批研究者的关注,但酶和pH 环境对蛋白质的降解、破坏以及蛋白质在胃肠道的低渗透性,使得蛋白质类药物的吸收障碍亦成为蛋白质类药物胃肠道给药研究的瓶颈。为此,本文在查阅近年国内、外研究论文基础上,寻找一种不破坏蛋白质活性的药物剂型。 2.蛋白质药物口服吸收的机制及途径 2.1 载体转运 小分子药物的转运以简单扩散为主,而大分子蛋白质口服给药经过胃肠道主要依靠载体转运介导通过细胞旁路转运至小肠黏膜内,如图1 所示,随后由淋巴回流进入血液循环系统。未被消化酶降解的多肽与肠表面膜基底外侧的H+ 依赖型多肽载体结合,以H+ 梯度和膜电位差为动力,经多肽载体转运进入基底膜内侧,由于H+ 与多肽是共同通过上皮细胞膜的,这一系统又称为H+ -依赖型肠多肽转运系统。 图1 治疗用多肽与蛋白质药物分布机制: 载体转运的作用超过简单扩散. 2.2 胞饮作用和M 细胞途径
蛋白质药物的研究现状 郭世江20123762 制药二班 摘要:蛋白质药物可分为多肽和基因工程药物、单克隆抗体和基因工程抗体、重组疫苗;本文主要着重讲解多肽和基因工程药物。与以往的小分子药物相比,蛋白质药物具有高活性、特异性强、低毒性、生物功能明确、有利于临床应用的特点。由于其成本低、成功率高、安全可靠,已成为医药产品中的重要组成部分。1982年美国Likky公司首先将重组胰岛素投放市场,标志着第一个重组蛋白质药物的诞生。一种新型生物技术候选药物,它具有高效抗肿瘤、抗病毒功能。经中国药品生物制品标准化研究中心检测证实,其抗肿瘤活性较同类产品高246.7倍,抗病毒活性高10倍以上,可用于治疗多种恶性肿瘤和病毒感染性疾病。 关键词:多肽,基因工程药物,单克隆抗体,基因工程抗体,重组疫苗,高活性,低毒性,抗肿瘤,抗病毒。 Abstract:Polypeptide and protein drugs can be divided into genetic engineering drugs, monoclonal antibodies and genetically engineered antibodies, recombinant vaccine; paper mainly focuses on explaining polypeptides and genetic engineering drugs. Compared with conventional small molecule drugs, protein drugs with high activity and specificity, low toxicity, biological features a clear, beneficial characteristics of clinical applications. Because of its low cost, high success rate, safe and reliable pharmaceutical products has become an important part. 1982 United States Likky company first recombinant insulin market, marking the birth of the first recombinant protein drugs. A new biotech drug candidates, it is an efficient anti-tumor, anti-viral function. By the China Research Center of Pharmaceutical and Biological Products Standardization tests confirmed that the anti-tumor activity of 246.7 times higher than similar products, high antiviral activity more than 10 times, can be used to treat a variety of malignancies and viral infections. Keywords:Peptides, genetic engineering drugs, monoclonal antibodies, genetically engineered antibodies, recombinant vaccine, high activity and low toxicity, anti-tumor, anti-viral 一、前言 生物技术的发展促进了大分子生物活性物质的发现,用于治疗或诊断的多肽、蛋白质、酶、激素、疫苗、细胞生长因子及单克隆抗体等药物不断出现,国外已批准上市的生物技术药物产品约90 多种,进入临床实验的生物技术药品有369种,占美国临床实验药品的1/3,正在研究发展的大分子活性物质或药物达千种以上,生物技术药物的销售增长率在1998 年到2004 年每年增长12%~15%,生物技术药物已涉足于200多种疾病,其研究多数是针对癌症治疗,以及传染性疾病、神经性疾病、心血管疾病、呼吸系统疾病、艾滋病、自体免疫性疾病、皮肤病等。早在上世纪90年代,美国FDA即已批准可以进行临床研究的基因疗法达72种,年初国家食品药品监督管理局也批准了重组人p53腺病毒注射液的生产。由于半衰期短,生物技术药物的基本剂型是冻干注射剂或注射液,需要长期频繁注射给药,面对生物大分子在稳定性及吸收等方面的困难,在研究和生产高质量的冻干粉针及溶液型注射剂的同时,发展多种途径给药的新剂型是制剂工业和研究的重要任务[1]。
氨基酸、多肽及蛋白质类药物 山东药品食品职业学院张慧婧 第一部分氨基酸、多肽及蛋白质基本知识 一、蛋白质基本知识 蛋白质是一切生命的物质基础,是生物体的重要组成成分之一。无论是病毒、细菌、寄生虫等简单的低等生物,还是植物、动物等复杂的高等生物,均含有蛋白质。蛋白质占人体重量的16%~20%,约达人体固体总量的45%,肌肉、血液、毛发、韧带和内脏等都以蛋白质为主要成分的形式存在;植物体内蛋白质含量较动物偏低,但在植物细胞的原生质和种子中蛋白质含量较高,如大豆中蛋白含量约为38%,而黄豆中高达40%;微生物中蛋白质含量也很高,细菌中的蛋白质含量一般为50%~80%,干酵母中蛋白质含量也高达46.6%,病毒除少量核酸外几乎都由蛋白质组成,疯牛病的病原体——朊病毒仅由蛋白质组成。 这些不同种类的蛋白质,具有独特的生物学功能,几乎参与了所有的生命现象和生理过程,可以说一切生命现象都是蛋白质功能的体现。 1.生物催化作用 作为生命体新陈代谢的催化剂——酶,是被认识最早和研究最多的一大类蛋白质,它的特点是催化生物体内的几乎所有的化学反应。生物催化作用是蛋白质最重要的生物功能之一。正是这些酶类决定了生物的代谢类型,从而才有可能表现出不同的各种生命现象。 2.结构功能 第二大类蛋白质是结构蛋白,它们构成动、植物机体的组织和细胞。在高等动物中,纤维状胶原蛋白是结缔组织及骨骼的结构蛋白,α-角蛋白是组成毛发、羽毛、角质、皮肤的结构蛋白。丝心蛋白是蚕丝纤维和蜘蛛网的主要组成成分。膜蛋白是细胞各种生物膜的重要成分,它与带极性的脂类组成膜结构。 3.运动收缩功能 另一类蛋白质在生物的运动和收缩系统中执行重要功能。肌动蛋白和肌球蛋白是肌肉收缩系统的两种主要成分。细菌的鞭毛或纤毛蛋白同样可以驱动细胞作相应的运动。 4.运输功能 有些蛋白质具有运输功能,属于运载蛋白,它们能够结合并且运输特殊的分子。如脊椎动物红细胞中的血红蛋白和无脊椎动物的血蓝蛋白起运输氧的功能,血液中的血清蛋白运输脂肪酸,β-脂蛋白运输脂类。许多营养物质(如葡萄糖、氨基酸等)的跨膜输送需要载体蛋白的协助,细胞色素类蛋白在线粒体和叶绿体中担负传递电子的功能。 5.代谢调节功能 执行该功能的主要是激素类蛋白质,如胰岛素可以调节糖代谢。细胞对许多激素信号的响应通常由GTP结合蛋白(G蛋白)介导。 6.保护防御功能 细胞因子、补体和抗体等是参与机体免疫防御和免疫保护最为直接和最为有效的功能分子,其化学本质大都为蛋白质,免疫细胞因子、补体和抗体等目前也已用于免疫性疾病和一些非免疫性疾病的预防和治疗。
生物制药学课程论文题目多肽和蛋白质类药物的应用及发展前景 学院 专业班级 姓名学号 指导教师 2013 年04 月25 日 新疆农业大学教务处制
多肽和蛋白质类药物的应用及发展前景 摘要:生物技术被认为是21世纪最具主导地位的高新技术,生物技术药物基本都是多肽蛋白类药物,对肿瘤遗传性和非遗传性疾病有着特殊的疗效。随着科学与技术的不断发展以及人民对生活质量的要求在不断提高蛋白药物的制备必将发展成为21世纪我国最具吸引力的新技术产业之一。多肽类和蛋白质作为药物,具有生理活性强、免疫原性低、疗效高等诸多优点,随着生物技术的不断发展,其在人类疾病治疗中的地位也日趋重要,目前已成为国际药学界研究的热点之一。本文从多肽和蛋白类药物的认识,多肽和蛋白类药物开发的技术研究,多肽和蛋白类药物给药方法,以及对多肽和蛋白类药物的研究前景等方面,对多肽和蛋白类药物的开发有了综合性的认识。 关键词:蛋白类药物蛋白质多肽开发生物技术发展 随着生物技术和基因工程的发展,越来越多的多肽和蛋白类药物用于临床治疗。近年来,蛋白类药物使用虽呈现上升趋势,但因制备工艺复杂、投递效率低、生物利用度差等诸多原因而受到限制,其中给药途径最为关键。随着生物物理学、生物化学以及材料学在药学中的应用,诸如脂质体、微球、微囊以及纳米囊等技术的出现为解决上述问题提供了新的思路,其中微球以制备工艺简便、生物利用度高、靶向性强等优点而备受关注。迄今为止,蛋白类药物由于诸多原因未能得到广泛应用,主要原因之一是较低的生物利用度问题难以解决。而可生物降解微球在药物投递过程中可有效改善上述问题,它特有的载药方式能够明显减少蛋白类药物被机体复杂生理环境以及酶类物质的破坏,另外缓释及靶向特性对发挥其生物学效应也会起到十分重要的作用。目前,其优势主要在疫苗和少数几个蛋白药物上得到验证和肯定。想要在蛋白类药物的开发上有更新的进展,必须对它的开发有一个全面的了解。 一、多肽和蛋白类药物的基本认识 1多肽和蛋白类药物的概念 多肽和蛋白质类药物指用于预防、治疗和诊断的多肽和蛋白质类物质生物
蛋白质药物市场简介 一、蛋白质药物 定义及作用: 蛋白质药物可分为多肽和基因工程药物、单克隆抗体和基因工程抗体、重组疫苗;与以往的小分子药物相比,蛋白质药物具有高活性、特异性强、低毒性、生物功能明确、有利于临床应用的特点。由于其成本低、成功率高、安全可靠,已成为医药产品中的重要组成部分。 二、蛋白质药物市场的发展 1、国外发展现状 全球生物技术公司总数已近5000家,上市公司有600余家, 销售总额近400亿美元,其中生物技术药物占总销售额的70%。从 整个产业的分布情况看,生物技术公司主要集中在欧美,占全球总 数的85%,欧美公司的销售额占全球生物技术公司销售额的97%。 美国:美国是世界生物工程产业的龙头,其生物工程公司占全 球总数的55%,销售额占全球生物工程产品销售总额的82%。目 前已批准近150个蛋白质药物上市,适应征达220种,使3.25亿患 者受益,蛋白质药物的产值和销售额已超过200亿美元。 日本:在生物技术的开发上仅次于美国,目前共有生物制药公 司约600家,上市的蛋白质药物近30种,正在研发的有几十种。 欧洲:是生物技术革命的重要发源地之一,目前有290种蛋白 质药物进入临床试验,其中29种已批准上市。 2、国内市场规模
目前我国有20个国家生物技术药物重点实验室、3个蛋白质药物开发中心、289家生物制药企业。我国已开发成功21种基因工程药物和疫苗,批准上市的蛋白质药物有19种。 3、国内技术水平及竞争情况。 1)传统蛋白质药物源头枯竭,创新产品缺乏 我国已经产业化的21种基因工程药物和疫苗,均为仿制产品,造成单一产品和同类产品一哄而上,无序竞争。尤其是一些疗效确切的蛋白质品种,多种剂型多家生产,单一品种多家生产。例如GM -CSF国内将近有20余家企业生产。 2)蛋白质药物的大规模生产技术落后,生产成本高 目前国内蛋白质药物的大规模生产相关技术如细胞高密度大规模培养、连续灌流培养、无血清培养、蛋白质药物的纯化处理等远远落后于国际先进水平,而常规的细胞培养技术,难于满足临床需求。 3)研究单位和生产企业缺乏有效沟通,上下游产业链脱节 我国蛋白质药物研发以科研院所为主,但科在项目研发时,常常缺乏前期的市场调研和论证,而生产企业不愿意过早地介入到具有极大风险的创新药物研究中,导致部分产品上下游产业链脱节,产品不能迅速产业化,进入市场并获得利润。 三、蛋白质的分类及生产方法 1、分类:
蛋白类药物生产工艺 蛋白质类药物是生化药物中非常活跃的一个领域,目前的生化产品主要是从动物脏器或组织包括人的血液中分离而得。20世纪70年代后,人们开始应用基因工程技术生产一些蛋白质药物,已实现工业化生产的产品如胰岛素、干扰素、白细胞介素、生长素、EPO、tPA、TNF等,现正从微生物和动物细胞的表达转向基因动植物发展。 第一节主要蛋白质类药物的制备 蛋白质类药物主要包括蛋白质类激素、蛋白质细胞生长调节因子、血浆蛋白质类、黏蛋白、胶原蛋白及蛋白酶抑制剂等,其作用方式包括对机体各系统和细胞生长的调节、被动免疫、替代疗法等。 一、蛋白质激素类 蛋白质类激素主要包括垂体蛋白质激素、促性腺激素和其他蛋白质激素。其中垂体蛋白质激素包括生长素(GH)、催乳激素(PRL)、促甲状腺素(TSH)、促卵泡激素(FSH)等。促性腺激素包括人绒毛膜促性腺激素(HCG)、血清促性腺激素( SGH )等。其他蛋白质激素包括胰岛素、胰抗脂肝素、尿抑胃素等。 (一) 生长素(growthhormone,GH) 生长素是动物脑垂体前叶外侧的特异分泌细胞分泌的一种促进生长的蛋白质激素,具有调节生长与发育的功能,对多种人类疾病有很好的疗效。 人生长素(human growth hormone,hGH)由一条191个氨基酸的多肽构成的一链多肽的球形蛋白质,分子中含两条二硫键,分子量为21700,等电点4.9,沉降系数S20 2.179, ,W 其活性不需要整个分子结构,N端1~134氨基酸为活性所必需,C端的肽链起到保护作用,其化学结构与催乳素近似,故生长素有弱催乳素作用,而催乳素有弱生长素作用。生长素包含大小两个环,以亲水球蛋白的形式存在。不同种类动物的生长素,其化学结构与免疫 264
多肽、蛋白质类药物给药系统 摘要随着重组DNA技术的发展.基因工程肽和蛋白质药物的大规模生产已成现实,这类药物应用于临床的数量越来越多。与传统的化学合成约物相比,其优点受到了广泛的关注,即与体内正常生理物质十分接近,更易为机体吸收,其药理活性高、针对性强、毒性低。但由丁多肽、蛋门质类约物(1)分子质量大、稳定性高、易被胃肠道中的的蛋白水解酶降解;(2)生物半衰期短、生物膜渗透性差、生物利用度不高、不易通过生物屏障等,故其给药系统的研究一直足约剂学领域的一个热点。许多学者曾尝试对肽类、蛋白质类约物进衍化学修饰、制成前体药物、应用吸收促进剂、使用酶抑制刺、采用离子电渗法皮肤给药以及设计各种给药系统解决上述问题.此炎药物一般注射给药,基本剂型足注射剂和冻粉针剂,常需频繁注射,患者顺从性差,且加重了患者的身体、心理和经济负担。近年来,脂质体、微球、纳米粒等制剂新技术发展迅述歼逐渐完善,国内外学者将其广泛应用于多肽、蛋白质炎约物给约系统(drug deiivery system,DDS)的研究中,为此炎药物的临床应用铺平了道路。 本文就多肽、蛋白质类约物的给药系统及新技术进行综述。主要介绍注射给药系统和非注射给约系统,及其下属几个分支。重点介绍非注射给药系统。 关键字给药系统注射非注射 l 新型注射给药系统 1.1 控释微球制剂 为了达到多肽、蛋白质类药物控制释放,可将其制成生物可降解的微球制剂。目前已经实际应用的生物可降解材料主要有淀粉、明胶、葡糖糖、清蛋白、聚乳酸(PLA)、聚乳酸乙醇酸共聚物(PIGA)、聚邻酯、聚内酯和聚酐等;其中PLGA最为常用,改变乳酸乙醇酸的比例或相对分子质量,可得到不同降解时间的微球。 PLGA 微球相对于常规注射剂具有如下优点:(1)释药周期长,避免频繁给药; (2)使用安全;(3)药理作用增强;(4)避免发生明显的不良反应;(5)生物利用度显著提高。 1.2 脉冲式给药系统 普通注射剂(疫苗、类毒素)一般至少接种3次,才能确保免疫效果,血药浓度波动大,且不能保证在疾病发作时相应的血药浓度。而脉冲给药制剂具有普通制剂不可比拟的优点,它可以根据忠者发病的节律性提前给药,使给药时间与释药时间有一个与生理周期相匹配的时间差,从而预防发病,降低药物的不良反应,且不易产生耐受性,提高患者的顺应性,是现代药剂学研究的新模式。 2 非注射给药系统 2.1 口服给药系统 多肽、蛋白质类药物口服给药主要存在4个问题:(1)在胃内酸催化降解;(2)在胃肠道内的酶水解;(3)对胃肠道黏膜的透过性差;(4)存在肝的首过效应。因此研制新的剂型,提高多肽、蛋白质类药物的生物利用度是人们关注的 热点。 2.1.1 纳米粒 Kawashima等以降钙素为模型药物制备壳聚糖包衣PLGA纳米粒来评价黏膜黏附纳米粒对肽类药物吸收的影响。体外实验表明,壳聚糖包衣PI GA纳米粒对十二指肠、空肠和回肠的黏膜黏附效应无部位特异性,且壳聚糖的黏附特性要强于聚乙烯醇和海藻酸钠。药物的释放特性与未包衣纳米粒相比没有变化。
多肽及蛋白质类药物传输系统研究进展 2004-2-8 中国药科大学(南京200019)平其能郭建新 一、多肽与蛋白质药物的发展 随着生物工程技术的迅速发展,生物技术活性物质不断面世,已有不少生物技术药物应用于临床,国内外已批准上市的约40多种,1995年开发数为234种,目前正在研究的则成倍增加,在这些品种中,大量的均为多肽与蛋白质类药物。由于多肽与蛋白质药物的体内外不稳定性,临床主要剂型是溶液型注射剂和冻干粉针。为解决长期用药的问题,克服注射剂的不便和缺点,发展适宜给药途径的非注射传输系统是药剂学面对的挑战。 二、发展多肽与蛋白质药物传输系统的关键问题 1、蛋白质药物的结构特征 蛋白质分子的化学结构决定其活性,影响活性的结构因素主要为氨基酸及其排序、末端基团,肽链和二硫键位置等。除外,药物的空间结构即二维、三维结构也同样影响生物活性。另外,多肽及蛋白质的分子量常为数千至几十万,颗粒大小在l~100nm之间,不能透过半透膜。 2、蛋白质药物体内外不稳定性 蛋白质药物在体内外环境可能经受多种复杂的化学降解和物理变化而失活,如凝聚、沉淀、消旋化、水解、脱酰氨基等。 提高稳定性的方法包括(1)温和的生产条件如对温度、机械搅拌强度和有机溶剂的选择,对无菌条件的控制,容器的吸附效应,水分控制,低温冷藏等。(2)设计正确的处方如PH、缓冲对、电解质;加入适宜稳定剂、冻干保护剂、阻聚剂如非离子表面活性剂、糖、甘露醇、山梨醇、PEG、人血清白蛋白等以及制备包合物等。 3、蛋白质药物的吸收特征 蛋白质药物半衰期短、清除率高、分子量大透股能力差、易受体内酶和细菌以及体液的破坏、非注射给药生物利用度低,一般都仅为百分之几,如狗口服亮丙瑞林醋酸酯的生物利用度低于3%。提高蛋白质药物吸收的方法一般有化学修饰或制备成前体药物,使用酶抑制剂,吸收促进剂,选择适宜剂型保护等。
多肽和蛋白质类药物的发展过程 悬赏分:30 - 解决时间:2007-10-28 21:16 各位学识之士帮帮手啊,要写论文啊 提问者:5TY67J - 魔法学徒一级 最佳答案 随着蛋白组学计划的逐步深入,蛋白质结构与功能关系逐渐被***,近年来越来越多的多肽及蛋白质类物质 在诊断、治疗或作为疫苗预防各种疾病方面发挥着重要作用。与小分子药物相比,多肽及蛋白质类大分子 药物稳定性差、易于被酶降解、故生物半衰期短;而扩散差、分配系数小,又使其难以通过生物屏障及脂 质膜[1],所以,如何将这些生物技术类物质有效地送达人体相应部位,一直是制剂研究面临的重大课题。 /i ekww^54 目前,生物技术类药物大多以注射用溶液或冻干粉针剂应用于临床,但常需要频繁给药,致使病人的顺应 性较差,且治疗费用较高。而将大分子药物通过可生物降解微球系统给药,不仅能有效防止生物大分子在 体内很快被降解,还能将药物定向送达体内有效部位,并通过可生物降解聚合物的降解达到缓释长效目的。 现已有的多肽及蛋白质类药物微球制剂主要有:注射用缓释制剂,口服及鼻腔吸入剂等。随着对这类微球制剂研究的深入,制备过程中蛋白质的稳定性差、包封率低、载药量小、且易于产生聚集而使其生物活性降低并可能引起免疫反应、体外释放时具有明显突释效应等问题严重影响着这类制剂的发展。本文将就目前多肽及蛋白质类微球制剂的应用、制备方法、出现的问题及常用的各种增加稳定性、减少其突释效应的物理化学方法进行综述。?sBbe @OC? AmmU oS\ 1、多肽及蛋白质微球制剂的主要类型BV pRk UC" 1.1 注射剂? YO$NYwE 采用可生物降解聚合物为骨架材料,将多肽及蛋白质药物制成微球制剂用于肌肉或皮下注射,给药后随着 聚合物的降解,药物以扩散、溶蚀方式释放,可达到缓释长效的目的[2]。 tu6Q7CjW8 ),肌肉注射后可缓释1或2个月。 这类制剂中,只有10个氨基酸的LHRH类似物微球的研究最为成功,第一个多肽微球产品——曲普瑞林于1986年问世,随后亮丙瑞林、布舍瑞林、高舍瑞林、那法瑞林等长效微球制剂相继上市。2000年美国Genentech公司推出了重组人生长激素(rhGH)PLGA微球(Nutropin p; V H g 1.2 口服制剂a:(.{z?nM 多肽及蛋白质类药物应用于口服须克服两大障碍,一是抑制胃肠道各种酶对其降解,二是选用合适的制剂形式及载体材料使药物透过生物屏障。粒径范围处于1-1000nm的毫微粒制剂是目前研究最多的口服多肽制剂,但毫微粒的表面带电荷情况及聚合物疏水性能均影响多肽在小肠部位的吸收。 s - H e 近年来的研究主要在对毫微粒表面进行修饰,如在毫微粒表面连接各种生物粘附材料,如脱乙酰壳多糖、Carbopol?等。Kawashima等研究者[3]采用乳化溶剂扩散法在降钙素的PLGA毫微粒表面覆盖一层粘附材料脱乙酰壳多糖后,与原PLGA毫微粒相比,虽然药物扩散形式没有显著改变,但能明显降低血钙水平,且能维持48小时。Lubben等报道[1],脱乙酰壳多糖及其衍生物能有效提高亲水性大分子物质的吸收,因其能增加细胞间的紧密连接的开放而有利于药物的细胞旁转运。 P` -K? k< 另外,将毫微粒的疏水性聚合物骨架上连接亲水性聚合物侧链,可大大提高多肽药物的吸收,这可能是由 于亲水性聚合物能打开小肠上皮细胞间的紧密连接。'v"{frh 1.3 鼻腔吸入剂=A, 6KY=E 将多肽及蛋白质类药物以微球制剂的形式在鼻腔给药可提高这类药物的吸收及生物利用度,这在胰岛素、 降钙素、人生长激素等微球制剂中都得到了证实。尽管微球对多肽及蛋白类药物的这种促吸收机理尚不确 定,但一般认为,微球与鼻粘膜直接接触而吸水溶胀,使上皮细胞脱水导致紧密连接开放,使多肽及蛋白 质易于透过[4]。mqg[2VT RP 目前,将疫苗通过鼻腔给药产生局部免疫反应又是研究的一个热点。微球包载疫苗在鼻腔内给药,通过适
《蛋白类药物研究进展》
1蛋白类药物 1.1蛋白类药物概述 现代生物技术的发展,使得蛋白质药物的大规模生产成为现实,这类药物应用于临床的数量也越来越多。蛋白质药物是指多肽和基因工程药物、单克隆抗体和基因工程抗体、重组疫苗。与以往的小分子药物相比,蛋白质药物具有高活性、特异性强、低毒性、生物功能明确、有利于临床应用的特点。[1] 随着蛋白质化学和分子生物学的发展,用于各种疾病治疗的蛋白质类药物的研制和应用已成为生物医药产业发展的热点。多肽和蛋白类药物副作用小,活性强。并具有标本兼治的功效,而且由于其成本低、成功率高、安全可靠,[2]已成为医药产品中的重要组成部分。但是,蛋白类药物也有其稳定性差、膜通透性差、生物半衰期短等等缺点,影响了蛋白质药物的治疗潜力和临床应用。[3] 1.2蛋白类药物的种类 蛋白药物大致可以分为以下几类:多肽类激素药:包括人胰岛素、人生长激素、卵泡刺激激素和其他激素;人造血因子:包括重组人促红细胞生成素、粒细胞/单核细胞集落刺激因子GM-CSF、人血浆蛋白因子:包括重组人凝血因子Ⅷ、重组人凝血因子Ⅶ、重组人凝血因子Ⅸ、重组人抗凝血酶等等。[1]
2蛋白类药物的研究现状 生物技术的发展促进了大分子生物活性物质的发现,用于治疗或诊断的多肽、蛋白质、酶、激素、疫苗、细胞生长因子及单克隆抗体等药物不断出现,国外已批准上市的生物技术药物产品约90多种,进入临床实验的生物技术药品有369种,占美国临床实验药品的1/3,正在研究发展的大分子活性物质或药物达千种以上,生物技术药物的销售增长率在1998年到2004年每年增长12%~15%,生物技术药物已涉足于200多种疾病,其研究多数是针对癌症治疗,以及传染性疾病、神经性疾病、心血管疾病、呼吸系统疾病、艾滋病、自体免疫性疾病、皮肤病等。早在上世纪90年代,美国FDA即已批准可以进行临床研究的基因疗法达72种,年初国家食品药品监督管理局也批准了重组人p53腺病毒注射液的生产。由于半衰期短,生物技术药物的基本剂型是冻干注射剂或注射液,需要长期频繁注射给药,面对生物大分子在稳定性及吸收等方面的困难,在研究和生产高质量的冻干粉针及溶液型注射剂的同时,发展多种途径给药的新剂型是制剂工业和研究的重要任务。我国国家食品药品监督管理局也批准了重组人p53腺病毒注射液的生产。[4] 2.1蛋白类药物的合成 2.1.1化学合成法 用化学法合成多肽主要依赖于固相肽自动合成仪,它是将氨基端被保护的第1个氨基酸的羧基结合到一个不溶性载体上,使之固定,然后脱掉该氨基酸的氨基端保护基,再将第2个氨基端被保护的氨基酸的羧基与固定的第1个氨基酸的游离氨基缩合形成不溶性二肽,如此反复进行,最后经化学降解和脱保护基后,从载体上脱落目的多肽。由于产率随每个氨基酸的缩合而递降,合成多肽的长度受到一定限制,一般在30~50氨基酸残基水平。目前,硫酯键介导的化学连接法已被成功地应用于较小蛋白质和蛋白质结构域的合成,其主要缺点是在连接位点需要特定的亲核性氨基酸残基。随着方法学的改进与发展,现在已经能够进行连续几个肽片断的连接,促红细胞生成素(EPO)变异体的合成就是一个成功的例子[5]。 2.1.2化学—生物合成法 化学—生物法合成蛋白质主要是利用分子克隆与生物工程技术将化学合成的小片断经特定的介导途径连接于大片断上,例如蛋白质内含子介导法,该法既解决了生物法合成的蛋白质局限于编码氨基酸又能避免化学合成法受到片断大小限制。近年来,已成功地合成了一些多肽与蛋白质。[6]
氨基酸、多肽及蛋白质类药物
氨基酸、多肽及蛋白质类药物 山东药品食品职业学院张慧婧 第一部分氨基酸、多肽及蛋白质基本知识 一、蛋白质基本知识 蛋白质是一切生命的物质基础,是生物体的重要组成成分之一。无论是病毒、细菌、寄生虫等简单的低等生物,还是植物、动物等复杂的高等生物,均含有蛋白质。蛋白质占人体重量的16%~20%,约达人体固体总量的45%,肌肉、血液、毛发、韧带和内脏等都以蛋白质为主要成分的形式存在;植物体内蛋白质含量较动物偏低,但在植物细胞的原生质和种子中蛋白质含量较高,如大豆中蛋白含量约为38%,而黄豆中高达40%;微生物中蛋白质含量也很高,细菌中的蛋白质含量一般为50%~80%,干酵母中蛋白质含量也高达46.6%,病毒除少量核酸外几乎都由蛋白质组成,疯牛病的病原体——朊病毒仅由蛋白质组成。 这些不同种类的蛋白质,具有独特的生物学功能,几乎参与了所有的生命现象和生理过程,可以说一切生命现象都是蛋白质功能的体现。 1.生物催化作用 作为生命体新陈代谢的催化剂——酶,是被认识最早和研究最多的一大类蛋白质,它的特点是催化生物体内的几乎所有的化学反应。生物催化作用是蛋白质最重要的生物功能之一。正是这些酶类决定了生物的代谢类型,从而才有可能表现出不同的各种生命现象。 2.结构功能 第二大类蛋白质是结构蛋白,它们构成动、植物机体的组织和细胞。在高等动物中,纤维状胶原蛋白是结缔组织及骨骼的结构蛋白,α-角蛋白是组成毛发、羽毛、角质、皮肤的结构蛋白。丝心蛋白是蚕丝纤维和蜘蛛网的主要组成成分。膜蛋白是细胞各种生物膜的重要成分,它与带极性的脂类组成膜结构。 3.运动收缩功能 另一类蛋白质在生物的运动和收缩系统中执行重要功能。肌动蛋白和肌球蛋白是肌肉收缩系统的两种主要成分。细菌的鞭毛或纤毛蛋白同样可以驱动细胞作相应的运动。 4.运输功能 有些蛋白质具有运输功能,属于运载蛋白,它们能够结合并且运输特殊的分子。如脊椎动物红细胞中的血红蛋白和无脊椎动物的血蓝蛋白起运输氧的功能,血液中的血清蛋白运输脂肪酸,β-脂蛋白运输脂类。许多营养物质(如葡萄糖、氨基酸等)的跨膜输送需要载体蛋白的协助,细胞色素类蛋白在线粒体和叶绿体中担负传递电子的功能。 5.代谢调节功能 执行该功能的主要是激素类蛋白质,如胰岛素可以调节糖代谢。细胞对许多激素信号的响应通常由GTP结合蛋白(G蛋白)介导。 6.保护防御功能 细胞因子、补体和抗体等是参与机体免疫防御和免疫保护最为直接和最为有效的功能分子,其化学本质大都为蛋白质,免疫细胞因子、补体和抗体等目前也已用于免疫性疾病和一