
第12章 氮族、碳族和硼族元素 习题参考答案
1. (1)解:
NH 4
(NH 4)2SO 4HSO 4(NH 4)2Cr
2O 2O 3 + N 2
O (2)解:
2KNO 32 + O 2Cu(NO 3)
222
2AgNO 3
2.解:(1) 5NO 2-+ 2MnO 4- + 6H 5NO 3- + 2Mn 2+ + 3H 2O
3NO 2-+ Cr 2O 27
+ 8H + →3NO 3- +2Cr 3+ +7H 2O
(2) 2NO 2- + 2I - + 4H +2NO↑+ I 2 + 2H 2O (3) HNO 2+NH 2+ 2H 2O
3.解:(1)
NH 4(NH 4)2SO 产生白色沉淀(BaSO 4)
(2)
KNO KNO 产生蓝色溶液(N 2O 3)、红棕色气体(NO 2)
(3)
AsCl BiCl SbCl 产生黄色沉淀(As 2S 3)
Sb 2S 3)产生黑色沉淀(Bi 2S 3)
4.解:(1)S + 2HNO 3(浓) H 2SO 4 + 2NO↑
(2)4Zn + 10HNO 3(很稀) 4Zn(NO 3)2 + NH 4NO 3 + 3H 2
O
(3)3CuS + 8HNO 3 3Cu(NO
3)2 + 3S↓ + 2NO↑ + 4H 2O
(4)PCl 5+4H 2H 3PO 4+ 5HCl
(5)2AsO 33- + 3H 2S + 6H As 2S 3↓ + 6H 2O (6)AsO 43- + 2I - + 5H +H 3AsO 3 + I 2 + H 2O
(7)2Mn 2+ + 5NaBiO 3 + 14H 2MnO 4- + 5Bi 3+ + 5Na + + 7H 2O
(8)Sb 2S 3 + 3S 2-2SbS 33-
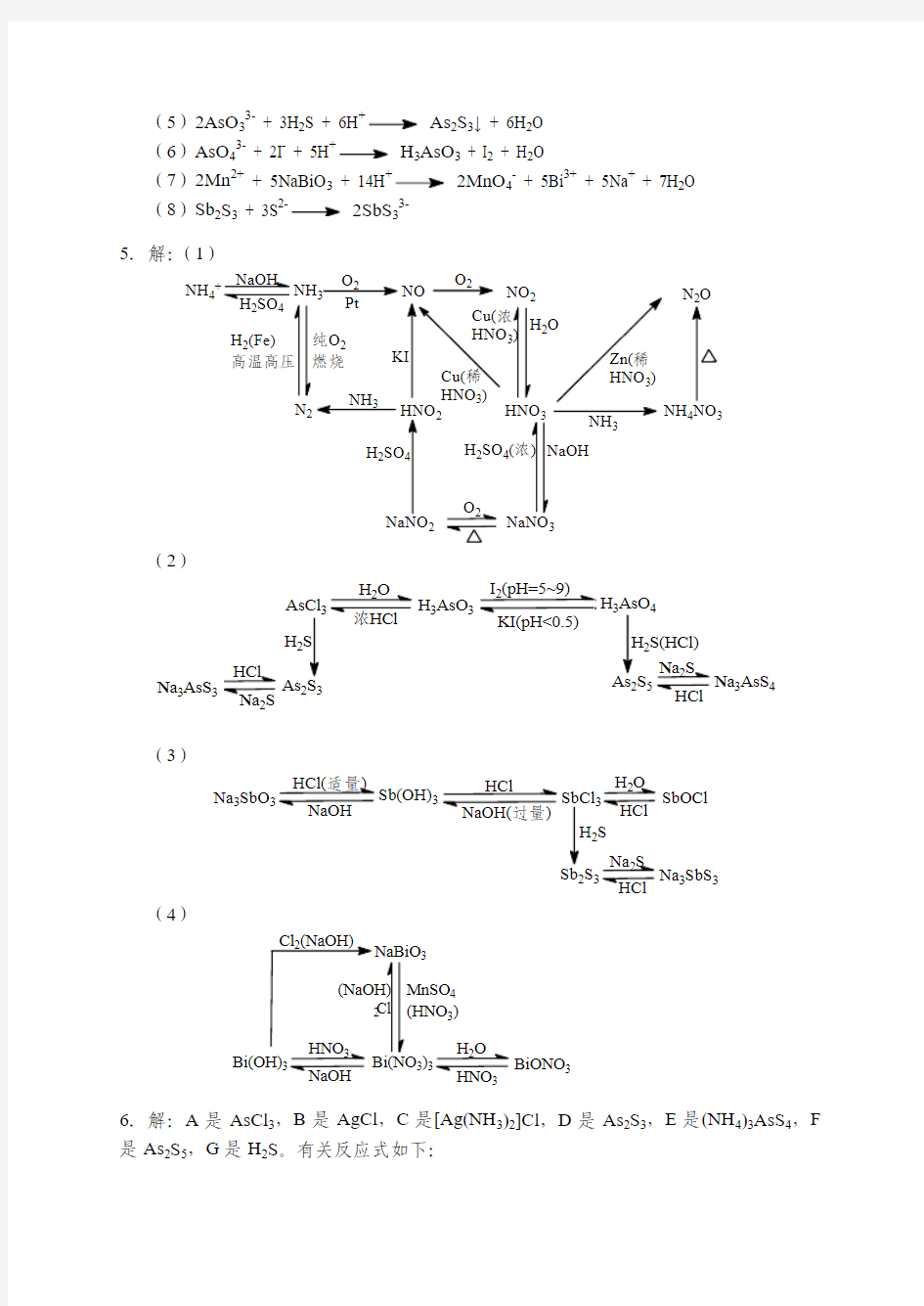
5.解:(1)
NH 4
NH 3
O 2
Pt
NO
O 2
NO
O 2H 2(Fe) N 2
2
2
NH 3
43
H 2SO 4(
H 2SO 2
3
NH 3
(2)
AsCl H 2As 23
2Na 3AsS
3
H 3AsO 3
H
4
2S(HCl)2S 5
Na 3AsS 4
(3)
Na 3SbO Sb(OH)
3
SbOCl
2S 2S
Na 3SbS 3
(4)
3
43)
3)3
Bi(OH)BiONO 3
6.解:A 是AsCl 3,B 是AgCl ,C 是[Ag(NH 3)2]Cl ,D 是As 2S 3,E 是(NH 4)3AsS 4,F 是As 2S 5,G 是H 2S 。有关反应式如下:
Ag + + Cl -AgCl↓
白色
AgCl + 2NH [Ag(NH 3)2]+ + Cl -
[Ag(NH 3)2]+ + Cl - + 2H +AgCl↓+ 2NH 4+
2AsCl 3 + 3H 2As 2S 3↓+ 6HCl As 2S 3 + 6OH -AsO 33- + AsS 33- + 3H 2O
As 2S 3 + 3S 22-2AsS 43- + S↓
2AsS 43- + 6H As 2S 5↓+ 3H 2S↑ 7.解:(1)
(2) (3) (4) (5) (6)
8.解:(1)
过量)
3+
3+
(2)
SnS
Pb(NO 3)Bi(NO 3
)3Sn(OH)Pb(OH)
SnCl SnCl SnCl AlCl SbCl SnCl
4
Mg 2+Pb 2+
3(过量)
(3)
3+
9. 解:A 是SnCl 2(固体),B 是Sn(OH)Cl ,C 是SnCl 2(aq),D 是AgCl ,E 是[Ag(NH 3)2]Cl ,F 是SnS ,G 是(NH 4)2SnS 3,H 是SnS 2,I 是Hg 2Cl 2,J 是Hg 。有关反应式如下:
SnCl 2 + H 2Sn(OH)Cl↓+ HCl
白色
Sn(OH)Cl + HCl(浓) SnCl 2 + H 2O
Cl - + Ag AgCl↓ AgCl + 2NH 3[Ag(NH 3)2]Cl
[Ag(NH 3)2AgCl↓+ 2NH 4Cl 白色
Sn 2+ + H 2SnS↓+ 2H +
棕色
SnS + S 2SnS 32-
SnS 32- + 2H SnS 2↓+ H 2S↑
黄色
SnCl 2 + 2HgCl Hg 2Cl 2↓+ SnCl 4
白色
SnCl 2 + Hg 2Cl 2
2Hg↓+ SnCl 4 黑色
10.解:(1)
浓HNO 3
HCl
H 2SnO 3
Sn
2
HCl
(适量4]2
3
[Sn(OH)6]2
SnCl 2
SnS 32
H 2SnO 3
2
2S 2Cl 2S
H 2β
α
(2)
MnSO HNO 3
HNO 3
Pb PbSO 4
2PbCrO 4
浓H 2SO 4
Pb(HSO 4)2
11.解:(1)SiO 2 + Na 2CO 3 熔融Na 2SiO 3 + CO 2↑ (2)Na 2SiO 3 + CO 2 + H 2O H 2SiO 3↓ + Na 2CO 3
(3)SiO 2 + 4HF SiF 4↑+ 2H 2O (4)B 2H 6 + 6H 2O
2H 3BO 3 + 6H 2↑
12.解:(1)Sn 2+和Fe 2+能共存。
(2)Sn 2+和Fe 3+不能共存,其反应为:
Sn 2+ + 2Fe 3+ Sn 4+ + 2Fe 2+
(3)Pb 2+和Fe 3+能共存。
(4)SiO 3
2?和NH 4+不能共存,其反应为: SiO 32? + 2NH 4+ + 2H 2O H 2SiO 3↓+ 2NH 3·H 2O
3↑+ 2H 2O (5)Pb 2+和[Pb(OH)4]2?不能共存,其反应为:
Pb2+ + [Pb(OH)4]2?2Pb(OH)2↓
(6)[PbCl4]2?和[SnCl6]2?能共存。
13.解:该金属是Sn。
14.解:X为Pb3O4,A为PbO2,B为PbCrO4,C为Cl2。
15.解:A是PbCO3(或是Pb2(OH)2CO3),B是PbO,C是CO2,D是Pb(NO3)2,E 是PbCl2,F是PbS,G是HCl,H是S,I是NO。
16.解:(1) PbO2+ 6H+ + H2O Pb2++ O2↑+ 2H2O
(2) Pb3O4 + 4HNO32 +2 Pb(NO3)2+ 2H2O
(3)5PbO2+ 2Mn2+ + 5SO42- + 4H+2MnO4- + 5 PbSO4↓ + 2H2O
(4)3[Sn(OH)4]2? + 2Bi(OH)33[Sn(OH)6]2?2Bi↓
(5)SnCl2 + 2HgCl Hg2Cl2↓+ SnCl4
SnCl2 + Hg2Cl22Hg↓+ SnCl4
(6)PbS+ 4H2O2PbSO4↓+ 4H2O
(7)[Sn(OH)4]2?+ 4H+(足量) 2+ +4H2O
(8)SnS +S22-2SnS32-
17.解:Na2B4O7+NiO2)·2NaBO2
Na2B4O72)·2NaBO2
18.解:将明矾KAl(SO4)2·12H2O溶于水,加入适量NaOH,控制pH在3.4~4.7之间:Al3+ + 3OH?Al(OH)3↓
过滤并洗涤沉淀即得Al(OH)3。
将上述滤液蒸发浓缩可得K2SO4。
在上述制得的Al(OH)3中加入浓KOH溶液:
Al(OH)3 + KOH(浓) K[Al(OH)4]
+ 2H2O
2
19.解:(1)2Al3+ + 3S2? + 6H2O 2Al(OH)3↓+ 3H2S↑
(2)Al3+ + 4OH?(过量)[Al(OH)4]?
(3)Al3+ + 3NH3·H2O(过量) Al(OH)3↓+ 3NH4+
(4)2Al3+ + 3CO32? + 3H2O 2Al(OH)3↓+ 3CO2↑
碳族和硼族元素练习 一、选择题 ( 共17题 34分 ) 1. (7643)与Na 2CO 3溶液作用全部都生成碱式盐沉淀的一组离子是……………………( ) (A) Mg 2+,Al 3+,Co 2+,Zn 2+ (B) Fe 3+,Co 2+,Ni 2+,Cu 2+ (C) Mg 2+,Mn 2+,Ba 2+,Zn 2+ (D) Mg 2+,Mn 2+,Co 2+,Ni 2+ 2. (7462)下列说法不正确的是…………………………………………………………… ( ) (A) SiCl 4在与潮湿的空气接触时会冒“白烟” (B) NF 3因会水解,不能与水接触 (C) SF 6在水中是稳定的 (D) PCl 5不完全水解生成POCl 3 3. (3718) 铅蓄电池在充电时,阳极反应是……………………………………………( ) (A) PbSO 4 + H 2O = PbO 2 + 4H + + SO -24+ 2e (B) Pb + SO -24 = PbSO 4 + 2e (C) PbSO 4 + 2e = Pb + SO -24 (D) PbO 2 + 4H + + SO - 24 + 2e = PbSO 4 + 2H 2 O 4. (0545) 已知在一定温度下 SnO 2(s) + 2H 2(g)Sn(s) + 2H 2O(g) K c = CO(g) + H 2O(g)CO 2(g) + H 2(g) K c = 因此下列反应SnO 2(s) + 2CO(g)Sn(s) + 2CO 2(g) 的K c 值………………………( ) (A) (B) (C) (D) 5. (7476)分离SnS 和PbS ,应加的试剂为…………………………………………………( ) (A) 氨水 (B) 硫化钠 (C) 硫酸钠 (D) 多硫化铵 6. (7475)鉴别Sn 4+和Sn 2+ 离子,应加的试剂为……………………………………………( ) (A) 盐酸 (B) 硝酸 (C) 硫酸钠 (D) 硫化钠(过量) 7. (7466)下列分子中,C 与O 之间键长最短的是…………………………………………( ) (A) CO (B) Ni(CO)4 (C) CO 2 (D) CH 3COOH 8. (7363)将过量SiF 4通入NaOH 溶液中,主要产物是……………………………………( ) (A) H 4SiO 4,NaF (B) Na 2SiO 3,NaF (C) Na 2SiO 3,Na 2SiF 6 (D) SiO 2,HF 9. (4370)下列说法不正确的是………………………………………………………… ( ) (A)HCO 3- 可通过氢键形成双聚离子 (B) NaHCO 3的热稳定性不如NaCO 3高 (C) BeCO 3在热水中就可发生分解 (D) 所有碱金属碳酸盐都是易溶于水的 10. (4308) CO 32- 的几何构型是……………………………………………………… ( ) (A) 平面三角形 (B) 三角锥形 (C) T 形 (D) 直线形 11. (1460) 下列硫化物,能溶于Na 2S 溶液生成硫代酸盐的是…………………………( ) (A) SnS (B) SnS 2 (C) PbS (D) Bi 2S 3 12. (1456) 试判断 Ge 、Sn 、Pb 分别与浓HNO 3作用时,正确的说法是………………( ) (A) 三元素都被氧化成 +2价 (B) 三元素都被氧化成 +4价 (C) Ge 和Sn 被氧化成 +4价,但Pb 却被氧化成 +2价 (D) Ge 被氧化成 +4价,但Sn 和Pb 只却被氧化成 +2价 13. (1451) IVA 族元素从Ge 到Pb ;下列性质随原子序数的增大而增加的是…………( ) (A) +2氧化态的稳定性 (B) 二氧化物的酸性 (C) 单质的熔点 (D) 氢化物的稳定性 14. (7354)从分子轨道理论出发,可以认为在B 2分子中存在的化学键是………………( )
第15章 碳族元素习题 1.选择题 15-1 在下列物质中,熔点最高的是……………………………………………..( ) (A )4SiF (B )4SnCl (C )3AlCl (D )KCl 15-2 下列物质中热稳定性最高的是…………………………………………….( ) (A )23)Mg(HCO (B )3MgCO (C )32CO H (D )3CaCO 15-3 能与碳酸钠溶液作用,生成沉淀,而此沉淀又能溶于氢氧化钠溶液的是( ) (A )3AgNO (B )2FeCl (C )3AlCl (D )23)Ba(NO 15-4 下列化合物中,不水解的是……………………………………………….( ) (A )4SiCl ; (B )4CCl ; (C )3BCl ; (D )5PCl 15-5 下列各对物质中,中心原子的轨道杂化类型不同的是………………….( ) (A )4CH 与4SiH ; (B )+O H 3与3NH ; (C )4CH 与+ 4NH ; (D )4CF 与4SF 。 15-6 下列物质在水中溶解度最小的是………………………………………….( ) (A )32CO Na ; (B )3NaHCO ; (C )3CaCO ; (D )3KHCO 15-7 下列分子中,偶极矩不为零的是………………………………………….( ) (A )3BCl ; (B )4SiCl ; (C )5PCl ; (D )2SnCl 。 15-8 与32CO Na 溶液反应生成碱式盐沉淀的离子是…………………………..( ) (A )+3Al ; (B )+2Ba ; (C )+2Cu ; (D )+Ag 15.9 碳化铝固体与水作用产生的气体是……………………………………….( ) (A )22H C ; (B )COOH CH 3; (C )2CO ; (D )4CH 15-10 下列物质中还原性最强的是…………………………………………( ) (A )4GeH ; (B )3AsH ; (C )Se H 2; (D )HI 15-11 能与CO 生成较稳定配合物的是…………………………………..( ) (A )Fe 3+; (B )Fe 2+; (C )Fe ; (D )Mg 2+
第13章硼族元素 一、选择题 1、在下列金属中,熔沸点相差最大的是(). A、Pb B、Al C、Ga D、Ge 2、电解法制备铝时,需加冰晶石,其作用是( ) A. 加快电解速度 B. 降低Al2O3的熔点 C. 作为电解原料 D. 防止制得的铝再次氧化 3、关于铝的化学性质叙述错误的是( ) A. 能溶于稀酸 B. 能与热的强碱反应 C.与氢气直接化合 D. 高温下可与S.P.C.N等直接反应 4、下列硼烷在室温呈气态的是(). A、B4H10 B、B5H9 C、B5H11 D、B6H10 5、硼砂珠实验产生蓝色表示存在(). A、Cr B、Ni C、Co D、Fe 6、B的独特性质表现在(). A、亲氧元素 B、生成正氧化态的化合物 C、能形成离域大 键 D、是缺电子原子 7、下列制备无水三氯化铝的方法,正确的是(). A、将过量Al加入稀HCl中,反应完毕后蒸干所得溶液. B、往盐酸中加入稀Al(OH)3,反应完毕后蒸干所得溶液. C、在Cl2气流中加热Al箔 D、将AlCl3·6H2O加热脱水 8、金属Ga常用于制造测量高温的温度计,这是利用了Ga的哪种性质() A、密度大 B、硬度大 C、溶沸点高 D、溶沸点相差大 9、下列金属单质中,熔点最低的是() A、Cu B、Zn C、Na D、Ga 10、α—Al2O3和γ—Al2O3性质差别很大,不能作出判断的是 ( ) A. 水溶性 B. 在酸碱中的溶解性 C. 表面吸附性 D. 催化活性 11、在铝酸盐溶液中加入足量的氢氧化钠固体则( ) A. 生成白色沉淀 B.有气体放出 C. 先生成白色沉淀,而后沉淀消失 D. 生成白色沉淀,并放出气体 二、填空题 1、写出下列物质的化学式: 冰晶石硼砂刚玉
【高中化学奥林匹克竞赛辅导】无机元素化学习题 第十一章硼族元素 1. 下列为有关硼酸的一些反应的图解,试写出其反应方程式,并指出反应条件。 B2H6 ↑ Mg2B2O5·H2O→Na2B4O7·10H2O→BF3→H[BF4] ↓H2SO4 B2O3←HBO2←H3BO3→BPO4 CH2-O (CH3)3BO3 HO-C B-OH CH2-O 2. 试解释下列各术语: (1)缺电子化合物(2)三中心键 3. B2H6的结构怎样?此分子中呈现出什么类型的键? 4. 为什么BN和BP都能形成石墨型的结构? 5. 硼酸晶体为什么呈鳞片状?晶体中硼酸分子是怎样结合在一起的? 6. 硼酸H3BO3有没有象磷酸那样的碱式盐?为什么? 7. 用盐酸可以溶解难溶的碳酸盐(如碳酸钙),但如用醋酸(K=1.8×10-5)或硼酸(K=7.8×10-10)能溶解碳酸钙吗?为什么? 8. 在焊接金属时,使用硼砂的原理是什么?用反应方程式表示硼砂和下列各氧化物共熔时所发生的化学反应:CaO,Fe2O3,NiO。 9. 为什么不能用AlC13·6H2O加热脱水制备无水的AlCl3? 10. 铝与硫混合,当加热时会剧烈的反应,生成硫化铝,但是此硫化铝不能从混有铝离子和硫离子的溶液中得到,如何解释?写出硫化铝与水的化学反应方程式。 11. 按金属的电极电位,铝的还原性远大于氢,但它不能将水中的H+还原为H2,可是在氢离子浓度比水小得多的碱性溶液中,铝反而可以容易地取代出氢气来,为什么? 12. 已知A12O3(s),Fe2O3(s),MnO2(s)和MgO(s)的标准生成焓分别为: -1672,-823.5,-518.3,-601.9kJ?mol-1 (1) 试求生成1mol铁,铝热剂反应的热效应? (2) 若用MnO2来代替Fe2O3,要得到lmol Mn反应的热效应如何? (3) 如果用MgO来代替Fe2O3,此反应是放热还是吸热,Al能否把MgO还原到Mg? 13. 铟能显示+l和+3价态,但没有+2价态,但是它的氯化物中有一种分子式为InCl2,如何解释? 14. 为什么不能制得TlI3和Tl2S3? 15. 虽然TlI与KI是同晶型的,但为什么TlI不溶于水? 16. 铊的化学性质,在某些方面相似于铝,在一些方面相似于IA金属,试用化学事实来说明上述叙述。 17. 今有K2SO4、Pb(NO3)2、SnC12、SbC13、A12(SO4)3和Bi(NO3)3等六瓶溶液,如何用
第12章 氮族、碳族和硼族元素 习题参考答案 1. (1)解: NH 4 (NH 4)2SO 4HSO 4(NH 4)2Cr 2O 2O 3 + N 2 O (2)解: 2KNO 32 + O 2Cu(NO 3) 222 2AgNO 3 2.解:(1) 5NO 2-+ 2MnO 4- + 6H 5NO 3- + 2Mn 2+ + 3H 2O 3NO 2-+ Cr 2O 27 + 8H + →3NO 3- +2Cr 3+ +7H 2O (2) 2NO 2- + 2I - + 4H +2NO↑+ I 2 + 2H 2O (3) HNO 2+NH 2+ 2H 2O 3.解:(1) NH 4(NH 4)2SO 产生白色沉淀(BaSO 4) (2) KNO KNO 产生蓝色溶液(N 2O 3)、红棕色气体(NO 2) (3) AsCl BiCl SbCl 产生黄色沉淀(As 2S 3) Sb 2S 3)产生黑色沉淀(Bi 2S 3) 4.解:(1)S + 2HNO 3(浓) H 2SO 4 + 2NO↑ (2)4Zn + 10HNO 3(很稀) 4Zn(NO 3)2 + NH 4NO 3 + 3H 2 O (3)3CuS + 8HNO 3 3Cu(NO 3)2 + 3S↓ + 2NO↑ + 4H 2O (4)PCl 5+4H 2H 3PO 4+ 5HCl
(5)2AsO 33- + 3H 2S + 6H As 2S 3↓ + 6H 2O (6)AsO 43- + 2I - + 5H +H 3AsO 3 + I 2 + H 2O (7)2Mn 2+ + 5NaBiO 3 + 14H 2MnO 4- + 5Bi 3+ + 5Na + + 7H 2O (8)Sb 2S 3 + 3S 2-2SbS 33- 5.解:(1) NH 4 NH 3 O 2 Pt NO O 2 NO O 2H 2(Fe) N 2 2 2 NH 3 43 H 2SO 4( H 2SO 2 3 NH 3 (2) AsCl H 2As 23 2Na 3AsS 3 H 3AsO 3 H 4 2S(HCl)2S 5 Na 3AsS 4 (3) Na 3SbO Sb(OH) 3 SbOCl 2S 2S Na 3SbS 3 (4) 3 43) 3)3 Bi(OH)BiONO 3 6.解:A 是AsCl 3,B 是AgCl ,C 是[Ag(NH 3)2]Cl ,D 是As 2S 3,E 是(NH 4)3AsS 4,F 是As 2S 5,G 是H 2S 。有关反应式如下:
第十四章 碳族元素 Chapter 14 The Carbon Family Elements Carbon (C) Silicon (Si) Germanium (Ge) Stannum (Sn) Plumbum (Pb) §14-1 碳及其化合物 Carbon and its Compounds 一、General Properties 1.根据σ键的数目,碳可采取sp 、sp 2、sp 3杂化,其最大配位数为4 2.由于碳—碳单键的键能特别大,所以C -C 键非常稳定,具有形成均键(homochains)的 倾向 C -C N -N O -O F -F E (kJ·mol -1) 374 250 210 159 实 例 H 3C -CH 3 H 2N -NH 2 HO -OH 从碳到氮的单键键能的突减,是由于N 2分子中氮原子之间非键电子对排斥的缘故。 二、The Simple Substance 1.在第二周期中,氟、氧和氮都以双原子分子存在:F 2、O 2和N 2;而碳存在多聚物,其理由为:O 2和N 2的多重键要比σ单键(均键)强得多 如: , E (kJ·mol -1) 494 > 210 + 210 , 946 > 250 + 250 而: E (kJ·mol -1) 627 < 374 + 374 即C 2分子中的多重键比均链中的两个σ单键之和小,所以碳往往形成多原子均键,虽然在星际空间存在有C 2(g)分子。 2.Allotropes: diamond 、graphite 、fullerene (C 60、C 70)、carbin (carbon fibers) (1) 熵 S carbin >S graphite >S diamond (2) d C-C (nm): diamond > graphite > benzene > ethylene > carbin > acethylene (3) C graphite → C diamond ?r H m >0,?r S m <0 根据平衡,需要高压Pa 100.1106109?-?,(because of the insignificant reduction of volume),升高温度不利于平衡的移动,但为了达到该过程可以接受 的速率,反应温度大约在2000℃,近来已发明一种低压生产金刚石的方法:把金刚石晶种(seed )放在气态碳氢化合物(甲烷methane ,ethane )中,温度升高到1000℃,可以得到金刚石粉末或者crystal whiskers (4) C 60 由12个正五边形和20个正六边形组成,每个碳原子以sp 3、sp 2杂化轨道与 相邻的三个碳原子相连,使∠CCC 小于120?而大于109?28',形成曲面,剩余的p 轨道在C 60球壳的外围和内腔形成球面π键,从而具有芳香性。 O N N N N N C C C C C O O O
碳族元素和硼族元素 第1题(共6分) 实验室制备少量硅一般采用镁粉还原SiO2的方法,然后用稀盐酸洗涤产品以除去杂质。某同学在进行上述操作时,在制得的产品中加HCl洗涤时突然起火。 (1)请用化学方程式解释: ①稀盐酸洗涤产品可除去哪些主要杂质? ②为什么加HCl洗涤时突然起火? (2)请设计一个实验来验证你的解释。(不必画出装置图,也不必指出具体化学药品,不要写方程式,只要 简明指出方法。) 1.(共6分) (1) ① 2HCl+MgO H2O+MgCl2 2HCl+Mg H2↑+MgCl2 ② SiO2+4Mg Mg2Si +2MgO Mg2Si+4HCl SiH4+2MgCl2 SiH4+2O2SiO2+2H2O (2) 在N2保护下(或惰性气体),对硅烷气体进行检验。 SiH4+2KMnO4H2+K2SiO3+2MnO2↓+ H2O (不要求) (方程式各1分,检验1分) 第2题(8分) C60的发现开创了国际科学的一个新领域,除C60分子本身具有诱人的性质外,人们发现它的金属掺杂体系也往往呈现出多种优良性质,所以掺杂C60成为当今的研究热门领域之一。经测定C60晶体为面心立方结构,晶胞参数a=1420pm。在C60中掺杂碱金属钾能生成盐,假设掺杂后的K+填充C60分子堆积形成的全部八面体空隙,在晶体中以K+和C60-存在,且C60-可近似看作与C60分子半径相同的球体。已知C的范德华半径为170pm,K+的离子半径133pm。 11-1 掺杂后晶体的化学式为;晶胞类型为; 如果为C60-顶点,那么K+所处的位置是;处于八面体空隙中心的K+到最邻近的C60-中心的距离是pm。 11-2 实验表明C60掺杂K+后的晶胞参数几乎没有发生变化,试给出理由。 11-3 计算预测C60球内可容纳的掺杂原子的半径。 第11题(8分) 11-1 KC60面心立方晶胞体心和棱心710pm (各1分,共4分) 11-2 C60分子形成面心立方最密堆积,由其晶胞参数可得C60分子的半径:
第十五章 碳族元素 1.碳单质有哪些同素异形体?其结构特点及物理性质如何? 答:碳单质有三种同素异形体:石墨,金刚石和C 60。结构分为层状,网状和球状,见教材p730-732。物理性质主要是石墨能导电,金刚石硬度大,C 60有超导性。 2.实验室里如何制取二氧化碳气体?工业如何制取二氧化碳气体? 答:实验室法:O H CO CaCl HCl 2CaCO 2223+↑+=+ 工业法: CaCO 3 CaO CO 3.图15-6中,三条直线相交于一点,这是必然的还是偶然的,试讨论其原因。 答:是一种必然。 在Ellingham 图中,以ΔrG θ=ΔrH θ-TΔrS θ作ΔrG θ-T 图,斜率为ΔrS θ,截距为ΔrH θ。 反应:22CO O C =+ ΔrS θ≈ 0,所以为一直线 反应:22CO 2O CO 2=+ ΔrS θ< 0,直线上斜 反应:CO 2O C 22=+ ΔrS θ> 0,直线下斜 所以三线相交于一点是必然的。 3.分别向0.20mol·dm -3的Mg 2+和Ca 2+的溶液中加入等体积的0.20mol·dm -3的Na 2CO 3溶液,产生沉淀的情况有何不同,试讨论其规律性。 答:有CaCO 3沉淀,也有MgCO 3沉淀。 沉淀: CaCO 3 MgCO 3 Mg(OH)2 K sp 2.9×10-9 3.5×10-8 1.8×10-11 溶液中122L mol 1.02 1 20.0]Mg []Ca [-++?=?== 加入Na 2CO 3后溶液浓度为0.1mol/L 。 溶液中- 23CO []计算: 31[] 4.2210OH mol L ---= = = =?? ∵ -- +=+OH HCO O H CO 32_23 0.1-x x x
第16章硼族元素 16.1 硼族元素的通性 16.1.1 硼族元素的通性 包括硼、铝、镓、铟、铊五种元素。硼在自然界中有硼镁矿、硼砂等;铝在地壳中的含量仅次于氧和硅,占第三位,主要以长石、云母、高岭土等硅酸盐形式存在。镓、铟、铊比较分散,没有单独矿藏,与其他矿物共生。 硼的原子半径最小,核电荷对外层电子的吸引较强,为非金属,其余四种元素为金属,从硼到铝是由非金属突变到金属,不是逐渐过渡的。 ●硼族元素氧化物的酸碱性递变规律:硼的氧化物呈酸性,铝和镓的氧化物为两性,铟和铊的氧化物是碱性的。 ●硼族元素的价电子构型为ns2np1,一般氧化态为+III。“惰性电子对效应”,随着原子序数的递增,生成低氧化态的(+I)的倾向增强。 镓、铟、铊在一定的条件下能显示出+I氧化态,特别是Tl ,其+I氧化态常见,Tl(+I)的化合物具有较强的离子健特征。 ●硼、铝两元素亲氧特性表现得突出。 ●硼族元素价电子轨道(ns和np)数为4,而价电子仅为3,为缺电子原子,它们所形成的化合物有些为缺电子化合物。 有空的价键轨道,这些化合物有很强的接受电子的趋势,容易形成聚合分子(如:Al2Cl6)和配合物(如:HBF4)。在此过程中,中心原子价轨道由sp2杂化过渡到sp3杂化,相应分子从平面结构过渡到立体结构。硼原子最高配位数为4,而其它元素外层d轨道可参与成键,最高配位数可以为6。 16.2 硼族元素的单质及其化合物 硼在自然界主要以含氧化合物的形式存在。硼的重要矿石有硼砂
Na2B4O7·10H2O,方硼石2Mg3B8O15?MgCl2,硼镁矿Mg2B2O5?H2O等。铝在自 然界分布很广,主要以铝矾土矿形式存在,它是一种含有杂质的水合氧化铝矿。镓、铟、铊在自然界单独矿物,以杂质的形式分散在其它矿物中。 16.2.1 硼族元素的单质 1. 单质硼 (1) 单质硼的结构 单质硼有多种同素异形体,包括无定形硼和晶体硼。无定形硼为棕色粉末,晶体硼呈黑灰色。晶体硼有各种复杂的晶体结构(只有三种测出结构),但都是以B12 的20面体为基本单元。该20面体有20个等边三角形面和12个顶角硼 原子,每个硼原子与邻近的5个硼原子距离相等,如图16-2(a) 所示。 图16-2 B12 20面体 由于20面体之间的连结方式不同,键型不同,所形成的硼晶体类型不同。 图16-3 在α—菱形硼中的三中心键(虚线三角形表示三中心键) 最普通的一种是α—菱形硼:由B12单元组成的层状结构。在每层中,每个B12单元通过6个硼原子用6个三中心二电子键与在同一平面的6个B12单元
第十六章 硼族元素 1. 下表中给出第二、三周期元素的第一电离能数据(单位kJ ·mol 1-)试说明B,Al 的第 一电离能为什么比左右两元素的都低? 形成全充满的稳定结构。 2. 在实验室中如何制备乙硼烷,乙硼烷的结构如何? 答:氢负离子置换法: 3LiAlH 4+4BF 3??→?乙醚2B 2H 6+3LiF+3AlF 3 3NaBH4+4BF3?? →?乙醚 2B 2H 6+3NaBF 4 B 2H 6 的结构见课本P 778 3. 说明三卤化硼和三卤化铝的沸点高低顺序,并指出蒸汽分子的结构。 答:三卤化物的熔沸点顺序见课本P780 三卤化硼的蒸气分子均为单分子,AlF 3的蒸气为单分子。而AlCl 3的蒸气为二聚分子,其结构见课本P781 4. 画出B 3N 3H 6(无机苯)的结构。 答: 5. B 10H 14的结构中有多少种形式的化学键?各有多少个? 答:B 10H 14的结构 6. 为什么硼酸是一种路易斯酸?硼砂的结构应怎样写法?硼砂水溶液的酸碱性如何? 答:硼酸为缺电子化合物,中心原子B 上还有一个空的p 轨道,能接受电子对,因而为路易斯酸; 硼砂的结构式见课本P787; 硼砂水溶液显强碱性。 7. 试用化学反应方程式表示从硼砂制备下列各化合物的过程: (1)H 3BO 3 (2) BF 3 (3) NaBH 4 答:将硼砂浓溶液与浓硫酸作用后冷却得H 3BO 3 4233242454243])([SO Na BO H O H SO H OH O B Na +=++; 8. 怎样从明矾制备(1) 氢氧化铝,(2)硫酸钾,(3)铝酸钾?写出反应式。 答:将明矾KAl (SO 4)2 12H 2O 溶于水,加入适量KOH 溶液得到Al (OH )3沉淀; Al 3++3OH -=Al (OH )3↓
一、选择题 1 硼的独特性质表现在: (D) (A) 能生成正氧化态化合物如BN,其它非金属则不能 (B) 能生成负氧化态化合物,其它非金属则不能 (C) 能生成大分子 (D) 在简单的二元化合物中总是缺电子的 2 二氧化硅: (A) (A) 与NaOH共熔反应生成硅酸钠(B) 是不溶于水的碱性氧化物 (C) 单质是分子晶体,与CO2晶体相似(D) 属AB2型的化合物,晶体结构属CaF2型 3 CO与金属形成配合物的能力比N2强的原因是: (D) (A) C原子电负性小易给出孤对电子 (B) C原子外层有空d轨道易形成反馈键 (C) CO的活化能比N2低 (D) 在CO中由于C-←O+配键的形成,使C原子负电荷偏多,加强了CO 与金属的配位能力 6 下列无机酸中能溶解酸性氧化物SiO2的是: (C) (A) HCl (B) H2SO4(浓) (C) HF (D) HNO3(浓) 7 下列元素性质最相似的是: (A) (A) B和Al (B) B和Si (C) B和Mg (D) B和C 二、简答题: 1 为什么SiCl4水解而CCl4不水解? 要点:SiCl4具有空的3d轨道可接受H2O:中的孤电子对而水解,CCl4无空的价轨道不能接受H2O:中的孤电子对,因此不能水解. 2 为什么说H3BO3是一个一元弱酸? 要点:H3BO3是一个一元弱酸,它的酸性是由于B的缺电子性而加合了来自H2O中氧原子上的孤电子对成配键,而释放出H+,使溶液的[H+]大于[OH-]的结果: B(OH)3 + H2O ←→B(OH)4- + H+ 3、等电子原理是什么?与CO互为等电子体的有哪些?与CO2互为等电子体的有哪些?要点:核外电子总数相等的分子或离子; N2, NO+; NO2+ ,N2O,N3- 三、推断题 14mg某黑色固体A,与浓NaOH共热时产生无色气体B 22.4ml(标况下)。A燃烧的产物为
硼族元素硼族元素基本性质 第ⅢA族包括硼、铝、镓、铟和铊五种元素。其中除硼是非金属元素外,其余的都是金属元素,且其金属性随着原子序数的增加而增强。 硼族元素的一些基本性质列于下表中。 性质硼(B)铝(Al)镓(Ga)铟(In)铊(Tl)原子序数513314981 原子量10.8126.9869.72114.82204.38价电子构型2s22p13s23p14s24p15s25p16s26p1主要氧化态+3,0+3,0+3,(+1),0+3,+1,0(+3),+1,0共价半径(pm)88125125150155离子半径(pm)M+ M3+ - 23 - 51 - 62 132 81 144 95 第一电离势(kJ/mol)800.6577.6578.8558.3589.3电负性 2.04 1.61 1.81 1.78 2.04 硼族元素的特性 本族元素原子的价电子层结构为ns2np1,常见氧化态为+3和+1,随原子序数的递增,ns2电子对趋于稳定,特别是6s上的2个电子稳定性特别强。使得从硼到铊高氧化数(+Ⅲ)稳定性依次减小,即氧化性依次增强;而低氧化数(+I)稳
定性依次增强,其还原性依次减弱。例如:Tl(Ⅲ)是很强的氧化剂,而Tl(Ⅰ)很稳定,其化合物具有较强的离子键特性。
+Ⅲ氧化态的硼族元素具有相当强的形成共价键的倾向。硼因原子半径较小,电负性较大,使其共价倾向最强,其它的硼族元素成键时表现为极性共价键。 硼族元素的价电子层有4条轨道(ns、np x 、np y 、np z ),而只有3个价电 子,这种价电子层中价轨道数超过价电子数的原子称为缺电子原子,中心原子价轨道数超过成键电子对数的化合物称为缺电子化合物。如本族+Ⅲ价单分子化合 物BF 3、AlCl 3 等。缺电子原子在形成共价键时,往往采用接受电子形成双聚分子 或稳定化合物和形成多中心键(即较多中心原子靠较少电子结合起来的一种离域共价键)的方式来弥补成键电子的不足。 硼族元素电势图 下面列出了硼族元素的标准电极电势图。
碳族和硼族元素练习 一、选择题( 共17题34分) 1. (7643)与Na2CO3溶液作用全部都生成碱式盐沉淀的一组离子是……………………() (A) Mg2+,Al3+,Co2+,Zn2+ (B) Fe3+,Co2+,Ni2+,Cu2+ (C) Mg2+,Mn2+,Ba2+,Zn2+ (D) Mg2+,Mn2+,Co2+,Ni2+ 2. (7462)下列说法不正确的是……………………………………………………………() (A) SiCl4在与潮湿的空气接触时会冒“白烟”(B) NF3因会水解,不能与水接触 (C) SF6在水中是稳定的(D) PCl5不完全水解生成POCl3 3. (3718) 铅蓄电池在充电时,阳极反应是……………………………………………() (A) PbSO4 + H2O = PbO2 + 4H+ + SO-24+ 2e-(B) Pb + SO-24= PbSO4 + 2e- (C) PbSO4 + 2e-= Pb + SO-24(D) PbO2 + 4H+ + SO-24+ 2e-= PbSO4 + 2H2O 4. (0545) 已知在一定温度下 SnO2(s) + 2H2(g)Sn(s) + 2H2O(g) K c= 21.0 CO(g) + H2O(g)CO2(g) + H2(g) K c= 0.0340 因此下列反应SnO2(s) + 2CO(g)Sn(s) + 2CO2(g) 的K c值………………………() (A) 21.0 (B) 0.714 (C) 0.0243 (D) 21.1 5. (7476)分离SnS和PbS,应加的试剂为…………………………………………………() (A) 氨水(B) 硫化钠(C) 硫酸钠(D) 多硫化铵 6. (7475)鉴别Sn4+和Sn2+离子,应加的试剂为……………………………………………() (A) 盐酸(B) 硝酸(C) 硫酸钠(D) 硫化钠(过量) 7. (7466)下列分子中,C与O之间键长最短的是…………………………………………() (A) CO (B) Ni(CO)4(C) CO2(D) CH3COOH 8. (7363)将过量SiF4通入NaOH溶液中,主要产物是……………………………………() (A) H4SiO4,NaF (B) Na2SiO3,NaF (C) Na2SiO3,Na2SiF6(D) SiO2,HF 9. (4370)下列说法不正确的是…………………………………………………………() (A)HCO3-可通过氢键形成双聚离子(B) NaHCO3的热稳定性不如NaCO3高 (C) BeCO3在热水中就可发生分解(D) 所有碱金属碳酸盐都是易溶于水的 10. (4308) CO32-的几何构型是………………………………………………………() (A) 平面三角形(B) 三角锥形(C) T形(D) 直线形 11. (1460) 下列硫化物,能溶于Na2S溶液生成硫代酸盐的是…………………………() (A) SnS (B) SnS2(C) PbS (D) Bi2S3 12. (1456) 试判断Ge、Sn、Pb 分别与浓HNO3作用时,正确的说法是………………() (A) 三元素都被氧化成+2价(B) 三元素都被氧化成+4价 (C) Ge和Sn被氧化成+4价,但Pb却被氧化成+2价 (D) Ge被氧化成+4价,但Sn和Pb只却被氧化成+2价 13. (1451) IV A族元素从Ge到Pb;下列性质随原子序数的增大而增加的是…………() (A) +2氧化态的稳定性(B) 二氧化物的酸性 (C) 单质的熔点(D) 氢化物的稳定性 14. (7354)从分子轨道理论出发,可以认为在B2分子中存在的化学键是………………() (A) 三中心二电子键(B) 一个σ键 (C) 二个单电子π键(D) 一个σ键和一个π键
第十六章硼族元素 §16-1 硼族元素的通性 硼族元素:B、Al、Ga、In、Tl 价电子层结构:ns2np1 主要氧化数: B Al Ga In Tl +3 +3 +3,(+1) +1,+3 +1,(+3) 从Al开始为金属,但成键时表现为极性共价键 +3氧化态化合物特点:缺电子,易聚合,易与路易斯碱形成稳定化合物 元素电势图(P769):所有单质都具有还原 性,无氧化性,碱性 条件下还原性更强。 酸性条件下Tl3+具有 较强氧化性,Ga2+、 In2+、In+易歧化。 §16-2 硼族元素的单质及其化合物 一、硼族元素在自然界中的分布 二、硼族元素的单质
2Al
3.镓、铟、铊 Ga: 银白色光泽的软金属。熔、沸点相差最大,m.p.=302.78K, b.p.=2343K。凝固时体积膨胀。在 干燥的空气中不起变化。两性金 属。 In: 银白略带淡蓝色金属,比铅还软。 在干燥的空气中不起变化。不与 碱作用。 Tl:灰白色,重而软的金属,在空气中生成一层Tl2O膜。不与碱作用。 化学性质:M+O2(或S) 灼热M2O3(或M2S3)(M=Ga,In,Tl) M+X2= MX3(M=Ga,In,Tl)(X=Br,Cl; Tl无三溴化物) M+I MI3(或MI) (M=Ga,In) 2In(粉末)+6H2O=2In(OH)3+3H2↑ M+HCl MCl3(或
MCl)+H2↑ M+HNO3(稀)M(NO 3)3(或MNO3)+NO↑+H2O 2Ga+2NaOH+6H2O=2Na[Ga (OH)4]+3H2↑ 4.单质的提取和冶炼 B的制备: 碱法:Mg2B2O5.H2O+2NaOH=2NaBO2+2Mg (OH)2 4NaBO2+CO2+10H2O=Na2B4O7.10H2 O+Na2CO3 Na2B4O7+H2SO4+5H2O=4H3BO3+Na2S O4 2H3BO3 O3+3H2O B B2O3+3Mg=2B+3MgO 酸法:
碳族和硼族元素练习 (C) BeCO 3 在热水中就可发生分解 (D) 所有碱金属碳酸盐都是易溶于水的 10. (4308) CO 32 的几何构型是 (A) 平面三角形 (B) 三角锥形 (C) T 形 (D) 直线形 11. (1460) 下列硫化物,能溶于Na 2S 溶液生成硫代酸盐的是 ......................... ( (A) SnS (B) SnS 2 (C) PbS (D) Bi 2S 3 12. (1456) 试判断 Ge 、Sn 、Pb 分别与浓HNO 3作用时,正确的说法是 ................... ( (A) 三元素都被氧化成 +2 价 (B) 三元素都被氧化成 +4 价 (C) Ge 和 Sn 被氧化成 +4 价,但 Pb 却被氧化成 +2 价 (D) Ge 被氧化成 +4 价,但 Sn 和 Pb 只却被氧化成 +2 价 13. (1451) IVA 族元素从Ge 到Pb ;下列性质随原子序数的增大而增加的是 ............... ( (A) +2 氧化态的稳定性 (B) 二氧化物的酸性 (C) 单质的熔点 (D) 氢化物的稳定性 14. (7354)从分子轨道理论出发,可以认为在 B 2分子中存在的化学键是 ........... ( (A) 三中心二电子键 15. (4403) BF 3通入过量的 Na 2CO 3溶液,得到的产物是 ........................ ( ) 一、选择题 ( 共 17 题 34 分 ) 1. (7643)与Na 2CO 3溶液作用全部都生成碱式盐沉淀的一组离子是 ........... (A) Mg 2+,Al 3+,Co 2+,Zn 2+ (B) Fe 3+,Co 2+,Ni 2+,Cu 2+ (C) Mg 2+,Mn 2+, Ba 2+,Zn 2+ (D) Mg 2+,Mn 2+,Co 2+,Ni 2+ 2. (7462)下列说法不正确的是 ................ (A) SiCl 4在与潮湿的空气接触时会冒“白烟” (C) SF 6 在水中是稳定的 3. (3718) 铅蓄电池在充电时,阳极反应是??… (A) PbSO 4 + H 2O = PbO 2 + 4H + + SO 2 4 2 (C) PbSO 4 + 2e = Pb + SO 24 4. (0545) 已知在一定温度下 SnO 2(s) + 2H 2(g)Sn(s) + 2H 2O(g) CO(g) + H 2O(g)CO 2(g) + H 2(g) (B) NF 3 因会水解,不能与水接触 (D) PCl 5不完全水解生成 POCl 3 2 (B) Pb + SO 2 4 = PbSO 4 + 2e (D) PbO 2 + 4H + + SO 24 + 2e = PbSO 4 + 2H 2O + 2e K c = 21.0 K c = 0.0340 因此下列反应 SnO 2(s) + 2CO(g)Sn(s) + 2CO 2(g)的 K c 值??… (A) 21.0 (B) 0.714 (C) 0.0243 (D) 21.1 5. (7476)分离SnS 和PbS,应加的试剂为 .................... (A) 氨水 (B) 硫化钠 (C) 硫酸钠 6. (7475)鉴别Sn 4+和Sn 2+离子,应加的试剂为 ................ (A) 盐酸 (B) 硝酸 (C) 硫酸钠 (D) 多硫化铵 7. (7466)下列分子中, C 与 O 之间键长最短的是 (A) CO 8. (7363)将过量SiF 4通入NaOH 溶液中,主要产物是 (A) H 4SiO 4, NaF (B) Na 2SiO 3, NaF (C) Na 2SiO 3, Na 2SiF 6 (B) Ni(CO) 4 (C) CO 2 (D) 硫化钠 (过量 ) ...... ( (D) CH 3COOH ........ ( 9. (4370)下列说法不正确的是 ......................................... (A) HCO 3 可通过氢键形成双聚离子 (B) NaHCO 3 的热稳定性不如 ) (D) SiO 2,HF ) NaCO 3 高 ) ) ) ) (C) 二个单电子 键 (D) 一个 键和一个 键 (B) 一个 键
第十六章硼族元素 一、选择题 1 下列化合物属于缺电子化和物的是() a. BeCl2 b. H[BF4] c. B2O3 d. Na[Al(OH)4] 2 在硼的化合物中,硼原子的最高配位数不超过4,这是因为() a. 硼原子半径小 b. 配位原子半径大 c. 硼与配位原子电负性差小 d. 硼原子无价层d 轨道 3 下列关于BF3的叙述中,正确的是() a. BF3易形成二聚体 b. BF3为离子化合物 c. BF3为路易斯酸 d.BF3常温下为液体 4 下列各对物质中,中心原子的轨道杂化类型不同的是() a. CH4与SiH4 b. H3O+与NH3 c. CH4与NH4+ d. CF4与SiF4 5 下列金属单质中,熔点最低的是() a. Cu b. Zn c. Na d. Ga 6 下列化合物中,熔点最低的是() a. BCl3 b. CCl 4 c.SiCl4 d. SnCl4 7 下列物质在水中溶解度最小的是() a. Na2CO3 b. NaHCO3 c. Ca(HCO3)2 d. KHCO3 8 下列分子中,偶极矩不为零的是() a. BCl3 b.SiCl4 c. PCl5 d. SnCl2 9 下列金属中,与硝酸反应得到产物价态最高的是: () a. In b. Tl c. Sb d. Bi 10 下列氧化物中,氧化性最强的是: () a. SiO2 b. GeO2 c. SnO2 d. Pb2O3 二、简答题 1 炭火烧得炽热时,泼少量水的瞬间炉火烧得更旺,为什么? 2 C 和O 的电负性相差较大,但CO 分子的偶极矩却很小,请说明原因。 3 N2 和CO 具有相同的分子轨道和相似的分子结构,但CO 与过渡金属形成配合物
第十三章氮族元素 1. 试写出硝酸或硝酸盐被还原为六种不同产物的化学方程式。 2. 写出下列各种硝酸盐的热分解化学方程式: (1) NaNO3(2) NH4NO3(3) LiNO3(4) Cu(NO3)2(5) AgNO3 4. 指出下列各分子或离子中氮的氧化数:N2,NH4+,NaNO3,N2H4,NH2OH,NO2,N2O4,NH4NO3,N2O,NCl3,Li3N,HN3 5. 为什么硝酸能用于从Na2CO3制备CO2而不能用于从Na2SO3制备SO2?写出相应的反应方程式。 6. 什么叫同素异形体?磷有几种主要的同素异形体?它们的性质主要区别表现在哪些方面? 7. 计算下列各分子中磷的氧化数:PH3,H3PO2,H3PO3,H3PO4,H4P2O7,PH4I,P4,PCl3 8. 写出NaH2PO4、NaNH4HPO4和NH4MgPO4的热分解方程式。 9. 试从HO-P-OH的缩水过程表明焦磷酸,偏磷酸,链状三磷酸,环状三偏磷酸的结构式。 10. 已知H3PO2是一元酸,你能推断出此酸的结构式吗? 11. 为什么NCl3不稳定,易爆炸,而PCl3则不然?写出它们与水反应的化学方程式。 12. 估计下列各酸的p K1值:H2CrO4,HBrO4,HClO,H5IO6,HNO3 14. 为什么用浓硝酸处理固体As、Sb和Bi只能分别生成H3AsO4溶液、Sb2O5白色沉淀和Bi3+离子溶液? 15. 试说明为何无NX5和BiI5存在。 16. 试解释砷分族的硫化物皆有色且难溶于水的原因。 17. 为什么Ag3PO4黄色沉淀既能溶于醋酸又能溶于浓氨水? 18. 下面的排列顺序是碱性减少的顺序:NH3>N2H4>NH2OH,根据分子结构来解释此顺序。 19. 试解释:为什么有SF6化合物,而OF6不存在;为什么有PCl5化合物而NCl5不存在? 20. 试解释:(1)N2比O2、Cl2稳定(2) 红磷比白磷不活泼(3)Bi的熔点特别低 (4) 氮的最高共价为4,磷的最高共价为6 21. 在由砷酸盐在酸性介质中与H2S反应制备硫化砷(III)时,为什么说I-可以作为催化剂?用相应的反应方程式说明。 22. 试比较Mg3N2,NCl3,PCl3,BiCl3的水解产物并从中找出规律性。 23. 试解释为何N2比N2+有较大的离解能,而O2比O2+的离解能低。 24. 有一白色固体,溶于水,显弱酸性,加碱中和,再加入I2,则颜色消失,酸化后又有I2的棕黄色出现,试判断固体为何物,并写出反应方程式。 25. 如何鉴别某无色晶体是否为NaNO3、NaNO2或NH4NO3? 26. 某溶液中可能有As3+、Sb3+、Bi3+,如何鉴别? 27. 如何区别下列各组物质: (1) 硝酸盐溶液及亚硝酸盐溶液 (2) 磷酸溶液及亚磷酸溶液 (3) 固体氯化铵和硝酸铵 28. 如何将含有H3PO4、H3AsO4和Bi3+离子的混合溶液,彼此分离成含有H3PO4、H3AsO4和Bi3+离子的三个溶液? 29. 联氨的标准生成热为+50.88kJ?mol-1,试计算联氨的燃烧热。 N2H4(l) + O2(g) ?→N2(g) + 2H2O(l)