
省级药监局生产能力审核所需资料:
《健康相关产品生产企业卫生条件审核申请表》
《产品配方及包装》
《生产工艺简图及简述》
《与该产品生产有关的设备清单》
《《化妆品生产企业卫生许可证》复印件》
如涉及委托加工的,需要提供《委托加工协议书》
《委托书》
药监局审核所需要的资料:
1、申请育发、健美、美乳类产品的,应提交功效成份及其使用依据的科学文献资料;时限:从检验开始算起,大约8-10个月左右
费用:
代理费:防晒类10000元/个产品健美、美乳类产品15000元/个产品
检测费:育发类的检测是36800元;
检测费:防晒类13600元/个产品,如果需检测SPF值和PA值,检测费还需增加如下:
健美类和美乳类的检测费:31800元/个产品
祛斑类的检测费为:13700元
如果审核产品配方后发现可能会带入某种风险物质,风险物质的检测费为每项1000元
国产特殊用途化妆品行政许可变更 发布时间:2018-01-01 1. 申请材料清单 (1)化妆品行政许可变更申请表; (2)化妆品行政许可批件(备案凭证)原件; (3)根据申请变更的内容分别提交下列资料。 1)产品名称的变更:申请变更产品中文名称的,应在变更申请表中说明理由,并提交拟变更的产品中文名称命名依据及拟变更的产品设计包装(含产品标签、产品说明书)。 申请变更防晒产品SPF、PFA或PA值的应当提交相应的SPF、PFA 或PA值检验报告,并提交拟变更的产品设计包装(含产品标签、产品说明书)。 2)生产企业名称、地址的变更(包括自主变更或被收购合并):国产产品生产企业名称或地址变更,应当提交当地工商行政管理部门出具的 证明文件原件或经公证的复印件、生产企业卫生许可证复印件; 境内企业集团内部进行调整的,应提交工商行政管理部门出具的有关证明文件;涉及台港澳投资企业或外商投资企业的,可提交经 公证的《中华人民共和国外商投资企业批准证书》或《中华人民共和 国台港澳侨投资企业批准证书》复印件。 化妆品生产企业名称或地址(生产现场未改动)的变更,符合《国家食品药品监督管理总局关于简化化妆品生产企业名称或地址
(生产现场未改变)变更有关事宜的通知》要求的,应按照通知要 求申报。 涉及改变生产现场的,应提交拟变更的生产企业产品的卫生学(微生物、卫生化学)检验报告;对于国产产品,还应提交拟变更 的生产企业所在地省级食品药品监督管理部门出具的生产卫生条件 审核意见。 3)实际生产企业的变更:涉及委托生产加工关系的,提交委托生产加工协议书。 生产企业属于同一集团公司的,提交生产企业属于同一集团公司的证明文件及企业集团公司出具的产品质量保证文件。 拟变更的实际生产企业生产的产品原包装。 拟变更的实际生产企业生产产品的卫生学(微生物、卫生化学)检验报告。 拟变更的实际生产企业所在地省级食品药品监督管理部门出具的生产卫生条件审核意见。 4)变更特殊用途化妆品类别,应按照各类别要求提交相应的资料。 5)申请其他变更的,应详细说明理由,并提交相关证明文件。 2. 申请材料一般要求 (1)提交申报资料原件1份。
一、审批流程 前期准备——样品检验——整理申报材料——申请注册———材料审评——核发注册批件 二、各阶段具体工作 (一)前期准备 1、了解产品 了解产品在国外的生产和销售情况,是否合法企业,产品其生产国有无上市 2、申报前提 产品在国外有销售,能开具销售证明(由产品生产国政府主管部门或者行业协会出具,译为中文,并经国内公证机关公正);国内有法人公司作为在华责任单位,且获得国外厂家的授权(双方协商签订)。 3、签订代理合同 作为经销商,应当与国外生产企业签订《产品代理合同》,CFDA批文的有效期是4年,那么代理合同的有效期最好是4年以上。签订合同时,应当了解
外方是否能够提供相关的技术文献(如完整配方、工艺、质量标准等)和证明文件(如销售证明);如果是欧洲国家,还要了解相关国家是否同意进行动物实验,因为一些欧洲国家不同意动物实验。 4、授权书备案 授权书即上面提到的授权委托书(有外文英翻译成中文并到公证机关公正),在申请行政审批之前,到CFDA进行备案。 (二)检测样品 备案后,按照相关要求准备好送检资料和样本到CFDA指定的检测机构(备注有详细介绍) 比如:到上海疾病预防控制中心检验,提交材料1份产品配方、2份检验申请表、2份使用说明书,配方和说明书需加盖生产企业公章。同时准备一电子版送检清单(检验机构提供),按照要求填写表格,项目须与行政许可申请表中相应部分完全一致。 检验机构出具的检验报告应当包括以下资料: 1、检验申请表
2、检验受理通知书 3、产品使用说明 4、卫生安全性检验报告(微生物、卫生化学、毒理学) 5、如有以下资料也应当提交 人体安全性检验报告(皮肤斑贴、人体试用试验)?防晒指数SPF、PFA或PA值检验报告?其他新增项目检测报告(如化妆品中石棉检测报告) 境外试验机构出具的防晒指数(SPF、PFA或PA值)检验报告的,应当提交下列资料: 1、出具报告的实验室已经过实验室认证资格的,应当提交资格认证证书 2、未经认证的,应提交实验室严格遵循《良好临床操作规范》(Good Clinial Practice,GCP) (三)递交申请 向CFDA递交相关材料: 进口非特殊用途化妆品所需要资料列表如下:
化妆品生产车间工作流 程 公司标准化编码 [QQX96QT-XQQB89Q8-NQQJ6Q8-MQM9N]
化妆品生产车间工作流程 1、乳化车间 (要求不断自检每道工序产品质量并要求下一道工序监督上一道工序) --原料接收(按配方单核实原料数量和重量并签字确认)--配料(按配方生产工艺单要求严格操作)--乳化(关键控制点:设备工具消毒和运行状况、纯水、蒸汽、抽真空、均质、搅拌、温度等)―― 出料(料桶消毒、请检、称重)--贮存(半成品料请检)--待灌装(检验合格主方可灌装) 2、灌装车间(要求不断自检每道工序产品质量并要求下一道工序监督上一道工序)――领料(核对半成品料和灌装包材的名称、数量、质量并开具领料单签字确认)――灌装(设备工具消毒、运行状况)―― 称量(净含量是否与灌装要求一致)――拧盖(确认瓶与盖是否相配、 拧紧)――首支产品确认(确认与所灌装产品名称、净含量、样板是否相符,确认无误后开始批量生产)――包装(在线检确认合格后方可送出进行外包装) 3、包装车间 (要求不断自检每道工序产品质量并要求下一道工序监督上一道工序)――领料(核对包装材料的名称、数量、质量并开具领料单
签字确认――喷生产日期(确认与所包装产品名称生产日期、样板是否相符)――包装材料检查(确认与所包装产品名称、外观质量、样 板是否相符)――喷生产批号(确认与所包装产品名称生产批号、样板是否相符)――半成品检查(确认与所包装产品名称、外观质量、 样板是否相符)――装彩盒(按要求折好与产品相对应的彩盒并统放入固定位置)――装说明书(按要求折好与产品相对应的彩盒并统一放入固定位置)――封盒盖(确认盒内所放入物料齐全方可封盖) ――套膜(确认与所包装、外观质量、样板是否相符)――裁膜(要求平整、压实、无破裂)――封膜(光滑、无破损)――首支产品确认(确认与所包装产品名称、样板是否相符,确认无误后开始批量生产)――装箱前检查(检查产品名称、生产日期、外观是否合格)――装箱(确认与所包装产品规格、外箱质量)――核数(装箱数量)――入库(核实成品数量并开具入库单签字确认)4、辅助车间 (要求不断自检每道工序产品质量并要求下一道工序监督上一道工序)――领料(核对包装材料的名称、数量、质量并开具领料单签字确认)――清洗(设备工具消毒、运行状况,按不同种类不同的清洗方法操作):1、气压吹尘;2、纯水清洗、烘干;3、酒精擦试;――首支产品确认(确认与所清洗包装产品名称、方法、样板
化妆品流水线生产工序流程图
生产工艺及流程图 一、生产工艺: 按工艺要求在水相锅中投入称好的水相类原料,搅拌加热到80℃,在油相锅中投入称好的油相类原料于85℃完全溶解。将乳化锅预热至60~70℃,抽真空吸入水相及油相,均质搅拌,冷却至45℃加入香精及添加物,搅拌至均匀后出料。半成品检验合格后灌装,成品检验合格后入库。 二、生产工艺简图: 水 锅 油 锅 油相原料 水相原料 包 装 成 品 灌 装 乳化锅 加入香精 添加物 冷却45℃ 均质搅拌 半成品储料 出 料 80℃☆ 入 库 半成品检验合格☆ 半成品检验合格☆ 预热至60~70℃,抽真按工艺要求☆ 85℃溶解 吸入
(预热至60~70℃,抽真空 按工艺要求☆ 85℃溶解☆ 半成品检验合格☆) 注:带☆为主要质量控制点 三、原材料采购与检验流程图 原材料申购 (原料) 盖合格章 合格 不合格 原材料申购 申购单审批 选择供应商 采 购 申请检验 抽 样 检 验 合格通知单 进 仓 留 样 向供应商索取检验报告 工艺验证
四、洗瓶工序流程 不合格通知单 按不合格处理程序处理
备注: 巡检跟踪全过程 五、灌装工序流程图 真空瓶清洗 擦净表面 吹掉瓶内灰尘 装筐标识 臭氧消毒 压嘴清洗 净水浸泡擦洗 装筐标识 烘干 臭氧消毒
六、包装工序流程图 巡检 巡检 巡检 巡检 巡检 巡检 确认半成品 领取半成品 用风筒吹干,不得留有水分 检查半成品 喷 码 贴标识 折彩盒 放内托 装彩盒 填写喷码记录 确认标识是否正 确? 确认说明书 彩盒是否正确?
《化妆品生产企业卫生许可证》复核办理程序 一、许可内容 《化妆品生产企业卫生许可证》复核。 二、设定许可的法律依据 1、《化妆品卫生监督条例》第五条; 2.《化妆品卫生监督条例实施细则》第三条第(三)项。 三、许可数量 每家生产企业办理一个《化妆品生产企业卫生许可证》复核。 四、许可条件 1、深圳市境内的化妆品生产企业; 2、生产企业符合《化妆品卫生监督条例》第六条和《化妆品生产企业卫生规范》要求; 3、申报资料合法、完整和规范。 五、申请材料 1、《化妆品生产企业卫生许可证复核申请表》; 2、《化妆品生产企业卫生许可证》原件。 3、年度生产的化妆品品种清单。 六、申请表格 《化妆品生产企业卫生许可证复核申请表》。 可在深圳市食品药品监督管理局网站(https://www.doczj.com/doc/4613156906.html,)的服务指南区、广东省食品药品监督管理局网站(https://www.doczj.com/doc/4613156906.html,)的办事指南区下载,或到市民中心行政服务大厅24、25号受理窗口领取。
七、行政许可实施机关 广东省食品药品监督管理局。 受理地点:深圳市食品药品监督管理局24、25号受理窗口。 时间:每周一至周五,上午9:00-12:00,下午2:00-6:00。 八、许可程序 申请人递交申请材料——市局24、25号窗口受理——现场复核——核准并加盖省局复核章——告知,在窗口办理领证。 九、许可时限 自受理申请之日起20个工作日(整改时间不计入许可时限)。 十、许可证件及有效期 《化妆品生产企业卫生许可证》,有效期四年。 十一、许可的法律效力 取得《化妆品生产企业卫生许可证》后方可按许可项目组织生产化妆品。 十二、许可收费 无。 十三、许可年审或年检 每二年复核一次。 十四、咨询投诉机构 咨询:深圳市食品药品监督管理局窗口工作组 电话:82105840、82105841 投诉:深圳市食品药品监督管理局办公室 电话:82002708
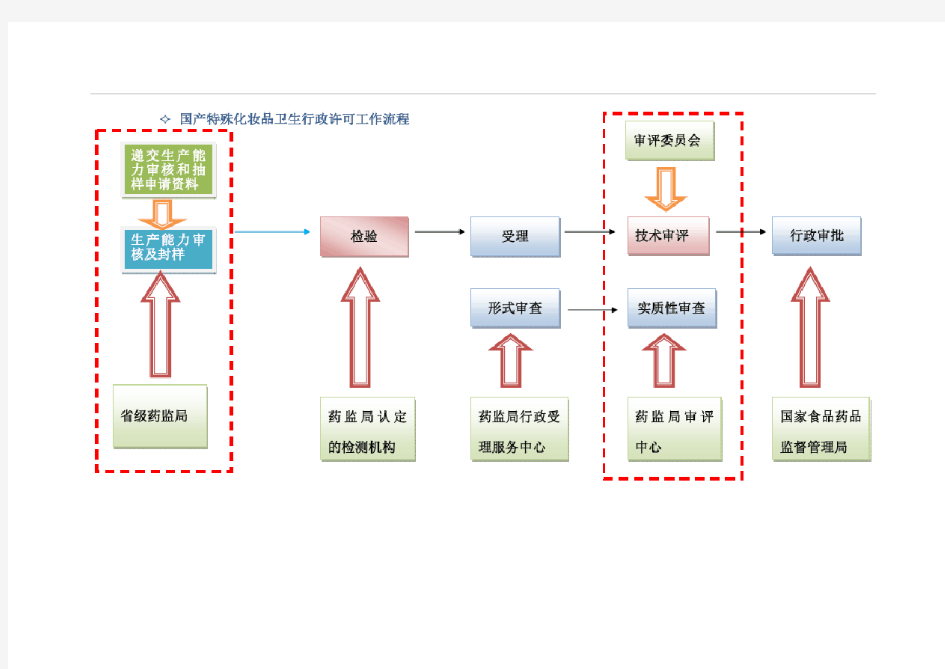
国产特殊化妆品申报指南 时间:2018-01-01 主管部门:国家食品药品监督管理总局 检测机构:化妆品行政许可检验机构(卫生安全性检验机构、人体安全性检验机构) 一、国产特殊化妆品定义: 是指最后一道接触内容物的(分装/罐装)工序在境内(中国大陆)完成的,育发、染发、烫发、脱毛、美乳、健美、除臭、祛斑(含美白)、防晒特殊用途化妆品。 二、国产特殊化妆品申报流程图 20个工作日 汇诚佳业取得批件合理时间(从送检开始至取得批件)是:8.5-10个月 三、国产特殊化妆品申报详细流程 1、在国家食品药品监督管理总局行政许可网上申报系统中注册企业用户名和密码 2、按照企业所在地的省级食品药品监督管理局的要求和流程准备生产能力审核资料并提交 3、领取化妆品生产卫生条件审核表。 4、按照《化妆品行政许可检验管理办法》确定检验项目 5、准备样品(数量、净含量均满足检验要求),按照相关要求进行封样。
6、填写检验申请表,与已封好的样品一并送至检验机构进行检验。 7、领取检验报告 8、按照《化妆品行政许可申报受理规定》要求,准备产品申报资料 9、将完整的申报资料送至国家食品药品监督管理总局行政受理服务大厅 10、等待产品审核结果 11、领取批件 四、申报资料清单 (1)国产特殊用途化妆品行政许可申请表; (2)产品名称命名依据; (3)产品质量安全控制要求; (4)产品设计包装(含产品标签、产品说明书); (5)经国家食品药品监督管理总局认定的许可检验机构出具的检验报告及相关资料; (6)产品中可能存在安全性风险物质的有关安全性评估资料; (7)省级食品药品监督管理部门出具的生产卫生条件审核意见; (8)申请育发、健美、美乳类产品的,应提交功效成分及其使用依据的科学文献资料; (9)可能有助于行政许可的其他资料; (10)产品技术要求的文字版和电子版。 另附省级食品药品监督管理部门封样并未启封的样品 1 件 五、申报材料要求 (1)首次申请特殊用途化妆品行政许可提交申报资料原件 1 份、复印件 4 份,复印件应清晰并与原件一致。 (2)除检验报告、公证文书、官方证明文件及第三方证明文件外,申报资料原件应由申请人逐页加盖公章或骑缝章。 (3)使用A4 规格纸张打印,使用明显区分标志,按规定顺序排列,并装订成册。 (4)使用中国法定计量单位。 (5)申报内容应完整、清楚,同一项目的填写应当一致。 (6)所有外文(境外地址、网址、注册商标、专利名称、SPF、PFA 或 PA、UVA、UVB 等必须使用外文的除外)均应译为规范的中文,并将译文附在相应的外文
您好 您咨询的化妆品申报过程如下: T he registration process of cosmetic that you consulted as follows: 化妆品申报过程和所需资料 Cosmetic registration process and required information 一、项目启动,提供在华申报责任单位授权书(签订协议后我公司提供模板) Providing authorization to the responsible units in China.(We will provide the template for you after signing agreement.)(SFDA need5workdays for approval)二、样品检测(时间5个月) sample testing(5months) 1、贵公司只需提供产品配方、说明书和送检样品;生产企业的基本信息。 You only need to provide product formulas,specifications and testing samples;basic information of manufacturer. 2、送样品检验(根据产品规格来定)。 To send samples for testing. 三、准备申报资料(我公司准备,在做检验同时完成)。 Preparing registration documents.(We complete it during the testing period.)(1)化妆品卫生许可申请表(我公司准备) Cosmetic sanitation license application form(We complete it) (2)产品命名依据(国外公司准备,但我公司需要审核) The named basis(Prepared by foreign company,but we need to review it.) (3)产品配方(100%复配成分表,含有PEG/SLS/SLES/AES等成分的需要原料厂商提供COA证明,里面要求含有二恶烷的含量证明)(国外提供,但我公司需要审核)Product formula(100%compound ingredients list,please provide the COA or specification of PEG/SLS/SLES/AES,which should include the wt%of dioxane)
国产特殊用途化妆品申报备案 根据国家相关法规规定,国产化妆品想要进入市场销售,应进行化妆品申报备案,否则无法在市场上进行销售。化妆品可分为特殊用途化妆品以及非特殊用途化妆品。 根据卫生部《化妆品卫生监督条例》中规定,特殊用途化妆品是指用于育发、染发、烫发、脱毛、美乳、健美、除臭、怯斑、防晒的化妆品。 国产特殊用途化妆品申报备案所需资料: (1)国产特殊用途化妆品行政许可申请表; (2)产品名称命名依据; (3)产品质量安全控制要求; (4)产品设计包装(含产品标签、产品说明书); (5)经国家食品药品监督管理局认定的许可检验机构出具的检验报告及相关资料或境外实验室出具的防晒指数(SPF、PFA或PA值)检验报告; (6)产品中可能存在安全性风险物质的有关安全性评估资料; (7)省级食品药品监督管理部门出具的生产卫生条件审核意见; (8)申请育发、健美、美乳类产品的,应提交功效成份及其使用依据的科学文献资料; (9)可能有助于行政许可的其他资料。 另附省级食品药品监督管理部门封样并未启封的样品1件。 国产特殊用途化妆品申报备案流程: 检验:在当地疾病预防控制中心或防疫站检验,当地不能检验的必须在中国疾病预防控制中心环境与健康相关产品安全所检验。检验机构接受企业的委托,完成企业要求的检测后,为企业提供相关的检测报告。 整理申报资料:根据卫生部的要求,整理一套符合评审规范的资料。 申请初审:到当地省级卫生行政部门(卫生厅或卫生局)申请参加化妆品初审。
产品初审后,根据初审委员会的意见,进一步完善申报资料,取得当地卫生行政部门同意上报的许可后,到卫生部卫生监督中心卫生许可受理处申请参加卫生部终审。 卫生部卫生监督中心卫生许可受理处对申请终审的产品资料进行初步审核,认为符合终审要求的,组织安排卫生部化妆品评审委员会的终审。 终审结束后,评委会如认为产品符合或基本符合化妆品的要求,则企业根据评委会的意见进行相应的修改后,重新将产品资料送至卫生部卫生监督中心卫生许可受理处,审批办公室将产品资料进行进一步的审核或直接进入上报卫生部批复流程。如评委会认为该产品需补做某些试验,或应提供某些重要资料,则该产品可能回重新参加大会评审。如评委会人该产品不宜作为化妆品申报,则在报请卫生部同意后,通知企业领取不予批准意见通知书。
彩妆工艺流程 Company number:【0089WT-8898YT-W8CCB-BUUT-202108】
唇膏生产工艺流程图 一、唇膏生产工艺流程图 二、开高速搅拌均质机并缓缓喷入料体; 三、将粉碎好粉体转入振动筛粉机过筛; 四、过筛的粉体存放24H; 五、检验合格后灌装、包装,成品检验后入库。 蜡和油脂溶解色粉放入三辊机内研磨 把研磨好的色粉加放到溶 解的蜡和油脂内进行搅拌 调好的颜色进行灌装 装箱、包装出厂装入塑胶盒中组装成成品 唇彩生产工艺流程图 一、唇彩生产工艺流程图 蜡和油脂溶解色粉放入三辊机内研磨 把研磨好的色粉加放到溶 解的蜡和油脂内进行搅拌 调好的颜色进行灌装 装箱、包装出厂装入塑胶盒中组装成成品 二、工艺流程简述 1、唇膏生产工艺流程图 2、开高速搅拌均质机并缓缓喷入料体; 3、将粉碎好粉体转入振动筛粉机过筛; 4、过筛的粉体存放24H; 5、检验合格后灌装、包装,成品检验后入库
粉类生产工艺流程图一、粉类生产工艺流程图 散粉生产工艺流程图 六、生产工艺简述 1.逐项称取A项组分,加入高速搅粉均质机; 2.逐项称取B项组分,加入加热锅加热至熔化为止; 3. 开高速搅粉均质机并缓缓喷入B组分; 4.将混合好的粉体转入粉碎机粉碎; 5.将粉碎好粉体转入振动筛粉机过筛; 6. 过筛的粉体存放24H; 7.检验合格后灌装、包装,成品检验后入库。 生产工艺简图
润唇膏生产工艺流程图 七、润唇膏生产工艺流程图 A B 防腐剂 香精溶解 *降温 55 ℃ 入袋包装迅速冷却合格 *真空脱泡冷却成型分装入托(模型)出料 * 17℃ 封口不合格 外包装 返工 成品 二、操作步骤 1.将去离子水和A相原料加入搅拌锅中加热升温(设定93℃),搅拌直至物料溶解完全,恒温20分钟。 2.通冷却水降温,待温度降到78℃时,加入B相原料,搅拌至反应完全。 3.继续降温,待温度达到60℃时,加入香精、防腐剂,搅拌至反应完全。
化妆品前处理操作流程 编写人:罗金仪 编写日期:2014-1-13 洗罐步骤:此过程所用的HNO 3为广州试剂公司生产,简称广试。H 2O 2为北京试剂公司生产,简称北试。HF 为进口HF ,小瓶装。 1、 化妆品罐(高压罐):定容完的化妆品罐,需加入HNO 3 12ml 。若罐子内部有明显的样 品残留如白蜡,则需用干净纸巾擦拭干净后再加酸。将已加酸的化妆品罐放入铁罐内,拧紧,然后放入电热鼓风干燥箱,简称烘箱,设置温度为145℃或185℃,4h 。烘箱停止后,待烘箱内部温度冷却至室温,取出铁罐。然后擦除外层铁罐后,加入三级水浸泡,待用。 2、 微波罐(常用作烟纸消解):定容完的微波罐,需加入HNO 3 5ml 、HF 1ml 、H 2O 2 1ml,然 后进行微波消解清洗。消解程序如下: 待用。 泡罐 定容 洗罐 加酸消解 称样 称样前处理 登单、扫单 送样
3、擦拭罐(用作擦拭的旧高压罐):定容完后,在罐子中加入HNO312ml,然后于电热板 (二档)加热10min,取下,冷却至室温,加入三级水浸泡,待用。 称样前处理指南: 1、化妆品项目:取用浸泡稀酸的高压罐,将其中稀酸倒去,用三级水冲洗,至少冲洗三遍。 然后用干净纸巾擦干高压罐外壁,并将罐内水分去除,不可用纸巾擦拭。若发现部分高压罐的编号不清晰,需用大头笔将其描写清晰。等待称样。 2、烟草项目:取用浸泡稀酸的微波罐,将其中稀酸倒去,用三级水冲洗,至少冲洗三遍。 接着装满5%的EDTA-2Na,振荡20秒。之后用三级水冲洗一遍。再装满一级水,振荡20秒,倒去水后,用干净纸巾擦干微波罐外壁,并将罐内水分去除,不可用纸巾擦拭。 若发现部分微波罐的编号不清晰,需用大头笔将其描写清晰。等待称样。 3、擦拭:由于我们只负责消解过程,不参与取样,所以不涉及称样前处理环节。 称样准则; 1、避免样品污染。 2、取样保持均一性。 3、取样质量避免差距过大,尽量取相近的质量,同时避免取样质量过大和太小。 消解指南:此过程所用的HNO3为使用进口HNO3即CNW HNO3,H2O2为北京试剂公司生产,简称北试。HF为进口HF,小瓶装。HCl为默克HCl,黑色瓶装。 1、化妆品项目:化妆品项目是采用烘箱消解方法,根据化妆品方法来添加酸。具体如下表;将已称好样品并加好酸的高压罐放入铁罐中,此时需要注意铁罐的底片及上盖的压片(有两 2 佩戴防毒面具,并提醒周边同事。
化妆品申报过程 化妆品分为普通化妆品和特殊化妆品两种,申报费用和时间不同。 进口普通化妆品申报过程 一、项目启动 1、贵公司只需提供产品配方、说明书、生产工艺和送检样品22个。 2、送样品检验 二、准备申报资料(我公司准备,在做检验同时完成)。 (1)进口化妆品卫生许可申请表 (2)产品配方 (3)生产工艺及简图 (4)产品质量标准(企业标准) (5)检验机构出具的检验报告 (6)产品设计包装(含产品标签) (7)产品说明书样稿 (8)自由销售证明和委托书(进口产品) (9)可能有助于评审的其它资料 注:资料送交卫生部前贵公司需提供自由销售证明和委托书。 三、资料送交卫生部后5个工作日做出答复是否受理。(5个工作日) 四、卫生部受理后行政签字,给予备案。(20个工作日) 绝大多数化妆品可以按普通化妆品申报 普通化妆品包括护肤品,发用品,彩妆品,唇膏,指甲油,香水类。
特殊化妆品包括育发类,健美类,美乳类,染发烫发类,防晒类,祛斑类,除臭类,脱毛类。 国产或进口特殊化妆品申报过程 一、项目启动 1、贵公司提供产品配方、说明书、生产工艺和送检样品。 2、送样品检验 检验周期:根据功能不同时间不同。 二、准备申报资料(我公司准备,在做检验同时完成)。 (1)进口化妆品卫生许可申请表(国产特殊化妆品申请表)(2)产品配方及依据 (3)功效成分及检验方法 (3)生产工艺及简图 (4)产品质量标准(企业标准) (5)检验机构出具的检验报告 (6)产品设计包装(含产品标签) (7)产品说明书样稿 (8)可能有助于评审的其它资料(如国内外有关资料) (9)自由销售证明和授权委托书(进口产品) 三、参加药监局定期举行的评审会(一个季度开一次会)。 四、评审会后7-15天下达评审意见,根据评审意见修改补充资料。 五、卫生部行政签字审批,颁发批文。(2-3个月)
化妆品良好生产规范 ISO22716(GMPC) 管理手册(最版全套) 含30个程序文件(原创全套)共112 页 2018年* 月* 日
颁布令 产品质量管理是涉及到我公司生存发展的一个环节,为了进一步完善企业的质量制度,加强各具体操作部门的规范化管理,由公司行政部负责,组织相关部门共同编制了此本“手册”。 现印发给各部门,希望以此能使我公司质量管理水平达到一个新的台阶,从而保证各项产品质量,提高企业整体效益。 同时任命 *** 为GMPC管理体系的管理者代表,负责公司GMPC管理体系的建立、维护和改进。 本手册于2017年9月1日起开始实施。 总经理:
公司简介 ***********有限公司是一家专业研发、生产、销售***的公司。本公司拥有强大的研发技术及生产能力,立足于自主开发,自主设计新产品,和国际上知名的品牌合作,开发出众多优秀的产品。产品采用高档进口原材料生产。
ISO22716:2007(GMPC)组织架构图
体系职能分配表 为了更好地执行ISO22716:2007(GMP)标准,公司编制了体系职能分配表,便于各部门遵照执行。
1. 制订目的 规范公司化妆品的生产、控制、贮藏和装运,使之符合ISO22716:2007(GMPC)标准要求。 2. 适用范围 公司化妆品的生产、控制、贮藏和装运的全过程。 3. 定义说明 3.1 验收标准 数值范围、区间后者其它适于测试结果验收的衡量方法。 3.2 审计 通过系统的、独立的检测来判定质量活动和相关结果是否符合计划安排,以及这些计划安排的实施是否有效并且有助于实现既定的目标。 3.3 批量 明确原材料数量、包装材料或产品发布的一个过程或者一系列过程以期实现材料的合理配置。 3.4 批号 识别一个批量所规定的不同的数字组合、字母和/或标志。 3.5 散货 任何已完成制造阶段、但不包括最后包装的产品。 3.6 校准 在特定的条件下设定一系列操作,建立起以一种测量工具、测量系统或实物测量方法得出的测试值与对应的参考标准已知值之间的关系。 3.7 变更控制 为了确保产品的制造、包装和贮藏符合明确的接受标准,GMP所包含的对于任何一种或多种变更计划活动的内部组织和责任。 3.8 清洁 为了确保一定程度的清洁和美观,利用多种方法分离和清除物体表面不同部分的可见污垢,包括化学方法、物理方法、高温方法、持续应用。 3.9 投诉 外部信息称一种产品未达到规定的验收标准。 3.10 沾污 在产品中出现了任何不良物质,例如化学,物理和/或微生物物质。 3.11 消耗品 在清洁、卫生处理或维护工作过程中消耗的例如清洁剂和润滑剂这样的物质。 3.12 合同受方 代表另一个个人、公司或组织执行一项工作的个人、公司或外部机构。
国产特殊用途化妆品行政许可检验 送检指南 一、适用范围 国产特殊用途化妆品:包括育发、健美、美乳、染发、烫发、防晒、祛斑、脱毛、除臭等9类。 二、送检要求 (一)资料要求 1、常规资料(可参考填写示范,详见附表1、 2、3) 序号资料名称数量要求 1 《化妆品行政许 可检验产品抽样 单》 一式1份 ?由省级化妆品卫生行政管理部门出具并加 盖公章 ?如需我所同时寄送人体安全性试验封样及 送检资料,请提供1份复印件,具体填写 要求请咨询人体安全性许可检验机构 2 《化妆品行政许 可检验申请表》一式2份 ?同上述进口化妆品 ?填写示范,详见附表1。 3 产品配方一式1份?配方为盖有省级食品药品监督管理局印章及申请企业公章的原件 ?余同上述进口化妆品 ?填写示范,详见附表3。 4 产品配方复印一式1份?加盖申请企业公章; ?如需我所同时寄送人体安全性试验封样及送检资料,请提供3份复印件,具体填写要求请咨询人体安全性许可检验机构 5 使用说明一式2份?纸质版,A4纸打印?中文填写 ?加盖申请企业公章
?如需我所同时寄送人体安全性试验封样及 送检资料,请提供3份,具体填写要求请 咨询人体安全性许可检验机构 ?填写示范,详见附表2。 6 送检清单1份?表格格式详见表2 表2 国产特殊用途产品化妆品送检清单 2、首次送检时,需提供加盖公章的送检企业营业执照复印件和送检者介绍信(或委托书,内容包括送检者姓名、证件号、办理事项和送检企业公章) (二)样品要求 1、一次性提供卫生安全性、人体安全性及其他特殊检测项目所需的数量,包装需完整,生产日期/批号需一致。 2、国产特殊用途化妆品样品为省级食品药品监督管理部门封样样品。市售包装,也可以为简易包装。简易包装需标明名称、型号/规格、申请企业名称、样品生产日期/批号、保质期/限期使用日期等信息。 3、送检数量参见附表4-5。 三、检测周期及费用
附件2 化妆品生产许可工作规范 第一章申请与受理 第一条从事化妆品生产,应当具备以下条件: (一)有与生产的化妆品品种相适应的生产场地、环境条件、生产设施设备; (二)有与化妆品生产相适应的技术人员; (三)有对生产的化妆品进行质量检验的检验人员和检验设备; (四)有保证化妆品质量安全的管理制度; (五)符合国家产业政策的相关规定。 第二条化妆品生产许可类别以生产工艺和成品状态为主要划分依据,划分为:一般液态单元、膏霜乳液单元、粉单元、气雾剂及有机溶剂单元、蜡基单元、牙膏单元和其他单元,每个单元分若干类别(见附1)。
第三条申请领取《化妆品生产许可证》,应当向生产企业所在地的省、自治区、直辖市食品药品监督管理部门提出,并提交下列材料: (一)化妆品生产许可证申请表(附2)。 (二)厂区总平面图(包括厂区周围30米范围内环境卫生情况)及生产车间(含各功能车间布局)、检验部门、仓库的建筑平面图。 (三)生产设备配置图。 (四)工商营业执照复印件。 (五)生产场所合法使用的证明材料(如土地所有权证书、房产证书或租赁协议等)。 (六)法定代表人身份证明复印件。 (七)委托代理人办理的,须递交申请企业法定代表人、委托代理人身份证明复印件和签订的委托书。 (八)企业质量管理相关文件,至少应包括:质量安全责任人、人员管理、供应商遴选、物料管理(含进货查验记录、产品
销售记录制度等)、设施设备管理、生产过程及质量控制(含不良反应监测报告制度、产品召回制度等)、产品检验及留样制度、质量安全事故处置等。 (九)工艺流程简述及简图(不同类别的产品需分别列出);有工艺相同但类别不同的产品共线生产行为的,需提供确保产品安全的管理制度和风险分析报告。 (十)施工装修说明(包括装修材料、通风、消毒等设施)。 (十一)证明生产环境条件符合需求的检测报告,至少应包括:(1)生产用水卫生质量检测报告(检测指标及标准详见附3); (2)车间空气细菌总数检测报告(检测指标及标准详见附3); (3)生产车间和检验场所工作面混合照度的检测报告(检测指标及标准详见附3)。 (4)生产眼部用护肤类、婴儿和儿童用护肤类化妆品的,其生产车间的灌装间、清洁容器储存间空气洁净度应达到30万级要求,并提供空气净化系统竣工验收文件。 检测报告应当是由经过国家相关部门认可的检验机构出具
化妆品业务跟单流程 一、接待客户 1、供货工厂整理好样品陈列室供客户参观,客户对产品有明确设计理念并提前知会,工厂 应准备好相应样品供客户挑选。 2、对客户选中的产品报价(无法现场报价的可推后,但必须在客户行程结束之前)。 3、双方业务员做好会议记录,客户对选中产品的细节要求及更改方案必需详细记录在案,以待备查。 4、对于客户选中产品工厂需要提供两套一样的订单(一套给客户,一套留存公司)。 二、订单确认 1、由我公司将双方审核无误的QUOTATION(报价单)发给客户。 2、客户选定产品,确认数量、单价、装箱量后由我方公司将ORDER LIST(订单)发给工厂,工厂提供产品、第二包装刀模(一般只需提供展示盒刀模,其他按照客户设计师要求提供)。 3、工厂按照客户药剂师提供的FT表格(Ficha Tecnic 及参数表格,见附件1)提供相对应的成分表,客户药剂师审核通过并修改格式后由我方公司发给工厂,工厂业务员复核无误后去做巴西领馆认证,认证费用由客户承担、工厂垫付。认证文件做好后要及时送到我方公司,费用将在相应产品出货后与货款一起结算。(attention:工厂业务员在检查过程中若发现错误或有疑问请联系我方公司,切勿擅自更改,否则因此而产生错误的成分表认证费用将由工厂自行承担)。 4、由我方公司将客户设计师发来的产品信息表(见附件2)、第一包装设计稿(标签 ..、 ..、底标 收缩膜 ..、卡头 ...、使用说明书 ..、背卡 ..等)检查后发给工 ...、个盒 .....等)、第二包装设计稿(展示盒 厂,工厂将产品信息表中的产品名称及所属品牌logo自行排版设计在产品塑壳、管材上,并且将设计稿发给我方公司让客户确定。(包材上产品名称和logo的摆放位置标准见附件3)。 5、工厂在收到设计稿及包材排版设计确认后,安排打样。并在7日内提供样品给我公司(attention:工厂检查时发现尺寸有误或文稿内容错误等问题请及时反馈给我公司,切勿擅自修改设计稿),特殊情况无法按时完成的需要用邮件通知我公司可提供的具体日期。所有 样品至少需要三份 ....。 ....、一份工厂留底 ..、一份给我公司留样 ......,一份提供给客户 6、根据产品信息表格制作固定格式的中盒、外箱标签并且发文稿给我方公司确认。外箱标签统一粘贴在外箱两面正唛的右下方,两面侧唛印刷整洁美观信息也必需填写完整,外箱文字可按照实际尺寸调整大小,但不能更改文字字体,封箱时胶带不能遮挡外箱上的文字。(外箱设计稿见附件4,中盒外箱的标签见附件5)。 三、签订合同 所有样品经客户确认后,我公司即与工厂签订购货合同。
国产非特殊用途化妆品备案管理办法 第一条为加强国产非特殊用途化妆品的备案管理,根据《化妆品卫生监督条例》及有关规定,制定本办法。 第二条本办法适用于中华人民共和国境内化妆品生产企业(以下称生产企业)生产的非特殊用途化妆品。 第三条国家食品药品监督管理局应加强对国产非特殊用途化妆品备案管理工作的指导。省级食品药品监督管理部门负责本行政区域内生产的国产非特殊用途化妆品备案管理,应建立健全备案管理工作制度,并按相关规定要求开展国产非特殊用途化妆品备案工作。 第四条国产非特殊用途化妆品应在产品投放市场后2个月内,由生产企业向所在行政区域内的省级食品药品监督管理部门申请备案,并按照有关要求提交备案资料,履行备案手续。 委托生产的,由生产企业(以下称委托方)向实际生产企业(以下称受托方)所在行政区域内的省级食品药品监督管理部门申请备案。 有多个受托方的,由委托方选择向其中一个受托方所在行政区域内的省级食品药品监督管理部门申请备案。委托方应将备案登记凭证复印件分别提交其他受托方所在行政区域内的省级食品药品监督管理部门。 仅限于出口的,由实际生产企业向所在行政区域内的省级食品药品监督管理部门申请备案。 第五条生产企业应当对备案产品申报资料的完整性、规范性、真实性和产品的安全性负责并承担相应的法律责任。
第六条申请国产非特殊用途化妆品备案的,应按照国产非特殊用途化妆品备案资料要求提交有关资料。 仅限于出口的化妆品,按照本办法的要求备案,并提交相关的资料。 第七条申请国产非特殊用途化妆品备案的产品中可能存在安全性风险物质的,应按照化妆品中可能存在的安全性风险物质风险评估指南的要求提交有关安全性评估资料。 第八条省级食品药品监督管理部门收到国产非特殊用途化妆品备案申请后,对备案资料齐全并符合规定形式的,应当当场予以备案并于5日内发给备案登记凭证;备案资料不齐全或不符合规定形式的不予备案并说明理由。 第九条备案登记凭证样式由国家食品药品监督管理局统一制定。 备案登记凭证号格式为:省、自治区、直辖市简称+G+妆备字+4位年份数+6位本行政区域内的发证顺序编号。 第十条生产企业不再生产已备案的产品时,应主动告知原备案的省级食品药品监督管部门,原备案的省级食品药品监督管理部门对告知情况予以备案。 生产企业对已获备案的产品,应自备案之日起,每满4年前4个月内向原备案的省级食品药品监督管理部门提交该产品是否继续生产的情况说明;逾期未提交的,原备案的省级食品药品监督管理部门应注销该产品的备案。 第十一条已获备案的产品,原备案内容发生变化的,应对发生变化的内容重新备案。 已获备案的产品,配方未发生改变的,生产企业不得申请改变原产品名称(违反有关法
特殊用途化妆品行政许可注册申报攻略之 国产防晒篇 作者:北京天健华成国际投资顾问有限公司化妆品注册部 防晒化妆品,顾名思义,是指添加了能阻隔或吸收紫外线的防晒剂来达到防止肌肤被晒黑、晒伤的化妆品。根据防晒原理,可将防晒霜分为物理防晒、化学防晒;根据防晒指数,又有SPF或PA值的区分。 那么,如何界定防晒类化妆品在行政许可注册申报工作中的法律地位呢?下面有必要引进一些官方术语。 术语定义 1.化妆品:是指以涂擦、喷洒或者其他类似的方法,散布于人体表面任何部位(皮肤、毛发、指甲、口唇等),以达到清洁、消除不良气味、护肤、美容和修饰目的的日用化学工业产品。 2.特殊用途化妆品:是指用于育发、染发、烫发、脱毛、美乳、健美、除臭、祛斑、防晒的化妆品。 3.非特殊用途化妆品:特殊用途化妆品以外的化妆品为非特殊用途化妆品。 4.国产化妆品:指最后一道接触内容物的(分装/罐装)工序在境内(中国大陆)完成的化妆品产品。 由以上定义可知,国产防晒类产品的注册申报,就是指最后一道接触内容物的(分装/罐装)工序在境内(中国大陆)完成的防晒类特殊用途化妆品的行政许可申请(为了表述准确,有点拗口哈)。
定义明确了,接下来我们需要讨论的是,该行政许可向谁申请?申请的条件是什么?申请流程、费用是怎样的?申请的资料要求及注意事项有哪些?常见的问题和误区是什么? 申报流程 我们首先来梳理一下国产防晒类产品行政许可的申报流程。
对于新手来说,估计看了上面的流程图就要头大了。为了便于理解,我们进行一下简单分解:1.国产防晒类产品行政许可向谁申请? 当前,主管特殊用途化妆品审批的部门为国家药品监督管理局,简称NMPA。国家中药品种保护审评委员会受NMPA的委托对受理品种进行技术审评,最终由NMPA负责审查并作出审批决定。国家药品监督管理局行政受理服务大厅负责送审资料的接收。在资料递送之前,应完成省级药品监督管理部门出具的生产卫生条件核查并出具审核意见,同时还应在NMPA认可的行政许可检测机构检测样品合格并出具检测报告。 申请人只要是国内合法化妆品生产企业均符合申请条件。 2.国产防晒类产品行政许可最终获得的批件是怎样的? 国产防晒类产品行政许可最终获得的批准文号为:国妆特字G+ 8位数字(前四位数字代表获得批准文号的那个年份),如国妆特字G2*******。批件的样式如下: 合格后颁发化妆品卫生许可批件
市场人员岗位职责 ■岗位名称:大区经理(高级讲师兼任) ■直接上级:市场总监 ■直接下级:讲师、芳香美疗导师 ■直接责任: 1、全面负责该大区域的销售任务、管理该区域服务人员及分配工作; 2、协助代理商组织的各种招商会、培训会、发布会、美容讲座等活动; 3、负责监管芳香美疗导师的工作; 4、培训好品牌的政策并指导代理商、加盟店、芳香美疗导师、业务人员的工作; 5、每天不定期与品牌小组人员沟通,进行有效的工作安排和跟进工作,了解市场信息,解 决市场出现各类问题; ■岗位名称:讲师 ■直接上级:市场总监、大区经理、技术总监 ■直接下级:芳香美疗导师 ■直接责任: 1.全面负责公司品牌专业、技术培训、促销推广; 2.负责产品知识咨询、技术指导、跟踪收集产品使用情况,解决产品使用过程中出现的各 种现象和问题; 3.独立完成片区售后工作和规定的销售业绩,做好工作报告; 4.负责主持沙龙会、发布会、美容讲座及终端会等推广活动; 5.负责进行产品技术巡回推广,同时开展售前、售中、售后服务; 6.培训指导经销商的美容导师、营销人员,使其迅速融入公司品牌的氛围中; 7.了解代理商进货及销售情况,做好进销存计划;
■岗位名称:芳香美疗导师 ■直接上级:大区经理 ■直接责任: 1.对经销商和加盟店美容师进行技术指导,做好终端加盟店的技术服务工作,使其完全接 受公司产品和新技术; 2.了解产品使用情况、售后服务品质,对客人投诉及时处理,对加盟店投诉及时反馈沟通; 3.将加盟店的培训需求、建议及时的反馈给讲师与代理商; 4.了解代理商进货及销售情况,做好进销存计划; 5.填写加盟店数据卡,加强与加盟店的联系与沟通; 6.做好售后工作并完成规定的销售业绩; 7.协助讲师进行终端会、美容讲座等方面的授课; 8.协助讲师做好驻店美容促销活动;
附件1 国产非特殊用途化妆品备案要求凡在中华人民共和国境内生产的非特殊用途化妆品,应当按以下要求进行产品备案: 一、备案程序相关要求 (一)生产企业应当在产品上市销售前整理、归档下列资料: 1.产品配方(不包括含量,限用物质除外。下同); 2.产品销售包装(含产品标签、产品说明书); 3.产品生产工艺简述; 4.产品技术要求; 5.产品检验报告; 6.委托生产协议复印件(委托生产的产品)。 第1、2项资料应当按要求通过统一的网络平台报送至所在地行政区域内的省级食品药品监管部门,其他资料由企业存档备查。 (二)委托生产的产品,委托双方应当分别向所在地行政区域内的省级食品药品监管部门报送备案信息。境外企业委托国内企业生产的产品及国内企业生产的仅供出口的产品,由实际生产企业向所在地行政区域内的省级食品药品监管部门报送备案信息。 (三)省级食品药品监管部门收到企业备案信息后,应
当在5个工作日内组织完成对产品是否属于备案范围、备案信息是否完整、备案信息是否符合规定形式等方面的核查。产品备案信息符合要求的,经省级食品药品监管部门确认后,在食品药品监管总局政务网站统一公布产品部分信息,供公众查询。 (四)对于不属于备案产品范围的、备案信息不齐全或不符合规定形式的,食品药品监管部门应当在5个工作日内告知企业并说明理由。食品药品监管部门在备案信息确认过程中发现产品存在明显违法情形的,对尚未上市销售的产品,应当责令改正;对已经上市销售的产品,应当依法予以查处,并在产品备案信息相关栏目予以标注。 (五)省级食品药品监管部门应当在备案后3个月内组织开展对备案产品的检查,发现不符合要求的,责令改正;发现违法的,依法立案查处,并在产品备案信息相关栏目予以标注。 (六)已经备案的产品,拟变更原备案事项的,应当在变更前将相关变更信息通过网络平台重新报送备案;涉及备案管理部门改变的,应当主动注销原备案信息后重新申请备案。 (七)已备案的产品,应当自备案之日起,每满4年重新确认产品备案信息。不再生产的,企业应当主动注销原备案信息。