
范围:适用于党参饮片的生产。
责任:生产部、质量保证部、饮片车间。
内容:
1标准依据:
1.1《中华人民共和国药典》2010年版?第二增补版
1.2湖南省中药饮片炮制规范(2010年版)
2产品概述:
2.1【来源】本品为桔梗科植物党参Codonopsis pilosula(Franch.)Nannf.、素花党参Codonopsis pilosula Nannf.var.modesta(Nannf.)L.T.Shen或川党参Codonopsis tangshen Oliv.的干燥根。秋季采挖,洗净,晒干。
2.2【炮制】:
2.2.1《中华人民共和国药典》2010年版?第二增补版:党参片除去杂质,洗净,润透,切厚片,干燥。
2.2.2 湖南省中药饮片炮制规范(2010年版):取原药材,除去杂质,洗净,润透,切长段片,干燥,筛去碎屑。
2.3【性味与归经】甘,平。归脾、肺经。
2.4【功能与主治】健脾益肺,养血生津。用于脾肺气虚,食少倦怠,咳嗽虚喘,气血不足,面色萎黄,心悸气短,津伤口渴,内热消渴。
2.5【用法与用量】9~30g。
2.6【注意】不宜与藜芦同用。
2.7【贮藏】置通风干燥处,防蛀。
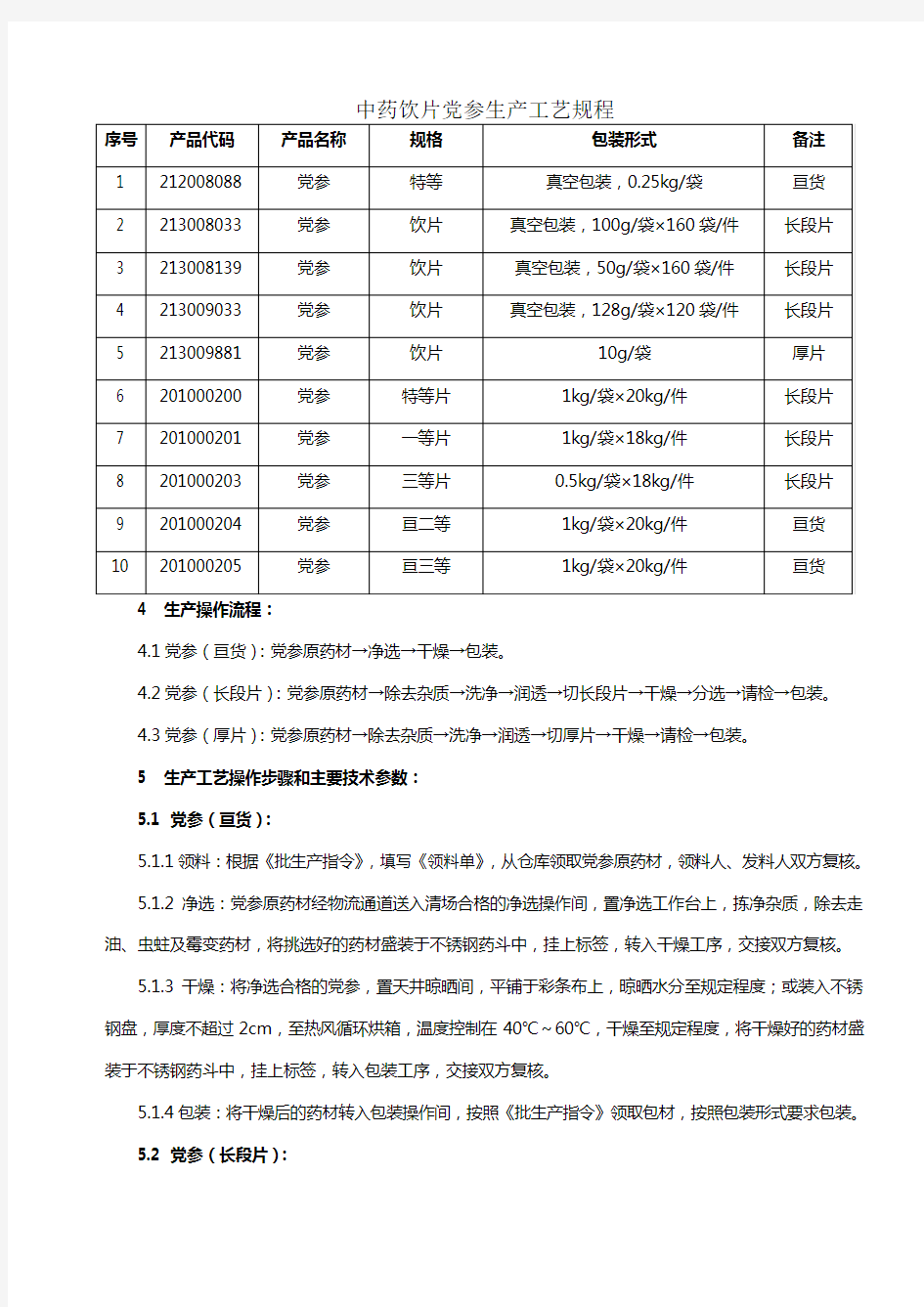
3 产品代码、名称、规格及包装形式:
4.1党参(亘货):党参原药材→净选→干燥→包装。
4.2党参(长段片):党参原药材→除去杂质→洗净→润透→切长段片→干燥→分选→请检→包装。
4.3党参(厚片):党参原药材→除去杂质→洗净→润透→切厚片→干燥→请检→包装。
5 生产工艺操作步骤和主要技术参数:
5.1 党参(亘货):
5.1.1领料:根据《批生产指令》,填写《领料单》,从仓库领取党参原药材,领料人、发料人双方复核。
5.1.2净选:党参原药材经物流通道送入清场合格的净选操作间,置净选工作台上,拣净杂质,除去走油、虫蛀及霉变药材,将挑选好的药材盛装于不锈钢药斗中,挂上标签,转入干燥工序,交接双方复核。
5.1.3干燥:将净选合格的党参,置天井晾晒间,平铺于彩条布上,晾晒水分至规定程度;或装入不锈钢盘,厚度不超过2cm,至热风循环烘箱,温度控制在40℃~60℃,干燥至规定程度,将干燥好的药材盛装于不锈钢药斗中,挂上标签,转入包装工序,交接双方复核。
5.1.4包装:将干燥后的药材转入包装操作间,按照《批生产指令》领取包材,按照包装形式要求包装。
5.2 党参(长段片):
5.2.1领料:根据《批生产指令》,填写《领料单》,从仓库领取党参原药材,领料人、发料人双方复核。
5.2.2净选:党参原药材经物流通道送入清场合格的净选操作间,置净选工作台上,拣净杂质,除去走油、虫蛀及霉变药材,将挑选好的药材盛装于不锈钢药斗中,挂上标签,转入干燥工序,交接双方复核。
5.2.3洗净:将净选合格的党参,至洗药池内,用流动的饮用水清洗干净,沥干余水,至润药框中,转入润药工序。
5.2.4润透:将洗净沥干余水的党参至润药间,润透,连同润药框转入切制工序,交接双方复核。
5.2.5切制:将润透的党参,至手工切药室,切3~5cm,至不锈钢药斗中,转入干燥工序,双方复核。
5.2.6干燥:将切制好的党参长段片,置天井晾晒间,平铺于彩条布上,晾晒水分至规定程度;或装入不锈钢盘,厚度不超过2cm,至热风循环烘箱,温度控制在40℃~60℃,干燥至规定程度;或至带式穿流干燥机传送带上,厚度不超过4cm,温度控制在40℃~60℃,干燥至规定程度。将干燥好的药材盛装于不锈钢药斗中,挂上标签,转入分选工序,交接双方复核。
5.2.7分选:将干燥后的党参至净选操作间分选,分选标准:
5.2.7.1党参特等片:3-5cm长段片;直径大于1.1cm片约占1/10;最小片直径不得小于0.8cm。
5.2.7.2党参一等片:3-5cm长段片;直径大于1.0cm片约占1/10;最小片直径不得小于0.6cm。
5.2.7.3党参饮片:3-5cm长段片;直径大于0.7cm片约占1/10;最小片直径不得小于0.55cm。
5.2.7.4党参三等片:3-5cm长段片;直径大于0.6cm片约占1/10。
5.2.7.5 尾料:剩余不符合以上等级的无规则片型。
5.2.8请检:将分选后的药材,盛装于编织袋中,称重,挂上标识卡,填写中间产品入库单,转入净料库,双方复核,同时填写请检单,通知QA取样送检。
5.2.9包装:中间产品检验合格后,依据生产指令,从净料库领取党参,从包材仓库领取包材,按照包装形式要求包装。
5.3 党参(厚片):
5.3.1领料:根据《批生产指令》,填写《领料单》,从仓库领取党参原药材,领料人、发料人双方复核。
5.3.2净选:党参原药材经物流通道送入清场合格的净选操作间,置净选工作台上,拣净杂质,除去走油、虫蛀及霉变药材,将挑选好的药材盛装于不锈钢药斗中,挂上标签,转入干燥工序,交接双方复核。
5.3.3洗净:将净选合格的党参,至洗药池内,用流动的饮用水清洗干净,沥干余水,至润药框中,转
入润药工序。
5.3.4润透:将洗净沥干余水的党参至润药间,润透,连同润药框转入切制工序,交接双方复核。
5.3.5切制:将润透的党参,至手工切药室,切0.3cm~0.5cm;或至机械切药间,用直线往复式切药机,切药厚度设置为0.5cm。将切好的党参至不锈钢药斗中,转入干燥工序,双方复核。
5.3.6干燥:将切制好的党参厚片,置天井晾晒间,平铺于彩条布上,晾晒水分至规定程度;或装入不锈钢盘,厚度不超过2cm,至热风循环烘箱,温度控制在40℃~60℃,干燥至规定程度;或至带式穿流干燥机传送带上,厚度不超过4cm,温度控制在40℃~60℃,干燥至规定程度。
5.3.7请检:将干燥后的药材,盛装于编织袋中,称重,挂上标识卡,填写中间产品入库单,转入净料库,同时填写请检单,通知QA取样送检。
5.3.8包装:中间产品检验合格后,依据生产指令,从净料库领取党参,从包材仓库领取包材,按照包装形式要求包装。
6 生产工艺操作要求:
6.1生产前必须进行工前检查,取得清场合格证,并签发生产合格证方可进行生产。
6.2净选后的药材不得直接接触地面。
6.3晾晒应有有效的防虫、防雨等防污染措施。
6.4使用流动的饮用水洗涤中药材,用过的水不得用于洗涤其他中药材。
6.5不同的药材不得同时在同一容器中洗涤、浸润。
6.6同一操作间内同时进行不同品种、规格的中药饮片,生产操作应当有有效的隔离措施。
6.7生产结束,必须进行清场,并有记录。
7 包装操作流程:
7.1产品代码:212008088,产品名称:党参,规格:特等,包装形式:0.25kg/袋。包装流程:
领料→装内袋→称量→放合格证、干燥剂、脱氧剂→抽真空→装外袋→封口→贴标签→装件(箱)
7.2产品代码:213008033,产品名称:党参,规格:饮片,包装形式:100g/袋×160袋/件。包装流程:
领料→装内袋→称量→放合格证、干燥剂、脱氧剂→抽真空→外袋贴标签→装外袋→封口→装件(箱)
7.3产品代码:213008139,产品名称:党参,规格:饮片,包装形式:50g/袋×160袋/件。包装流
程:
领料→装内袋→称量→放合格证、干燥剂、脱氧剂→抽真空→外袋贴标签→装外袋→封口→装件(箱)
7.4产品代码:213009033,产品名称:党参,规格:饮片,包装形式:128g/袋×120袋/件。包装流程:
领料→装内袋→称量→放合格证、干燥剂、脱氧剂→抽真空→外袋贴标签→装外袋→封口→装件(箱)
7.5产品代码:213009881,产品名称:党参,规格:饮片,包装形式:10g/袋。包装流程:
领料→小袋包装→贴标签→装外袋→封口→装件(箱)
7.6产品代码:201000200,产品名称:党参,规格:特等片,包装形式:1kg/袋×20kg/件。包装流程:
领料→装袋→称量→放合格证→封口→贴标签→装件(箱)
7.7产品代码:201000201,产品名称:党参,规格:一等片,包装形式:1kg/袋×18kg/件。包装流程:
领料→装袋→称量→放合格证→封口→贴标签→装件(箱)
7.8产品代码:201000203,产品名称:党参,规格:三等片,包装形式:0.5kg/袋×18kg/件。包装流程:
领料→装袋→称量→放合格证→封口→贴标签→装件(箱)
7.9产品代码:201000204,产品名称:党参,规格:亘二等,包装形式:1kg/袋×20kg/件。包装流程:
领料→装袋→称量→放合格证→封口→贴标签→装件(箱)
7.10产品代码:201000205,产品名称:党参,规格:亘三等,包装形式:1kg/袋×20kg/件。包装流程:
领料→装袋→称量→放合格证→封口→贴标签→装件(箱)
8 包装工艺操作步骤:
8.1领料:根据《批生产指令》或《批包装指令》,从上工序领取党参,或填写领料单从净料库领取党参药材,领料人、发料人双方复核;根据《批生产指令》或《批包装指令》,填写领料单,从包材库领取所需包装材料,领料人、发料人双方复核。
8.2 装袋、装内袋:依据包装形式规定的袋装数量,盛装与袋装量接近的药材。
8.3 称量:将装好袋或装好内袋的药材至电子秤准确称量。
8.4小袋包装:根据《批生产指令》或《批包装指令》,调试好背封手投式自动包装机,设定好背封温度,准确称量指令规定数量的药材,至背封手投式自动包装机中进行小袋包装。
8.5放合格证、干燥剂、脱氧剂:根据《批生产指令》或《批包装指令》,往准确称量好的药材内放入指令规定数量的合格证、干燥剂、脱氧剂。
8.6 抽真空:调试好真空包装机真空压力,将需要抽真空的药材至真空包装机中进行真空包装。
8.7 贴标签、外袋贴标签:根据《批生产指令》或《批包装指令》喷码、打码、打印信息,调试好喷码机(热打码机/打印机),经QA复核,对标签进行赋码。将赋码后的标签贴在产品开发指定的位置。
8.8 装外袋:将装好内袋的产品根据《批生产指令》或《批包装指令》规定的数量装入贴好标签的外袋。
8.9 封口:根据《批生产指令》或《批包装指令》,调试好多功能薄膜封口机或脚踏式封口机,进行封口。
8.10装箱:根据《批生产指令》或《批包装指令》指定的,将待装件(箱)产品准确计数,装入编织袋或纸箱,打包,。
9 包装工艺操作要求:
9.1包装前必须进行工前检查,取得清场合格证,并签发生产合格证方可进行生产包装。
9.2称量前检查称量器具是否在校准有效期内,称量净重控制在包装形式规定重量±1g以内。
9.3赋码、贴标过程应仔细核对标签内容(品名、规格、包装形式、批号、生产日期、有效期至、产地)与本批生产内容一致。赋码过程要求字迹清晰、内容准确无误。贴标过程要求位置端正,不偏不斜,不易脱落。
9.4封口要求严实,真空包装不易胀气,封口处整洁干净,无皱缩,不易脱开。
9.5同一操作间内同时进行不同品种、规格的中药饮片,包装操作应当有有效的隔离措施。
9.6生产结束,必须进行清场,并有记录。
10 生产场所关键房间与所用设备:
13.1物料平衡(消耗定额)明细表:
A、各工序及成品收得率、物料平衡计算及合格范围:参照上述“物料消耗定额明细表”判定。
B、包装材料物料平衡计算及合格范围:领用量=使用量+退库量+报损量。
13.3.1 凡物料平衡的计算,其收得率在合格范围内,经车间管理员及QA员结合其他工艺条件是否达到要求决定该物料是否递交下道工序。
13.3.2 凡物料平衡的计算,其收得率超出合格范围内,由计算人填写《偏差处理通知单》,按《偏差处理管理制度》进行处理。
14 工艺卫生要求:
14.1 个人卫生要求:
操作人员必须按照规定穿戴好相应工作区域的工作服,按规定洗手消毒后方可进入各操作间,各岗位人员必须严格遵守《人员进入一般生产区标准操作规程》。
14.2 工艺卫生:
物料必须按照规定经物流通道进入生产车间,生产过程中必须严格按照《一般生产区生产过程卫生管理制度》进行操作。
文件编号:******* 版本号:00 *****工艺再验证方案
*****有限公司
验证方案
目录 1.概述 (3) 1.1产品基本信息 (3) 1.2验证背景 (3) 1.3验证目的 (3) 1.4适用范围 (3) 2.职能部门及职责 (4) 3.风险评估 (4) 3.1目的 (4) 3.2范围 (4) 3.3评估方法 (4) 3.4评估标准 (5) 3.5风险评估结果及风险控制 (5) 4.验证项目、接受标准、实测结果及验证结论 (9) 4.1验证文件确认 (9) 4.2设备、设施及公用系统确认 (10) 4.3关键人员确认 (11) 4.4工艺参数控制确认 (12) 4.5成品质量确认 (14) 4.6稳定性考察试验 (15) 4.7偏差和变更控制 (15)
5.验证结果评定与结论 (15) 6.时间进度安排 (15) 7.附件 附件1:称量情况确认表 附件2:制粒生产过程记录表 附件3:压片生产过程记录表 附件4:包装质量检查记录表 其他附件:合格物料供应商名单、中间产品报告单、成品报告单、生产记录、培训记录、药品生产工艺验证合格证 1.概述 1.1产品基本信息 1.1.1产品名称:*** 1.1.2产品剂型:片剂 1.1.3产品规格:***
1.1.4药品批准文号:国药准字*** 1.1.5制剂批量:*** 1.1.6内包装:**** 1.1.7产品有效期:*** 1.1.8制剂生产工艺流程图: 1.2验证背景 ****为我公司中药制剂品种,制剂生产工艺于***年进行了再验证,验证结果判定为合格。***年月因生产需要,*******。 1.3验证目的 按照GMP及“附录2 确认与验证”的要求,应对*****制剂生产工艺进行再验证,以证明*******按照现行批准的生产工艺仍能生产出符合GMP要求、质量标准及注册标准要
××××颗粒工艺验证方案 VA/J—0 /00 起草人:日期:年月日会签人: 固体制剂车间:日期:年月日生产部:日期:年月日质量管理部:日期:年月日批准人:日期:年月日
××××颗粒工艺验证方案(前处理) 1.适用范围 本方案适用于公司中药提取车间小儿感冒颗粒(前处理)的工艺验证。 2.责任: 中药提取车间:负责工艺验证方案本车间验证的组织实施。 生产部:负责工艺验证方案起草。 质量管理部QA人员:负责协助验证方案的组织实施。 质量管理部QC人员:负责按计划完成工艺验证方案中相关检验任务;确保检验结论正确可靠。 QA验证管理员:负责验证工作的管理,协助工艺验证方案的起草,组织协调验证工作,并总结验证结果,起草验证报告。 质量管理部经理:负责工艺验证方案及报告的审核。 生产技术总监:负责工艺验证方案及报告的批准。 验证小组: 组长:×××× 副组长:×××× 成员:×××××××× 3.概述 小儿感冒颗粒是我公司已生产多年的产品,在多年的生产过程中,此产品生产工艺系统是稳定可靠的。公司现有的厂房都已经验证合格。工艺用水已检验合格,主要生产设备,样品取样及检验方法,设备清洁方法均已经进行验证合格。在人员培训合格并已经取得上岗证的基础上,辅以工序生产及检验结果依据。 4.验证目的 本产品工艺验证方案的目的:为评价小儿感冒颗粒产品生产系统要素和生产过程中可能影响产品质量的各种生产工艺因素提供系统的验证计划。以保证实现在正常的生产条件下,按照现生产工艺能够生产出符合质量标准的小儿感冒颗粒,并确认生产过程的稳定性及生产系统的可靠性。 在试生产的同时对小儿感冒颗粒(前处理)的生产工艺进行验证。进行生产工艺验证的产品批次为连续生产三批。
规范中药材 炮制操作, 确保中药材 质量。 范围: 中药材炮制 操作 责任: 生产部、提 取车间、中 药材炮制操作人员、QA监控员。 内容: 1.中药材炮制系指将中药材通过净制、切制或炮炙操作,制成一定规格的饮片,以适应医疗要求及调配、制剂需要,保证用药安全有效。炮制药材用水为饮用水、用醋为米醋、用酒为黄酒、用盐为食用盐。 1.1净制 中药材在切制、炮炙、调配或制剂时,均应使用净药材。净制药材可根据其具体情况,分别通过拣选、筛选、风选、洗、漂、剪、切、刮削、剔除、刷、擦、碾和捣等方法将杂质和非药用部位除去和分离,使药材达到炮制质量标准要求。 1.2 切制 药材切制时,除鲜切、干切外,须经浸润使其柔软者,应少泡多润,防止有效成分流失。并应按药材的大小、粗细、软硬程度等分别处理。注意掌握气温、水量、时间等条件。切后应及 时干燥,保证质量。 页脚内容1
切制品有片、段、块、丝等规格。其厚薄大小通常为: 片极薄片0.5mm以下,薄片1-2mm,厚片2-4mm; 段长10-15mm; 块8-12mm的方块; 丝皮类药材宽2-3mm,叶类药材丝宽5-10mm. 其他不宜切制的药材,一般应捣碎用。 1.3 炮炙 除另有规定外,常用的炮炙方法和要求如下: 1.3.1 清炒 1.3.1.1炒黄(包括炒爆):取净药材置加热容器内,用文火或中火炒至表面呈黄色,或较原色加深或发泡鼓起,或种皮爆裂,并透出固有气味,取出,放凉。 1.3.1.2 炒焦取净药材置加热容器内,用中火或武火加热,不断翻动,炒至药物表面成焦黄或焦褐色并具有焦香气味时,取出,放凉。 1.3.1.3炒炭取净药材置加热容器内用武火或中火加热,不断翻动,炒至表面焦黑色内部焦黄色或焦褐色。 1.3.2 加固体辅料炒 1.3. 2.1麸炒取麦麸置加热容器内,加热至冒烟时,放入净药材,迅速翻动,炒至药材表面呈米黄色或深褐色时取出,筛去麦麸,放凉。(蜜麸制法:蜂蜜置加热容器内加1/3饮用水,加热至沸,过滤得稀蜜液。干燥麦麸过筛置加热容器内翻炒至有热感淋入蜜液,翻拌并搨开蜜团,炒至麸不粘手、味香、麸色黄亮,取出,过筛冷却备用。除另有规定外,每100kg麦麸用蜂蜜20kg).除另有规定外,每100kg 净药材用麸皮10-15kg. 1.3. 2.2 米炒取米置加热容器内,加热至冒烟时,投入净药材,共同拌炒,炒至米呈黄色或焦褐色,药物挂火色,取出,筛取米,放凉。 页脚内容2
中药制剂工艺 中药材前处理生产管理要点 1. 中药材的验收 (1) 中药材验收人员,必须由有中药材鉴别真、伪、优、劣、规格、等级的业务知识,并掌握质量标准的人员担任。 (2) 净选前的中药材,包装应整齐每件附有合格证。注明品名、产地、进厂编号、检验证号,毛重、皮重、净重。并逐件检斤验质,将检验情况逐项填写原始记录。 (3) 合格的待加工中药材按通则要求码放,并发出加工通知书。 2. 净选本工序包括清除杂质和分离、去除非药用部用部位等过程。 (1) 中药材净选前应按通则要求做好清场工作。 (2) 净选工序应由会使用净选工具,掌握各种净选技术,熟悉加工方法,分清药用部位及非药用部分的人员操作。 (3) 净选后的药料要标明品名、批号、规格(等级)、数量、工号、挑选日期,并做好记录。 3. 水制 对水制的用水量,时间等技术要求,必须根据品种、规格(等级)、季节、气候等条件制订,并认真操作, 严格控制。 (1) 水制设施应清洁无异物。 (2) 水制应用饮用水,浸过一种药材的水,不得浸另一种药材。 (3) 淘洗药材时,最后一遍水洗应用流水冲洗。 (4) 除必须浸泡的药材外,应做到“少泡多润”、“药透汁尽”。 (5) 水制后药材应无泥沙、杂质、无伤水腐败和霉变异味及非药用部位。 (6) 水制后的药材,应及时淋干或甩干后,装入洁净容器,标明品名、重量、件数、生产日期、批号、工号迅速转入下工序。 4. 切制 切制包括切、镑、创、挫、劈等过程。操作人员应熟练掌握所使用的机具切制技术。 (1) 各种中药材饮片企业应有切制规格的标准,并按规格要求进行操作。 (2) 按质量要求进行切制,切制后的药材装在洁净的容器里,注明品名、重量、件数、生产日期、批号、工号迅速转入下工序。 (3) 切制后的药材应及时干燥并做好记录。 5. 炮制本工序包括炒、灸、煮、蒸、炖、烊、煨、烫、制霜、制炭、水飞、复制、发酵、发芽、提净等过程。 (1) 本工序操作人员应是具有二年以上炮制操作经验的技术工人,并在中药技师的指导下操作。 (2) 应制定炮制品质量标准,并有炮制前、后实物标本作对照。 (3) 各类药材炮制前应符合饮片质量标准,炮制时应严格按炮制规范应用辅料,根据品种特点制定炮制时间、温度和程度等工艺规定,严格掌握操作方法和质控要点,炮制后炮制品应符合质量标准。 (4) 炮制品冷透后应用洁净专用容器盛装,标明品名、数量、工号、炮制日期、批号、作好原始记录,及时转入下工序。 (5) 对直接入药无需灭菌的炮制品应用无菌包装盛装。 6. 干燥 (1) 干燥设备应清洁无异物。定期检查其干燥设备的温度均匀性,发现问题及时解决。 (2) 应依药材性质不同制订各类饮片干燥方法,提出不同的工艺条件。 (3) 干燥中要定时倒盘和翻料,防止糊化,并应定期验证干燥设备温度的均匀性,发现问题及时检修。 (4) 干燥后的净药应用洁净容器盛装,附标签,标明品名、数量、工号、批号、生产日期并作好记录。 7. 配料 (1) 本工序操作人员应由能鉴别中药材、掌握药材质量标准、保管技术熟悉配伍及上、下道工序工艺操作的人员担任。 (2) 本工序收、存、发等过程操作,应参照通则生产技术管理中的车间物料管理办法执行。收料时做好验收、检验工作,认真核对药材的品名与实物、称重无误后收料。 配料时由专人填写配料卡、车间工艺员复核并签名,投料操作者与复核者核对品名与物料一致后,称重投料并签名。对剧毒、贵重和部分容易发生差错的净药料应建立监督投料制度,由车间工艺员、质检员监督投料,签名并严格执行。
...............有限公司片剂工艺验证方案文件编号JM-JSB-ZYZ(01)-053-02 ...............有限公司 生产质量技术标准文件 .....片工艺验证方案 文件编号:JM-JSB-ZYZ(01)-053-02 2020年03月
...............有限公司 验证立项申请表
...............有限公司 验证方案审批表
验证小组成员及职责 验证实施前对参与验证人员进行确认,小组成员经过本方案的培训,掌握验证目的和验证程序及可接受标准。 目录
1.验证目的 2.验证范围 3.产品概况 4.验证涉及文件 5.验证背景 6.片剂生产工艺质量风险评估 7.工艺验证方法及验证实施 7.1验证要求 7.2验证实施 7.2.1药粉制备工序验证实施 7.2.2提取浓缩收膏工序验证实施 7.2.3喷雾制粒干燥工序验证实施 7.2.4整粒、总混工序验证实施 7.2.5压片工序验证实施 7.2.6包糖衣工序验证实施 7.2.7铝塑包装工序验证实施 7.3收率或物料平衡 7.4成品质量的检测 7.5片剂持续稳定性考察 8.偏差及变更 9.验证时间安排 10.拟定再验证周期 11.评价报告及验证结论 12.验证证书 13.培训 附件1:验证方案修改申请及批准书 片剂工艺验证方案
1.验证目的 工艺验证是在预先经过确认所有的生产条件下,确认按规定的生产工艺规程生产的最终产品符合质量标准的要求。确认该工艺是有效的、可重现的。 通过对生产过程各工序的质量控制指标的检测及各个岗位的操作数据分析,对片剂生产照预先设定的目标和指标进行对比,对过程工艺执行情况进行综合的评价和系统的分析,综合评定本生产线生产工艺的安全性、稳定性和可靠性。 通过验证可以提前发现问题,确保生产出符合预定用途和注册要求的产品。所以对片剂生产线进行全面的工艺验证。本方案是以连续生产三批片剂[批量为150万片(525kg)]为代表,对片剂生产工艺进行验证。 验证过程严格按本方案规定的内容进行,若因特殊原因确需修改时,应填写“验证方案修改申请及批准书”(附件1),报验证委员会批准。 2.验证范围 本验证方案适用于在本方案指定的厂房、设施、设备、工艺条件下片剂的生产工艺验证,当上述条件改变时,应重新验证。 3.产品概况 3.1品名:片剂 3.2剂型:片剂 3.3性状:本品为糖衣片,除去糖衣后显褐色;味微苦涩。 3.4规格:基片重0.35克 3.5处方和依据 3.5.2依据:国家食品药品监督管理局标准YBZ03012008 3.6片剂药材提取、粉碎工艺流程图
2014 中药药剂学各剂型制备工艺流程汇总 一、一般散剂的制备 工艺流程:粉碎→过筛→混合→分剂量→质量检查→包装 (一)粉碎与过筛 内服:细粉 儿科、外用:最细粉 眼用:极细粉 二、特殊散剂的制备 1.含毒性药物的散剂 倍散:指在小剂量的毒性药物中添加一定比例量的辅料制成的稀释散。 -0.1g:10倍散 -0.01g:100倍散等量递增法混合 <0.001g:1000倍散 剂量上限×稀释倍数=1 2.含低共熔混合物的散剂
低共熔现象:两种或两种以上的药物混合时出现润湿或液化的现象。低共熔药物:薄荷脑+樟脑; 薄荷脑+冰片 樟脑+水杨酸苯酯 视药理作用变化,决定是否低共熔 药理作用增强或无变化——可低共熔 药理作用减弱——避免出现低共熔 3.含液体药物的散剂 4.眼用散剂 无菌、过200目的极细粉 极细粉:全部通过八号筛,并含能通过九号筛不少于95%的粉末 二、合剂的制备 1.工艺流程:浸提→纯化→浓缩→配液→分装→灭菌。
2.制备要点: 浸提:煎煮法、双提法(芳香挥发性成分)。 纯化:离心分离→水醇法→吸附澄清法。 方法及其参数的选择(如含醇量、澄清剂用量以及离心的转速等)应以不影响有效成分的含量为指标。 浓缩:每次服用量——10~20ml。 配液: 添加矫味剂、防腐剂,调节pH,加液体药料(酊剂、醑剂、流浸膏,应以细流缓缓加入药液中,随加随搅拌,使析出物细腻,分散均匀)。 灭菌: 小包装:流通蒸汽、煮沸(100℃,30min)大包装:热压 三、糖浆剂的制备★ 工艺流程:
二、煎膏剂的制备 工艺流程: 炼糖方法: 蔗糖+水+酒石酸—→加热溶解—→微沸熬炼—→滴水成珠,脆不粘牙,色泽金黄(糖转化率达到40%~50%) 酒剂的制备工艺流程 酊剂的制备工艺流程 二、分类和制备
***********中药注射液提取生产工艺 验证方案及报告 文件编号: 文件类别:验证 ************药业有限公司 目录 验证立项申请
验证方案批准……………………………………………………………………… 验证小组人员名单………………………………………………………………… 1.目的……………………………………………………………………………… 2.职责…………………………………………………………………………… 3.适用范围……………………………………………………………………… 4.验证背景……………………………………………………………………… 5.验证所需文件………………………………………………………………… 6.工艺风险分析………………………………………………………………… 7.验证程序………………………………………………………………………… 7.1***********中药注射液提取处方……………………………………… 7.2 工艺流
7.3生产操作…………………………………………………………………… 8. 工艺过程风险评估………………………………………………………… 9.工艺验证过程………………………………………………………………… 9.1提取效果的确认…………………………………………………………… 9.2 65%含醇量冷沉时间的确认……………………………………………… 9.3 75%含醇量冷沉时间的确认…………………………………………… 9.4收膏质量和数量的确认………………………………………………… 10.再验证周期………………………………………………………………… 11.验证中偏差/变更处理……………………………………………………… 12.培训……………………………………………………………………………
编号: 药业有限公司生产工艺验证方案 栓剂车间生产工艺验证方案 验证方案制订 验证方案审查 验证方案最终审查及批准
目录1.引言 1.1.概述 1.2.文件 2.目的 3.验证准备 4.验证步骤 4.1.配制 4.2制袋 4.3灌注、冷凝、封口 4.4包装 5.验证周期 6.验证结果及评价
1.引言 1.1概述 本次验证采用下列处方: 理论处方实际处方 甲硝唑 2.00kg 2.08kg 克霉唑 1.6kg 1.632kg 醋酸氯己定 0.08kg 0.088kg 石蜡 1.2kg 1.2kg 羊毛脂 5g 5g S—36#或38# 12kg 12kg 10000枚 10000枚 共进行三批次生产。进行工艺确认。 1.2.文件 1.2.1.栓剂设备操作规程存放处 1.2.2.工艺规程、岗位操作SOP 存放处 1.2.3.关键设备的验证报告存放处 1.2.4.产品质量标准及产品检验操作规程存放处 2.目的:确认双唑泰栓的配制、灌注、冷却、封口、包装等工序的生产工艺过程,栓剂生产的工艺参数,并确认在此工艺条件下,三批双唑泰栓各项检测指标均符合产品法定质量标准要求。 3.验证准备 3.1.关键设备验证已完成。 3.2.公用工程系统已验证,并处于运行状态。 3.3.有关衡器、仪表等均已经过校正。
3.4.原辅材料检验合格,待用。 3.5.所需设备、器具均已清洁。 4.验证步骤 4.1配制、灌封参数验证 检查人: 4.1配制 栓剂配制工艺流程
现场检查设备是否按上述流程配置,检查栓剂配制罐验证报告。结论: 检查人:日期: 4.1.1配料 4.1.1.1环境监测 标准:室温 18~26℃ 相对湿度 45~65% 洁净级别十万级 结论:见外用药车间洁净厂房验证报告。 4.1.1.2.按操作规程进行原辅料备料 批号: 批号: 批号:
口服固体制剂 中成药胶囊剂工艺验证方案 XXXX药业有限公司 年月
目录 验证方案会签与批准表 1 引言 1.1 概述 1.2 验证条件 1.3 验证范围 2 验证目的 3 验证小组成员及其职责 4 文件资料 5 工艺流程及处方 6 验证内容 6.1.中药饮片的验证 6.2原辅料验证 6.3 称量配料工艺验证 6.4制粒干燥工艺验证 6.5整粒总混工艺验证 6.6充填工艺验证 6.7铝塑包装工艺验证 6.8外包装工艺的验证 6.9产品的验证 7 验证周期
验证方案会签与批准表
1 引言 1.1 概述: 阐述XXXX囊产品的类型、药品剂型、生产车间概况。XXX胶囊是本公司的一个新品种,为确保产品工艺的稳定、重现性及可操作性,保证按照制定的工艺生产出来的产品质量可靠,故必须对制定的生产工艺进行验证。 1.2 验证条件: 口服固体制剂X车间生产所涉及到的生产设备、设施及公用工程系统已通过了全面的验证; 计量检定、检验方法的验证已完成;所配套的软件(生产、质量相应的)均对生产过程有保障。 1.3 验证范围:XXXX胶囊工艺流程包括:中药材、原辅料、称量配料、制粒干燥、整粒总混、 充填、铝塑包装、外包装等。 2 验证目的: 2.1 证实该产品的工艺过程稳定,生产工艺重现性好,没有发生漂移。完全能够生产出符合内 控质量标准要求的产品。 2.2 各种文件管理符合GMP要求。
4 文件与设备 4.1 文件:检查下列文件是否齐全,并在指定地点存放,并将检查结果填入文件检查确认表。 4.2设备仪器:检查设备检验设备是否在制定地点安装,设备能力是否满足生产需要。将检查结果填入设备检查记录表中。
工艺验证方案 1
下载文档 收藏 1工艺验证方案 体外诊断试剂质量管理体系文件 北京生物医学科技有限公司生产工艺验证方案类别:验证方案编号: 部门:XXXXXX 诊断试剂盒(AAAA)工艺验证小组页码:共 23 页,第 1 页 XXXX(XXXX) XXXX(XXXX)诊断试剂盒 (AAAA)工艺验证方案 AAAA)版次: □ 新订□ 替代: 年月日制定人: 审批会签: (验证小组) 批准人: 生效日期: 年年月月日日共 23 页,第 1 页 北京易斯威特生物医学科技有限公司生产工艺验证方案目录一. 目的 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈3 二、范围 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈3 三、职责 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈3 1、验证委员会 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈3 2、工艺验证小组 2
备科 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈4 4、生产部 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈4 5、质量检验部 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈4 四、验证内容 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈4 1、文件 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈4 2、方案概要 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈5 3、验证步骤 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈5 五、时间进度表 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈10 六、验证周期 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈11 七、验证结果评价和建议 ┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈11 八、附件 3
目的:对中药加工过程中的净制工序进行验证,验证净制工序的可行性和稳定性,保证产品质量。 范围:适用于中药加工过程中的净制工序的验证。 责任:验证小组负责对此工艺的验证,生产人员协助操作。 内容: 1. 材料及设备: 中药材或中间产品、磅秤。 2. 方法:依据中药饮片生产工艺规程对其进行净制。 2.1. 取样:从净制样品中随机抽取5个点采样,每点采样约100g,置样品袋中,并编号。 2.2. 挑选耗率:将净制后饮片称重(含取样样品重),计算挑选耗率。 挑选耗率(%)=〔药材投料量-净制后饮片重量(含取样样品重量)〕/药材投料量×100% 2.3. 杂质:以上试验所得样品,挑出未净选干净的杂质和非药用部位,计算杂质含量,计算 公式:杂质含量(%)=杂质和非药用部位量/样品量×100% 3. 合格标准:根、根茎类、藤木类、花叶类、皮类、动物类、矿物类、菌藻类,含药屑、 杂质不得超过2%;果实、种子类、全草类、树脂类,含药屑、杂质不得超过3%。挑选耗率不得超过15%。 4. 本试验重复3次,并填写验证记录。 5. 再验证:同一药材在使用一年应进行一次净制效果验证。
目的:对生产过程中洗药工艺进行验证,检查并确认洗药效果达到规定要求。 范围:适用于白术、党参、甘草、厚仆、杜仲、莪术、佛手、何首乌、巴戟天、山药等类似质地药材的水洗效果的验证。 责任:验证小组负责对此工艺的验证,生产人员协助操作。 内容: 1. 材料与设备 原药材或中间产品、磅秤、洗药池。 2. 方法:依据中药饮片生产工艺规程进行洗药。 2.1. 取样:从水洗后的样品中随机抽取5个点采样,置样品袋中,并编号。 2.2. 洗药:选用合适的洗药方式用流动的饮用水对物料进行清洗。 2.3.水洗操作记录:将所取样品中的泥沙与合格品物料分别干燥称重,计算泥沙的含量,计 算公式如下: 泥沙含量=泥沙/取样量×100% 3.合格标准: 3.1.洗制后的物料泥沙含量不得超过1.5%。 3.2. 洗后外观不得有损伤。 4. 本试验重复3次,并填写验证记录。 5.再验证 5.1. 同一药材在使用一年应进行一次洗药效果验证。
第一章中药饮片简介 1.1 中药材 1.1.1中药材的定义 中药材是指在中医药基础理论指导下,对天然来源的动、植、矿物(除人工制品和鲜品外)通过采捕收集、加工干燥、包装贮藏等工序制成一定规格的药材,通称为中药材。 1.1.2 中药材质量的控制关键 为了保证中药饮片的质量,必须首先保证原料药材的质量。中药材质量的控制关键如下。 1、选择道地产区,无污染和品质优良的道地药材(最好从建立GAP基地的供应商购进药材)。 2、选择适当的采集、捕捉季节、生长年限,并采用适当的方法得到品质优良的药材。 3、选择适当的加工方法,如切、洗、煮、蒸、干燥、分档等不同方式进行产地加工,保证规格、性状、干燥状态品质优良。 4、选择适宜的包装、贮藏和养护,做好防虫、防潮、防霉变等,保持品质稳定。 1.2中药饮片 1.2.1 中药饮片的定义 中药饮片是在中医药基础理论指导下,将中药材通过净选、切制
和炮制三大工序,制成一定规格的成品。其中属于“把子货”的药材都得切制成一定形态的薄片(或颗粒)。所以经过加工炮制的中药材通称为“中药饮片”。为了适应中医处方调配、成药调配以及中医临床诊疗的需要,中药饮片的质量至关重要,只有保证中药饮片的质量才能保证中医用药的安全和有效。 1.2.2 中药饮片的分类 1、传统饮片 传统饮片是指中药材通过净制、浸润、炮制、切制、干燥等工序加工后的成品。根据《中华人民共和国药典》(简称《中国药典》)和目前各省市饮片炮制规范中传统饮片的类型有薄片、厚片、直片(顺片)、斜片、丝、块、段或节等。s 2、包煎饮片 包煎饮片即将中药材通过炮制后,粉碎成40目左右的颗粒(籽类除外),然后按一般处方用量装成几种不同重量规格的布袋或纤维袋,供配方用。其可直接带包煎,因颗粒度小,表面积大,提高了有效成分的溶出率和溶出度,各批产品质量稳定,重现性好。亦有粉状制成袋泡茶包装形式直接用开水冲泡服用的。 3、中药颗粒饮片 中药颗粒饮片即将单味中药饮片经提取、浓缩、干燥、制成颗粒,按一般处方用量装成几种不同重量规格的塑袋,供配方用。其产品质量均一、稳定、可控、体积小、溶出快,可直接冲服,便于贮存和运输。
小儿感冒颗粒工艺验证方案 VA/J—0 /00 起草人:日期:年月日会签人: 固体制剂车间:日期:年月日生产部:日期:年月日质量管理部:日期:年月日批准人:日期:年月日
小儿感冒颗粒工艺验证方案(前处理) 1.适用范围 本方案适用于公司中药提取车间小儿感冒颗粒(前处理)的工艺验证。 2.责任: 中药提取车间:负责工艺验证方案本车间验证的组织实施。 生产部:负责工艺验证方案起草。 质量管理部QA人员:负责协助验证方案的组织实施。 质量管理部QC人员:负责按计划完成工艺验证方案中相关检验任务;确保检验结论正确可靠。 QA验证管理员:负责验证工作的管理,协助工艺验证方案的起草,组织协调验证工作,并总结验证结果,起草验证报告。 质量管理部经理:负责工艺验证方案及报告的审核。 生产技术总监:负责工艺验证方案及报告的批准。 验证小组: 组长:×××× 副组长:×××× 成员:×××××××× 3.概述 小儿感冒颗粒是我公司已生产多年的产品,在多年的生产过程中,此产品生产工艺系统是稳定可靠的。公司现有的厂房都已经验证合格。工艺用水已检验合格,主要生产设备,样品取样及检验方法,设备清洁方法均已经进行验证合格。在人员培训合格并已经取得上岗证的基础上,辅以工序生产及检验结果依据。 4.验证目的 本产品工艺验证方案的目的:为评价小儿感冒颗粒产品生产系统要素和生产过程中可能影响产品质量的各种生产工艺因素提供系统的验证计划。以保证实现在正常的生产条件下,按照现生产工艺能够生产出符合质量标准的小儿感冒颗粒,并确认生产过程的稳定性及生产系统的可靠性。 在试生产的同时对小儿感冒颗粒(前处理)的生产工艺进行验证。进行生产工艺验证的产品批次为连续生产三批。
1.产品概述 1.1 品名:煅磁石,成品代码CP70082。 1.2 性状: 本品为不规则的碎块或颗粒。表面黑色。质硬而酥。无磁性。有醋香气。 1.3 性味与归经: 咸,寒。归肝、心、肾经。 1.4 功能与主治:镇惊安神,平肝潜阳,聪耳明目,纳气平喘。用于惊悸失眠,头晕目眩,视物昏花,耳鸣耳聋,肾虚气喘。 1.5 用法用量:19?30g ,先煎。 1.6 规格与包装规格:1kg/包、2kg/包、5kg/包。 1.7贮存:置干燥处。 2.处方依据及制法 2.1 依据:《中国药典》2015年版一部; 《江西中药炮制规范》(2008年版)。 2.2 处方 磁石 2.3 批量 每批按100kg 进行换算物料消耗定额。 2.4制法 取原药材,净制、锻制。 3.生产工艺流程图 4.饮片生产过程、工艺条件及质量风险控制点和风险控制措施 4.1生产准备 4.1.1 文件准备 “已清洁”标志。 “检定合格证”,对生产用的测试仪器、仪表按要求进行必要的调试,符合生产需要。 班前要进行检查,有安全检查表的要依安全检查表进行检查。对运转设备要进行试车听诊、视诊,必要的润滑,和防护措施的检查。要排除设备的安全隐患。要做好防冻或降温工作,电气设备要防止漏电伤人、短路或过载起火。 4.2备料 4.2.1 领用前的核对与计算
批生产指令或中药饮片批包装指令核对所需领物料的品名、批号、规格、数量及合格标志等; ①未经检验或检验不合格的物料; ②包装容器内无标签或物料标识卡、合格证; ③因包装被损坏、内容物已受到污染; ④已霉变、虫蛀、鼠蛟烂; ⑤在仓库存放已过复验期,未按规定进行复验; ⑥其他有可能给产品带来质量问题的异常现象。 4.3净选:将按中药饮片批生产指令领取的煅磁石移至净选岗位“待加工”区域。将药材置于药材净选台上人工挑选,去除非药用部位,杂质.一次倾置量不能太多。净制好的药材装入洁净容器内,称量,挂好物料标签,并移至“已加工”区域,杂质倒入废弃桶内。 4.4锻制:设定炒药机温度为600℃,按启动炒药机预热约30分钟,至设定温度时,净制好的材料倒入炒药机内炒炙,每锅炒炙数量不超过20公斤,炒至药材表面颜色变深黄色,取出。 4.5包装: 4.6生产结束 各工序生产结束后应按规定作好清洁、清场、收率计算、物料结退以及批生产记录等工作。 4.6.1 清洁与清场 4.6.1.1作业人员在加工作业结束后,先将加工好的物料转移到指定处。 4.6.1.2清理设备、容器、室内产品遗留物。剩余物料能回收的可作上标示,待下批生产同品种时掺入,不能回收的要及时处理。 4.6.1.3整理室内器具,清除废物贮器中的废物。 4.6.1.4按清洁操作规程对室内设备、器具、场所进行清洁。 4.6.1.5 QA人员按要求进行清场检查、评价,符合要求发给清场合格证,不符合要求,按程序重新清场。 4.6.2结料与退料 4.6.2.1每个工序每批产品生产结束后,都必须进行物料使用情况的统计,应符合规定定额; 4.6.2.2剩余的原辅料经检查质量、数量后应及时封装,防止污染。包装上注明名称、剩余数量、封装日期、封装人、复核人等,退库或退回车间暂存间,并做好记录。 4.6.2.3当物料结算发生偏差时,应按偏差处理程序及时处理,并记录。 4.6.3批生产记录: 4.6.3.1批生产记录各岗位记录由岗位操作人员填写,岗位负责人、QA员审核签字,后交车间工艺员汇总、整理、审核。
党参饮片验证方案 编号: 起草人:日期: 审核人:日期: 批准人:日期: 安徽世纪浪潮药业科技有限公司
目录 1、验证目的 2、验证依据 3、产品及工艺概述 4、工艺流程图 5、验证范围及验证项目 6、工艺验证 6.1 原料验证: 6.2 净制(挑选)工艺验证 6.3 洗润工艺验证 6.4 切片工艺验证 6.5 干燥工艺验证 6.6 包装工艺验证 6.7 成品工艺验证 6.8 批记录检验 7、漏项和偏差及处理 8、验证结论 9、综合评价 10、验证报告 11、验证结果分析 12、验证合格证 1、验证目的 验证党参生产工艺在车间指导生产的可行性和重现性。 2 、验证依据 中华人民共和国药典2010年版一部 安徽省中药饮片炮制规范 党参生产工艺规程 党参饮片质量标准 党参中间产品质量标准 本次验证是在人员得到培训,设备已经验证的基础上进行工艺验证。 3、产品及工艺概述 3.1 产品概述 3.1.1党参: 本品为桔梗科植物党参Codonopsis pilosula(Franch.)Nannf.、素花党参Codonopsis pilosula Nannf. var. modesta(Nannf.)L.T.Shen或川党参Codonopsis tangshen Oliv.的干燥根。秋季采挖,洗净,晒干。 【性状】党参呈长圆柱形,稍弯曲,长10~35cm,直径0.4~2cm。表面黄棕色至灰棕色,根头部有多数疣状突起的茎痕及芽,每个茎痕的顶端呈凹下的圆点状;根头下有致密的环状横纹,向下渐稀疏,有的达全长的一半,栽培品环状横纹少或无;全体有纵皱纹和散在的横长皮孔样突起,支根断落处常有黑褐色胶状物。质稍硬或略带韧性,断面稍平坦,有裂隙或放射状纹理,皮部淡黄白色至淡棕色,木部淡黄色。有特殊香气,味微甜。 素花党参(西党参) 长10~35cm,直径0.5~2.5cm。表面黄白色至灰黄色,根头下致密的环状横纹常达全长的一半以上。断面裂隙较多,皮部灰白色至淡棕色。 川党参长10~45cm,直径0.5~2cm。表面灰黄色至黄棕色,有明显不规则的纵沟。质较软而结实,断面裂隙较少,皮部黄白色。 【鉴别】(1)本品横切面:木栓细胞数列至10数列,外侧有石细胞,单个或成群。栓内层窄。韧皮部宽广,外侧常现裂隙,散有淡黄色乳管群,并常与筛管群交互排列。形成层成环。木质部导管单个散在或数个相聚,呈放射状排列。薄壁细胞含菊糖。 (2)取本品粉末1g,加甲醇25ml,超声处理30分钟,滤过,滤液蒸干,残渣加水15ml使溶解,通
中药提纯工艺验证方案 提取工艺 验证方案 目录
1 引言 1.1 验证小组人员责任 1.1.1 验证小组人员 1.1.2 验证小组成员及责任 1.1.3 验证工作中各部门责任1.2 概述 1.3 工艺流程图 1.4 验证目的 1.5 验证依据及采纳文件 1.5.1 验证依据 1.5.2 采纳文件 2 验证项目、评判方法及标准2.1 人员 2.1.1 培训 2.1.2 健康检查 2.2 生产环境 2.2.1 操作间温度和湿度 2.2.2 操作间相对压差 2.2.3 操作间清洁、清场 2.3 公用介质 2.3.1 饮用水 2.4 原辅料 2.4.1 质量 2.4.2 贮存条件 2.5 设备 2.5.1 设备清洁 2.5.2 设备爱护保养和运行状况2.6 工艺文件 2.6.1 工艺文件的正确性
2.6.2 生产指令的正确性 2.7 前处理提取中药材洗涤工艺变量2.8 前处理提取中药材切制工艺变量2.9 前处理提取中药材干燥工艺变量2.10 前处理提取煎煮工艺变量 2.11 前处理提取浓缩工艺变量 2.12 前处理提取浸膏喷雾干燥工艺变量2.13 前处理提取中药材灭菌工艺变量2.14 前处理提取中药材粉碎工艺变量2.15 质量保证 2.15.1 文件完整 2.15.2 正确的检验方法 2.15.3 检验结果正确 3 进度安排 3.1 验证批次 3.2 时刻安排 4 拟订日常监测程序及验证周期 5 验证结果评定与结论 6 附件 1 引言 1.1 验证小组人员责任
1.1.2 验证小组成员及责任 验证小组-组长负责方案起草、验证方案实施全过程的组织和验证全过程的组织和完成验证报告;负责验证和谐工作;以保证本验证方案按预定的规定项目顺利实施。 验证小组组员-分不负责方案实施中各工艺操纵点的确认,负责收集各项验证记录,最终完成工艺验证方案的实施工作。 1.1.3 验证工作中各部门责任 验证委员会-负责验证方案的批准;负责验证数据及结果的审核;负责验证报告的审批;负责验证证书的发放。 生产技术部-参加会签验证方案、验证报告、验证结果的会审会签、提供工艺验证方法,负责对工艺验证全过程实施监控。 质量保证部-负责组织验证方案、验证报告、验证结果的会审会签,负责协助验证小组进行有关验证和谐工作,负责对验证全过程实施监控,负责建立验证档案,及时将批准实施的验证资料收存归档。
江西臻药堂药业股份有限公司 1.产品概述 1.1 品名:肉苁蓉,成品代码CP30201。 1.2 性状: 呈不规则形的厚片。体重,质硬,黴有柔性,不易折断。气微,味甜、微苦。 1.3 性味与归经:甘、咸,温。归肾、大肠经。 1.4 功能主治:补肾阳,益精血,润肠通便。用于肾阳不足,精血亏虚,阳痿不孕,腰膝酸软,筋骨无力,肠燥便秘。 1.5 用法用量:6~10g。 1.6规格与包装规格: 1kg/包、2kg/包、5kg/包。 1.7贮存:置通风干燥处,防蛀。 2.处方依据及制法 2.1 依据:《中国药典》2015年版一部; 《江西中药炮制规范》(2008年版)。 2.2 处方 肉苁蓉 2.3 批量 每批按100kg进行换算物料消耗定额。 2.4制法 取原药材,除去杂质。润透,切厚片,干燥。
3.生产工艺流程图 4.饮片批过程、工艺条件及质量风险控制点和风险控制措施 4.1生产准备 4.1.1 文件准备 4.1.1.1中药饮片批生产指令明确了饮片批品名、批号、生产批量、炮制加工基本流程、原药材进厂编号及检验单号、投料量等。 4.1.1.2中药饮片批包装指令明确了包装品种名称、规格、批号、包装规格、包装批量、包材用量等。 4.1.1.3生产品种应有质量标准、工艺规程、岗位标准操作程序等相关文件。 4.1.1.4生产场所应有卫生要求的文件规定和卫生清洁标准操作程序。 4.1.1.5使用设备应有相应的设备操作、维护保养、清洁标准操作程序。 4.1.1.6容器具清洁应有相应的标准操作程序。 4.1.1.7应有岗位所需生产记录(含清场),工序运行状态标志、设备运行状态标志、物料领料单、工序操作记录等空白表格。 4.1.1.8其他有关执行文件。 4.1.1.9上述文件均应为现行文件。 4.1.2物料准备 4.1.2所用物料与中药饮片批生产指令或中药饮片批包装指令或工艺规程相符。 4.1.2.1核对领(配)料单或物料标签等内容,如物料名称、批号、检验报告书(检验单号)等,应准确无误。 4.1.2.2检查物料外包装或容器,应完好、清洁、物料无污染,并称量、复核。
××××颗粒工艺验证方案 VA/J—0 /00 起草人:日期:年月日会签人: 固体制剂车间: 日期:年月日生产部: 日期: 年月日质量管理部:日期: 年月日批准人:日期:年月日
××××颗粒工艺验证方案(前处理) 1.适用范围 本方案适用于公司中药提取车间小儿感冒颗粒(前处理)的工艺验证。 2.责任: 中药提取车间:负责工艺验证方案本车间验证的组织实施。 生产部:负责工艺验证方案起草。 质量管理部QA人员:负责协助验证方案的组织实施。 质量管理部QC人员:负责按计划完成工艺验证方案中相关检验任务;确保检验结论正确可靠。 QA验证管理员:负责验证工作的管理,协助工艺验证方案的起草,组织协调验证工作,并总结验证结果,起草验证报告。 质量管理部经理:负责工艺验证方案及报告的审核。 生产技术总监:负责工艺验证方案及报告的批准。 验证小组: 组长:×××× 副组长:×××× 成员:×××××××× 3.概述 小儿感冒颗粒是我公司已生产多年的产品,在多年的生产过程中,此产品生产工艺系统是稳定可靠的。公司现有的厂房都已经验证合格。工艺用水已检验合格,主要生产设备,样品取样及检验方法,设备清洁方法均已经进行验证合格。在人员培训合格并已经取得上岗证的基础上,辅以工序生产及检验结果依据。 4.验证目的 本产品工艺验证方案的目的:为评价小儿感冒颗粒产品生产系统要素和生产过程中可能影响产品质量的各种生产工艺因素提供系统的验证计划。以保证实现在正常的生产条件下,按照现生产工艺能够生产出符合质量标准的小儿感冒颗粒,并确认生产过程的稳定性及生产系统的可靠性。 在试生产的同时对小儿感冒颗粒(前处理)的生产工艺进行验证。进行生产工艺验证的产品批次为连续生产三批。
XXXXX工艺验证方案 YZS-G-1XX037 类别:验证管理工艺验证方案 制定人:制定日期:年月日 审核人:审核日期:年月日 批准人:批准日期:年月日 颁发部门:生效日期:年月日 复印数:份
目录 1.概述 2.目的 3.产品简介 4.验证内容、方法及标准 4.1粉碎过筛 4.2配料混合 4.3压片 4.4包装 4.5成品质量 4.6各工序收率及物量平衡 5验证结果评定与结论 6.稳定性考察 7.相关文件 8.图一 9.相关记录
1.主题内容 本方案规定了XXXXX生产工艺验证的目的,步骤、标准及评价内容 2.适用范围 本方案适用于XXXXX生产工艺的验证 3.责任人 3.1工艺验证小组 组长: 组员: 3.2其他相关人员 4.验证的内容 4.1概述 XXXXX是我公司的主要产品,在以往的生产过程中,此产品生产工艺是稳定可靠的,但是为符合GMP要求,我公司新建了厂房,引进了先进的设备,因此在该产品正式投入生产前进行工艺验证,进行工艺验证的前提条件是: 1.厂房、设施、设备已经过验证并验证合格可投入使用。 2.相应的文件已批准执行。 3.物料通过供应商审计并审计合格。 4.人员已进行全面健康检查和系统培训且已有健康证和培训上岗证。 本验证方案拟在XXXXX试生产时实施 4.2目的: 本产品工艺验证方案的目的在于通过对XXXXX生产工艺的验证,证明该生产工艺可靠性和稳定性 4.3产品简介: 4.3.1处方:原辅料名称万片的用量 4.3.2工艺流程图(见图一) 4.3.3生产、质、量管理文件 批生产指令及记录 XXXXX批生产指令及记录 生产工艺规程 XXXXX批生产工艺规程 质量标准 XXXXX质量标准及主要物料质量标准
小儿感冒颗粒工艺验证方案
小儿感冒颗粒工艺验证方案 VA/J —0 /00 起草人:日期:年月日会签人: 固体制剂车间:日期:年月日生产部:日期:年月日质量管理部:日期:年月日批准人:日期:年月日
1.适用范围 本方案适用于公司中药提取车间小儿感冒颗粒(前处理)的工艺验证。 2.责任: 中药提取车间:负责工艺验证方案本车间验证的组织实施。 生产部:负责工艺验证方案起草。 质量管理部QA人员:负责协助验证方案的组织实施。 质量管理部QC人员:负责按计划完成工艺验证方案中相关检验任务;确保检验结论正确可靠。 QA验证管理员:负责验证工作的管理,协助工艺验证方案的起草,组织协调验证工作,并总结验证结果,起草验证报告。 质量管理部经理:负责工艺验证方案及报告的审核。生产技术总监:负责工艺验证方案及报告的批准。验证小组: 组长:XXXX 副组长:XXXX 成员:XXXXXXXX 3.概述 小儿感冒颗粒是我公司已生产多年的产品,在多年的生产过程中,此产品生产工艺系统是稳定可靠的。公司现有的厂房都已经验证合格。工艺用水已检验合格,主要生产设备,样品取样及检验方法,设备清洁方法均已经进行验证合格。在人员培训合格并已经取得上岗证的基础上,辅以工序生产及检验结果依据。 4.验证目的 本产品工艺验证方案的目的:为评价小儿感冒颗粒产品生产系统要素和生产过程中可能影响产品质量的各种生产工艺因素提供系统的验证计划。以保证实现在正常的生产条件下,按照现生产工艺能够生产出符合质量标准的小儿感冒颗粒,并确认生产过程的稳定性及生产系统的可靠性。 在试生产的同时对小儿感冒颗粒(前处理)的生产工艺进行验证。进行生产