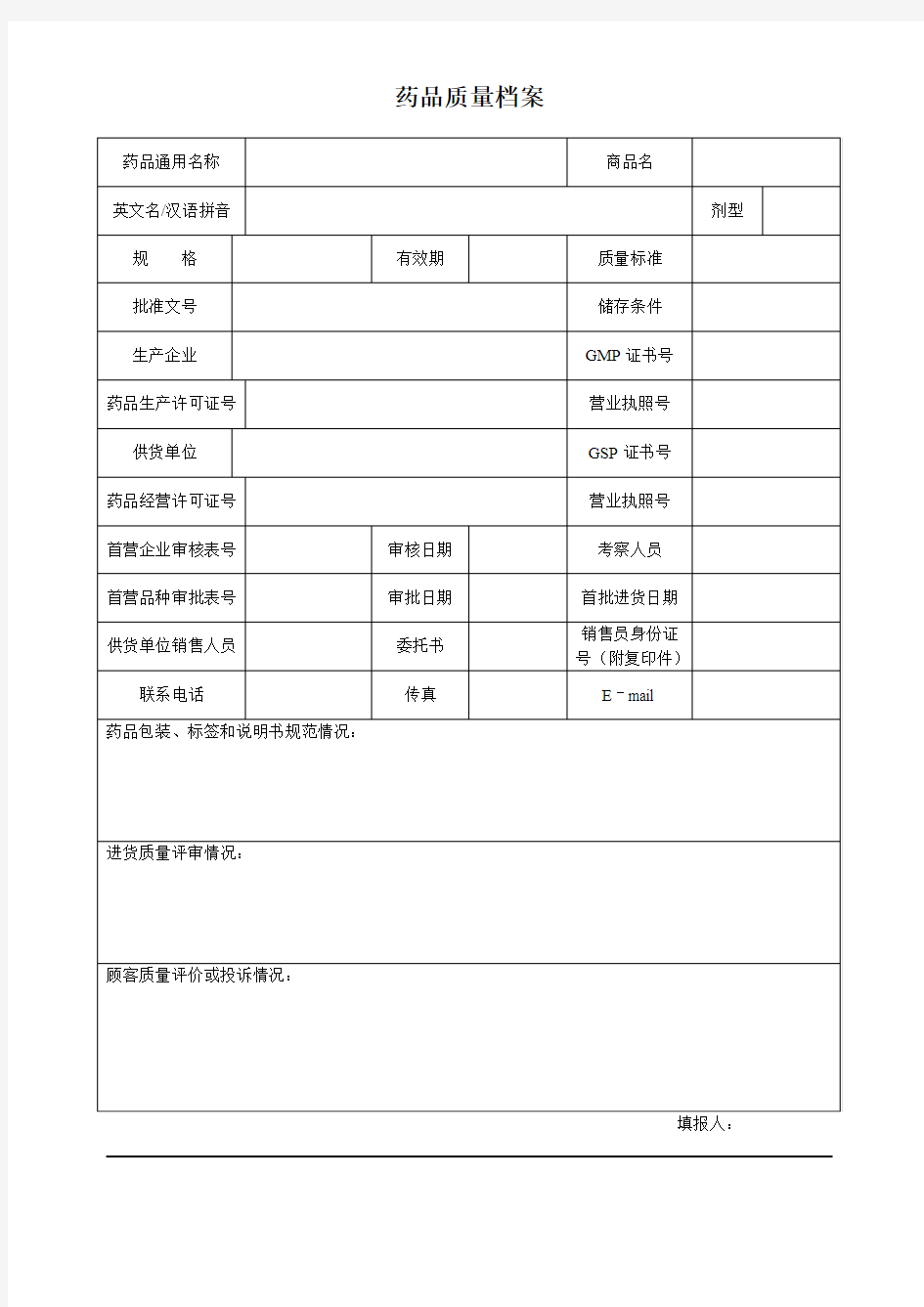
药品质量档案
填报人:
医疗器械经营企业 质量管理制度、质量管理档案 Xxxxxxx 有限公司 二0 一五年
一、企业内管理、执行、验证人员的职责权限及 相互关系的规定 (3) 二、产品的质量验收、保管、养护及出库复核制度 (6) 三、效期产品管理制度 (8) 四、不合格产品管理制度 (9) 五、质量跟踪及不良反应的报告制度 (10) 六、产品售后服务制度 (12) 七、文件、资料、记录管理制度 (12)
医疗器械经营企业管理制度 一、企业内管理、执行、验证人员的职责权限及相互关系的规定 根据本企业的经营规模,品种和管理需要,设置了组织机构及职能部门和人员,并规定了其职能和相互关系,以下框图表示: 质量管理领导小组 组长: (一)总经理 1、总经理对本企业的质量工作负全面责任 2、组织贯彻上级的质量方针、政策、法规和指令,不断提高全员的质 信 息 反 馈 信 息 反 馈 信 息 反 馈 信 息 反 馈 信 息 反 馈 兼职质检员各类人员的职责权限:
量意识和质量管理水平 3、本企业质量工作方针、目标、建立健全质量责任制,并首先在各级领导层落实。 4、合理安排人员上岗,对质管人员按规定进行培训,保证质量管理等重要岗位人员具备相应的专业水平和工作能力。 5、保证质量管理部门依照有关规定,独立行使职权,在全企业实行“质量否决权”制度。 6、对存在的质量问题和质量隐患,要及时采取有效措施,防止发生质量事故。 (二)质量管理人员 1. 质量管理部在经理的直接领导下工作,对企业的质量管理工作负有具体责任。 2. 依照国家《医疗器械监督管理条例》、《医疗器械经营企业监督管理办法》、《计量法》、《产品质量法》及《山东省医疗器械经营企业资格认定实施细则(试行)》等有关法律、法规及本企业的有关规定行使质量管理和质量否决权。 3. 对本企业的各项质量管理工作,管理制度提出修定意见。对存在的质量问题及质量隐患要及时采取措施并提出处理意见。 4. 负责督促、检查、指导企业各环节有关人员认真执行上级有关规定的各项质量管理制度。 5. 配合进货、销货、保管等人员认真把好进货、入库验收、保管养护、 出库复核等关键环节,确保无质量不合格商品流入市场
1、目的 严格贯彻《中华人民共和国药品管理法》及《药品经营质量管理规范》的有关规定和要求,进行药品质量档案的建立和质量分析工作。 2、适用范围 适用于本公司经营药品的质量档案管理。 3、质量档案的基本内容 3.1 基础质量档案,包括: 3.1.1 供方法定资格证明文件,包括: a、《药品生产许可证》或《药品经营许可证》复印件; b、供方营业执照复印件 3.1.2 供方质量信誉证明文件,包括: a、供方GMP或GSP证书复印件; b、质量保证协议书。 3.1.3 药品合法性证明文件,包括: a、药品生产批准证明文件 b、法定质量标准复印件 c、进口药品注册证复印件。 3.1.4 药品质量可靠性证明文件,包括: a、药品出厂检验报告书 b、进口药品检验报告书 c、首营品种审批表 d、药品包装、标签和说明书与药品实物样品。 3.1.5 其它有关资料,包括: a、商标注册证复印件 b、物价批复文件 3.2 运作质量管理档案,包括: 3.2.1 药品进、验、存、销运作质量管理档案,包括: a、药品购进合同或经销、代理协议书。 b、药品购进记录 c、药品验收记录 d、购进药品入库单 e、退货记录 f、不合格品台帐
g、不合格药品报损审批表 h、不合格药品销毁记录 i、药品检验报告书 j、顾客证照 k、药品销售合同或协议 l、出库复核记录 m、药品销售记录 n、客户档案资料一览表 o、供方名单 3.2.2 药品养护档案,包括 a、药品养护检查记录 b、温湿度记录 c、药品质量复检通知单 d、药品质量处理通知单 e、质量报表 f、近效期药品催销月报表 3.2.3 用户访问及质量信息档案,包括 a、用户电话咨询记录 b、药品质量管理征询意见书 c、药品质量信息反馈表 d、质量信息报表 3.2.4 计量器具管理档案,包括: a、计量器具周期检定表 b、计量器具管理台帐 c、检定/校准证书 d、精密仪器使用记录 e、仪器设备一览表 3.2.5 质量事故管理档案,包括: a、质量事故报表 b、质量事故调查处理记录 4、质量档案管理职责 4.1 管理职责分工按有关部门、组织和人员的质量责任的有关规定执行,包括:4.1.1 基础质量档案资料索取由计划采购部负责。
药品质量管理体系文件
药品质量管理制度 1、药品必须确定专人专管,建立药品帐册,对出入库药品及时记帐,以保证帐物相符。 2、药品入库要验收药品的批准文号、生产批号、有效期、失效期、注册商标等,防止购进假劣药品。 3、药品的存放应按剂型分成片(丸)、注射剂、糖浆剂、冲剂等进行分区分类。 4、特殊药品的管理要实行五专:“专人负责、专柜加锁、专用帐册、专用处方、专册登记”。 5、对有有效期的药品,应按有效期的远近,按批号依次摆,本着先进先出、近期先出、储存期短的先出原则。 6、药柜应保持整洁干燥,防止药品受热、受潮、霉变而变质失效。 7、领取药品时要有手续,认真检查药品品质,确保药品符合药典规定,不多领、多存,根据临床需要,及时发放,做 到准确、安全、有效。 8、药品上柜橱要摆放整齐,分类定位做到片剂与针剂、内服与外用药品分开。 9、对有失效期的药品,应建立有效期药物周期表,便于检查核对防止过期失效。 10、配方人员必须认真负责。配方前,查对姓名、性别、年龄、处方日期。配方时,查对处方的内容、药物剂量、含量、 配伍禁忌。发药时,实行“四查、一交代":查对药名、规格、剂量、含量、用法与处方内容是否相符;查对标签(药袋)与处方内容是否相符;查药品包装是否完好、有无变质。安瓿针剂有无裂痕、各种标志是否清楚、是否超过有效期; 查对姓名年龄;交待用法及注意事项。 11、对药品消耗做到日清月结,及时报帐。 12、定期清点、检查药品,防止积压、变质,如发现有沉淀变色、过期、标签模糊等药品时,应停止使用。 13、每月盘点一次,做到药品进、销、存帐目清楚,帐物相符,根据药品消耗和存量、做好药品金额结算,并根据药品 使用情况,及时调整、制订进货计划。 14、库存药品管理,做到无伪劣品,无过期、失效、霉变药品。 15、处方药帐应根据规定妥善保管,保存期不少于二年。
质量管理部档案 一、质量管理体系文件 1、起草质量管理体系文件(制度、职责月日起草、程序、记录月日起草) 2、质量管理部经理月日审定体系文件; 3、总经理月日批准发布体系文件。 二、建立标准文件管理记录档案 1、质量管理体系文件编制计划表(见蓝本) 2、文件编制申请及批准表(见蓝本) 3、文件编号登记表(见蓝本) 4、文件分发记录(见蓝本) 5、其他四个记录; 三、质量方针目标 1、完成质量方针目标展开图(见蓝本);确定质量方针目标应有质量领导小组会议记录 2、完成部门质量方针目标的分解(见蓝本) 3、分发并回收各部门季度质量方针目标自查表; 4、完成公司年度质量方针目标检查表并对本年度有无完成目标作一汇总报告,制定下一年度方针目标(有会议记录); 四、建立药品质量档案 1、完成质量档案表内容; 2、收集质量标准、生产批文,药品检验报告书、最小包装、标签、说明书样板等资料(首营品种资料可共用) 五、建立质量信息档案 1、多渠道收集或下载外部信息(见蓝本),完成信息传递反馈单,并应有最新质量公告等信息; 2、定期收集内部质量信息(包括验收质量信息报告、养护质量信息报表、近销期药品催销表、近效期药品催销报告、拒收报告单、各类汇总分析报告或报表等); 3、完成年度质量信息汇总分析报告。 六、建立药品不良反应报告档案 1、对回收的不良反应调查表进行统计(见蓝本) 2、完成年度不良反应调查汇总分析(见蓝本) 七、建立制度自查档案 1、分发并回收部门自查表; 2、组织质量领导小组进行制度的检查并完成检查记录,检查时应注意部门回避原则; 3、完成年度不合格药品、效期药品、退货药品的汇总分析。 八、建立不合格药品、效期药品、退货药品档案 1、对不合格药品、效期药品和退货药品的质量记录分别进行归档; 2、完成年度不合格药品、效期药品、退货药品的汇总分析。 九、建立操作标准档案 1、根据蓝本指定本公司的操作标准; 2、组织验收员、养护员学习操作标准并重点考核,尤其是澄明度的检查 3、将操作标准分发到相应部门及岗位,验收养护室应有一本合订本或上墙
药品质量档案管理规程 (ISO9001-2015/GMP) 1.0总则 1.1目的:本文件规定了产品质量档案建档要求,为质量管理和检验工作提供服务。 1.2范围:适用于本公司所有正式批准文号的产品。 1.3责任:本文件由化验室负责起草,化验室主任负责审核,生产负责人负责批准;化验室主任负责实施。 2.0档案建立要求: 2.1.凡有正式批准文号的产品均要建立产品质量档案。 2.2.档案管理员负责建立整理、编集产品质量档案,每年汇总归档。 2.3.每一份档案要按规定编目成册,存放保存。 2.4质量档案内容: 2.4.1.产品简介 产品名称、产品特点(性状、规格、有效期等)、类型等。 2.4.2.工艺流程 简易工艺流程图 2.4. 3.批件 生产批准文号批件复印件,包括:证书、批件和批准的质量标准等。 2.4.4.工艺规程 工艺规程及变更情况。 2.4.5.质量标准
原料、辅料、中间产品、成品质量标准及变更情况,包括:有关试验资料等。 2.4.6.质量情况 历年质量情况及与同类产品对比情况,如年度质量回顾报告。 2.4.7.稳定性考察 产品持续稳定性考察试验资料,每年均要有数据或书面总结。 2.4.8.质量事故 重大质量事故与质量事故报告全套资料。 2.4.10.产品投诉 用户访问、用户投诉情况。 2.4.11.退货与回收 产品回收,退货等情况每年汇总归档。 2.4.12.检验方法变更 变更申请报告、对比试验资料。 2.4.1 3.质量工作总结 提高产品质量工作总结、数据资料、方法和效果、质量改进文字资料。 2.4.14.包装材料质量标准及变更 变更说明,变更后备案情况。历次印刷性包装材料标准样张样本。 2.4.15.空白记录 全套检验记录、现场监控记录、取样单、请验单、取样记录等空白记录,及变更情况。 2.4.16.质量抽检 产品抽检情况,包括:抽检质量情况统计、抽检报告书等。
ICH Q10药品质量管理体系 2009年03月
目录 1、介绍(1,1.1) 2、药品质量管理系统 A范围(1.2) B ICHQ10与当地GMP规定、ISO标准和ICHQ7的关系 C ICHQ10与监管方式的关系 D ICHQ10的宗旨 E 助推器:知识管理和质量风险管理 F 设计和内容的思考 G 质量手册 3、管理职责 A 管理概述 B 质量方针 C 质量计划 D 资源管理 E 沟通交流 F 管理回顾 G 外包活性物质和采购物料的管理 H 产品所有人变更管理 4、工艺性能和产品质量的持续性提高 A 产品生命周期的目标 B 药品质量系统的组成元素 5、药品质量系统的持续性提高 A 药品质量系统的管理回顾 B 影响质量系统的内外因素的监控 C管理回顾和监控的结果 6、术语 附录1:提升基于科学和风险分析的监管方式的潜在机会附录2:ICHQ10药品质量管理系统模板图表
1.简介:(1,1.1) 该指南全球统一,作为药品质量系统的一个参考,旨在以描述制药行业一个有效的的质量系统模板,帮助药品生产企业。药品质量系统这个术语贯穿ICHQ10模板。 ICH Q10描述了一个综合而有效的药品质量系统模板准,它基于国际质量(ISO)的质量理念,包括现行GMP规则,补充指南ICH“Q8药品开发”和ICH“Q9质量风险管理”。ICHQ10则是一个药品质量管理系统的模板,来完善药品整个生命周期的不同阶段。ICHQ10中适用于生产场所的许多内容现在都作为各地区的GMP要求。ICHQ10并不旨在创造新的超越现行法规要求的愿景。总之,ICHQ10是对现行各地GMP要求的一种合理的补充。 ICHQ10说明行业和当局权威出于公共健康考虑,对有效的药品质量管理系统的支持,以提高全世界药品质量和疗效。贯穿产品生命周期的ICHQ10的实施应利于产品的更新和持续性提高,并加强药品研发和生产的关系。 FDA各档,包括该指南,并不具有法律性的强制要求。而只是表达了FDA当局现阶段的想法,并且这些档只应该看成是建议,除非被法规引用。当局指南中应该这词的使用表明了是建议或推荐某些东西而不是要求。 1、药品质量管理系统 A范围(1.2) 该指南适用于一些系统,这些系统支持药品原料(如API)及药品,包括生物技术和生物学制品整个生命周期的研发和生产。 认识到产品生命周期不同阶段的不同点和不同目的,ICHQ10对于每个阶段都是合适的、相符的。 依据该指南的目的,新的及现有的产品的生命周期包括以下技术活动: ●药品研发: ?药品原料开发 ?处方开发(包括容器/密闭系统) ?实验性产品的生产 ?系统开发的移交(相关处) ?生产工艺开发和优化 ?分析方法研究 ●技术转移 ?从开发到生产的新产品转移
实施药品使用质量管理规范 档案相关表格 例表目录: 例表1 首营企业审批表 例表2 首营品种审批表 例表3 合格供货方档案表 例表4 药品质量档案表 例表5 药品质量信息收集分析表 例表6 药品购进验收记录 例表7 进口药品验收记录 例表8 中药饮片质量验收记录 例表9 陈列药品质量检查记录 例表10药品检查养护记录 例表11近效期药品催销表 例表13 不合格药品台帐 例表14 设施设备一览表 例表15 养护设备检修维护记录 例表16 药品储存温湿度记录表 例表17 员工培训计划 例表18培训实施记录表 例表19企业员工健康检查汇总表 例表20职工健康档案 例表21药品拆零记录
首营企业审批表 编号:填表日期:企业名称 企业类别药品生产企业□药品经营企业□ 拟供品种 详细地址 邮政编码E—mail 传真联系人联系电话 许可证许可证名称许可证号 企业名称负责人许可范围有效期至企业地址 发证机关 发证日期 营业执照 企业名称注册号法定代表人经济性质注册资金经营范围经营方式企业地址 发照机关及 发照日期 质量认证证书与编号有效期限 采 购 人 员 意 见 签字:年月日 质量信誉实地考察结论 签字:年月日 审 核 意 见质量管理员:年月日审 批 意 见企业负责人:年月日
首营品种审批表 编号: 药品编号通用名称商品名称规格单位生产企业 药品性能、质量、用途、疗效等情况 批准文号质量标准 GMP 证书号认证时间 装箱规格有效期储存条件 正常出厂价采购价批发价零售价 申请原因 采购员 意见 签字:年月日 质量管理 员意见 签字:年月日 负责人 意见 签字:年月日注:本表附药品生产许可证、营业执照、批准文件、质量标准、出厂检验报告书、样品、价格批文、GMP证书以及临床总结报告等资料。
药品质量档案管理制度 起草人:起草日期:年月日 制订人:制订日期:年月日 审核人:审核日期:年月日 批准人:批准日期:年月日 分发部门:公司各部门执行日期:年月日 1.目的:建立药品经营档案管理标准,规范药品质量档案的管理工作。 2.依据:《药品经营质量管理规范》、《药品经营质量管理规范现场检查指导原则》。3.适用范围:本标准规定了药品质量档案管理的内容和要求,适用于企业经营的药品。4.职责:质量管理员、药品购进人员对本标准的实施负责。 5.内容: 5.1药品质量档案的管理: 5.1.1对所经营的药品包括首营品种、发现有质量问题的药品都必须建立质量档案,向供货商索取药品的质量标准、生产批准文件或批准文号的相关证明文件、使用说明书、最小包装原样和首次进货批次的检验报告书等资料。其中药品的质量标准、生产批准文件或批准文号的相关证明和首营药品的该批次出厂合格检验报告书必须加盖有生产企业的原印章(注:该品种并非由生产企业直接供货,则不需生产企业的原印章,但必须加盖供货单位的原印章,且生产企业的印章须清晰可见)。 5.1.2药品质量档案的各项资料由药品购进人员负责索取。 5.1.3药品质量档案的内容包括:药品通用名称(商用名)、剂型、规格、生产批准文件、有效期、质量标准号、生产企业、供货企业、建档日期以及附件;附件的内容包括药品外观质量检查情况、包装情况、临床疗效反应、质量查询情况、用户访问情况、质量标准变更情况、抽验化验情况、在库养护质量情况等,可逐项或选项归档。 5.1.4药品质量档案按药品生产厂家分类归档。 5.1.5药品质量档案应指定专人负责管理,任何部门或人员借阅药品质量档案管理人员的同意,并办理借阅手续,按时归档。 5.1.6药品质量档案的内容发生变更或增加时,必须经质量管理机构负责人审核批准并签章后,档案管理人员才能进行相应的修改和补充。
药店档案 xx药店企业档案(一) 1.药品经营许可证、营业执照、组织机构代码证、税务证等证照 2.企业近年来有关荣誉证书 3.特殊药品的批文(二类精神药品的经营批文) 4.企业筹建资料 5.企业现场验收资料 6.GSP申报资料 xx药店法律法规和技术标准档案(二) 1.《药品管理法》 2.《药品管理法实施条例》 3.《药品流通监督管理办法》 4.《药品经营许可证管理办法》 5.《药品零售企业GSP认证检查评定标准》 6.《药品零售企业GSP认证检查项目》 7.《处方药与非处方药分类管理办法》 8.《药品经营质量管理规范》 9.《药品经营质量管理规范实施细则》 10.药品包装、标签和说明书管理规定(暂 行) 11.《药品经营企业岗位知识培训教材》 xx 药 店 管 理 文 件 档 案(三) 1、管理制度汇总 2、工作程序汇总 3、《文件编制申请及批准表》 4、《文件分发记录》 5、《文件状态档案》 xx 药 店 评 审 考 核 档 案(四) 1、评审考核通知 2、《质量管理体系内审检查评定标准和评审结果汇总》 3、《质量管理体系评审项目内容和评审结果》 4、《质量管理体系内部评审记录》 5、《质量管理制度执行情况自(检)查评分表》 6、《质量管理制度考核情况反馈及其整改情况报告》 xx药店供货单位档案(含首营企业)(五)
1、《供货单位汇总表》 2.《合格供货方档案》 3、合格供货方有关资料包括①生产或经营许可证和营业执照复印件; ②质量保证书或协议;③GMP或GSP认证证书(已取得认证的企业) 4、《首营企业审批表》 5、首营企业有关资料包括①生产或经营许可证和营业执照复印件;②质量保证书或协议:③GMP或GSP认证证书复印件(已取得认证的企业); ④法人委托书、业务人员身份证复印件、上岗证。 6.采购合同或协议。 xx 药 店 药 品 质 量 档 案(含首营品种)(六) 1、《药品质量档案表》附该药品的质量标准、药品的包装、标签、说明书等一切与药品质量有关的材料 xx 药 店 质 量 信 息 档 案(七) 1、《药品质量信息传递单》和有关信息资料 2、《文件传阅处理单》和主管部门文件 3.《服务质量满意征询表》 xx 药 店 设 施 设 备 档 案(八) 1、《设施设备一览表》 2、《养护设备维修、保养记录》 3、《计量器具管理台帐》 4、《仪器、衡器校验记录》 5、设备计量器具使用说明书、保修卡、购进票据 6、每月装订好的《养护设备使用记录》 xx 药 店 员 工 资 质 档 案(九) 1、《员工名册》 2、《员工履历表》 3、各员工的学历证 4、执业或职业资格证书(职称证书) 5、药学技术人员的聘书 6、任命通知 xx 药 店 员 工培 训 档 案(十) 1、《年度培训计划》 2、《员工教育培训情况记录》 3、《员工个人教育培训档案》 4、各员工的继续教育有关证明 5、GSP岗位证书
质量记录表格 1、文件编制申请表 2、制度执行情况检查记录 3、供货方汇总表 4、供货方质量体系调查表 5、合格供货方档案表 6、采购计划表 7、购进质量验收药品目录 8、药品质量档案表 9、药品购进、质量验收纪录 10、药品储存、陈列环境检查记录 11、环境温湿度监测记录 12、近效期药品催销表 13、药品拆零销售记录 14、处方药销售调配销售记录 15、中药饮片装斗复核记录 16、中药方剂调配销售记录 17、顾客意见征询表 18、药品质量问题查询表 19、药品质量问题投诉、质量事故调查处理报告
文件编制申请批准表 申请人(部门): 文件名称申请原因 审核意见 负责人:日期:批准意见 负责人:日期:
制度执行情况检查记录 检查日期:年月日检查人: 序 检查内容检查结果与问题采取措施复查结果号 质量管理体系文件 1 检查考核制度 2药品采购管理制度 3药品验收管理制度 4药品陈列管理制度 5药品销售管理制度 供货单位和采购品 6 种审核管理制度 7处方销售管理制度
8药品销售管理制度 含麻黄碱类复方制9 剂质量管理制度 记录和凭证管理制10 度 收集和查询质量信11息管理制度 药品质量事故、质12量投诉管理制度 中药饮片处方审 核、调配、核对管13 理制度 药品有效期管理制14 度 不合格药品、药品15 销毁管理制度
16环境卫生管理制度17人员健康管理制度 提供用药咨询、指18导合理用药等药学 服务管理制度 人员培训及考核管19 理制度 药品不良反应报告20管理制度 计算机系统管理21制度 执行药品电子监管22 规定管理制度
新版GSP档案目录 一、企业证件档案(质量管理) 1. 四证一照 2. 厂房房产证件 3. 认证有关资料 二、质量体系设置档案(质量管理) 1. 公司概况 2. 组织机构成立文件 3. 企业组织机构设置与职能框架图 4. 质量管理机构设置与职能框架图 4. 办公室、仓库、验收养护室平面图(物流的) 5. 员工花名册 6. 质量领导小组成立文件 7. 主要岗位人员聘任书(复印件) 三、质量管理体系文件档案(质量管理) 1. 文件系统的管理制度 2. 文件审批、变更、发放、收回、记录表 3. 质量管理制度(原稿) 4. 部门岗位职责(原稿) 5. 工作程序(原稿) 6. 全套空白质量记录。 四、质量方针目标档案(质量管理) 1. 质量方针与质量目标管理制度 2. 年度质量方针和目标一览表 3. 年度部门质量指标和管理方案 4. 年度部门质量目标分解 5、质量方针与质量目确定文件 6、质量与方针确定会议记录 7、质量方针培训记录 五、质量管理体系内审档案(质量管理)
1. 质量管理体系审核制度 2. 内部评审计划表 3. GSP内部评审记录 4. 不合格项目通知书 5. 整改实施报告 6. 纠正和预防措施表 六、质量管理制度检查、考核档案(质量管理) 1. 质量管理制度检查、考核与奖惩管理制度 2. 质量管理制度执行情况检查考核记录表 3. 整改通知单 4.《预防与纠正措施表》 七、质量信息档案(质量管理) 1. 质量信息管理制度 2. 药品质量信息收集、分析处理表 3.《质量信息传递、反馈表》 4. 药监部门、检查部门发放文件或公报等资料 5. 其他资料信息 八、药品质量档案(质量管理) 1. 药品质量档案审核表 2. 药品质量标准 3. 药监所出具该药品检验报告书 4. 进口药品注册证和检验报告书 5. 首营企业与首营品种资料 6. 药品包装、使用说明书、标签复印件等 九、不合格药品管理档案(质量管理) 1. 不合格药品管理制度 2.《不合格药品报损申请表》 3.《不合格药品报告、确认表》 4.《不合格药品销毁记录》 5.《药品销毁申请单》 6.《不合格药品管理台账》
产品质量档案及原始记录管理 产品管理档案和原始记录,是企业在生产过程中产品质量和作业量的真实记载,是质量跟踪和质量分析的重要依据,是原材料进厂,半成品入库、产品出厂的凭证.因此,对原始记当的填写、归档、保管、查阅必须进行科学管理.原始凭证存档分类见下表。 一、由检验科负责各种检验原始记录、台帐和内部报表的拟定、修改及编号工作、并规定其传递程序。 二、各有关部门和个人必须按表式认真填写,做到数据准确,字迹清楚。对原始记录、台帐和种报表的填写情况,列入有关人员的工作质量进行考核。 三、所有各质量原始记录,统一由检查科编号按<<原始凭证存档分类表>>,归类存档,各单位和个人不得私自截留。 四、除按厂技术文件归档程序规定的资料外,有关质量原始资料保存期限按《原始凭证存档分类表》规定办理。 品味人生 1、不管鸟的翅膀多么完美,如果不凭借空气,鸟就永远飞不到高空。想象力是翅膀,客观实际是空气,只有两方面紧密结合,才能取得显着成绩。 2、想停下来深情地沉湎一番,怎奈行驶的船却没有铁锚;想回过头去重温旧梦,怎奈身后早已没有了归途。因为时间的钟摆一刻也不曾停顿过,所以生命便赋予我们将在汹涌的大潮之中不停地颠簸。 3、真正痛苦的人,却在笑脸的背后,流着别人无法知道的眼泪,生活中我们笑得比谁都开心,可是当所有的人潮散去的时候,我们比谁都落寂。
4、温暖是飘飘洒洒的春雨;温暖是写在脸上的笑影;温暖是义无反顾的响应;温暖是一丝不苟的配合。 5、幸福,是一种人生的感悟,一种个人的体验。也许,幸福是你风尘仆仆走进家门时亲切的笑脸;也许,幸福是你卧病床上百无聊赖时温馨的问候;也许,幸福是你屡遭挫折心灰意冷时劝慰的话语;也许,幸福是你历经艰辛获得成功时赞赏的掌声。关键的是,你要有一副热爱生活的心肠,要有一个积极奋进的目标,要有一种矢志不渝的追求。这样,你才能感受到幸福。 6、母爱是迷惘时苦口婆心的规劝;母爱是远行时一声殷切的叮咛;母爱是孤苦无助时慈祥的微笑。 7、淡淡素笺,浓浓墨韵,典雅的文字,浸染尘世情怀;悠悠岁月,袅袅茶香,别致的杯盏,盛满诗样芳华;云淡风轻,捧茗品文,灵动的音符,吟唱温馨暖语;春花秋月,红尘阡陌,放飞的思绪,漫过四季如歌。读一段美文,品一盏香茗,听一曲琴音,拾一抹心情。 8、尘缘飞花,人去楼空,梦里花落为谁痛?顾眸流盼,几许痴缠。把自己揉入了轮回里,忆起,在曾相逢的梦里;别离,在泪眼迷朦的花落间;心碎,在指尖的苍白中;淡落,在亘古的残梦中。在夜莺凄凉的叹息里,让片片细腻的柔情,哽咽失语在暗夜的诗句里。 9、用不朽的“人”字支撑起来的美好风景,既有“虽体解吾犹未变兮”的执着吟哦,也有“我辈岂是蓬蒿人”的跌宕胸怀;既有“我以我血荐轩辕”的崇高追求,也有“敢教日月换新天”的豪放气魄。33 我是一只蜜蜂,在祖国的花园里,飞来飞去,不知疲倦地为祖国酿制甘甜的蜂蜜;我是一只紫燕,在祖国的蓝天上,穿越千家万户,向祖国向人民报告春的信息;我是一滴雨点,在祖国的原野上,从天而降,滋润干渴的禾苗;我是一株青松,在祖国的边疆,傲然屹立,显示出庄严的身姿。 10、母爱是一滴甘露,亲吻干涸的泥土,它用细雨的温情,用钻石的坚毅,期待着闪着碎光的泥土的肥沃;母爱不是人生中的一个凝固点,而是一条流动的河,这条河造就了我们生命中美丽的情感之景。 11、青春是盛开的鲜花,用它艳丽的花瓣铺就人生的道路;青春是美妙的乐章,用它跳跃的音符谱写人生的旋律;青春是翱翔的雄鹰,用它矫健的翅膀搏击广阔的天宇;青春是奔腾的河流,用它倒海的气势冲垮陈旧的桎梏。 12、失败,是把有价值的东西毁灭给人看;成功,是把有价值的东西包装给人看。成功的秘诀是不怕失败和不忘失败。成功者都是从失败的炼狱中走出来的。成功与失败循环往复,构成精彩的人生。成功与失败的裁决,不是在起点,而是在终点。 13、母爱是一缕阳光,让你的心灵即便在寒冷的冬天也能感受到温暖如春;母爱是一泓清泉,让你的情感即使蒙上岁月的风尘仍然清澈澄净。
药品质量管理制度(医院) 药剂科职责 一、负责起草药品质量管理制度,并认真组织执行; 二、负责对供货单位和购进药品的合法性和药品质量进行审核; 三、负责建立本单位所使用药品的质量档案; 四、负责药品质量查询和药品质量事故或质量投诉的调查、处理及报告; 五、负责不合格药品的检查确认和处理; 六、负责药品的购进、验收、储存、陈列、保管、养护、调配和临床药学工作; 七、负责搜集和分析药品质量信息、负责药品不良反应监测和报告等药事管理工作。
主管药品质量负责人职责 一、贯彻、执行《药品管理法》、《药品管理法实施条例》和《山东省药品使用条例》等有关法律、法规,确保依法使用药品,保证患者用药安全、有效、合理、及时、方便; 二、在“质量第一”的思想指导下进行药品质量管理,组织本单位职工认真学习和贯彻执行有关药品监督管理的法律、法规,加强药品质量管理,对本单位所使用的药品质量负领导责任; 三、组织、督促有关人员建立和完善各项规章制度,并负责签发药品质量管理文件; 四、定期召开药品质量管理工作会议,研究、解决药品质量管理方面的重大事项; 五、督促药品质量管理工作的落实,保证药剂科有效行使职权; 六、组织职工积极参加各种业务培训,保证职工不断提高法律意识、业务素质和药品质量管理水平; 七、重视患者意见和投诉的处理,负责质量事故的处理、质量问题的解决和质量改进; 八、督促、检查各岗位履行质量职责,监督药品管理制度的落实; 九、负责组织制定和修订各项药品质量管理制度,实施和维护药品质量管理体系的有效运行,主持药品质量管理制度的检查与考核工作; 十、负责协调部门之间药品质量管理工作的有效开展; 十一、负责药品从业人员培训教育工作的组织工作; 十二、研究、部署、检查药品质量管理工作,实施奖惩; 十三、其它药事管理工作。
质量记录生效期: 2001/9/20 质量记录表格汇编修改状态: 0 文件编码:ZJ.QR- 第页共页 目录 受控文件清单 (4) 文件发放登记表 (5) 文件领用申请表 (6) 文件修改建议表 (7) 文件更改通知书 (8) 计算机登记表 (9) 收文(图)登记表 (10) 发文(图)登记表 (11) 会议签到表 (12) 档案资料移交表 (13) 管理评定质量改进措施记录表 (14) 年度员工培训工作计划表 (15) 员工培训申请表 (16) 年度员工培训实施情况汇总表 (17) 合同(标书)评审/会签表 (18) 外部投诉处理记录表 (19) 供方评价记录 (20) 合格供方名单 (21) 建设监理月报 (22) 施工组织设计(方案)报审表 (27) 分包单位资格报审表 (28) 工程定位测量放线报验单 (29) 工程材料/构配件/设备报审表 (30) 进场主要施工机械报验单 (31) 隐蔽工程验收记录 (32)
报验申请表 (33) 事故报告单 (34) 监理工程师通知单 (35) 监理工程师通知回复单 (36) 监理工作联系单 (37) 工程监理日记 (38) 工程开工/复工报审表 (40) 工程暂停令 (41) 工程临时延期申请表 (42) 工程临时延期审批表 (43) 工程最终延期审批表 (44) ()月工程计量申报表 (45) 工程款支付申请表 (46) 工程款支付证书 (47) 工程变更单 (48) 费用索赔申请表 (49) 费用索赔审批表 (50) 工程进度款审核委托单 (51) 工程预/结算审核委托单 (52) 审核通知 (53) 单位工程竣工预验申请表 (54) 工程竣工报验单 (55) 遗留问题处理表 (56) 质量回访工作记录 (57) 样品登记 (58) 顾客提供办公用品登记表 (59) 外租/借检测设备、仪器登记表 (60) 检测设备、仪器台帐 (61) 检测设备、仪器领用登记表 (62)
药品质量档案 阜阳市全家福大药房零售连锁有限公司
阜阳市全家福大药房零售连锁有限公司 药品质量档案 建档部门建档日期年月日建档原因建档人质量标准 生产企业名称 品名 规格剂型 主要成份 功能主治 用法用量 性状 禁忌 贮藏要求OTC 是甲类□乙类□否□批准文号注册商标 营业执照编号许可证编号 质量状态记录 年月日购进数量批号质量状态不良反应
药品质量档案 建档部门建档日期年月日建档原因建档人质量标准 生产企业名称 品名 规格剂型 主要成份 功能主治 用法用量 性状 禁忌 贮藏要求OTC 是甲类□乙类□否□批准文号注册商标 营业执照编号许可证编号 质量状态记录 年月日购进数量批号质量状态不良反应
药品质量档案 建档部门建档日期年月日建档原因建档人质量标准 生产企业名称 品名 规格剂型 主要成份 功能主治 用法用量 性状 禁忌 贮藏要求OTC 是甲类□乙类□否□批准文号注册商标 营业执照编号许可证编号 质量状态记录 年月日购进数量批号质量状态不良反应
药品质量档案 建档部门建档日期年月日建档原因建档人质量标准 生产企业名称 品名 规格剂型 主要成份 功能主治 用法用量 性状 禁忌 贮藏要求OTC 是甲类□乙类□否□批准文号注册商标 营业执照编号许可证编号 质量状态记录 年月日购进数量批号质量状态不良反应
药品质量档案 建档部门建档日期年月日建档原因建档人质量标准 生产企业名称 品名 规格剂型 主要成份 功能主治 用法用量 性状 禁忌 贮藏要求OTC 是甲类□乙类□否□批准文号注册商标 营业执照编号许可证编号 质量状态记录 年月日购进数量批号质量状态不良反应
1.适用范围 本标准适用于经药品监督管理部门批准的有正式批准文号产品质量档案管理。 2.职责 QA主管:保证该文件顺利、正确地执行。 质量管理员:负责产品质量档案管理的全部工作。 QC人员:负责提供质量检验方面的数据统计结果。 3.内容 3.1.凡已取得正式批文的产品均要建立产品质量档案。 3.2.质量档案的管理 3.2.1.质量管理员负责建立、整理、编辑产品质量档案,按年汇总归档。 3.2.2.每一份档案要按规定编辑成册,存放在加锁的柜中保存,注意防潮、防虫蛀、防火, 保管得当,不得遗失。 3.2.3.借阅产品质量档案执行《文件管理程序》中的规定。 3.3.产品质量档案的内容 3.3.1.产品概述 3.3.1.1.产品简介及工艺流程图 ●产品简介:产品名称(正式品名、商品名、汉语拼音名、英文名、结构式、化学名、 分子式、分子量)、产品特点(性状、规格、适应症、用法与用量、贮藏、有效期等)、新药类型、处方来源等。 ●简易工艺流程图 3.3.1.2.新药证书及批件(包括:证书、批件和批准的质量标准、使用说明书) 3.3.1.3.制备工艺及其研究资料 3.3.1. 4.理化性质研究及文献资料 3.3.1.5.成品质量标准及起草说明 3.3.2.成品质量标准的变更(包括:变更申请报告、有关试验资料、药品监督部门的批文、 变更的统计) 3.3.3.原料、辅料、包装材料、产品内控质量标准及变更(包括内容同上) 3.3. 4.逐年质量指标完成情况及历年产品质量情况统计(包括:逐年质量指标完成情况统计、 历年产品质量情况统计) 3.3.5.质量事故及报告资料(包括:质量事故登记、上报资料) 3.3.6.产品回收及退货处理(包括:产品收回记录、退货处理单)
首营企业审批表 编号:填表日期: 企业名称 类别药品生产企业□药品经营企业□ 拟供品种 详细地址邮政编码联系人联系电话传真 许可证许可证名称许可证号 许可范围法定代表人 有效期至年月日 发证机关 发证日期年月日 营业执照企业名称许可证号 许可范围法定代表人 经济性质发证机关 有效期至年月日发证日期年月日 质量认证证书及编号有效期限 需索取企业相关资料1、供货单位合法证件:药品生产许可证或药品经营许可证、营业执照复印件(加 盖公章)。() 2、供货单位的GMP或GSP认证书。() 3、供货单位签订的药品质量保证协议。() 4、销售人员的法人委托书、身份证。() 5、销售人员的药品从业资格证书。() 6、销售人员的毕业证书、法律法规培训证、无不良品行记录证明。() 7、其他证件() (具体内容:) 申请理由 采购人员:年月日 实地考察 结论 考察人:年月日其他 核实情况核实人:年月日审核意见 审核合格,请企业负责人审批□ 审核不合格,不得购进□ 质量负责人:年月日审批意见 同意作为合格供货方□ 不同意作为合格供货方□ 企业负责人:年月日备注
附表2 首营品种审批表 编号:填写日期: 通用名称规格 商品名称单位 生产企业 性能、用途 储存条件质量信誉 批准文号质量标准批发价装箱规格有效期零售价GMP证书号认证时间采购价 索取产品资料1、供货单位合法证件:药品生产许可证或药品经营许可证、GMP或GSP认证书、营业 执照(复印件加盖公章)。( ) 2、药品销售人员的法人委托书(原件)、身份证。( ) 3、药品销售人员的药品从业资格证书( ) 4、药品销售人员的法律法规培训证书、无不良品行记录证明、毕业证书。( ) 5、药品批准文号() 6、药品质量标准() 7、药品检验报告()8、药品包装标签、说明书等() 9、物价部门核准价格()10、临床总结报告及其他相关资料() 申请理由 采购员:年月日 质量管理 部门意见 审核合格,请企业负责人审批□ 审核不合格,不得购进□ 质量负责人:年月日审批意见 同意进货□不同意进货□ 企业负责人:年月日备注
资料范本 本资料为word版本,可以直接编辑和打印,感谢您的下载 药品质量管理制度范本 地点:__________________ 时间:__________________ 说明:本资料适用于约定双方经过谈判,协商而共同承认,共同遵守的责任与义务,仅供参考,文档可直接下载或修改,不需要的部分可直接删除,使用时请详细阅读内容
药品质量管理制度(医院) 药剂科职责 一、负责起草药品质量管理制度,并认真组织执行; 二、负责对供货单位和购进药品的合法性和药品质量进行审核; 三、负责建立本单位所使用药品的质量档案; 四、负责药品质量查询和药品质量事故或质量投诉的调查、处理及报告; 五、负责不合格药品的检查确认和处理; 六、负责药品的购进、验收、储存、陈列、保管、养护、调配和临床药学工作; 七、负责搜集和分析药品质量信息、负责药品不良反应监测和报告等药事管理工作。
主管药品质量负责人职责 一、贯彻、执行《药品管理法》、《药品管理法实施条例》和《山东省药品使用条例》等有关法律、法规,确保依法使用药品,保证患者用药安全、有效、合理、及时、方便; 二、在“质量第一”的思想指导下进行药品质量管理,组织本单位职工认真学习和贯彻执行有关药品监督管理的法律、法规,加强药品质量管理,对本单位所使用的药品质量负领导责任; 三、组织、督促有关人员建立和完善各项规章制度,并负责签发药品质量管理文件; 四、定期召开药品质量管理工作会议,研究、解决药品质量管理方面的重大事项; 五、督促药品质量管理工作的落实,保证药剂科有效行使职权; 六、组织职工积极参加各种业务培训,保证职工不断提高法律意识、业务素质和药品质量管理水平; 七、重视患者意见和投诉的处理,负责质量事故的处理、质量问题的解决和质量改进; 八、督促、检查各岗位履行质量职责,监督药品管理制度的落实; 九、负责组织制定和修订各项药品质量管理制度,实施和维护药品质量管理体系的有效运行,主持药品质量管理制度的检查与考核工作; 十、负责协调部门之间药品质量管理工作的有效开展; 十一、负责药品从业人员培训教育工作的组织工作; 十二、研究、部署、检查药品质量管理工作,实施奖惩; 十三、其它药事管理工作。
(一)、正确理解和把握GSP认证条款中的一些基本概念,是全面推进GSP管理的基础环节。 1、药品经营方式 药品经营方式是指药品批发经营和药品零售经营。 批发:是指将购进的药品销售给药品生产企业、药品经营企业、医疗机构的经营活动。药品批发不包括药品生产企业销售自产药品的经营活动 零售:指药品经营企业将购进的药品直接销售给消费者、病患者的经营活动。零售不得对其他药品经营企业及医疗机构销售药品。 零售连锁:指经营同类药品、使用统一商号的若干个门店,在同一总部的管理下,采取统一采购配送、统一质量标准、采购与销售分离、实行规模化管理经营的组织形式,零售连锁是零售的一种特殊模式。 2、药品经营范围 药品经营范围是指经药品监督管理部门核准经营药品的品种类别。主要分类为:生物制品(预防性生物制品除外);中药材、中药饮片、中成药、化学原料药、化学药制剂、抗生素原料药、抗生素制剂、生化药品、诊断药品。 企业依法领取的《药品经营许可证》上的经营范围和经营方式,是药品监督管理部门根据《药品经营许可证管理办法》及企业申请,经审核其相应条件后依法批准的,2009年成考大纲,是对企业经营方式与经营范围的法律界定。药品经营企业必须保证执行国家有关法律法规,对本企业的经营方式、经营范围有准确了解,并依照《药品经营许可证》批准的经营范围和经营方式从事经营活动。 药品经营企业不得在经药品监督管理部门核准的地址以外的场所储存或者现货销售药品药品(现货销售是指药品生产、经营企业或其委派的销售人员,在药品监督管理部门核准的地址以外的其他场所,携带药品现货向不特定对象现场销售药品的行为);不得为他人以本企业的名义经营药品提供场所,或者资质证明文件,或者票据等便利条件;不得以展示会、博览会、交易会、订货会、产品宣传会等方式现货销售药品;未经药品监督管理部门审核同意,药品经营企业不得擅自改变经营方式、经营地址或擅自扩大经营范围。 3、质量管理制度 药品质量管理制度是药品经营企业根据GSP要求和企业质量管理的实际需要而制定的工作准则,是对企业各部门和各业务环节如何实施质量管理作出的明确规定,即对于相关的质量管理工作明确规定应该怎么作?按什么程序去作?质量管理制度是药品经营质量管理的决定性要素,是实施、保证和保持质量管理工作有效开展的基础。 GSP规定企业应制定的有关质量管理的制度包括十七项:有关业务和管理岗位的质量责任;药品购进的管理规定;药品验收的管理规定;药品储存的管理规定;药品陈列的管理规定;药品养护的管理规定;首营企业和首营品种审核的规定;药品销售及处方管理的规定,成人高考考试大纲。拆零药品的管理规定;特殊管理药品的购进、储存、保管和销售的规定;质量事故的处理和报告的规定;质量信息管理的规定;药品不良反应报告的规定;各项卫生管制度;人员健康状况的管理规定;服务质量的管理规定;经营中药饮片的企业,应有符合中药饮片购、销、存管理的规定。 药品质量管理制度的制定必须遵循合法性(内容要符合现行的有关药品法律、法规、规章的规定);系统性(层次清楚,相互协调);指令性(明确具体工作要求并能保证有效执行);实用性(与企业的质量管理紧密结合,符合企业的客观实际,不简单照搬照抄);可操作性(制度的规定在实际工作中能够达到和实现);可检查性(要求具体,指标量化,便于检查
编号: GZHXYXT-QA-QMS-003-03 执行日期: 2014年09 月 30 日密级■普通□秘密□绝密 文件类别: 管理制度标题: 药品质量档案管理制度 起草部门:质量管理部 起草日期: 2006年 07月 15日起草人:** 修订:■是□否 修订时间: 2014年 07月 01日修订人:*** 审核部门:质量管理领导小组 审核日期:2014年09 月 30 日审核人:*** 会签确认人: 各部门经理 会签日期:2014年09 月 30 日发放部门:公司各部门 批准人:**批准日期:2014年09 月 30 日 1. 目的:为规范公司各部门及员工的资料档案管理、实现信息共享、提高工作效率、统一归档便于查阅、规范档案管理,特制订本制度。 2. 制定依据: 2.1《中华人民共和国药品管理法》及其实施条例; 2.2《药品经营质量管理规范》等。 3. 适用范围:适用于本公司各部门文件档案管理。 4. 制度内容: 4.1公司行政人事部负责企业的知识档案管理、并对其他各部门档案监督检查指导;各部门负责人负责本部门所属工作档案的建档管理日常工作;各兼职制度管理人员负责所辖档案资料的搜集、整理、归档,并移交行政人事部门;质量管理类档案由质量管理部依照GSP标准对所辖的档案资料负责搜集、整理、存档。 4.2公司行政人事部统一制定档案管理分类编码,指导各部门规范档案整理归档工作。 4.3公司质量管理类相关单据及表格(包括填写说明)由质量管理领导小组组织制定,各执行部门执行。 4.4单据及有关表格书写规范要求: 4.4.1字迹清晰可辨,便于长期保存。数字书写不得连体,并按标准书写分节号;书写笔使用蓝黑钢笔、碳素笔书写,防止年久淡化、字迹不清; 4.4.2当记录文件需要修改时,应使用“---”将需要修改的内容划去,保持原内容清晰可见,旁边写上修改内容,签上修改人的姓名及修改日期; 4.4.3正式文件、规章制度、流程制度应有文件标头,必须记载文件类别、题目、文件编号、起草部门及起草人、审阅部门及审阅人、批准人、批准日期、执行日期。经批准人签发后,该制度正式生效。禁用手稿复印发文; 4.4.4归档整理应书写“卷宗号码”、“部门码”、“文件类别码”、“序号码”、“年代标识”、“保密标识”