
第一章气体、液体和溶液的性质Chapter 1The Behaviors of Gas、Liquid and Solution
§1-1 气体的性质
The Properties of Gases
本节的重点是三个定律:
1.道尔顿分压定律(Dalton’s law of partial pressures)
2.阿码加分体积定律(Amagat’s law of partial volumes)
3.格拉罕姆气体扩散定律(Graham’s law o f diffusion)
一、理想气体(Ideal Gases)――讨论气体性质时非常有用的概念
1.什么样的气体称为理想气体?
气体分子间的作用力很微弱,一般可以忽略;
气体分子本身所占的体积远小于气体的体积。
即气体分子之间作用力可以忽略,分子本身的大小可以忽略的气体,称为理想气体。2.理想气体是一个抽象的概念,它实际上不存在,但此概念反映了实际气体在一定条件下的最一般的性质。
3.实际气体在什么情况下看作理想气体呢?
只有在温度高和压力无限低时,实际气体才接近于理想气体。因为在此条件下,分子间距离大大增加,平均来看作用力趋向于零,分子所占的体积也可以忽略。二、理想气体定律(The Ideal Gas Law)
1.由来
(1) Boyle’s law(1627-1691)British physicist and chemist - The pressure-volume
relationship
n、T不变,V∝ 1/ p or pV = constant
(2) Charles’s law(1746-1823)French scientist
1787年发现-The temperature-volume relationship
n、p不变,V∝T or V/T = constant
(3) Avogadro’s law(1778-1823)Italian physicist
Avogadro’s hypothesis :Equal volumes of gases at the same temperature and pressure contain equal numbers of molecular.
Avogadro’s law The volume of a gas maintained at constant temperature and pressure is directly proportional to the number of moles of the gas.
T、p不变,V∝n
2.理想气体方程式(The ideal-gas equation)
由上三式得:V∝nT / p,即pV∝nT,引入比例常数R,得:pV = nRT
3.R:Gas constant
Units l·atm·mol-1·K-1J·mol-1·K-1m3 ·Pa·mol-1·K-1cal·mol-1·K-1l·torr·mol-1·K-1 Numerical Value 0.08206 8.314 8.314 1.987 62.36
在标准状况下:
1.000 0.08206 273.15
22.41(L)
1.000
nRT
V
p
??
===
4.理想气体方程式应用(Application of the ideal-gas equation)可求摩尔质量
(1) 已知p,V,T,m求M
(2) 已知p,T,ρ求M
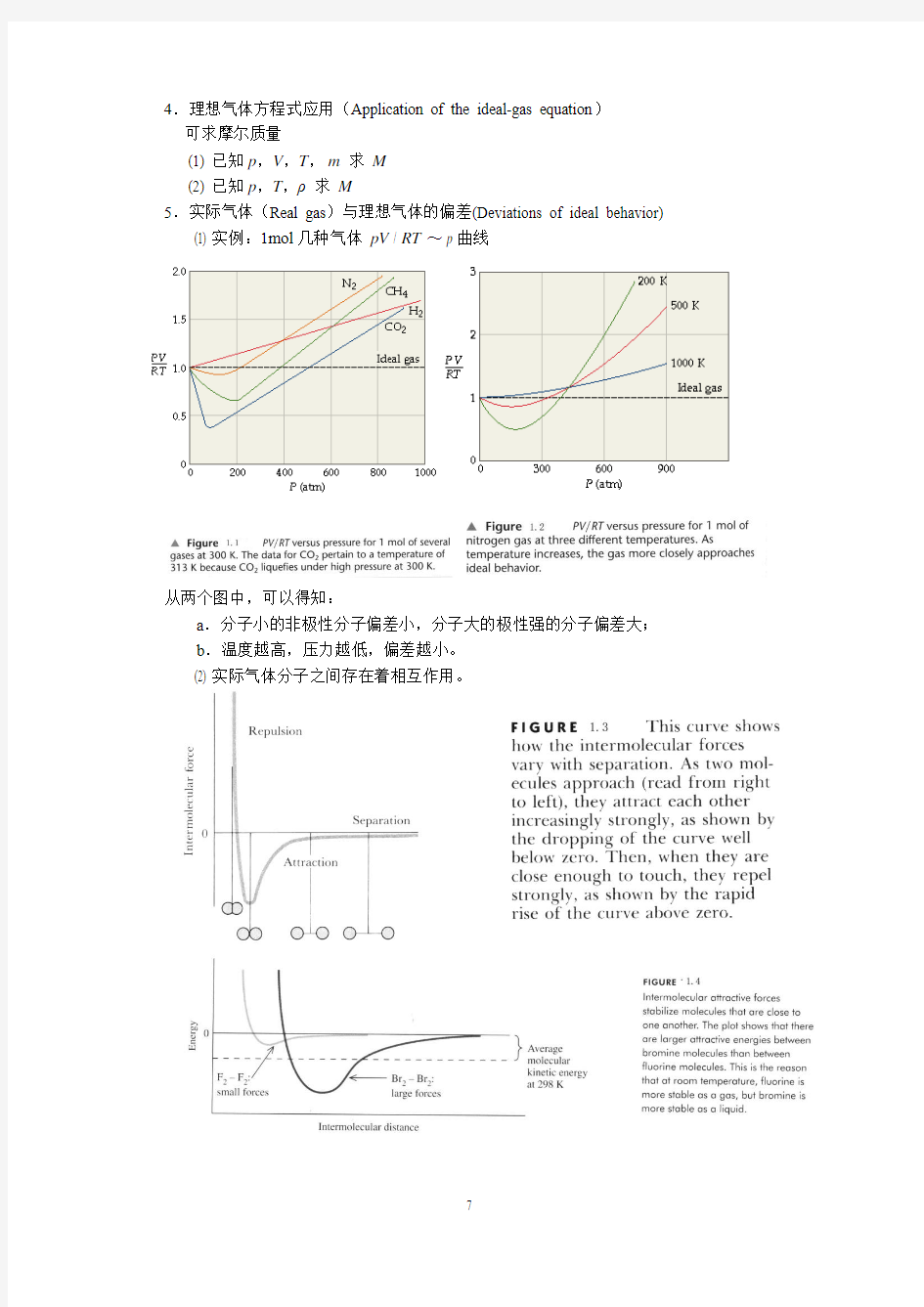
5.实际气体(Real gas)与理想气体的偏差(Deviations of ideal behavior) (1) 实例:1mol几种气体pV / RT~ p曲线
从两个图中,可以得知:
a.分子小的非极性分子偏差小,分子大的极性强的分子偏差大;
b.温度越高,压力越低,偏差越小。
(2) 实际气体分子之间存在着相互作用。
实验证明,两个氩原子核之间距d <4?时,f 排斥起主要作用;d = 4 ~ 7?时,f 引力起主要作用,d >7?时,氩原子之间的作用忽略。对于复杂分子的作用,缺少准确的数据,但类似的规律性为:近程排斥;中程吸引;远程为零。 (3) 当排斥力起主要作用时,PV >> nRT ,因为在排斥力的作用下,即使增大一定的压力,由于排斥力的抵抗,气体的体积也不会变小,所以V 实际偏大,产生正偏差,故 PV >> nRT ; 当吸引力起主要作用时,PV < nRT ,这是由于分子之间存在的吸引力,使分子对外界的压力变小。所以p 实际偏小,产生负偏差。故 PV < nRT 。
6.对理想气体定律的修正— van der Waals equation (1837-1923) Dutch scientist ,荣获1910年 Noble physical prize (1) 形式
2
2
n p a
V nb nRT V +-()()=
(2) 讨论:上式与p id V id = nRT 相比:
a .V id = V 实-n
b ,n 为mol 数,b 为每mol 分子本身占有的体积 ∴ V 实-nb 就成了气体分子本身占有体积已被扣除了的空间,即为V id b .2
id 2
n p p a
V =+实,为什么要在p 实项上再加上一项2
2
n a
V
呢?即为什么p 实<p 理呢?
降压的因素来自两个方面。(i) 由于分子内存在相互作用,所以分子对器壁的碰
撞次数减少,而碰撞次数与分子的密度(n / V )成正比;(ii) 分子对器壁碰撞的能量减少,它也正比于 n / V ,所以压力降低正比于n 2
/ V 2
,即p 实 + 22
n a
V
= p id 。
a 、
b 称为 van der Waals constant ,由实验确定。 7.从分子运动论推导理想气体定律 (1) 基本假设(Basi
c hypotheses ):
a .物质由分子或原子、离子所组成。同一化学性质的物质,其粒子的大小、形状和作用是一样的;
b .分子作不规则运动;
c .气体分子对器壁的碰撞是弹性碰撞。
(2) 推导(Deduction):设边长L 的一个立方箱子;其中有N 个气体分子。每个分子的质量为m ,速度为u 。假设有N /3气体分子沿x 轴方向运动,其动量为mu 。分子撞在左面箱壁A 后,以原来的速度向右飞(因为是弹性碰撞),其动量为-mu ,因此每撞壁一次,分子的动量就改变了2mu 。一个分子平均起来看,它向左、向右运动跨越容器,与器壁A 连续两次碰撞之间所走的距离为2L 。所以每个分子每秒钟的动量改变为
()2
2/2/mu mu L u L
=
N / 3个分子每秒钟的动量改变为
23N
m u f L
?= (单位时间内的动量改变), P (压强)= f / S = f / L 2 ∴ 22333N mu N mu L V p == , 即 2
3
Nmu pV = 实际上n i 个分子,其速度为u i ,作修正:
pV = 3m
(n 1u 12 + n 2u 22 +… + n i u i 2 + …),i i
N n =
∑
定义:2222
1122i i n u n u n u u N ++++
= ,2u 称为速率平方的平均值(均值),
代入上式,得 pV =2221323u m N u N m =,动E u m =221
统计物理学又导出了气体分子的平均动能与温度的关系:单原子分子的平均动能与温度的关系:kT E K 2
3
=
,k -Boltzmann’s constant , ∴2332
N pV kT NkT =?=
与pV = nRT 作比较:nR = N k ,则k = nR / N ,而N / n = N A
∴231
23
8.314/ 1.38110J K 6.02210
A
k R N
--==
=??? k 的物理意义是分子气体常数
三、道尔顿分压定律(Dalton’s Law of Partial Pressures ) 1801年
1.Deduction :假设有一理想气体的混合物,此混合物本身也是理想气体,在温度T 下,占有体积为V ,混合气体各组分为i (=1,2,3,… i ,…)
由理想气体方程式得:
11
RT p n V
= ,22
RT p n V
= ,……,i i
RT p n V
=,……
∴总p V
RT
n V RT n p i
i ===∑∑,即∑=i
p p 总 2.表达式:∑=
i
p
p 总
3.文字叙述:在温度和体积恒定时,其总压力等于各组分气体单独存在时的压力之和。
4.另一种表达形式:i
i i i RT
n p n V x RT p n
n V
===总─ mole fraction 在温度和体积恒定时,理想气体混合物中,各组分气体的分压(p i )等于总压(p 总)乘以该组分的摩尔分数(x i )。
5.实验证明:Ramsay (1852-1916) — British chemist, 荣获
1904 Nobel chemical prize
6.Application of Dalton’s law of partial pressures (1) 求分压:
Sample Exercise 1:Suppose that hydrogen is collected over water at 25℃ .How much H 2 (expressed in moles) has been collected when the volume of gas is 223 ml under atmospheric pressure of 74.2 cm Hg?
Solution : 22atm H H O p p p =+ , atm p =74.2 cm Hg
The vapor pressure of water at 25℃ is 23.8 mmHg (=2.38 cm Hg)
∴2
2
H atm H O 74.2 2.471.8cmHg p
p p =-==-
Solving the ideal gas equation for n , we find
31061.815
.29808206.0223
.0)0.76/8.71(-?=??==
RT pV n (mol) (2) 求转化率:
Sample Exercise 2:已知某温度、1atm 下,A 4B 2(g)在密闭容中进行如下分解
A 4
B 2(g)
2A 2(g) + B 2(g)
达到平衡时,容器的压力为1.4atm ,求A 4B 2的转化率为多少?
如左图:Pd 制小管只允许氢气通过,而不许氩气通过。在外管通入一定压强的氢气,平衡后,2T Ar H p p p =+。不断改变氢气的压强(2'H p 、2''H p ),则2''T Ar H p p p =+,
2''''T Ar H p p p =+,T p 关系式不变,从而验证
了Dalton 分压定律。
Fig. 1.8 Ramsay ’s apparatus of verifying the law of partial pressures
Solution : A 4B 2(g)2A 2(g) + B 2(g)
1 0 0
1-α 2α α ∴
1112 1.4
ααα
=-++ ∴α = 0.2
四、阿玛加分体积定律(Amagat’s Law of Partial Volumes )
1.什么叫分体积:混合气体中某组分i 单独存在,并且和混合气体的温度,压强相同时,所具有的体积V i ,称为混合气体中第i 组分的分体积,图示为:
总体积 V
分体积 V 1
分体积 V 2
n 1 + n 2
n 1
n 2
2.分体积定律:当温度,压力相同时,混合气体的总体积等于各组分分体积之和 3.Deduction :
1212()///i i n n n RT
nRT V n RT p n RT p n RT p p p
++
++=
==++
++
12///i n RT p n RT p n RT p =++++ 12i i V V V V =++
+
+
=∑
五、格拉罕姆扩散定律 (Graham’s Law of Effusion and Diffusion )
1.Difference between effusion and diffusion . The mixture of one gas with another is called
diffusion. Effusion means gas molecules move from a high-pressure region to a low-pressure region through a pin hole
2.Graham’s law: Thomas Graham discovered that the ef fusion rate of a gas is inversely
proportional to the square root of its molar mass
恒压条件下,某一温度下气体的扩散速率与其密度(或摩尔质量)的平方根成反比 3
.表达式:12/u u ==
4.验证
(1)实验证实:自白烟圈与管口的距离,可测得两种气体的扩散速率。
(2) 理论推导
由分子运动论的推导可知: 2
23()3
u pV m pV Nu N m
=
=
?
∴
u =
N m
V ρ?=
∴当p = constant , u ∝
∴
12/u u =
又 ∵ M ρ∝ ∴
12/u u =思考:扩散时间与密度(或摩尔质量)之间的关系如何?
212121///M M t t ==ρρ
5.Application of Graham’s law
(1) 利用此定律可以测定未知气体的分子量(或原子量),Ramsay 就是利用此法,测
定了Rn 的原子量。
Sample Exercise :An unknown gas composed of homonuclear, diatomic molecules effuses at a rate that is only 0.355 times that of O 2 at the same temperature. What is the identity of the unknown gas? Solution
:
22
x O rate rate =
22x O r a t e r a t e
0.355= ∴
0.355= M 2x = 254 g / mol ∴ 原子摩尔质量 = 254×1
2
= 127 g / mol ∴ We conclude that the unknown gas is I 2(g). (2) 可以分离同位素
自然界中235U 占0.7%,238U 占99.3%,235U 可以由热中子诱发裂变,而238U 不能由热中子诱发裂变。
从铀矿(pitchblende )(沥青铀矿,UO 2)制备UF 6(b. p. = 56℃):
3UO 2 + 8HNO 3
3UO 2(NO 3)2 + 2NO + 4H 2O
2UO 2(NO 3)2
300 o
C
2UO 3 + 4NO 2 + O 2 UO 3 + H 2
700 o
C
UO 2 + H 2O
UO 2
+ 4HF UF 4 + 2H 2O UF 4 + F 2 UF 6
2356
2386UF UF
rate 1.0043rate =
=
==
这种微乎其微的差别,要求gaseous diffusion plant must be very large. The original plant in Oak Ridge Tennessee had 4000 diffusion stage and covered an area of 43 acres (267亩,1英亩 = 6.07亩)
§1-2 液体 Liquids
液体所表现出来的特性由其结构特点决定的。它处于完全混乱的气体状态和基本上完全有序的固体状态之间,所以它既不能象气体运动论那样作基本假设,又不能象固体那样,通过一定的对称性作一些定量计算,因而液体的定量理论的发展到目前为止还不甚理想。但液体本身也有一些特性,如:粘度(viscosity)、表面张力(surface tension)、凝固点
(freezing point)、沸点(boiling point)、饱和蒸气压(saturated vapor pressure of liquid ),简称为蒸汽压(vapor pressure of liquid )。本节我们主要讨论液体的饱和蒸气压和凝固点。
一、液体的蒸气压(Vapor Pressure of Liquid )
1.蒸发过程
(1) 蒸发是液体气化的一种方式,也可以称为相变过程(phase changes )。蒸发过程伴随着能量的变化(energy changes)。很显然,当液体不能从外界环境吸收能量的情况下,随着液体的蒸发,液体本身温度下降,蒸发速率也随之减慢。 (2) 液体的蒸发热(heat of vaporization),也称为蒸发焓(enthalpy of vaporization)。 恒压、恒温下,维持液体蒸发所必须的
热量,称为液体的蒸发热。 2.液体的饱和蒸气压(简称蒸气压) (1) 在液体表面,只有超过平均动能的分
子,才能克服邻近分子的吸引,进入气相中-─蒸发。
(2) 在密闭容器中,在不断蒸发的同时,部
分蒸气又会重新回到液体-─凝聚。
(3) 在一定温度下,在密闭容器中,经过一
定时间,蒸发与凝聚达到平衡,这时液
面上的蒸气称为饱和蒸气。
(4) 由饱和蒸气产生的压强称为饱和蒸气压,简
称蒸气压(vapor pressure of liquid )。
(5) 对于同一种液体的蒸气压不决定于液体的体积,也不决定于蒸气体积,只与温度
有关,所以蒸气压仅与液体本质和温度有关。
思考题:蒸气是气体,它是否服从Boyle’s law? 3.蒸气压与蒸发热的关系(The relationship between
vapor pressure and enthalpy of vaporization)-The Clausius —Clapeyron equation ((克劳修斯─克拉贝龙方程式)
(1) 以饱和蒸气压的自然对数ln p 对绝对温度的倒数(1/T )作图,得到的图象是一条直线,乙醇的ln p 与1 / T 的关系如左图,符合下面的直线方程:
vap ln (1/)H
p T C R
?=-
+ R :gas constant C :直线的截距
Δ
vap H :enthalpy of vaporization per mole of substance
(2) Clausius-Clapeyron equation 假设在T 1~T 2温度区间内,Δvap H
不变,蒸气压分别为p 1和p 2,则
vap 11ln (1/)H p T C R
?=-
+ (1) vap 22ln (1/)H p T C R
?=-
+ (2)
(1)-(2)式,得 vap 122111ln(/)(
)H p p R T T ?=
-
或者 vap 122
1
1
1lg(/)()2.303H
p p R T T ?=
-
此式称为克劳修斯-克拉贝龙方程式。
(3) Application
a .已知T 1、P 1、T 2、P 2,求 △vap H ;
b .已知△vap H 和一个温度下的p ,求另一个温度下的p 。
Sample Exercise :The melting point of potassium is 62.3℃. Molten potassium has a vapor pressure of 10.00 torr at 443℃ and a vapor pressure of 400.0 torr at 708℃. Calculate the heat of vaporization of liquid potassium.
Solution :By using the Clausius-Clapeyron equation
vap 12
2111
ln
()H p p R T T ?=
- ∴ vap 10.00
1
1ln
(
)400.08.314708273.15
443273.15
H
?=-
++
△vap H = 81.32(kJ · mol -1)
二、液体的沸点(Boiling Point of Liquids )
1.液体的沸点是指液体的饱和蒸气压与外界大气压相等时的温度。 2.特征:在此温度下,气化在整个液体中进行,液体表现出沸腾。
3.沸腾与蒸发的区别:蒸发是低于沸点温度下的气化,仅限于在液体表面上进行,所以
在沸点以下的液体气化和达到沸点时液体气化是不同的。
4.The boiling point of a liquid at l atm pressure is called its normal boiling point
三、液体的凝固点(Freezing Point of Liquids )
1.液体的蒸气压与其固体的蒸气压相等时的温度称为液体的凝固点。
2.低于凝固点的液体称为过冷液体(super cooling liquid)。这种现象称为过冷现象(super cooling phenomena)。液体越纯,过冷现象越严重,高纯水可以冷到-40
℃才开始结
冰。因为液体越纯,结晶中心越难形成。过冷液体是不稳定的状态。结晶一旦开始,体系有趋向平衡的趋势。
3.水的三相点(Triple point):气-液-固三相的平衡点。即纯水在平衡水蒸气压下的凝固点,气、液、固都是纯净的H2O。而冰点是指在标准压力下,被空气饱和的水的凝固点,即空气的饱和水溶液(含有少量N2、O2、Ar等)和冰(纯H2O)的平衡温度。所以水的三相点是指一个纯净、简单的体系,是一个固定不变的状态;而水的冰点是指一个比较复杂的体系,随外界条件的不同略有差异。
Fig. 1.13 Phase diagram of (a) H2O and (b) CO2. The axes are not drawn to scale in either case. In (a), for water, note the triple point A (0.0098℃, 4.58 torr), the normal melting (or freezing) point B (0℃, 1atm), the normal boiling point C (100℃, 1atm), and the critical point D (374.4℃, 217.7atm). In (b), for carbon dioxide, note the triple point X (-56.4℃, 5.11atm), the normal sublimation point Y (-78.5℃, 1atm), and the critical point Z (31.1℃, 73.0atm).
4.水的临界温度T c (Critical temperature)
气液平衡曲线不能无限延长。实验证明其顶点D为374.2℃和2.21×107 Pa。温度高于374.2℃,水只能以气态的形式存在,再加多大外压,气体也不能液化。在374.2℃以上,既然液态已不再存在,也没有气—液平衡。所以D点是气-液平衡曲线的顶端,就是水的临界状态。
物质的临界点有何特征?什么是超临界流体?
将一个刚性密封容器内部抽成真空,然后充入适量某液体物质(例如,31℃以下充入CO2)。在该温度下,该物质会有部分挥发成气态,当达到饱和蒸气压时,气-液两相达到相平衡,液体表面成为两相的界面。当加热该容器时,容器内温度升高,蒸气压加大,符合Clausius-Clapeyron公式。当温度升到某一特定点时(对CO2,该点温度为31℃),气-液两相的界面突然消失,两相变为一相,具有相同的密度,此时的气化热(相变潜热)为零,这一点称为该物质的临界点(critical point)。
当T>T c,p>p c时的流体称为超临界流体(supercritical fluid)。物质在超临界状态下有一些特殊的性质:
(1) 在临界点附近,其密度与液态的密度数量级类似,而其流动性却更接近气态;
(2) 超临界流体的密度随压力的变化改变极大;
(3) 物质在超临界状态下可以溶解许多其在液态时不能溶解的物质,而且这种溶解度也
随压力的变化会有极大的改变。
§1-3 溶液
Solutions
一、一些基本概念(Some Basic Concepts)
1.分散系(Dispersion system)
(1) 一种或几种物质的质点分散在另一种物质的质点中所形成的体系,称为分散系。
分散系中又分为:
分散相(dispersion phase) :被分散的物质称为分散相
分散介质(dispersion medium):容纳分散相的物质称为分散介质
(2) 分类(Classification):
a.均匀分散系(homogeneous dispersion system)
b.不均匀分散系(heterogeneous dispersion system)
(3) 分散相直径:
d < 1nm 溶液,d = 1~100nm 溶胶,d > 100nm 悬浊液、乳浊液。
2.溶液(Solutions)
(1) 溶液是均匀的分散系。它包括分散相─溶质(solute),分散介质─溶剂(solvent)。
(2) 溶液的种类(kinds of solution)
Table 1.1 Examples of Solutions
State of Solution State of Solvent State of Solute Example Gas Gas Gas Air
Liquid Liquid Gas Oxygen in water
Liquid Liquid Liquid Alcohol in water
Liquid Liquid Solid Salt in water
Solid Solid Gas Hydrogen in palladium
Solid Solid Liquid Mercury in silver
Solid Solid Solid Silver in gold 3.溶解(Dissolve)
(1) 溶解过程是物理化学过程。固体盐的溶解常伴随热效应,两种液体之间的混合常
伴随体积变化,也伴随热效应。
(2) 溶解度(solubility)
a.溶解平衡是一个动态平衡(dynamic equilibrium)。
b.饱和溶液的浓度也可以认为是溶解度。溶解度除了用g/100g H2O表示,还可用 mol·dm 3, % 表示。
c.在室温下,s >10g/100g H2O称为易溶,s在1~10g/100g H2O称为可溶,s在
0.1g ~ 1g/100g H2O 称为微溶,s<0.1g/100g H2O称为难溶。绝对不溶的物质
是没有的。
d.影响溶解度的因素:
(i) 内因:“相似相溶”:H2O (polar solvent)-离子化合物(Ionic compounds),
水-极性分子(polar molecule)相溶较好
non-polar solvent –non-polar molecule 相溶较好
(ii) 外因:温度(temperature)和压强(pressure)
温度:Solid:温度升高,溶解度有增大,有不变,有减少;
Liquid:温度升高,溶解度增大。
∵ 温度升高液体分子间距增大, ∴ 分子易互溶
Gas :温度升高,溶解度减少。
压强:压强增大时,对固体、液体溶解度变化不大,但对气体的溶解度影
响很大。
4.享利定律(Henry’s law )-气体溶解定律
(1) 叙述:在一定温度和一定体积的液体中,所溶解的气体质量与该气体的分压成正比。例如:0℃、1atm 的CO 2的溶解度:s 0 = 0.335g / 100ml H 2O ,0℃、2 atm 的CO 2的溶解度:s 0 = 0.670g/100ml H 2
O
(2) 解释:当气体的压强增加n 倍,那么气体进入液体的机会也增加n 倍,所以气体溶解的质量也增加n 倍。故亨利定律与其它气体的分压无关。例如:1atm 的纯氧在水中的溶解度是空气中氧气的4.7倍,因为空气中氧的分压2O p = 0.21atm 。所以若气相中有几种气体,则各种气体的溶解度皆与其分压成正比。 (3) 数学表达式:k H = p / x (k H :Henry’s constant)
p 是被溶解气体的分压(以mmHg 为单位),x 是溶解的气体在溶液中所占的物质的量分数。
由于亨利定律有几种不同的叙述方式,浓度,压强都可以用不同的单位,所以在用公式时,特别要注意亨利定律常数k H 的单位。
在我们这个表达式中,摩尔分数 (x ) 是无量纲的,气体分压 (p ) 的单位用mmHg 柱,所以k H 的单位也应是mmHg 柱。
Sample Exercise :20℃时,氧气溶解在水中的亨利定律常数为2.95×107mmHg 柱,在
通常大气中,氧分压为0.21atm ,此时有多少摩尔氧气溶在1000g 水中?
Solution :2O 0.21760160(mmHg)p =?=, 7
H 2.9510(mmHg)k =?
由亨利定律 2
2
O O
p k x =
,得226O O 7
160/ 5.42102.9510
x p k -==
=??
2
22O O O 1000/18
n x n =+2O 1000/18
n ?
2O (1),n <<
∴ 2
6
4
O 10005.4210 3.011018
n --=??
=?
(mol)
(4) 亨利定律只适用于溶解度小、且不与溶剂相互作用的气体。HCl 、NH 3等气体与水有
相互作用,所以它们都不服从亨利定律。
二、溶液的浓度(The Concentrations of Solution )
1.溶液浓度表示法
(1) 质量分数(m/m ):(mass fraction, mass percentage),ppm(parts per million),ppb(parts per billion)
饮水中的砷含量不得超过0.05ppm (= 0.05mg/1L H 2O ) (2) 体积物质的量浓度(M = n / V )Molarity :
物质的量浓度(M ) = moles of solute/liters of solution
(3) 质量物质的量浓度(n / 1000g H 2O )Molality :
质量物质的量浓度(m ) = moles of solute / kilograms of solvent 当溶液很稀时,ρ = 1,所以1kg 溶剂近似看作1L 溶液,则M ≈ m (4) 摩尔分数(x i )Mole fraction of component:
摩尔分数x i = n i / n = moles of component/total moles of all components (5) Normality (N )(当量浓度)
当量浓度(N ) = n × moles of solute/liters of solution
在酸碱反应中,n 等于参加反应的H +
或OH -
数目,在Ox-Red 反应中,n 等于1mol 物质氧化数的总改变值。离开化学反应讲当量浓度,是毫无意义的。 2.各种浓度之间的换算(Units exchange )
上面的(1)换算成(2)和(5)必须知溶液的密度,(2)、(5)之间的互换必须知化学反应方程式。
3.各种不同纯度试剂的表示:
优级纯:Guarantee reagent (G. R.) 分析纯:Analytical reagent (A. R.) 化学纯:Chemical reagent (C. R.) 实验试剂:Laboratory reagent (L. R.)
三、稀溶液的依数性(Colligative Properties of Dilute Solution )
Colligative 来自拉丁语:colligare ,意为团结、一起的意思。依数性指的是仅仅与溶液中微粒的个数有关的性质,而与溶质的种类无关。
1.溶液的蒸气压降低(Lowering the vapor pressure )──稀溶液依数性的核心 (1) 在一定温度下,向纯溶剂中加入难挥发性的溶质,此溶液的蒸气压仍然是溶剂的蒸气压。
(2) 在一定温度下,溶液的蒸气压小于纯溶剂的蒸气压。
(3) 拉乌尔定律:1880年法国化学家拉乌尔(Raoult )通过实验发现:溶液的蒸气压下降与溶质的摩尔分数有关:
△0
p p p x p =-=?剂溶质剂,称为Raoult’s law. 其中0
p 剂为在某温度下纯溶剂蒸气压,p 为同一温度下溶液蒸气压。
对于只有一种难挥发溶质的溶液:x 质 + x 剂 = 1
∴△
00(1)p p p x p =-=-?剂溶剂剂,故 0
p x p =?剂剂
这是一种更常用的形式。文字叙述为:在一定温度下,某难挥发性溶质的溶液的蒸气压等于纯溶剂的蒸气压乘以溶剂的摩尔分数。
(a) (b)
Fig. 1.16 An aqueous solution and pure water in a closed environment. (a) Initial stage, (b) After a period of time, the water is transferred to the solution.
Sample Exercise 1:Glycerin, C 3H 8O 3, is a nonvolatile nonelectrolyte with a density of 1.26g/ml at 25℃. Calculate the vapor pressure at 25℃ of a solution made by adding 50.0ml of glycerin to 500.0ml of water. The vapor pressure of pure water at 25℃ is 23.8 torr. Solution : Moles of C 3H 8O 3 =
50 1.26
92.1? = 0.684(mol )
Moles of H 2O = 500118? = 27.8(mol ) 976.0681
.08.278
.27O H 2=+=x
)torr (2.238.23976.00
O
H O H O H 222=?=?=p x p
如果难挥发性的非电解质溶质的溶液很稀时,则n n >>剂质
∴剂质剂质质
质n n n n n x ≈
+=
, 而 1kg n m =
质
质溶剂
, 等式两边乘以M 剂
∴质剂
质剂
质剂质x n n M n M m ==
=
?/1000, 把x =质m M ?质剂
代入Δp 式中
得△0
p x p M p m K m =?=??=?质剂剂剂质质 (0
,
C C K M p T p =?≡≡剂剂剂时,)
即在一定温度下,某难挥发、非电解质稀溶液的蒸气压下降与其质量物质的量浓度成正比。严格来讲,这个定律只适合理想溶液(ideal solution )。在受到理想气体的启发下,人们也抽象出一种理想溶液:
a .在理想溶液中,各组分分子是如此相似,以致它们之间的相互作用情况完全一致;
b .当各组分分子混合时,不会产生热效应和体积变化。
所以拉乌尔定律的实质是理想溶液中分子的挥发和相应纯液体中的分子完全一样。
(4) 两种挥发性成分组成的溶液(two volatile components),其溶液上方的蒸气压(p T )
如果两种挥发性液体混合成一种溶液,例如C 6H 6 (benzene)和C 7H 8(toluene )的混合,没有热效应和体积变化,称为理想溶液,那么这两种液体以任何比例相混合,其溶液均服从拉乌尔定律。即 p 1 = x 1p 10 , p 2 = x 2 p 20
∴ 溶液上方的蒸气压 00
total 121122p p p x p x p =+=+
Sample Exercise 2:Such a solution, consider a mixture of benzene, C 6H 6 , and toluene , C 7H 8 , containing 1.0 mol of benzene and 2.0 mole of toluene (x ben = 0.33 and x tol = 0.67). At 20℃, the
vapor pressure of the pure substances are torr 750ben =p , .torr 220
o =l t p Calculate x ben in vapor.
Solution:
torr
257533.00
ben ben ben ??=?=p x p
torr
152267.00
tol tol tol ??=?=p x p
total ben tol 251540torr p p p =+=+= b e n 25
in vapor 0.631525
x =
=+
虽然苯在溶液中仅占33mol%,但在蒸气中占63mol %,所以易挥发的成份在蒸气中富积,成为蒸馏技术(distillation )的重要基础。
(5) 对于挥发性的固体非电解质溶质的溶液,其溶液上方的蒸气压p T
不饱和溶液时:00
T p x p x p =+质质剂剂
饱和溶液时:00T p p x p =+质剂剂
(即与溶质的摩尔分数无关) 思考题:请学生证明饱和的挥发性的固体非电解质溶质的溶液上方的蒸气压的公式。 2.溶液沸点的升高(Boiling point elevation of solution )
(1) 由于溶液的蒸气压低于纯溶剂的蒸气压。所以溶液的沸点要高于纯溶剂的沸点,即T b > T b 0,△T b = T b - T b 0
(2) 由于△p = K ·m 质,而与溶液的性质无关,所以,沸点升高的表达式为△T b =K b ·m , K b 为molar boiling point elevation constant 。在数值上恰好等于1m 溶液的沸点上升的度数,其单位为(℃)K · kg · mol -1。
(3) Application: a .已知?T b ,求K b
Sample Exercise :1.00g 尿素[CO(NH 2)2]溶解于75.0g 水中,测得其溶液的沸点为100.114℃,已知尿素的分子量为60.1,求水的K b 解: CO(NH 2)2的 1.00/60.1
0.22275/1000
m =
=(m )
?T b = 100.114 - 100 = 0.114℃,K b = 0.114 / 0.222 = 0.513(℃/m )
b .已知?T b ,求溶质的摩尔质量
3.溶液的凝固点的降低(Freezing point depression of solution )
(1) 由于液体的凝固点是指0p p =固液时的温度,而在此温度下,0
p p <溶液液体
, ∴ p 固 > p 溶液。因此只有当温度下降时,由于p 固下降得更快一点(从上图可以看出),才能实现p 固 = p 溶液,这时的温度才是溶液的凝固点T f ,由于T f <T f 0,所以溶液的凝固点要低于纯溶剂的凝固点。
(2) 同样由?p = K · m ,可以把凝固点降低表达式表示为:?T f = K f · m K f molar freezing-point depression constant. (3) Application
Sample Exercise 1: Automotive antifreeze consists of ethylene glycol , C 2H 6O 2, a nonvolatile nonelectrolyte. Calculate the freezing point of a 25.0 mass percent solution of ethylene glycol in water.
Solution: Molality =
25.0/62.1
5.37(m)75/1000
= ?T f = K f ·
m =1.86 × 5.37 = 9.99 ℃ ∴ 5.37m 乙二醇溶液的凝固点 = 0 - 9.99 = -9.99℃
Sample Exercise 2:Lauryl alcohol is obtained from coconut oil and is used to make detergents. A solution of 5.00g of lauryl alcohol in 0.100 kg of benzene freezes at 4.1℃. What is the molar mass of this substance?(K f = 5.12,T f 0 = 5.5℃ of benzene ) Solution: ?T f = 5.5 - 4.1 = 1.4℃, 由△T f = K f · m
得 5.00/5.12 1.40.1
M
?
=,解得 M = 182.9(g ·
mol -1) (4) 凝固点降低法测定分子量比沸点升高法测定分子量更准确。因为K f 数值大于K b ,
所以实验误差相对小一些;其次测凝固点时,可以减少溶剂的挥发。
(5) 对于电解质溶液,m 是指溶液中所有溶质含的离子的质量物质的量浓度。例如1m NaCl(aq) 中溶质的粒子浓度为2m 。
Sample exercise 3:3.24g Hg(NO 3)2和10.14g HgCl 2 分别溶解在1000g 水中,溶液的凝固点分别为 -0.0558℃和-0.0744℃,问哪种盐在水中以离子状态存在?(K f = 1.86)
Solution : Hg(NO 3)2 f f 0.588
0.0300m 1.86T m K ?===() 而
(3.24/324)mol
0.01m 1kg
=() ∴Hg(NO 3)2在水中以离子状态存在 HgCl 2:f f
0.07440.0400m 1.86
T m K ?==
=()
而
(10.84/271)mol
0.041m 1kg
=() ∴HgCl 2基本上以分子形式存在
Sample exercise 4:List following aqueous solutions in order of their expected freezing points :
0.050m CaCl 2、0.15m NaCl 、0.10m HCl 、0.050m CH 3COOH 、0.10m C 12H 22O 11 Solution :0.050m CaCl 2~0.15m in particles 0.15m NaCl ~0.30m 0.10m HCl ~0.20m 0.050m CH 3COOH ~0.05~0.10m 之间 ∴ freezing points ’ ordering is NaCl 、HCl 、CaCl 2、C 12H 12O 11、CH 3COOH
low high
4.渗透压(Osmotic pressure)
(1) 半透膜(semipermeable membrane)
a.材料:Certain materials, including many membranes in biological systems and synthetic substances such as cellophane, are semipermeable. Cu2[Fe(CN)6] 淀积在
素烧粗瓷筒的细孔内,也有半渗透性。
b.作用:They permit the passage of some molecules but not others. They often permit the passage of small solvent molecules such as water but block the passage
of large solute molecules or ions.
c.structure: Semipermeable membrane character is a network of tiny pores within the membrane.
(2) 渗透(osmosis):溶剂分子通过半透膜从稀溶液向浓溶液方向移动的现象,称为
渗透。
There is a net movement of solvent molecules from the less concentrated solution into the more concentrated one. This process is called osmosis.
The important point to remember is that the net movement of solvent is always toward the solution with the higher solute concentration.
(3) 实验(experiment)
图1 .18 a中,半透膜左边放入浓溶液,右边放入稀溶液;溶剂从右边移动到左边(就好像溶液要获得相等的浓度)。由于溶剂的净移动,产生了压力差,如图1 .18
b,它是由于渗透引起的,称为渗透压,表现为U型管两边的液面差;如果在U型管左边加一个压力,可以阻止溶剂分子的静移动,如图1 .19。
(4) 1887年van’t Ho ff(1852-1911)[ 范德霍夫,荷兰物理化学家,曾获1901年诺
贝尔化学奖 ] 研究溶液的渗透压,其结论为:溶质分散在一定体积的溶剂中的渗
透压和溶质扩散在等体积中的气体压力一样,即:πV = nRT or π = cRT (The osmotic pressure is found to obey a law similar in form to the ideal gas law) 注意:a.此公式只适用于非电解质稀溶液;b.在极稀溶液中,一升溶液近似看作1kg溶剂,所以π≈mRT;c.只有在半透膜存在下,才能表现出渗透
压;d.虽然稀溶液的π = cRT与气体的pV = nRT完全符合,但π与p产
生的原因是不同。
(5) Application
a.求分子量。渗透压常用于极高分子量的物质的测定。
Sample exercise 1:在250C、1升苯中含5.0克聚苯乙烯的溶液,其π = 7.6mmHg,试求聚苯乙烯的分子量?
Solution:π = 7.6 / 760 = 0.01(atm)
5.0
n
M
=,T= 298K
由π = c RT得5.0/
M
RT
V
π
=
∴
5.0 5.00.08206298
0.011
RT
M
V
π
??
==
?
= 1.22×104(g / mol)
故聚苯乙烯的分子量为1.22×104
b.配制等渗溶液(isotonic solution):渗透压相等的溶液,例如红血球的渗透压与0.9%的NaCl(aq)的渗透压相同。若把血液放入小于0.9%NaCl溶液中,水就
渗入红血球中,红血球溶涨,可使红血球破裂,称为溶血作用(hemolysis);
若把血液放入大于0.9%的NaCl溶液中,红血球中的水分就渗出,红血球缩小
(shrive),所以大量的静脉注射必须配制与血液相等的渗透压才能应用,否则会
引起严重的疾病。
Sample exercise 2:The average osmotic pressure of blood is 7.7 atm at 25℃. What concentration of glucose, C6H12O6, will be isotonic with blood?
Solation:由π = c RT得
7.7
0.31
0.08206298
c
RT
π
===
?
(mol / L)
c.可使海水淡化
5.稀溶液依数性的总结
(1)当难挥发性的非电解质溶解在溶剂中形成极稀溶液,它的蒸气压降低、沸点升
高、凝固点降低以及渗透压,与在一定量的溶剂或一定体积的溶液中所溶解的溶
质的摩尔数成正比,而与溶质的本质无关。我们把这种溶液在性质上变化的规律
性称为稀溶液的依数性(colligative properties)
(2)蒸气压降低、沸点升高和凝固点降低都是由x剂或m质来决定的,因此它们之间有
联系,蒸气压下降是核心。正是由于蒸气压的下降,引起了沸点升高和凝固点降低。
四、胶体溶液(Colloidal Solution)
1.胶体的定义:分散相粒子的直径在1~100nm范围内的均匀分散系。
2.胶态体系有8种(gas-gas 除外),我们研究固体分散在液体中的胶态体系-溶胶(sol-gel)。
3.溶胶制备(preparation):
(1) 凝聚法
a.物理凝聚法:
(i) 更换介质法:硫的洒精溶液倒入水中形成硫溶胶;
(ii) 蒸气凝聚法:在特制的反应器中,蒸发钠金属与有机化合物(苯),在蒸气相中形成钠溶胶(aerosol)。
b.化学凝聚法:
(i) 还原法制Au溶胶:2HAuCl4 + 3H2O2 2Au + 8HCl + 3O2
(ii) 氧化法制硫溶胶:2H2 3S + 2H2O
(iii) 分解法制镍溶胶:Ni(CO)4(苯中)+ 4CO
(iv) 水解法制Fe2O3水溶胶:2FeCl3 + (3 + x )H2O Fe2O3 ·x H2O + 6HCl
(2) 分散法:机械、电、超声波等分散,胶体磨分散。
4.溶胶的特性:
除了高分子溶液的溶胶外,溶胶的分散相与分散介质之间存在着明显的物理界面
(1) 丁铎尔效应(Tyndall’s effect):
溶胶粒子质点大,散射能力大,只要λ~d质点,就可发生散射。
(2) 电泳现象(Electrophoresis):
在电流的作用下,胶体粒子的定向移动。这说明溶胶粒子带同性电荷,如果电场中固相不动而液相流动,称为电渗析(Electro-osmosis)
正电荷胶体:Fe、Cd、Al、Cr、Pb、Ce、Th、Ti等氢氧化物溶胶
负电荷胶体:Au、Ag、Pt、S等溶胶,As2S3、Sb2S3、H2SiO3、锡酸等。
(3) 溶胶不稳定,放置一定时间,会沉淀出来,若再加入分散介质,不能再形成溶
胶,这是不可逆的。
(4) 高分子溶液是一个均匀体系,分散介质和分散相之间无界面,但分子直径
100nm-1nm之间,一般不带电荷,比溶胶稳定。高分子溶液的溶解是可逆的,
它具有稀溶液的依数性,也具有丁铎尔效应,但无电泳现象。
(5) 胶体分成两类:亲液胶体和疏液(憎液)胶体。前者指大分子溶液,是热力学
稳定体系;后者则属于热力学不稳定的非均相体系,主要靠动力学稳定性和界
面电荷维持体系的相对稳定,胶体化学主要研究后一类体系。
5.胶粒带同种电荷的原因
(1) Liepatoff’s rule(李伯托夫规则):胶粒总是选择性的吸附与它本身结构相似的离子。
(2) 实例:
a.SiO2溶胶:表面SiO2 + H2O H2SiO3SiO32- + 2H+,[SiO2]m胶粒吸附SiO32-,使硅胶带负电荷
b.Fe(OH)3胶体:FeCl3水解,生成Fe(OH)3,一部分Fe(OH)3与盐酸反应生成
FeOCl,FeOCl电离,生成FeO+和Cl-,胶粒[Fe(OH)3]m吸附FeO+而带正电荷c.KI(aq)和AgNO3(aq)反应,制备AgI溶胶:当AgNO3过量时,AgI溶胶吸附Ag+离子,带正电荷;若KI过量时;AgI溶胶吸附I-离子,带负电荷。
(3) 溶胶的胶团结构书写:
a.氢氧化铁溶胶:
{ [Fe(OH)3]m
n FeO
+
,(n x )Cl }x + x Cl
.
.
吸附层
扩散层胶粒
胶团
胶核
表面离子束缚反离子
自由反离子
b .硅胶溶液
胶粒
胶团
胶核
表面离子
束缚反离子
自由反离子
{ [SiO 2]m
n SiO 32 ,2(n x )H + }2x 2x H +..
6.溶胶的聚沉和保护方法 (1) 溶胶的聚沉(Coagulation )
a .加入电解质:(i) 反离子电荷数越高,聚沉越快(
Al 3+>Mg 2+>Na +
),v ∝
(离子电荷数)6;(ii) 反离子的水合半径越小,越易聚沉;(iii) 反离子越易吸附,越易聚沉;b .加入相反电荷的溶胶;c .升高温度。
(2) 溶胶的保护:加入适当的高分子溶胶,但量太少会发生敏化作用,反而起不到保
护作用。
第一章 气体的pVT 性质——习题 一、填空题 1.温度为400K ,体积为2m 3的容器中装有2mol 的理想气体A 和8mol 的理想气体B ,则该混合气体中B 的分压力p B =( )KPa 。13.302 V RT n p /B B ==(8×8.314×400/2)Pa =13.302 kPa 或()[]B B A B B /y V RT n n py p +== (){}kPa 13.3020.8Pa 2/400314.828=???+= 2.在300K ,100KPa 下,某理想气体的密度ρ=80.8275×10-3kg ·m -3。则该气体的摩尔质 量M=( )。1-3m o l kg 10016.2??- ()()RT M V RT M m nRT pV //ρ=== ()Pa 10100/K 300K mol J 314.8m kg 10827.80/31-1-3-3-???????==p RT M ρ 1-3mol kg 10016.2??=- 3.恒温100°C 下,在一带有活塞的气缸中装有3.5mol 的水蒸气H 2O (g ),当缓慢地压缩到压力p=( )KPa 是才可能有水滴H 2O (l )出现。101.325 因为100℃时水的饱和蒸汽压为101.325kPa ,故当压缩至p=101.325kPa 时才会有水滴H 2O (l )出现。 4.恒温下的理想气体,其摩尔体积随压力的变化率T m p V ???? ???? =( )。2/-p RT 理想气体满足理想气体状态方程RT pV =m 所以 ()0/m m =+??V p V p T ,即()2m m ///p RT p V p V T -=-=?? 5,一定的范德华气体,在恒容条件下,其压力随温度的变化率()=??V T /p . ()nb V nR -/ 将范德华状态方程改写为如下形式: 2 2 V an nb V nRT p --=所以()()nb V nR T p V -=??// 6.理想气体的微观特征是:( )理想气体的分子间无作用力,分子本身不占有体积
第一章 气体、液体和溶液
1.1 1.2 1.3 1.4 1.5 1.6 1.7 气体的概念与相关性质 理想气体及相关定律 实际气体和van der Waals方程 液体 溶液、溶解度 稀溶液的依数性 胶体溶液
物质的三种聚集状态
水的三态变化
1.1 气体的概念与相关性质
气体的压力
分子的运动与气体的压力
1643年E. Torriceli的实验
气体的一般性质
气体的扩散 气体的压缩性 气体的热胀冷缩 气体的液化
因扩散气体的混合
1.2
1.2.1
理想气体及相关定律
理想气体的概念及理想气体状态方程
理想气体的概念:温度不太低,压力不太高的稀薄气体。 两点基本假设: (1) 分子间距离很远,相互作用力可忽略不计; (2) 分子自身的体积很小,与气体所占体积相比,可忽略不计。 显然,理想气体并不存在。但当气压趋近于零时,可无限接近理想气体。 理想气体状态方程 (The Ideal Gas Law):
pV = nRT
式中 p:压力 (压强,Pa或kPa); V:体积(dm3或cm3) n:气态物质的量 (摩尔,mol); R:摩尔气体常数,或叫普适气体恒量
The Gas Constant R
R= PV = 0.082057 L atm mol-1 K-1 nT = 8.3149 m3 Pa mol-1 K-1 = 8.3149 J mol-1 K-1
相关单位换算: 1 Pa = 1 N?m-2 1 bar = 1×105 Pa = 100 kPa 1 atm = 760 mmHg = 1.01325×105 Pa ≈ 101 kPa ≈ 0.1 MPa 1 kPa?dm3 = 1 J = 0.239 cal 1 cal = 4.184 J
第三章 理想气体的性质 一、目的及要求: 了解理解气体的特点及性质,掌握理想气体比热容、热力学能、焓,熵等量的计算方法。了解混合理想气体的性质及热力学参数的计算。二、内容: 3.1 理想气体的概念及其状态方程式 3.2 理想气体的比热、热力学能、焓及熵 3.3 理想气体的混合物 三、重点及难点: 3.1 熟练掌握并正确应用理想气体状态方程式。 正确理解理想气体比热容的概念;熟练掌握和正确应用定值比热容、平均比热容来计算 过程热量,以及计算理想气体热力学能、焓和熵的变化。四、主要外语词汇: ideal gas, real gas,the heat capacity, properties, Dalton’s law of partial pressure , 五、本章节采用多媒体课件 六、复习思考题及作业: 思考题: 1、何谓理想气体和实际气体?火电厂的工质水蒸气可视为理想气体吗? 2、气体常数和通用气体常数有何区别和联系? 3、气体常数Rg 与气体种类是否有关?与状态呢? 4、理想气体的cp -cv =,与气体状态关? 5、容器内盛有一定状态的理想气体,如将气体放出一部分后重新又达到新的平衡状态, 6、放气前后两个平衡状态之间可否表示为下列形式: (a) 112212p v p v T T = (b) 112212 p V p V T T = 作业: 3-3,3-4,3-6,3-9,3-10,3-14,3-18 第三章 理想气体的性质 §3-1 理想气体的概念
理想气体是一种实际不存在的假象气体,其两点假设为: ① 分子是些弹性的、不具体积的质点。 ②分子间相互没有作用力。 在这两点假设条件下,气体分子的运动规律极大的简化了,分子两次碰撞之间为直线运动,且弹性碰撞无动能损失。对此简化了的物理模型,不但可定性地分析气体某些热力现象,而且可定量的导出状态参数间存在的简单函数关系。那么,由哪些气体可看成是理想气体呢? 众所周知,高温、低压的气体密度小、比体积大,若大到分子本身体积远小于其活动空间,分子间平均距离远到作用力极其微弱的状态就很接近理想气体。因此,理想气体是气体压力趋近于零(0→p )、比体积趋近于无穷大(∞→v )时的极限状态。工程中常用的氧气、氮气、氢气、一氧化碳等及其混和空气、燃气、烟气等工质,在通常使用的温度、压力下都可作为理想气体处理,误差一般都在工程计算允许的精度范围之内。如空气在室温下、压力达10MPa 时,按理想气体状态方程计算的比体积误差在1%左右。不符合上述两点假设的气态物质称为实际气体。蒸汽动力装置中采用的工质水蒸气,制冷装置的工质氟里昂蒸汽、氨蒸汽等,这类物质的临界温度较高,蒸汽在通常的工作温度和压力下离液态不远,不能看作理想气体。通常,蒸汽的比体积较气体小得多,分子本身体积不容忽略,分子间的内聚力随距离减小急剧增大。因而,实际气体运动规律极其复杂,宏观上反映为状态参数的函数关系式复杂,热工计算种需要借助于计算机或利用为各种蒸汽专门编制的图或表。实际气体的性质将在第六章中讨论。而对于大气中含有的少量水蒸气,燃气和烟气中含有的水蒸气和二氧化碳等,因分子浓度低,分压力甚小,在这些混合物的温度不太低时仍可视作为理想气体。**注:当工质温度超过临界温度后,即使压力再高,工质也不存在液相。 对于理想气体而言,其热力学能u 和焓h 只是温度的函数,原因如下: 由于理想气体分子间不具作用力,因此不存在内位能,只存在取决于温度的内动能,因而与体积v 无关,u 只是温度T 的单值函数,即:u = u ( T )。又因为h = u + pv ,
第三单元固体和液体单元分析本单元是依据物质世界板块中关于“物体的特征”等具体内容标准建构的,意在指导学生利用多种方法认识固体和液体,培养学生的观察能力,并使学生在现阶段完成对固体和液体的认识,初步掌握“要想全面认识一个事物,就需要用多种多样的方法”的研究思路。 本单元教学内容涉及《科学(3~6年级)课程标准》中的具体内容标准有: 一、科学探究: 1、知道在科学探究中问题的解决或结论的得出据为基础,证据的收集可以有观察、实验等多种方法。 2、收集证据 (1)能针对问题,通过观察、实验等方法收集证据。 (2)尊重事实,对收集到的证据能做好原始记录,并注意保留且不随便涂改原始数据。 (3)能对收集到的证据用文字、图表等方式来呈现。 3、分析与解释能对收集到的证据进行比较、分类。 4、交流与质疑能条理清晰地陈述自己的观点,并为自己的观点辩护,阐明自己观点的合理性。 5、结论与拓展 (1)能对探究的问题做出初步的结论。 (2)能把探究过程中习得的知识、过程与方法运用于新的情境中。 二、科学知识: 1、能用感官判断物体的特征,如大小、轻重、形状、颜色、冷热、沉浮等,并加以描述。 2、能根据特征对物体进行简单分类或排序。 3、会使用简单仪器(如尺、天平、温度计)测量物体的常见特征(长度、质量、温度),能设计简单的二维记录表格,做简单的定量记录,并能使用适当的单位。在此基础上,其他物体进行估量。意识到多次测量能够提高测量的准确性。 三、情感、态度与价值观: 1、在学习和解决问题中注重证据。 2、愿意合作与交流。 3、认识到科学技术是不断发展的。 4、喜欢用学到的科学知识解决生活中的问题,改善生活。 通常情况下,物质有三种主要存在形式:固态、气态、液态,物质在不同形态下表现出不同的特征。本单元在这一背景下引领学生利用多种方法认识固体和液体,诸如轻重、软硬、形状、颜色、沉浮、溶解等方面的一些特点。由于本单元没有涉及分子或原子的概念,没有提及密度,因此对于固体和液体的沉浮与溶
第一章气体的pVT性质 1.1物质的体膨胀系数与等温压缩率的定义如下 试推出理想气体的,与压力、温度的关系。 解:根据理想气体方程 1.5两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。若将其中的一个球加热到100 ?C,另一个球则维持0 ?C,忽略连接细管中气体体积,试求该容器内空气的压力。 解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。 标准状态: 因此, 1.9 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。 (1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。 (2)隔板抽取前后,H2及N2的摩尔体积是否相同?
(3)隔板抽取后,混合气体中H2及N2的分压立之比以及它们的分体积各为若干? 解:(1)等温混合后 即在上述条件下混合,系统的压力认为。 (2)混合气体中某组分的摩尔体积怎样定义? (3)根据分体积的定义 对于分压 1.11 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。重复三次。求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。 解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。设第 一次充氮气前,系统中氧的摩尔分数为,充氮气后,系统中氧的摩尔分数 为,则,。重复上面的过程,第n次充氮气后,系统的摩尔分数为 , 因此 1.13 今有0 C,40.530 kPa的N2气体,分别用理想气体状态方程及van der Waals 方程计算其摩尔体积。实验值为。 解:用理想气体状态方程计算 用van der Waals计算,查表得知,对于N2气(附录七) ,用MatLab fzero函数求得该方程的解为 也可以用直接迭代法,,取初值 ,迭代十次结果
第一章 气体、液体和溶液的性质 §1-1 气体的性质 本节的重点是三个定律: 1.道尔顿分压定律(Dalton’s law of partial pressures ) 2.阿码加分体积定律(Amagat’s law of partial volumes ) 3.格拉罕姆气体扩散定律(Graham’s law of diffusion ) 一、理想气体(Ideal Gases )――讨论气体性质时非常有用的概念 1.什么样的气体称为理想气体? 气体分子间的作用力很微弱,一般可以忽略; 气体分子本身所占的体积远小于气体的体积。 即气体分子之间作用力可以忽略,分子本身的大小可以忽略的气体,称为理想气体。 2.理想气体是一个抽象的概念,它实际上不存在,但此概念反映了实际气体在一定条件下的最一般的性质。 3.实际气体在什么情况下看作理想气体呢? 只有在温度高和压力无限低时,实际气体才接近于理想气体。因为在此条件下,分子间距离大大增加,平均来看作用力趋向于零,分子所占的体积也可以忽略。 二、理想气体定律(The Ideal Gas Law ) 1.由来 (1) Boyle’s law (1627-1691)British physicist and chemist - The pressure-volume relationship n 、T 不变 , V ∝ 1/ p or pV = constant (2) Charles’s law (1746-1823)French scientist 1787年发现-The temperature-volume relationship n 、p 不变 , V ∝ T or V /T = constant (3) Avogadro’s law (1778-1823)Italian physicist Avogadro’s hypothesis :Equal volumes of gases at the same temperature and pressure contain equal numbers of molecular. Avogadro’s law The volume of a gas maintained at constant temperature and pressure is directly proportional to the number of moles of the gas. T 、p 不变 , V ∝ n 2.理想气体方程式(The ideal-gas equation ) 由上三式得:V ∝ nT / p ,即pV ∝ nT ,引入比例常数R ,得:pV = nRT pV = nRT R---- 摩尔气体常量 在STP 下,p =101.325kPa, T =273.15K n =1.0 mol 时, V m =22.414L=22.414×10-3m 3 R =8.314 kPa ?L ?K -1?mol -1 nT pV R =K 15.2731.0mol m 1022.414Pa 1013253 3???=-1 1K mol J 314.8--??=
十、固体和液体的性质 水平预测 (45分钟) 双基型 ★1.晶体的各向异性指的是晶体( ). (A)仅机械强度与取向有关(B)仅导热性能与取向有关 (C)仅导电性能与取向有关(D)各种物理性质都与取向有关 答案:D(提示:由晶体的各向异性的定义得出结论) ★★2.如图(a)所示,金属框架的A、B间系一个棉线圈,先使布满肥皂膜,然后将P和Q 两部分肥皂膜刺破后,线的形状将如图(b)中的( ). 答案:C(提示:液体的表面张力作用,液体表面有收缩的趋势) 纵向型 ★★3.有一些小昆虫可以在水面上停留或能跑来跑去而不会沉入水中,这是由于昆虫受到向上的力跟重力平衡,这向上的力主要是( ). (A)弹力(B)表面张力 (C)弹力和表面张力(D)浮力和表面张力 答案:B(提示:由于液体的表面张力作用使液体的表面像张紧的橡皮膜,小昆虫受到表面张力) ★★★4.为什么铺砖的地面容易返潮? 答案:毛细现象.土地、砖块 横向型 ★★★★5.关于液体表面张力的正确理解是( ). (A)表面张力是由于液体表面发生形变引起的 (B)表面张力是由于液体表面层内分子间引力大于斥力所引起的 (C)表面张力是由于液体表面层内分子单纯具有一种引力所引起的 (D)表面张力就其本质米说也是万有引力 答案:B(提示:液体表面层里的分子比液体内部稀疏,就是分子间的距离比液体内部大些,那么分子间的引力大于分子斥力,分子间的相互作用表现为引力) ★★★★★6.水和油边界的表面张力系数为σ=1.8×10-2N/m,为了使1.0×103kg的油在水内散成半径为r=10-6m的小油滴,若油的密度为900kg/m3,问至少做多少功? 答案:6×103J.开始时的油滴看成半径为R的球:V=m/ρ=4πR3/3,油分散时总体积不变,设有n滴小油滴,每个小油滴的半径为r,V=/ρ=n4πR3/3,n=1×103/12油滴的表面积变化△S 为:△S=n4πr2-4πR2,油滴分散时,表面能的增量与外力做功的值相等:W=σ△S=6×10-2J
中学化学常见气体性质归纳 1、有色气体:F2(淡黄绿色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(g)(紫红色)、NO2(红棕色)、O3(淡蓝色),其余均为无色气体。 2、有刺激性气味的气体:HF、HCl、HBr、HI、NH 3、SO2、NO2、F2、Cl2、Br2(g);有臭鸡蛋气味的气体:H2S。 3、极易溶于水能做喷泉实验的气体:NH3、HF、HCl、HBr、HI;能溶于水的气体:CO2、SO2、Cl2、Br2(g)、H2S、NO2。 4、易液化的气体:NH3、SO2、Cl2 。 5、有毒的气体:F2、HF、Cl2、H2S、SO2、CO、NO2、NO、Br2(g)。 6、在空气中易形成白雾的气体:NH3、HF、HCl、HBr、HI。 7、常温下不能共存的气体:H2S和SO2、H2S和Cl2、HI和Cl2、NH3和HCl、NO和O2、F2和H2。 8、其水溶液呈酸性的气体:HF、HCl、HBr、HI、H2S、SO2、CO2、NO2、Br2(g)。可使湿润的红色石蕊试纸变蓝的气体:NH3。 9、有漂白作用的气体:Cl2(有水时)和SO2,但两者同时使用时漂白效果减弱。检验Cl2常用Cl2能使湿润的紫色石蕊试纸先变红后褪色。 10、能使澄清石灰水变浑浊的气体:CO2和SO2,但通入过量气体时沉淀又消失。 11、在空气中可以燃烧的气体:H2、CO、CH4、C2H4、C2H2、H2S。在空气中燃烧火焰呈蓝色(或淡蓝色)的气体:H2S、H2、CO、CH4。 12、具有强氧化性的气体:F2、Cl2、Br2(g)、NO2、O2、O3;具有强或较强还原性的气体:H2S、H2、CO、NH3、HI、HBr、HCl、NO;SO2和N2既具有氧化性又具有还原性。 13、与水可反应的气体:Cl2、F2、NO2、Br2(g)、CO2、SO2、NH3;其中Cl2、NO2、Br2(g)与水的反应属于氧化还原反应(而且都是歧化反应),只有F2与水剧烈反应产生O2。 14、能使湿润的淀粉碘化钾试纸变蓝的气体:Cl2、NO2、Br2(g)、O3。 15、能使溴水和酸性高锰酸钾溶液褪色的气体:H2S、SO2、C2H4、C2H2。 16、可导致酸雨的主要气体:SO2; 导致光化学烟雾的主要气体:NO2等氮氧化物和烃类; 导致臭氧空洞的主要气体:氟氯烃(俗称氟利昂)和NO等氮氧化物; 导致温室效应的主要气体:CO2和CH4等烃; 能与血红蛋白结合导致人体缺氧的气体是:CO和NO。 17、可用作致冷剂或冷冻剂的气体:CO2、NH3、N2。 18、用作大棚植物气肥的气体:CO2。 19、被称做地球保护伞的气体:O3。 20、用做自来水消毒的气体:Cl2 物质的学名、俗名及化学式 (1) 生石灰、氧化钙:CaO (2)熟石灰(或消石灰):Ca(OH)2 (3)食盐:NaCl (4)干冰:CO2 (5)纯碱:Na2CO3 (6)烧碱(或苛性钠,火碱):NaOH (7)胆矾(蓝矾、硫酸铜晶体):CuSO4·5H2O (8) 明矾:KAl(SO4) 2·12H2O (9)CaCO3碳酸钙(石灰石、大理石) (10) NaHCO3碳酸氢钠(小苏打) (11)石碱(碳酸钠晶体、纯碱晶体):Na2CO3·10H2O (12)碱式碳酸铜(铜绿、孔雀石):
第十章 固体和液体的性质 检测题(45分钟) 基本知识和基本技能 *1.晶体的各向异性指的是晶体( )。 (A )仅机械强度与取向有关 (B )仅导热性能与取向有关 (C )仅导电性能与取向有关 (D )各种物理性质都与取向有关 **2.如图10-1所示,金属框架的A 、B 间系一个棉线圈,先使布满肥皂膜,然后将P 和Q 两部分肥皂膜刺破后,线的形状将如下列哪一个图所示( )。 知识的应用 **3.有一些小昆虫可以在水面上停留或能跑来跑去,而不会沉入水中,这是由于昆虫受到向上的力跟重力平衡,这向上的力主要是( )。 (A ) 弹力 (B )表面张力 (C )弹力和表面张力 (D )浮力和表面张力 ***4.为什么铺砖的地面容易返潮? 知识的拓展 ****5.关于液体表面张力的正确理解( )。 (A )表面张力是由于液体表面发生形变引起的 (B )表面张力是由于液体表面层内分子间引力大于斥力所引起的 (C )表面张力是由于液体表面层内分子单纯具有一种引力所引起的 (D )表面张力就是本质上来说也是万有引力 *****6.水和油边界的表面张力系数为211.810N m σ--=??,为了使3 1.010kg -?的油在水内散成半径为610m r -=的小油滴,若油的密度为3 900kg m -?,问至少做功多少? 固体 基本知识和基本技能 *1.下列固体哪一组全是由晶体组成的( )。[1] (A )石英、云母、明矾、食盐、雪花、铜 (B )石英、玻璃、云母、铜 图10-1
**2.某物体表现出各向异性是由于组成物体的物质微粒()。[1] (A)在空间的排列不规则(B)在空间按一定规则排列 (C)数目较多的缘故(D)数目较少的缘故 **3.晶体和非晶体的区别在于看其是否具有()。[1] (A)规则的外形(B)各向异性 (C)一定的熔点(D)一定的硬度 **4.如果某个固体在不同方向上的物理性质是相同的,那么()。[1] (A)它一定是晶体(B)它一定是多晶体 (C)它一定是非晶体(D)它不一定是非晶体 ***5.物体导电性和导热性具有各向异性的特征,可作为()。[1] (A)晶体和非晶体的区别(B)单晶体和多晶体的区别 (C)电的良导体和电的不良导体的区别(D)热的良导体和热的不良导体的区别***6.下列关于晶体和非晶体性质的说法,哪些是正确的()。[2] (A)凡是晶体,其物理性质一定表现为各向异性 (B)凡是非晶体,其物理性质一定表现为各向同性 (C)物理性质表现了各向异性的物体,一定是晶体 (D)物理性质表现了各向同性的物体,一定是非晶体 知识的应用 ***7.从物体的外形来判断是否是晶体,下列叙述正确的是()。[2] (A)玻璃块具有规则的几何外形,所以它是晶体 (B)没有确定熔点的物体,一定不是晶体 (C)敲打一块石英后,使它失去了天然面,没有规则的外形了,但它仍是晶体 (D)晶体自然生成的对应表面之间夹角一定 ***8.如图10-2所示,在地球上,较小的水银滴呈球形,较大的水银滴因所受重力的影响不能忽略而呈扁平形状,那么在处于失重状态的宇宙飞船中,一大滴水银会呈什么形状?为什么? [4] 图10-2 ****9.在样本薄片上匀均地涂上一层石蜡,然后用灼热的金属针尖点在样本的另一侧面,结果得到如图10-3所示的两处图样,则()。[2] (A)样本A一定是非晶体 (B)样本A可能是非晶体 (C)样本B一定是晶体 (D)样本B不一定是晶体 图10-3 ****10.要想把凝在衣料上的蜡去掉,可以把两层吸墨纸分别放在蜡迹的上面和下面,然后用热熨斗在吸墨纸上来回熨,为什么这样做可以去掉衣料上的蜡?[3]
固体和液体 §3.1 固体的有关性质 固体可以分为晶体和非晶体两大类。岩盐、水晶、明矾、云母、冰、金属等都是晶体;玻璃、沥清、橡胶、塑料等都是非晶体。 (1)晶体和非晶体 晶体又要分为单晶体和多晶体两种。单晶体具有天然规则的几何外形,如雪花的形状总是六角形的。并且,单晶体在各个不同的方向上具有不同的物理性质,即各向导性。如力学性质(硬度、弹性模量等)、热性性质(热胀系数、导热系数等)、电学性质(介电常数、电阻率等)、光学性质(吸收系数、折射率等)。如云母结晶薄片,在外力作用下很容易沿平行于薄片的平面裂开,但在薄片上裂开则要困难得多;在云母片上涂一层薄薄的石蜡,然后用烧热的钢针去接触云母片的反面,则石蜡将以接触点为中心、逐渐向四周熔化,熔化了的石蜡成椭圆形,如果用玻璃片做同样的实验,熔化了的石蜡成圆形,这说明非晶体玻璃在各方向的导热系数相同,而晶体云母沿各方向的导热系数不同。 因多晶体是由大量粒(小晶体)无规则地排列组合而成,所以,多晶体不但没有规则的外形,而且各方向的物理性质也各向同性。常见的各种金属材料就是多晶体。 但不论是单晶体还是多晶体,都具有确定的熔点,例如不同的金属存在着不同的熔点。 非晶体没有天然规则的几何外形,各个方向的物理性质也相同,即各向同性。非晶体在加热时,先逐渐变软,接着由稠变稀,最后成为液体,因此,非晶体没有一定的熔点。晶体在加热时,温度升高到熔点,晶体开始逐渐熔解直到全部融化,温度保持不变,其后温度才继续上升。因此,晶体有一定的熔点。 (2)空间点阵 晶体与非晶体性质的诸多不同,是由于晶体内部的物质微粒(分 子、原子或离子)依照一定的规律在空间中排列成整齐的后列,构成所 谓的空间点阵的结果。 图3-1-1是食盐的空间点阵示意图,在相互垂直的三个空间方向 上,每一行都相间的排列着正离子(钠离子)和负离子(氯离子)。 晶体外观的天然规则形状和各向异性特点都可以用物质微粒的规 则来排列来解释。在图3-1-2中表示在一个平面上晶体物质微粒的排 列情况。从图上可以看出,沿不同方向所画的等长直线AB、AC、AD 上,物质微粒的数目不同,直线AB上物质微粒较多, 直线AD上较少,直线AC上更少。正因为在不同方向 上物质微粒排列情况不同,才引起晶体在不同方向上物 理性质的不同。 组成晶体的粒子之所以能在空间构成稳定、周期性 的空间点阵,是由于晶体微粒之间存在着很强的相互作 用力,晶体中粒子的热运动不能破坏粒子之间的结合, 粒子仅能在其平衡位置(结点处)附近做微小的热振动。晶体熔解过程中达熔点时,它吸收的热量都用来克服有规则排列的空间点阵结构,所以,这段时间内温度就不会升高。 例题:NaCl的单位晶胞是棱长a=5.6?1010-m的立方体,如图7-1-3。黑点表示Na+位置,圆圈表示Cl-位置,食盐的整体就是由这些单位晶胞重复而得到 的。Na原子量23,Cl原子量35.5,食盐密度 3 10 22 .2? = ρg/m3。 我们来确定氢原子的质量。 在一个单位晶胞里,中心有一个Na+,还有12个Na+ 位于大立 图3-1-1 A 图3-1-2 图3-1-3
一、填空题 1.温度为400K ,体积为2m 3的容器中装有2mol 的理想气体A 和8mol 的理想气体B ,则该混合气体中B 的分 压力p B =( )KPa 。13.302 2.在300K ,100KPa 下,某理想气体的密度ρ=80.8275×10-3kg ·m -3。则该气体的摩尔质量M=( )。 3.恒温100°C 下,在一带有活塞的气缸中装有3.5mol 的水蒸气H 2O (g ),当缓慢地压缩到压力p=( )KPa 是才可能有水滴H 2O (l )出现。 4.恒温下的理想气体,其摩尔体积随压力的变化率T m p V ???? ???? =( )。 5,一定的范德华气体,在恒容条件下,其压力随温度的变化率()=??V T /p . 6.理想气体的微观特征是:( ) 7. 在临界状态下,任何真实气体的宏观特征为:( ) 8. 在n,T 在一定的条件下,任何种类的气体当压力趋近于零时均满足:()=→pV p lim 0 ( ). 9.实际气体的压缩因子定义为Z=( )。当实际气体的Z>1时,说明该气体比理想气体( ) 三、问答题 理想气体模型的基本假设是什么?什么情况下真实气体和理想气体性质接近?增加压力真实气体就可以液化,这种说法对吗,为什么? 第二章 热力学第一定律――附答案 一、填空题 1. 理想气体向真空膨胀过程 , 下列变量 中等于零的有 : 。 2. 双原子理想气体经加热内能变化为 ,则其焓变为 。 3. 在以绝热箱中置一绝热隔板,将向分成两部分,分别装有温度,压力都不同的两种气体,将隔板抽走室气 体混合,若以气体为系统,则此过程 。 4. 绝热刚壁容器内发生CH 4+2O 2=CO 2+2H 2O 的燃烧反应,系统的 Q ___ 0 ; W ___ 0 ;?U ___ 0;?H ___ 0 5. 某循环过程 Q = 5 kJ, 则 ?U + 2W + 3 ?(pV) = __________. 6. 298K 时, S 的标准燃烧焓为-296.8 kJ ?mol -1, 298K 时反应的标准摩尔反应焓 ?r H m = ________ kJ ?mol -1 . 7. 已知 的 , 则 的 。 8. 某均相化学反应 在恒压,绝热非体积功为零的条件下进行,系统的温度由 升高到 则此 过程的 ;如果此反应是在恒温,恒压,不作非体积功的条件下进行,则 。 9. 25 ℃ 的液体苯在弹式量热计中完全燃烧 , 放热 则反应 的 。 10.系统的宏观性质可以分为( ),凡与系统物质的量成正比的物理量皆称为( )。 11.在300K 的常压下,2mol 的某固体物质完全升华过程的体积功W=( ) 12.某化学反应:A(l)+0.5B(g)-- C(g) 在500K 恒容条件下进行,反应进度为1mol 时放热10KJ,若反应在同样温度恒压条件下进行,反应进度为1mol 时放热( )。
第1章气体、溶液和胶体 练习题 一、选择题 1.用来描述气体状态的四个物理量分别是(用符号表示)() A. n,V,p,T B. n,R,p,V C. n,V,R,T D. n,R,T,p 2.现有两溶液:A为mol·kg-1氯化钠溶液;B为mol·kg-1氯化镁溶液() A. A比B沸点高 B. B比A凝固点高 C. A比B沸点低 D. A和B沸点和凝固点相等 3.稀溶液在蒸发过程中() A.沸点保持不变 B.沸点不断升高直至溶液达到饱和 ' C.凝固点保持不变 D.凝固点不断升高直至溶液达到饱和 4.与纯液体的饱和蒸汽压有关的是() A. 容器大小 B. 温度高低 C. 液体多少 D. 不确定 5.质量摩尔浓度是指在() 溶液中含有溶质的物质的量 B. 1kg溶剂中含有溶质的物质的量 C. 溶剂中含有溶质的物质的量溶液中含有溶质的物质的量 6.在质量摩尔浓度为·kg-1的水溶液中,溶质的摩尔分数为() B. C. D. 7.下列有关稀溶液依数性的叙述中,不正确的是() A. 是指溶液的蒸气压下降、沸点升高、凝固点降低和渗透压 > B. 稀溶液定律只适用于难挥发非电解质的稀溶液 C. 稀溶液依数性与溶液中溶质的颗粒数目有关 D. 稀溶液依数性与溶质的本性有关 8.质量摩尔浓度均为mol·kg-1的NaCl溶液,H2SO4溶液,HAc溶液,C6H1206(葡萄糖)溶液,蒸气压最高的是() A. NaCl溶液 B. H2SO4溶液 C. HAc溶液 D. C6 H1206溶液 9.糖水的凝固点() A.等于0℃ B. 低于0℃ C. 高于0℃ D.无法判断
10.在总压力100kPa的混合气体中,H2、He、N2、CO2的质量都是,其中分压最小的是() A. H2 B. He C. N2 D. CO2 二、填空题 》 1.理想气体状态方程的表达式为。 2.按分散质颗粒直径大小,可将分散系分为,,。 3.·kg-1的KCl溶液,K2SO4溶液,HAc溶液,C6H1206溶液的渗透压由低到高的顺序为,凝固点由高到低的顺序。 4.稀溶液的依数性分别是、、和,其核心性质是。 5.已知水的K f为·kg·mol-1,要使乙二醇(C2H6O2)水溶液的凝固点为-10℃,需向100g水中加入g乙二醇。 6.将相同浓度的30mLKI和20mLAgNO3溶液混合制备AgI溶胶,其胶团结构为,进行电泳时,胶粒向极移动。 三、判断题 1.()液体的蒸汽压随温度的升高而升高。 2.()液体的正常沸点就是其蒸发和凝聚速率相等时的温度。 3.()将100gNaCl和100gKCl溶于等量水中,所得溶液中NaCl和KCl的摩尔分数都是。4.()b B相等的两难挥发非电解质稀溶液,溶剂相同时凝固点就相同。 5.()“浓肥烧死苗”的现象与溶液依数性中的渗透压有关。 、 6.()两种溶液的浓度相等时,其沸点也相等。 四、计算题 1.混合气体中含96gO2和130g N2,其总压力为120kPa,其中N2的分压是多少2.将(20℃,120KPa)氨气溶于水并稀释到250mL,求此溶液的物质的量浓度。3.某物质水溶液凝固点是℃,估算此水溶液在0℃时的渗透压。 4.取血红素溶于水配成100mL溶液,测得此溶液在20℃时的渗透压为336Pa 。
6.《固体、液体和气体》教案 教学目标 一、知识与技能 1.能分别说出固体、液体和气体的特点。 2.能说出同种物质的不同状态的各个特点的差异。 3.能分别举例说出固体、液体和气体在生产、生活中的用途。 二、过程与方法 1.能正确地对周围常见的物体或物质进行分类。 2.能够利用感官估测物体的质量或体积。 3.能正确使用适当的工具测量某一种物体的质量或体积。 4.能归纳出固体、液体和气体的主要特点。 三、情感态度与价值观 1.能设计两种以上的方法测量出不规则形状物体的体积。 2.对探究物质三态的问题产生浓厚的兴趣。 3.能将本组研究结果与其他小组交流。 教学重点 指导学生通过观察、实验、比较、分类等多种方法探究三种常见物质状态的特性。 教学难点 指导学生通过观察、实验、比较、分类等多种方法探究三种常见物质状态的特性。 教学准备 常见物体的图片、纸、木块、棉球、橡皮、硬塑料、小米、豆、沙、天平、放大镜、记录表、烧杯、水槽、量筒、酒、果汁、牛奶、蜂蜜、酱油、汽水、水、注射器、水杯、乒乓球、橡皮泥。 教学过程 (一)导入新课: 师:今天我们来玩一个闯关游戏,闯过一关发一个通行证,闯过四关将获得智慧小组荣誉称号。你们有信心吗? 师:(出示百宝箱)这是百宝箱,里面有许多物体,你们能不能对他们进行分类,粘贴在响应的圈内。(画在黑板上三个圈) 学生分类开始,教师进行简单的评议,并对优胜者颁发通行证。 (二)学习新课:
1.活动1:研究固体的主要性质。 (1)师:第二关是为什么你们认为这些是固体呢?它有哪些性质?如果研究过程中有困难可以看一下老师发给大家的建议卡和记录表。 (2)学生研究,教师指导学生使用天平。 (3)学生汇报研究结果,教师学生进行评议,颁发通行证。 (4)教师小结:固体有固定的形状和体积,不易流动,不易被压缩。 (5)师:第三关是把小米、豆、沙或木屑混合后,你们怎么能把他们分里出来,看哪个小组的方法多? (6)学生讨论,操作,汇报。 (7)教师评议,颁发通行证。 2.活动2:研究液体的主要性质。 (1)师:第四关是为什么你们认为这些是液体呢?它有哪些性质?如果研究过程中有困难可以看一下老师发给大家的建议卡和记录表。 (2)学生研究,教师指导学生怎样测量液体的体积和质量。 (3)学生汇报研究结果,教师学生进行评议,颁发通行证。 (4)教师小结:液体有固定体积,没有固定的形状,易流动,不易被压缩。 (5)师:第五关是把不同液体混合后,会出现什么现象? (6)学生讨论,操作,汇报。 (7)教师评议,颁发通行证。 3.活动3:比较固体、液体和气体的性质。 (1)师:第六关是固体、液体和气体之间有什么相同点和不同点? (2)学生实验探究,教师进行指导。 (3)学生汇报,抓住“怎样区别固体、液体和气体”这个问题进行讨论。 (4)教师进行评议,办法通行证。 (三)巩固拓展: 1.你们小组都闯过了哪几关?了解了哪些知识? 2.老师还有一关,怎样测量石块的体积? 3.颁发智慧小组证书,祝贺他们闯关成功。 教学反思
第一章气体、液体和溶液的性质Chapter 1The Behaviors of Gas、Liquid and Solution §1-1 气体的性质 The Properties of Gases 本节的重点是三个定律: 1.道尔顿分压定律(Dalton’s law of partial pressures) 2.阿码加分体积定律(Amagat’s law of partial volumes) 3.格拉罕姆气体扩散定律(Graham’s law o f diffusion) 一、理想气体(Ideal Gases)――讨论气体性质时非常有用的概念 1.什么样的气体称为理想气体? 气体分子间的作用力很微弱,一般可以忽略; 气体分子本身所占的体积远小于气体的体积。 即气体分子之间作用力可以忽略,分子本身的大小可以忽略的气体,称为理想气体。2.理想气体是一个抽象的概念,它实际上不存在,但此概念反映了实际气体在一定条件下的最一般的性质。 3.实际气体在什么情况下看作理想气体呢? 只有在温度高和压力无限低时,实际气体才接近于理想气体。因为在此条件下,分子间距离大大增加,平均来看作用力趋向于零,分子所占的体积也可以忽略。二、理想气体定律(The Ideal Gas Law) 1.由来 (1) Boyle’s law(1627-1691)British physicist and chemist - The pressure-volume relationship n、T不变,V∝ 1/ p or pV = constant (2) Charles’s law(1746-1823)French scientist 1787年发现-The temperature-volume relationship n、p不变,V∝T or V/T = constant (3) Avogadro’s law(1778-1823)Italian physicist Avogadro’s hypothesis :Equal volumes of gases at the same temperature and pressure contain equal numbers of molecular. Avogadro’s law The volume of a gas maintained at constant temperature and pressure is directly proportional to the number of moles of the gas. T、p不变,V∝n 2.理想气体方程式(The ideal-gas equation) 由上三式得:V∝nT / p,即pV∝nT,引入比例常数R,得:pV = nRT 3.R:Gas constant Units l·atm·mol-1·K-1J·mol-1·K-1m3 ·Pa·mol-1·K-1cal·mol-1·K-1l·torr·mol-1·K-1 Numerical Value 0.08206 8.314 8.314 1.987 62.36 在标准状况下: 1.000 0.08206 273.15 22.41(L) 1.000 nRT V p ?? ===
气体和溶液 【1-1】在0℃和100kPa 下,某气体的密度是1.96g·L -1。试求它在85千帕和25℃时的密度。 解:根据公式p M=ρRT 得111222 P T P T ρρ=, 所以211212 85.0 1.96273.15===1.53100298.15P T PT ρρ???g·L -1 【1-2】 在一个250 mL 容器中装入一未知气体至压力为101.3 kPa ,此气体试样的质量为0.164 g ,实验温度为25℃,求该气体的相对分子质量。 解:-1101.30.250=n 8.314n=0.0102mol 0.1640.0102=16.1g mol 298.15 ??÷?,, 【1-3】收集反应中放出的某种气体并进行分析,发现C 和H 的质量分数分别为0.80和0.20。并测得在0℃和101.3 kPa 下,500 mL 此气体质量为0.6695 g 。试求该气态化合物的最简式、相对分子质量和分子式。 解:(1)(0.80(12.01):(0.20(1.008) = 1:3.0,最简式为CH 3 (2)-1101.30.500=n 8.314n=0.0223mol 0.66950.023=30.0g mol 273.15 ??÷?,, (3)C 2H 6 【1-4】将0℃和98.0 kPa 下的2.00 mL N 2和60℃ 53.0 kPa 下的50.00 mL O 2在0℃混合于一个50.0 mL 容器中,问此混合物的总压力是多少? 解:112298.0 2.00(N ) 3.92kPa 50.0p V p V ?=== 122153.0273(O )43.5kPa 333p T p T ?=== 3.9243.547.4kPa p =+=混合 【1-5】现有一气体,在35℃和101.3 kPa 的水面上捕集,体积为500 mL 。如果在同样条件下将它压缩成250 mL ,干燥气体的最后分压是多少? 解:查教科书第4页表1-1,得35℃时水的饱和蒸气压为5.63 kPa , 101.3 5.630.500=n 8.314n=0.01867mol 308.15 -??(), P 0.250=0.018678.314P=191.3kPa 308.15 ??,
第二节理想气体和真实气体 在空分装置中,其工质为气态物质,分子在不断地作热运动:移动、转动和振动,分子的数量是巨大的,运动是不规则的。因此,气体的性质是很复杂,很难找出其运动规律。为了便于分析,提出了理想气体这一概念。 凡能满足以下三个条件的气体称为理想气体: 1. 分子本身的体积忽略不计; 2. 分子相互没有作用力; 3. 分子间不发生化学反应。 理想气体虽然是一种实际上不存在的假想气体,但是在上述假设条件下,气体分子运动的规律就可大大简化,能得出简单的数学关系式。为区别理想气体把自然界中的实际气体叫做真实气体。真实气体 在通常压力下,大多数符合理想气体的假设条件。例如O 2.N 2 .H 2 等气体均符合上述条件。 1.2.1 气体的基本状态参数 描写物质的每一聚集状态下的特性的物理量,称为物质的状态参数。物质的每一状态都有确定数值的状态参数与其对应,只要有一个状态参数发生变化,就表示物质状态在改变。描写气体状态的基本参数是温度、压强和比容。 1.温度,它表示物体冷热的程度。从分子运动论的观点看,温度是分子热运动平均动能的量度,温度愈高,分子的热运动平均动能就愈大,为了具体地确定分子运动的数值,在工程上常用的测温标尺有摄氏温标和热力学温标。 摄氏温标规定在一个标准大气压下,冰的熔点为0度,水的沸点为100度,将它分成100等分,每一等分1度。用摄氏温度表示的温度叫做摄氏温度,量的符号t,单位名称摄氏度,单位符号℃,低于冰点温度,用负值表示,例如在6at下,空气液化温度为-173℃。 实践证明,-273℃是实际能够接近而不可能达到的最低温度。如果-273℃作为温度的起算点,就不为出现负温度值,把-273℃叫做绝对零度。从绝对零度起算,温度测度与摄氏温度相同,这种计算温度的标尺叫热力学温标,也称绝对温标。热力学温度量的符号T,单位名称开尔文,单位符号K。 两种温标的关糸是; T=273.15+(K) ,通常简化为T=273+t(K) t=T-273.15(℃)通常简化为t=T-273(℃) 例如,在标准大气压下,冰的熔点为0℃即273Κ。 测量温度的仪器有水银温度计、铂电阻温度计、热电偶温度计等。仪表指示的温度常用℃,而工程计算中常用K,为此应熟悉这两种温标的换算。由于摄氏温度和绝对温度所示的温标每一个刻度值大小一样,不论是采用那种温标,它们的数值是相同的。