第四章气体的性质
同步题库一气体的状态和状态参量
一、选择题
1.准确地描述某种气体的状态所需要的物理量是 ( ).
A. 压强P、体积V和温度T
B. 压强P、密度ρ和温度T
C. 压强P、体积V、温度T和质量M
D. 压强P、体积V、温度T和摩尔数n
2.关于热力学温标的下列说法中,正确的是().
A. 热力学温度的每一度的大小与摄氏温度的相同的
B. 热力学温度的零度记为0 K,它等于––273.15℃
C. 一定质量的气体,当它的温度降低至绝对零度时,气体的压强也应为零
D. C叙述的内容是理论上的推导,实际是达不到的
3.在摄氏温度与热与学温度的换算中,下列哪几种说法是正确的 ( ).
A. 5℃等于278K
B. 升高5℃就是升高278K
C. 降低到5℃就是降低到278℃
D. 降低了5℃就是降低了278K
4.一瓶气体的温度是10℃,那么 ( ).
A. 每个分子的温度都是10℃
B. 分子的平均温度
是10℃
C. 单位体积内气体的温度是10℃
D. 单位质量
的气体的温度是10℃
5.一个物体温度升高27℃,则其热力学温度增加量
是 ( ).
A. 300K
B. ––246K
C. 246K
D.27K
6.关于气体的压强正确的理解是 ( ).
A. 大气压是由地球表面空气的重量产生的,将开口
瓶密封以后,瓶内的气体压强就会小于大气压
B. 气体的压强就是气体分子不断碰撞器壁而产生
的
C. 气体压强取决于单位体积内的分子数和分子的平均速变
D. 单位面积器壁受到的压力就是气体对器壁的压强
7.空气的压强为一个标准大气压时,水面底下20.68m深处的压强是 ( ).
A. 2280mmHg
B. 3.039×105Pa
C. 3个atm (标)
D. 等于31.02m高水柱所产生的压强
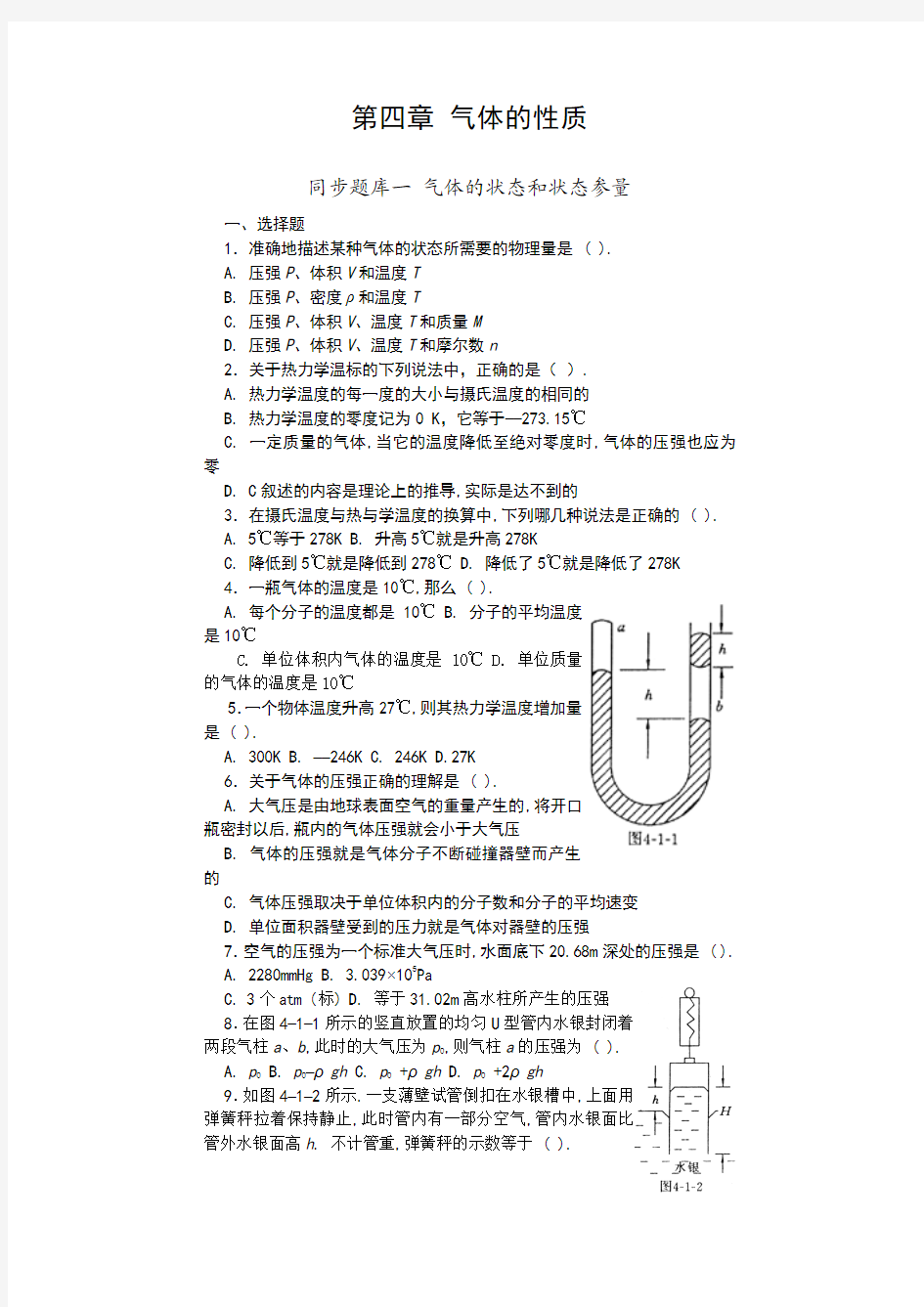
8.在图4–1–1所示的竖直放置的均匀U型管内水银封闭着
两段气柱a、b,此时的大气压为p0,则气柱a的压强为 ( ).
A. p0
B. p0–ρgh
C. p0 +ρgh
D. p0 +2ρgh
9.如图4–1–2所示.一支薄壁试管倒扣在水银槽中,上面用
弹簧秤拉着保持静止,此时管内有一部分空气,管内水银面比
管外水银面高h. 不计管重,弹簧秤的示数等于 ( ).
A. 外部大气与内部空气对试管平底部分的压力之差
B. 试管内h高水银的重力
C. 上面所述的两上数值之和
D. 试管内H高水银的重力
10.一定质量的理想气体,发生状态变化时,关于气体稳定状态的三个状态参量,下面说法正确的是 ( ).
A. 有一个量发生变化,其它两个量也一定发生变化
B. 有一个量发生变化,其它两个量可以都不发生变化
C. 两个量同时发生变化时,第三个量一定随之发生变化
D. 两个量同时发生变化时,第三个量可以保持不变
二、填空题
11.气体的状态参量是 ,对于一定质量的气体来说,如果这三个量都不变,我们说气体处于 ,状态中,如果这三个量中有两个或三个量改变,我们说气体的 ,了.
12.在热力学温标中,标准大气压下,冰的熔点为 ,;水的沸点和冰的熔点之间相隔的度数是 ,
13.用某化学反应制取氢气,其制得氢气在标准状况下为2.24L,现有一个容积为5L的真空集气瓶去收集这些气体,则气体体积为 ,
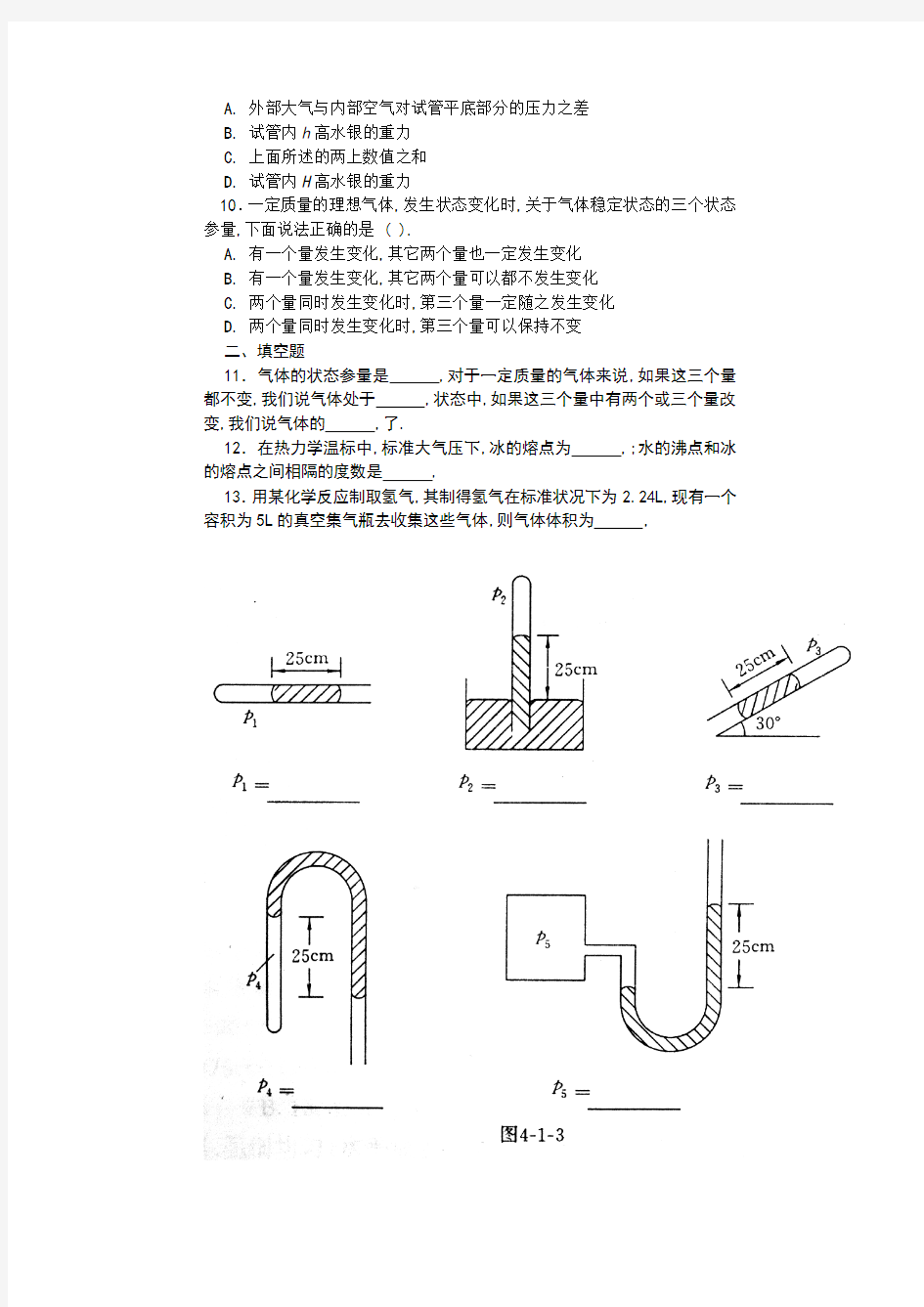
14.计算图4–1–3中各情况下,被封闭气体的压强. (标准大气压强p0=76厘米汞柱,图中液体为水银)
15.四个长方体容器中被光滑的活塞封闭一定质量的气体. 如图4–1–4所示,M为重物质量,F是外力, p0为大气压,S为活塞面积,G为活塞重,则压强各为:
16.如图4–1–5所示,一个横截面积为S的圆筒形容器竖直放置,金属圆板A的上表面是水平的,下表面是倾斜的,下表面与水平面的夹角为θ,圆板的质量为M,不计圆板与容器内壁之间的摩擦,若大气压为P0,则被圆板封闭的容器中的气体的压强P等于 .
17.如图4--1–6所示,两个气缸A和B被活塞各封住一部分气体,活塞面积比S A : S B = 2 : 1,气缸A内气体压强p A =10atm (标),外界为一个标准大气压,则气缸B中气体压强p B = 个标准大气压.
同上题库二气体三条实验定律(一)
一、选择题
1.一定质量的气体,温度不变体积减小时,气体压强增大是由于( ).
A. 单位体积内分子数变大,单位时间对器壁的碰撞次数变多
B. 气体密度变大,分子对器壁排斥力变大
C. 每个分子对器壁平均撞击力变大
D. 气体分子密度变大,单位体积内分子的质量变大
2.一定质量的理想气体在等温压缩时,体积减少1L,则压强增加20%,如果体积减少2L,那么体的压强将增加( ).
A. 40%
B. 50%
C. 60%
D. 80%
3.将一试管管口朝下压入水中,若管内2/3进水,则管内空气的压强为( ).
A. 3/2atm
B. 2/3atm
C. 2atm
D. 3atm
4.一直径为D的气泡从湖底升起,到达水面时直径扩大为2D,设湖水温度均匀,大气压为1.0×105Pa,则湖水深度约为( ).
A. 20m
B. 40m
C. 70m
D. 100m
5.在水面下30m深处有一个体积为V1的气泡(设水温均匀,大气压为10m水柱高),则该气泡升到水面时的体积V将为( ).
A. 2V1
B. 3V1
C. 4V1
D. 5V1
6.在标准状况下进行托里拆利实验时,水银柱高度为75cm,此时若将玻璃管向上提起5cm (管口仍在水银槽中),那么水银柱高度将( ).
A. 不变
B. 降低
C. 增高
D. 不能确定
7.一端封闭的粗细均匀的细玻璃管中有一段水银柱将管内气体
封闭,管口朝下竖直放置,如图4–2–1所示. 现将玻璃管倾斜一些,则( ).
A. 被封闭的气体压强将增大
B. 被封闭的气体压强将减少
C. 被封闭的气体体积将增大
D. 被封闭的气体体积将减少
8.将一端封闭的玻璃管插入水银槽内,内封一定质量的气体,如图4–2–2所示. 若将管略压下一些,下述说法正确的是( ).
A. 玻璃管内气体体积扩大
B. 玻璃管内气体体积缩小
C. 管内外水银面高度差减小
D. 管内外水银面高度差增大
9.将长1m、一端封闭、内径均匀的玻璃管开口
向下插入水银槽内25cm深,当时大气压为75cmHg
高,则进入管内的水银柱高为( ).
A. 11.6cm
B. 13.4cm
C. 25cm
D. 38.4cm
10.两端封闭、粗细均匀、水平放置的玻璃管正中有一段水银柱,如图4–2–3所示,两边是压强为76cmHg的空气. 当玻璃管竖直放置时,上部空气柱的长是下部空气柱长度的2倍,则玻璃管内水银
柱的长度h应为( ).
A. 76cm
B. 57cm
C. 38cm
D. 19cm
二、填空题
11.一定质量的气体,体积从8L等温压缩至6L,压强增加了3×104Pa,则该
气体初态压强为Pa, 末态压强为Pa.
12.一个贮气筒内装有20L压强1.0×105Pa的空气,现在要使筒内气体压强增为1.0×106Pa,则应向筒内再打入L1.0×106Pa的空气. (设此过程中温度保持不变).
13.一个上下粗细一样的气缸竖直放置,用一个质量和厚度均不计的活塞将气体封闭于气缸内,筒高1m,当时的大气压为75cmHg,现往活塞上部倒水银,最多能倒入深的水银,使原活塞在筒高1m处.
14.容积为20L的钢瓶,充满氧气后,压强为150 atm,打开钢瓶的阀门,把氧气分装到每个容积为5L的小瓶中去,原来小瓶是真空的,装至压强为10atm时为此. 假设在分装过程中不漏气,并且温度不变,那么最多能分装瓶.
15. 一端封闭的均匀玻璃管,竖直插入水银中,管中水银面比管外水银面低4cm,管内空气柱长19cm. 如果要使管内外水银面相平,那么应该使玻璃管向移动,移动 cm.
三、计算题
16.如图4–2–4所示.长为100cm的内径均匀的细玻璃管,
一端被封闭,一端开口. 当开口端竖直向上时,用20 cmHg柱封住
49cm长的空气柱,当开口竖直向下时,管内被封闭的空气柱长为
多少?当时大气压强为76cmHg柱高.
参考答案
第四章气体的性质
同步题库一气体的状态和状态参量
一、1. B、C、D 2. A、B、D 3. A、C 4. C、D 5. D 6. B、C、D 7. A、
B、C、D 8. A 9. A、B 10. D
二、11. 压强体积温度平衡状态改变 12. 273K 100K 13. 5L 14. 76cmHg 51cmHg
同步题库二气体三条实验定律 (一)
一、1. A 2. B 3. D 4. C 5. C 6. C 7. A、D 8. B、C 9. B 10. B
二、11.9×1041.2×105 12. 18 13. 75cm 14. 56 15. 上 5
三、16. 81.6cm
第一章 气体的pVT 性质——习题 一、填空题 1.温度为400K ,体积为2m 3的容器中装有2mol 的理想气体A 和8mol 的理想气体B ,则该混合气体中B 的分压力p B =( )KPa 。13.302 V RT n p /B B ==(8×8.314×400/2)Pa =13.302 kPa 或()[]B B A B B /y V RT n n py p +== (){}kPa 13.3020.8Pa 2/400314.828=???+= 2.在300K ,100KPa 下,某理想气体的密度ρ=80.8275×10-3kg ·m -3。则该气体的摩尔质 量M=( )。1-3m o l kg 10016.2??- ()()RT M V RT M m nRT pV //ρ=== ()Pa 10100/K 300K mol J 314.8m kg 10827.80/31-1-3-3-???????==p RT M ρ 1-3mol kg 10016.2??=- 3.恒温100°C 下,在一带有活塞的气缸中装有3.5mol 的水蒸气H 2O (g ),当缓慢地压缩到压力p=( )KPa 是才可能有水滴H 2O (l )出现。101.325 因为100℃时水的饱和蒸汽压为101.325kPa ,故当压缩至p=101.325kPa 时才会有水滴H 2O (l )出现。 4.恒温下的理想气体,其摩尔体积随压力的变化率T m p V ???? ???? =( )。2/-p RT 理想气体满足理想气体状态方程RT pV =m 所以 ()0/m m =+??V p V p T ,即()2m m ///p RT p V p V T -=-=?? 5,一定的范德华气体,在恒容条件下,其压力随温度的变化率()=??V T /p . ()nb V nR -/ 将范德华状态方程改写为如下形式: 2 2 V an nb V nRT p --=所以()()nb V nR T p V -=??// 6.理想气体的微观特征是:( )理想气体的分子间无作用力,分子本身不占有体积
第一章气体的pVT性质 1.1物质的体膨胀系数与等温压缩率的定义如下 试推出理想气体的,与压力、温度的关系。 解:根据理想气体方程 1.5两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。若将其中的一个球加热到100 ?C,另一个球则维持0 ?C,忽略连接细管中气体体积,试求该容器内空气的压力。 解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。 标准状态: 因此, 1.9 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。 (1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。 (2)隔板抽取前后,H2及N2的摩尔体积是否相同?
(3)隔板抽取后,混合气体中H2及N2的分压立之比以及它们的分体积各为若干? 解:(1)等温混合后 即在上述条件下混合,系统的压力认为。 (2)混合气体中某组分的摩尔体积怎样定义? (3)根据分体积的定义 对于分压 1.11 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。重复三次。求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。 解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。设第 一次充氮气前,系统中氧的摩尔分数为,充氮气后,系统中氧的摩尔分数 为,则,。重复上面的过程,第n次充氮气后,系统的摩尔分数为 , 因此 1.13 今有0 C,40.530 kPa的N2气体,分别用理想气体状态方程及van der Waals 方程计算其摩尔体积。实验值为。 解:用理想气体状态方程计算 用van der Waals计算,查表得知,对于N2气(附录七) ,用MatLab fzero函数求得该方程的解为 也可以用直接迭代法,,取初值 ,迭代十次结果
第一章 气体、液体和溶液的性质 §1-1 气体的性质 本节的重点是三个定律: 1.道尔顿分压定律(Dalton’s law of partial pressures ) 2.阿码加分体积定律(Amagat’s law of partial volumes ) 3.格拉罕姆气体扩散定律(Graham’s law of diffusion ) 一、理想气体(Ideal Gases )――讨论气体性质时非常有用的概念 1.什么样的气体称为理想气体? 气体分子间的作用力很微弱,一般可以忽略; 气体分子本身所占的体积远小于气体的体积。 即气体分子之间作用力可以忽略,分子本身的大小可以忽略的气体,称为理想气体。 2.理想气体是一个抽象的概念,它实际上不存在,但此概念反映了实际气体在一定条件下的最一般的性质。 3.实际气体在什么情况下看作理想气体呢? 只有在温度高和压力无限低时,实际气体才接近于理想气体。因为在此条件下,分子间距离大大增加,平均来看作用力趋向于零,分子所占的体积也可以忽略。 二、理想气体定律(The Ideal Gas Law ) 1.由来 (1) Boyle’s law (1627-1691)British physicist and chemist - The pressure-volume relationship n 、T 不变 , V ∝ 1/ p or pV = constant (2) Charles’s law (1746-1823)French scientist 1787年发现-The temperature-volume relationship n 、p 不变 , V ∝ T or V /T = constant (3) Avogadro’s law (1778-1823)Italian physicist Avogadro’s hypothesis :Equal volumes of gases at the same temperature and pressure contain equal numbers of molecular. Avogadro’s law The volume of a gas maintained at constant temperature and pressure is directly proportional to the number of moles of the gas. T 、p 不变 , V ∝ n 2.理想气体方程式(The ideal-gas equation ) 由上三式得:V ∝ nT / p ,即pV ∝ nT ,引入比例常数R ,得:pV = nRT pV = nRT R---- 摩尔气体常量 在STP 下,p =101.325kPa, T =273.15K n =1.0 mol 时, V m =22.414L=22.414×10-3m 3 R =8.314 kPa ?L ?K -1?mol -1 nT pV R =K 15.2731.0mol m 1022.414Pa 1013253 3???=-1 1K mol J 314.8--??=
一、填空题 1.温度为400K ,体积为2m 3的容器中装有2mol 的理想气体A 和8mol 的理想气体B ,则该混合气体中B 的分 压力p B =( )KPa 。13.302 2.在300K ,100KPa 下,某理想气体的密度ρ=80.8275×10-3kg ·m -3。则该气体的摩尔质量M=( )。 3.恒温100°C 下,在一带有活塞的气缸中装有3.5mol 的水蒸气H 2O (g ),当缓慢地压缩到压力p=( )KPa 是才可能有水滴H 2O (l )出现。 4.恒温下的理想气体,其摩尔体积随压力的变化率T m p V ???? ???? =( )。 5,一定的范德华气体,在恒容条件下,其压力随温度的变化率()=??V T /p . 6.理想气体的微观特征是:( ) 7. 在临界状态下,任何真实气体的宏观特征为:( ) 8. 在n,T 在一定的条件下,任何种类的气体当压力趋近于零时均满足:()=→pV p lim 0 ( ). 9.实际气体的压缩因子定义为Z=( )。当实际气体的Z>1时,说明该气体比理想气体( ) 三、问答题 理想气体模型的基本假设是什么?什么情况下真实气体和理想气体性质接近?增加压力真实气体就可以液化,这种说法对吗,为什么? 第二章 热力学第一定律――附答案 一、填空题 1. 理想气体向真空膨胀过程 , 下列变量 中等于零的有 : 。 2. 双原子理想气体经加热内能变化为 ,则其焓变为 。 3. 在以绝热箱中置一绝热隔板,将向分成两部分,分别装有温度,压力都不同的两种气体,将隔板抽走室气 体混合,若以气体为系统,则此过程 。 4. 绝热刚壁容器内发生CH 4+2O 2=CO 2+2H 2O 的燃烧反应,系统的 Q ___ 0 ; W ___ 0 ;?U ___ 0;?H ___ 0 5. 某循环过程 Q = 5 kJ, 则 ?U + 2W + 3 ?(pV) = __________. 6. 298K 时, S 的标准燃烧焓为-296.8 kJ ?mol -1, 298K 时反应的标准摩尔反应焓 ?r H m = ________ kJ ?mol -1 . 7. 已知 的 , 则 的 。 8. 某均相化学反应 在恒压,绝热非体积功为零的条件下进行,系统的温度由 升高到 则此 过程的 ;如果此反应是在恒温,恒压,不作非体积功的条件下进行,则 。 9. 25 ℃ 的液体苯在弹式量热计中完全燃烧 , 放热 则反应 的 。 10.系统的宏观性质可以分为( ),凡与系统物质的量成正比的物理量皆称为( )。 11.在300K 的常压下,2mol 的某固体物质完全升华过程的体积功W=( ) 12.某化学反应:A(l)+0.5B(g)-- C(g) 在500K 恒容条件下进行,反应进度为1mol 时放热10KJ,若反应在同样温度恒压条件下进行,反应进度为1mol 时放热( )。
第五章 气体的热力性质 一、是非题 1.各种气体的气体常数都相同。( ) 2.在相同的温度和压力下,各种气体的摩尔体积相同。( ) 3.理想气体热力学能和焓都是温度的单值函数。( ) 4.理想气体的定压摩尔热容与定容摩尔热容的差值与状态无关,与气体种类有关。( ) 5.理想气体的比热容都是常数。( ) 6.在相同的温度和压力下,各种气体的压缩因子都相同。( ) 7.气体的压缩因子不可能大于1。 ( ) 8.应用通用压缩因子图计算的精确性不高主要是由于查图容易引起误差。( ) 9.对应态定律是由实验得出的规律,这一规律只是近似的。( ) 二、问答题 1.理想气体热力性质有哪些特点? 2.对本章所述气体状态参数的各种计算方法作一小结,并说明它们分别适用于什么情况? 3.有人认为,供暖使室内温度升高总意味着室内空气的总热力学能增加。核算一下,看这种认识是否正确(室内气体与室外大气相同)。 4.如果比热容 c 是温度 t 的单调递增函数,当 12t t 时,平均比热容 1 0t c 、 2 0t c 、 2 1 t t c 中哪一个最大,哪一个最小? 5.完成把范德瓦尔斯状态方程变换成幂级数形式的推导。
6.状态方程式在临界点上满足如下两个关系式: 0=???? ????C T m V p 022=???? ????C T m V p 试应用这两个关系式导出范德瓦尔斯状态方程的常数 R 、 a 、 b 与临界点参数 c p 、 c T 、 c m V ,之间的以下关系: c c m c T V p R ,38= 2 2 26427c c p T R a = c m c c V p RT b ,3 1 8== 从而说明,遵循范德瓦尔斯状态方程的物质在临界状态点的压缩因子为 375.0,== c c m c c RT V p z 7.利用上题所得关系,将范德瓦尔斯状态方程转化成如下的对比态方程的形式: ()r r r r T V V p 81332=-???? ??+ 或整理成 1164272=? ??? ??-???? ??+r r r r T p zT p z 三、习题
范德瓦耳斯气体的热力学性质 陈东 2008061144 (黔南民族师范学院物理与电子科学系,贵州都匀 558000) 【摘要】讨论范德瓦尔斯气体的内能、熵、焓和自由能,给出相应的数学表达式,并对相应问题进行讨论。【关键词】范德瓦尔斯气体;内能;熵;焓;自由能;绝热过程;节流过程 Van der Waals gas thermodynamic properties Chen Dong 200806114 ( Qiannan Normal College for Nationalities Department of physics and electronic science, Guizhou Tuyun 558000) [ Abstract ] to discuss Van Der Waals gas internal energy, entropy, enthalpy and free energy, the corresponding mathematical expressions, and the relative problems are discussed. [ Key words ] Van Der Waals gas; energy; entropy; enthalpy; free energy; adiabatic process; throttling process 理想气体是反映各种实际气体在压强趋于零时所共有的极限性质的气体,是一种理想模型。在一般的压强和温度下,可以把实际气体近似地当作理想气体出来,但是在压强太大或温度太低(接近于其液化温度)时,实际气体与理想气体有显著的偏离。为了更精确地描述实际气体的行为,人们提出很多实际气体的状态方程,其中最重要、最有代表性的是范德瓦尔斯方程。 1、范德瓦尔斯气体的状态方程 范德瓦尔斯方程是在理想气体状态方程的基础上修改而得到的半经验方程。理想气体是完全忽略除分子碰撞瞬间外一切分子间的相互作用力的气体,而实际气体就不能忽
第一章气体、液体和溶液的性质Chapter 1The Behaviors of Gas、Liquid and Solution §1-1 气体的性质 The Properties of Gases 本节的重点是三个定律: 1.道尔顿分压定律(Dalton’s law of partial pressures) 2.阿码加分体积定律(Amagat’s law of partial volumes) 3.格拉罕姆气体扩散定律(Graham’s law o f diffusion) 一、理想气体(Ideal Gases)――讨论气体性质时非常有用的概念 1.什么样的气体称为理想气体? 气体分子间的作用力很微弱,一般可以忽略; 气体分子本身所占的体积远小于气体的体积。 即气体分子之间作用力可以忽略,分子本身的大小可以忽略的气体,称为理想气体。2.理想气体是一个抽象的概念,它实际上不存在,但此概念反映了实际气体在一定条件下的最一般的性质。 3.实际气体在什么情况下看作理想气体呢? 只有在温度高和压力无限低时,实际气体才接近于理想气体。因为在此条件下,分子间距离大大增加,平均来看作用力趋向于零,分子所占的体积也可以忽略。二、理想气体定律(The Ideal Gas Law) 1.由来 (1) Boyle’s law(1627-1691)British physicist and chemist - The pressure-volume relationship n、T不变,V∝ 1/ p or pV = constant (2) Charles’s law(1746-1823)French scientist 1787年发现-The temperature-volume relationship n、p不变,V∝T or V/T = constant (3) Avogadro’s law(1778-1823)Italian physicist Avogadro’s hypothesis :Equal volumes of gases at the same temperature and pressure contain equal numbers of molecular. Avogadro’s law The volume of a gas maintained at constant temperature and pressure is directly proportional to the number of moles of the gas. T、p不变,V∝n 2.理想气体方程式(The ideal-gas equation) 由上三式得:V∝nT / p,即pV∝nT,引入比例常数R,得:pV = nRT 3.R:Gas constant Units l·atm·mol-1·K-1J·mol-1·K-1m3 ·Pa·mol-1·K-1cal·mol-1·K-1l·torr·mol-1·K-1 Numerical Value 0.08206 8.314 8.314 1.987 62.36 在标准状况下: 1.000 0.08206 273.15 22.41(L) 1.000 nRT V p ?? ===
第一章 气体自测题 1. 在温度恒定为25℃,体积恒定为25 dm 3的容器中,含有0.65 mol 的理想气体A , 0.35 mol 的理想气体B ;若向容器中再加人0.4 mol 的理想气体D , 则B 的分压力B p ( ), 分体积* B V ( )。 (A) 变大;(B) 变小;(C) 不变;(D) 无法确定。 2. 由A(g )和B(g )形成的理想气体混合系统,总压p =p A +p B ,体积V =*A V +* B V ,n =n A + n B 下列各式中,只有式( )是正确的。 (A) *B B B p V n RT =;(B) *A pV nRT =;(C) B B p V n RT =;(D) * A A A p V n RT =。 3. (1)在一定的T ,p 下(假设高于波义耳温度T B ): V m (真实气体)( )V m (理想气体) (2)在n ,T ,V 皆为定值的条件下: p (范德华气体)( )p (理想气体) (3)在临界状态下,范德华气体的压缩因子 c Z ( )1 (A)>;(B)=;(C)<;(D)不能确定。 4. 已知A(g )和B(g )的临界温度之间的关系为:c c (A)(B)T T >;临界压力之间的关系为: c c (A)(B)p p <。则A ,B 气体的范德华常数a 和b 之间的关系必然是:a (A)( )a (B); b (A)( )b (B)。 (A)>;(B)<;(C)=;(D)不能确定。 5. 在一个密闭的容器中放有足够多的某纯液态物质,在相当大的温度范围内皆存在气(g )、 液(l )两相平衡。当温度逐渐升高时液体的饱和蒸气压* p 变大,饱和液体的摩尔体积V m (1) ( );饱和蒸气的摩尔体积V m (g )( );m m m =()()V V g V l ?-( )。 (A)变小;(B)变大;(C)不变;(D)无一定变化规律。 6. 在t =-50℃,V =40 dm 3的钢瓶内纯H 2的压力p =12.16 × 106 Pa 。此时钢瓶内H 2的相态必然是( )。 (A)气态;(B)液态;(C)固态;(D)无法确定。 7. 在温度恒定为373.15 K ,体积为2.0 dm 3的容器中含有0.035 mol 的水蒸气H 2O(g )。若向 上述容器中再加人0. 025 mol 的水H 2O(1)。则容器中的H 2O 必然是( )。 (A)液态;(B)气态;(C)气-液两相平衡;(D)无法确定其相态。 8. 当真实气体的温度T 与其波义耳温度T B 为:
七、气体的热力性质 热机中的热能—机械能转换是通过体积功实现的,因而要求其工质的热膨胀性要好,故均选气体为工质。 7.1 理想气体 忽略自身分子所占体积与分子间作用力的气体。 此时,各种气体的许多性质趋同,其共性就只与分子的个数有关。 一、 状态方程 T mR pV g = T R pv g = 气体常数g R 与种类有关(同质量不同种气体分子的个数不等),与状态无关。 T nR pV m = T R pV m M = 气体常数M R 与种类、状态均无关,故被称为普适气体常数, K mol J R M ?=/314.8。 M R R m g =, M 为摩尔质量, mol kg /。 通常,气体若温度不太低,压力不太高, 均可视为理想气
体。如100大气压 %1≈总 分子 V V 气体分子间的相互作用与分子的间距亦即体积总V 有关。 二、 热系数与热力学函数 p p T V V ??? ????=1α T 1= v v T p p ??? ????= 1β T 1= T T p V V ??? ????-=1κ p 1= v T V T p T v c ???? ????=??? ????22 0= → )(T c V p T p T v T p c ???? ????-=???? ????22 0= → )(T c p T p V p v p T v T c c ??? ??????? ????-=-2 + T R pv g = g R = p p h J c v T v T p T -??? ????= ??? ????=μ 0= dv T p T p dT c du v V ??? ?? ???? ????--= dT c V = dp T v T v dT c dh p p ??? ?? ???? ????-+= dT c p = dv T p dT T c ds v V ??? ????+= v dv R T dT c g V += dp T v dT T c p p ??? ????-= p dp R T dT c g p -=
第五章气体的热力性质 5.1 理想气体性质 (1) 5.1.1 理想气体状态方程 (2) 5.1.2 理想气体热系数 (3) 5.1.3 理想气体热力学能和焓的特性 (4) 5.1.4 理想气体熵方程 (4) 5.2 理想气体比热容及参数计算 (5) 5.2.1 比热容的单位及其换算 (5) 5.2.2 理想气体比热容与温度的关系 (5) 5.2.3 平均比热容 (6) 5.2.4 理想气体性质特点 (11) 5.3 实际气体状态方程 (11) 5.3.1 范德瓦尔斯状态方程 (12) 5.3.2 其它状态方程 (14) 5.3.3 维里(Virial) 状态方程 (16) 5.3.4 对比态状态方程 (17) 5.4 实际气体比热容及焓、熵函数 (20) 5.4.1 实际气体状态函数的推导方法 (20) 5.4.2 计算气体热力性质的三种方法 (22) 思考题及答案 (22) 5.1 理想气体性质 工质在通常的参数范围内可呈现为气、液、固三种聚集状态,或称三种相。这里所谓的气体是指在其工作的参数范围内总是呈现为气态的工质。例如空气、气体燃料、燃气(燃料燃烧生成的气体),以及组成它们的单元气体氮、氢、氧、二氧化碳等等。 本节主要讲述理想气体性质。理想气体性质是指当压力减小到趋于零时,气体热力性质趋近的极限情况。这时,表达气体热力性质的各状态函数有最简单的形式。在压力很低时,气体的比体积大而内部分子自身占有的体积相对极小;分子间的平均距离大,使分子间的相互作用力很小,以致可以忽略分子自身占有的体积和分子间的相互作用力对气体宏观热力性质的影响。因此,常将分子自身不占有体积和分子之间无相互作用力作为理想气体的微观模型。这也是理想气体性质有简单表达形式的内在原因。尽管理想气体性质不能
一、制冷用图形符号(JB/T7965-95) 1 主题内容与适用范围 本标准规定了制冷用阀门及管路附件、制冷机组、辅助设备、控制元件等的图形符号。 本标准适用于绘制制冷系统的流程图、示意图和编制相应的技术文件。 2 引用标准 GB4270 热工图形符号和文字代号 GB4457.4 机械制图图线 GB4458.5 机械制图尺寸注法 GB1114 采暖、通风与空气调节制图标准 3 一般规定 3.1 本标准中的图形符号一般用粗实线绘制,线宽b应符号GB4457.4的规定,对管路、管件、阀及控制元件等,允许用细实线(线宽为b/3)绘制。在同一图样上,图形符号的各类线型宽度应分别保持一致。 3.2 文字代号应按直体书写,笔划宽度约为文字高度的1/10。 3.3 图形符号允许由一基本符号与其他符号组合,图形符号的位置允许转动。 3.4 绘制图形符号时,可按本标准所示图例,按比例适当放大或缩小。 3.5 在不违反本标准的前提下,各单位可作出补充规定。 4 介质代号 介质代号见表1。 表 1 5 图形符号 5.1 管道 管道的图形符号见表2。 5.2 管接头 管接头的图形符号见表4。 5.3 管路弯头及三通 管路弯头及三通的图形符号见表5。 表 2 表 3 表 4 表 5 (续表) 5.4 阀门 阀门的图形符号见表6。 5.5 控制元件和测量用表
控制零件和测量用表的图形符号见表7。 5.6 管路附件 管路附件的图形符号见表8。 5.7 动力机械 动力机械的图形符号见表9。 5.8 辅助设备 辅助设备的图形符号见表10。 5.9 制冷机组 制冷机组的图形符号见表11。 5.10 空调系统 空调系统的符号应符合GBJ 114的规定。 表 6 (续表) 表 7 (续表) 表 8 (续表) 表 9 (续表) 表 10 (续表) 表 11 二、制冷空调电气技术资料 表2-1 电气技术中项目种类的字母代码表 (续表) 注:因为一个项目可能有几种名称,故可能有几个字母代码,使用时应选较确切的代码。表2-2 我国电气设备常用文字符号新旧对照表 (续表)
一、单选题: 1.在温度、容积恒定的容器中,含有A 和B 两种理想气体,这时A 的分压分别是p A 和分体V A 。若在容器中再加入一定量的理想气体C ,问p A 和V A 的变化为:( ) A .p A 和V A 都变大; B .p A 和V A 都变小; C .p A 不变,V A 变小; D .p A 变小,V A 不变。 答案:C. 这种情况符合Dalton 分压定律,而不符合Amagat 分体积定律。 2.在温度T 、容积V 都恒定的容器中,含有A 和B 两种理想气体,它们的物质的量、分压和分体积分别为A A V ,p ,n A 和B B V ,p ,n B ,容器中的总压为p 。试判断下列公式中哪个是正确的( ) A .RT n V A A =p B .RT n n V A A B )(p += C .RT n V A A A =p D .RT n V B B B =p 答案:A. 只有(A)符合Dalton 分压定律。 3.已知氢气的临界温度和临界压力分别为Tc=33.3K ,pc=1.29×106Pa 。有一氢气钢瓶,在298K 时瓶内压力为98.0×106Pa ,这时氢气的状态为:( ) A .液态; B .气态; C. 气-液两相平衡; D. 无法确定。 答案:B. 仍处在气态区。 4.在一个绝热的真空容器中,灌满373K 和压力为101.325kPa 的纯水,不留一点空隙,这时水的饱和蒸汽压为:( ) A .等于零; B .大于101.325 kPa ; C .小于101.325 kPa ; D .等于101.325 kPa 。 答案:D. 饱和蒸汽压是物质的本性,与是否有空间无关。 5.真实气体在如下哪个条件下,可以近似作为理想气体处理( ) A .高温、高压; B .低温、低压; C .高温、低压;
第1章气体的pVT性质 思考题 1.如何使一个尚未破裂而被打瘪的乒乓球恢复原状?采用了什么原理? 2.在两个密封、绝热、体积相等的容器中,装有压力相等的某理想气体。试问这两容器中气体的温度是否相等? 3.两个容积相等的玻璃球内充满N2(g),两球中间用一玻管相通,管中间有一水银滴将两边的气体分开。当左球的温度为273K,右球的温度为293K时,水银滴处在中间达成平衡。试问:(1)若将左球的温度升高10K,中间水银滴向哪边移动?(2)若两球同时都升高10K,水银滴向哪边移动? 4.在大气压力下,将沸腾的开水迅速倒入保温瓶中,达该瓶容积的70%左右,迅速塞上软木塞防止漏气,然后放开手,请估计会发生什么现象? 5.当纯物质的气、液两相处于平衡时,不断升高平衡温度,这时处于平衡状态的气液两相的摩尔体积V m(l)和V m(g)将如何变化? 6.如何定义气体的临界温度和临界压力? 7.处于临界点的各物质有何共同特性? 概念题 1.在温度、容积恒定的容器中,含有A和B两种理想气体,这时A的分压和分体积分别为p A和V A。若在容器中再加入一定量的理想气体C,问p A和V A的变化。 (A)p A,V A都变大(B)p A,V A都变小(C)p A不变,V A变小(D)p A变小,V A不变2.在温度T、容积V恒定的容器中,含有A和B两种理想气体,它们的物质的量、分压和分体积分别为能n A,p A,V A和n B,p B,V B,容器中的总压力为p。试判断下列公式中哪个是正确的? (A)p A V=n A RT(B)pV B=(n A+n B)RT(C)p A V A=n A RT(D)p B V B= n B RT 3.已知H2(g)的临界温度和压力分别为T c=33.3K,p c=1.297×106Pa。有一氢气钢瓶,在298K时瓶内的压力为98.0×106Pa,问这时氢气的状态。 (A)液态(B)气态(C)气—液两相平衡(D)无法确定 4.在一个绝热真空容器中,灌满373K和压力为101.325kPa的纯水,不留一点空隙,这时水的饱和蒸气压为多少? (A)等于零(B)大于101.325kPa(C)小于101.325kPa(D)等于101.325kPa 5.真实气体在下述哪个条件下可近似作为理想气体处理? (A)高温高压(B)低温低压(C)高温低压(D)低温高压 6.真实气体液化的必要条件是什么? (A)压力大于p c(B)温度低于T c(C)体积等于V m,c(D)同时升高温度和压力 7.在一个恒温、容积为2dm3的真空容器中,依次充入温度相同始态为100kPa,2dm3的N2(g)和200kPa,1dm3的Ar(g),设两者形成理想气体混合物,则容器中的总压力为多少? (A)100kPa(B)150kPa(C)200kPa(D)300kPa 8.在298K时,往容积相等的A、B两个抽空容器中分别灌入100g和200g水,当达到平衡时,两容器中的水蒸气压力分别为p A和p B,则两者的关系为? (A)p A<p B(B)p A>p B(C)p A=p B (D) 无法确定 9.在273K,101.325kPa时,摩尔质量为154g·mol-1的CCl4(l)的蒸气可近似看作理想气体,则气体的密度是多少(单位为g·dm-3)? (A)6.87(B)4.52(C)3.70(D)3.44
第二章 气体热力学性质 第一节 理想气体的性质 一、理想气体: 1、假设:①气体分子是弹性的、不占据体积的特点; ②气体分子间没有相互作用力。 对于气体分子的体积相对气体比容很小,分子间作用力相对于气体压力也很小时,可 作为理想气体处理。 2、状态方程 理想气体在任一平衡状态时的压力P 、温度T 、比容v 之间的关系应满足状态方程, 即克拉佩龙方程 Pv= RT mkg 质量气体为: Pv=mRT=m 0R T R 气体常数,反映气体特征的物理量,和气体所处状态无关; n 物质的量(千克数或摩尔数); 0R 通用气体常数,与气体状态、其他性质无关的普适恒量; K Kmol J R R ?==/8314150μ P V C C ,分别表示定压比容及定容比容,对于理想气体,他们仅是温度的单值函 数,P V C C > 其 R C C P V =- 比值k C C P V =/(绝热指数) 标准状态时(压力未101.325Kpa, 0℃) 单原子气体 k=1.66?1.67 双原子气体 k=1.40?1.41 多原子气体 k=1.10?1.3 此外 R k k C R R C C C k P V P V ?-=-=>=1 ,1,1/ 二、过程方程及过程功 气体在压缩和膨胀过程中,状态的变化应符合动量守恒及转换定律,即内能、外功、热交换三者间应满足 P d V dW dT C dU dW dU dq V ==+=,,其中
压缩过程中的能量关系 1、 等温过程 数字式:0==dT const T 即 过程方程式:const PV = 过程功:2 111121112ln ln ln P P V P V V V P V V RT W === 内能变化:012=-U U 热交换:w q = 等温过程的热交换q 和过程功w 值相等,且正负号相同,即气体加热进行等温膨胀时,加入的热量全部用于对外膨胀做功,气体被压缩时外界对气体所作的功全部转换为热量的形式排出。 2、 绝热过程 数字式:0,0==dq q 过程方程式:const PV K = 过程功:]1[1]1[112111 121--???? ??--=??? ? ??--=K k k V V T k R P P T R R W 内能变化:W U U =-12 功质在绝热过程中与外界没有热量交换,过程功只能来自工质本身的能量,绝热膨胀机等于内能降,绝热压缩时,工质消耗的压缩功等于内能的增加量。 3、 多变过程 状态变化过程中,状态参数都由显著的变化,存在热交换时他们的过程特征满足过程方程 过程功:)(1 1]1[1211121T T C n k P P T n R W V n n ---=???? ??--=- 内能变化:)(12T T C U V -=? 热量交换:)(1 21T T C n k n W U q V ---= =?= 压缩机级的工作工程
第一章气体的PVT性质授课时数:3学时 主要内容: 1. 理想气体状态方程及模型 2. Dalton 定律与Amagat 定律 3. 实际气体的PVT性质 4. 范德华方程 5. 实际气体的液化与临界性质 6. 对应状态原理与压缩因子图 重点: 1. 重点掌握理想气体状态方程及模型 2. 重点掌握Dalton 定律与Amagat 定律 3. 重点掌握实际气体的液化与临界性质 4. 重点掌握对应状态原理与压缩因子图 难点: 1. 理想气体模型及其理论解释 2. 实际气体的液化与临界性质 3. 对应状态原理与压缩因子图及有关计算 教学方式: 1. 采用CAI 课件与黑板讲授相结合的教学方式。 2. 合理运用问题教学或项目教学的教学方法。 3. 作业:习题2,5,7,10,12,16,18
4. 答疑:(a) 课后答疑;(b) 通过网络答疑。 1.1理想气体状态方程 1.理想气体状态方程 Boyle R定律 PV=常数(n,T一定) Gay J-Lussac J定律V/T=常数(n,p一定) Avogadro A定律V/n=常数(T,p一定) 理想气体状态方程PV=nRT = (m/M)RT R=8.314510 Pa.m3.mol-1.K-1 =8.314510 J.mol-1.K-1 计算时可取R=8.315 J.mol-1.K-1 2.理想气体模型 (1)分子间力(2)理想气体模型 理想气体在微观上具有两个特征:分子之间无相互作用力;分子本身不占有体积。理想气体状态方程是由研究低压下气体的行为导出的,各种气体在适用该方程时有些偏差,压力越低偏差越小,在极低压力下理想气体状态方程可准确地描述气体的行为。 3.摩尔气体常数 先测量某些真实气体在一定温度T下于不同压力p时的摩尔体积V m然后将PV m对p 作图,外推到p→0处,求出对应的PV m值,计算R值。 1.2理想气体混合物 1.混合物的组成
物化第一章气体的p V T性质-含答案
第一章 气体的pVT 性质——习题 一、填空题 1.温度为400K ,体积为2m 3的容器中装有2mol 的理想气体A 和8mol 的理想气体B ,则该混合气体中B 的分压力p B =( )KPa 。13.302 V RT n p /B B ==(8×8.314×400/2)Pa =13.302 kPa 或()[]B B A B B /y V RT n n py p +== (){}kPa 13.3020.8Pa 2/400314.828=???+= 2.在300K ,100KPa 下,某理想气体的密度ρ=80.8275×10-3kg ·m -3。则该气体的摩尔质量M=( )。1-3mol kg 10016.2??- ()()RT M V RT M m nRT pV //ρ=== () Pa 10100/K 300K m ol J 314.8m kg 10827.80/31-1-3-3-???????==p RT M ρ 1-3m ol kg 10016.2??=- 3.恒温100°C 下,在一带有活塞的气缸中装有3.5mol 的水蒸气H 2O (g ),当缓慢地压缩到压力p=( )KPa 是才可能有水滴H 2O (l )出现。101.325 因为100℃时水的饱和蒸汽压为101.325kPa ,故当压缩至p=101.325kPa 时才会有水滴H 2O (l )出现。 4.恒温下的理想气体,其摩尔体积随压力的变化率T m p V ???? ? ??? =( )。2/-p RT 理想气体满足理想气体状态方程RT pV =m 所以 ()0/m m =+??V p V p T ,即()2m m ///p RT p V p V T -=-=??
The Properties of Gases §1.1理想气体模型及状态方程 1分子间力 压力越低,气体分子间距离 越大,分子间作用减小 2分子体积 当压力越低,分子间距离越 大时,这也意味着分子本身所占 的体积与此时气体所具有的非常 大的体积相比可忽略不计。
沸点--饱和蒸气压与外界压力相等时,液体沸腾,此时相应的温度。正常沸点:外压为101325Pa时的沸点 在沸腾时,液体表面及内部分子同时汽化 2、临界参数 ?每种液体都存在有一个 临界温度Tc,T>Tc时,无 论多大压力,都不可能使 气体液化 ?临界温度Tc时的饱和蒸 气压为p c 临界温度T c 能够用加压方法使气体液化的最高温度。 临界压力p c 在T c 下使气体液化所施加的最小压力。 临界体积V c,m 在T c , p c 下物质的摩尔体积。
3、真实气体的p-V m图及气体的液化、临界点 CO 2 等温线 阴影区--气液共存 左方为液相区 右方为气相区 (2)T=Tc 临界点,临界状态 V mg =V ml 界面消失 拐点处的高数性质:数学特征,临界点处等温线的一阶、二 阶偏导数均为零。 ) (= ? ? c T m V p ) ( 2 2 = ? ? c T m V p (3)T>Tc 无论压力多大,气体均不能液化, 等温线为光滑曲线。 T≤Tc是气体液化的必要条 件,对真实气体,不同的物质 因性质不同,p-V m 图会有所差 异,不同的气体有不同的p c 、 T c 、V c 临界点, 只有当T≤Tc、p≥p*时才出现液体,否则体系将以气体形态存在。
Z=f (p r ,T r )依据实验数据,作出了等T r 线
第一章 气体pVT 性质 1.对于真实气体,当处于( )条件时,其行为与理想接近。 A.高温高压 B.高温低压 C.低温低压 D.低温高压 2.某真实气体的压缩因子Z < 1,则表示该气体,( ) A.易被压缩 B.难于压缩 C.易液化 D.难液化 3.物质能以液态形式存在的最高温度是( ) A.沸腾温度b T B.临界温度c T C.玻义尔温度B T D.凝固点温度f T 4.对比温度是其所处的温度T 与( )比值。 A.玻义尔温度 B T B.临界温度 c T C. 沸腾温度b T D.273 K 5.对于临界点的描述,下列说法中( )是不正确的。 A.临界点处22()0,()0T T p p V V ??==?? B.在临界点处,液体和蒸气具有相同的密度 C.临界点所对应的温度是气体可以加压液化所允许的最高温度 D.在临界参数中,临界体积是最易精确测定的 6.理想气体的微观模型是( ) A.各种分子间的作用力相等,各种分子的体积大小相等 B.所有分子都看作一个质点,它们具有相同的能量 C.分子间无作用力,分子本身不占有体积 D.处于临界温度以上的气体 7.描述真实气体的状态方程有许多种,但它们都有一个共同的特点是( ) A.当压力趋近于零时,都可还原成m pV RT = B.当温度越高时,都可还原成pV nRT = C.当压力趋于无穷大时,都可还原成pV nRT = D.当压力趋近于零时,都可还原成范德华方程 2()()m m a p V b RT V + -= 8.对应状态原理的正确描述应该是( ) A.各种气体处于相同的温度和压力之下 B.各种气体处于相同的对比压力和对比温度下具有近似相同的对比体积 C.各种气体压缩因子都是1 D.各种气体都处于临界温度以上 9. 关于物质临界状态的下列描述中, 不正确的是 (A) 在临界状态, 液体和蒸气的密度相同, 液体与气体无区别
第2章 气体的热力性质 2.1 理想气体与实际气体 1.理想气体与实际气体 自然界中的气体都是实际气体,实际气体的各种状态参数关系复杂。 大量实验证明,当压力较低或温度较高时,分子本身所占据的体积以及分子间相互作用力可以忽略不计,这样的气体可以作为理想气体处理。 理想气体是经过科学抽象的假想气体,如果符合以下条件: 1、气体分子是弹性的; 2、气体分子不占有体积的质点; 3、可以忽略气体分子相互作用力; 可以定义为理想气体。即当实际气体p →0, v →∞的极限状态时,气体为理想气体。 在实际气体分析中,若采用理想气体研究时产生的误差不超过精度范围,就可以认为是理想气体。 工程上常见的气体都可以看作是理想气体。 但是离液态不远的气态物质不能看作是理想气体,如氨,氟利昂等蒸汽,密度比容较大,本身所占据的体积不能忽略,且随着压力的增加,分子平均距离减小,内聚力急剧增大,不能忽略不计,这样的气体就不能按照理想气体处理。 注意:理想气体和实际气体没有明显的界限。 例:空气中的水蒸气可以看作理想气体,而做饭时锅中的蒸汽不能看作是理想气体 2.理想气体状态方程的导出 RT BT N nvBT pv nBT p ==== '32 323 2 式中:N ’——每千克气体的分子数,随分子量的不同而不同,和气体种类有 关; 1).RT pv = (适用于1千克理想气体) 式中:p ——绝对压力,Pa ; v ——比容,m 3 /kg ; T ——热力学温度,K 。 2).m R T pV = (适用于m 千克理想气体)
式中:V ——m kg 气体所占的容积; 3).M R T M p v =(千摩尔容积kmol m kg m kmol kg Mv 3 3:=?) T R pV M 0= (适用于1千摩尔理想气体) 式中:M ——气体的千摩尔质量,㎏/ kmol ; V M ——气体的千摩尔容积,m 3/kmol ; R 0——通用气体常数,J/ kmol ·K ; kmol kmol kg kg B N M R R 个 个= ?= ?=:'320。 4).T nR pV 0= (适用于n 千摩尔理想气体) 式中:V ——n kmol 气体所占有的容积,m 3; n ——气体的摩尔数,M m n = ,kmol 。 5). 2 2 2111T v P T v P = 仅适用于闭口系统 三、气体常数与通用气体常数 通用气体常数:831415 .2734 .22325.1010=?== T PV R M J/Kmol ·K 注意:R 0与气体性质、状态均无关。 气体常数:M M R R 83140= = J/kg ·K 注意:与状态无关,仅决定于气体性质。 思考题1:某种理想气体的体积按照P /α的规律变化,其中α是常数,问气体膨胀时,温度增加还是减小? 例题1:为了检查制冷装置是否漏气,在充入制冷剂前要先进行压力试验,一般是将氮气冲入,然后关闭所有阀门,使得装置成为封闭的容器。假设充气结束时,装置上的压力表显示1Mpa ,温度计显示27℃,24h 后,压力表显示934.5kpa ,温度计显示17℃,,设大气压力为0.1 Mpa ,问系统是否漏气。