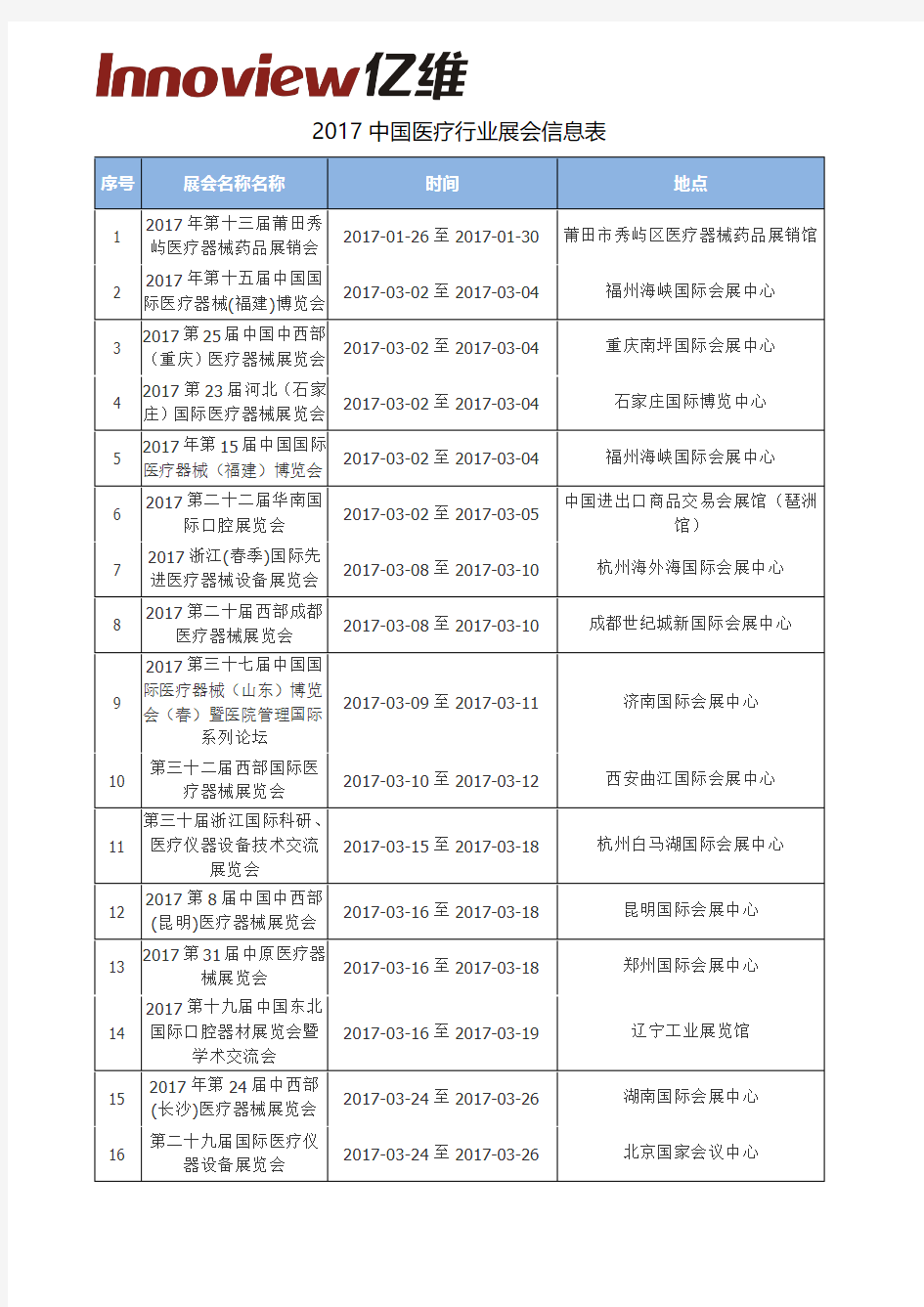

2017中国医疗行业展会信息表
2017年医疗器械相关知识培训试题 姓名: 分数: 一、选择题(每题4分,共20分) 1、( )医疗器械经营企业应当建立质量管理自查制度,并于每年年底前向所在地设区的市级食品药品监督管理部门提交年度自查报告。 A、第一类 B、第二类 C、第三类 D、全部类别 2、进货检查记录与销售记录应当保存至医疗器械有效期后( )年,无有效期的,不得少于5年。 A、1年 B、2年 C、3年 D、5年 3、通过检查的经营企业,其《医疗器械经营许可证》有效期( ) A、5年 B、3年 C、2年 D、1年 4、医疗器械经营企业经营无合格证明文件、过期、失效、淘汰的医疗器械,或者使用未依法注册的医疗器械的( ) A、责令改正 B、没收违法经营的医疗器械 C、货值金额1万元以上的,并处2万元以上5万元以下罚款 D、情节严重的,责令停产停业,直至吊销相关证照 5、库内应实行色标管理,各区色标一般如下:( ) A、合格区与发货区为绿色、不合格区为红色、待验区与退货区为黄色 B、合格区与发货区为绿色、不合格区与退货区为红色、待验区为黄色 C、合格区为绿色、不合格区与退货区为红色、待验区与发货区为黄色 D、合格区、不合格区、待验区、退货区均为黄色 二、多选题(每题5分,共30分) 1、医疗器械经营企业应当从有资质的( )购进医疗器械。 A、生产企业 B、医疗机构 C、个人 D、经营企业 2、《医疗器械经营许可证》事项的变更分为许可事项变更与登记事项变更。许可事项变更包括( )。 A、经营场所、仓库地址 B、经营方式、经营范围 C、法定代表人、企业负责人 D、住所 3、有下列情形之一的,食品药品监督管理部门可以对医疗器械经营企业的法定代表人或者企业负责人进行责任约谈。( ) A.经营存在严重安全隐患的B、经营产品因质量问题被多次举报投诉或者媒体曝光的C、信用等级评定为不良信用企业的 D、食品药品监督管理部门认为有必要开展责任约谈的其她情形 4、有下列情形之一的,由县级以上食品药品监督管理部门责令改正,并按照《医疗器械监督管理条例》第
2017 年医疗器械相关知识培训试题 姓名:分数: 一、选择题(每题 4 分,共20 分) 1、()医疗器械经营企业应当建立质量管理自查制度,并于每年年底前向所在地设区的市级食品药 品监督管理部门提交年度自查报告。 A. 第一类 B. 第二类 C.第三 D. 全部类别 类 2、进货检查记录和销售记录应当保存至医疗器械有效期后()年,无有效期的,不得少 5 年。 于 年年年年 3、通过检查的经营企业,其《医疗器械经营许可证》有效期() 年年年年 4、医疗器械经营企业经营无合格证明文件、过期、失效、淘汰的医疗器械,或者使用未依法注册的医疗 器械的() A. 责令改正 B. 没收违法经营的医疗器械 C. 货值金额 1 万元以上的,并处 2 万元以上5 万元以下罚款 D. 情节严重的,责令停产停业,直至吊销相关证照 5、库内应实行色标管理,各区色标一般如下:() A、合格区和发货区为绿色、不合格区为红色、待验区和退货区为黄色 B、合格区和发货区为绿色、不合格区和退货区为红色、待验区为黄色 C、合格区为绿色、不合格区和退货区为红色、待验区和发货区为黄色 D、合格区、不合格区、待验区、退货区均为黄色 二、多选题(每题 5 分,共30 分) 1、医疗器械经营企业应当从有资质 () 购进医疗器械。 的 A. 生产企业 B. 医疗机构 C. 个人 D. 经营企业 2、《医疗器械经营许可证》事项的变更分为许可事项变更和登记事项变更。许可事项变更包括 ( ) 。 A. 经营场所、仓库地址 B. 经营方式、经营范围 C. 法定代表人、企业负责人 D. 住所 3、有下列情形之一的,食品药品监督管理部门可以对医疗器械经营企业的法定代表人或者企业负责人进 行责任约谈。( ) A. 经营存在严重安全隐患的 B. 经营产品因质量问题被多次举报投诉或者媒体曝光的 C. 信用等级评定为不良信用企业的 D. 食品药品监督管理部门认为有必要开展责任约谈的其他情 形 4、有下列情形之一的,由县级以上食品药品监督管理部门责令改正,并按照《医疗器械监督管理条例》 第六十八条的规定予以处罚:( ) A、经营的医疗器械的说明书、标签不符合有关规定的
医疗质量与安全管理委员会会议记录 为了进一步加强医疗安全管理工作,持续提高医疗服务水平,迎接等级医院的评审,我们完善了院、科两级医疗安全管理组织,围绕基础质量、环节质量、终末质量全面加强了医疗安全工作监管,定期召开相关医疗安全的各专业委员会会议。今天,我们召开今年下半年医疗安全管理委员会会议。 议程: 1、各位科主任结合乡镇卫生院等级医院的评审准备,简要汇报一下上半年的科室工作,针对科室在等级医院评审准备方面、医疗安全、医疗质量方面以及病历质量监控方面存在的问题和整改措施,作一个交流性的发言。 2、医务科主任李长友作上半年医疗安全管理工作的总结,主要从各科按乡镇卫生院等级医院要求安全开展医疗技术 的情况、医疗安全核心制度落实情况、处方与病历质量、抗生素合理应用、投诉处理等方面进行总结,提出具体的整改意见及建议,布置下季度工作。 3、医院管理委员会成员相继发言,院长衣英强总结:刚才,各位科主任对本科室上半年的医疗安全工作作了很好的发言,医务科对上半年的医疗安全管理工作作了总结。在大家的共同努力下,2018年上半年共接受医疗投诉0起,医疗安全管理里工作有所提高,医疗安全方面做得较好,至今没有重大医疗纠纷,也没有较大的经济赔偿,这些成绩,和大家的努力是分不开的。医疗安全管理与持续改进是医院管理的永恒主题,今年,我们在医疗安全常规管理的基础上,结合乡镇卫生院等级医院的评审,加强了病历点评制度,强化了“三基”培训与考核,注重有技术含量的医疗技术的开展,加大了抗感染药物专项整治的力度,进一步加强医患沟通和
投诉接待工作,进一步加强医院安全管理工作,确保医疗安全和安全生产,创建平安、稳定、和谐的医院环境。 并对2018年各科室关于医疗安全的相关工作做了布署:一、医务工作各有关人员在具体工作中一定要有法规意识,要熟练掌握院的有关规章制度,要注重协同配合,共同将医疗安全工作做到位,营造和谐发展的良好环境; 二、强化制度落实,认真执行各项医疗制度,尤其是医疗安全核心制度的落实,巩固基础医疗质量; 三、乡镇卫生院等级评审工作迫在眉睫,由医务科主任李长友主抓医疗安全工作的开展; 四、 五、继续医院管理年工作的深入开展; 六、加强临床抗菌药物的合理使用; 七、将质控工作常态化,医疗质量督查组定期对全院医疗质量进行质控检查,建立初步的质控体系,尽量做到公正、公平。积极主动地为临床一线服务,查找医疗隐患、加强安全意识、提高医疗质量; 八、 九、加强对临床一线医务人员的业务培训,提高医务人员整体素质; 八、质量就是稳定,管理就是沟通,希望各科室在工作中要注意沟通,提高工作效率。 医疗安全贯穿在我们整个的医疗工作之中,卫生部“医疗质量万里行”的主题就是“持续改进质量,保障医疗安全”,科主任要进一步提升自己的医疗质量意识和风险防范意识,承担起管理的职责,从管理的概念上来提高我们的管理水平和风险防范能力。科室管理不能是粗放型的,要精细化管理。作为科主任,对科内哪些病人会有风险要做到心中有数,对危重病人、有基础性疾病的病人、老幼病人、有过敏史的病人等要加倍警惕。要健全预警机制,对存在的问题要敏感,
目录 医疗器械生产企业质量控制与成品放行指南 (2) 医疗器械工艺用水检查要点指南(2014版) (6) 《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号) (36) 《医疗器械使用质量监督管理办法》(国家食品药品监督管理总局令第18号)错误!未定义书签。 医疗器械生产质量管理规范现场检查指导原则 (43) 医疗器械生产质量管理规范 (63) 无菌医疗器械现场检查指导原则 (63) 医疗器械生产质量管理规范 (96) 植入性医疗器械现场检查指导原则 (96) 第一类医疗器械备案资料要求及说明 (135) 国家食品药品监督管理总局关于医疗器械生产经营备案有关事宜的公告(第25号)错误!未定义书签。医疗器械产品技术要求编写指导原则 (168)
医疗器械生产企业质量控制 与成品放行指南 医疗器械生产企业(以下简称企业)应当按照《医疗器械生产质量管理规范》(国家食品药品监督管理总局公告2014年第64号)及其附录的要求,加强对产品实现全过程,特别是采购和生产过程的质量控制以及成品放行的管理,确保放行的医疗器械符合强制性标准以及经注册或者备案的产品技术要求。 一、适用范围 本指南所指质量控制,包括与产品有关的主要原材料、零部件、外协件、中间品、成品、初包装材料、标签等相关的验证/确认/监视/测量/检验/试验活动及其质量管理,也包括与生产过程相关的,特别是与生产过程中关键工序和特殊过程相关的验证/确认/监视/测量/检验/试验活动及其质量管理。本指南所指成品放行,不包括采购物品和中间品的放行程序。企业可以参考医疗器械成品放行的原则,自行制定采购物品和中间品的放行程序。 本指南不包括与生产、检验相关的环境、设施、设备及其相关过程的质量控制与管理,如生产、检验洁净区的环境监测,辅助工艺用水、辅助工艺用气的质量管理等要求。如上述质量控制及其管理活动与采购物品、中间品或成品要求直接相关,则本指南视其为采购物品、中间品或成品相关要求的一部分。 二、质量控制与成品放行 企业应当依据法规要求、风险管理要求、产品技术要求、产品特性、生产规模、工艺特点、质量管理能力等实际,确定产品实现全过程,特别是采购和生产过程的验证/确认/监视/测量/检验/试验的过程和要求。 企业应当针对采购物品、中间品和成品及其相关过程,在医疗器械设计和开发完成后,特别是在设计转换完成后,输出进货检验规程、过程检验规程和成品检验规程等系统全面的质量控制文件,用以指导产品实现全过程,特别是采购和生产过程的质量控制和成品放行工作,确保使用符合要求的采购物品,流转符合要求的中间品,放行符合要求的成品。 (一)采购控制与进货检验
2017年医疗器械相关知识培训试题 姓名:分数: 一、选择题(每题4分,共20分) 1、()医疗器械经营企业应当建立质量管理自查制度,并于每年年底前向所在地设区的市级食品药品监督管理部门提交年度自查报告。 A.第一类 B.第二类 C.第三类 D.全部类别 2、进货检查记录和销售记录应当保存至医疗器械有效期后()年,无有效期的,不得少于5年。 A.1年 B.2年 C.3年 D.5年 3、通过检查的经营企业,其《医疗器械经营许可证》有效期() A.5年 B.3年 C.2年 D.1年 4、医疗器械经营企业经营无合格证明文件、过期、失效、淘汰的医疗器械,或者使用未依法注册的医疗器械的() A. 责令改正 B. 没收违法经营的医疗器械 C.货值金额1万元以上的,并处2万元以上5万元以下罚款 D.情节严重的,责令停产停业,直至吊销相关证照 5、库内应实行色标管理,各区色标一般如下:() A、合格区和发货区为绿色、不合格区为红色、待验区和退货区为黄色 B、合格区和发货区为绿色、不合格区和退货区为红色、待验区为黄色 C、合格区为绿色、不合格区和退货区为红色、待验区和发货区为黄色 D、合格区、不合格区、待验区、退货区均为黄色 二、多选题(每题5分,共30分) 1、医疗器械经营企业应当从有资质的( )购进医疗器械。 A. 生产企业 B. 医疗机构 C. 个人 D. 经营企业 2、《医疗器械经营许可证》事项的变更分为许可事项变更和登记事项变更。许可事项变更包括( )。 A.经营场所、仓库地址 B.经营方式、经营范围 C.法定代表人、企业负责人 D.住所 3、有下列情形之一的,食品药品监督管理部门可以对医疗器械经营企业的法定代表人或者企业负责人进行责任约谈。( ) A.经营存在严重安全隐患的 B. 经营产品因质量问题被多次举报投诉或者媒体曝光的
****医院**外科 医疗质量与安全管理小组月度会议记录 会议时间:2012年8月16日17:00 会议地点:16楼外科示教室 主持人:**主任 参加人员: 医师:**主任医师 护士:**护士长、**主管护师 会议主题一:上月科室重点工作总结回顾 上月我科重点工作为手术安全核查制度和手术风险评估制度。8月6日我科在16楼外科示教室组织了手术安全核查制度和手术风险评估制度的学习、培训与病历抽查分析。手术安全核查是由具有执业资质的手术医师、麻醉医师和手术室护士三方(以下简称三方),分别在麻醉实施前、手术开始前和患者离开手术室前,共同对患者身份和手术部位等内容进行核查的工作。手术安全核查制度和手术风险评估制度也是“患者十大安全目标”的内容,因此属于科室质量与安全管理的重点内容。在抽查的20份手术患者在架病历及归档病历中,均有手术安全核查和手术风险的记录,执行较好,这也是丙级病历的一票否决内容,因此所有病历必须符合要求。但也有不足待改进的地方:例如开始执行手术核查的时候,少部分病人是由先到手术室的研究生或进修生完成的,而本院手术医师到手术室时病人已经准备开始麻醉,进行审核时间较短,因此我科规定凡手术病人必须由本院手术医师与麻醉医师、手术室巡回护士完成,研究生及进修生不得完成这一过程,防止手术差错发生,保证医疗安全,防止医疗事故。会议主题二:上月我科医疗质量与安全考核指标汇总:
会议主题三:科室核心制度与医保执行情况抽查通报 核心医疗制度执行情况 值班与交接班 危重病人的床旁交班做得不规范,交班本上新病人的 交班不全面,描述过于笼统。交班本上没有接班者的 签字,夜班交白班缺乏书面记录。 三级医师负责制 8月因休假各医疗小组医务人员调动重新分配,以医疗 组长、稍低年资副主任医师或者主治及住院医师分为 三级,执行三级医师负责制。病例抽查484107,483784 高淑彬入院录缺职业及工作单位记录,484788 病程记 录已打印无签字。 会诊485630段幼文,缺乏会诊后的处理情况病程记录说明。疑难及死亡病例讨论 8月,科内按惯例,进行疑难病例讨论,病例为,住院 号:480097,,讨论目的为左足坏死平面上移且伴恶臭, 须行手术治疗,讨论手术方式。讨论情况的记录有欠 缺,缺少主任的发言意见,不能特别准确的反应医务 人员的意见。死亡病例为住院号为482401,死亡原因 分析没有单独写明,以后应注意单独罗列重点讨论内 容。三级医师基本能按三级医师负责制开展查房等日 常医疗活动,各种记录基本能每天完成,但是,下级 医师对上级医师的意见把握及记录书写,稍有欠缺, 需要加强各级医师间的沟通。 8月运行病历中基本有危急值记录或者分析不够详细, 没有说明处理或者未作的出来的理由。 ,但病重病危的医嘱下达时间不够及时,除家属强烈 要求放弃抢救者(均有沟通签字)外,均按制度加强 护理及组织抢救工作 危急值报告及应答 8月运行病历中基本有危急值记录,但病程记录缺乏原 因分析,或者分析不够详细,没有说明处理或者未作 的出来的理由。 平均住院日管理 8月的平均住院日为10.5天,比6月增加了2.4天, 比我科计划值高的1.5天,这与病人入院数减少,感 染病例增多有关,应制定相应的处理对策。 超过30天住院 患者管理 8月的超长住院时间的患者人数有5例,与7月收入的 患者以感染患者为主有关,抗感染治疗周期长,治疗 难度大,可能是我科本月超长住院时间患者人次多的 主要原因之一。 危重病人管理 8月科室的危重病人较6月有所增加,病重病危通知等 均及时与家属沟通签字。
《医疗器械注册管理办法》培训试卷 姓名:成绩: 一、单项选择题(40分) 1、《医疗器械注册管理办法》已于( )经国家食品药品监督管理总局局务会议审议通过,现予公布,自( )起施行。 A、2014年6月27日、2014年10月1日 B、2000年6月25日、2000年7月20日 C、2002年6月1日、2004年5月20日 D、 2002年6月25日 2006年7月20日 2、第一类医疗器械实行( )管理。 A、备案 B、注册 C、登记 D、批准 3、、第二类、第三类医疗器械实行( )管理。 A、备案 B、注册 C、登记 D、批准 4、申请第二类、第三类医疗器械注册,应当进行( )检验。 A、备案 B、注册 C、登记 D、批准 5、办理第一类医疗器械备案可提交产品( ) A、注册检验报告 B、委托检验报告 C、型式检验报告 D、自检报告 6、受理注册申请的食品药品监督管理部门应当自受理之日起( )个工作日内将申报
资料转交技术审评机构。技术审评机构应当在( )个工作日内完成第二类医疗器械注册的技术审评工作,在( )工作日内完成第三类医疗器械注册的技术审评工作。 A、3、60、60 B、3、60、90 C、3、90、90 D、3、45、45 7 、境内第二类、第三类医疗器械注册质量管理体系核查,由( )食品药品监督管理部门开展,其境内第三类医疗器械注册质量管理体系核查,由( )食品药品监督管理总局技术审评机构通知相应省、自治区、直辖市食品药品监督管理部门开展核查。 A、省、自治区、直辖市 B、国家 C、县级 D、区级 8、技术审评过程中需要申请人补正资料的,技术审评机构应当一次告知需要补正的全部内容。申请人应在( )年内按照补正通知的要求一次提供补充资料;技术审评机构应当自收到补充资料之日起())个工作日内完成技术审评。 A、1、30 B、1、45 C、1、60 D、2、60 9、医疗器械注册证有效期为()年。 A、3 B、4 C、5 D、6 10、2004年8月9号公布的《医疗器械注册管理办法》(原国家食品药品监督管理局令第16号)()。 A、未废止 B、自2014年9月30日会后废止 B、自2017年10月1日会后废止 二、判断题(40分)
重症医学科医疗质量与安全管理小组会议记录 会议时间:2017年1月26日主持人:xxx 记录人:xxx 地点:xx学科 参会人员:xx主任医师,xx护士长,xx主治医师,xx副主任医师 会议主题:如何降低中心静脉导管感染率 xxx主任:今天我们对中心静脉导管相关血流感染预防策略(2014 年版)进行一次学习。通过学习以提高我们科的中心静脉置管的管理质量。 ICU(重症监护病房)患者出现中心静脉导管相关性血流感染(CLABSI)的风险很高。原因包括多种导管的频繁使用,只用于ICU 患者的特殊类型导管伴有相当大的风险(如带导管导引器的肺动脉导管)。在紧急情况下,需要重复放置导管,而且常常需要长时间放置。对于我科患者,90%以上患者都有留置中心静脉置管,现在患者比较多,感染风险也随之增加,希望通过此次学习加强中心静脉置管的管理,降低导管相关血流感染率。 xxx主治医师:对于指南中提到的独立的危险因素,其中:长期住院、长时间放置导管、颈内静脉置管、中性粒细胞减少症、全肠外营养,这些患者我科常见。对于不合格的导管护理,可以通过培训和学习来避免此类事件的发生。指南中提到的风险降低的相关因素,包括性别因素、抗生素的使用及米诺环素- 利福平涂层的导管。其中涂层导管我们也正在开展使用,对于高风险的患者可以选用此类导管。对于不必要的中心静脉置管尽早拔除。对于必要的中心静脉导管,插入时要遵守操作规范,并要求操作医生能够熟练操作,操作过程中严格执行无菌操作。在进行CVC 插入时,应该有其他具有相应资质的医生,护士或其他医疗卫生工作人员在旁指导,以确保操作的无菌。上述操作中,医护人员如果观察到违反无菌原则的操作,有权终止操作。 xxx护士长:在导管插入之前,操作人员要进行手部清洁。用无水酒精产品或抗菌肥皂和水。使用手套并不能忽略手部卫生。条件允许条件下,肥胖患者应避免采用股静脉中心静脉通路作为导管放置点。虽然指南中说ICU 患者经外周静脉置入中心静脉导管出现感染的风险等同于锁骨下静脉或颈内静脉。但是我科患者PICC的感染率确实比其他导管低,可能与护理操作更加细致有关。其实说明我们在中心静脉置管护理方面仍然有提升的可能。指南中说使用含酒精的洗必泰消毒皮肤。但我院没有此类消毒剂,我们现在应用酒精及碘伏对穿刺部位进行消毒,目前需要强调的是要等到消毒液挥发干净后再进行皮肤穿刺。尽量做到护士相对固定,在换药及操作过程中按照操作规范进行消毒。撤去不必要的导管。 xxx副主任医师:我们目前可以应用超声引导进行中心静脉置管,超声引导下颈内静脉穿刺置管术减少了CLABSI 以及CVC 非感染性并发症的发生。指南要求在CVC 插入过程中,使用最大限度的消毒隔离防护措施。包括所有医疗人员在导管插入过程中都应穿戴面具,帽子,无菌手术衣,无菌手套。病人应该在导管插入过程中全身覆盖无菌洞巾。 xxx主任医师总结:对于患者自身的疾病导致的高风险我们不能控制,但是对于可以控制的风险,我们必须严格进行防控。比如操作前消毒范围要尽量大,操作要尽量做到的最大无菌防护措施,拔除不必要的中心静脉导管,撤除不必要的连接管,不常规换管等。护士操作要遵守无菌操作流程,尽量减少护士的流动,对于特殊患者护士长要做好安排,避免人为的失误而造成的感染的发生。
2017年医疗器械高值耗材行业分析报告
正文目录 药品流通领域格局已定未来将强者恒强 (4) 政策持续加码助推药品流通领域快速整合 (5) 格局已定未来将强者恒强 (9) 高值耗材流通领域整合已拉开序幕 (10) 高值耗材流通领域整合潜力更具想象空间 (11) 整合空间更大 (13) 利润空间更高 (14) 政策持续加码推动高值耗材流通领域逐步整合 (15) 全国范围推行高值耗材统一采购、集中配送 (16) 加大高值耗材流通领域整治力度 (18) 部分省市已陆续试点高值耗材两票制 (19) 群雄并起短期冲规模,长期拼实力 (19) 和佳股份(致新医疗):打造专业的高值耗材供应链管理平台 (20) 瑞康医药:由药品到器械从山东走向全国 (24) 风险提示 (28) 图表目录 图表1:未来五年我国医药流通行业还将保持平稳增长 (4) 图表2:药品流通是我国医药流通领域最大的细分市场 (4) 图表3:全产业链政策指引助推药品流通行业快速整合 (5) 图表4:各省药品集中采购对配送企业、配送范围的要求 (6) 图表5:国家在持续规范整治药品流通企业 (7) 图表6:2016年已有超500家企业被吊销/注销药品GSP认证 (7) 图表7:“两票制”将直接压缩药品流通环节 (8) 图表8:药品流通领域“两票制”正在全国各省陆续推行 (9) 图表9:我国医药流通行业集中度逐年提高 (10) 图表10:药品流通领域的竞争格局已定 (10) 图表11:预计2018年我国医疗器械市场将突破5000亿(出厂口径) (11) 图表12:2014年高值耗材占整个医疗器械市场的比重达16.10% (12) 图表13:我国高值耗材市场规模已突破千亿元 (13) 图表14:高值耗材相比药品具备更高的配送要求 (13) 图表15:高值耗材配送企业的资金周转周期更长 (14) 图表16:医疗器械流通领域市场集中度很低 (14) 图表17:高值耗材流通领域的利润空间更高 (15) 图表18:政策高压将逐步推进高值耗材流通领域整合 (15) 图表19:高值耗材的统一采购平台在全国陆续推行 (17) 图表20:国家逐步加大高值耗材流通领域的整治力度 (18) 图表21:部分省市逐步试点医用耗材两票制 (19) 图表22:高值耗材流通领域的三种整合模式 (20)
2017医疗器械法规试卷 姓名:部门:分数: 一、填空题:(共10题,每题4分) 1.GMP全称: 2.《医疗器械生产许可证》的有效期是年,有效期届满需要延期的,医疗器械生产企业应当于到期前个月向原发证部门提出《医疗器械生产许可证》延期申请。 3.医疗器械标签因位置或大小受限,至少应标志:、、 和或者失效日期,并在标签中明确“其他内容详见说明书”。 4.年度管理评审一年至少次。 5.医疗器械产品的分类依据是 6.质量管理的核心是 7.医疗器械按风险级别分为类管理,我公司产品属于第类医疗器械。 8.《医疗器械生产质量管理规范》(试行)于2009年12月16日颁布, 自起实施。 9.物料的质量状态分为:、、。 10.企业应当建立员工档案,质量管理、验收、库房管理等直接接触医疗器械岗位的人员,应当至少进行一次健康检查。身体条件不符合相应岗位特定要求的,不得从事相关工作。 二、选择题:(共10题,每题4分) 1.()医疗器械生产企业应当建立质量管理自查制度,并于每年年底前向所在地设区的市级食品药品监督管理部门提交年度自查报告。 A.第一类 B.第二类 C.第三类 D.全部类别 2.进货检查记录和销售记录应当保存至医疗器械有效期后()年。 年年年年 3.以下不属于《医疗器械生产质量管理规范》适用范围的是() A.新产品立项 B.特殊过程确认 C.设备安装 D.忠告性通知的发布 4.以下属于《医疗器械生产质量管理规范》对从事影响产品质量的工作人员的要求的是() A.内审员资格 B.具有相关理论知识年以上相关理论知识 D.大专以上学历 5.以下关于产品放行的说法正确的是() A.放行产品应当附有合格证明 B.产品实现所规定的全部过程后,才能对产品进行放行 C.必须经过授权的产品放行人签字 D.以上皆是 6.销售部接到经销商退回的故障产品后,根据《医疗器械生产质量管理规范》的要求,正确的处理方法是() A.给客户进行退换货 B.向经销商询问产品故障原因并记录后,交销售部经理处理
医疗质量管理委员会会 议记录 Document number【AA80KGB-AA98YT-AAT8CB-2A6UT-A18GG】
2015年第四季度医疗质量管理委员会会议记录 12月7日下午,在会议室召开了医疗质量管理委员会会议,会有由主任解建强主持,成员梁辰做出了发言,医疗质量管理委员会成员:王红梅、袁淑辰、石瑞平、张静茹、贾爱平参加了此次会议。 成员梁辰做出了发言:医疗安全贯穿在我们整个的医疗工作之中,卫生部“医疗质量万里行”的主题就是“持续改进质量,保障医疗安全”,科主任要进一步提升自己的医疗质量意识和风险防范意识,承担起管理的职责,从管理的概念上来提高我们的管理水平和风险防范能力。科室管理不能是粗放型的,要精细化管理。作为科主任,对科内哪些病人会有风险要做到心中有数,对危重病人、有基础性疾病的病人、老幼病人、有过敏史的病人等要加倍警惕。要健全预警机制,对存在的问题要敏感,发现问题必须及时报告,决不可隐瞒。结合本次抗菌药物专项整治活动,进一步加强合理用药的管理,把医疗安全管理工作落到实处。 一、医务工作各有关人员在具体工作中一定要有法规意识,要熟练掌握院的有关规章制度,要注重协同配合,共同将医疗安全工作做到位,营造和谐发展的良好环境;二、强化制度落实,认真执行各项医疗制度,尤其是医疗
安全核心制度的落实,巩固基础医疗质量;三、医院“二甲”评审工作迫在眉睫,由医务科科长主抓医疗安全工作的开展;四、继续医院管理年工作的深入开展;五、将质控工作常态化,医疗质量督查组定期对全院医疗质量进行质控检查,建立初步的质控体系,尽量做到公正、公平。积极主动地为临床一线服务,查找医疗隐患、加强安全意识、提高医疗质量;七、加强对临床一线医务人员的业务培训,提高医务人员整体素质;八、质量就是稳定,管理就是沟通,希望各科室在工作中要注意沟通,提高工作效率 医务科 2015年12月7日
XXXX年XX月XX日,为了进一步加强医疗质量,规范医疗行为,消除安全隐患,保障患者就医安全,我院根据“以病人为中心,以提高医疗质量为主题”的医院管理年活动的要求,严格每一项医疗操作,我院以医疗质量委员会第X次会议在X楼X会议室召开,会议由医疗质量委员会主任李映江主持,医疗质量委员会成员全部参加。虽然在全院职工的共同努力下,XXXX年我院各项工作均取得了较好的成绩,没有出现一起医疗纠纷及医疗事故,但在医疗安全上还存在一定的隐患问题,需要我们持续改进。 存在问题: 一、病员反映服务态度欠佳的情况 1、对门诊挂号收费处人员的服务效率和服务态度表示欠满意; 2、药房工作人员的告知说明方面欠详细; 3、门诊医技科(检验科及B超室)工作人员态度生、冷、硬等。 二、主管医生及责任护士查看病人次数不够 1、个别病员反映主管医生每天查房次数不一,有时只有一次,病员想咨询问题或了解情况较难; 2、其它医生的协作精神不够,不是自己只管的病员就不愿意管及回答;
3、护士查看病员时不仔细,只管询问一下“你有啥不舒服的没有?”,随后就走掉了,同时做事马虎,敷衍了事。 三、上级医生查房记录不详细 1、较多病历住院记录中对有鉴别诊断意义的阴性症状欠缺或不够; 2、首次病程记录对诊断依据的记录或描述不够规范,部分缺少鉴别诊断内容; 3、主治医师及以上查房记录流于形式,缺乏对病人个体诊治方案等的针对性分析,缺乏指导意义; 4、部分危重急疑难病人缺少抢救或讨论记录等。 四、抗生素使用不合理 1、住院病人使用抗生素时间较长; 2、由于我院系专科医院,抗生素的品种有限,故使用中有些受局限及欠合理性; 3、围手术期用药欠合理及规范。 五、医患沟通有待进一步落实
《医疗器械基础知识》试卷 姓名:分数: 一、填空题(每空1.5分,共72分) 1.医疗器械是指或者使用于人体的仪器、、、或者其他物品,包括所需的;其用于人体体表及体内的作用不是用、或者的手段获得,但是可能有这些手段参与并起一定的辅助作用。 2. 医疗器械按照风险程度由低到高,管理类别依次分为、、。 3. 医疗器械根据结构特征的不同,分为和。根据是否接触人体,分为和。 4. 如果同一医疗器械适用两个或者两个以上的分类,应当采取其中的分类;由多个医疗器械组成的医疗器械包,其分类应当与的医疗器械一致。 5. 以无菌形式提供的医疗器械,其分类应不低于。 6. 可被人体吸收的医疗器械,按照医疗器械管理。 7.以医疗器械作用为主的药械组合产品,按照医疗器械管理。 8. 我国医疗器械分类目录中共有类代码个。 9. 《医疗器械经营企业许可证》有效期为年。 10.《医疗器械注册证》有效期为年。 11. 医疗器械说明书是指由医疗器械或者制作,随产品提供给用户,涵盖该产品的基本信息,用以指导正确安装、调试、操作、使用、维护、保养的技术文件。 12. 医疗器械说明书和标签的内容应当、、完整、准确,并与相一致。医疗器械说明书和标签的内容应当与或者的相关内容一致。 13. 医疗器械的产品名称应当使用,通用名称应当符合国家食品药品监督管理总局制定的医疗器械命名规则。第二类、第三类医疗器械的产品名称应当与的产品名称一致。
14. 按照医疗器械风险程度,医疗器械经营实施分类管理。经营第一类医疗器械,经营第二类医疗器械实行,经营第三类医疗器械实行。 15. 根据《医疗器械注册管理办法》规定,第一类医疗器械实行。第二类、第三类医疗器械实行。境内第一类医疗器械备案,备案人向食品药品监督管理部门提交备案资料。境内第二类医疗器械由食品药品监督管理部门审查,批准后发给医疗器械注册证。境内第三类医疗器械由审查,批准后发给医疗器械注册证。 16.国食药监械(准/进/许)2012第3650001号中的“准”字适用于;“进”字适用于;“许”字适用于;“2012”代表;“3”代表医疗器械;“65”代表医疗器械;“0001”代表注册流水号。 二、简答题(共28分) 零售企业可以直接向消费者销售,无需办理备案的第二类医疗器械有哪些? 《医疗器械基础知识》试卷答案 一、填空题(每空1.5分,共72分) 1.(单独)(组合)(设备)(器具材料)(软件)(药理学)(免疫学)(代谢) 2.(第一类)(第二类)(第三类) 3.(无源医疗器械)(有源医疗器械)(接触人体器械)(非接触人体器械) 4.(风险程度最高)(包内风险程度最高) 5.(第二类)
×××××××××××医院 医疗质量管理会议记录 会议时间:××年××月××日16:00 会议地点:×× 主持人:医务科主任 参加人员:副院长 医务科主任、院感办主任、医保办主任、财务科科长 各临床科主任、护士长、病案室科员 会议主题一:××月份医疗综合目标考核通报 医务科主任××发言:二甲刚评审完,各科医疗综合考核均较好,××月份平均分均在85分以上。但病历检查情况仍存在问题:普遍为病历书写不及时,缺病程记录;中医辨证分型不正规,应以中华中医药学会印发的《中医常见病诊疗指南》为准;医患沟通记录、病程记录签字不及时,医师自我保护意识不强。科室台账检查时,存在完成不及时情况。 医保办主任××发言:××月份医保质量考核通报已发至医院工作群。医保建立大数据,重点检查住院情况,要求医院医生严格依照住院指针收治,规范诊疗,如实书写病历,不允许出现挂床现在,违规医务人员将予以处罚。 院感办主任××××发言:①传染病报告经培训以能及时上报,××月份无漏报、迟报现象。但报告卡填写不规范,有缺项漏项;字迹潦草,难以辨识,要求必须字迹整洁。②即将进行××年下半
年全院院感知识三基考试,要求45岁以下人员闭卷,45岁以上人员开卷。 医技科主任××××发言:①临床科室加强病原学检查,规范临床抗生素药品的使用。②医生如果要求陪检,要与患者提前沟通定好时间,以免患者在医技科室长时间等候。 医务科主任××××发言:要求于××月××日前各临床科室将质量考核反馈发至医务科。本月工作重点为病历质量检查,检查过程中如发现存在无大病历、无首程或病历缺2个以上病程记录者,处罚主管医师200元/份。 会议主题二:关于规范医院病案管理 会议主题三:关于加强医院药品管理相关规定 会议主题四:中医院医务人员外出进修学习管理规定 副院长××××总结发言:①关于加强病案管理:要求科室人员从病案室借阅病历必须要依照规定执行,填写病案借阅卡,不允许私自借阅。结算处人员禁止外借病历,病历登记结算完全部在病案室归档。病案室做好病历借阅登记工作。②关于加强药品管理:要求科室依照规定借用药品,填写借药卡,不允许个人借药后以药抵药。 ③关于外出进修学习管理:短期学习等,医务人员必须由院领导审批,医务科登记后方可去。长期培训人员,必须签订进修协议。 ④各科室要从思想上加强对医疗质量的认识。强调加强法律法规的学习,加强督查力度,同时加强各类质量管理制度的学习,提高医疗质量,做到诊断有标准,治疗有依据,从而减少乙级病历的产生。
2017年度医疗器械行业研究报告 概述 2017年10月28日,中国药品监督管理研究会、社会科学文献出版社和〈医疗器械蓝皮书》编委会联合发布了中国医疗器械行业发展报告(2017 )》。这是我国医疗器械行业的第一 部蓝皮书。 蓝皮书中指出,从过去几年我国医疗器械行业总体来看,我国医疗器械行业发展势头正猛 规模以上生产企业主营业务收入增速在11.66% —22.20% ,明显高于同期国民经济发展的增幅,并且高端医疗器械研发生产形势喜人,创新产品加速涌现。 2017年被誉为人工智能、大数据、3D打印等为代表的新兴技术融合发展的一年。在新兴 技术的引领下,技术的更迭使得医疗器械行业的竞争加剧。医疗器械行业或迎来新一轮变 革,企业不能再只看重利润,而不注重服务质量的提升。医疗器械虽是制造行而言,但也同样如此。在激烈的竞争下,企业为了寻找新的出路,开始探索新的业务模式。 前沿 按照〈中华人民共和国国民经济和社会发展第十三个五年规划纲要》、《十三五”国家科技创新规划》、《健康中国2030”规划纲要》等总体部署,为加速推进医疗器械科技产业发展,科技部办公制定并发布了《十三五”医疗器械科技创新专项规划》(以下简称规划”)。 根据《规划》的框架和内容,明确了医疗器械行业发展面临的新的战略机遇及目标,提出了 医疗器械前沿技术和重大产品的发展重点。 规划》中指出的具体发展目标有: 1.突破1-3项原始创新技术,10-20项前沿关键技术,形成核心专利300项以上;
2?研发10-20项前沿创新产品,引领筛查预警、早期诊断、微/无创治疗、个体化诊疗、人 工智能诊断、术中精准成像、智慧医疗、中医治未病等新型医疗产品与健康服务技术发 展; 3?重点培育8-10家在国内、国际市场具备较强竞争力的大型医疗器械企业集团 技术企业。 向。 .2017年中国医疗器械行业现状 医疗器械行业属朝阳行业,其规模源于国家和内需的强烈干预 1?生产数量变化 我国生产企业目前大约 1.6万家,经营企业186269万家;增长趋势稳定且高速,在未来几 年内增长数量会明显增多。 生产企业数畳变化 2007 - 2O15^BK1f 企业牝蠻器来垠.CFDA] 生产企业 強音企业 年度 I 类 □类 冊类 Bit 2007 J245 7233 2123 12601 160952 如03 1368 7533 2240 13141 157564 2009 3696 7869 2^11 13876 155765 2010 4015 7906 2416 14337 165203 2011 4051 8174 2405 14630 168596 2012 4095 8247 2586 14928 177788 2013 4218 8804 2676 15698 183809 2014 1966 9355 2843 16169 189S33 2Q15 4080 9317 2903 16300 186269 2?生产企业地区分布图 从地域数量统计来看,医疗器械行业生产企业与其他行业等同 ,支撑国内医疗器械 近60% 产业的产能集中在 华北、华东、华南地区。目前,华北、华南和华东是国内经济基础较为 雄厚的地区,说明未来医疗器械行业的最佳发展落实地也在此 3个地区。 I 生产企业地区分布圏 冥心心问 钿忡叱畑 朽毎底莊疗恭崩亍習牛卢誓业各严喊林诂址计 ,建立8-10 个医疗器械科技产业集聚区 ,80-100 家具有自主核心知识产权且具备一定规模的创新型高 同时,规划》阐述的重点任务包括: 前沿和颠覆性技术重点发展方向、共性关键技术重点 发展方向、重大产品研发重点发展方向 、示范推广重点发展方向、基地建设重点发展方
XXXXXX公司 2017年度《医疗器械监督管理条例》培训试题姓名:岗位:日期:2017.4.15 分数: 一、单项选择(每小题3分,15小题共45分) 1.在中华人民共和国境内从事医疗器械的(),应当遵守本条例。 A、研制、生产、经营、使用、监督管理的单位 B、研制、生产、经营、使用、监督管理的单位和个人 C、生产、经营、使用、监督管理的单位或者个人 D、研制、生产、经营、使用、监督管理的单位或者个人 2.医疗器械,是指() A、直接或者间接使用于人体的仪器、设备、器具、材料或者其他物品,包括所需要的软件; B、直接作用于人体的仪器、设备、器具、材料或者其他物品,包括所需要的软件; C、是指直接或者间接使用于人体的仪器、设备、器具、材料或者其他物品,无形软件除外; D、直接或者间接使用于人体的仪器、设备、器具、材料,包括所需要的软件; 3.第一类医疗器械产品备案,由备案人向所在地()部门提交备案资料。 A.市食品药品监督管理局 B.省食品药品监督管理局 C.国家食品药品监督管理局 4. 国家对医疗器械共分()类进行管理。 A、2 B、3 C、4 D、5 5.《医疗器械生产许可证》有效期()年。 A、2 B、3 C、4 D、5 6.《医疗器械监督管理条例》于2014年2月12日国务院第39次常会会议修订通过,自()起施行。 A、2014年3月7日 B、2014年5月1日 C、2014年6月1日 7. 国家对医疗器械实行分类管理,第三类是指() A、对其安全性、有效性应当加以控制的医疗器械 B、植入人体;用于支持、维持生命;对人体具有潜在危险,对其安全性、有效性必须严格控制的医疗器械 C、通过常规管理足以保证其安全性、有效性的医疗器械 8.()级以上地方人民政府药品监督管理部门负责本行政区域内的医疗器械监督管理工作。 A、县 B、设区的市 C、省、自治区、直辖市 9.医疗器械产品的分类依据() A、《医疗器械分类目录》 B、《医疗器械分类规则》 C、《医疗器械注册管理办法》 10.《医疗器械经营企业许可证》的有效期限为() A、2年 B、3年 C、4年 D、5年 11第一类医疗器械产品备案,不需要进行;而申请第二类、第三类医疗器械产品注册,应当进行的是()。 A、检验 B、临床试验 C、分析评价
医疗质量专题会议记录 为了进一步加强医疗质量,规范医疗行为,消除安全隐患,保障患者就医安全,我院根据“以病人为中心,以提高医疗质量为主题”的医院管理年活动的要求,严格每一项医疗操作,我院以医疗质量委员会在三楼小议室召开,会议由医疗质量委员会主任衣英强主持,医疗质量委员会成员全部参加。虽然在全院职工的共同努力下,2017年我院各项工作均取得了较好的成绩,没有出现一起医疗纠纷及医疗事故,但在医疗安全上还存在一定的隐患问题,需要我们持续改进。 存在问题: 一、病员反映服务态度欠佳的情况 1、对门诊挂号收费处人员的服务效率和服务态度表示欠满意; 2、药房工作人员的告知说明方面欠详细; 3、门诊医技科(检验科及B超室)工作人员态度生、冷、硬等。 二、主管医生及责任护士查看病人次数不够 1、个别病员反映主管医生每天查房次数不一,有时只有一次,病员想咨询问题或了解情况较难; 2、其它医生的协作精神不够,不是自己只管的病员就不愿意管及回答;
3、护士查看病员时不仔细,只管询问一下“你有啥不舒服的没有?”,随后就走掉了,同时做事马虎,敷衍了事。 三、上级医生查房记录不详细 1、较多病历住院记录中对有鉴别诊断意义的阴性症状欠缺或不够; 2、首次病程记录对诊断依据的记录或描述不够规范,部分缺少鉴别诊断内容; 3、主治医师及以上查房记录流于形式,缺乏对病人个体诊治方案等的针对性分析,缺乏指导意义; 4、部分危重急疑难病人缺少抢救或讨论记录等。 四、抗生素使用不合理 1、住院病人使用抗生素时间较长; 2、由于我院系专科医院,抗生素的品种有限,故使用中有些受局限及欠合理性; 3、围手术期用药欠合理及规范。 五、医患沟通有待进一步落实
医院质控科工作职责制度提要: 负责组织协调各相关职能部门对全院临床、医技等科室的医疗质量运行情况进行监督、检查和奖评,并对监督考评结果进行通报。 医院质控科工作职责制度 医疗质量控制科科长工作制度 1.在主管院长和医务护理部部长的领导下,具体组织实施全院医疗质量管理的各项工作,并及时请示、总结和汇报。 2.及时对全院医疗质量管理体系的建设提出意见和建议,确保院、科二级质量管理组织体系的健全性和有效性。 3.负责修订全院医疗服务质量管理目标、计划、方案、措施等,经医疗质量管理委员会或主管院长审批后组织实施。 4.负责对全院员工进行医疗质量、医疗安全管理的教育和培训。 5.组织修订全院临床、医技科室医疗质量规范和标准。 6.负责临床、医技科室日常医疗文书表单的编写和修订。 7.负责组织协调各相关职能部门对全院临床、医技等科室的医疗质量运行情况进行监督、检查和奖评,并对监督考评结果进行通报。 8.及时发现全院各部门医疗质量和医疗安全管理中存在的问题或隐患,并采取有效措施,督促或指导其进行整改,以促进医疗质量持续改进。 9.负责组织编辑和发放《医疗服务质量管理通讯》工作。 10.开展医疗服务质量管理的科学研究工作。 医疗质量控制科科员工作制度 1.遵守国家医疗卫生法律法规,以及医院各项规章制度。 2.服从科长领导,执行科长的决定。 3.负责完成科室各项日常工作和事务。 4.根据科室分工,完成医疗质量管理、控制的各项工作任务。 5.做好各类工作文件、档案、数据、信息的整理和归档管理。 6.完成对各临床、医技、门急诊等科室或部门的医疗质量监控工作。 7.向相关科室或部门做好医院质量管理政策措施的解释工作,并指导各科室完成质量控制任务和目标。 8.及时发现各科室或部门日常工作中存在的医疗质量问题或缺陷,认真记录、归纳总结,并及时向科长汇报。 9.向科长提出工作意见和建议。 10.努力学习医疗质量管理专业理论知识和方法,认真实践、总结和提高。