
全国中小学“教学中的互联网搜索”优秀教学案例评选
教案设计
四、教学方法
采用启发式、合作式、探究式等教学法,通过联想质疑、交流研讨等学生分组讨论以及对表中数据的分析促进学生学习能力的全面发展。
电教手段:flash动画设计、PowerPoint多媒体课件
五、教学过程
【多媒体展示】本节课的教学目标
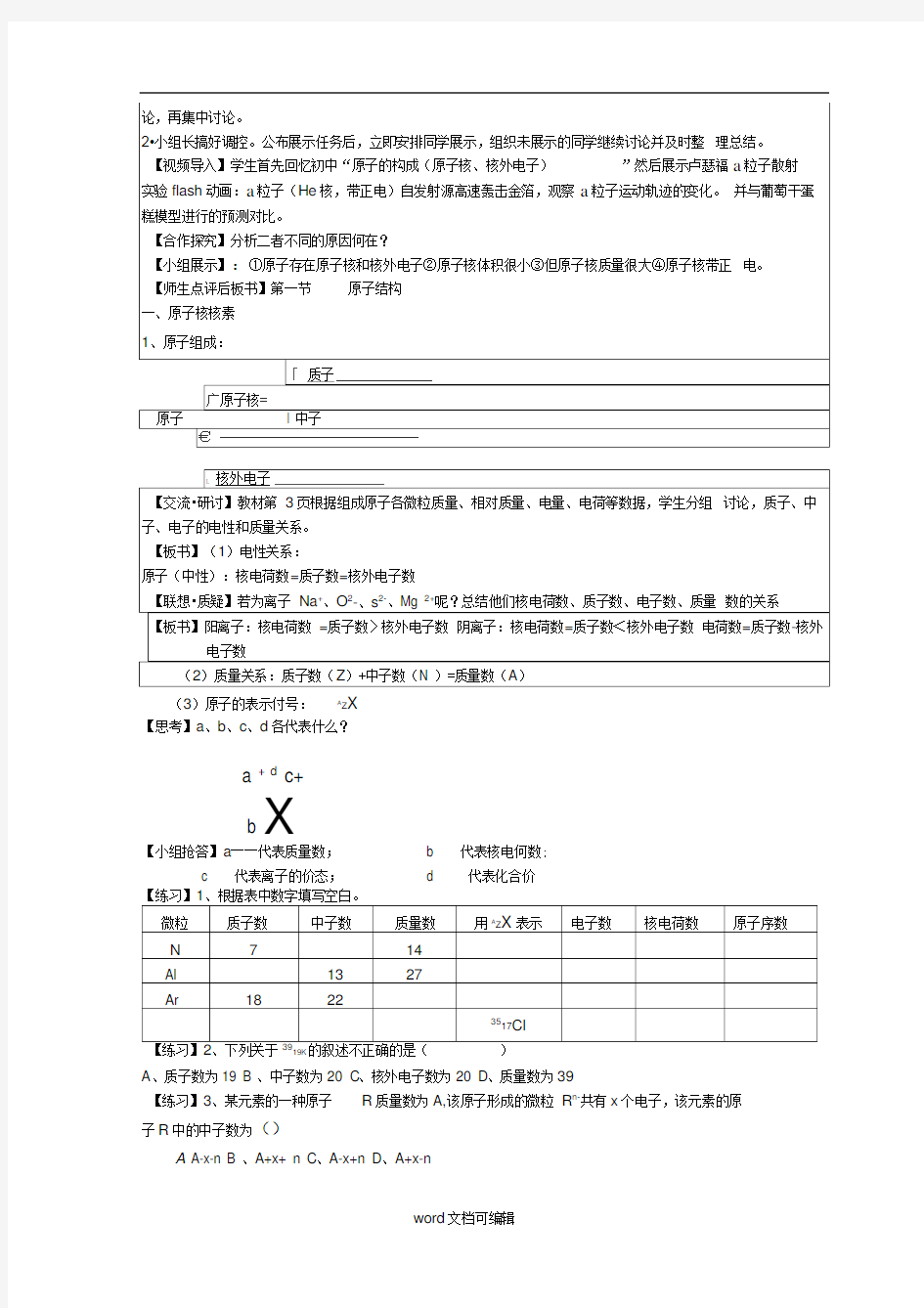
19K
A、质子数为19 B 、中子数为20 C、核外电子数为20 D、质量数为39
【练习】3、某元素的一种原子R质量数为A,该原子形成的微粒R n-共有x个电子,该元素的原子R中的中子数为()
A A-x-n
B 、A+x+ n C、A-x+n D、A+x-n
【练习】4、填写下表
【总结板书】2、核素
⑴、元素:具有相同质子数(核电荷数)的同一类原子的总称。
⑵、核素:把具有一定数目质子和一定数目中子的一种原子称为核素。
⑶、同位素:质子数相同而中子数不同的同一元素的不同核素互为同位素。【合作探究,小组展示】元素、核素、同位素关系图。
【练习】5、下列各组微粒中互为同位素的是()
A C2 和C3
B 4020Ca 和4220Ca
C 、146C 和147N D、金刚石和石墨
144 150 144
【练习】6、我国稀土资源丰富。下列有关稀土元素62 Sm与62 Sm的说法正确的是()A. 62 Sm
150 144 150
与62 Sm互为同位素 B. 62 Sm与62 Sm的质量数相同
144 150 144 150
C. 62 Sm与62 Sm是同一种核素
D. 62 Sm与62 Sm的核外电子数和中子数均为62
【当堂小结】通过本节课的学习,你有哪些收获?你认为本节课的重点是什么?你还有哪些困惑?
当堂检测
1、下列叙述错误的是()
A. 13C和14C属于同一种元素,它们互为同位素
B. 1 H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D. 6 Li和7 Li的电子数相等,中子数也相等
2、和OH-具有不同质子数和相同电子数的微粒是:()
A . F-;
B . Cl -; C. NH ; D . NH-
3、质子数和中子数相同的原子 A ,其阳离子AT 核外共有x 个电子,则A 的质量数为:(
)
6、最近医学界通过用 14C 标记的C 60发现一种C 60的羟酸衍生物,在特定条件下可以通过断裂 DNAI 抑制艾滋病毒的繁殖,则有关
14
C 的正确叙述是( )
A .与12C 60的碳原子化学性质不同
B .与14N 含的中子数相同
12
12
13
C.
是 C 60的同素异形体 D ?与 C 、 C 互为同位素
【学科组长总结评价】总结本节课重点内容,并评价出最佳小组和个人 【课后活动】
1、 花岗岩会产生氡(86222Rn ),从而对人体产生危害。回答:
① 该原子质量数是—,质子数是—,中子数是—。 ②
86222Rn 86220Rn 86219Rn
是:A 同种元素 B 同位素C 同种核素 D 同种原子
2、 预习下一部分:核外电子排布
六、
教学反思
这节课的容量很大,是在我校深入实施高效课堂建设巩固提升活动的背景下实施的一节公开 课教案。强化了学生的主体地位,重视学生学习兴趣的激发,倡导启发式、小组合作式、诱思探 究式教学,努力提高课堂效益。原子结构属于微观领域,看不见摸不着,即使用最先进的隧道显 微镜也只能看到原子,本节内容的抽象性是学生感到困难的原因之一。如何既要解决大容量的教 材内容在一节课完成,又要帮助学生理解一个个疑问,我想了一些办法:①向课前、课后延伸, ②采用问题生成单,及时准确把握学生的困惑,③我还想到用课件来上这节课。制成的课件在每 个班上后,根据学生的反馈不断修改,在教研组的公开课上,总体达成了教学目标。
不过,我觉得有几处需要进一步改进的地方:构成原子各微粒间的关系是本节内容的重点, 我想通过补充练习、强化重点;补充关于原子和阴阳离子的质子数、中子数、电子数、质量数、 核电荷数的关系并辅以课堂随练将有助于强化核心知识点。但反馈花了大量的时间,今后在小组 任务分配上还需要进一步打磨。我想通过这堂课,在以后的班级小组合作中,我还要加强这方面 的训练,找一些更为省时的方法, 学生之间的配合也需要大量的时间去尝试琢磨,
要多“备学生”。
A . 2(x+ n)
B . 2(x-n)
C . 2x
D 4、 若a A n+与b B 2-两种离子的核外电子层结构相同, A 、b + n + 2 B 、b + n - 2 C
5、 某元素一种同位素 X 的原子质量数为 A,含 .2x+ n 则 a 等于( )
、b - n - 2 D 、b - n + 2
N 个中子,它与1H 原子组成 HX 分子。在a g H
中所含质子的量是(
)
B. a ( A N ) mol
C. A
A a /
A. -------------- (A N
A m
a ,
------- (A N) mol A m
m) mol
D. — (A N m) mol A
请提供100字左右个人介绍,个人介绍将会冋案例在百度教育频道进行展示。
必修2第一章物质结构元素周期律 第一节元素周期表第3课时 教学目标: (一)知识与技能: 了解元素周期表的结构以及周期、族等概念;了解周期、主族序数和原子结构的关系 (二)过程与方法: 通过自学有关周期表的结构的知识,培养学生分析问题、解决问题的能力。 (三)情感态度价值观: 通过精心设计的问题,激发学生的求知欲和学习热情,培养学生的学习兴趣。教学重点、难点:周期表的结构;周期、主族序数和原子结构的关系。 教学方法:导学探究法 教学过程: [引入]至今已经发现了100多种元素,人们根据一定的原则将其编排起来,得到了我们现在的元素周期表,而绘制出第一个元素周期表的是俄国化学家门捷列夫。 [板书]三、元素周期表 [讲解]按照元素在周期表中的顺序给元素编号,得到原子序数。在发现原子的组成及结构之 后,人们发现,原子序数与元素的原子结构之间存在着如下关系: [板书]原子序数一核电荷数一质子数一核外电子数 [科学探究] 1?画出1—18号元素原子的结构示意图。 2?认真分析、观察原子结构上有哪些相同点与不同点。 3?将上述1 —18号元素排列成合理的元素周期表,说明你编排的理由。 [板书](一)、元素周期表编排原则: 1、按原子序数递增的顺序从左到友排列。 2、将电子层数相同的元素排列成一个横行。 3、把最外层电子数相同的元素排列成一个纵行。 [过渡]下面我们就一起来研究一下元素周期表的结构,请大家阅读书本第5页的内容。[板书](二)、元素周期表的结构 [指导阅读]1、周期
2?族 主族(_个;用 ________________________ 表示) 族(_个纵行,副族(_个;用_________________________ 表示) ——个族)]第 _____ 族(—个,_______ 列) J ______ 族(—个,_________ 列) 过渡元素:[讲解]周期表中还有些族还有一些特别的名称。例如: 第IA族:碱金属元素第VIIA族:卤族元素0 族:稀有气体元素 [随堂练习] 1.下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是 3?原子序数为x的元素位于周期表中的第n A族,则原子序数为x+ 1的元素可能处在第 () A .川A族 B . I A族C.I B族 D .川B族 4?下列各组原子序数的表示的两种元素,能形成AB2型化合物的是() A.12 和17 B.13 和16 C.11 和17 D.6 和8 5?在下列各元素组中,除一种元素外,其余都可以按某种共性归属一类,请选出各组的例外元素,并将该组其他元素的可能归属,按所给六种类型的编号填入表内。 兀素组例外兀素其他兀素所属类型编号 S、N、Na、Mg P、Sb、Sn、As Rb、B、Te、Fe 素(5 )金属兀素(6)非金属兀素 周期(—个横 行,—个周期) 第1周期 第2周期 第3周期 第4周期 第5周期 -第6周期 第7周期, (共—种元素) (共—种元素) (共_种元素) (共—种元素) (共—种元素) (共—种元素) 目前发现______ 种元素(—个)
原子核物理基础 概论 原子核是原子的中心体。研究这个中心体的性质、特征、结构和变化等问题的一门学科称为原子核物理学。 一、原子核物理的发展简史 1.1886年 Bequenel发现天然放射性。进一步研究表明,放射性衰变具有统计性质;放射性元素经过衰变(α,β, );一种元素会变成另一种元素,从而突破了人们头脑中元素不可改变的观点。 2.1911年 Rutherford α粒子散射实验,由α粒子的大角度散射确定了原子的核式结构模型。 3.1919年α粒子实验首次观察到人工核反应(人工核蜕变)。使人们意识到用原子核轰击另外的原子核可以实现核反应,就象化学反应一样。 4.1932年查德威克中子的发现表明原子核由质子和中子构成,中子不带电荷,易进入原子核引起核反应。 在这件大事中,实际上有我国物理学家的贡献。根据杨振宁先生的一篇文章介绍,我国物理学家赵忠尧在1931年发表了一篇文章,文中预言了中子的存在,但查德威克看了之后未引用,故失去了获得诺贝尔奖的机会。 5.20世纪40年代核物理进入大发展阶段(引用科学史材料): (1)1939年Hahn发现核裂变现象; (2)1942年Fermi建立第一座链式反应堆,这是人类利用原子能的开端; (3)加速器的发展,为核物理理论和核技术提供了各种各样的粒子流,便于进行各种各样的研究; (4)射线探测器技术的提高和核电子学的发展,改变了人类获取实验数据的能力; (5)计算机技术的发展和应用,一方面进一步改进了人们获取数据,处理核数据的能力,另一方面提供了在理论上模拟各种核物理过程的工具。
例如模拟反应堆中中子的减速、慢化过程等物理过程。 二、核物理的主要研究内容 核物理学可以分为理论和应用两个方面。理论方面是对原子核的结构、核力及核反应等问题的研究。同其它基础研究一样,是为了了解自然、掌握自然规律,为更好地改造自然而开辟道路的。另一方面是原子能和各种核技术的应用,包括民用与军用。这两方面的研究相互联系,相互促进,相互推动向前发展。 三、学习中的要求 掌握基本概念、基本规律、基本计算方法,学习思考问题的基本方法等。 四、读物 [日]片山泰久,量子力学的世界,科学出版社,1983。 [美]I.阿西莫夫,原子能的故事,科学出版社,1980。 冯端,冯步云,熵,科学出版社,1992。 阅读科普读物掌握一点常识。
高三物理原子核衰变及半衰期教学设计 40 本资料为woRD文档,请点击下载地址下载全文下载地址3.2 原子核衰变及半衰期 新课标要求 、知识与技能 (1)了解天然放射现象及其规律; (2)知道三种射线的本质,以及如何利用磁场区分它们; (3)知道放射现象的实质是原子核的衰变; (4)知道两种衰变的基本性质,并掌握原子核的衰变规律; (5)理解半衰期的概念。 2、过程与方法 (1)能够熟练运用核衰变的规律写出核的衰变方程式; (2)能够利用半衰期来进行简单计算(课后自学)。 (3)通过观察,思考,讨论,初步学会探究的方法; (4)通过对知识的理解,培养自学和归纳能力。 3、情感、态度与价值观 (1)树立正确的,严谨的科学研究态度; (2)树立辨证唯物主义的科学观和世界观。
教学重点:天然放射现象及其规律,原子核的衰变规律及半衰期。 教学难点:知道三种射线的本质,以及如何利用磁场区分它们及半衰期描述的对象。 教学方法:教师启发、引导,学生讨论、交流。 教学用具:投影片,多媒体辅助教学设备 (一)引入新课 本节课我们来学习新的一章:原子核。本章主要介绍了核物理的一些初步知识,核物理研究的是原子核的组成及其变化规律,是微观世界的现象。让我们走进微观世界,一起探索其中的奥秘!我们已经知道原子由原子核与核外电子组成。 那原子核内部又是什么结构呢?原子核是否可以再分呢?它是由什么微粒组成?用什么方法来研究原子核呢? 人类认识原子核的复杂结构和它的变化规律,是从发现天然放射现象开始的,1896年,法国物理学家贝克勒尔发现,铀和含铀的矿物能够发出看不见的射线,这种射线可以穿透黑纸使照相底片感光。居里和居里夫人在贝克勒尔的建议下,对铀和铀的各种矿石进行了深入研究,又发现了发射性更强的新元素。其中一种,为了纪念她的祖国波兰而命名为钋(Po),另一种命名为镭(Ra)。 (二)进行新课
【课题名称】:原子核的组成 【教材和学情分析】 教材选择了化学史中人类对原子认识的不断深入、原子结构模型的不断演变的过程来引入原子结构的内容,这样安排水到渠成地把学生带入完全的化学微观世界,又为整个专题“化学家眼中的物质世界”作了恰到好处的诠释,同时也为化学2的学习做好铺垫。在初中化学的学习中,学生已经接触过原子的构成和同位素的相关知识,本单元中有关“原子核的组成”的内容就是在这个基础上引导学生让学生明白化学学习和研究必须进入原子、分子等微观世界。 【教学目标】 知识与技能: 了解原子由原子核和核外电子构成,认识、使用符号原子的组成。及质子数、电子数和质量数之间的关系; 过程与方法: 通过阅读教材内容,归纳出其中的一些规律;通过对微观粒子的认识,逐步形成抽象思维。培养学生观察能力、分析综合能力和抽象思维能力;理解原子序数、核电荷数、质子数、中子数、质量数、核外电子数之间的关系;通过复习元素的概念,认识元素、核素、同位素的概念,并区分它们。 情感态度与价值观: 世界的物质性、物质的可分性的辨证唯物主义观点的教育。 【教学重难点】: 质量数、核数、同位素的概念及质子数、中子数、电子数、和质量数之间的关系 【教学方法】:启发、诱导、拟人、讲述、练习、比较 【教学过程】: 【回顾提问】:通过前面的学习我们已经知道原子是可以再分的,它可以被分为原子核和核外电子。 【回顾提问】:上节课我们学习了原子核外电子的排布。我们了解到了原子组成是什么样的呢?(学生回答) 原子核 【板书】原子 【引入】仅仅知道原子可以再分,是不是就可以满足人类不断探索,不断进取的求知欲
呢? 【情境创设】: 1.据报道,人类研制出了在一些西方阴谋家眼中具备“摧毁地球”能力的大型强子对撞机(LHC)。新型加速器——大型质子对撞机(LHC)能重新建立一些条件,其中包括能量 密度——在约150亿年前宇宙诞生之后仅仅10亿分之一秒宇宙中存在的能量密度。有些人 甚至认为它能造成人造黑洞并毁灭地球,当然,这是不可信的。 2.中子星的密度为10的11次方千克/立方厘米,也就是每立方厘米的质量竟为一亿吨之巨!在中子星里,压力是如此之大(白矮星中的简并电子压再也承受不起了:电子被压缩 到原子核中,同质子中和为中子)使原子变得仅由中子组成。(而整个中子星就是由这样的 原子核紧挨在一起形成的。可以这样说,中子星就是一个巨大的原子核。中子星的密度就是 原子核的密度) 【过渡】例子中所说的质子,中子又是怎样的粒子呢?他们和原子核又有怎样的联系呢。 前面我们主要研究对象是核外电子这部分,那么本节课我们将把目光对准对原子核部分 进行剖析(圈出板书上的“原子核”),探寻原子核内部的组成。 【陈述】其实,早在20世纪,卢瑟福也和我们一样把目光投向了原子核。他的想法其实很简单,就是打破原子核去观察内部的结构。就跟我们打破鸡蛋的壳可以观察到鸡蛋的内部一样。当然,对于微观粒子,我们不可能直接去打破,卢瑟福采用了α粒子轰击N原子核的实验方法,最终发现了质子。 1918年他任卡文迪許實驗室主任時,用α粒子轟擊氮原子核,注意到在使用α粒子轰击氮气时他的闪光探测器纪录到氢核的迹象(碳核+氢核)。卢瑟福认识到这些氢核唯一可能的来源是氮原子,因此氮原子必须含有氢核。他因此建议原子序数为1的氢原子核是一个基本粒子。盧瑟福發現質子以後,又預言了不帶電的中子存在。后来,查德威克通过研究约里奥·居里夫妇石蜡在“铍射线”照射下产生大量质子实验,发现了卢瑟福所预言的中子,发现了这是一种不带电荷的粒子。 质子(+) 原子核(+) 【板书】原子中子(0) 核外电子(-) 【自主学习】同学们请观察教材上的表1-7,注意电子,质子,中子的电荷,质量和相 对质量的大小。相对质量的概念可以参考课本本页下方的注释。
★第三课时 [板书]第三节元素周期表(第三课时) [师]前面我们学习了元素周期表的有关知识,知道了门捷列夫在元素周期律的发现及元素周期表的编制过程中,做出了杰出的贡献。那么,引起元素性质周期性变化的本质原因是什么门捷列夫当时怎样认为的 [生]引起元素性质周期性变化的本质原因是原子序数的递增,而门捷列夫认为元素的性质是随着相对原子质量的递增而呈周期性变化的。 [师]不但门捷列夫是这样认为的,在他之前的纽兰兹、迈耶尔、德贝莱纳等在探索元素周期律时也是以此为标准的。与他们不同的是:门捷列夫并没有机械地完全相信当时所测定的相对原子质量数值,从而,使元素周期表的编制出现了质的飞跃。 这也说明,相对原子质量的测定在化学发展的历史进程中,具有十分重要的地位。正如我国著名化学家傅鹰先生所说:“没有可靠的原子量,就不可能有可靠的分子式,就不可能了解化学反应的意义,就不可能有门捷列夫的周期表。没有周期表,则现代化学的发展特别是无机化学的发展是不可想象的。” 那么,元素周期表中各元素的相对原子质量是怎样得出来的呢 [生]元素原子的质量与一种碳原子质量的1/12的比值。 [师]这里的“一种碳原子”指的是哪种碳原子呢 [生]是原子核内有6个质子和6个中子的一种碳原子,即碳—12原子。 [师]元素周期表中各元素的相对原子质量真的是这样计算出来的吗要想知道究竟,我们还须了解以下两个概念。 [板书]四、核素、同位素 [师]我们以前学过元素,即具有相同核电荷数(即质子数)的同一类原子的总称。知道同种元素原子的原子核中质子数相同。那么,它们的中子数是否相同呢 科学研究证明,同种元素原子的原子核中,中子数不一定相同。如组成氢元素的氢原子,就有以下三种: [投影展示] 三种不同的氢原子 原子符号质了数中子数氢原子名称和简称 ①1 1H 氕(H) ②2 1H 氘(D) ③3 1H 氚(T) [问]1 1H、3 1 H分别表示什么 [生]1 1H表示一个质量数为1、质子数为1的原子;3 1 H表示一个质量数为3、质子数为1的原 子。 [师]根据第一节所写内容,填写表中空白。 [请一个同学把答案填写在胶片上] 答案: 10
元素周期表——核素 人教版《化学2》第9至10页 1 课程标准、教材以及学生分析 1.课程标准和教材分析 对于《元素周期表——核素》的教学,《课程标准》要求知道元素、核素的涵义。活动与探究建议:查阅资料并讨论放射性元素、放射性同位素在能源、农业、医疗、考古等方面的应用。《课程标准教学要求》(江苏)提出这样的学习要求,知道元素、核素、同位素、质量数的涵义。 人教版《化学2》根据新课标要求和新课改精神,必修内容要求学生具备化学学科的基本知识,具备必须的学科素养。化学是在原子、分子水平上研究物质组成、结构、性质及其变化和应用的科学。要研究物质的宏观性质,必须从微观粒子入手,才能寻找到原因。核素这部分知识内容属于结构理论的基础知识,理解难度并不大,学生通过本节了解原子构成、核素、同位素概念,了解质子数、中子数和质量数间的关系,为后续元素周期律的学习打好基础。同时通过本节内容的学习,学生对结构理论有初步的了解,为进一步学习选修内容做好铺垫。 2.学生分析 学生在九年级化学学习中,已经学习了原子的构成和原子的相对原子质量,知道构成原子的粒子以及它们的电性和相对质量,知道相对原子质量是以一种碳原子质量的1/12为标准的。在学习核素之前,学习了元素周期表,碱金属元素和卤族元素的主要性质等知识,学生对元素周期表有了初步的了解,并对碱金属元素和卤族元素为代表的同主族元素性质的相似性和递变性有了初步的认识。本课教学内容起点低,强调知识与应用的融合,让学生在已有知识的基础上,一方面进一步深化认识原子的构成,使学生知道核素、同位素等涵义,并知道同位素和同素异形体的区别。另一方面从同位素在生活、工农业生产、科研、考古等方面广泛应用出发,介绍同位素的放射性,再从同位素的放射性角度分析接触和使用它的风险性,让学生分析如何进行风险的预防控制和一旦发生事故的应急处理,完善学生的认知结构,提升学生对知识的应用能力。 2 教学目标
课时1 原子核 核素 目标与素养:1.了解原子的结构。(微观探析)2.知道质量数和A Z X 的含义,掌握构成原子的各微粒间的关系。(微观探析) 3.了解元素、核素、同位素的含义。(宏观辨识与微观探析) 一、原子的构成 1.原子及构成微粒 原子??? 原子核? ?? ?? 质子:带有一个单位正电荷中子:不带电核外电子:带有一个单位负电荷 对于一个确定的原子存在关系: 核电荷数=核内质子数=核外电子数。 2.质量数
3.原子的表示方法 一般用符号A Z X 表示,字母表示意义如下: 表示质量数——A 表示质子数——Z X ——表示元素符号 如37 17Cl 表示质量数为37、质子数为17、中子数为20的氯原子。 微点拨:(1)原子中不一定含有中子,且中子数不一定等于质子数,如1 1H 。 (2)同种元素的原子与其相应离子的质量数相等,如23 Na 与 23 Na + 。 二、核素 1.元素 具有相同质子数(核电荷数)的同一类原子的总称。 2.核素 具有一定数目质子和一定数目中子的一种原子。 3.同位素 质子数相同而中子数不同的同一种元素的不同核素互为同位素。 如氢元素的三种核素 11 H 21 H 31 H 俗称 - 重氢 超重氢 符号 H D T 质子数 1 1 1 中子数 1 2 4(1)作为相对原子质量和阿伏加德罗常数测定用的标准原子为 12 6 C ;考古中常测量14 6C 的数量来推断生物体的存在年代。 (2)制造氢弹的原料为2 1H 、3 1H 。 (3)核反应堆的燃料是235 9292U 。 微点拨: 同位素的两个特点 (1)相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。 (2)天然存在的某种元素,不论是化合态还是游离态,各种同位素所占的原子个数百分比
《原子核的组成》教案 第一课时 一、教学目标 1.在物理知识方面要求. (1)了解原子核的人工转变.了解它的方法和物理过程. (2)了解质子和中子是如何被发现的. (3)会写核反应方程式. (4)了解原子核的组成,知道核子和同位素的概念. 2.掌握利用能量和动量守恒的思想来分析核反应过程.从而培养学生运用已知规律来分析和解决问题的能力. 3.通过发现质子和中子的历史过程,使学生认识通过物理实验研究和探索微观结构的研究方法及体会科学研究的艰巨性和严谨性. 二、重点、难点分析 1.重点是使学生了解原子核的人工转变和原子核的组成.在原子核的人工转变中发现了质子和中子,它是确定原子核组成的实验基础. 2.用已经学过的能量和动量守恒以及有关的知识来分析核反应过程,是本节的难点.三、教具 1.分析卢瑟福做的“α粒子轰击氮原子核的实验”. 2.讲解约里奥·居里和伊丽芙·居里夫妇做的“用来自铍的射线去轰击石蜡的实验”. 用投影幻灯、投影片. 四、主要教学过程 (一)引入新课 复习提问: 1.什么是天然放射现象?天然放射性元素放射出哪几种射线?这些射线的成分是什么? 天然放射现象说明原子核存在着复杂的内部结构,为了了解原子核的组成,人们开始寻找研究原子核组成的有效方法,那就是原子核的人工转变. (二)教学过程设计 1.质子的发现. (1)原子核的人工转变. 是指为了了解原子核的组成,人们有目的的用高速粒子去轰击某些元素的原子核,通过对核反应过程及其产生的新粒子的研究,了解原子核的内部结构和粒子的本质及特点.
(2)α粒子轰击氮原子核的实验. 1919年,卢瑟福做了用α粒子轰击氮原子核的实验,第一次实现了原子核的人工转变,有了很重要的发现. 实验装置如图1所示(用投影幻灯打出装置的示意图),容器C中放有放射性物质A,从A射出的α粒子射到铝箔F上,适当选取铝箔的厚度,使α粒子恰好被它完全吸收而不能透过,在F 后面放一荧光屏S,用显微镜M观察荧光屏. 实验现象:当在荧光屏上恰好观察不到闪光后,通过阀门T往容器C里通入氮气,此时卢瑟福从荧光屏S上又观察到了闪光. 实验结论:实验表明,闪光一定是α粒子击中氮核后产生的新粒子透过铝箔引起的. (3)质子的发现. 讨论提问:引导学生用已经学过的知识分析怎样知道新粒子的性质. ①若想知道新粒子的性质,必须测出粒子的什么有关物理量? 归纳得到:测出粒子的电性、电量、质量和速度等. ②用什么方法可以知道新粒子的电性? 归纳得到:可将粒子引入电场或磁场中,观察粒子的偏转轨迹. 如图2所示,在匀强电场中粒子的轨道是抛物线,若粒子向下偏转,说明粒子带正电;若向上偏转,说明粒子带负电. 如图3所示,在匀强磁场中粒子的轨道是圆,若粒子向上做圆运动,说明粒子带正电,若粒子向下做圆运动,说明粒子带负电. 实验证明:这个新粒子带正电. ③用什么方法可测出粒子的速度? 归纳得到:使粒子通过一个正交的电磁场,如图4所示,调节B或E的值,使粒子在正交场中,沿入射方向做匀速直线运动,则可知此时
绝密★启用前 【原创精品】高中化学人教版 必修2 第一章 物质结构 元素 周期律 第一节 元素周期表 核素 试卷副标题 注意事项: 1.答题前填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上 第I 卷(选择题) 请点击修改第I 卷的文字说明 一、单选题 1.下列叙述正确的是( )。 A.40 K 和40 Ca 原子中的质子数和中子数都相等 B.某元素原子最外层只有一个电子,则它一定是第ⅠA 族元素 C.任何原子或离子的组成中都含有质子 D.同位素的不同核素物理、化学性质完全相同 2.下列各组物质中,互为同位素的是( )。 A.重氢、超重氢 B.氧、臭氧 C.红磷、白磷 D.H 2O 、D 2O 3.现有5种微粒,分别是XZQ +R 2+ M,它们所属的元素种类是( )。 A.2 B.3 C.4 D.5 4.重水(D 2O)是重要的核工业原料,下列说法错误..的是( )。 A.氘(D)原子核外有1个电子 B.1 H 与D 互为同位素 C.H 2O 与D 2O 互为同素异形体 D.1O 与O 的相对分子质量相同 5.已知R 2+ 有b 个中子,核外有a 个电子,表示R 原子符号正确的是( )。 A .b R B . 2a b R +- C . 2a b R ++ D . a b R +
○………※※订※※线○………6.已知自然界中氧的同位素有16O 、17O 、18 O,氢的同位素有H 、D 、T,从水分子的原子组成来看,自然界中的水一共有( )。 A.9种 B.12种 C.18种 D.24种 7.I 是常规核裂变产物之一,可以通过测定大气或水中I 的含量变化来检测核电站是否发生放射性物质泄漏。下列有关I 的叙述中错误..的是( )。 A .I 的化学性质与I 相同 B .I 的原子序数为53 C .I 的原子核外电子数为78 D .I 的原子核内中子数多于质子数 8.下列关于X 与X + 两种粒子的叙述中正确的是( )。 A.质子数一定相等,电子数一定不同 B.化学性质几乎相同 C.一定由质子、中子和电子构成 D.核电荷数、核外电子数一定相同 9.科学家第一次实现人工转变元素是从如下核反应开始的NHe OH,下列叙述正确的 是( )。 A .O 原子核内有9个质子 B .H 原子核内有1个中子 C.O 2和O 3互为同位素 D.14 NH 3和O 具有相同的质子数 10.2013年2月朝鲜进行了第三次核试验,引起国际社会的极大关注U 是一种重要的核燃料,其原子核内中子数为( )。 A.92 B.235 C.143 D.327 11.与铂同族的贵金属钯(Pd)有多种核素。下列关于Pd 、Pd 的说法正确的是( )。 A.中子数相同,化学性质不同 B.质子数相同,互为同位素 C.核外电子数不同,是同一种元素 D.质量数不同,性质完全相同 12.核磁共振(NMR)技术已广泛用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR 现象。试判断下列哪组原子均可以产生NMR 现象( ) 18 19 24 12 31 27
学业要求核心素养对接 1.了解质量数的定义。 2.了解原子的表示方法。 3.了解原子的核外电子能量高低与分层排布的关系。 4.了解核外电子分层排布的规律。 5.知道元素、核素的概念。 通过原子结构的学习、通过对 核外电子排布规律的学习,提 高学生宏观辨识与微观辨析的 素养水平。 版新教材高中化学第4章第1节第1课时原子结构核素教案新人 教版必修第一册 [知识梳理] 知识点一原子的构成、质量数 如图1:原子结构的发现史,通过本图我们可以知道原子结构的认知是逐步深入的,图2表示原子结构,结合本图完成下列知识点: 1.原子的构成 (1)构成 原子 ?? ? ??原子核 ?? ? ??质子(相对质量近似为1,带一个单位正电荷) 中子(相对质量近似为1,不带电荷) 核外电子(带一个单位负电荷) 原子显电中性 (2)原子的表示方法 →元素符号,如3717Cl表示质量数为37、核电荷数为17的氯原子。
阳离子:质子数>核外电子数阴离子:质子数<核外电子数 2.质量数 (1)质量数 质子和中子的相对质量都近似为1,忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值相加所得的数值即为质量数,用符号A表示。 (2)两个关系 ①质量数(A)=质子数(Z)+中子数(N)(质量关系)。约为相对原子质量 ②原子序数=核电荷数=质子数=核外电子数(数量关系)。 知识点二原子核外电子的排布 如图所示,核外电子在原子核外的排布规律是用电子云来表示的,在高中阶段为了好理解,出现了最后一图排布方式,结合上图,完成下列知识点: 1.核外电子的分层排布 在多电子的原子里,电子的能量并不相同。能量低的,通常在离核近的区域运动;能量高的,通常在离核远的区域运动。核外电子的分层运动,又叫核外电子的分层排布。其关系如下: 2.原子核外电子的排布规律 尝试自己写一下Na的核外电子排布 知识点三核素、同位素
第十九章原子核 新课标要求 1.内容标准 (1)知道原子核的组成。知道放射性和原子核的衰变。会用半衰期描述衰变速度,知道半衰期的统计意义。 (2)了解放射性同位素的应用。知道射线的危害和防护。 例1 了解放射性在医学和农业中的应用。 例2 调查房屋装修材料和首饰材料中具有的放射性,了解相关的国家标准。 (3)知道核力的性质。能简单解释轻核与重核内中子数、质子数具有不同比例的原因。会根据质量数守恒和电荷守恒写出核反应方程。 (4)认识原子核的结合能。知道裂变反应和聚变反应。关注受控聚变反应研究的进展。 (5)知道链式反应的发生条件。了解裂变反应堆的工作原理。了解常用裂变反应堆的类型。知道核电站的工作模式。 (6)通过核能的利用,思考科学技术与社会的关系。 例3 思考核能开发带来的社会问题。 (7)初步了解恒星的演化。初步了解粒子物理学的基础知识。 例4 了解加速器在核物理、粒子物理研究中的作用。 2.活动建议: (1)通过查阅资料,了解常用的射线检测方法。 (2)观看有关核能利用的录像片。 (3)举办有关核能利用的科普讲座。 新课程学习 19.5 核力与结合能 ★新课标要求 (一)知识与技能 1.知道核力的概念、特点及自然界存在的四种基本相互作用; 2.知道稳定原子核中质子与中子的比例随着原子序数的增大而减小; 3.理解结合能的概念,知道核反应中的质量亏损; 4.知道爱因斯坦的质能方程,理解质量与能量的关系。 (二)过程与方法 1.会根据质能方程和质量亏损的概念计算核反应中释放的核能;
2.培养学生的理解能力、推理能力、及数学计算能力。 (三)情感、态度与价值观 1.使学生树立起实践是检验真理的标准、科学理论对实践有着指导和预见作用的能力;2.认识开发和利用核能对解决人类能源危机的重要意义。 ★教学重点 质量亏损及爱因斯坦的质能方程的理解。 ★教学难点 结合能的概念、爱因斯坦的质能方程、质量与能量的关系。 ★教学方法
《元素周期表》(第二课时) 元素周期表教学设计 (40907063 丁胜根) 一、教材分析 物质结构和元素周期律是化学的重要理论知识,也是中学化学教学的重要内容。而元素周期表是元素周期律的具体表现形式,是学习化学的重要工具。元素周期表在初中化学中已有简单介绍,本节书的总体思路是在初中已有知识的基础上让学生学习元素周期表,突出原子结构与元素原子在周期表中的位置关系后,引导学生思考原子结构与元素性质的关系,得出元素性质主要与原子核外电子排布密切相关的结论,最后,引导学生思考原子核与元素的性质是否有关引出核素概念,了解放射性同位素的应用。 在教学时可将本节教材分为三个课时,第一课时主要认识元素周期表的结构以及其与原子结构的关系;第二课时主要探究元素的化学性质与原子结构的关系;第三课时探究元素的化学性质与原子结构的关系,小结元素性质与原子核外电子排布密切相关后,学习核素及同位素概念。 二、学情分析 在人教版九年级上册第四单元物质构成的奥秘中,学生对元素周期表的简介以及原子的核外电子排布等知识已有所了解,从元素周期表中能够获取元素名称、符号、原子序数、原子相对原子质量等信息,知道最外层电子数为8(第一周期为2)的结构化学性质稳定,金属元素最外层电子数一般少于4,反应中易失去电子,非金属元素的最外层电子数一般多于4,反应中易得到电子。结合学生过往已有的知识,本节课将从实验出发,以一系列的实验事实凸显元素的原子结构(尤其是最外层电子数)与化学性质之间的密切联系,丰富学生对元素周期表的认识,深刻理解“元素周期表是学习和研究化学的重要工具”的含义。 教材中对碱金属元素化学性质的探究通过实验归纳得出,这要求学生能够准确描述实验现象并进行对比归纳;对卤族元素化学性质的探究则将实验事实以表格的形式呈现,这对学生处理信息的能力提出了较高的要求,能够从文字中筛选出关键内容进行对比,归纳出“递变性”规律。另外,本节课除了要让学生发现同一主族元素“递变性”外,还要从同一主族元素化学性质的“相似性”归纳出结构与性质的关系,要求学生有较为全面的思维能力,能够充分挖掘未知的潜在性规律。
【课题】§4.2 原子核的衰变 【教学目标】 知识与技能 1、了解天然放射现象的发现过程,知道三种射线的本质,以及区分它们的方法; 2、知道放射现象的实质是原子核的衰变;知道两种衰变的基本性质,并掌握原子核的 衰变规律; 3、理解半衰期的概念及考古工作中的“碳-14测年法”。 过程与方法 1、通过学习科学家发现探究天然放射现象的过程,理解天然放射现象的实质以及规律。 2、通过练习,使学生掌握书写原子核的衰变方程式表示核衰变的规律,能够利用半衰 期来进行简单计算。 3、通过阅读,了解研究放射性元素的半衰期在考古工作中的“碳-14测年法”。 情感、态度与价值观 1、体验科学家在科学研究中严谨的工作态度和作风,树立严谨细致的治学态度; 2、通过学习树立辩证唯物主义的科学观和世界观,树立为人类造福的价值观。 【教学重点】 学习理解天然放射现象的实质,理解其规律:原子核的衰变规律及半衰期。 【教学方法】 读书自学法 + 指导性讲授 【教学过程】 19世纪末的三大发现: 1895年伦琴发现了X射线; 1896年贝克勒尔发现了天然放射性; 1897年J·J·汤姆生发现了电子。 这就是说,关于原子核的实验研究实际上在19世纪末已经开始,这就是贝克勒尔关于天然放射性的发现,以及居里夫妇和卢瑟福对射线的研究。 为什么这样说?因为后来才知道他们对天然放射现象的研究已经触及到原子核的结构及其变化问题了。 下面我们看看什么是天然放射现象,其实质是什么?看看它遵循什么规律? 指导学生阅读教材P.70\ 贝克勒尔的偶然发现
?放射性元素普查 居里夫人的研究 居里夫人的发现 教师小结,并明确讲解如下概念: 天然放射现象 放射性 放射性元素 指导学生阅读教材P.66~67: ?“三剑客”姓甚名谁 ?“三剑客”的本领 教师小结,并明确讲解如下结论: 1、这些射线是从原子核内发射出来的。α射线是粒子流,α粒子就是氦原子核,电荷数为2,质量数为4;β射线是高速运动的电子流;γ射线是波长很短的电磁波。 2、三种射线的性质: α射线: β射线: γ射线: 先让学生阅读P.72d的相关内容,然后老师精讲,明晰概念和规律 1、原子核的衰变:原子核由于放出某种粒子而转变成新核的变化,叫做原子核的衰变。 2、α衰变:放出α粒子的衰变叫做α衰变。
第3课时 [板书]第三节元素周期表(第三课时) [师]前面我们学习了元素周期表的有关知识,知道了门捷列夫在元素周期律的发现及元素周期表的编制过程中,做出了杰出的贡献。那么,引起元素性质周期性变化的本质原因是什么门捷列夫当时怎样认为的 [生]引起元素性质周期性变化的本质原因是原子序数的递增,而门捷列夫认为元素的性质是随着相对原子质量的递增而呈周期性变化的。 [师]不但门捷列夫是这样认为的,在他之前的纽兰兹、迈耶尔、德贝莱纳等在探索元素周期律时也是以此为标准的。与他们不同的是:门捷列夫并没有机械地完全相信当时所测定的相对原子质量数值,从而,使元素周期表的编制出现了质的飞跃。 这也说明,相对原子质量的测定在化学发展的历史进程中,具有十分重要的地位。正如我国著名化学家傅鹰先生所说:“没有可靠的原子量,就不可能有可靠的分子式,就不可能了解化学反应的意义,就不可能有门捷列夫的周期表。没有周期表,则现代化学的发展特别是无机化学的发展是不可想象的。” 那么,元素周期表中各元素的相对原子质量是怎样得出来的呢 [生]元素原子的质量与一种碳原子质量的1/12的比值。 [师]这里的“一种碳原子”指的是哪种碳原子呢 [生]是原子核内有6个质子和6个中子的一种碳原子,即碳—12原子。 [师]元素周期表中各元素的相对原子质量真的是这样计算出来的吗要想知道究竟,我们还须了解以下两个概念。 [板书]四、核素、同位素 [师]我们以前学过元素,即具有相同核电荷数(即质子数)的同一类原子的总称。知道同种元素原子的原子核中质子数相同。那么,它们的中子数是否相同呢 科学研究证明,同种元素原子的原子核中,中子数不一定相同。如组成氢元素的氢原子,就有以下三种: [投影展示] 三种不同的氢原子 原子符号质了数中子数氢原子名称和简 称 ①1 H氕(H) 1 ②2 H氘(D) 1 ③3 H氚(T) 1
高三物理教案原子核衰变及半衰期 原子核衰变及半衰期 新课标要求 1、知识与技能 (1)了解天然放射现象及其规律; (2)知道三种射线的本质,以及如何利用磁场区分它们; (3)知道放射现象的实质是原子核的衰变; (4)知道两种衰变的基本性质,并掌握原子核的衰变规律; (5)理解半衰期的概念。 2、过程与方法 (1)能够熟练运用核衰变的规律写出核的衰变方程式; (2)能够利用半衰期来进行简单计算(课后自学)。 (3)通过观察,思考,讨论,初步学会探究的方法; (4)通过对知识的理解,培养自学和归纳能力。 3、情感、态度与价值观 (1)树立正确的,严谨的科学研究态度; (2)树立辨证唯物主义的科学观和世界观。 教学重点:天然放射现象及其规律,原子核的衰变规律及半衰期。 教学难点:知道三种射线的本质,以及如何利用磁场区分它们及半衰期描述的对象。 教学方法:教师启发、引导,学生讨论、交流。
教学用具:投影片,多媒体辅助教学设备 (一)引入新课 本节课我们来学习新的一章:原子核。本章主要介绍了核物理的一些初步知识,核物理研究的是原子核的组成及其变化规律,是微观世界的现象。让我们走进微观世界,一起探索其中的奥秘!我们已经知道原子由原子核与核外电子组成。那原子核内部又是什么结构呢?原子核是否可以再分呢?它是由什么微粒组成?用什么方法来研究原子核呢? 人类认识原子核的复杂结构和它的变化规律,是从发现天然放射现象开始的,1896年,法国物理学家贝克勒尔发现,铀和含铀的矿物能够发出看不见的射线,这种射线可以穿透黑纸使照相底片感光。居里和居里夫人在贝克勒尔的建议下,对铀和铀的各种矿石进行了深入研究,又发现了发射性更强的新元素。其中一种,为了纪念她的祖国波兰而命名为钋(Po),另一种命名为镭(Ra)。 (二)进行新课 1、天然放射现象 (1)物质发射射线的性质称为放射性(radioactivity)。元素这种自发的放出射线的现象叫做天然放射现象,具有放射性的元素称为放射性元素。 (2)放射性不是少数几种元素才有的,研究发现,原子序数大于82的所有元素,都能自发的放出射线,原子序数小于83
第4课时 核 素 三维目标 知识与技能 1.了解核素、同位素、质量数等概念。 情感、态度与价值观 1.通过探究、分析,培养学生创新思维能力。 2.培养理论联系实际的能力。 要点提示 教学难点 质量数、同位素、核素的概念。 教具准备 多媒体课件、实物投影仪、试管、烧杯、胶头滴管;新制饱和氯水、NaBr 溶液、KI 溶液、CCl 4、苯、溴水。 教学过程 导入新课 师:通过前面学习,我们已经知道元素的性质与原子核外电子,尤其是最外层电子数有密切关系,那么,同学们是否会联想到元素的性质与原子核有无关系? 请同学们回忆初中定义:相对原子质量的标准是什么?C12是什么含义? 多媒体展示: 原子的构成 X A Z 师:实验证明原子的质量主要集中在原子核上,如果忽略电子的质量,取质子和中子的相对质量都近似为1,把核内所有质子和中子的相对质量(取近似整数值)相加,所得到的数叫质量数,它是原子的一个重要性质。我们可以用“A”表示。好,同学们现在知道C-12中12的含义了吧! 生:(齐声)知道!它表示C 原子的质量数。 多媒体展示:构成原子的三种粒子比较 1.构成原子的三种粒子比较
师:请同学看书P 10表:氢元素的原子核,由此,能得出什么结论? 生1:氢元素的原子核中,质子数相同,都是1,但中子数各不相同。 生2:原子名称也不一样。 生3:元素符号相同,都含“H”,但原子符号不相同。 师:很好,同学们观察得很仔细。 师:研究表明,与氢元素的原子核相似,同种元素的原子核中,质子数相同,中子数不一定相同,我们把具有一定数目质子和一定数目中子的一种原子叫做“核素”。 师:同学们在日常生活中可听说过“同位素”这一名称?我们班有没有家长在医院工作的同学? 生:(齐声)有两个同学家长在医院工作!×××和×××。 生:听说过“同位素”这个名词,医院里利用放射性同位素给肿瘤病人治疗——即常说的“放疗”。 师:请坐,那么,同学们,你确切知道什么叫“同位素”吗?它有哪些性质?具有哪些重要的用途?好,请同学们看书,说明同位素的含义。 板书:二、核素 1.核素 2.同位素 [知识拓展] 1.天然同位素无论是在单质还是化合物中原子所占的百分比一般不变。 2.同位素原子物理性质不同,但化学性质几乎完全相同,例如: 2211H +O 2====2O H 211;2221H +O 2====2O H 22 1
元素周期表第3课时-精品 2020-12-12 【关键字】方法、质量、认识、问题、难点、有效、密切、深入、合作、掌握、了解、研究、规律、位置、稳定、基础、素质、重点、能力、方式、结构、水平、关系、分析、激发、形成、提高、新知识、中心 第一节元素周期表第3课时 一、教材分析: 化学是在原子、分子水平上研究物质组成、结构、性质及其变化和应用 的科学。要研究物质的宏观性质,必须从微观粒子入手,才能寻找到原因。化学 学科涉及分子、离子、原子、质子、中子、核外电子等多种微观粒子,但最重要 的是原子。只要了解了原子的结构,才可以进一步了解分子、离子结构,进而深 入认识物质的组成和结构,了解化学变化规律。在初中,学生已初步了解了一些 化学物质的性质,因此有必要让学生进入微观世界,探索物质的奥秘。通过本节 了解原子构成、核素、同位素概念,了解质子数、中子数和质量数间的关系,为后续周期律的学习打好基础。 二、教学目标 知识目标: X的含义。 1.明确质量数和A Z 2.认识核素、同位素等概念的含义及它们之间的关系。 能力目标: 提高同学们辨别概念的能力。 情感、态度与价值观目标: 通过对原子结构的研究,激发学生从微观角度探索自然的兴趣。
三.教学重点难点: 重点:明确质量数和A X的含义。 Z 难点:认识核素、同位素等概念的含义及它们之间的关系。 四、学情分析: 同学们在初中已经有了关于原子结构的知识,所以这节课原子表示方法比较容易接受,但对于核素同位素的概念是新知识。 五、教学方法:学案导学 六、课前准备: 学生学习准备:导学案 教师教学准备:投影设备 七、课时安排:一课时 八、教学过程: (一)、检查学案填写,总结疑惑点(主要以学生读答案展示的方式) (二)、情景导入,展示目标 原子是构成物质的一种微粒(构成物质的微粒还有离子、分子等),是化学变化中的最小微粒。物质的组成、性质和变化都都与原子结构密切相关,同种原子性质和质量都相同。那么原子能不能再分?原子又是如何构成的呢?这节课我们一起来学习有关原子的几个概念。 (三)、合作探究,精讲点拨 探究一:核素和同位素 1、原子结构:原子由原子核和核外电子构成,原子核在原子的中心,由带正电的质子与不带电的中子构成,带负电的电子绕核作高速运动。也就是说,质子、中子和电子是构成原子的三种微粒。在原子中,原子核带正电荷,其正电荷数由所含质子数决定。 (1)原子的电性关系:核电荷数= 质子数= 核外电子数 (2)质量数:将原子核内所有的质子和中子的相对质量取近似整数值加起来所得的数值,叫质量数。 质量数(A)= 质子数(Z)+ 中子数(N) (3)离子指的是带电的原子或原子团。带正电荷的粒子叫阳离子,带负电荷的粒子叫阴离
19.5 核力与结合能 ★新课标要求 (一)知识与技能 1.知道核力的概念、特点及自然界存在的四种基本相互作用; 2.知道稳定原子核中质子与中子的比例随着原子序数的增大而减小; 3.理解结合能的概念,知道核反应中的质量亏损; 4.知道爱因斯坦的质能方程,理解质量与能量的关系。 (二)过程与方法 1.会根据质能方程和质量亏损的概念计算核反应中释放的核能; 2.培养学生的理解能力、推理能力、及数学计算能力。 (三)情感、态度与价值观 1.使学生树立起实践是检验真理的标准、科学理论对实践有着指导和预见作用的能力; 2.认识开发和利用核能对解决人类能源危机的重要意义。 ★教学重点 质量亏损及爱因斯坦的质能方程的理解。 ★教学难点 结合能的概念、爱因斯坦的质能方程、质量与能量的关系。 ★教学方法 教师启发、引导,学生讨论、交流 ★教学用具: 多媒体教学设备一套:可供实物投影、放像、课件播放等。 ★课时安排 1 课时 ★教学过程 (一)引入新课 复习提问:氦原子核中有两个质子,质子质量为m p=1.67×10-27kg,带电量为元电荷e=1.6×10-19C,原子核的直径的数量级为10-15m,那么两个质子之间的库仑斥力与万有引力两者相差多少倍? 学生通过计算回答:两者相差1036倍 问:在原子核那样狭小的空间里,带正电的质子之间的库仑斥力为万有引力的1036
倍,那么质子为什么能挤在一起而不飞散?会不会在原子核中有一种过去不知道的力,把核子束缚在一起了呢?今天就来学习这方面的内容,也就是第五节:核力与结合能(板书) 点评:让学生从熟悉的库仑定律和万有引力定律出发,比较氦原子核中两个质子之间的库仑斥力与万有引力的大小,产生强烈的认知冲突,进而引入核力的概念。 (二)进行新课 1.核力与四种基本相互作用(板书) 点拨:20世纪初人们只知道自然界存在着两种力:一种是万有引力,另一种是电磁力(库仑力是一种电磁力)。在相同的距离上,这两种力的强度差别很大。电磁力大约要比万有引力强1036倍。 基于这两种力的性质,原子核中的质子要靠自身的引力来抗衡相互间的库仑斥力是不可能的。核物理学家猜想,原子核里的核子间有第三种相互作用存在,即存在着一种核力,是核力把核子紧紧地束缚在核内,形成稳定的原子核,后来的实验证实了科学家的猜测. 问:那么核力有怎样特点呢? 学生:阅读教材核力的特点部分,讨论、总结并回答核力特点: (1)核力是强相互作用(强力)的一种表现。 (2)核力是短程力,作用范围在1.5×10-15 m之内。 (3)核力存在于核子之间,每个核子只跟相邻的核子发生核力作用,这种性质称为核力的饱和性。 教师总结:除核力外,核物理学家还在原子核内发现了自然界的第四种相互作用—弱相互作用(弱力),弱相互作用是引起原子核β衰变的原因,即引起中子转变质子的原因。弱相互作用也是短程力,其力程比强力更短,为10-18m,作用强度则比电磁力小。 点评:通过学生自主学习培养学生的自学能力,同时通过讨论激发学习兴趣。 教师讲述:四种基本相互作用力 弱力、强力、电磁力、引力和分别在不同的尺度上发挥作用: ①弱力(弱相互作用):弱相互作用是引起原子核β衰变的原因→短程力 ②强力(强相互作用):在原子核内,强力将核子束缚在一起→短程力 ③电磁力:电磁力在原子核外,电磁力使电子不脱离原子核而形成原子,使原了结合成分子,使分子结合成液体和固体。→长程力 ④引力:引力主要在宏观和宇观尺度上“独领风骚”。是引力使行星绕着恒星转,并且联系着星系团,决定着宇宙的现状。→长程力 学生:阅读课本左边的阅读内容总结自然界的四种基本相互作用力及它们的作用范围。 2.原子核中质子与中子的比例