
全国高中化学竞赛资料
第一讲
原子结构。核外电子运动状态,用s、p、d等来表示基态构型(包括中性原子、正离子和负离子),核外电子排布。电离能和电负性。
一、原子核
1.原子核
(1)原子的组成原子核和核外电子构成
(2)原子核的组成质子(p)和中子构成
(3)质量数(A)数值上等于质子数(Z)和中子(N)数之和,是质子和中子相对质量之和取其整数值。A=P+N
(4)原子符号
(5)原子中的质量(由原子核的质量决定)、体积(由核外电子运动的空间区域决定)、电性(质子数等于核外电子数,电中性)关系
2.同位素
(1)元素具有相同核电荷数(质子数)的同一类原子(如1H、2H、3H)的总称
(2)核素具有确定的质子数和中子数的原子,氢元素有三种核素:1H、2H、3H
(3)同位素同种元素不同种核素互称为同位素,如互称同位素
a.同位素的化学性质几乎相同
b.稳定核素在自然界中含量不变
c.重要同位素的应用(2H、235U、18O、14C等)
3.相对原子质量
(1)相对原子质量的定义
(2)核素(原子或同位素)的相对原子质量以1个12C质量的1/12作标准,其他核素的质量跟它的比值
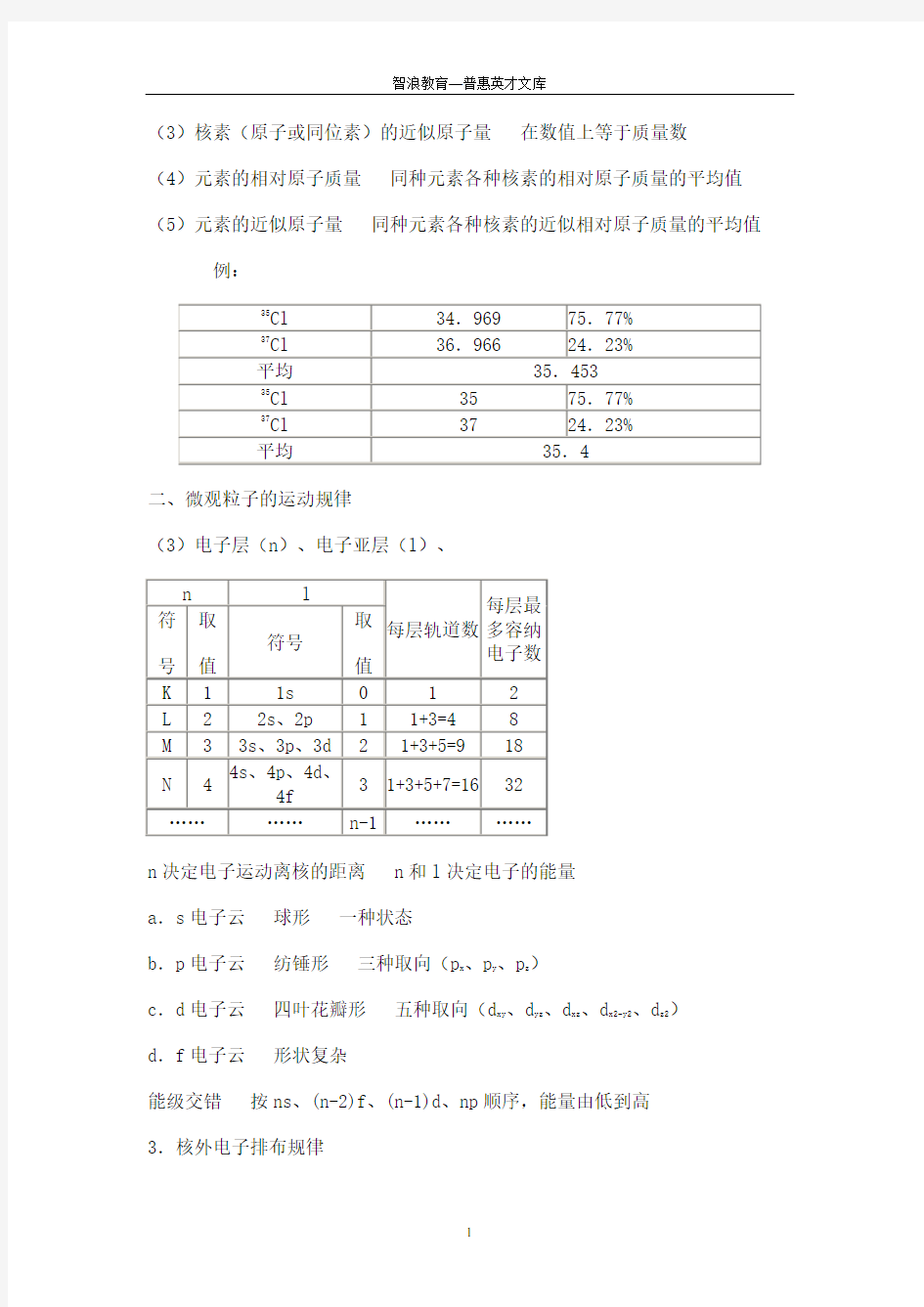
(3)核素(原子或同位素)的近似原子量在数值上等于质量数
(4)元素的相对原子质量同种元素各种核素的相对原子质量的平均值(5)元素的近似原子量同种元素各种核素的近似相对原子质量的平均值例:
二、微观粒子的运动规律
(3)电子层(n)、电子亚层(l)、
n决定电子运动离核的距离 n和l决定电子的能量
a.s电子云球形一种状态
b.p电子云纺锤形三种取向(p
x 、p
y
、p
z
)
c.d电子云四叶花瓣形五种取向(d
xy 、d
yz
、d
xz
、d
x2-y2
、d
z2
)
d.f电子云形状复杂
能级交错按ns、(n-2)f、(n-1)d、np顺序,能量由低到高3.核外电子排布规律
a. 能量最低原理按ns、(n-2)f、(n-1)d、np顺序填入电子
b. 泡利不相容原理同一原子中找不到运动状态完全相同的两个电子,即1 个轨道最多容纳2个电子
c. 洪特规则及特例电子尽可能占有最多的等价(能量相同的)轨道电子在填入轨道时,半满、全满、全空状态时更稳定
(7)表示核外电子排布的方法
a. 原子结构简图
b. 电子排布式
c. 轨道表示式
练习:
A.用电子排布表示19—36号元素的核外电子排布
B.用轨道表示式表示1-18元素的核外电子排布
五、元素周期律
1.元素周期律的内容
元素的性质随核电荷数递增而呈现周期性的变化
2.元素周期律中元素的性质指的是什么(第1电离能、原子半径、主要化合价等)
(1)电离能(I)从气态原子上失去1个电子变成+1价气态阳离子所需要的能量叫第1电离能,用I1表示;从+1价气态阳离子失去1个电子变成+2价气态阳离子所需要的能量叫第2电离能,用I2表示等。从电离能的突变可以推断出电子是分层排布的。
第1电离能的周期性变化
分析3-18号元素第1电离能的变化规律
(2)电负性:原子在分子中吸引电子的能力。
1932年化学家鲍林(L. Pauling)指出:“电负性是元素的原子在化合物中吸引电子能力的标度。”并提出:F的负电性为4.0,其它原子的负电性均为相对值,以Xp表示。Xp的数值越大, 表示该元素的原子吸引电子的能力就越强; 反之, Xp 的数值越小, 表示该元素的原子吸引电子的能力就越弱。。
3.元素周期律的实质
元素核外电子排布的周期性
六、元素周期表
1.元素周期表的结构
(1)周期:把具有相同的电子层数而又按原子序数递增的顺序排列的一系列元素,叫做一个周期。周期的序数就是该元素原子具有的电子层数。元素周期表中共有 7 个周期。第一、二、三周期为短周期,第四、五、六周期为长周期,第七周期为不完全周期。
(2)族:元素周期表中共有 18 个纵行。除第 8 、 9 、 10 三个纵行叫做第Ⅷ族外,其余 15 个纵行,每个纵行称为一族,并分为主族和副族。
7个主族,7个副族,一个第Ⅷ族,一个 0 族,共 16 个族。
(3)区,划分为 s 、 p 、 d 、 ds 和 f 五个区
(4)最外层电子构型外围电子构型、特征电子构型、价电子构型
(5)各周期元素的数目
2.结构和性质的关系
(1)元素的金属性和非金属性
元素的金属性是指元素的原子失去电子变成阳离子的性质,元素的非金属性是指元素的原子得到电子变成阴离子的性质。元素的原子越易失去电子,金属性就越强;元素的原子越易得到电子,非金属性就越强。
11-18号元素金属性和非金属性性质变化规律
(2)同一周期元素,从左到右,元素金属性逐渐减弱,非金属性逐渐增强。
(3)同一主族元素,从上到下,元素金属性逐渐增强,非金属性逐渐减弱。
(4)金属元素、非金属元素跟结构之间的关系
例:116、117、118元素分别是金属元素还是非金属元素?
3.过渡元素和铂系元素
过渡元素是指元素周期表中d区的一系列金属元素,又称过渡金属。一般来说,这一区域包括3到12一共十个族的元素,但不包括f区的内过渡元素。
铂系元素都是稀有金属,它们在地壳中的质量分数估计为:
铂系元素几乎完全以单质状态存在,高度分散在各种矿石中,并共生在一起。
从铂系元素原子的价电子结构来看,除锇和铱有2个s原子外,其余都只有1个s电子或没有s电子。
第二讲共价键与分子结构
?共价键理论
1、共价键的成键原理
价键的形成可以看作是原子轨道重叠或电子配对的结果。两个原子如果都有未成键的电子,并且自旋方向相反,就能配对,也就是原子轨道可重叠形成共价键。
重叠部分越大,所形成的共价键就越牢固。(键长越短,键能越大)
由一对电子形成的共价键叫做单键,如果原子各有二个或三个未成键的电子,构成的共价键则是双键或叁键。
这一理论最早是由路易斯(1916年,G.C.Lewis,美国化学家),所以我们通常所说电子式又称为路易斯结构式。
在路易斯结构式中,线段的意义,如前所述,代表共用电子对,仍称“单键”、“双键”和“叁键”(代表1,2,3对共用电子对)。成对的小黑点则代表未用来形成化学键的“价层电子对”,叫做“孤对电子对”(有时分子里有单个的非共用电子,如NO2)。
对于无机物,写路易所结构式就要困难得多。但大多数情况下,“八偶律”仍是起作用的。从上面已经写出的路易斯结构式里我们很容易发现这一点。但有时八偶律不起作用。主要有两种例外。
①缺电子结构——价电子,包括形成共价键的共用电子对之内,少于8电子的,称为缺电子结构。例如,第3主族的硼和铝,中性原子只有3个价电子,若一个硼原子和其它原予形成3个共用电子对,也只有6个电子,这就是缺电子结构。典型的例子有BCl3、AlCl3(这些化学式是分子式,即代表一个分子的结构)。缺电子结构的分子有接受其它原子的孤对电予形成配价键的能力。例如:
BCl3+:NH3=Cl3B←NH3
②多电子结构例如,PCl5里的磷呈5价,氯呈1价。中性磷原予的价电子数为5。在PCl5磷原子的周围的电子数为10,超过8。这种例外只有第3周期或更高周期的元素的原子才有可能出现。
2、共价键的特性
①饱和性。
当原子的未成键的一个电子与某原子的一个电子配对之后,就不能再和第三个电子配对了,这就是共价键的饱和性。
②方向性。
成键时,两个电子的原子轨道发生重叠,重叠部分的大小决定共价键的牢固程度。p、d、f、有一定的方向性。
3、共价键的键型。
从电子云重叠的方式来看,共价键可分为σ键和π键。
①σ键
当原子之间只有一对电子时,这对电子形成的化学键为单键。单键是σ键,σ键是成键的两个原子的轨道沿着两核连线方向“头碰头”进行重叠而形成的共价键。s与s轨道,s与p轨道,p与p轨道可以形成σ键。σ键的特点是重叠的电子一在两核连线上,受原子核束缚力较大,重叠程度也大,比较牢固。
②π键
π键是成健原子的p轨道电子云“肩并肩”进行重叠而形成的共价键。一般来说,π健不能独立存在,总是和σ键一起形成双键或叁键。π键的特点是重叠的电子云分布在两核连线的两方,受原子核束缚力小,电子云重叠程度要比σ键小得多,所以π键不如σ键牢固。但是π键电子云受原子束缚力小,电子的能量较高,易活动,其化学性质较σ键活泼。
电子配对法阐明了共价键的本质、特征和类型,但在解释多原子分子的几何形状(或空间构型)方面遇到了困难。例如C原子只有两个成单电子,但能形成稳定的CH4分子,所以电子配对法不能说明甲烷分子为什么是正四面体构型的分子。1931年鲍林提出杂化轨道理论,满意地解释了许多多原子分子的空间构型。
二、杂化轨道理论。
形成分子时,由于原子间的相互影响,使同一原子中能量相近的不同类型原子轨道,例如ns轨道与np轨道,发生混合,重新组合为一组新轨道.这些新轨道称为杂化轨道。杂化轨道的数目等于参与杂化的原子轨道数目。
杂化有多种方式,视参加杂化的原子以及形成的分子不同而不同。
①sp3杂化——这是原子最外层的1个s轨道和3个p轨道发生的杂化。杂化以后形成四个等价的sp3杂化轨道。碳原子在与氢原子形成甲烷分子时就发生了
sp3杂化。发生杂化时,碳原子的2s轨道和3个2p轨道发生混杂,形成4个能量相等的杂化轨道,碳原子最外层的4个电子分别占据1个杂化轨道。
杂化轨道的形状也可以说介于s轨道和p轨道之间。
四个sp3杂化轨道在空间均匀对称地分布——以碳原子核为中心,伸向正四面体的四个顶点。这四个杂化轨道的未成对电子分别与氢原子的1s电子配对成键,这就形成了甲烷分子。
杂化轨道理论不仅说明了碳原子最外层虽然只有2个未成对电子却可以与4个氢原子形成共价键,而且很好地说明了甲烷分子的正四面体结构。
在形成H2O、NH3分子时,O、N原子实际上也发生了sp3杂化。与C原子杂化不同的是N、O原子最外层电子数分别为5个和6个,因而四个sp3杂化轨道里必然分别有1个和2个轨道排布了两个电子。这种已经自配对的电子被称为孤对电子。N和O的未成对电子分别与H原子的1s电子结合就形成了NH3分子和H2O 分子。
孤对电子相对来说带有较多的负电荷。受孤对电子云的排斥,NH3分子中N-H 键间的夹角被压缩为107o,H2O分子中O—H键间的夹角被压缩到104o401。
含有孤对电子的杂化被称为不等性杂化。NH3和H2O分子中N和O都发生了不等性sp3杂化。
②sp2杂化—BCl3
这是原子最外层的一个s轨道和两个p轨道发生的杂化。杂化后形成三个等价的sp2轨道。B原子最外层的3个电子分别占据1个杂化轨道。在空间以B原子为中心3个sp2轨道伸向平面三角形的三个顶点。所以sp2杂化轨道夹角为1200。
此外SO3中的硫原子也是sp2杂化。
③sp杂化——形成CO2分子时,碳原子1个2s轨道与1个2p轨道发生杂化,形成两个sp杂化轨道。两个sp杂化轨道在X轴方向上呈直线排列,未杂化的两个即轨道分别在Y轴方向和Z铀方向垂直于杂化轨道。两个氧原子各以一个2p 轨道与碳原子的sp杂化轨道重叠形成σ键。而两个氧原子的另一个未配对的
2p轨道分别在Y轴方向和Z轴方向与碳原子的未杂化的2p轨道“肩并肩”重叠形成π键。所以CO2分子中碳、氧之间以双键相结合。
碳原子在形成乙炔(C2H2)时也发生sp杂化,两个碳原子以sp杂化轨道与氢原子结合。两个碳原子的未杂化2p轨道分别在Y轴和Z轴方向重叠形成
π键。所以乙炔分子中碳原子间以叁键相结合。
所以sp杂化轨道夹角为1800
④sp3d杂化——磷原子在形成PCl5分子时,除最外层s、p轨道参与杂化外,其3d轨道也有1个参加了杂化,称为sp3d杂化。杂化后形成5个杂化轨道,其中各有1个未成对电子。5个杂化轨道指向三角双锥的5个顶点,并与氯原子配对成键。
可以看出,杂化方式与分子的空间结构形状有关。一般地说,发生sp3杂化时,形成的分子是正四面体,杂化原子处于中心;发生不等性sp3杂化时,如有一对孤对电子,则分子呈三角锥形,杂化原子处于锥顶。如果有2对孤对电子,则分子呈V型;发生sp2杂化时,分子呈平面三角型,杂化原子处于正三角形中心,未杂化的p电子通常形成π键(构成双键);发生sp杂化时,分子呈直线型,
未杂化的p电子通常也参与形成π键(构成双键或叁键);发生sp3d杂化时,分子是三角双锥形。杂化原子处于双三角雄的中心。sp3d2正八面体。
练习:
1、氯化亚砜(SOCl2)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。氯化亚砜分子的几何构型是;中心原子采取杂化方式,是(等性、不等性)杂化。
三角锥形 sp2 不等性
2、磷的氯化物有PCl3和PCl5,氮的氯化物只有NCl3,为什么没有NCl5?
N原子最外层无d轨道,不能发生sp3d杂化,故无NCl5。
3、C2H4的杂化方式?共价键的键型有哪些?
4、冰晶石(Na3AlF6)AlF63-配离子中心离子的杂化轨道类型、配离子空间构型
三、价层电子对互斥理论(VSEPR)
现代化学的重要基础之一是分子(包括带电荷的离子)的立体结构。
例如,实验测出,SO3分子是呈平面结构的,O—S—O的夹角等于120o,而 SO32-离子却是呈三角锥体,硫是锥项,三个氧原子是三个锥角,象一架撑开的照相用的三角架。又例如SO2的三个原子不在一条直线上,而CO2却是直线分子等等。早在1940年,Sidgwick和Powell就在总结测定结果的基础上提出了一种简单的理论(更确切地说,是一种模型),用以预测简单分子或离子的立体结构。这种理论后经Giliespie和Nyholm在50年代加以发展,并称之为VSEPR(Valence Shell Electron Pair Repulsion),即价层电子对互斥理论。我们不难学会用这种理论来预测和理解分子或离子的立体结构,并用来进一步确定分子或离子的结构。当然我们不应忘记,这一理论绝不可能代替实验测定,也不可能没有例外。不过统计表明,对于我们经常遇到的分子或离子,用这一理论来预言其结构,很少发现例外。作为一种不需要任何计算的简单模型,它应当说是很有价值的。
?价层电子对互斥理论的基本要点:
1、在AXm型分子中,中心原子了A的周围配置的原子或原子团的几何构型,主要决定与中心价电子层中电子对(包括成键电子对和未成键的孤对电子对)的互相排斥作用,分子的几何构型总是采取电子对相互排斥作用最小的那种结构。
2、在AXm型分子中,A与X之间通过两对或三对电子(即通过双键或叁键)结合而成,则价层电子对互斥理论把双键或叁键作为一个电子对。
3、价层电子对之间相互排斥作用大小的一般规律:
孤对-孤对>孤对-键对>键对-键对
(二)推断分子或离子的空间构型的具体步骤:
1、确定中心原子A价层电子对数目。中心原子A的价电子数与配位体X提供共用的电子数之和的一半,就是中心原子A价层电子对的数目。例如BF3分子,B 原子有3个价电子,三个F原子各提供一个电子,共6个电子,所以B原子价层电子对数为3。计算时注意:(ⅰ)氧族元素(ⅥA族)原子作为配位原子时,可认为不提供电子(如氧原子有6个价电子,作为配位原子时,可认为它从中心原子接受一对电子达到8电子结构),但作为中心原子时,认为它提供所有的6
个价电子。(ⅱ)如果讨论的是离子,则应加上或减去与离子电荷相应的电子数。如PO43-离子中P原子的价层电子数应加上3,而NH4+离子中N原子的价层电子数则应减去1。(ⅲ)如果价层电子数出现奇数电子,可把这个单电子当作电子对看待。如NO2分子中N原子有 5个价电子,O原子不提供电子。因此中心原子N价层电子总数为5,当作3对电子看待。
练习:
?CH4、NH3、H2O、SO3、NO的电子对数。
2、CO32-、SO
3、CCl
4、SO42-、PO43-、IO65-的电子对数。
2、确定价层电子对的空间构型。由于价层电子对之间的相互排斥作用,它们趋向于尽可能的相互远离。于是价层电子对的空间构型与价层电子对数目的关系如下表所示:
这样已知价层电子对的数目,就可及确定它们的空间构型。
3、分子空间构型的确定。价层电子对有成键电子对和孤电子对之分。中心原子周围配位原子(或原子团)数,就是健对数,价层电子对的总数减去键对数,得孤对数。根据键对数和孤对敌,可以确定相应的较稳定的分子几何构型,如下表所示:
电子对数目电子对的
空间构型
成键电
子对数
孤电子
对数
电子对的
排列方式
分子的
空间构型
实例
2 直线 2 0 直线
BeCl2
CO2 3 三角形 3 0 三角形
BF3
SO3
2 1 V—形SnBr2 PbCl2
4 四面体4 0 四面体
CH4
CCl4 3 1 三角锥
NH3
PCl3 2 2 V —形H2O
5 三角
双锥
5 0 三角双锥PCl5
4 1
变形
四面体
SF4
3 2 T—形BrF3
2 3 直线形XeF2
6 八面体6 0 八面体SF6 5 1 四角锥IF5 4 2 正方形XeF4
利用上表判断分子几何构型时应注意,如果在价层电对中出现孤电子对时,价层电子对空间构型还与下列斥力顺序有关:孤对—孤对>孤对—键对>键对—键对
因此,价层电子对空间构型为正三角形和正四面体时,孤电子对的存在会改变键对电子的分布方向。所以SnBr2的键角应小于120o,NH3、H2O分子的键角应小于109o281。
对于分子中有双键、叁键等多重键时,使用价层电子对理论判断其分子构型时,双键的两对电子和叁键的三对电子只能作为一对电子来处理。或者说在确定中心原子的价电子层电子对总数时,不包括π键电子。
使用价层电子对互斥理论我们可以判断在杂化理论中提到的所有只含一个中心原子的分子的结构,当然用这一理论也可以判断我们常遇到的所有单中心分子或离子的结构。
练习:
?IO65-和IO4-的空间构型和中心原子的杂化类型分别
为
2、利用杂化轨道理论、价层电子互斥理论和等电子体原理分析分子的空间结构。判断下列分子或离子的空间构型
PCl4+ AlF63- XeF6 NO3- NO2+ IO65-
3、高氙酸盐(XeO64-)Xe的杂化类型与XeO64-离子的空间构型
4、O3的空间构型。
(三)等电子原理及其运用
具有VSEPR理论的相同通式AXmEn(A表示中心原子,X表示配位原子,下标m 表示配位原子的个数,E表示中心原子的孤对电子对,下标n表示电子对数),又具有相同的价电子数的分子或离子具有相同的结构,这个原理称为“等电子体原理”。
如:1、N2、CO、CN-
2、NO3-、CO32-、SO3
3、CCl
4、SO42-、PO43-
综合练习
【练习1】PCl5是一种白色固体,加热到160℃不经过液态阶段就变成蒸气,测得180℃下的蒸气密度(折合成标准状况)为9.3g/L,极性为零,P-Cl键长为204pm和211pm两种。继续加热到250℃时测得压力为计算值的两倍。PCl5在加压下于148℃液化,形成一种能导电的熔体,测得P-Cl的键长为198pm和206pm 两种。(P、Cl相对原子质量为31.0、35.5)回答如下问题:
①180℃下,PCl5蒸气中存在什么分子?为什么?写出分子式,画出立体结构。
②在250℃下PCl5蒸气中存在什么分子?为什么?写出分子式,画出立体结构。
③PCl5熔体为什么能导电?用最简洁的方式作出解释。
④PBr5气态分子结构与PCl5相似,它的熔体也能导电,但经测定其中只存在一种P-Br键长。PBr5熔体为什么导电?用最简洁的形式作出解释。
1.① 9.3×22.4=208.3g/mol
PCl5相对分子质量31.0+35.5×5=208.5
蒸气组成为PCl5
呈三角双锥体(如图6-3所示)
三角双锥分子无极性,有两种键长。
② PCl5 = PCl3 + Cl2
氯分子Cl-Cl;三氯化磷分子(如图6-4所示)
压力为计算值的两倍表明1mol PCl5完全分解成1mol PCl3和1mol Cl2, 共2mol。气体由等摩尔PCl3和Cl2组成。
③ 2PCl5==PCl4+ + PCl6-
含PCl4+和PCl6-两种离子,前者为四面体,后者为八面体(如图6-5所示),因此前者只有一种键长,后者也只有一种键长,加起来有两种键长。
④ PBr5==PBr4+ + Br-,PBr4+ 结构同PCl4+
初赛基本要求 1.有效数字在化学计算和化学实验中正确使用有效数字。定量仪器(天平、量筒、移液 管、滴定管、容量瓶等等)测量数据的有效数字。数字运算的约化规则和运算结果的有效数字。实验方法对有效数字的制约。 2.气体理想气体标准状况(态)。理想气体状态方程。气体常量R。体系标准压力。分 压定律。气体相对分子质量测定原理。气体溶解度(亨利定律)。 3.溶液溶液浓度。溶解度。浓度与溶解度的单位与换算。溶液配制(仪器的选择)。重 结晶的方法及溶质/溶剂相对量的估算。过滤与洗涤(洗涤液选择、洗涤方式选择)。重结晶和洗涤溶剂(包括混合溶剂)的选择。胶体。分散相和连续相。胶体的形成和破坏。 胶体的分类。胶体的基本结构。 4.容量分析被测物、基准物质、标准溶液、指示剂、滴定反应等基本概念。酸碱滴定曲 线(酸碱强度、浓度、溶剂极性对滴定突跃影响的定性关系)。酸碱滴定指示剂的选择。 以高锰酸钾、重铬酸钾、硫代硫酸钠、EDTA为标准溶液的基本滴定反应。分析结果的计算。分析结果的准确度和精密度。 5. 原子结构核外电子运动状态: 用s、p、d等来表示基态构型(包括中性原子、正离子 和负离子)核外电子排布。电离能、电子亲合能、电负性。 6.元素周期律与元素周期系周期。1—18族。主族与副族。过渡元素。主、副族同族元 素从上到下性质变化一般规律;同周期元素从左到右性质变化一般规律。原子半径和离子半径。s、p、d、ds区元素的基本化学性质和原子的电子构型。元素在周期表中的位置与核外电子结构(电子层数、价电子层与价电子数)的关系。最高氧化态与族序数的关系。对角线规则。金属与非金属在周期表中的位置。半金属(类金属)。主、副族的重要而常见元素的名称、符号及在周期表中的位置、常见氧化态及主要形态。铂系元素的概念。 7.分子结构路易斯结构式。价层电子对互斥模型。杂化轨道理论对简单分子(包括离子) 几何构型的解释。共价键。键长、键角、键能。σ键和π 键。离域π键。共轭(离域)体系的一般性质。等电子体的一般概念。键的极性和分子的极性。相似相溶规律。对称性基础(限旋转和旋转轴、反映和镜面、反演和对称中心)。 8.配合物路易斯酸碱。配位键。重要而常见的配合物的中心离子(原子)和重要而常见的配体(水、羟离子、卤离子、拟卤离子、氨分子、酸根离子、不饱和烃等)。螯合物及螯合效应。重要而常见的配合反应。配合反应与酸碱反应、沉淀反应、氧化还原反应的关系(定性说明)。配合物几何构型和异构现象基本概念和基本事实。配合物的杂化轨道理论。用杂化轨道理论说明配合物的磁性和稳定性。用八面体配合物的晶体场理论说明Ti(H2O)63+的颜色。软硬酸碱的基本概念和重要的软酸软碱和硬酸硬碱。 9.分子间作用力范德华力、氢键以及其他分子间作用力的能量及与物质性质的关系。 10.晶体结构分子晶体、原子晶体、离子晶体和金属晶体。晶胞(定义、晶胞参数和原子 坐标及以晶胞为基础的计算)。点阵(晶格)能。配位数。晶体的堆积与填隙模型。常见的晶体结构类型:NaCl、CsCl、闪锌矿(ZnS)、萤石(CaF2)、金刚石、石墨、硒、冰、干冰、金红石、二氧化硅、钙钛矿、钾、镁、铜等。 11.化学平衡平衡常数与转化率。弱酸、弱碱的电离常数。溶度积。利用平衡常数的计算。 熵(混乱度)的初步概念及与自发反应方向的关系。 12.离子方程式的正确书写。
全国高中化学竞赛试题集萃(五) 二、本题包括5小题,共29分。 26. (3分)如右图所示,在盛有水的烧杯中,等质量的铁圈和银圈的连接处,吊着一根绝缘的细丝,使之平衡。小心地在烧杯中央滴入CuSO 4溶液。 ⑴经过一段时间后,观察到的现象是(指金属圈) 。 A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变 C.铁圈向下倾斜 D.银圈向下倾斜 ⑵产生上述现象的原因是 。 27. (4分)以铜为阳极,石墨为阴极,用含3~5gNaOH 的15%NaCl 的混合溶液做电解液,外加电压为 1.5V 电解时,得到一种半导体产品(产率93%以上)和一种清洁能源,则它的阳极反应式为 ,阴极反应式为 ;电解也是绿色化学中一种有效工具,试以此为例,写出绿色化学的两点特征: 和 。 28. (10分)下图中E 是一种固体的非金属单质,A 、B 、D 、F 、G 、H 中都含有E 元素,A 、C 、F 、H 、G 都含有相同的阳离子,G 加入含碘的淀粉蓝色溶液,蓝色褪去。 ⑴试写出A ~H 的分子式; A ; B ; C ; D ; E ; F ; G ; H 。 ⑵写出G 与单质碘反应的离子方程式。 29. (5分)某溶液中可能含有下列物质中的两种:HCl 、NaOH 、NaH 2PO 4、Na 3 PO 4、H 3 PO 4和Na 2HPO 4。 ⑴这六种物质两两间可能形成 种互相不发生反应的组合。 ⑵取某种组合溶液,滴入甲基红指示剂后为黄色(pH=6.2),再滴入酚酞指示剂后仍是黄色(酚酞无色,pH ≤8.0),则此组合是 和 的组合液。 ⑶取另一组合溶液xmL ,以甲基橙作指示剂,用c mol/LNaOH 溶液滴定至红橙色(此时pH 约为9.6左右),又消耗V 1mL(V>V 1),试确定此组合溶液是 和 物质组成的。 30. (7分)我国东方Ⅱ号宇宙火箭的燃料是N 2H 2(CH 3)2,助燃剂为N 2O 4,两者发生完全燃烧时产生了巨大推力,让火箭携带卫星上天。 ⑴N 2H 2(CH 3)2中N 的氧化数为 ,N 2O 4中N 的氧化数为 。 ⑵完全燃烧反应的化学方程式为 。 ⑶试写出N 2O 4中N 、N 连接的一种Lewis 结构式并标出形式电荷 。 ⑷N 2H 4与N 2O 4比较, 的N -N 键长较长,其理由是 。 H G E A F B C D O 2 NH 3·H 2O HCl
绪论 1.化学:在分子、离子和原子层次上,研究物质的组成和结构以及物质的化学 性质和化学变化及其内在联系的科学。 应注意的问题: (1)化学变化的特点:原子核组成不变,发生分子组成或原子、离子等结合方式的改变; (2)认为物理变化不产生质变,不生成新物质是不准确的,如: 12H+3 1 H==42He+10n是质变,产生了新元素,但属于物理变化的范畴; (3)化学变化也有基本粒子参加,如:2AgCl==2Ag+Cl2就有光子参加; (4)物质 2.无机化学:除去碳氢化合物及其大多数衍生物外,对所有元素和他们的化合 物的性质和反应进行研究和理论解释的科学。(莫勒提法) 3.怎样学习无机化学? (1)你所积累的好的学习方法都适于学习无机化学。 (2)课前预习,带着问题听课。提倡写预习笔记。 (3)课上精力集中,边听边看边想边记,眼、耳、手、脑并用。 (4)课后趁热复习,按时完成作业,及时消化,不欠账。 (5)提高自学能力,讨论课积极发言。 (6)随时总结,使知识系统化。达到书越读越薄之目的。 (7)理论联系实际,做好化学实验。
第一章原子结构和原子周期系 教学目标:1.学会一个规则:斯莱特规则; 2.掌握两个效应:屏蔽效应、钻穿效应; 3.掌握三个原理:能量最低、保里不相容、洪特规则; 4.掌握四个量子数:n、l、l、m s 5.掌握五个分区:s、p、d、ds、f 6.掌握六对概念; 7.掌握七个周期; 8.掌握八个主族八个副族。 重点:1.原子核外电子排布三个原理,核外电子的四个量子数; 2.元素周期表的结构其及元素性质变化规律。 难点:屏蔽效应、钻穿效应概念及应用; 教学方法:讲授与讨论相结合,做适量练习题和作业题。 教学内容: §1-1经典物理学对原子结构的认识 1-1原子的核形结构 1708年卢瑟福通过α粒子散射实验确认:原子是由中央带正电的原子核和周围若干绕核旋转的电子组成。遇到的问题:电子绕核运动,将不断辐射电磁波,不断损失能量,最终将落到核上,原子因此而消亡实际与此相反,原子是稳定存在的,急需找到理论解释。 1-2 原子光谱的规律性 1光谱一束光通过分光棱镜折射后再屏幕上得到一条彩带或线形亮条前者称连续光谱后者称线形光谱太阳光电灯光为连续光谱原子光谱为线形光谱图1-1 2氢原子光谱里德堡方程 R H=1.097×10 M n1 导讲义 【竞赛要求】 气体。理想气体标准状态。理想气体状态方程。气体密度。分压定律。气体相对分子质量测定原理。 【知识梳理】 一、气体 气体、液体和固体是物质存在的三种状态。气体的研究对化学学科的发展起过重大作用。气体与液体、固体相比较,具有两个明显特点。 1、扩散性 当把一定量的气体充入真空容器时,它会迅速充满整个容器空间,而且均匀分布,少量气体可以充满很大的容器,不同种的气体可以以任意比例均匀混合。 2、可压缩性 当对气体加压时,气体体积缩小,原来占有体积较大的气体,可以压缩到体积较小的容器中。 二、理想气体 如果有这样一种气体:它的分子只有位置而无体积,且分子之间没有作用力,这种气体称之为理想气体。当然它在实际中是不存在的。实际气体分子本身占有一定的体积,分子之间也有吸引力。但在低压和高温条件下,气体分子本身所占的体积和分子间的吸引力均可以忽略,此时的实际气体即可看作理想气体。 三、理想气体定律 1、理想气体状态方程 将在高温低压下得到的波义耳定律、查理定理和阿佛加德罗定律合并,便可组成一个方程: pV= nRT (1-1) 这就是理想气体状态方程。 式中p 是气体压力,V 是气体体积,n 是气体物质的量,T 是气体的绝对温度(热力学温度,即摄氏度数+273),R 是气体通用常数。 在国际单位制中,它们的关系如下表: 表1-1 R 的单位和值 p V n T R 国际单位制 Pa m3 mol K 8.314K mol m Pa · ·3 或K mol J · kPa dm3 mol K 8.314K mol dm kPa · ·3 (1-1)式也可以变换成下列形式: pV= M m RT (1-2) p = V m ·M RT = M RT ρ 则: ρ = RT pM (1-3) 式中m 为气体的质量,M 为气体的摩尔质量,ρ为气体的密度。 对于一定量(n 一定)的同一气体在不同条件下,则有: 全国高中化学竞赛资料 第一讲 原子结构。核外电子运动状态,用s、p、d等来表示基态构型(包括中性原子、正离子和负离子),核外电子排布。电离能和电负性。 一、原子核 1.原子核 (1)原子的组成原子核和核外电子构成 (2)原子核的组成质子(p)和中子构成 (3)质量数(A)数值上等于质子数(Z)和中子(N)数之和,是质子和中子相对质量之和取其整数值。A=P+N (4)原子符号 (5)原子中的质量(由原子核的质量决定)、体积(由核外电子运动的空间区域决定)、电性(质子数等于核外电子数,电中性)关系 2.同位素 (1)元素具有相同核电荷数(质子数)的同一类原子(如1H、2H、3H)的总称 (2)核素具有确定的质子数和中子数的原子,氢元素有三种核素:1H、2H、3H (3)同位素同种元素不同种核素互称为同位素,如互称同位素 a.同位素的化学性质几乎相同 b.稳定核素在自然界中含量不变 c.重要同位素的应用(2H、235U、18O、14C等) 3.相对原子质量 (1)相对原子质量的定义 (2)核素(原子或同位素)的相对原子质量以1个12C质量的1/12作标准,其他核素的质量跟它的比值 (3)核素(原子或同位素)的近似原子量在数值上等于质量数 (4)元素的相对原子质量同种元素各种核素的相对原子质量的平均值(5)元素的近似原子量同种元素各种核素的近似相对原子质量的平均值例: 二、微观粒子的运动规律 (3)电子层(n)、电子亚层(l)、 n决定电子运动离核的距离 n和l决定电子的能量 a.s电子云球形一种状态 b.p电子云纺锤形三种取向(p x 、p y 、p z ) c.d电子云四叶花瓣形五种取向(d xy 、d yz 、d xz 、d x2-y2 、d z2 ) d.f电子云形状复杂 能级交错按ns、(n-2)f、(n-1)d、np顺序,能量由低到高3.核外电子排布规律 中国化学会第25届全国高中学生化学竞赛 1.008 Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Ac-Lr H Li Be B C N O F Na Mg Al Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr Ba Ra Y La Lu -6.9419.01222.9924.31 39.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210] [210]126.979.9035.454.003 20.18 39.9583.80 131.3 [222]He Ne Ar Kr Xe Rn 相对原子质量 Rf Db Sg Bh Hs Mt 评分通则: 1.凡要求计算得,没有计算过程,即使结果正确也不得分。 2.有效数字错误,扣0、5分,但每大题只扣1次。 3.单位不写或表达错误,扣0、5分,但每大题只扣1次。 4.只要求1个答案、而给出多个答案,其中有错误得,不得分。 5.方程式不配平不得分。 6.不包括在此标准答案得0、5分得题,可由评分组讨论决定就是否给分。 第1题(15分) 1-1 2011年就是国际化学年,就是居里夫人获得诺贝尔化学奖100周年。居里夫人发现得两种化学元素得元素符号与中文名称分别就是 与 。 1-2 向TiOSO 4水溶液中加入锌粒,反应后溶液变为紫色。在清夜中滴加适量得CuCl 2水溶液,产生白色沉淀。生成白色沉淀得离子方程式就是 ;继续滴加CuCl 2水溶液,白色沉淀消失,其离子方程式就是 。 1-3 20世纪60年代维也纳大学V 、Gutmann 研究小组报道,三原子分子A 可由SF 4与NH 3反应合成;A 被AgF 2氧化得到沸点为为27℃得三元化合物B 。A 与B 分子中得中心原子与同种端位原子得核间距几乎相等;B 分子有一根三种轴与3个镜面。画出A 与B 得结构式(明 确示出单键与重键,不在纸面上得键用楔形键表示,非键合电子不必标出)。 1-4 画出Al 2(n-C 4H 9)4H 2与Mg[Al(CH 3)4]2得结构简式。 1-5 已知E ?(FeO 42—/Fe 3+) = 2、20 V ,E ?(FeO 42— /Fe(OH)3) = 0、72 V 。 ① 写出氯气与三氯化铁反应形成高铁酸根得离子方程式。 。 ② 写出高铁酸钾在酸性水溶液中分解得离子方程式。 。 ③ 用高铁酸钾与镁等组成碱性电池,写出该电池得电极反应 。 第2题(11分) 2-1 画出2,4-戊二酮得钠盐与Mn 3+形成得电中性配合物得结构式(配体用O O 表示)。 2-2 已知该配合物得磁矩为4、9玻尔磁子,配合物中Mn 得未成对电子数为 。 2-3 回答:该化合物有无手性?为什么? 2-4 画出2,4戊二酮负离子得结构简式(必须明确其共轭部分),写出其中离域π键得表示符号。 2-5 橙黄色固体配合物A 得名称就是三氯化六氨合钴(Ⅲ),就是将二氯化钴、浓氨水、氯化铵与过氧化氢混合,以活性炭为催化剂合成得。机理研究发现,反应过程中首先得到Co(NH 3)62+离子,随后发生配体取代反应,得到以新配体为桥键得双核离子B 4+,接着发生桥键断裂,同时2 中国化学会第 21届( 2019 年)全国高中学生化学竞 赛 (省级赛区)试题 时间: 3 小时 满分: 100 分) 1 2 3 4 5 6 7 8 9 10 11 总分 满分 12 6 10 7 10 12 8 4 10 12 9 100 H 1.008 相对原子质量 He 4.003 Li Be B C N O F Ne 6.941 9.012 10.81 12.01 14.01 16.00 19.00 20.18 Na Mg Al Si P S Cl Ar 22.99 24.31 26.98 28.09 30.97 32.07 35.45 39.95 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 39.10 40.08 44.96 47.88 50.94 52.00 54.94 55.85 58.93 58.69 63.55 65.39 69.72 72.61 74.92 78.96 79.90 83.80 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 85.47 87.62 88.91 91.22 92.91 95.94 [98] 101.1 102.9 106.4 107.9 112.4 114.8 118.7 121.8 127.6 126.9 131.3 Cs Ba La - Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 132.9 137.3 Lu 178.5 180.9 183.8 186.2 190.2 192.2 195.1 197.0 200.6 204.4 207.2 209.0 [210] [210] [222] Fr [223] Ra [226] Ac - Lr Rf Db Sg Bh Hs Mt Ds Rg 第一题(12 分) 通常,硅不与水反应,然而,弱碱性水溶液能使一定量的硅溶解,生成 Si (OH ) 4 1.已知反应分两步进行,试用化学方程式表示上述溶解过程。 早在上世纪 50 年代就发现了 CH 5+ 的存在,人们曾提出该离子结构的种种假设,然而,直 至 1999 年才在低温下获得该离子的振动-转动光谱,并由此提出该离子的如下结构模型:氢 原子围绕着碳原子快速转动;所有 C - H 键的键长相等。 2.该离子的结构能否用经典的共价键理论说明?简述理由。 第二题( 6分) 羟胺和用同位素标记氮原子( N* )的亚硝酸在不同介质中发生反应,方程式如下: NH 2OH + HN*O 2→A +H 2O NH 2OH +HN*O 2→B +H 2O A 、 B 脱水都能形成 N 2O ,由 A 得到 N*NO 和 NN*O ,而由 B 只得到 NN*O 请分别写出 A 和 B 的路易斯结构式。 ) 路易斯酸 3.该离子是( A 质子酸 B 2003年 5月报道, 在石油中发现一种新的烷烃分子, 子钻石”,若能合成,有可能用作合成纳米材料的理想模板。该分子的结构简图如下: 4.该分子的分子式为 C 自由基 D 亲核试剂 因其结构类似于金刚石, 被称为 “分 6.该分子有几种不同级的碳原子? 7.该分子有无手性碳原 子? 中学化学竞赛试题资源库——有机合成 A 组 1.6-羰基庚酸是合成某些高分子材料和药物的重要中间体。某实验室以溴代甲基环己烷为原料合成6-羰基庚酸。 请用合成反应流程图表示出最合理的合成方案(注明反应条件) 提示:①合成过程中无机试剂任选,②如有需要,可以利用试卷中出现过的信息,③合成反应流程图表示方法示例如下: 2.已知①卤代烃(或 -Br )可以和金属反应生成烃基金属有机化合物。后者又 能与含羰基化合物反应生成醇: RBr +Mg ()?? ?→?O H C 252RMgBr ??→?O CH 2RCH 2OMgBr ???→?+ H O H /2RCH 2OH ②有机酸和PCl 3反应可以得到羧酸的衍生物酰卤: ③苯在AlCl 3催化下能与卤代烃作用生成烃基苯: 有机物A 、B 分子式均为C 10H 14O ,与钠反应放出氢气并均可经上述反应合成,但却 又不能从羰基化合物直接加氢还原得到。A与硫酸并热可得到C和C’,而B得到D和D’。 C、D分子中所有碳原子均可共处于同一平面上,而C’和D’却不可。请以最基础的石油产品(乙烯、丙烯、丙烷、苯等)并任选无机试剂为原料依下列路线合成B,并给出A、C’、D的结构简式及下述指定结构简式。 合成B的路线: 3.由指定原料及其他必要的无机及有机试剂会成下列化合物: (1)由丙烯合成甘油。 (2)由丙酮合成叔丁醇。 (3)由1-戊醇合成2-戊炔。 (4)由乙炔合成CH3CH2CH2CH2CH2CH2CH3。 (5)由CH3CH2CH2CHO合成 4.已知苯磺酸在稀硫酸中可以水解而除去磺酸基: 又知苯酚与浓硫酸易发生磺化反应: 请用化学方程式表示苯、水、溴、铁、浓硫酸及烧碱等为原料,合成的过程。 5.以CH2=CH2和H218O为原料,自选必要的其他无机试剂合成CH3--18O-C2H5,用化学方程式表示实现上述合成最理想的反应步骤。 中国化学会第21届全国高中学生化学竞赛(省级赛区)试题 (2007年9月16日 9:00 - 12:00共3小时) 题号 1 2 3 4 5 6 7 8 9 10 11 总分 满分 12 6 10 7 10 12 8 4 10 12 9 100 得分 评卷人 ● 竞赛时间3小时。迟到超过半小时者不能进考场。开始考试后1小时内不得离场。时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。 ● 试卷装订成册,不得拆散。所有解答必须写在指定的方框内,不得用铅笔填写。草稿纸在最后一页。不得持有任何其他纸张。 ● 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。 ● 允许使用非编程计算器以及直尺等文具。 第1题(12分) 通常,硅不与水反应,然而,弱碱性水溶液能使一定量的硅溶解,生成Si(OH)4。 1-1 已知反应分两步进行,试用化学方程式表示上述溶解过程。 早在上世纪50年代就发现了CH 5+ 的存在,人们曾提出该离子结构的多种假设,然而,直至1999年,才在低温下获得该离子的振动-转动光谱,并由此提出该离子的如下结构模型:氢原子围绕着碳原子快速转动;所有C-H 键的键长相等。 1-2 该离子的结构能否用经典的共价键理论说明?简述理由。 1-3 该离子是( )。 A.质子酸 B.路易斯酸 C.自由基 D.亲核试剂 2003年5月报道,在石油中发现了一种新的烷烃分子,因其结构类似于金刚石,被称为“分子钻石”,若能合成,有可能用做合成纳米材料的理想模板。该分子的结构简图如下: 1-4 该分子的分子式为 ; 1-5 该分子有无对称中心? 1-6 该分子有几种不同级的碳原子? 1-7 该分子有无手性碳原子? 1-8 该分子有无手性? 第2题(5分) 羟胺和用同位素标记氮原子(N ﹡ )的亚硝酸在不同介质中发生反应,方程式如下: NH 2OH+HN ﹡ O 2→ A +H 2O NH 2OH+HN ﹡ O 2→ B +H 2O A 、 B 脱水都能形成N 2O ,由A 得到N ﹡NO 和NN ﹡O ,而由B 只得到NN ﹡ O 。 请分别写出A 和B 的路易斯结构式。 第3题(8分) X-射线衍射实验表明,某无水MgCl 2晶体属三方晶系,呈层形结构,氯离子采取立方最密堆积(ccp ),镁离子填满同层的八面体空隙;晶体沿垂直于氯离子密置层的投影图如下。该晶体的六方晶胞的参数: a=363.63pm,c=1766.63pm;p=2.53g ·cm -3 。 3-1 以“ ”表示空层,A 、B 、C 表示Cl -离子层,a 、b 、c 表示Mg 2+ 离子层,给出三方层型结构的堆积方 式。 2计算一个六方晶胞中“MgCl 2”的单元数。 3假定将该晶体中所有八面体空隙皆填满Mg 2+ 离子,将是哪种晶体结构类型? 第4题(7分) 化合物A 是一种热稳定性较差的无水的弱酸钠盐。用如下方法对其进行分析:将A 与惰性填料混合均匀制成样品,加热至400℃,记录含A 量不同的样品的质量损失(%),结果列于下表: 样品中A 的质量分数/% 20 50 70 90 样品的质量损失/% 7.4 18.5 25.8 33.3 利用上述信息,通过作图,推断化合物A 的化学式,并给出计算过程。 1-3该离子是()。 A.质子酸 B.路易斯酸 C.自由基 D.亲核试剂 2003年5月报道,在石油中发现了一种新的烷烃分子,因其结构类似于金刚石,被称为“分子钻石”,若能合成,有可能用做合成纳米材料的理想模板。该分子的结构简图如下: 1-4该分子的分子式为; 1-5该分子有无对称中心? 1-6该分子有几种不同级的碳原子? 1-7该分子有无手性碳原子? 1-8该分子有无手性? 第2题(5分) 羟胺和用同位素标记氮原子(N﹡)的亚硝酸在不同介质中发生反应,方程式如下: NH2OH+HN﹡O2→A+H2O NH2OH+HN﹡O2→B+H2O A、B脱水都能形成N2O,由A得到N﹡NO和NN﹡O,而由B只得到NN﹡O。 请分别写出A和B的路易斯结构式。 第3题(8分) X-射线衍射实验表明,某无水MgCl2晶体属三方晶系,呈层形结构,氯离子采取立方最密堆积(ccp),镁离子填满同层的八面体空隙;晶体沿垂直于氯离子密置层的投影图如下。该晶体的六方晶胞的参数:a=363.63pm,c=1766.63pm;p=2.53g·cm-3。 3-1 以“”表示空层,A、B、C表示Cl-离子层,a、b、c表示Mg2+离子层,给出三方层 型结构的堆积方式。 3-2计算一个六方晶胞中“MgCl2”的单元数。 3-3 假定将该晶体中所有八面体空隙皆填满Mg2+离子,将是哪种晶体结构类型? 第4题(7分) 化合物A是一种热稳定性较差的无水的弱酸钠盐。用如下方法对其进行分析:将A与惰性填料混合均匀制成样品,加热至400℃,记录含A量不同的样品的质量损失(%),结果列于下表: 利用上述信息,通过作图,推断化合物A的化学式,并给出计算过程。 第5题(10分) 甲苯与干燥氯气在光照下反应生成氯化苄,用下列方法分析粗产品的纯度:称取0.255g 样品,与25mL 4mol·L-1氢氧化钠水溶液在100 mL圆底烧瓶中混合,加热回流1小时;冷至室温,加入50 mL20%硝酸后,用25.00mL 0.1000mol·L-1硝酸银水溶液处理,再用0.1000mol·L-1NH4SCN水溶液滴定剩余的硝酸银,以硫酸铁铵为指示剂,消耗了6.75 mL。 高中化学竞赛模拟试题(二) 第1题(7分) 完成下列各步反应的化学反应式 1.由AgCl 制备AgNO 3:将AgCl 溶解在氨水中,电解,所得产物溶于硝酸; 2.由Hg 2Cl 2得到Hg :浓硝酸氧化,加热至干,溶于热水后电解; 第2题(8分) 钢中加入微量钒可起到脱氧和脱氮的作用,改善钢的性能。 测定钢中钒含量的步骤如下:钢试样用硫磷混合酸分解,钒以四价形式存在。再用KMnO 4将其氧化为五价,过量的KMnO 4用NaNO 2除去,过量的NaNO 2用尿素除去。五价钒与N -苯甲酰-N -苯基羟胺在3.5~5mol/L 盐酸介质中以1︰2形成紫红色单核电中性配合物,比色测定。 回答如下问题: 1.高价钒在酸性溶液中通常以含氧阳离子的形式存在。写出钒与浓硫酸作用的反应方程式。 2.以反应方程式表示上述测定过程中KMnO 4、NaNO 2和尿素的作用。 第3题(8分) 黄金的提取通常采用氰化-氧化法。 (1)氰化法是向含氰化钠的矿粉(Au 粉)混合液中鼓入空气,将金转移到溶液,再用锌粉还原提取Au 。试写出反应过程的离子方程式,计算两个反应的平衡常数。 (已知:Ф0Au +/Au =1.68V ,Ф0O 2/OH -=0.401V ,Ф0Zn 2+/Zn =-0.70V ,K 稳Au(CN)2-=2.0×1038 K 稳Zn(OH)4 2-=1.0×1016) (2)为保护环境,必须对含CN -废水进行处理,请设计两个原理不同的处理方案。比较它们的优缺 第4题(6分) 1.用通用的符号和式子说明所谓的过氧化合物,写出四种过氧化合物的化学式。 2.过氧化钙由于具有稳定性好,无毒,且具有长期放氧的特点,使之成为一种应用广泛的多功能的无机过氧化物,主要用于消毒杀菌。定量测定过氧化钙(Ⅱ)中过氧化物含量,通常先用适当的酸使过氧化钙分解,然后采用高锰酸钾法或碘量法测定以上分解产物。请写出这两种方法的化学方程第5题完成下列各化学反应方程式(11分): 1 三硫化二砷溶于硫化钠溶液。 高中化学竞赛第三讲热分解反应基本规律 本讲的主题是“有规则拆分”! 一、热分解反应的“推动力” 从热力学角度看,热分解反应是向着能量低产物方向进行,反应的“推动力”是能量降低的过程(△r G=△r H-T△r S)。 用上述观点可以解释下列反应为什么是按(1)式而不是按(2)式进行: CaCO3→CaO+CO2(1)CaCO3→CaC+3/2O2(2) KClO3→KCl+3/2O2(1)KClO3→1/2K2O+1/2Cl2O5(2) 二、含氧酸盐的热分解反应规律 按上述能量观点,由于氧化物能量低于相应硫化物、氮化物、磷化物、碳化物,所以(大多数)硫酸盐、硝酸盐、碳酸盐、草酸盐的(固态)热分解按以下规律进行:含氧酸盐(s)→金属氧化物(s)+酸酐(热分解通式) 还要考虑的是,酸酐是否稳定?金属氧化物是否稳定?两种产物间是否还会发生氧化还原反应?(实例见下)。 (一)硫酸盐的热分解反应 规律:硫酸盐(s)→金属氧化物(s)+SO3 例: 1、当温度显著高于758℃时,SO3分解,气态产物以SO2和O2为主,反之气态产物以SO3为主。(758℃是从△r G=△r H-T△r S计算出来的数据。) 例: 2、在活动序中位于铜以后的金属硫酸盐,因碱性氧化物对热不稳定而分解。 例: 若分解温度不很高,则得HgO和SO3;若高于HgO显著分解的温度,则产物为Hg和SO3、O2。 3、两种产物间发生氧化还原反应 例: 产物中有Fe2O3、SO2,原因是“高温”下SO3有一定的氧化性,氧化FeO为Fe2O3,自身转化为SO2。 (二)硝酸盐的热分解反应 1、NaNO3、KNO3在温度不很高条件下分解为MNO2和O2。 例:2KNO32KNO2+O2↑ 2、其余硝酸盐均可按照热分解反应通式讨论:硝酸盐→金属氧化物+硝酸酐(N2O5) ∵N2O5在室温下就明显分解:N2O5=2NO2+1/2O2 第五章晶体结构 §5-1晶体的点阵理论 1. 晶体的结构特征 人们对晶体的印象往往和晶莹剔透联系在一起。公元一世纪的古罗马作家普林尼在《博物志》中,将石英定义为“冰的化石”,并用希腊语中“冰”这个词来称呼晶体。我国至迟在公元十世纪,就发现了天然的透明晶体经日光照射以后也会出现五色光,因而把这种天然透明晶体叫做"五光石"。其实,并非所有的晶体都是晶莹剔透的,例如,石墨就是一种不透明的晶体。 日常生活中接触到的食盐、糖、洗涤用碱、金属、岩石、砂子、水泥等都主要由晶体组成,这些物质中的的晶粒大小不一,如,食盐中的晶粒大小以毫米计,金属中的晶粒大小以微米计。晶体有着广泛的应用。从日常电器到科学仪器,很多部件都是由各种天然或人工晶体而成,如,石英钟、晶体管,电视机屏幕上的荧光粉,激光器中的宝石,计算机中的磁芯等等。 晶体具有按一定几何规律排列的内部结构,即,晶体由原子(离子、原子团或离子团)近似无限地、在三维空间周期性地呈重复排列而成。这种结构上的长程有序,是晶体与气体、液体以及非晶态固体的本质区别。晶体的内部结构称为晶体结构。 晶体的周期性结构,使得晶体具有一些共同的性质: (1) 均匀性晶体中原子周期排布的周期很小,宏观观察分辨不出微观的不连续性,因而,晶体内部各部分的宏观性质(如化学组成、密度)是相同的。 (2) 各向异性在晶体的周期性结构中,不同方向上原子的排列情况不同,使得不同方向上的物理性质呈现差异。如,电导率、热膨胀系数、折光率、机械强度等。 (3) 自发形成多面体外形无论是天然矿物晶体还是人工合成晶体,在一定的生长条件下,可以形成多面体外形,这是晶体结构的宏观表现之一。晶体也可以不具有多面体外形,大多数天然和合成固体是多晶体,它们是由许多取向混乱、尺寸不一、形状不规则的小晶体或晶粒的集合。 (4) 具有确定的熔点各个周期内部的原子的排列方式和结合力相同,到达熔点时,各个周期都处于吸热溶 竞赛时间3小时。迟到超过半小时者不能进考场。开始考试后1小时内不得离场。时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。 ●试卷装订成册,不得拆散。所有解答必须写在指定的方框内,不得用铅笔填 写。草稿纸在最后一页。不得持有任何其他纸张。 ●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废 卷论处。 ●允许使用非编程计算器以及直尺等文具。 第一题 (17分) Cr及其化合物在现今工业上十分常用,Cr占地壳蹭的丰度为0.0083%,主要来源是铬铁矿、铬铅矿。最初Cr的提炼是用铬铁矿与焦炭共热生产的。 1.写出铬铁矿、铬铅矿的化学式,写出铬铁矿与焦炭共热的反应方程式。 。其水溶液可有三2.Cr常见的价态为+3和+6,常见的Cr(Ⅲ)化合物为CrCl 3 种不同的颜色,分别为紫色、蓝绿色和绿色,请分别画出这三种不同颜色的Cr (Ⅲ)化合物阳离子的立体结构。指出Cr的杂化方式 3.常见的Cr(Ⅵ)化合物是重铬酸钾,是由铬铁矿与碳酸钠混合在空气中煅烧后用水浸取过滤,然后加适量硫酸后加入氯化钾即可制得,写出涉及的反应方程式。 4.在钢铁分析中为排除Cr的干扰可加入NaCl和HClO 加热至冒烟来实现,写出 4 (CN)2被称为拟卤素,其性质与卤素单质既有相似点,也有一些不同。它可以由含有同一种元素的两种化合物一同制取得到。 1. 写出制取(CN)2的反应方程式。 2. (CN)2不稳定,它在水溶液中有2种水解方式,其中一种是生成HCN与HOCN。 请分别写出(CN)2的两种水解反应的方程式。 3. HCN在加热时与O2反应,反应比为8:3,写出该反应方程式。 4.液态的HCN不稳定,易聚合。其中,三聚体中包含有2种不同环境的C, 2 种不同环境的H与2种不同环境的N;而四聚体中H只有1种环境,C,N则各有2种不同环境。试画出两种聚合体的结构,并分别标明它们中所具有的 SmCo5是一种典型的AB5型金属化合物,可作为磁性材料,其结构如下 其中大球为Sm,小球为Co。而另一种永磁体材料X跟SmCo5的结构密切相关,他是将如图(a)层的1/3Sm原子用一对Co原子代替,并且这对Co原子不在(a)平面上而是出于该平面的上方和下方,其连线被(a)平面垂直平分。且相邻两(ABAB……型排列,三方晶胞则为ABCABC……型排列。 高中化学竞赛培训讲义分子结构 【高中知识】 一.化学键1.含义及其分类 通称为化学键,包括离子键和共价键。化学键的形成与有关,它主要通过原子的或来实现。 2.一个化学反应的过程,本质上是旧化学键断裂和新化学键的形成。 二、离子键: 1、离子键 称为离子键 ①成键微粒: ②成键本质: ③成键条件: 注意:1含有离子键的化合物均为离子化合物(如:大多数金属化合物、碱、盐类) 2 金属和非金属不一定形成离子键,例如:氯化铝 3非金属和非金属也能形成离子键,例如:氯化铵 例1.下列化合物中有离子键的是() (1)KI (2)HBr (3)Na 2 SO 4(4)NH 4 Cl (5)H 2 CO 3 三、电子式: 1、定义:在化学反应中,一般是原子的电子发生变化,我们可以在元素符 号周围用小黑点(·或X)来代表原子的最外层电子,这种式子叫电子式。 2、电子式的的书写 (1)原子的电子式 (2)离子的电子式 (3)离子化合物的电子式 (4)用电子式表示化合物的形成过程: 例2.用电子式表示氯化钠的形成过程: 注意:左边写原子的电子式,右边写化合物的电子式,中间用箭头连接,离子化合物还要 用箭头表示出电子的转移方向,不写反应条件。 例3用电子式表示下列化合物的形成过程 KBr: MgCl 2: Na2S: 四、共价键 1、共价键 叫做共价键 ①成键微粒: ②成键本质: ③成键条件: 注意:(1)只含有共价键的化合物属于共价化合物(即若存在离子键,一定为离子化合物)(2)共价键存在于非金属单质的双原子分子中,共价化合物和某些离子化合物 中(如NaOH、Na2O2)。 (3)稀有气体不存在任何化学键 2、共价键的表示方法 ①电子式: 单质: 化合物: ②结构式(用短线“-”表示一对共用电子):H2 N2 HCl H2O NH3 CO2 CH4 Cl2 ③用电子式表示共价化合物的形成过程: H2: HCl: 例1 用电子式表示下列化合物的形成过程 CO2: H2O: 3、共价键的分类: ①非极性键:在双原子单质分子中,同种原子形成的共价键,两原子吸引电子的能力,共用电子对任何一个原子,成键的原子都电性。这样的共价键叫做非极性 高中化学竞赛用书推荐 常规/高考类: 化学岛 用户名: 密码:woaihuaxuedao 以下是另一个公邮 icholand. 密码:huaxuedaogongyou 提供公共邮箱的目的还是方便大家交流,如果遇到超出流量限制的问题,可以直接把邮件转发出去。 尽管以前有XX的Gbaopan。。但是貌似很多人并不清楚密码。。 附上: 部分优秀资料帖索引 《高中化学重难点手册》(华中师范大学出版社,王后雄老师主编);历年高考试题汇编(任何一种,最好有详细解析的,比如三年高考两年模拟);《高中化学读本》(很老的人民教育出版社甲种本化学教材,最近有更新版本);《高中化学研究性学习》(龙门书局,施华、盛焕华主编)南师大化科院创办的《化学教与学》每年的十套高考模拟题题型新颖质量比较高,可作为江苏预赛的模拟卷,不少5月份预赛原题就出自本套模拟题。 初赛类: 比较经典的有《化学高考到竞赛》(陕西师范大学出版社,李安主编,比较老);《高中化学奥林匹克初级本》(江苏教育出版社,段康宁主编);《高中化学竞赛初赛辅导》(陕西师范大学出版社,李安、苏建祥主编);《高中化学竞赛热点专题》(湖南师范大学出版社,肖鹏飞、苏建祥、周泽宇主编,版本比较老,但编排体系不错);最新奥林匹克竞赛试题评析·高中化学》(南京师范大学出版社,马宏佳主编,以历年真题详细解析为主,可作为课外指导);《最新竞赛试题选编及解析高中化学卷》(首都师范大学出版社);《化学竞赛教程》(华东师范大学出版社,三本,王祖浩、邓立新、施华等人编写,适合同步复习),还有一套西南师范大学出版社的《奥林匹克竞赛同步教材·高中化学》(分高一、高二和综合卷,综合卷由严先生、吴先生、曹先生等参加编写,绝对经典),还有浙江大学出版社《高中化学培优教程》AB教程、《金牌教程·高一/二化学》(邓立新主编,南京大学出版社)。江苏省化学夏令营使用的讲义是马宏佳主编的《全国高中化学竞赛标准教程》(东南大学出版社),简明扼要,但由于不同教授编写不同章节,参差不齐;春雨出版的《冲刺金牌·高中化学奥赛辅导》(任学宝主编,吉林教育出版社)、《冲刺金牌·高中化学奥赛解题指导》(孙夕礼主编,吉林教育出版社)。《赛前集训·高中化学竞赛专题辅导》(施华编著,体现他的竞赛培训思维,华东师范大学出版社) 比较新颖的包括浙江大学出版社的林肃浩主编的竞赛系列《高中化学竞赛实战演练》(高一、高二)、《高中化学竞赛解题方法》、《冲刺高中化学竞赛(省级预赛)》、《冲刺高中化学竞赛(省级赛区)》、《高中化学竞赛解题方法》、《决战四月:浙江省高中化学竞赛教程(通向金牌之路)》《金版奥赛化学教程》(高一、高二、·综合)都是近年来体系、选题新颖的竞赛资料,足见浙江省对化学竞赛的重视,端木非常推荐。南京教研室刘江田老师2010年5月份主编的《高中化学竞赛全解题库》(南京大学出版社)选择了近年来省级赛区真题和各地新颖的预赛题,解析详细,适合缺少老师指导的同学参考。 决赛类: 比较经典的有《高中化学奥林匹克高级本》(江苏教育出版社,段康宁主编,完全按照大学的思路);《金牌之路高中化学竞赛辅导》以及配套解题指导书(陕西师范大学出版社,李安主编);《高中化学竞赛决赛辅导》(陕西师范大学出版社,李安、苏建祥主编);《历届国际化学奥林匹克竞赛试题分析》(学苑出版社);《最新国际国内化学奥林匹克竞赛优化解题题典》(吉林教育出版社),还有浙江大学出版社的浙江大学出版社《高中化学培优教程》“专题讲座”,《高中化学奥赛一 初赛基本要求 1、有效数字在化学计算与化学实验中正确使用有效数字。定量仪器(天平、量筒、移 液管、滴定管、容量瓶等等)测量数据得有效数字。数字运算得约化规则与运算结果得有效数字。实验方法对有效数字得制约。 2、气体理想气体标准状况(态)。理想气体状态方程。气体常量R。体系标准压力。 分压定律。气体相对分子质量测定原理。气体溶解度(亨利定律)。 3、溶液溶液浓度。溶解度。浓度与溶解度得单位与换算。溶液配制(仪器得选择)。 重结晶得方法及溶质/溶剂相对量得估算。过滤与洗涤(洗涤液选择、洗涤方式选择)。 重结晶与洗涤溶剂(包括混合溶剂)得选择。胶体。分散相与连续相。胶体得形成与破坏。 胶体得分类。胶体得基本结构。 4、容量分析被测物、基准物质、标准溶液、指示剂、滴定反应等基本概念。酸碱滴 定曲线(酸碱强度、浓度、溶剂极性对滴定突跃影响得定性关系)。酸碱滴定指示剂得选择。以高锰酸钾、重铬酸钾、硫代硫酸钠、EDTA为标准溶液得基本滴定反应。分析结果得计算。分析结果得准确度与精密度。 5、原子结构核外电子运动状态: 用s、p、d等来表示基态构型(包括中性原子、正离 子与负离子)核外电子排布。电离能、电子亲合能、电负性。 6、元素周期律与元素周期系周期。1—18族。主族与副族。过渡元素。主、副族同 族元素从上到下性质变化一般规律;同周期元素从左到右性质变化一般规律。原子半径与离子半径。s、p、d、ds区元素得基本化学性质与原子得电子构型。元素在周期表中得位置与核外电子结构(电子层数、价电子层与价电子数)得关系。最高氧化态与族序数得关系。对角线规则。金属与非金属在周期表中得位置。半金属(类金属)。主、副族得重要而常见元素得名称、符号及在周期表中得位置、常见氧化态及主要形态。铂系元素得概念。 7、分子结构路易斯结构式。价层电子对互斥模型。杂化轨道理论对简单分子(包括离 子)几何构型得解释。共价键。键长、键角、键能。σ键与π 键。离域π键。共轭(离域)体系得一般性质。等电子体得一般概念。键得极性与分子得极性。相似相溶规律。 对称性基础(限旋转与旋转轴、反映与镜面、反演与对称中心)。 8. 配合物路易斯酸碱。配位键。重要而常见得配合物得中心离子(原子)与重要而常见得 配体(水、羟离子、卤离子、拟卤离子、氨分子、酸根离子、不饱与烃等)。螯合物及螯合效应。重要而常见得配合反应。配合反应与酸碱反应、沉淀反应、氧化还原反应得关系(定性说明)。配合物几何构型与异构现象基本概念与基本事实。配合物得杂化轨道理论。用杂化轨道理论说明配合物得磁性与稳定性。用八面体配合物得晶体场理论说明Ti(H2O)63+得颜色。软硬酸碱得基本概念与重要得软酸软碱与硬酸硬碱。 9. 分子间作用力范德华力、氢键以及其她分子间作用力得能量及与物质性质得关系。 10、晶体结构分子晶体、原子晶体、离子晶体与金属晶体。晶胞(定义、晶胞参数与原 子坐标及以晶胞为基础得计算)。点阵(晶格)能。配位数。晶体得堆积与填隙模型。常见得晶体结构类型:NaCl、CsCl、闪锌矿(ZnS)、萤石(CaF2)、金刚石、石墨、硒、冰、干冰、金红石、二氧化硅、钙钛矿、钾、镁、铜等。 11、化学平衡平衡常数与转化率。弱酸、弱碱得电离常数。溶度积。利用平衡常数得计 算。熵(混乱度)得初步概念及与自发反应方向得关系。 12、离子方程式得正确书写。高中化学 第1讲 气体奥赛辅导讲义
全国高中化学竞赛资料
中国化学会第25届全国高中学生化学竞赛试题及答案(word版)
中国化学会第21届(2019年)全国高中学生化学竞赛(省级赛区)试题和答案(内部资料,请不要上传到互
高中化学竞赛题--有机合成
历年高中化学奥赛竞赛试题及答案
全国高中学生化学竞赛初赛试题及答案
高中化学竞赛模拟试题(二)
高中化学竞赛讲义_热分解反应规律
高中化学竞赛经典讲义——晶体结构
高中化学竞赛模拟试题(附答案)
高中化学竞赛培训讲义 分子结构
高中化学竞赛用书推荐
高中化学竞赛全套