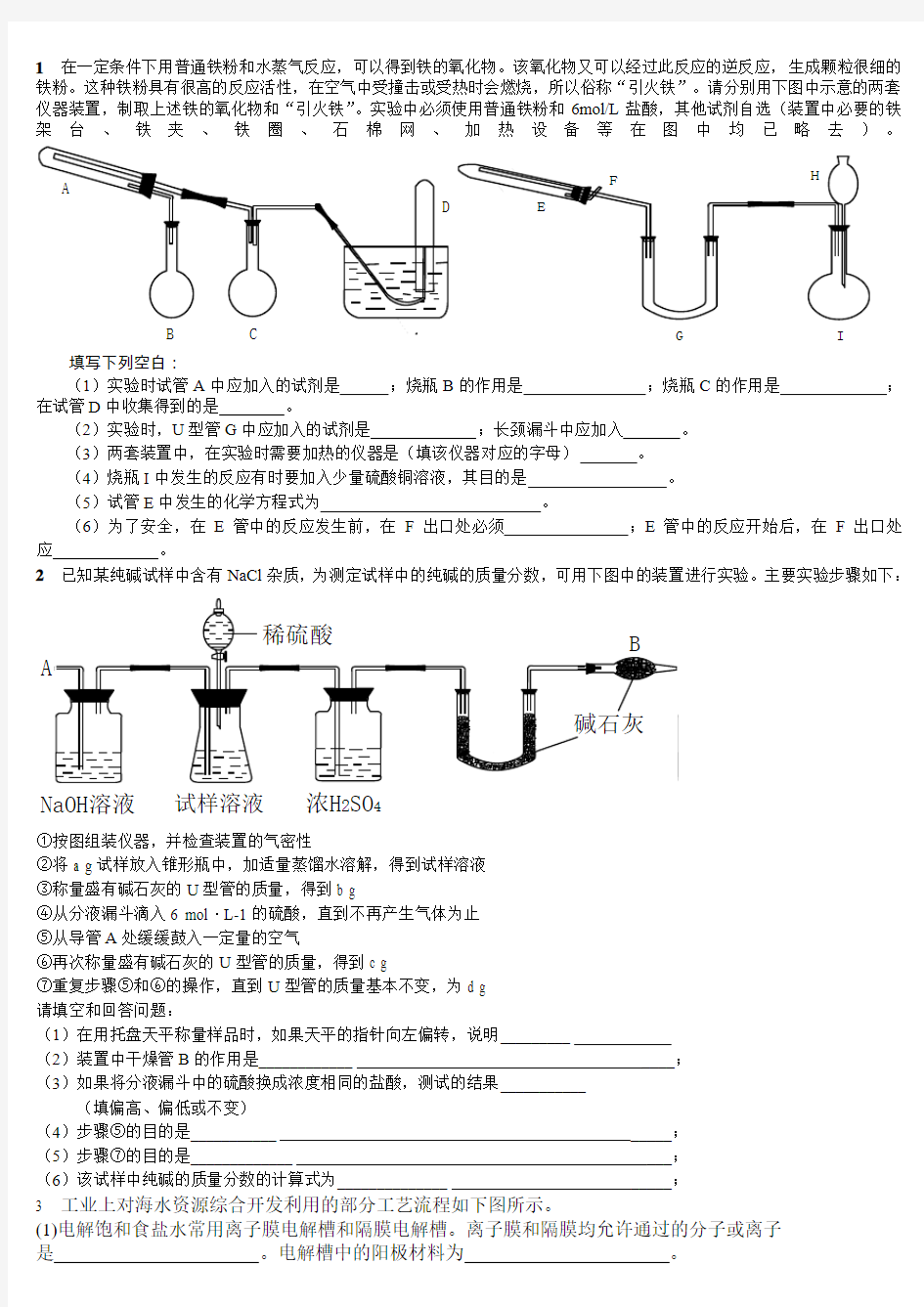
1在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6mol/L盐酸,其他试剂自选(装置中必要的铁
架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)
。
G I
填写下列空白:
(1)实验时试管A中应加入的试剂是;烧瓶B的作用是;烧瓶C的作用是;在试管D中收集得到的是。
(2)实验时,U型管G中应加入的试剂是;长颈漏斗中应加入。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)。
(4)烧瓶I中发生的反应有时要加入少量硫酸铜溶液,其目的是。
(5)试管E中发生的化学方程式为。
(6)为了安全,在E管中的反应发生前,在F出口处必须;E管中的反应开始后,在F出口处应。
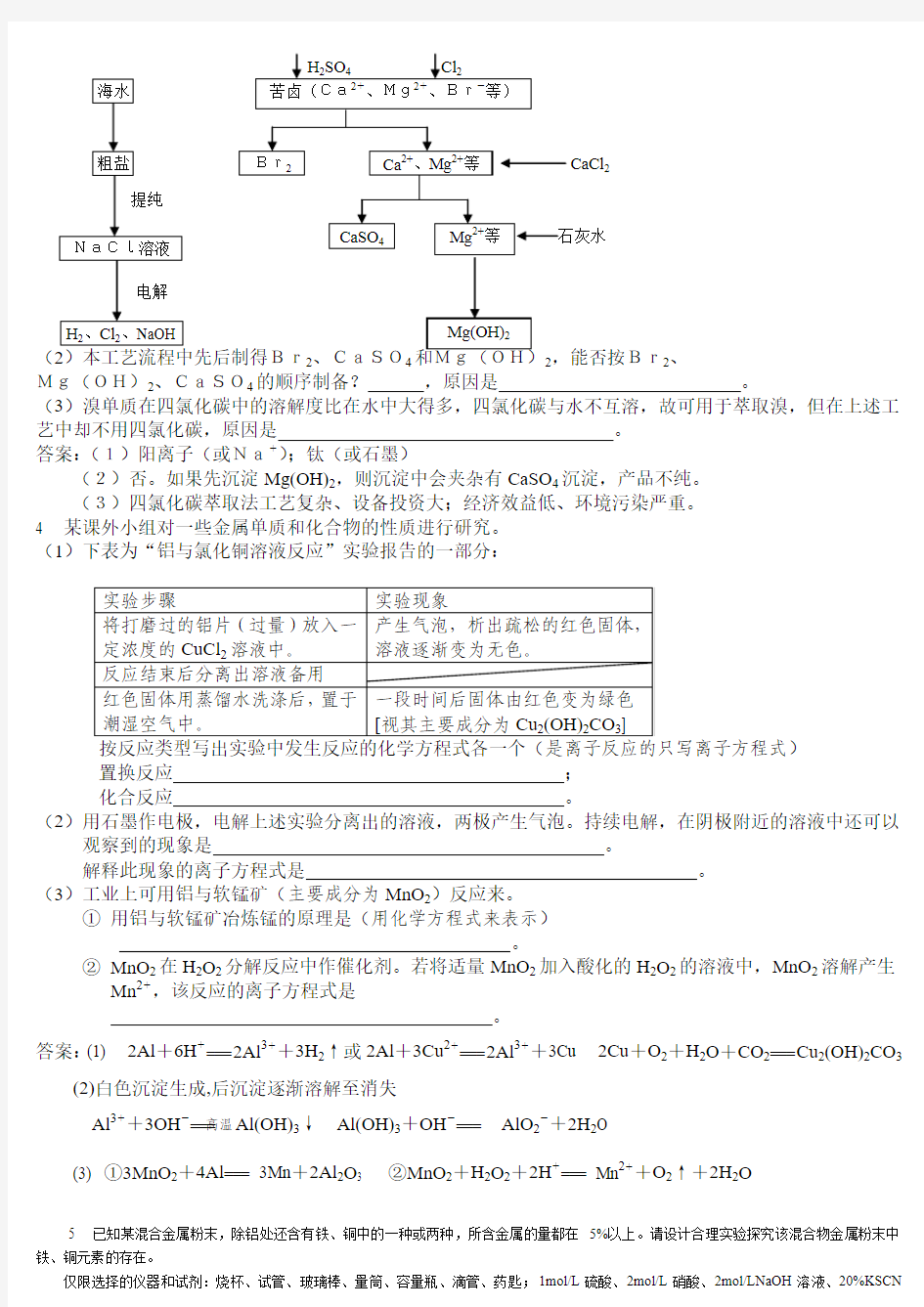
2已知某纯碱试样中含有NaCl杂质,为测定试样中的纯碱的质量分数,可用下图中的装置进行实验。主要实验步骤如下:
NaOH溶液试样溶液浓H2SO4
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到b g
④从分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明_________
(2)装置中干燥管B的作用是____________ ____;
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果___________
(填偏高、偏低或不变)
(4)步骤⑤的目的是___________ _____;
(5)步骤⑦的目的是_____________ ___;
(6)该试样中纯碱的质量分数的计算式为______________ _____;
3 工业上对海水资源综合开发利用的部分工艺流程如下图所示。
(1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽。离子膜和隔膜均允许通过的分子或离子
是。电解槽中的阳极材料为。
(
2422
、
Mg(OH)2、CaSO4的顺序制备?,原因是。
(3)溴单质在四氯化碳中的溶解度比在水中大得多,四氯化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氯化碳,原因是。
答案:(1)阳离子(或Na+);钛(或石墨)
(2)否。如果先沉淀Mg(OH)2,则沉淀中会夹杂有CaSO4沉淀,产品不纯。
(3)四氯化碳萃取法工艺复杂、设备投资大;经济效益低、环境污染严重。
4 某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
)置换反应;
化合反应。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是。
解释此现象的离子方程式是。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来。
①用铝与软锰矿冶炼锰的原理是(用化学方程式来表示)
。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生
Mn2+,该反应的离子方程式是
。
答案:(1) 2Al+6H+===2Al3++3H2↑或2Al+3Cu2+===2Al3++3Cu 2Cu+O2+H2O+CO2===Cu2(OH)2CO3
(2)白色沉淀生成,后沉淀逐渐溶解至消失
Al3++3OH-===Al(OH)3↓Al(OH)3+OH-===AlO2-+2H2O
(3) ①3MnO2+4Al=== 3Mn+2Al2O3 ②MnO2+H2O2+2H+=== Mn2++O2↑+2H2O
5 已知某混合金属粉末,除铝处还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol/L硫酸、2mol/L硝酸、2mol/LNaOH溶液、20%KSCN 高温
溶液。
完成以下实验探究过程:
(1)提出假设:
假设1:该混合金属粉末中除铝外还含有元素;假设2:该混合金属粉末中除铝外还含有元素;
假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
(2)设计实验方案基于假设3,设计出实验方案(不要在答题卡上作答)。
(3)实验过程
根据(2)的实验方案,叙述实验操作、预期现象和结论。
【提示】Ⅰ.在答题卡上按以下方式作答,注意前后内容对应;
Ⅱ.注意文字简洁,确保不超过答题卡空间。
答案:(1)Cu;Fe(顺序可交换)
(3)①用药匙取少许样品,加入试管A中,再用滴管取过量NaOH溶液并滴加到试管A中,充分反应后,静置,弃去上层清液,剩余固体备用样品部分溶解,并有气体放出
②往试管A的剩余固体中加过量稀硫酸,充分反应后,静置。取上层清液于试管B中,剩余固体备用固体部分溶解,并有气体放出,
溶液呈浅绿色,可能含铁
③往试管B中加入少许稀硝酸,再滴加KSCN溶液溶液先变黄色,加KSCN后显血红色,结合②可知,一定含铁
④往②剩余固体中加入稀硝酸,再滴加NaOH溶液固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色,加NaOH溶液
后有蓝色沉淀产生,一定含铜。
6 某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如右图装置。倾斜A使稀硫酸(足量)与固体M 充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)
由上述实验事实可知:
(1)①固体M中一定有的物质是______________(填化学式)
理由是__________________________________________________________________________
②其中一种物质的质量可以确定为___________g(用代数式表示)。
(2)B装置的名称是________。
写出B装置中反应的离子方程式_______________________________________。
(3)C装置的作用是_________________________,如果实验中没有B装置,则C装置中产生的现象是____________________________________________________________________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________ a.M中有未反应的铁和硫b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体d.气体进入D装置前未用浓硫酸干燥
答案:(1)①FeS、Fe B装置增重、量气管有气体。②V/11200
(2)洗气瓶2OH-+H2S → 2H
O+S2--(3)证明H2S已被完全吸收黑色沉淀
2
(4)硫漏斗、玻璃棒(5)b、C
7 有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C
中,木条复燃。
请回答下列问题:
(1)第1小组同学认为Na 2O 2与SO 2反应生成了Na 2SO 3和O 2,该反应的化学方程式是: (2)请设计一种实验方案证明Na 2O 2与SO 2反应生成的白色固体中含有Na 2SO 3。
(3)第2小组同学认为Na 2O 2与SO 2反应除了生成Na 2SO 3和O 2外,还有Na 2SO 4生成。为检验是否有Na 2SO 4生成,他们设计了如下方案: 上述方案是否合理? 。请简要说明 两点理由:
① ;
② 。
答案: ⑴.用导管将A 的上口和B 相连(或将A 换成恒压滴液漏斗) 在G 和H 之间增加干燥装置
⑵.MnO 2 + 4 H +
+2 C1-
== Mn 2+
+ C12 ↑+ 2H 2O 2S+C12
S 2C12
⑶.饱和食盐水(或水) 浓硫酸 ⑷.分液漏斗 蒸馏烧瓶 导气、冷凝 ⑸.产率降低 有固体产生(或其他正确描述) ⑹.SCl 2、C12、S (任写其中两种即可)
8 过碳酸钠(Na 2CO 4)和稀硫酸反应的化学方程式为: 2Na 2CO 4+2H 2SO 4=2Na 2SO 4+2CO 2↑+O 2↑+2H 2O
某过碳酸钠样品中含有少量过氧化钠,甲、乙两位同学各称取质量为m 的该样品,并用下图所示是仪器测定样品的纯度。仪器的连接顺序是:甲是①⑦③⑥④; 乙是①②。
请回答下列问题:
(1)甲同学想通过实验测得的数据是_______。他使用之中③______(填“有”或“没有”)必要。
(2)乙同学想通过实验测得的数据是_______。按他测得的数据计算出的实验结果_______(填“偏高”或“偏低”),理由是________。
(3)为了测得准确的实验数据,请你将乙同学的实验装置进行改进(每种仪器只准使用一次),写出各仪器接口的连接顺序。 (4)按你设计的实验之中进行实验,若测得实验前后装置②的质量分别是w 1和w 2,则样品中过碳酸钠的质量分数为__________。
答案 :(1)氧气的体积 没有 (2) CO 2的质量 偏高 气体中的水蒸气被碱石灰吸收,同时空气中的CO 2和水蒸气也被碱石灰吸收 (3)AHGBCFE 或AFEBCHG(B 、C 可交换) (4) 30.5(w 2-w 1)
11m
9 氯化铁是中学化学实验室中比不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl 3·6H 2O 。该同学设计的实验之中如图所示,A 中放有m g 废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a ,关闭b ,从分液漏斗内向A 中加过量的稀盐酸,此时溶液呈浅绿色,再打开b 进行过滤,过滤结束后,取烧杯内溶液倒入蒸
发皿加热,蒸发掉部分水使多余HNO 3分解,再降温结晶得FeCl 3·
6H 2O 。
F
① ②
③
④ ⑤ ⑥ ⑧
⑦
请完成下列问题:
(1)如何检验装置A 的气密性?
(2)滴加盐酸时,发现反应速率较之同浓度盐酸与纯铁粉反应要快,其原因是____。 (3)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl 3·6H 2O 晶体,而不用直接蒸发结晶的方法来制得晶体的理由是________。
(4)用该法制得的晶体中往往混有Fe(NO 3)3,为了制得较纯净的FeCl 3·6H 2O ,可将烧杯内的稀硝酸换成______。
(5)若要测废铁屑的纯度,可测出从B 中放出气体的体积V(已折算成标况,单位:L),则废铁屑的纯度为________(用m 、V 的代数式表示),请在框图C 中画出必要的装
答案 :(1)①关闭活塞a 、b ,打开分液漏斗活塞和上端塞子,从中注水,漏斗下端会形成一段液柱,一段时间后,若液柱缓缓下移,说明气密性不好,若液柱停住不动,则说明气密性良好。
②关闭分液漏斗活塞和活塞b ,打开活塞a ,将管口B 接一段带玻璃管的乳胶管并浸入水槽水中,双手捂住装置A ,若水槽中有气泡产生,放开双手,玻璃管中形成一段液柱,则气密性良好。 (2)铁粉与杂质铜形成原电池反应,加快了反应速率
(3)因为FeCl 3是强酸弱碱盐,所以会发生如下的水解反应:FeCl 3+3H 2
O 3+3HCl ,加热蒸干时使挥发造成水解
平衡右移,因此得不到FeCl 3·6H 2O (4)双氧水(或新制氯水) (5)
5V 2m 或56V 22.4m
(实验装置见图)
10某学习小组用题27图装置测定铝镁合金中铝的质量分数和铝的相对原子质量. (1)A 中试剂为 .
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是 .
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C 的液面位置;②将B 中剩余固体过滤,洗涤,干燥,称重;③待B 中不再有气体产生并恢复至室温后,记录C 的液面位置;④由A 向B 中滴加足量试剂;⑤检查气密性,上述操作的顺序是 ;(填序号)记录C 的液面位置时,除视线平视外,还应 . (4)B 中发生反应的化学方程式为 .
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b ml (已换算为标准状况),B 中剩余固体的质量为cg ,则铝的相对原子质量为 .
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将 .(填“偏大”、“偏小”、“不受影响”) 答案: (1)NaOH 溶液.(2)除去铝镁合金表面的氧化膜.(3)⑤①④③②(2分);
使D 和C 的液面相平(4)2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑或2Al+2OH -+2H 2O=2AlO 2- +3H 2↑ (5)
33600()
.a c b
(6)偏小.
11 为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将a g 铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580 mL (标准状况);
方案二:将
10
a g 铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000 mol ·L -1
的KMnO 4溶液滴定,达到终点时消耗了25.00 mL KMnO 4溶液。 请回答下列问题:
(1)配平下面的化学方程式(将有关的化学计量数填入答题卡的横线上):
□KMnO 4+□FeSO 4+□H 2SO 4=□Fe 2(SO 4)3+□MnSO 4+□K 2SO 4+□H 2O
(2)在滴定实验中不能选择 式滴定管,理由是 ; (3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为 和 ;(铁的相对原子质量以55.9计)
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。 ①方案一 (填“准确”“不准确”“不一定准确”),理由是 ; ②方案二 (填“准确”“不准确”“不一定准确”),理由是 。 解析:(15分)
(1)2 10 8 5 2 1 8 (2)碱 KmnO 4是强氧化剂,它会腐蚀乳胶管
(3)
a 45
.1 a
45
.1 (4)
①不一定准确 如果铁片中存在与稀硫酸反应并能生成氢气的其他金属,会导致结果偏高;铁片中存在与稀硫酸反应而溶解、但不产生氢气的铁的氧化物,会导致结果偏低;如果上述情况均不存在,则结果准确
②不一定准确 如果铁片中存在与稀硫酸反应而溶解的其他金属,生成的金属离子在酸性溶液中能被高锰酸钾氧化,会导致结果偏高;如果铁片中存在与稀硫酸反应而溶解的铁的氧化物,生成的Fe 3+离子在酸性溶液中不能被高锰酸钾氧化,会导致结果偏低;如果上述情况均不存在,则结果准确
注:本小题属于开放性试题,若考生回答“准确”或“不准确”且理由合理,可酌性给分。例如:考生回答 方案一准确,因为铁片中不存在能与稀硫酸反应并能生成氢气的其他金属,也不存在铁的氧化物
方案一不准确,如果铁片中存在与稀硫酸反应生成氢气的其他金属,会导致结果偏高;如果存在与稀硫酸反应而溶解、但不产生氢气的铁的氧化物,会导致结果偏低
方案二准确,铁片溶于稀硫酸后,除Fe 2+外,其他可能存在的金属离子在酸性溶液中均不能被高锰酸钾氧化,也不存在氧化铁
方案二不准确,如果铁片中存在与稀硫酸反应而溶解的其他金属,生成的金属离子在酸性溶液中能被高锰酸钾氧化,会导致结果偏高;如果存在与稀硫酸反应而溶解的铁的氧化物,千百万的Fe 3+离子在酸性溶液中不能被高锰酸钾氧化,会导致结果偏低
12 .现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg 3N 2)。已知实验中可能会发生下列反应: ①2Mg+O 2
△
2MgO ;②3Mg+N 2
△
3N 2;③2Mg+CO 2
△
2MgO+C
④Mg+H 2O
△
MgO+H 2↑ ⑤Mg 3N 2 +6H 2O
△
2+2NH 3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
回答下列问题;
(1)在设计实验方案时,除装置A 、E 外,还应选择的装置(填字母代号)及其目的分别______________________________________;
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)___________________ _;
(3)通气后,如果同时点燃A 、F 装置的酒精灯,对实验结果有何影响?__________,原因是____________________; (4)请设计一个实验,验证产物是氮化镁:
_____________________________________________________________________
_
答案:16、(1)B、D、F 选择B,目的:除去空气中的水蒸气选择D,目的:除去空气中的CO2选择F,目的:除去空气中的O2(2)h→g→d→c→k→l→a→b
(3)制得的氮化镁将不纯;因为A装置没有排完空气前就加热会让空气中的氧气、CO2、水蒸气等与镁反应。
(4)将产物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁。
13 某小组同学对废干电池筒内的黑色固体(内含有MnO2、NH4Cl、ZnCl2等)进行了如下图所示的实验:
是,该操作中玻璃棒
的作用是。
(2)操作③灼烧滤渣黑色固体
时,会产生一种使澄清石灰水变
浑浊的气体,由此推测滤渣
中除含有MnO2外,还存在的
物质是。
(3)操作④的试管中产生的气体使带火星的木条复燃,则该气体为。
(4)请你写出用pH试纸检测滤液酸碱性的具体操作:
。
(5)已知在氯化锌溶液中逐滴滴入稀氨水,先生成Zn(OH)2白色沉淀,然后溶解生成可溶
于水的Zn(NH3)4Cl2。同学们对操作②的滤液中的成分进行探究。
(1)(2分)过滤引流(2)(1分)炭(或碳、或C)
(3)(1分)氧气或O2
(4)(3分)剪取小段pH试纸放在洁净表面皿(或点滴板、玻璃片)上(1分),用玻璃棒蘸取(或用胶头滴管取)少许滤液(或溶
液、待测液)点(或滴)在pH试纸上(1分),试纸变色后再与比色卡比较读出相应数值(1分)。
(5)(6分)
14 海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
(1)请列举海水淡化的两种方法:、。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、、、或H2、。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br,其目的为。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称:。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:。
④C中液体产生颜色为。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是。
答案:(1)蒸馏法、电渗析法、离子交换法及其其他合理答案中的任意两种
(2)Cl2NaOH NaClO
(3)富集溴元素
(4)Br2+SO2+2H2O=4H++SO42-+2Br-强酸对设备的严重腐蚀
(5)①冷凝管②Br2腐蚀橡胶③控制温度计b的温度,并收集59℃的馏分④深红棕色分液(或蒸馏)
15 医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂志)生产医药级
二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以出去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的试验操作是。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③。
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.05000mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
①上述测定过程中需要溶液润洗的仪器有。
②计算上述样品中CaCl2·2H2O的质量分数为。
③若用上述办法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有;。
答案:
(1)取少量上层清液,滴加KSCN溶液,,若不出现血红色,则表明Fe(OH)3沉淀完全。
(2)防止溶液吸收空气中CO2
(3)①酸式滴定管②99.9% ③样品中存在少量的NaCl 少量的CaCl2·2H2O失水
铁铜钠镁铝及其重要化合物的相互转化关系铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑ 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑ 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑ 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑MgCO3+2HCl=MgCl2+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO高温2Fe+3CO2 冶炼金属原理Fe3O4+4CO高温3Fe+4CO2 冶炼金属原理WO3+3CO高温W+3CO2 冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O 2CH3OH+3O2点燃2CO2+4H2O C2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色Cu+Hg(NO3)2=Hg+ Cu (NO3)2 Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质镀银Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解Na2O+2HCl=2NaCl+H2O 白色固体溶解CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HCl=ZnCl2+ H2O 白色固体溶解
1在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6mol/L盐酸,其他试剂自选(装置中必要的铁 架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去) 。 G I 填写下列空白: (1)实验时试管A中应加入的试剂是;烧瓶B的作用是;烧瓶C的作用是;在试管D中收集得到的是。 (2)实验时,U型管G中应加入的试剂是;长颈漏斗中应加入。 (3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)。 (4)烧瓶I中发生的反应有时要加入少量硫酸铜溶液,其目的是。 (5)试管E中发生的化学方程式为。 (6)为了安全,在E管中的反应发生前,在F出口处必须;E管中的反应开始后,在F出口处应。 2已知某纯碱试样中含有NaCl杂质,为测定试样中的纯碱的质量分数,可用下图中的装置进行实验。主要实验步骤如下: NaOH溶液试样溶液浓H2SO4 ①按图组装仪器,并检查装置的气密性 ②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液 ③称量盛有碱石灰的U型管的质量,得到b g ④从分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体为止 ⑤从导管A处缓缓鼓入一定量的空气 ⑥再次称量盛有碱石灰的U型管的质量,得到c g ⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g 请填空和回答问题: (1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明_________ (2)装置中干燥管B的作用是____________ ____; (3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果___________ (填偏高、偏低或不变) (4)步骤⑤的目的是___________ _____; (5)步骤⑦的目的是_____________ ___; (6)该试样中纯碱的质量分数的计算式为______________ _____; 3 工业上对海水资源综合开发利用的部分工艺流程如下图所示。 (1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽。离子膜和隔膜均允许通过的分子或离子 是。电解槽中的阳极材料为。
高中化学镁铝铁知识归纳【知识网络】 一、镁及其化合物 相关化学方程式 2Mg+O 2 =2MgO 3Mg+N 2Mg 3 N 2 Mg+Cl 2MgCl 2 Mg+2H+=Mg2++H 2 ↑ Mg+2H 2O Mg(OH) 2 +H 2 ↑ 2Mg+CO 2 2MgO+C MgO+H 2O=Mg(OH) 2 MgO+2HCl=MgCl 2+H 2 O MgCl 2(熔融) Mg+Cl 2 ↑
Mg2++CO 32-=MgCO 3 ↓ MgCO 3+2H+=Mg2++CO 2 ↑+H2O MgCO 3+CO 2 +H 2 O=Mg(HCO 3 ) 2 MgCO 3+H 2 O Mg(OH) 2 +CO 2 ↑ Mg(OH) 2+2H+=Mg2++H 2 O Mg(OH) 2MgO+H 2 O Mg 3N 2 +6H 2 O=3Mg(OH) 2 ↓+2NH3↑ 二、铝及其化合物 相关化学方程式 4Al+3O 2=2Al 2 O 3 3S+2Al Al 2S 3 2Al+3Cl 22AlCl 3 2Al+6HCl=2AlCl 3+3H 2 ↑
2Al+6H 2O 2Al(OH)3+3H 2↑ 2Al+Fe 2O 3 Al 2O 3+2Fe 2Al+2NaOH+2H 2O =2NaAlO 2+3H 2↑ Al 2O 3+6HCl =2AlCl 3+3H 2O Al 2O 3+2NaOH =2NaAlO 2+2H 2O 2Al 2O 3(熔融) 4Al+3O 2↑ Al 3++3H 2O=Al(OH)3+3H + Al 3++3NH 3·H 2O=Al(OH)3↓+3NH 4+ Al 3++3OH -=Al(OH)3↓ Al 3+ +4OH -=AlO 2- +2H 2O Al 2S 3+6H 2O=2Al(OH)3↓+3H 2S ↑ Al(OH)3+3H + =Al 3+ +3H 2O Al(OH)3+OH -=AlO 2-+2H 2O AlO 2-+CO 2+2H 2O=Al(OH)3↓+HCO 3- AlO 2-+H ++H 2O=Al(OH)3↓ AlO 2-+4H +=Al 3++2H 2O 3AlO 2-+Al 3++6H 2O=4Al(OH)3↓ 三、铁及其化合物
Na、Mg、Al、Fe及其化合物的化学方程式和离子方程式 一、Na及其化合物的化学方程式和离子方程式 (1)Na的反应 1、钠和水反应: 方程式: 2Na+2H2O=2NaOH+H2↑ 离子方程式: 2Na+2H2O=2Na+2OH-+H2↑ 2.钠分别和氧气、硫、氯气: 2Na+O2点燃Na2O2 (或加热) 4Na+O2=2Na2O 2Na+S=Na2S 2Na+Cl2点燃2NaCl 3.钠分别和盐酸(或硫酸)、醋酸 方程式: 2Na+2HCl=2NaCl+H2↑ 离子方程式: 2Na+2H+=2Na++H2↑ 方程式: 2Na+H2SO4=Na2SO4+H2↑ 离子方程式: 2Na+2H+=2Na++H2↑ 方程式:2Na+2CH3COOH=2CH3COONa+H2↑离子方程式: 2Na+2CH3COOH=2CH3COO-+2Na++H2↑4.钠分别和硫酸铜溶液、氯化铁溶液 方程式:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑离子方程式: 2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑方程式: 6Na+6H2O+2FeCl3=2Fe(OH)3↓+6NaCl+3H2↑离子方程式:6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na++3H2↑(2)Na的氧化物反应 1.氧化钠分别与水、盐酸 方程式: Na2O+H2O=2NaOH 离子方程式: Na2O+H2O=2Na++2OH- 方程式: Na2O+2HCl=2NaCl+H2O 离子方程式: Na 2O+2H+=2Na++H2O 2.过氧化钠分别与盐酸、水 方程式: 2Na2O2+4HCl=4NaCl+2H2O+O2↑离子方程式: 2Na2O2+4H+ =4Na++2H2O+O2↑方程式: 2Na2O2+2H2O=4NaOH+O2↑离子方程式: 2Na2O2+2H2O=4Na++4OH-+O2↑3.过氧化钠分别与二氧化碳:2Na2O2+2CO2=2Na2CO3+O2 (3)Na2CO3、NaHCO3盐的反应 1.分别加热碳酸钠和碳酸氢钠固体(鉴别固体Na2CO3、NaHCO3的方法) 碳酸钠受热不分解2NaHCO3△ Na2CO3+H2O+CO2↑ 2.碳酸钠和碳酸氢钠溶液分别与少量(或过量)的盐酸反应 少量的盐酸时:Na2CO3+HCl=NaHCO3 +NaCl CO32-+H+=HCO3-
全国各地备战高考化学分类:镁及其化合物推断题综合题汇编附详细答案 一、镁及其化合物 1.以硼镁泥(主要成分为MgSiO3、Fe2O3及少量A l2O3、FeO和MnO)为原料制备高纯 Mg(OH)2的流程如下: 己知: ①常温下此体系中各氢氧化物开始沉淀与沉淀完全时的pH范围如下表所示: pH值Mg(OH)2Mn(OH)2MnO(OH)2Fe(OH)2Al(OH)3Fe(OH)3 开始沉淀时9.37.17.87.6 3.7 2.3 沉淀完全时10.810.89.89.6 4.7 3.7 ②温度高于340℃时Mg(OH)2开始分解为MgO和H2O。 (1)“浸取”时,为提高镁的浸取率可行的措施为__________。 a.将硼镁泥制成浆料 b.降低浸取温度 c.用盐酸多次浸取 (2)“浸取”时,MgSi O3与盐酸反应的化学方程式为_________________________。 (3)“除铁、铝”时,需调节溶液pH范围为_________________________。 (4)“除Mn2+”时发生反应的离子方程式为_________________________; 过滤3所得滤渣中含有MnO(OH)2和__________。 (5)“沉镁”时,反应温度与Mg(OH)2的产率如图所示,当温度超过60℃,随温度再升高,Mg(OH)2产率反而降低,其原因可能是________________。 【答案】ac MgSi O3+2HCl+(n-l)H2O=MgCl2+Si O2·n H2O4.7 知识点归纳: 从钠的原子核外电子排布看,其最外电子层上只有一个电子,因此,极易将这一电子失去,而达到稳定结构,形成+1价的钠阳离子(Na+)。即金属钠的原子结构决定了其性质的活泼。因其易失电子被氧化,故金属钠是还原剂。 钠的物理性质 钠是银白色金属,质软(可用刀切割),密度小(0.97g/cm3),熔点低,是电和热的良导体。 钠的化学性质 由于钠原子最外层只有一个电子,所以钠的化学性质极活泼,具有强还原性,是强还原剂,具有金属的典型性质。 1. 与非金属反应 (1)与氧气的反应 常温下能与空气中的氧气化合,表面变暗。 4Na+O2=2Na2O 在空气或氧气中燃烧,发出黄色火焰,生成淡黄色固体。 (2)与硫反应 2Na+S=Na2S(研磨易爆炸) (3)与氯气反应(发出黄色火焰,产生白烟) 2. 与水反应 钠与水反应的实验现象及现象解释如下: 注:钠与水反应在钠的周围有白雾生成,此白雾是氢气燃烧产生的水蒸气。 钠与水反应的化学方程式为: 2Na+2H2O=2NaOH+H2↑ 该反应的实质是钠原子与水电离出的H+发生氧化还原反应,其离子方程式为:2Na+2H2O=2Na++2OH-+H2↑ 注:钠与水反应的现象可概括为“浮、熔、游、响、红”,并结合钠的性质进行记忆。 3. 与酸反应 钠与酸反应比与水反应更加激烈,极易爆炸。 钠与盐酸反应2Na+2HCl=2NaCl+H2↑ 钠与稀硫酸反应2Na+H2SO4 =Na2SO4 +H2↑ 钠与酸溶液反应的实质是:钠与酸电离出来的H+直接反应,而不是钠先与水反应,生成的氢氧化钠再和酸溶液反应。因为钠与水反应时,得电子的是水电离的H+,而酸中H+浓度大于水中H+的浓度。 4. 与盐的反应 将一小粒钠投入硫酸铜溶液中,除观察到与水反应相同的现象外,还看到蓝色沉淀生成。这是因为钠先与水反应,生成的NaOH再与盐CuSO4发生复分解反应 钠、镁、铝及其化合物 A卷全国卷 钠及其化合物 1.(2016·课标全国卷Ⅱ,12,6分)某白色粉末由两种物质组成,为鉴别其成分进行如下实验: ①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解; ②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。 该白色粉末可能为( ) A.NaHCO3、Al(OH)3 B.AgCl、NaHCO3 C.Na2SO3、BaCO3D.Na2CO3、CuSO4 解析A项,NaHCO3、Al(OH)3中加入足量稀硫酸有气泡产生,生成硫酸钠、硫酸铝、二氧化碳和水,最终无固体存在,错误;B项,AgCl不溶于酸,固体不能全部溶解,错误;C项,亚硫酸钠和碳酸钡加入水,碳酸钡不溶于水使部分固体不溶解,加入稀盐酸,碳酸钡与盐酸反应生成氯化钡、二氧化碳和水,固体全部溶解,再将样品加入足量稀硫酸,稀硫酸和碳酸钡反应生成硫酸钡沉淀、二氧化碳和水,正确;D项,Na2CO3、CuSO4中加入足量稀硫酸,振荡后无固体存在,错误。 答案 C 镁、铝及其化合物 2.(2015·课标全国卷Ⅱ,13,6分)用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( ) 选项①中物质②中物质预测②中的现象 A 稀盐酸碳酸钠与氢氧化钠的混合溶液立即产生气泡 B 浓硝酸用砂纸打磨过的铝条产生红棕色气体 C 氯化铝溶液浓氢氧化钠溶液产生大量白色沉淀 D 草酸溶液高锰酸钾酸性溶液溶液逐渐褪色 解析A项,发生的反应依次为:NaOH+HCl===NaCl+H2O、Na2CO3+HCl===NaHCO3+NaCl、NaHCO3+HCl===NaCl+H2O+CO2↑,由此可知开始时无气泡,最后才有气泡产生,错误;B项,常温下浓硝酸具有强氧化性,可将铝钝化,不生成气体,错误;C项,开始时NaOH过量,发生反应Al3++4OH-===AlO-2+2H2O,无沉淀生成,错误;D项,草酸(乙二酸)具有还原性,能还原酸性高锰酸钾溶液,使其褪色,正确。 Na 、Mg 、Al 、Fe 及其化合物的化学方程式和离子方程式 一、Na 及其化合物的化学方程式和离子方程式 (1)Na 的反应 1、钠和水反应: 方程式: 2Na+2H 2O=2NaOH+H 2↑ 离子方程式: 2Na+2H 2O=2Na +2OH -+H 2↑ 2.钠分别和氧气、硫、氯气: 2Na+O 2 点燃 Na 2O 2 (或加热) 4Na+O 2 = 2Na 2O 2Na+S =Na 2S 2Na+Cl 2 点燃 2NaCl 3.钠分别和盐酸(或硫酸)、醋酸 方程式: 2Na+2HCl=2NaCl+H 2↑ 离子方程式: 2Na+2H +=2Na ++H 2↑ 方程式: 2Na+H 2SO 4=Na 2SO 4+H 2↑ 离子方程式: 2Na+2H +=2Na ++H 2↑ 方程式:2Na+2CH 3COOH=2CH 3COONa+H 2↑ 离子方程式: 2Na+2CH 3COOH=2CH 3COO -+2Na ++H 2↑ 4.钠分别和硫酸铜溶液、氯化铁溶液 方程式: 2Na +2H 2O+CuSO 4=Cu(OH)2↓+Na 2SO 4+H 2↑ 离子方程式: 2Na +2H 2O+Cu 2+=Cu(OH)2↓+2Na ++H 2↑ 方程式: 6Na +6H 2O+2FeCl 3=2Fe(OH)3↓+6NaCl+3H 2↑ 离子方程式: 6Na +6H 2O+2Fe 3+=2Fe(OH)3↓+6Na ++3H 2↑ (2)Na 的氧化物反应 1.氧化钠分别与水、盐酸 方程式: Na 2O+H 2O=2NaOH 离子方程式: Na 2O+H 2O=2Na + +2OH - 方程式: Na 2O+2HCl=2NaCl+H 2O 离子方程式: Na 2O+2H +=2Na ++H 2O 2.过氧化钠分别与盐酸、水 方程式: 2Na 2O 2+4HCl=4NaCl+2H 2O+O 2↑ 离子方程式: 2Na 2O 2+4H + =4Na ++2H 2O+O 2↑ 方程式: 2Na 2O 2+2H 2O=4NaOH+O 2↑ 离子方程式: 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ 3.过氧化钠分别与二氧化碳:2Na 2O 2+2CO 2=2Na 2CO 3+O 2 (3)Na 2CO 3、NaHCO 3盐的反应 1.分别加热碳酸钠和碳酸氢钠固体(鉴别固体Na 2CO 3、NaHCO 3的方法) 碳酸钠受热不分解 2NaHCO 3 △ Na 2CO 3+H 2O+CO 2↑ 2.碳酸钠和碳酸氢钠溶液分别与少量(或过量)的盐酸反应 镁和铝 1.复习重点 1.镁和铝单质的化学性质; 2。镁和铝的重要化合物的化学性质。 3.重点是Al2O3、Al(OH)3的两性。 2.难点聚焦 1.金属的晶体结构: 金属具有一些共同性质,是由它们的原子结构和晶体结构的相似性决定的。金属的价电子较少,容易失去价电子变成金属离子,这些释出的价电子,不在属于那个或那几个指定的金属离子,而是整体金属的“集体财富”。它们在整个晶体内自由移动,人称“自由电子”。有人描述金属晶体内的实际情况是“金属离子沉浸在自由电子的海洋中”。换言之,是金属离子和自由电子之间存在着较强的电性作用,使许多金属离子和自由电子相互结合在一起形成晶体。 但是金属晶体中的“金属离子和自由电子之间存在着较强的电性作用”有相对强弱之分。一般来说,价电子数越多,原子半径越小,“作用”愈强,其熔沸点相对较高,密度、硬度也相对较大。 例如:同一主族金属元素的原子,价电子数目相同,从上到下随原子序数的递增,电子层数增多,原子半径增大,金属晶体中金属阳离子与自由电子的作用逐渐减弱,因此,它们的熔点逐渐降低,硬度逐渐减小。如:碱金属熔点钠比钾高,硬度钠比钾大。 同一周期金属元素的原子的电子层数相同,从左到右随原子序数的递增,价电子数增多,原子半径减小,金属晶体中金属阳离子与自由电子的作用逐渐增强。因此它们的熔点逐渐升高,硬度逐渐增大。如:按钠、镁、铝的顺序熔点依次升高,硬度逐渐增大。 2.金属的物理特性及解释 (1)金属都是电的良导体,通常情况下,自由电子在金属晶体内部的自由电子在金属内部作无规则的热运动,当金属的两端存在电势差的时候,在电场力的作用下,这些自由电子便作定向的移动,酷似人的定向移动就形成“人流”一样,电子的定向移动也便成了电流。 (2)在金属晶体内,自由电子运动时与金属离子相碰撞,引起两者的能量交换,致使整块金属达到了同样的温度,这是金属导热的原因。 大多数金属有良好的导电性和导热性,是由于这两种性质都与自由电子有关,所以善 化学阶段性测试卷(钠镁铝铁铜) 本卷可能用到的相对原子质量:H-1,C-12,O-16,Na-23,Mg-24,Al-27,S-32,Fe-56,Cu-64 第I卷(选择题,共40分) 一、选择题(本大题包括23小题,每小题只有一个最佳选项符合题意,共46分) 1.由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是 A.②④③⑤①B.③②④①⑤C.③④②⑤①D.②④⑤③① 2.下列关于钠及其化合物的说法正确的是 ①钠钾合金通常状况下呈液态,可做原子反应堆的导热剂 ②钠的化学性质活泼,少量的钠可保存在有机溶剂CCl4中 ③钠在空气中缓慢氧化而自燃,在氧气中燃烧更为剧烈 ④Na2CO3溶液能跟酸溶液反应,但不能跟碱溶液反应 A.①②③B.②③④C.①④D.① 3.下列说法正确的是 A.液态HCl、固体NaCl均不导电,所以HCl、NaCl均是非电解质 B.NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质 C.铜、石墨均导电,所以它们是电解质 D.蔗糖、酒精在水溶液或熔融时均不导电,所以它们是非电解质 4.下列说法中正确的是 ①钠在空气中燃烧生成白色的固体氧化钠②氢气在氯气中燃烧能产生大量的白烟 ③过氧化钠可在防毒面具中做供氧剂④铁丝在氯气中燃烧产生大量红棕色的烟 A.①②B.②③C.③④D.①④ 5.实验室里做钠跟水反应的实验时,用到的仪器和药品是 ①试管夹②镊子③小刀④滤纸⑤研钵⑥烧杯⑦坩埚⑧石棉网 ⑨玻璃片⑩药匙 A.①②③④B.②③④⑥⑨C.③④⑧⑨⑩D.②⑤⑦⑨⑩ 6.下列各组物质相互混合反应后,最终 ..有白色沉淀生成的是 ①金属钠投入到FeCl2溶液中②过量NaOH溶液和明矾溶液混合 ③少量Ca(OH)2投入过量NaHCO3溶液中④向NaAlO2溶液中通入过量CO2 ⑤向饱和Na2CO3溶液中通入过量CO2 A.①③④⑤B.只有①④C.只有②③D.只有③④⑤ 7.下列物质间的转化关系中不能 ..全部通过一步反应完成的是 A.Na→NaOH→Na2CO3→NaCl B.Mg→MgCl2→MgCO3→Mg(OH)2 C.Al→Al2O3→Al(OH)3→AlCl3D.Fe→FeCl3→Fe(OH)3→Fe2O3 8.已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。如下图所示,将少量试剂分别放入培养皿中的相应 跟踪检测(七)镁、铝及其化合物1.铝元素对人体健康有危害,因此,1989年世界卫生组织正式把铝确定为食品污染源之一而须加以控制。铝在下列应用场合使用时应加以控制的是() ①制铝合金②制电线③制炊具④制银色漆颜料⑤用明矾净水⑥明矾和小苏打制食品膨松剂⑦制易拉罐⑧用氢氧化铝凝胶制胃舒平⑨包装糖果盒小食品A.③⑤⑧⑨B.⑥⑧⑨ C.③⑤⑨D.③⑤⑥⑦⑧⑨ 解析:选D由铝的应用可知,铝制炊具、铝制易拉罐、明矾净水、明矾和小苏打制食品膨松剂、使用铝包装糖果和小食品、用氢氧化铝凝胶制胃舒平药品都有可能使铝元素进入人体,对人体造成危害,都需要加以控制。 2.(2019·朝阳区模拟)某小组用打磨过的铝片进行如下实验,下列分析不合理的是() A.①中铝片发生了钝化 B.②中产生的气泡可能是氮氧化合物 C.③中沉淀溶解的离子方程式是Al(OH)3+OH-===AlO-2+2H2O D.②中加水稀释过程中,仅发生了氧化还原反应 解析:选D浓硝酸具有强氧化性,常温下铝在浓硝酸中发生钝化,故A正确;加水稀释硝酸浓度变稀,产生气泡说明铝和稀硝酸发生反应生成一氧化氮气体,②中产生的气泡可能是氮氧化合物,故B正确;③中沉淀溶解是氢氧化铝和氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式是Al(OH)3+OH-===AlO-2+2H2O,故C正确;②中加水稀释过程中,铝表面形成的氧化物薄膜溶于稀硝酸为复分解反应,过程中不仅发生了氧化还原反应,故D错误。 3.铝是一种很重要的金属,可以发生一系列反应制备物质。下列说法错误的是() A.反应①又称铝热反应,常用于野外焊接铁轨 B.利用②③反应都能产生氢气,产生等量氢气消耗Al的质量相等且转移电子数也相等 C.常用反应⑥制备Al(OH)3,方法是向Al2(SO4)3溶液中滴加NaOH溶液至恰好完全沉淀 必修化学方程式小结 写出下列反应的化学方程式和离子方程式,并描述相应的实验现象。 1、金属钠放在水中的现象是: 化学方程式为: 离子方程式为: 2、钠长期露置在空气中(3个反应) 3、钠在氧气中燃烧现象是: 化学方程式是: 4、过氧化钠的用途是:(请写出原理,两个方程式) 5、钠放入硫酸铜溶液中现象: 化学方程式: 离子方程式: 6、制取氢氧化铁胶体: 7、向碳酸钠溶液加入盐酸,反应为: 离子方程式为: 8、碳酸氢钠溶液加入盐酸,反应为: 离子方程式为: 9、加热除去碳酸钠固体中混有的少量的碳酸氢钠的方法为: 其原理为: 中燃烧,反应为: 10、镁在CO 2 11、镁在空气中燃烧,反应为: 12、Mg(OH) 溶解在盐酸中,反应为: 2 离子方程式为: 13、氯化镁中加入氢氧化钠,离子方程式为: 14、铝、铁遇冷浓硫酸、浓硝酸会钝化 铝片放入稀硫酸溶液,反应为: 铝片放入氢氧化钠溶液,反应为: 离子方程式: 15、实验室制备氢氧化铝的原理: 离子方程式为: 16、Al 2O 3 的两性: 和硫酸反应: 和NaOH溶液反应: 17、灼烧Al(OH) 3 : 18、Al(OH) 3 的两性: 与HCl 与NaOH 19、明矾的电离方程式: 明矾的净水原理: 20、检验Fe3+试剂为:①现象: ②现象: 21、要除去FeCl 3溶液中少量的FeCl 2 ,其方法是:; 原理为: 22、要除去FeCl 2溶液中少量的FeCl 3 ,其方法是:; 原理为: 23、用FeCl 3 溶液腐蚀铜箔制造的印刷电路板,原理为: 24、向FeCl 2 溶液中加入NaOH现象: 化学反应为: 25、高炉炼铁的原理(原料为Fe 2O 3 和焦炭) 镁铝 一、镁和铝 1 2、物理性质 共同点:密度小熔点较低,硬度较小银白色金属. 不同点:Al的上述性质都比镁略高. 3、化学性质 (1)跟O2及其它非金属反应 常温下,在空气中都因生成氧化膜,具有抗腐蚀能力. 2Mg+O22MgO4Al+3O22Al2O3 3Mg+N2Mg3N2Mg+Br2MgBr2 2Al+3S Al2S3 (2)跟某些氧化物 2Mg+CO22MgO+C 2Al+Fe2O32Fe+Al2O3 (铝热反应) (3)跟水反应 Mg+2H2O Mg(OH)2+H2↑(冷水慢,沸水快) 2Al+6H2O=2Al(OH)3+3H2↑(一般不反应,只有氧化膜被破坏后反应) (4)跟酸的反应 Mg+2H+=Mg2++H2↑ 2Al+6H+=3Al3++3H2↑(常温下,在浓H2SO4、浓HNO3中钝化) (5)跟碱反应 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ [例1]甲、乙两烧杯中各盛有100 mL3 mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=1∶2(同温、同压下),则加入的铝粉的质量为( ) A.3.6g B.2.7g C.5.4g D.1.8g [例2]由锌、铁、镁、铝四种金属中的两种组成的混合物10g,与足量的盐酸反应生成的氢气在标准状况下为11.2L,则混合物中一定含有的金属是( ) A、锌 B、铁 C、铝 D、镁 4、制取:电解法 MgCl2Mg+Cl2↑2Al2O34Al+3O2↑ [例3]已知工业上真空炼铷的反应方程式为:2RbCl+Mg MgCl2+2Rb,对于此反应,能够进行正确解释的是( ) A.Rb比Mg金属性强 B.铷的沸点比镁的低,当把铷蒸气抽走时,平衡向正反应方向移动 C.MgCl2对热的稳定性比RbCl弱 D.高温下,Mg2+离子得电子的能力比Rb+离子弱 二、镁和铝的重要化合物 1 2 Al 3 高一化学钠镁铝 可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mg24 Al 27 Cl 35.5 Zn 65 一.选择题 1.下列关于Na2O2的叙述正确的是( ) A.Na2O2是淡黄色固体,久置于空气中变成Na2O B.Na2O2与水的反应中,Na2O2只作氧化剂 C.Na2O2是金属氧化物,所以能和水反应生成O2 D.Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出 2.关于NaHCO3的性质,下列说法不正确的是( ) A.NaHCO3只能和酸作用不能和碱作用 B.和酸反应放出等量的CO2所消耗的酸比Na2CO3少 C.热稳定性比Na2CO3小D.相同温度下溶解度比Na2CO3要小 3.欲除去小苏打溶液中少量的Na2CO3杂质,最适宜的物质是( ) A.干冰B.盐酸C.碳酸氢钙D.氢氧化钙 4.相同质量的钠在下列情况下产生氢气最多的是( ) A.放在足量食盐水中B.放在足量盐酸中 C.放在足量CuSO4溶液中D.用刺有小孔的铝箔包好放入足量水底中 5.下列说法不正确的是( ) A.钠离子半径比钠原子半径小 B.钠是电和热的良导体 C.钠在空气中燃烧生成氧化钠,并发出黄色火焰 D.钠与硫化合时可以发生爆炸 6.将一小块钠投入下列溶液时,既能产生气体又会出现白色沉淀的是( ) A.稀H2SO4B.氢氧化钠稀溶液 C.硫酸铜溶液D.氯化镁溶液 7.mg钠、铝混合物,放入ng水中,反应停止后,仍有不溶物ag,则溶液中溶质为( ) A.NaOH B.NaAlO2C.NaOH和NaAlO2D.无法确定 8.下列各组溶液,只用试管和滴管,不用其它试剂和仪器不可以鉴别的是()A.NaCl、MgCl2、AlCl3、NaOH B.CuCl2、BaCl2、(NH4)2 SO4、NaOH C. NaHCO3、BaCl2、HCl、Na2CO3D.NaCl、BaCl2、(NH4)2 SO4、Na2CO3 2018年全国卷高考化学总复习《镁铝铁》专题突破【考纲要求】 1.了解镁、铝、铁、铜等金属及其重要化合物的主要性质及应用。 2.以铝为例了解两性氧化物、两性氢氧化物的概念和一般性质。 3.以铁为例了解变价金属的性质。 【知识网络】 1、镁及其化合物 2、铝及其重要化合物 2、铁及其重要化合物 【考点梳理】 考点一.镁、铝及其化合物 1.镁与铝 ①共同点:均为银白色,属于轻金属(<4.5g/cm3),熔点较低,硬度较小。 ②不同点:密度:Mg 2 Al(OH)3 4.镁铝的工业制取流程 (1)以海水为原料提取镁: 海水(或苦卤、光卤石溶液等)??→?熟石灰 Mg(OH)2盐酸 过滤?? →?MgCl 2溶液?→?? MgCl 2·6H 2O 加热干燥气流中 ?????→?HCl MgCl 2) (熔融电解??→?Mg 。 要点诠释: ①MgCl 2的物理性质:易溶于水、味苦、易潮解,是制取镁的重要原料。 ②苦卤就是提取过食盐后的海水;光卤石成分为KCl·MgCl 2·6H 2O 。 ③海水的成分为:Na +、Mg 2+、Cl -、Br -等。 ④MgCl 2溶液变成MgCl 2·6H 2O 的操作是:蒸发浓缩、冷却结晶、过滤。 (2)以铝土矿为原料提取Al 铝土矿主要成分是Al 2O 3,含SiO 2、Fe 2O 3、MgO 等杂质,提取Al 的两种工艺流程如下: Al 2323 SiO 2 Al 3+、Fe 32+、Cl -Mg(OH)2Fe(OH)3 2、NaOH Al(OH)NaCl 、NaHCO 3Fe 2O 3、MgO 2、Na 2 3、H 2SiO 3 Al(OH)NaCl 、NH 4Cl NH 3 H 2O 5.铝及其化合物间相互转化、铝三角及相关图象 (1)铝三角 高考总复习《镁铝铁》 【考纲要求】 1.了解镁、铝、铁、铜等金属及其重要化合物的主要性质及应用。 2.以铝为例了解两性氧化物、两性氢氧化物的概念和一般性质。 3.以铁为例了解变价金属的性质。 【知识网络】 1、镁及其化合物 2、铝及其重要化合物 2、铁及其重要化合物 【考点梳理】 考点一.镁、铝及其化合物 1.镁与铝 ⑴原子结构及物理性质 元素符号原子结构原子半径化合价颜色 密度 (g·cm-3) 熔点沸点 硬 度 12 Mg 1.60×10-10m +2 银白色 1.74 645℃1090℃很软13 Al 1.43×10-10m +3 银白色 2.70 660.4℃2467℃较软要点诠释: ①共同点:均为银白色,属于轻金属(<4.5g/cm3),熔点较低,硬度较小。 ②不同点:密度:Mg 考点11 镁铝及其化合物 1.(2013·山东理综·9)足量下列物质与等质量的铝反应,放出氢气且消耗溶质物质的量最少的是 A .氢氧化钠溶液 B .稀硫酸 C .盐酸 D .稀硝酸 答案:A 2.(2013·上海化学·17)某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL ,加入过量NaOH 溶液,加热,得到0.02mol 气体,同时产生红褐色衬垫;顾虑,洗涤,灼烧,得到1.6g 固体;向上述滤液中加足量BaCl2溶液,得到4.66g 不溶于盐酸的沉淀。由此可知原溶液中 A.至少存在5种离子 B.Cl-一定存在,且c (Cl-)≥0.4mol/L C.SO42-、NH4+、一定存在,Cl-可能不存在 D.CO32-、Al3+一定不存在,K+可能存在 【答案】B 3.(2013·江苏化学·4)下列有关物质性质的应用正确的是 A.液氨汽化时要吸收大量的热,可用作制冷剂 B.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 C.生石灰能与水反应,可用来干燥氯气 D.氯化铝是一种电解质,可用于电解法制铝 【参考答案】A 选项 操作 现象 结论 A 将浓硫酸滴到蔗糖表面 固体变黑膨胀 浓硫酸有脱水性和强氧化性 B 常温下将Al 片放入浓硝酸中 无明显变化 Al 与浓硝酸不反应 C 将一小块Na 放入无水乙醇中 产生气泡 Na 能置换出醇羟基中的氢 D 将水蒸气通过灼热的铁粉 粉末变红 铁与水在高温下发生反应 5.(2013·上海化学·23-26)金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。完成下列填空: 23.铝原子核外电子云有 种不同的伸展方向,有 种不同运动状态的电子。 24.镓(Ga )与铝同族。写出镓的氯化物和氨水反应的化学方程式。 25.硅与铝同周期。SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O ·CaO ·6SiO2。盛放NaOH 溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 。 长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为 26.用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如: 2Al+4BaO ??→ ?高温 3Ba ↑+BaO ·Al2O3 常温下Al 的金属性比Ba 的金属性 (选填“强”“弱”)。利用上述方法可制 取Ba 的主要原因是 。 专题三、钠镁铝及其重要的化合物(一) 【基础落实】 1.下列事实与胶体性质有关的是( ) ①用盐卤点豆腐 ②河流入海处易形成沙洲 ③一束平行光照射蛋白质溶液时,从侧面可以看到光亮的通路 ④用静电除尘装置净化空气 ⑤血液透析法治疗肾功能衰竭 ⑥氢氧化铁胶体中加入少量盐酸产生红褐色沉淀 A. 只有①②⑤ B. 只有①③④⑤⑥ C. 只有①②③④⑤ D. 全部都有关2.将一小块钠投入到CuSO4溶液中,一定观察不到的现象是( ) A. 钠浮在溶液表面 B. 发出“嘶嘶”的响声,钠块四处游动,逐渐变小直至消失 C. 有蓝色沉淀生成 D. 有红色粉末生成 3.下列关于钠的说法不正确的是( ) A. 金属钠与O2反应,条件不同,产物不相同 B. 钠-钾合金通常状况下呈液态,可作原子反应堆的导热剂 C. 钠的化学活泼性很强,少量的钠可保存在煤油中 D. 金属钠着火,可以用二氧化碳灭火 4.取一小块金属钠放在燃烧匙里加热,下列实验现象: ①金属熔化;②在空气中燃烧,放出白色火花;③燃烧后得白色固体;④燃烧时火焰为黄色; ⑤燃烧后生成浅黄色固体物质。其中描述正确的是( ) A. ①② B. ①②③ C. ①④⑤ D. ④⑤5.下利说法正确的是(N A表示阿伏加德罗常数的值) ( ) ①28g氮气所含有的原子数目为N A ②4g金属钙变成钙离子时失去的电子数目为0.1 N A ③在常温常压下,11.2LN2含有含有的分子数为0.5N A ④在标况下,1 molNe含有的原子数为N A ⑤0.5 mol单质铝与足量盐酸反应转移电子数为1.5N A ⑥标准状况下,1 L水所含分子数为1 /22.4N A ⑦17g氨气所含电子数目为10N A A. ①②⑤⑥⑦ B. ①②④⑤⑥ C. ⑤⑦ D. ④⑤⑦ 钠、镁、铝复习 一、钠及其重要化合物间的转化关系 Na 2 S Na 2O NaOH Na Na 2O 2 Na 2CO NaCl CH 3COONa NaHCO 1、以下关于金属钠的叙述中正确的是: ( ) A 、钠在空气中能发生缓慢氧化而自燃 B 、金属钠可保存在煤油中,也可保存在CCl 4中 C 、钠能和CuSO 4溶液反应置换出Cu D 、钠投入水中立即熔化成小球,说明其熔点低且钠与水的反应是放热反应 2、向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入绿豆大小 的金属钠,可能观察到的现象是 ( ) 3、用等量的小苏打制取CO 2可用①煅烧法②与酸作用法,两种方法得到CO 2的量( ) A .①大于② B .①小于② C .相等 D .无法比较 4、对于①a g Na 2CO 3 ②a g NaHCO 3的混合物,下列描述正确的是 ( ) A .分别配成等体积的溶液,②的pH 大 B .分别与盐酸反应时, ②耗酸量大 C .分别与足量盐酸反应, ②放出CO 2多 D .分别配成等体积的溶液,②中Na +浓度大 5、可用于判断NaHCO 3粉末中混有Na 2CO 3的实验方法是: ( ) A 、加热时有无气体放出 B 、滴加盐酸时有无气体放出 C 、溶于水后,滴加澄清石灰水,有无白色沉淀生成 D 、溶于水后,滴加BaCl 2溶液,有无白色沉淀生成 6、将CO 2气体持续通入下列溶液中,最终有沉淀或晶体生成的是: ( ) A 、CaCl 2溶液 B 、澄清石灰水 C 、Na 2CO 3饱和溶液 D 、NaHCO 3溶液 水 7、设N A代表阿伏加德罗常数,下列说法中正确的是() A. 4.48 L N2与CO的混合物所含分子数为0.2 N A B.常温、常压下,0.5mol臭氧中含有氧原子为1.5N A C. 标准状况下0.5N A个Br2所占的体积约为11.2L D. 7.8gNa2O2与足量水反应,转移电子数目为0.2 N A 8、在1.00L 2.00mol·L-1NaOH溶液中通入33.6L标准状况下的CO2,计算所得溶液中含有 的NaHCO3和Na2CO3的物质的量。 9、现拟用50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。某研究性学习小组 甲、乙、丙分别设计了如下实验方案: 甲:将50mL NaOH溶液盛装在锥形瓶中,用导气管通过CO2气体。 乙:将CO2气体通入50mL NaOH溶液中至过量,加热蒸发过滤得晶体,然后加热晶体完全分解,把所得粉末溶于水即制得Na2CO3溶液。 丙:①用25mL NaOH溶液吸收过量CO2气体至不再溶液;②小心煮沸溶液; ③冷却后再加入25mL NaOH溶液,使溶液充分混合即得Na2CO3溶液。 试回答: (1)甲、乙、丙实验方案最合理的是。 (2)甲实验方案中,由于CO2的通入量不同,溶液中的溶质不同,可能的情况是(有几种写几种;填写溶质的化学式): ①,②,③, ④,⑤…… (3)乙实验方案中,过滤操作用到的玻璃仪器是,实验中如何判断晶体已经完全分解 。 (4)丙实验方案中,②③的顺序对调,即先混合,再煮沸,你认为是否合理(填“合理”“不合理”),其原因是 。 写出丙方案中的有关离子方程式: 。 2009届高考化学试题汇编:镁铝及其化合物 1.(广东省六校2009届高三第二次联考试卷)(10分)某化学兴趣小组为探索工业废料的再 利用,在实验室中用含有铝、铁、铜的合金制取氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体。其实验方案如下: (1)所加试剂①、②分别是。 (2)从滤液E中得到绿矾晶体的实验操作是 ;从滤渣F制取胆矾的第一步操作最好采用。 (3)上述实验方案中,有一步设计明显不合理,请你予以指出,并说明理由 。你认为正确的设计方案是 。 答案 (1)NaOH溶液和稀硫酸(2分) (2)在隔绝空气的条件下,蒸发浓缩、冷却结晶(2分);将滤渣F在空气中灼烧(1分)(3)由滤液A制得氯化铝溶液不合理,所得氯化铝溶液中含有大量NaCl杂质。(2分)向滤液A中通入足量的CO2生成Al(OH)3沉淀,过滤,向Al(OH)3沉淀中加入盐酸至沉淀溶解(3分) 2.(广东省广州六中2009届高三第一次月考测试卷)一定量的Mg和MgO的混合物投入100ml 2mol/L的稀HCl中完全溶解后,再向反应后的溶液中加入4mol/L的NaOH溶液,要使Mg元素全部沉淀出来,所加入的NaOH溶液的体积最小是 A.100ml B.50ml C.25ml D.由于Mg、MgO的质量未知无法判断3.(湛江师院附中2008—2009学年高三级第三次月考)(6分)置换反应的通式可以表示为: 单质(1)+化合物(1)=化合物(2)+单质(2)请根据下列条件:①所涉及的元素的原子序数都小于18;②6种单质分别属6个不同的主族。写出满足上述要求的3个置换反应的化学方程式: (1) ; (2) ; (3) 。 答案 2Mg+CO22MgO+C ;3A l+6HCl===2AlCl3+3H2↑;2F2+2H2O===4HF+O2; Mg + H2O Mg(OH)2 + H2↑;H2S + Cl2=== 2HCl + S。他合理写法也可。 4.(湛江师院附中2008—2009学年高三级第三次月考) (10分)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应: ①2Mg+O2△ 2MgO;②3Mg+N2 △ Mg3N2;③2Mg+CO2 △ ④Mg+H2O △ MgO+H2↑⑤Mg3N2 +6H2O ===3Mg(OH)2+2NH3↑ 可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的。 回答下列问题; (1)组装实验装置时,导管导管口间的连接是: a →()()→( )()→()()→h (2)装置A的作用是____________________________________,装置C的作用是________ ___________________________,装置E的作用是_____________________________________。 (3)通气后,应先点燃_______装置的酒精灯。如果同时点燃B、C装置的酒精灯,对实验钠镁铝及其化合物的相关计算
高考化学一轮总复习专题十二钠镁铝及其化合物AB卷
钠镁铝铁及其化合物方程式和离子方程式锦集
镁和铝
化学阶段性测试卷(金属钠镁铝铁铜)
2021届高考化学一轮复习镁、铝及其化合物作业
钠镁铝铁化学方程式练习
高中化学 镁铝教案
高一化学钠镁铝单元考试题及答案解析
2018年全国卷高考化学总复习《镁铝铁》专题突破
高考化学镁铝铁(提高)
全国高考化学真题分类汇编(含答案,暂无解析)—考点11 镁铝及其化合物(高考)
专题三、钠镁铝及其重要的化合物(一)
高中化学知识点:钠镁铝复习
高考化学试题汇编镁铝及其化合物