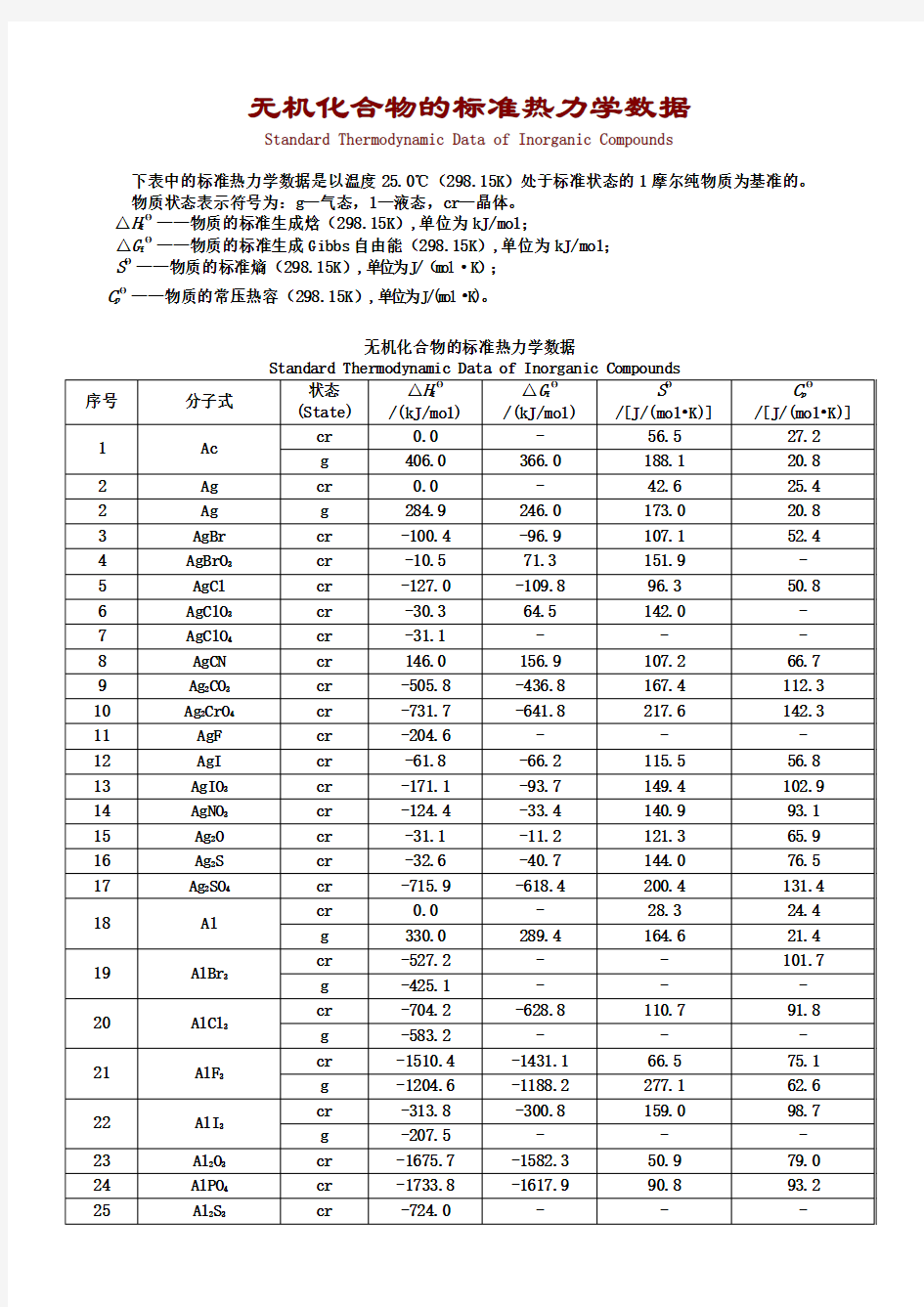

无机化合物的标准热力学数据
Standard Thermodynamic Data of Inorganic Compounds
下表中的标准热力学数据是以温度25.0℃(298.15K)处于标准状态的1摩尔纯物质为基准的。物质状态表示符号为:g—气态,l—液态,cr—晶体。
△H fΘ——物质的标准生成焓(298.15K),单位为kJ/mol;
△G fΘ——物质的标准生成Gibbs自由能(298.15K),单位为kJ/mol;
SΘ——物质的标准熵(298.15K),单位为J/(mol·K);
C pΘ——物质的常压热容(298.15K),单位为J/(mol?K)。
无机化合物的标准热力学数据
标准热力学数据(298.15K) https://www.doczj.com/doc/0d8134609.html, 2005-6-7 20:58:37 来源:生命经纬 化学式(状态)H G S 氢(hydrogen) H2(g)0 0 130.57 H+(aq)0 0 0 锂(lithium) Li(s)0 0 29.12 Li+(aq)-278.49 -293.30 13.39 Li2O(s)-597.94 -561.20 37.57 LiCl(s)-408.61 -384.38 59.33 钠(sodium) Na(s)0 0 51.21 Na+(aq)-240.12 261.89 58.99 Na2O(s)-414.22 -375.47 75.06 NaOH(s)-425.61 -379.53 64.45 NaCl(s)-411.65 -384.15 72.13 钾(potassium) K(S)0 0 64.18 K+(aq)-252.38 -283.26 102.51 KOH(s)-424.76 -379.11 78.87 KCl(s)-436.75 -409.15 82.59 铍(beryllium) Be(s)0 0 9.50 BeO(s)-609.61 -580.32 14.14 镁(magnesium) Mg(s)0 0 32.68 Mg2+(aq)-466.85 -454.80 -138.07 MgO(s)-601.70 -569.44 27.91 Mg(OH)2(s)-924.54 -833.58 63.18 MgCl2(s)-641.32 -591.83 89.62 MgCO3(s)-1095.79 -1012.11 65.69 钙(calcium) Ca(s)0 0 41.42 Ca2+(aq)-542.83 -553.54 -53.14 CaO(s)-635.09 -604.04 39.75 Ca(OH)2(s)-986.09 -898.56 83.39
《实用无机物热力学数据手册》 使用说明 1 关于化学反应吸热(或放热)量的计算 1.1计算公式 根据《手册》P.21式(70):
()()298G G G G G G T T 298T 298H H H -H H -H ?????=?+-????∑∑iiii生成物反物 nn (1.1) 式中: T G H ?——应理解为实际状态(101.325kPa ,T K )下的定压化学反应热P,T Q 。在反应前后温度T 相同时,(因压力均为101.325kPa )故也可理解为定压化学反应热效应。 化学反应热效应与反应热的区别仅仅在于:热效应是状态量(反应前后的温度、压力必须相同),而反应热是过程量(反应前后的温度、压力不一定相同)。 298 G H ?——为热化学标准状态(101.325kPa ,298K )下,生成物与反应物的标准生成焓298G H 之差。按下式计算: ()()298G G G 298298H H H ?????=-????∑∑iiii生成物反物 nn (1.2) ( )G G T 298H -H ????∑i i生成物 n——化学反应的每个生成物,从反应温度T K 降温到298K 的焓变(放热量)之和。 ( )G G T 298H -H ????∑i i反物 n——化学反应的每个反应物,从298K 升温到反应温度T K 的焓变(吸热量)之和。 ()G 298H ???? ∑i i 生成物 n——化学反应的每个生成物,从反应温度T K 降温到298K 的焓变 (放热量)之和。 ()G 298H ???? ∑i i 反物 n——化学反应的每个反应物,从298K 升温到反应温度T K 的焓变 (吸热量)之和。 ()G G T 298H -H i——单个生成物从反应温度T K 降温到298K 的焓变,或单个反应物从 298K 升温到反应温度T K 的焓变。 in——单个生成物(或单个反应物)的化学计量系数,即:化学反应方程式中,该物质的分子式前面的系数(也就是参与反应的该物质的摩尔数)。 1.2 吸热反应或放热反应的判定 根据式(1.1):当0G T H ?>时,表示系统能量增加,为吸热反应;当0G T H ?<时,表示系统能量减少,为放热反应。 1.3 对计算公式的分析 对于式(1.1):反应热G T H ?主要体现在298G H ?之中,即298G H ?为主要部分;而()()G G G G T 298T 298H -H H -H ????-????∑∑iiii生成物反物nn相当于是对298G H ?进行温度修正,为次要部分。
功和热量 1-1 工质和热力系 一、工质、热机、热源与冷源 1、热机(热力发动机):实现热能转换为机械能的设备。 如:电厂中的汽轮机、燃气轮机和内燃机、航空发动机等。 2、工质:实现热能转换为机械能的媒介物质。 对工质的要求: 1)良好的膨胀性; 2)流动性好;3)热力性质稳定,热容量大;4)安全对环境友善;5)价廉,易大量获取。如电厂中的水蒸汽;制冷中的氨气等。 问题:为什么电厂采用水蒸汽作工质? 3、高温热源:不断向工质提供热能的物体(热源)。 如电厂中的炉膛中的高温烟气 4、低温热源:不断接收工质排放热的物体(冷源) 如凝汽器中的冷却水 二、热力系统 1、热力系统和外界概念 热力系:人为划分的热力学研究对象(简称热力系)。 外界:系统外与之相关的一切其他物质。 边界:分割系统与外界的界面。在边界上可以判断系统与外界间所传递的能量和质量的形式和数量。边界可以是实际的、假想的、固定的,或活动的。 注意:热力系的划分,完全取决于分析问题的需要及分析方法的方便。它可以是一个设备(物体),也可以是多个设备组成的系统。 如:可以取汽轮机内的空间作为一个系统,也可取整个电厂的作为系统。 2、热力系统分类 按系统与外界的能量交换情况分 1)绝热系统:与外界无热量交换。 2)孤立系统:与外界既无能量(功量、热量)交换,又无质量交换的系统。 注意:实际中,绝对的绝热系和孤立系统是不存在的,但在某些理想情况下可简化为这两种理想模型。这种科学的抽象给热力学的研究带来很大的方便。 如:在计算电厂中的汽轮机作功时,通常忽略汽缸壁的散热损失,可近似看作绝热系统。状态及基本状态参数 状态参数特点
热力学基本状态参数 功和热量 1-1 工质和热力系 一、工质、热机、热源与冷源 1、热机(热力发动机):实现热能转换为机械能的设备。 如:电厂中的汽轮机、燃气轮机和内燃机、航空发动机等。 2、工质:实现热能转换为机械能的媒介物质。 对工质的要求: 1)良好的膨胀性; 2)流动性好;3)热力性质稳定,热容量大;4)安全对环境友善;5)价廉,易大量获取。如电厂中的水蒸汽;制冷中的氨气等。 问题:为什么电厂采用水蒸汽作工质? 3、高温热源:不断向工质提供热能的物体(热源)。 如电厂中的炉膛中的高温烟气 4、低温热源:不断接收工质排放热的物体(冷源) 如凝汽器中的冷却水 二、热力系统 1、热力系统和外界概念 热力系:人为划分的热力学研究对象(简称热力系)。 外界:系统外与之相关的一切其他物质。 边界:分割系统与外界的界面。在边界上可以判断系统与外界间所传递的能量和质量的形式和数量。边界可以是实际的、假想的、固定的,或活动的。 注意:热力系的划分,完全取决于分析问题的需要及分析方法的方便。它可以是一个设备(物体),也可以是多个设备组成的系统。 如:可以取汽轮机内的空间作为一个系统,也可取整个电厂的作为系统。 2、热力系统分类 按系统与外界的能量交换情况分 1)绝热系统:与外界无热量交换。 2)孤立系统:与外界既无能量(功量、热量)交换,又无质量交换的系统。 注意:实际中,绝对的绝热系和孤立系统是不存在的,但在某些理想情况下可简化为这两种理想模型。这种科学的抽象给热力学的研究带来很大的方便。 如:在计算电厂中的汽轮机作功时,通常忽略汽缸壁的散热损失,可近似看作绝热系统。状态及基本状态参数 状态参数特点 u状态参数仅决定于状态,即对应某确定的状态,就有一组状态参数。反之,一组确定的
Thermo-Calc 姓名:xxx 学号:111111111111 一、软件简介 相图计算(CALPHAD:Calculation of Phase Diagram)是在前人收集、总结热力学数据的基础上发展形成的一门新的介于热力学、相平衡和计算机科学之间的交叉学科。Thermo-Calc是一款基于已有文献和实验数据基础之上的相图和热力学计算软件,由瑞典皇家工学院(KTH)研发,并于1981年首次发布。经过将近30年的发展,Thermo-Calc现已成为数据齐全、功能强大、结构较为完整的计算系统,是目前世界上享有相当声誉的热力学计算软件。目前,该软件已被广泛用于计算不同体系的复杂相平衡或多元相图,在新材料设计,材料工程应用等过程中根据Thermo-Calc计算结果进行设计优化,可有效节省人力、物力。该软件最早被发展用于钢的热力学计算,有关钢的数据库也比其他体系的数据库更为完备,是钢铁材料研究过程中一款有力的工具,可从钢的平衡态相组成、合金化的影响、析出相形成规律等不同角度开展热力学计算。 目前该软件分为经典版(TCC)和视窗版(TCW)两种,计算机原理及过程完全一样。使用TCC能够更灵活、充分的发挥软件的功能,通过其中的“acro-file-open”命令还能直接调用已有程序,计算参数可以在文本格式的程序文件中随时修改,使日常的计算过程大为简化。TCW是在TCC基础上发展而来,采用了Windows界面,使初学者能够迅速根据窗口提示开展计算。本文仅针对后者进行简单介绍。 二、原理及应用 Thermo-Calc把历史形成的热力学文献数据打包备用,是所有各种热力学和相图计算的通用和柔性的软件包,是建立于强大的Gibbs能最小化基础之上的。它是多于30年和100人年的劳动以及很多各种项目的国际合作的结果。Thermo-Calc软件可使用多种热力学数据库,特别是热力学数据库的国际合作组织Scientific Group Thermodata Europe(SGTE)开发的数据库。其最大的优点在于使用灵活、方便,起到钢铁材料研发人员的桌面词典的作用。遇到新的钢种设计或者工艺优化时,通过对钢的平衡进行计算,可加深对各种热过程中钢的组织特点的理解,并指导材料设计工艺优化。 通过将直观的图形用户界面与热力学计算的强大引擎相结合,TCW可以方便地进行材料科学与工程领域的许多计算: ●相图(二元、三元、等温截面、垂直界面等)(可设置多达3个独立变量) ●单质、化合物、固溶体的热力学性质 ●性质图(相分数、吉布斯自由能、热焓、C、体积等) ●易挥发分子的化学势、偏压(多达1000种分子) ●Scheil-Gulliver非平衡凝固模拟及其改进的考虑固相中间隙原子扩散的部分平衡凝固模 拟 ●多元合金液相面计算 ●热力学因子、驱动力 ●多相平衡(可计算多达20多种成分) ●亚稳平衡、仲平衡 ●特殊量的计算,例如Tm,绝对温度T,冷却因子,?T/?x等 ●钢表面氧化膜的形成,钢或合金的精炼,PRE值
Thermo-Calc 概述:(原产地:瑞典)热力学计算软件的开拓者,软件开发历史比较悠久,因此软件功能比较完善和强大,所涉及的领域比较广泛,包括冶金、金属合金、陶瓷、熔岩、硬质合金、粉末冶金、无几物等等,产品主要包括TCC、TCW、DICTRA、二次开发工具和数据库。 软件功能:1、热力学——相图、热力学性能、凝固模拟、液相面、热液作用、变质、岩石形成、沉淀、风化过程的演变、腐蚀、循环、重熔、烧结、煅烧、燃烧中的物质形成、CVD 图、薄膜的形成、CVM 计算,化学有序- 无序等等。2、动力学(DICTRA)——扩散模拟,如合金均匀化、渗碳、脱碳、渗氮、奥氏体/铁素体相变、珠光体长大、微观偏析、硬质合金的烧结等等。 数据库:TC的数据库比较多,甚至可以说杂来形容,呵呵,TC自己做的最好的数据库应该是Fe,当然现在也有像Ni等等的自己开发的数据库,但是大部分数据库都是利用第三方的,如有色金属(Al、Mg、Ti等)是英国ThermoTech的。当然TC的同盟战线非常广,所以相应可用的数据库也就非常多,包括众多无几物数据库、陶瓷数据库、硬质合金数据库、核材料数据库等等。 优势:软件功能强大、用户群较大方便交流、软件扩展性能好、灵活性强、适用范围广。 缺点:操作界面不是很友好,很难上手,动力学(扩散)数据目前不是很全,计算引擎技术滞后(主要表现在初始值方面)。 适用范围:适合于科学研究,尤其是理论研究,从行上来讲非常适合黑色金属行业,当然陶瓷、化工等行业也是首选(因为其他没有软件有这方面的数据库和功能)。 Pandat 概述:(原产地:美国,全是中国人开发,呵呵)热力学计算软件的后起者,或者说新秀吧,呵呵!主要是抓住竞争对手界面不友好和需要计算初值的弱点发展起来的,目前主要是在金属材料也就是合金行业中发展,产品包括Pandat、PanEngine和数据库。 软件功能:相图计算、热力学性能、凝固模拟、液相投影面、相图优化以及动力学二次开发(注意二次开发要在C++环境中进行)等。 数据库:Pandat的数据库主要的优势还在于有色金属方面,尤其是Mg和Al的数据应该是全球最优秀的,除此之外还有自己开发的Ti、Fe、Ni、Zr等,以及日本的Cu和Solder数据库。 优势:界面非常友好,容易上手不要很多的计算机知识,计算引擎先进(其实就是算法比较好),可二次开发。 缺点:功能不是很完善,适用面比较窄(暂时只能用于金属行业) 适用范围:适合于科学研究,工程应用,但目前只推荐用于金属行业。
第五讲热力学函数法 讲授内容:教科书§1.9-10 学时:6 教学方法:结合课件中的文字、画图、公式进行讲授;通过习题课使学生熟悉用热力学函数解决问题的方法 教学目的:1使学生熟悉热力学基本方程和基本不等式的应用,掌握热力学函数法的基本精神,会在典型热效应之间建立联系,会用热力学方法计算简单系统的热力学函数。 教学重点:热力学函数法的基本精神 教学难点:应用导数变换方法建立不同热效应之间的联系。本讲吸取国内对此内容的教学经验,将问题归纳为几种典型,通过较多的练习和习题课,使难点得以突破。 教学过程: 一热力学函数与典型过程(70分钟)(字幕) 引言:通过前面的讨论,我们在热力学定律和统计规律的基础上引进了两个基本的态函数——内能和熵。从原则上讲,利用这两个热力学函数再加上物态方程可以解决宏观热现象的一般问题。然而在实际操作上并不都很方便。例如在绝热过程中(字幕),外界对系统作的功等于系统内能的U A-U B=W (字幕)通过末态B与初态A内能之差可以直接得到功。根据熵增原理dS≥0(字幕)可以判断不可逆绝热过程的进行方向(字幕)。可是很多过程并不是绝热的,对于经常遇到的等温过程或等温等压过程就无法直接运用内能和熵解决上述问题。本节将引入几个新的热力学函数使问题得到简洁地处理。 1焓与等压过程:(字幕)
1.1等压过程中的功: (字幕)如果系统只有V 作为外参量,在等压过程中外界对系统的功W=-P 0(V B -V A )=-P 0ΔV (字幕) 1.2焓与等压过程中的热量: (字幕)ΔU=U B -U A =Q-P 0ΔV (字幕)移项得Δ(U+P 0V)=Q (字幕)不管等压过程是否可逆,只要初末态是平衡态,系统在初末态的压强P =P 0,引入新的热力学函数——焓H=U+PV (字幕)则ΔH=Q (字幕) 对于初末态为平衡态的无穷小过程则有dH=δQ (字幕)焓是广延量,具有和内能相同的量纲。焓具有明显的物理意义:在没有非体变功的等压过程中系统吸收的热量等于系统焓的增加,系统放出的热量等于系统焓的减少。(字幕)通过末态与初态焓的差就可以算得系统在等压过程中吸收的热量。 1.3焓的全微分式: (字幕)在热力学基本方程两端加d(PV),即 d U P V T d S P d V d P V ()()+=-+ 于是有 d H T d S Vd P =+ (字幕) 上式是以熵S 和压强P 为独立变量时焓的全微分表达式。有时,使用它讨论等压过程的问题比使用基本方程更为方便。通常,H(S,P)的全微分为 dH H S dS H P dP P S =+(/)(/)???? 两式对照即有(/)??H S T P =, (/)??H P V S = 。(字幕) 1.4定压热容:(字幕)系统的定压热容 C li m H T )H T )P T P ==→???0(/(/?? 对于等压过程, dH T dS Q C dT P ===δ 定压热容又可以由下式算得C H T T S T P P P ==(/)(/)???? (字幕) 2自由能与等温过程:(字幕) 2.1自由能与等温过程的功:(字幕)对于等温过程,将热力学基本不等式移项可得
常用数据手册 D. R. Lide,“CRC Handbook of Chemistry and Physics”,77th ed.,Chemical Rubber Co, 该手册是美国化学橡胶公司(Chemical Rubber Co,简称CRC)出版的一部著名化学和物理学科的工具书。它初版于1913年,以后逐年改版,内容不断完善更新。该手册资料丰富,查阅方便,为人们提供了可靠的常用基础数据。 全书由目录、正文、附录和索引组成,正文分16个部分。其中: 第3部分是有机化合物的物理常数。主要内容是有机化合物的物理常数表,收录了1.5万多种有机化合物的物理常数。 第4部分是元素和无机化合物的性质。主要内容为元素和各种化合物的物理和化学性质、无机化合物的物理常数表。 第5部分是热力学、电化学和动力学。主要内容有化学物质的标准热力学性质、某些有机化合物的燃烧焓、无机化合物的融化焓、电解质水溶液的当量导电率、电解质的溶解焓等。 第6部分是流体的性质,汇集了流体的各种物理和化学数据。主要内容有流体的热物理性质、蒸气压、气体在水中的溶解度、某些化合物的临界常数、沸点、熔点、无机物和有机物的气化焓、共沸混合物、流体的粘度等。 第7部分是生物化学和营养。 第8部分是分析化学,包括试剂的制备、酸碱盐的标准溶液、有机分析试剂、酸碱指示剂、荧光指示剂、电化次序、酸碱在水溶液中的解离常数,溶解度表等。 J. A. Dean; “L ange’s Handbook of chemistry”,14th ed,McGraw-Hill New York,1992 这是一本著名的化学数据手册,1934年发行第一版。正文以表格形式为主,共分为11个部分。其中有(9)热力学性质和(10)物理性质。每一部分的前面有目次表,书末有主题索引。 该手册的第13版有中译本,名为《兰氏化学手册》,由尚久方等翻译,1991年3月科学出版社出版。 R. C. Reid et.al.,“The properties of Gases and Liquids,” Fourth ed.,McGraw-Hill,New York,1987 该书共分11个部分:(1)物理性质的估算;(2)纯组分常数,包括临界性质、偏心因子、沸点、熔点及偶极矩;(3)纯气体的PVT关系;(4)混和物的容积性质;(5)热力学性质;(6)理想气体热力学性质;(7)纯液体的蒸气压和蒸发焓;(8)多组元系统的流体相平衡;(9)粘度;(10)导热系数; (11)表面张力。书后附有468种物质的物性数据表,涉及了几乎所有类型的热力学性质。国内外
金属铝水解制备高纯氢氧化铝① 刘建良1,2,胡劲1,2,施安1,徐茂1,王开军1,孙加林1,2 (1.昆明贵金属研究所,云南昆明650221;2.昆明理工大学,云南昆明650011) 摘要:本文介绍了一种全新的高纯氢氧化铝制备技术。经多极雾化活化设备处理得到的活性铝粉,可在不添加任何 化学试剂的条件下与水发生持续水解反应,获得高纯度氢氧化铝粉体。利用XRD,BET,SE M和拉曼光谱、激光粒度仪 对水解产物进行性能和结构研究。研究结果表明,活性金属铝粉末的水解历程较为复杂,在反应过程中有多种水解产 物生成。水解反应溶液的拉曼光谱结果表明溶液中存在Al(OH)4-阴离子,Al(OH)4-阴离子的出现推动了水解产物 的生成。水解产物粒度及颗粒形貌随水解历程发生较大的变化。 关键词:活性铝粉;水解;高纯氢氧化铝 中图分类号:T Q031.5 文献标识码:A 文章编号:10021752(2005)11001404 Preparation of high purity aluminium hydroxide by aluminium hydrolyzation LI U Jian-liang1,2,HU Jin1,2,SHI An2, X U Mao2,WANG K ai-jun2,S UN Jia-lin1,2 (1.K unming Institute of Precious Metals,K unming Y unnan650221; 2.K unming University of Science and T echnology,K unming Y unnan650093) Abstract:A new technology for preparation of high purity alum inium hydroxide has been introduced in this paper.The activated alum inium powder had been pro2 duced by multistage-spraying and spinning atom ized equipment and can continuously hydrolyze with water without any chem ical reagent.The hydrolysate is high purity alum inium hydroxide.The properties and structure of com posite powder had been researched by XRD,SE M,BET,Raman spectrum and laser particle siz2 er.The results show that the hydrolyzation reaction is a very com plex course.There are several kinds of hydrolysates acquired during the hydrolyzation reaction. The Raman spectrum shows there is Al(OH)4-anion in reacting s olution.The Al(OH)4-anion prom otes the hydrolysate.The distribution and m icrograph of hy2 drolysate powder has a great difference during different reacting course. K ey w ords:activated alum inium powder;hydrolyzation;high purity alum inium hydroxide 传统制备高纯氢氧化铝的方法有硫酸铝铵热解法〔1〕、碳酸铝铵热解法〔2〕、异丙醇铝水解法〔3〕等,这些方法均存在成本高、工艺复杂、污染环境的缺点。近年来,以高纯金属铝为原料生产高纯氢氧化铝的新工艺不断涌现,如氯化汞活化水解法〔4〕、胆碱活化水解法〔5〕、多级超音速雾化水解法〔6〕。其中,后两种方法已经实现规模化生产,二者总产量在国内高纯氧化铝市场占据了相当比例。综观这两种法,其优点在于原料便宜、工艺简单易行、环境友好。本文介绍采用多级超音速雾化水解法制备活性金属铝粉末并与水发生水解反应,制备高纯氢氧化铝新工艺,该工艺在水解反应过程中无需添加任何化学试剂,其产品纯度更高,成本也更低。 1 试验 试验用原料为中铝集团贵州分公司特级精铝,纯度达到99.996%;水解反应用纯水为自来水经四级反渗透加树脂交换后得到的去离子水,其电阻率≥12MΩ。将金属铝用自制活化设备进行活化处理制成粉末,用AS AP-2000比表面仪和欧美克LSP-OP(III)激光粒度仪对活化铝粉进行比表面积和粒度分析;之后,将活化铝粉与去离子水在加热条件下进行水解反应,反应过程中按一定时间间隔取样,并对样品进行SE M、XRD及拉曼光谱分析,分析设备分别为ESE M测试仪、德国Bruker公司D8advance X 衍射仪及Near-in frared FT-Raman S pectrometer测试仪。 2 结果与讨论 2.1 促成水解反应的原因分析 1)水解反应的热力学计算 对于本研究中的Al-H2O反应体系,存在以下方程: ①基金项目:国家中小企业创新基金(编号:03C26215301149)收稿日期:2005-08-22
电动势法测定化学反应的热力学函数 实验预习题 1. 能否用伏特计测化学反应的电动势?为什么?实验怎么用对消法测电动势? 2. 了解电位差计、标准电池和检流计的使用及注意事项。 3. 对消法测定电池电动势的装置中,电位差计,工作电池,标准电池及检流计 各起什么作用?标准电池的重要特点是什么?正负极各是什么?写出正负极及总反应方程式。 4. 在测量电池电动势的过程中,若检流计指针或光点总向一个方向偏转,可能 是什么原因? 5. 用电池电动势法测定化学反应热力学函数的原理和方法。 一、仪器及试剂 电势差计及附件:1套,超级恒温槽:1台,银—氯化银电极:1只, U型电极管:1只,饱和甘汞电极:1支,饱和氯化钾溶液 二、基本原理 原电池由正、负两极和电解质组成。电池在放电过程中,正极上发生还原反应,负极则发生氧化反应,电池反应是电池中所有反应的总和。 电池除可用作电源外,还可用它来研究构成此电池的化学反应的热力学性质,从化学热力学得知,在恒温、恒压、可逆条件下,电池反应有以下关系: (Δr G m)T,P= -nFE (1) (2) (3) 式中,F为法拉弟(Farady)常数;n为电极反应式中电子的计量系数;E为电池的电动势。 电池反应的Δr G m、Δr S m、Δr H m、Δr G m 分别测定“1”中电池在各个温度下的电动势, 作E—T图,从曲线斜率可求得任一温度下的,利用公式(1),(2),(3),(5),即 可求得该电池反应的Δr G m、Δr S m、Δr H mΔr G m 三、操作步骤 1、电池的组合 将Ag—AgCl电极、饱和甘汞电极插入装有饱和氯化钾溶液的电极管中,即得下列电池。
https://www.doczj.com/doc/0d8134609.html,/data/2006/0822/article_4750.htm 国外的.这是在线免费查热力学的数据库. https://www.doczj.com/doc/0d8134609.html,/show/download/shtml/014965.shtml 这个则是150页的许多种有机物的热力学数据. https://www.doczj.com/doc/0d8134609.html,/ 化学数据库https://www.doczj.com/doc/0d8134609.html,7KMWeWFuZ2Rvbmd5dQ==Ir0z ---清风小木虫 1. 化合物毒性相关数据库 Toxnet https://www.doczj.com/doc/0d8134609.html,/ 2毒性物质与健康和环境数据库https://www.doczj.com/doc/0d8134609.html,/efdb/TSCA TS.htm 3. 急性毒性数据库https://www.doczj.com/doc/0d8134609.html,/data/acute/acute.html 4. SpectraOnline,Galact https://www.doczj.com/doc/0d8134609.html,/SpectraOnline/Default_ie.htm 5. 药物使用指南,USP DI https://www.doczj.com/doc/0d8134609.html,/medlineplus/druginformation.html 6。美国常用药物索引库RxList https://www.doczj.com/doc/0d8134609.html,/ 7. 有机化合物光谱资料库系统http://www.aist.go.jp/RIODB/SDBS/menu-e.html 8. NIST的Chemistry WebBook https://www.doczj.com/doc/0d8134609.html,/chemistry/ 9. 化合物基本物性库https://www.doczj.com/doc/0d8134609.html, 10. 化学物质热力学数据https://www.doczj.com/doc/0d8134609.html,/databases/key1.html 11. 溶剂数据库SOLV-DB https://www.doczj.com/doc/0d8134609.html,/solvdb.htm 12. 三维结构数据库NCI-3D https://www.doczj.com/doc/0d8134609.html,/nci3d/ 13. 有机合成手册数据库https://www.doczj.com/doc/0d8134609.html,/ 14. Beilstein Abstracts https://www.doczj.com/doc/0d8134609.html,/databases/belabs 15. 有机合成文献综述数据库 https://www.doczj.com/doc/0d8134609.html,/ ... als/info/index.html 16. 预测LogP和LogW https://www.doczj.com/doc/0d8134609.html,/ 17. 物性、质谱、晶体结构数据库http://factrio.jst.go.jp/ 18. 网上光谱资料库https://www.doczj.com/doc/0d8134609.html,/SpectraOnline/Default_ie.htm 19. 中国科学院学位论文数据库https://www.doczj.com/doc/0d8134609.html,/cgrs 全球实用化学化工期刊和数据库网址 资源名称:AIChE(美国化学工程师协会) 资源地址:https://www.doczj.com/doc/0d8134609.html,/ 获取途径:部分资源可免费查阅 资源名称:American Chemical Society(美国化学学会网站) 资源地址:https://www.doczj.com/doc/0d8134609.html,/ 获取途径:大部分资源可免费查阅,34种期刊(https://www.doczj.com/doc/0d8134609.html,/about.html)全部免费阅览全文。 精选网络化学资源之一常用资源 ? A. 元素周期表WebElements - https://www.doczj.com/doc/0d8134609.html,/ B. 化合物性质(MSDS) ChemFinder服务https://www.doczj.com/doc/0d8134609.html,/
氟化物熔盐中含钕及钕—氧络合离子 存在形式的研究① 胡宪伟,王兆文,罗旭东,路贵民,崔建忠,陈广华 (东北大学材料电磁过程研究教育部重点实验室,辽宁 沈阳 110004) 摘 要:采用冰点降低法分别研究了以LiF为溶剂的稀LiF-NdF3熔盐中Nd-F离子团及LiF-NdF3-Li2C O3熔盐中Nd-O-F离子团的非氟离子的个数。结果表明,在以LiF为溶剂的稀LiF-NdF3熔盐中,Nd-F离子团中Nd3+的个数为2,这种离子团最可能的存在形式为Nd2F7-;而在以LiF为溶剂的稀LiF-NdF3-Li2C O3熔盐的含Nd3+,O2-离子团中,Nd3+与O2-的个数比为1,认为这种离子团最可能的存在形式为Nd2O2F42-。由此而得到的关于熔盐离子结构的信息对于理解工业实际应用的高NdF3含量的电解钕熔盐结构会有很大帮助。 关键词:LiF-NdF3(-Li2C O3)熔盐;Nd-F离子团;Nd-O-F离子团;冰点降低法 中图分类号:TF84516 文献标识码:A 文章编号:100420277(2008)0520058203 NdF3-LiF-Nd2O3熔盐电解法是当今生产金属钕及钕铁合金的重要方法,已有许多关于相关熔盐体系的物理化学性质的研究见诸文献[1~9];然而,国内外关于相关体系熔盐结构的研究很少。通过对熔盐结构的研究,可以理解其物理化学性质及其变化规律,认识熔盐电解的电极过程,具有重要的理论意义。 本文采用冰点降低法分析了以LiF溶剂的稀LiF-NdF3熔盐中Nd-F离子团中Nd3+的个数及稀LiF-NdF3-Li2C O3熔盐中的络合离子团中Nd3+和O2-的个数,并在此基础上推断了熔盐中的络合离子团形式,由此而得到的关于熔盐离子结构的信息对于理解工业实际应用的高NdF3含量的电解钕熔盐结构会有很大帮助。 1 实验原理与方法 111 LiF-NdF3熔盐冰点降低分析原理 在NdF3-LiF相图中,没有固溶体的形成,以LiF作为溶剂,认为当NdF3浓度很小时,该熔盐体系符合理想T emkin行为,忽视偏微分混合热,那么少量的NdF3的加入所引起的LiF熔盐的液相线降低值为: ΔT=c×N NdF 3 × RT2LiF ΔH LiF (1) 式中,ΔT为熔盐液相线温度的降低值,单位为K;c为熔盐中由于NdF3的加入所产生的新质点数; N NdF 3 为熔盐中NdF3的摩尔分数;T LiF和H LiF分别为溶剂LiF的熔点和熔化热,其数值分别为1122K和27090J?m ol-1[10];R为普适气体常数,数值为81314J ?m ol-1?K-1。将已知数据带入式(1),并整理可得 ΔT=3861355×c×N NdF 3 (2) 于是可以通过测定已知NdF3摩尔分数的以LiF 为溶剂的稀LiF-NdF3熔盐的液相线温度并由(2)式计算出c的值来,进而可以对熔盐中Nd-F离子团的形式进行推断。 112 LiF-NdF3-Li2C O3熔盐冰点降低分析原理向以LiF为溶剂的稀LiF-NdF3熔盐中引入O2-并研究其对液相线温度的影响可以对O2-的存在形式进行推断。在本实验中,O2-的引入是通过向熔盐中加入Li2C O3来实现的,不采用Nd2O3是因为这样又会向熔盐中引入Nd3+,不利于冰点降低分析;而在高温熔盐中Li2C O3可以完全分解为LiO和C O2,新引入的离子只有O2-。 由于NdF3的加入导致的新离子团的生成,将会 第29卷第5期2008年10月 稀 土 Chinese Rare Earths V ol129,N o15 October2008 ①收稿日期:2008201202 基金项目:国家重点基础研究发展计划(2007C B210305) 作者简介:胡宪伟(19812),男,河北承德人,博士研究生,主要从事钕电解系熔盐结构的研究。
第二章 2-1.使用下述方法计算1kmol 甲烷贮存在体积为0.1246m 3、温度为50℃的容器中产生的压力:(1)理想气体方程;(2)R-K 方程;(3)普遍化关系式。 解:甲烷的摩尔体积V =0.1246 m3/1km ol =124.6 c m3/m ol 查附录二得甲烷的临界参数:T c =190.6K P c =4.600MP a V c=99 cm 3/mol ω=0.008 (1) 理想气体方程 P=RT/V =8.314×323.15/124.6×10-6=21.56M Pa (2) R-K方程 2 2.52 2.5 60.5268.314190.60.427480.42748 3.2224.610 c c R T a Pa m K mol P -?===???? 53168.314190.60.086640.08664 2.985104.610 c c RT b m mol P --?===??? ∴() 0.5RT a P V b T V V b =--+ ()()50.5558.314323.15 3.22212.46 2.98510323.1512.461012.46 2.98510---?=--???+? =19.04MPa (3) 普遍化关系式 323.15190.6 1.695r c T T T === 124.699 1.259r c V V V ===<2 ∴利用普压法计算,01Z Z Z ω=+ ∵ c r ZRT P P P V = = ∴ c r PV Z P RT = 65 4.61012.46100.21338.314323.15 c r r r PV Z P P P RT -???===? 迭代:令Z0=1→P r0=4.687 又Tr=1.695,查附录三得:Z 0=0.8938 Z 1=0.4623 01Z Z Z ω=+=0.8938+0.008×0.4623=0.8975 此时,P=P c P r =4.6×4.687=21.56MP a 同理,取Z 1=0.8975 依上述过程计算,直至计算出的相邻的两个Z 值相差很小,迭代结束,得Z 和P 的值。 ∴ P =19.22MPa 2-2.分别使用理想气体方程和Pi tzer 普遍化关系式计算510K 、2.5MPa 正丁烷的摩尔体积。已知实验值为1480.7cm 3/m ol 。 解:查附录二得正丁烷的临界参数:T c =425.2K P c =3.800MPa V c =99 cm 3/mol ω=0.193
热力学参数优化评估的标准规程 The standard regulations for the assessment of thermodynamic parameters (讨论稿) 2011年10月11日
前言 本规程主要针对Thermo-Calc热力学计算软件的使用群体。 本规程阐述了对相图及热力学数据的搜集、常用热力学模型的选取、热力学参数的优化和数据库的建立。 本规程的起草单位:北京科技大学材料科学与工程学院材料相平衡与新材料设计梯队。 本规程的主要起草人:王金三博士,李长荣教授。
热力学参数优化评估的标准规程 1 范围 本规程中数据库文件的格式是以Thermo-Calc热力学计算软件中的数据库标准格式为准。 本规程采用了CALPHAD(CALculation of PHAse Diagram)技术。 2 术语和定义 2.1 相图计算技术Calculation of phase diagram,简写为CALPHAD 在热力学理论和热力学数据库支持下,进行相图计算的技术。 2.2 热力学计算软件Thermo-Calc software,简称TC 一款以CALPHAD技术为核心,能够实现热力学优化计算的软件。 2.3 热力学数据库文件Thermo-Calc Database,简写为TDB 以Thermo-Calc软件规定格式书写的数据库文件。 2.4 欧洲热力学数据科学组织The Scientific Group Thermodata Europe,简称SGTE 在欧洲成立的一个专门发展无机和冶金体系热力学数据库的科学组织。 3 概述 相图的热力学参数的优化过程是利用目标体系已有的相图和热化学实验信息,建立描述该体系中各相吉布斯自由能与温度、压力、成分等变量之间关系的热力学模型、确定模型参数的过程。目前,热力学参数的优化一般借助专业的热力学计算软件来完成,本文是以国际上较为流行的Thermo-Calc软件为标准。
第2章. 化学热力学与化学平衡 2.1 化学热力学基本知识 1. 研究内容:化学热力学研究的对象是宏观系统。 化学反应的能量变化;化学反应的方向;化学的反应限度。 2. 一些相关的重要的基本概念 (1)系统、环境和相: 热力学中研究的对象为系统;称系统以外的其他密切相关部分为环境。 相是系统中物理性质和化学性质完全相同的均匀部分,相与相之间存在明显的界面。通常把只含有一个相的系统称为均相系统;含两个或两个以上相的系统称为多相系统。(2)系统的分类: 按系统与环境之间能量和物质交换有无交换分三类: 重点讨论的是封闭系统。 (3)状态和状态函数: 状态:系统的宏观性质的综合表现。
状态函数:描述系统性质的物理量(如:n、p、V、T、U、H、G、S ……) 广度性质:具有加和性的系统性质,如体积、质量等。 强度性质:不具有加和性的系统性质, 如温度。 状态函数的特点:其量值只取决系统所处的状态;其变化值仅取决于系统的始态和终态,而与变化的途径无关。(4)过程和途径: 系统状态所发生的任何变化称为过程。系统经历一个过程,由始态变化到终态,可以采用多种不同的方式,通常把完成某一过程的具体方式称为途径。 根据过程发生时的条件不同,可分为以下几类: (1)等温过程:系统的始态温度与终态温度相同。 (2)等压过程:系统始态的压力与终态的压力相同。 (3)等容过程:系统的体积无变化的过程称为等容过程。 (4)循环过程:如果系统由某一状态出发,经过一系列变化又回到原来的状态,这种过程就称为循环过程。 无机化学重点讨论等温等压等压过程。 3. 标准状态、标准状况 热力学标准状态:
标准热力学数据(298.15K) 化学式(状态)H G S 氢(hydrogen) H2(g)0 0 130.57 H+(aq)0 0 0 锂(lithium) Li(s)0 0 29.12 Li+(aq)-278.49 -293.30 13.39 Li2O(s)-597.94 -561.20 37.57 LiCl(s)-408.61 -384.38 59.33 钠(sodium) Na(s)0 0 51.21 Na+(aq)-240.12 261.89 58.99 Na2O(s)-414.22 -375.47 75.06 NaOH(s)-425.61 -379.53 64.45 NaCl(s)-411.65 -384.15 72.13 钾(potassium) K(S)0 0 64.18 K+(aq)-252.38 -283.26 102.51 KOH(s)-424.76 -379.11 78.87 KCl(s)-436.75 -409.15 82.59 铍(beryllium) Be(s)0 0 9.50 BeO(s)-609.61 -580.32 14.14 镁(magnesium) Mg(s)0 0 32.68 Mg2+(aq)-466.85 -454.80 -138.07 MgO(s)-601.70 -569.44 27.91 Mg(OH)2(s)-924.54 -833.58 63.18 MgCl2(s)-641.32 -591.83 89.62 MgCO3(s)-1095.79 -1012.11 65.69 钙(calcium) Ca(s)0 0 41.42 Ca2+(aq)-542.83 -553.54 -53.14 CaO(s)-635.09 -604.04 39.75 Ca(OH)2(s)-986.09 -898.56 83.39
第一章 气体的pVT 关系 主要公式及使用条件 1. 理想气体状态方程式 nRT RT M m pV ==)/( 或 RT n V p pV ==)/(m 式中p ,V ,T 及n 单位分别为Pa ,m 3,K 及mol 。 m /V V n =称为气体的摩尔体积,其单位为m 3 · mol -1。 R = J · mol -1 · K -1,称为摩尔气体常数。 此式适用于理想气体,近似地适用于低压的真实气体。 2. 气体混合物 (1) 组成 摩尔分数 y B (或x B ) = ∑A A B /n n 体积分数 /y B m,B B * =V ?∑*A V y A m ,A 式中∑A A n 为混合气体总的物质的量。A m,* V 表示在一定T ,p 下纯气体A 的摩 尔体积。∑*A A m ,A V y 为在一定T ,p 下混合之前各纯组分体积的总和。 (2) 摩尔质量 ∑∑∑===B B B B B B B mix //n M n m M y M 式中 ∑=B B m m 为混合气体的总质量,∑=B B n n 为混合气体总的物质的量。上 述各式适用于任意的气体混合物。 (3) V V p p n n y ///B B B B * === 式中p B 为气体B ,在混合的T ,V 条件下,单独存在时所产生的压力,称为B 的分压力。* B V 为B 气体在混合气体的T ,p 下,单独存在时所占的体积。 3. 道尔顿定律 p B = y B p ,∑=B B p p 上式适用于任意气体。对于理想气体
V RT n p /B B = 4. 阿马加分体积定律 */B B V n RT p = 此式只适用于理想气体。 第二章 热力学第一定律 主要公式及使用条件 1. 热力学第一定律的数学表示式 W Q U +=? 或 'amb δδδd δdU Q W Q p V W =+=-+ 规定系统吸热为正,放热为负。系统得功为正,对环境作功为负。式中 p amb 为环境的压力,W ’为非体积功。上式适用于封闭体系的一切过程。 2. 焓的定义式 3. 焓变 (1) )(pV U H ?+?=? 式中)(pV ?为pV 乘积的增量,只有在恒压下)()(12V V p pV -=?在数值上等于体积功。 (2) 2 ,m 1d p H nC T ?=? 此式适用于理想气体单纯pVT 变化的一切过程,或真实气体的恒压变温过程,或纯的液体、固体物质压力变化不大的变温过程。 4. 热力学能(又称内能)变 此式适用于理想气体单纯pVT 变化的一切过程。 5. 恒容热和恒压热 V Q U =? (d 0,'0)V W == p Q H =? (d 0,'0)p W == 6. 热容的定义式 (1)定压热容和定容热容 pV U H +=2 ,m 1 d V U nC T ?=?