
痛觉过敏的研究 【关键词】过敏;疼痛 外周组织炎症或神经损伤常常引起持续性自发痛(spontaneous pain)、痛觉过敏(hyperalgesia)和痛觉超敏(allodynia)等病理性疼痛。持续性自发痛是指在不受任何外来刺激下持续发生的疼痛,痛觉超敏是指非伤害性刺激即可引起的疼痛,痛觉过敏指伤害性刺激下在受损部位及周围组织或远处可产生各种敏感性增强的疼痛或痛觉过敏区域,引起的更加强烈的疼痛。这些病理性疼痛是外周和中枢敏感化的结果,其中脊髓敏感化起着十分重要的作用。痛觉过敏时机体对疼痛的感觉阈值降低,轻微刺激即可引起疼痛感觉的现象。兴奋性氨基酸(excitatory amino acids,EAAs)的释放及受体的激活所引起的细胞内信使,特别是蛋白激酶C(protein kinase C,PKC)、一氧化氮(nitric oxide,NO)等生成是此种外周损伤或伤害性刺激所引发的痛觉过敏现象的原因。 1痛觉过敏及疼痛模型 1.1敏化和痛觉过敏 组织损伤可以导致伤害感受系统出现两种反应,即外周敏化和中枢敏化。外周敏化是初级传入纤维的变化引起的,表现为:对刺激反应阈值的下降、对阈上刺激反应增强、自主活动增强、感受野(刺激可诱发传入神经纤维动作电位的区域)的扩大。伤害性刺激的输入能提高中枢神经系统疼痛传递神经元的反应,称为中枢敏化。例如,损伤区域以外的刺激也可诱发脊髓背角疼痛反应增加。外周敏化导致初级痛觉过敏,表现为对来自损伤区域的刺激产生夸大的疼痛反应。中枢敏化导致次级痛觉过敏,表现为损伤区域外的刺激也能产生增加的疼痛反应。许多研究表明:机械刺激(不是温度刺激)产生的次级痛觉过敏(次级机械性痛觉过敏)发生在损伤后,它不是由未损伤区域的初级传入纤维的敏化引起的。 1.2痛觉过敏的类型 皮肤或周围组织损伤可引起各种感觉敏感性增强的疼痛称痛觉过敏。初级痛觉过敏产生于受损部位,二级痛觉过敏产生于邻近未受损部位的组织、皮肤或远距离及深部组织。通过进一步研究痛觉过敏的产生机理表明,初级痛觉过敏主要是由于外周受损部位神经末梢伤害性感受器不断受到刺激产生的,而二级痛觉过敏为神经中枢尤其脊髓神经元兴奋性发生改变所致。根据测试方法及组织对不同刺激的感受,痛觉过敏分为热痛觉过敏和机械性痛觉过敏。前者指皮肤损伤后产生持续性疼痛和痛觉过敏,原发性痛觉过敏发生在组织损伤部位,表现为热刺激的反应增强;后者指继发性痛觉过敏发生在损伤周围的正常组织,表现为对机械刺激的反应增强,如轻触刺激诱发疼痛。在实验室里对热刺激痛觉过敏观测,热板法是研究动物对伤害性刺激反应的常用方法,但不太适用于神经损伤后的动物。目前较常用的是Hargreaves发明的热辐射刺激的方法。采用一定功率之辐射热,从下向上照射动物之脚底,测试其回缩潜伏期(热刺激回缩潜伏期),或采用后脚浸泡方法测试一定温度下后脚回缩潜伏期。也有采用不同温度的热探头刺激以观测后脚回缩阈值。对机械性痛觉过敏的观测,一般可应用软毛刷或铅笔头轻触动物的皮毛以测试动物对轻触觉刺激的反应。目前较常用的方法是应用系列的Von Frey 针丝压迫皮肤以产生不同程度的压力(几毫克至几百克)。
内脏感觉与痛觉 植物性神经主要是传出性内脏神经从脊髓和脑干部分出,支配头、胸腔、腹腔与盆腔中的内脏活动,但是在迷走神经中80-90%的纤维具有传入功能,内脏交感神经中也有半数纤维是传人性的,副交感性盆神经中至少有30%的纤维是传人性的。与浅感觉不同,内脏性传入神经信息绝大多数并不投射到意识中来产生明确的感知觉,而是自动调节体内环境的稳定性。当然,浅感觉和深感觉在产生主观感觉的同时,也具有无意识地调节体内环境的作用。倒如在肢体运动时伴随血液供应的调节,出现寒冷感觉的同时,皮肤的血液供应也发生相应变化等。 胸腔、腹腔和盆腔的各种内脏都存在着机械感受器、温度感受器、化学感受器和游离神经末梢,体内环境的变化引起它们的兴奋,神经信息沿内脏神经向中枢神经系统传人。在延脑下丘脑存在着各种内脏功能皮层下中枢,如呼吸中枢、血压调节中枢、渗透压调节中枢、化学感受中枢、饱食中枢、饥饿中枢、渴中枢等。边缘皮层则是内脏感觉的高级中枢,对皮层下中枢执行着复杂的调节功能。 在躯体各层次中,都分布着大量游离神经末梢,可能是产生痛觉的主要感受器,但是体内各种感受器受到超强刺激均可引起痛觉。所以痛觉是一种生物学保护性反应,使机体对有害刺激产生相应行为以排除有害刺激。痛觉与其他感觉相比,具有许多特点。首先,痛觉不仅包含感觉成分,还包含有情感成分、植物性成分和运动成分。主观疼痛感觉总伴有紧张、焦虑不愉快,甚至恐惧等情感变化,与此同时还有血压、心率、汗腺等植物性功能变化以及畏缩,逃脱等运动反应。情感、注意和认知活动对疼痛有明显调节作用,增强或减弱疼痛感与疼痛反应。所以说疼痛感是比较复杂的感知活动。其次,疼痛感觉的适应性较差,在痛觉刺激持久作用的过程中,痛觉感受阈值并不增高;相反,多次重复应用痛刺激反而出现敏感化现象,这一特点是其他感觉所不具备的。最后,疼痛感的性质是多样的,可以按出现的部位、特点和方式将痛觉分为很多类型。按痛觉发生的部位,可分为体表疼痛、深部疼痛和内脏疼痛等3大类;按疼痛定位的性质不同可将之分为投射性痛、牵涉性痛两大类;按疼痛出现的时间特点可分为有害刺激作用时立即出现的剌痛、延迟出现的钝痛或灼烧样痛,痉挛性疼痛和阵发性疼痛等。 常见的体表疼痛有刺痛和钝痛;深部疼痛中最常见的是肌肉痉挛性疼痛和持续性头痛、
瑞芬太尼的临床应用研究 【摘要】瑞芬太尼是一种较理想的阿片类药物,虽已在临床上得到广泛应用,但其临床应用研究资料仍在不断丰富,本文简要叙述其在临床相关作用的研究及麻醉、镇痛、镇静方面的进展。 【关键词】瑞芬太尼;镇静;镇痛 瑞芬太尼是具有独特药代动力学特性的阿片受体激动剂,在体内被组织和血浆中的非特异性酯酶迅速水解,具有起效迅速、清除快、其代谢不受肝肾功能影响、时一量相关半衰期短(3.7rain)、长时间输注无蓄积等特点[1],目前已广泛应用于临床,包括心血管、神经外科、妇产科、儿科等专科手术的麻醉。现将瑞芬太尼在临床研究所取得的进展综述如下。 1 药理作用及特点 1.1 药理作用瑞芬太尼由于其结构中有酯键,可被组织和血浆中非特性酯酶迅速水解,主要代谢物经肾脏排出,消除率不依赖肝肾功能。无论持续输注多长时间,输注停止后瑞芬太尼血浆浓度减少50%的时间仅需3~5 min,与血浆蛋白结合率为70%。故无需手术,结束前逐渐减量或提前停药[2]。它具有独特的代谢机制N酰基端存在酯键。被组织和血液中的非特异性酯酶在肝外持续水解,其消除主要是因为药物的快速清除而不是再分解。在人体内1 min左右迅速达到血一脑平衡、起效快、维持时间短。与其他芬太尼类似物明显不同。瑞芬太尼的镇痛作用及其副作用呈剂量依赖性,与催眠药、吸人性麻醉药和苯二氮革类药物合用有协同作用。瑞芬太尼的阿片受体激动作用可被纳洛酮所拮抗。另外,瑞芬太尼也可引起呼吸抑制、骨骼肌强直、恶心呕吐、低血压等,在一定剂量范围内,随剂量增加而作用加强。由于其独特的药代动力学特点,更适于静脉滴注,控制输注速度,可达到预定的血药浓度。 1.2 药理特点瑞芬太尼的药理特点有:镇痛作用相似或强于芬太尼;血一脑平衡时间仅1 min;5~10 min作用消失:独特的非特异性酯酶代谢;药剂量和速度可根据麻醉深度和手术需要快速而精确地调整;术后5~10 min患者恢复:肝肾损伤患者不需调整剂量。 2 临床应用 2.1 在心血管手术中的应用Stephane等[3]做动脉内膜切除术患者以瑞芬太尼和苏芬太尼做血流动力学稳定性比较,结果表明,在插管时,最高收缩压在苏芬太尼组比瑞芬太尼组高,瑞芬太尼组使用异丙酚和异氟醚量均低于苏芬太尼组。在苏醒时,两者收缩压和心率相似,因此得出结论,在进行动脉内膜切除术时,瑞芬太尼和苏芬太尼在术中和术后血流动力学稳定性方面是相似的。然而,瑞芬太尼抑制插管反应更有效,在术中需要催眠性药物的量更少一些。更为有趣的是瑞芬太尼组血压与心率增快与苏醒无关,这一点在血管手术中很重要,因为它可以降低心肌缺血。通过这项研究及它本身的短效性,看来它比苏芬太尼更适于应用于血管手术。在几种心外科手术中,瑞芬太尼可以有效抑制与转流前期相关的血糖升高和心动过速。瑞芬太尼能够提供强有力的术中镇痛,同时又能快速苏醒和拔管,这使得它在新生儿心外科手术中越来越受欢迎[4]。
1痛觉过敏在术后早期阶段加重疼痛经历,引起机体循环、呼吸、消化、内分泌、免疫、凝血等系统发生改变。剧烈的疼痛甚至会造成精神创伤,使患者产生焦虑、恐惧、失眠等。这些改变和反应与术后并发症的发生密切相关,给预后带来不良的影响。同时,由于疼痛加重,镇痛药物的使用量增加,使镇痛药物相关的不良反应也相应增加。 2痛觉过敏的定义 痛觉过敏是指外周组织损伤或炎症导致的对伤害性刺激产生过强的伤害性反应,或对非伤害性刺激产生伤害性反应。可以表现为局部的有限区域或弥散的全身性症状。典型的局部痛觉过敏 与损伤相关,通常分为两个亚型,即原发性痛觉过敏和继发性痛觉过敏。原发性痛觉过敏表现为对来自损伤区域的刺激产生夸大的疼痛反应,是外周敏化引起的。继发性痛觉过敏表现为对损伤区域外的刺激也能产生加重的疼痛反应,是中枢敏化所致。 3术后痛觉过敏的原因及机制 术后痛觉过敏可以发生于外科伤害性刺激(伤害性刺激导致的痛觉过敏),也可以发生于麻醉性镇痛药的效应引起的神经系统的致敏作用(药物引起的痛觉过敏) 4阿片类药物诱导的痛觉过敏有3个主要的机制。 ①中枢谷氨酰肽系统的活化,主要通过与阿片肽能和脑啡肽能系统稳态配对的NMDA受体发挥作用,研究表明,NMDA受体的激活在痛觉过敏的产生和维持中发挥着重要的作用 ②通过脊髓释放一种可引发痛觉过敏的物质强啡肽。强啡肽最初被认
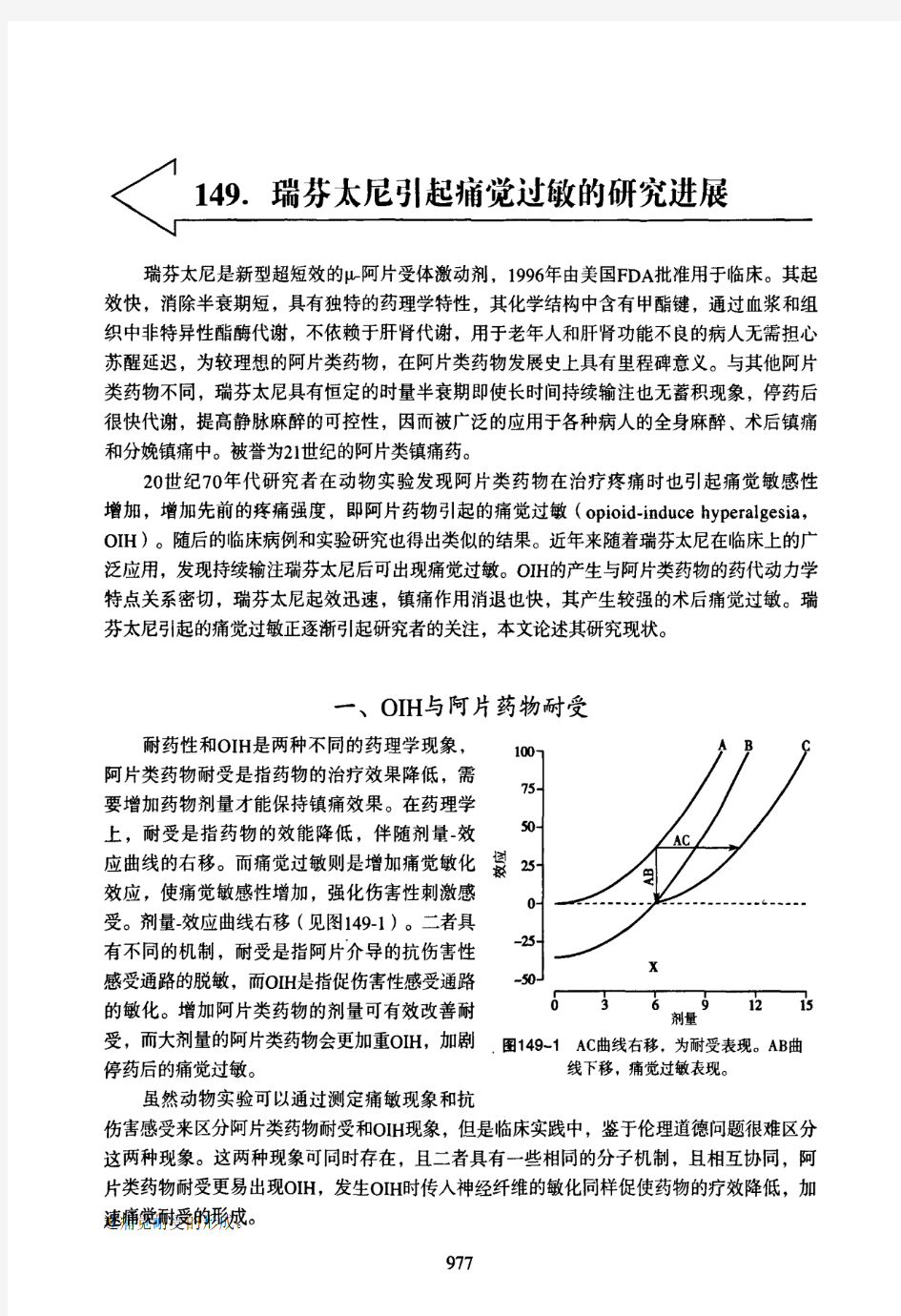
为是外源性K-阿片受体激动剂,而目前认为它在某些情况下具有内源性抗阿片作用。 ③通过位于延髓头端腹内侧的阿片敏感的“兴奋型”细胞调节脊髓下行易化。 5伤害性刺激引起的痛觉过敏与药物诱导的痛觉过敏在术后早期阶段并存,产生对伤害性感受和疼痛的高敏感性。动物研究也显 示,阿片类药物和伤害性刺激诱导的痛觉过敏有协同作用。 6 瑞芬太尼 瑞芬太尼是新型超短效的炒阿片受体激动剂,1996年由美国FDA 批准用于临床。其起效快,消除半衰期短,具有独特的药理学特性,20世纪70年代研究者在动物实验发现阿片类药物在治疗疼痛时也引起痛觉敏感性增加,增加先前的疼痛强度,即阿片药物引起的痛觉过敏(opioid.induce hyperalgesia,OIH)。随后的临床病例和实验研究也得出类似的结果。近年来随着瑞芬太尼在临床上的广泛应用,发现持续输注瑞芬太尼后可出现痛觉过敏。oIH的产生与阿片类药物的药代动力学特点关系密切,瑞芬太尼起效迅速,镇痛作用消退也快,其产生较强的术后痛觉过敏。 二、瑞芬太尼诱发痛觉过敏的证据 (一)人类志愿者研究 目前对瑞芬太尼引起痛觉过敏的研究多集中在人类研究中,志愿者可排除其他干扰因素,在人类研究中广泛采用。持续输注瑞芬太尼
硬膜外阻滞对全麻术后痛觉过敏影响的临床研究 发表时间:2014-08-05T16:19:14.217Z 来源:《医药前沿》2014年第12期供稿作者:林育南曾菲杨瑞敏[导读] 疼痛是一种伤害性刺激所导致的复杂的心理生理过程,是一种与组织创伤相关的不愉快的情感经历和躯体感觉。 林育南曾菲杨瑞敏 (广西医科大学第一附属医院麻醉科 530021) 【摘要】目的: 探讨低浓度罗哌卡因硬膜外阻滞对全麻术后痛觉过敏的影响。方法:选择在我院行择期全麻下开腹手术患者共60例,将患者分成2组:对照组(C组,n=30)和硬膜外阻滞组(E组,n=30)。两组均采用全凭静脉麻醉;E组患者在全麻前先行硬膜外穿刺并于手术切皮前20min经硬膜外导管注射0.2%罗哌卡因10ml,每小时追加一次0.2%罗哌卡因5ml,最后在手术结束前再次注射0.2%罗哌卡因 10ml。分别记录两组患者一般情况、麻醉时间、苏醒时间、芬太尼及瑞芬太尼的平均用量,同时采用视觉模拟评分法(VAS法)对两组患者术后30min、1h、4h、8h、24h的疼痛程度进行评分,另外运用von Frey hair测痛仪测量患者术后12h和24h的触痛阈(静息痛觉过敏)和机械痛觉过敏范围(动态痛觉过敏)。结果:两组患者性别、年龄及体重比较无明显差异(P>0.05)。两组患者麻醉时间、苏醒时间的比较无明显差异(P>0.05)。丙泊酚及瑞芬太尼平均用量比较,E组明显高于C组,差异有统计学意义(P<0.05)。两组患者术后各时间点疼痛程度的VAS评分比较,E组患者术后各时间点VAS评分明显低于C组,且差异有统计学意义(P<0.05)两组患者触痛阈及机械痛觉过敏范围的比较,C组患者三个测定点的触痛阈均高于E组,三条测定线上机械痛觉过敏范围均较F组窄,差异有统计学意义(P<0.05)。与术前比,两组患者三个测定点的触痛阈在术后12h及24h均降低,差异有统计学意义(P<0.05)。结论:经硬膜外注射低浓度罗哌卡因可有效减轻全麻术中患者的应激反应,减少术中阿片类镇痛药的用量,同时减轻全麻术后患者痛觉过敏的范围。【关键词】硬膜外罗哌卡因全身麻醉痛觉过敏 【中图分类号】R614.2 【文献标识码】A 【文章编号】2095-1752(2014)12-0044-02 疼痛是一种伤害性刺激所导致的复杂的心理生理过程,是一种与组织创伤相关的不愉快的情感经历和躯体感觉。临床上治疗中、重度疼痛的主要药物是阿片类药物,但是近年来有国内外相当多的研究均发现阿片类药物在发挥镇痛作用的同时,还能激活体内的促进伤害机制,最终导致痛觉敏感性物质的增加而引发痛觉过敏。全身麻醉中所使用的雷米芬太尼是一种新型超短效类阿片药物,其通过体内胆碱酯酶代谢,具有起效快,半衰期短,持续输注无蓄积等优点,目前已经成为临床麻醉中使用最为普遍的阿片类镇痛药。但是目前有研究发现,雷米芬太尼大剂量使用停药后经常出现痛觉过敏现象,导致术后患者疼痛加剧,影响循环、呼吸、消化、内分泌及免疫等系统,产生一系列的术后并发症,影响患者术后康复。本研究旨在探讨硬膜外阻滞对全麻腹部开腹手术后痛觉过敏的影响。 1. 资料与方法 1.1一般资料 选择我院2011年11月到2012年11月期间,在全麻下开腹的择期手术患者60例,其中女性38例,男性22例,中位年龄42岁,中位体重57kg,ASAⅠ~Ⅱ级,既往无高血压及冠心病史、肝肾功能正常、无阿片药物滥用及过敏史、无手术及硬膜外穿刺禁忌症,无慢性疼痛史。将患者随机分为硬膜外阻滞组(E组)和对照组(C组)。 1.2方法 1.2.1麻醉方法 所有患者术前均禁食8h,于入室前30min均肌注鲁米那1.0g、阿托品0.5mg。入室后予患者持续心电、血压、血氧饱和度、及BIS监护,间断监测肌松情况。开放静脉通道后,C组患者运用丙泊酚及瑞芬太尼血浆靶控诱导,丙泊酚初始浓度为2.0μg/ml,瑞芬太尼初始浓度为3ng/ml, 根据BIS值逐步调高丙泊酚浓度。待BIS值等于75时给予维库溴铵0.1mg/kg,当BIS值小于50、TOF值为0时行气管内插管。连接麻醉机,调节潮气量为8~10ml/kg、呼吸频率10~12次/min、新鲜气流量2L/min、氧浓度50%,维持PETCO235~45mmHg。麻醉维持为血浆靶控输注丙泊酚及瑞芬太尼,维持BIS值50~60,同时根据肌松监测TOF值追加维库溴铵,每次1~2mg。术中根据BIS值及患者血压、心率变化适时运用血管活性药物。E组患者选择L1~2或L2~3椎间隙行硬膜外穿刺,经硬膜外导管向硬膜外腔注射2%利多卡因3ml,3~5min后测试出现麻醉阻滞平面且无局麻药中毒等不良反应后开始全麻诱导,方法同C组,于手术开始前20min向硬膜外腔分次注入0.2%罗哌卡因10ml,术中每小时追加0.2%罗哌卡因5ml,手术结束时向硬膜外腔分次注入0.2%罗哌卡因10ml。 1.2.2观测指标 ①记录两组患者性别、年龄、体重等一般情况;②记录两组患者麻醉时间、苏醒时间、芬太尼及瑞芬太尼的平均用量;③采用视觉模拟评分法(VAS法)对两组患者术后30min、1h、4h、8h、24h的疼痛程度进行评分;④运用von Frey hair测痛仪测量患者术后12h和24h 的触痛阈(静息痛觉过敏)和机械痛觉过敏范围(动态痛觉过敏)。 1.2.3统计学方法 采用spss13.0统计软件进行数据分析,计量资料用均数±标准差(-x±s)表示,组间比较采用独立样本t检验,组内比较采用重复测量数据方差分析,计数资料的比较采用χ2检验,P<0.05为差异有统计学意义。 2. 结果 2.1两组患者性别、年龄及体重比较无明显差异(P>0.05)。见表1。 表1 两组患者性别、年龄及体重比较(-x±s) 组别例数年龄(岁) 体重(kg) 性别比(男/女) E组 30 53.62±8.72 55.14±11.56 12/18 C组 30 51.67±9.23 57.37±10.92 10/20 2.2两组患者麻醉时间、苏醒时间的比较无明显差异(P>0.05)。丙泊酚及瑞芬太尼平均用量比较,E组明显高于C组,差异有统计学意义(P<0.05)。见表2。 表2 两组患者麻醉时间、苏醒时间、丙泊酚及瑞芬太尼平均用量比较(-x±s)
2慢性广泛性疼痛的脊髓机制 2.1谷氨酸的释放增加:兴奋性氨基酸谷氨酸和天冬氨 酸在脊髓的伤害性刺激传导中起重要作用。慢性广泛性疼痛 时,脊髓背侧角的兴奋性氨基酸谷氨酸和天冬氨酸的释放增 加[8]。酸性盐肌肉注射导致的慢性广泛性疼痛中,重复酸性 盐注射1周后,在脊髓的背侧角,兴奋性氨基酸谷氨酸和天冬 氨酸的基础浓度升高,表明在脊髓水平有兴奋性神经递质持 续的释放增加,且谷氨酸和天冬氨酸浓度的增加水平与痛觉 过敏和中枢痛觉致敏的水平呈正相关[2]。 重复性酸性盐肌肉注射导致的非炎症性慢性广泛性疼痛 的模型中,阻断脊髓部位的谷氨酸受体,包括N-甲基-D- 天(门)冬氨酸(NMDA)受体和o-氨基羟甲基恶唑丙酸/红 藻氨酸盐受体,能改善痛觉过敏;单纯阻断NMDA受体,还可 以延缓痛觉过敏的发生,这一现象表明谷氨酸的释放增加在 重复性酸性盐注射导致的痛觉过敏中发挥重要作用[9]。纤维 肌痛的患者应用氯胺酮阻断NMDA受体,可缓解高渗盐水肌 肉注射引起的注射部位疼痛和牵涉痛[10]。然而, NMDA受 体兴奋剂右美沙芬不能加剧上述疼痛[11]。因此,除NMDA 受体之外,纤维肌痛可能另有机制。 2.2环磷腺苷(cAMP)通路的激活:脊髓cAMP通路的激 活对伤害性疼痛的上传非常重要。脊髓cAMP通路的激活引 起脊髓水平的机械性痛觉过敏,并加强脊髓丘脑束神经元对 有害的机械性冲动的反应[3]。当小鼠体内缺乏腺苷酸环化酶 1和腺苷酸环化酶8时,痛觉过敏不会发生[12]。阻断腺苷酸 环化酶或蛋白激酶A(PKA),同样能够避免酸性盐肌肉注射 或者辣椒辣素肌肉关节注射导致的机械性痛觉过敏[3,13,14]。 PKA的催化亚基核转移引起cAMP效应元件结合蛋白 (CREB)的丝氨酸133位点磷酸化。重复性酸性盐肌肉注射 后,双侧脊髓背侧角中的CREB和磷酸化CREB增加,阻断 cAMP通路能抑制磷酸化CREB的生成[13]。产生的磷酸化 CREB并非只存在于脊髓,也存在于脊髓丘脑束和其他神经 细胞[14],而且其生成具有时效依赖性,痛觉过敏发生后24小 时内磷酸化CREB增加,1周后磷酸化CREB恢复正常[13]。 而cAMP通路阻滞也具有时效依赖性,于深部痛觉过敏后24 小时内发生,1周后恢复[3,13]。由此,可得出结论:深部组织受 损后,cAMP通路发生时效性激活,从而引发痛觉过敏,此反 应与磷酸化CREB的基因转录激活有关。 其他蛋白激酶参与慢性广泛性疼痛与痛觉过敏也有报 道。PKC通路的激活剂巴豆油酯能够导致痛觉过敏,然而,脊 髓水平的PKC通路阻滞不能抑制重复性酸性盐注射导致的 非炎症性痛觉过敏,这一现象表明:非炎症性疼痛中,蛋白酶C通路的激活不发生在脊髓水平[15]。 2.3神经胶质细胞的作用:中枢神经系统尤其是脊髓中, 神经胶质细胞对伤害性疼痛的信息处理有关键作用[16]。神
瑞芬太尼的药理学特点及临床应用 瑞芬太尼的药理学特点及临床应用 摘要:瑞芬太尼(Remifentanil,REM)正是一种人工合成的新型超短型阿片受体激动药,主要优点就是作用效果迅速,时量半衰期较短,停药后5-10min就可以苏醒,容易控制止痛剂量,效果的可预见性强,安全可靠。我国于1999年开始用于国内患者。通过临床验证以来,REM被证实有着作用效果快、作用时间短、镇痛作用强、剂量容易控制等优点。主要用于全身麻醉诱导及维持、心脏手术麻醉、神经外科麻醉、产科麻醉等,是一种非常理想的阿片类镇痛药。目前,世界上大多数国家已经将该药正式应用于临床。 关键词:瑞芬太尼麻醉药理学临床应用 由于瑞芬太尼结构中含有独特的甲酯键,所以容易被血液和组织中的非特异性胆碱酯酶迅速水解。代谢物经由肾脏排出,不依赖肝肾功能清除。无论持续输注时间长短,输注停止后瑞芬太尼血浆浓度 3-5min就可减少50%,与血浆蛋白有70%的结合率。在人体内达到血-脑平衡仅需要1min左右,起效快,维持时间短。瑞芬太尼容易产生剂量依赖性,也可以引起呼吸抑制、恶心呕吐、骨骼肌强直、低血压等副作用,副作用强度随着剂量的增加而加强(在一定剂量范围内)。纳洛酮可以拮抗瑞芬太尼。由于瑞芬太尼的独特药代动力学,所以瑞芬太尼更适合静脉滴注。 一、瑞芬太尼药理学特点 (一)瑞芬太尼的理化性质 瑞芬太尼的分子结构如下图1,属于短效苯基哌啶衍生物芬太尼族,哌啶衍生物,结构与其他六氢吡啶衍生物类似,化学结构中有特殊的酯键,容易被血和组织中的非特异酯酶代谢。市面上的兜售的REM制剂为盐酸盐,白色冻干粉剂,内含甘氨酸,每支剂量为lmg,使用前需稀释成25mg/L或50mg/L,稀释后的溶液pH值为7.07,可以保存24h。临床应用一般为盐酸盐制剂,性状为白色或类白色冻干疏松块状物。因市售制剂中有甘氨酸做辅料,所以硬膜外麻醉不能使
舒芬太尼和瑞芬太尼的临床应用 本1. 舒芬太尼临床应用 舒芬太尼于1970年合成,是芬太尼家族一个新的衍生物。它属于选择性的u受体激动剂,其镇痛效果是吗啡的1000倍,阿芬太尼的40~50倍。由于具脂溶性高(约为芬太尼的2倍),240 min输注后时量相关半衰期(context sensitive half time,CSHF)为33.9min,而能迅速进入脑髓和其他组织,快速分布半衰期为1~2 min,清除率为12.7ml.kg-1.min-1,消除半衰期约160 min(芬太尼200 min),分布容积是1.7L.kg-1。舒芬太尼在组织中无明显蓄积现象,在脂肪和肌肉组织易清除资料来源 :医学教育网。在脑中只有微量的非特异性结合,所以易于消除,没有持续的镇静作用。因此,长时间应用舒芬太尼镇痛不会有延长药效作用时间,此现象可由CSHT来反映。 (1) 舒芬太尼在临床麻醉中的应用 舒芬尼在平衡麻醉中的应用:气管插管前3-4分钟给予舒芬尼0.25-2µg /kg可以有效预防喉镜刺激引起的血流动力学变化。可能诱发胸部肌肉僵硬或声门闭合。输注速率低于1.0µg /kg可以有效维持术后通气和镇痛;血药浓度低于0.2ng/ml时可以恢复自主呼吸;应在手术结束前45分钟停止输注;在拔管前的45分钟内不应给药. 舒芬尼用于心脏手术:舒芬尼是冠脉搭桥手术快通道麻醉的适合药物。在欧洲最常用的诱导剂量是:1.0-2.0µg /kg;维持剂量:1.0µg /kg/h,此剂量可以保证快速拔管; 资料来源 :医学教育网 舒芬尼用于颅内手术时的全静脉麻醉:丙泊酚靶控输注,维持效应部位浓度为3-5µg /ml;舒芬尼的初始单次给药剂量:0.3-0.6µg /kg;舒芬尼的输注速率:0.003-0.006µg /kg/min 直至关闭硬膜 ?手术结束后立即拔管. 资料来源 :医学教育网 舒芬尼用于ICU病人的镇痛和镇静用药量:机械通气时:0.75-1.0µg/kg/h;拔管时:0.25-0.35µg/kg/h (2)舒芬太尼在术后镇痛中的应用
1在术后早期阶段加重疼痛经历,引起机体循环、呼吸、消化、内分泌、免疫、凝血等系统发生改变。剧烈的疼痛甚至会造成精神创伤,使患者产生焦虑、恐惧、失眠等。这些改变和反应与术后并发症的发生密切相关,给预后带来不良的影响。同时,由于疼痛加重,镇痛药物的使用量增加,使镇痛药物相关的不良反应也相应增加。 2痛觉xx的定义 痛觉过敏是指外周组织损伤或炎症导致的对伤害性刺激产生过强的伤害性反应,或对非伤害性刺激产生伤害性反应。可以表现为局部的有限区域或弥散的全身性症状。典型的局部痛觉过敏 与损伤相关,通常分为两个亚型,即原发性痛觉过敏和继发性痛觉过敏。 原发性痛觉过敏表现为对来自损伤区域的刺激产生夸大的疼痛反应,是外周敏化引起的。继发性痛觉过敏表现为对损伤区域外的刺激也能产生加重的疼痛反应,是中枢敏化所致。 3术后痛觉xx的原因及机制 术后痛觉过敏可以发生于外科伤害性刺激(伤害性刺激导致的痛觉过敏),也可以发生于麻醉性镇痛药的效应引起的神经系统的致敏作用(药物引起的痛觉过敏) 4阿片类药物诱导的痛觉过敏有3个主要的机制。 ①中枢谷氨酰肽系统的活化,主要通过与阿片肽能和脑啡肽能系统稳态配对的NMDA受体发挥作用,研究表明,NMDA受体的激活在痛觉过敏的产生和维持中发挥着重要的作用 ②通过脊髓释放一种可引发痛觉过敏的物质强啡肽。强啡肽最初被认为是外源性K-阿片受体激动剂,而目前认为它在某些情况下具有内源性抗阿片作用。 ③通过位于延髓头端腹内侧的阿片敏感的“兴奋型”细胞调节脊髓下行易化。
5伤害性刺激引起的痛觉过敏与药物诱导的痛觉过敏在术后早期阶段并存,产生对伤害性感受和疼痛的高敏感性。动物研究也显 示,阿片类药物和伤害性刺激诱导的痛觉过敏有协同作用。 6xx芬太尼 瑞芬太尼是新型超短效的炒阿片受体激动剂,1996年由美国FDA批准用于临床。其起效快,消除半衰期短,具有独特的药理学特性,20世纪70年代研究者在动物实验发现阿片类药物在治疗疼痛时也引起痛觉敏感性增加,增加先前的疼痛强度,即阿片药物引起的痛觉过敏(opioid.induce hyperalgesia,OIH)。随后的临床病例和实验研究也得出类似的结果。近年来随着瑞芬太尼在临床上的广泛应用,发现持续输注瑞芬太尼后可出现痛觉过敏。oIH的产生与阿片类药物的药代动力学特点关系密切,瑞芬太尼起效迅速,镇痛作用消退也快,其产生较强的术后痛觉过敏。 二、xx芬太尼诱发痛觉xx的证据 (一)人类志愿者研究 目前对瑞芬太尼引起痛觉过敏的研究多集中在人类研究中,志愿者可排除其他干扰因素,在人类研究中广泛采用。持续输注瑞芬太尼30~90min后,可加重已有的机械性痛觉过敏,出现痛觉过敏的皮肤面积增加 1.4。 2.2倍,而且和瑞芬太尼的用量相关。Angst研究发现输注瑞芬太尼90min 后的30min内,原来存在的皮肤机械痛觉过敏区域明显扩大。Hodd等的实验表明在输注瑞芬太尼后的4h内,由辣椒辣素所造成的痛觉过敏区域也明显扩大,第二天恢复正常。对志愿者的研究结果表明瑞芬太尼输注后引起痛觉敏感性增高,使痛觉过敏区域加大,且痛觉过敏强度和输注时间及剂量相关。 (二)临床研究 Guignard等对行结肠手术病人研究中发现分别以o.1№·min。1·kg一和o.3№·min。1·kg‘1
? 综述?麻醉手术后痛觉过敏的研究进展 俞红丽 于布为 作者单位:200025 上海交通大学医学院附属瑞金医院麻醉科 手术后疼痛迄今仍然是术后疼痛管理的一个主要问题。在最近的一项包括20000例患者和800篇文献的荟萃分析中,Dolin 等[1]指出,约41%的手术患者仍旧经历了中重度急性术后疼 痛,另外24%的患者疼痛缓解得并不充分。这一结果表明,虽然临床已广泛开展了术后疼痛服务,但急性术后疼痛的控制效果并没有实质性的改善[2]。此外,手术治疗直接导致慢性疼痛的情况也越来越多,且长期预后结果并不令人满意。特别是近年来对于术后慢性疼痛的调查证明,这个问题比以往预料的更加普遍,在某些类型的手术如开胸手术、乳房切除术、截肢术等,其术后1年慢性疼痛的发生率均高于50%[324]。伤害性刺激的输入或者使用调节伤害性刺激输入的药物都可以改变神经系统的放大作用。伤害性刺激和组织损伤导致伤害性感受系统出现外周敏化和中枢敏化,从而引起痛觉过敏[5]。使用镇痛药物尤其是阿片类药物来对抗外科手术疼痛和伤害性刺激,也有可能引起术后疼痛敏感性增加/增强这种反常的矛盾现象[6]。 与手术创伤引起的“正常”疼痛相比,痛觉过敏是一种“非正常”的疼痛,它影响疼痛的传递处理过程,产生机制也更为复杂,可能对术后早期恢复带来有害的影响。首先,痛觉过敏使伤害性刺激的输入幅度增加,从而加重患者的疼痛。其次,术后疼痛加重意味着患者要经受更多的心理和生理应激,从而引起各种术后并发症和不良结果的发生。最后,神经系统在伤害性刺激持续异常致敏的作用下,其兴奋性神经元可发生可塑性改变,表现为痛觉过敏和疼痛增加,从而导致慢性疼痛的发生[3,5]。痛觉过敏的发生原因非常复杂,通常是在接受一个伤害性刺激后或(和)同时使用阿片类药物后产生的超出正常的过强的伤害性反应,对它的检测主要是基于对伤害性刺激和药物使用 前、后刺激2反应曲线的构成和比较。仅仅基于临床症状对痛觉过敏进行可靠诊断非常困难。因此,痛觉过敏的诊断和量化需要在标准化的情况下进行刺激2反应曲线的系统测定,称为定量感觉 试验(QST )。本文对术后早期伤害性刺激引起的和阿片类药物诱导的痛觉过敏的发生,临床工作中痛觉过敏的现象,以及针对术后痛觉过敏和镇痛的管理及有效治疗的现状作一综述。1 痛觉过敏的定义 痛觉过敏是指外周组织损伤或炎症导致的对伤害性刺激产生过强的伤害性反应,或对非伤害性刺激产生伤害性反应。可以表现为局部的有限区域或弥散的全身性症状。典型的局部痛觉过敏与损伤相关,通常分为两个亚型,即原发性痛觉过敏和继发性痛觉过敏。 原发性痛觉过敏表现为对来自损伤区域的刺激产生夸大的疼痛反应,是外周敏化引起的。继发性痛觉过敏表现为对损伤区域外的刺激也能产生加重的疼痛反应,是中枢敏化所致。外周敏化是初级传入纤维的变化引起的,表现为对刺激反应阈值的下降、对阈上刺激反应的增强、自主活动的增强以及感受野的扩大。而中枢敏化是伤害性刺激的输入提高了中枢神经系统疼痛传递神经元的反应,如损伤区域以外的刺激也可诱发脊髓背角疼痛反应增强。许多研究也已表明,机械刺激产生的继发性痛觉过敏发生在损伤后,它并不是由未损伤区域的初级传入纤维的敏化引起的。切口区域的自发性疼痛和原发性机械性痛觉过敏可能与临床急性疼痛更为相关。2 术后痛觉过敏的原因及机制 术后痛觉过敏可以发生于外科伤害性刺激(伤害性刺激导致的痛觉过敏),也可以发生于麻醉性镇痛药的效应引起的神经系统的致敏作用(药物引起的痛觉过敏)。两者具有相似的机制,