
注:已建计量标准,至少每年进行一次重复性试验,测得的重复性应满足检定或校准结果的测量不确定度的
压力计量标准装置的稳定性考核记录
注:若计量标准在使用中采用标称值或示值,则稳定性应小于计量标准的最大允许误差的绝对值;如加修正值使用,则应小于修正值的扩展不确定度。
压力计量标准的稳定性考核记录
重复性与再现性研究(repeatability and reproducibility) 又名:R&R研究( R&R study),量具R&R( gage R&,R),测量系统分析『measurement system analysis, MSA) ?概述 重复性与再现性研究的分析对象是由仪器或量具组成的测量系统的变异。测量系统的变异是相对于观测过程的总变异而言的。重复性与再现性研究的主要目的是使测量的变异足够小,从而确保测量结果能反映真实的过程,因为如果测量变异过大,以致掩盖了过程变异,就不可能了解到产品是否符合要求或是否应该继续设法减小过程变异。 重复性与再现性研究的主要对象是两类变异:重复性——指使用相同仪器重复读数时产生的变异;再现性——由不同操作员做同样的测量工作时产生的变异。 ?适用场合 ·当使用仪器或设备进行测量时; ·在研究过程变异或过程能力之前; ·当要在几种测量方法中选择一种时; ·当要对测量方法、程序或培训进行测评或标准化时; ·当作为一个周期性持续改进的程序,保证改进过程保持统计受控时。 ?实施步骤 计划 1确定所要研究的零件或产品、测量过程和仪器。 2确定需要抽取的样本容量和获得样本的方法。通常抽取5~10个样品,如果不能始终保持样本的一致性,就要先找到在研究过程中将样本内变异最小化的方法。 3确定研究需要多少名操作员(执行测量工作的人)以及哪几个操作员,通常是1~3人。 4确定每名操作员要进行的实验次数(重复测量),通常2~3次。 5确定校准、测量以及分析的步骤。 测量 6校准测量仪器。 7确定抽样的随机次序。先由第一名操作员按照标准的操作步骤对所有的样品进行测量,记录结果。 8随机产生另一种抽样次序。和之前一样,让第二名操作员测量全部样品。不允许操作员看其他人的结果。不断重复,直到全部的操作员对所有的样品都测量了一次,此时称为完成了一轮实验。 9重复步骤7、8的工作直到计划的试验全部完成。不能让操作员看到样本容量以及之前的结果或者其他可能会透露测量结果的任何信息。 分析和改进 10分析数据。通常使用计算机软件处理计算,最常用的方法是极差-均值法和方差分析法( ANOV A),后面会给出对这些方法的简单描述。分析的主要指标是: 重复性(设备变异EV)。反映同一名操作者使用同一测量设备重复测量同样的样品时测量结果的变异程度,通常用反映该变异程度的一个区间来表示(通常用99%),同时,也可利用标准差来反映重复性变异。 再现性(测量者变异A V)。反映由不同操作员在测量同样的样品时产生的变异,也通常用反映该变异程度的一个区间来表示(通常用99%),同时,也可利用标准差来反映再现性变异。 重复性与再现性(R&R)。它是结合上述两种变异来估算测量系统变异大小的,同样也要给出其标准差(需要注意的是:它不是重复性和再现性大小的简单加和,因为标准差不具有加和性)。 11将测量变异与整个过程的变异相比较。最简单的方法是计算R&R变异在整个过程变异
稳定性-重复性
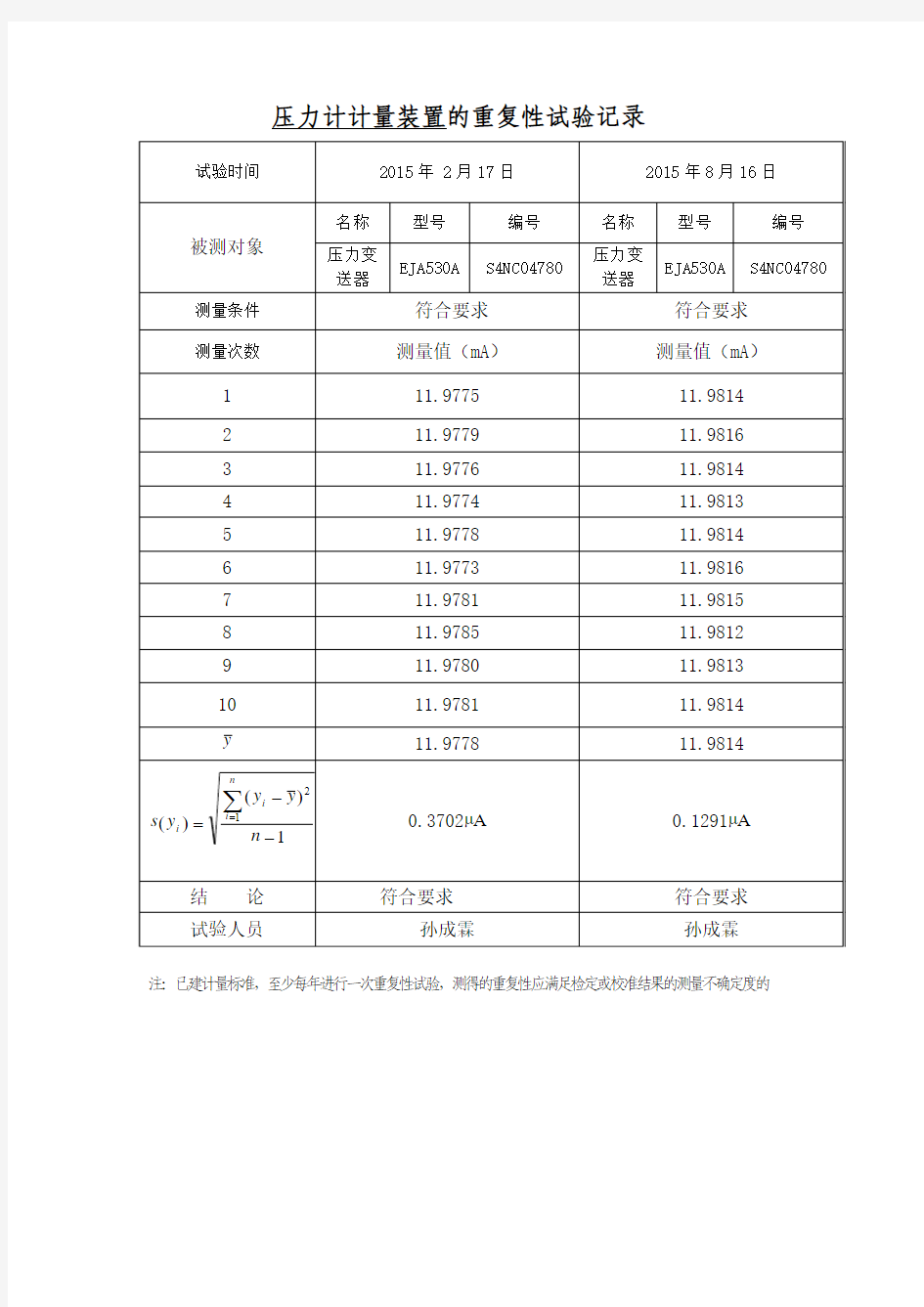
压力计计量装置的重复性试验记录 试验时间2015年 2月17日2015年8月16日 被测对象 名称型号编号名称型号编号 压力变 送器 EJA530A S4NC04780 压力变 送器 EJA530A S4NC04780 测量条件符合要求符合要求测量次数测量值(mA)测量值(mA) 1 11.9775 11.9814 2 11.9779 11.9816 3 11.9776 11.9814 4 11.9774 11.9813 5 11.9778 11.9814 6 11.9773 11.9816 7 11.9781 11.9815 8 11.9785 11.9812 9 11.9780 11.9813 10 11.9781 11.9814 y11.9778 11.9814 1) ( ) (1 2 - - =∑ = n y y y s n i i i 0.3702μA0.1291μA 结论符合要求符合要求试验人员孙成霖孙成霖 注:已建计量标准,至少每年进行一次重复性试验,测得的重复性应满足检定或校准结果的测量不确定度的
压力表计量装置的重复性试验记录 试验时间2016年 2月16日2016年8月18日 被测对象 名称型号编号名称型号编号 压力变 送器 EJA530 A S4NC04780 压力变 送器 EJA530 A S4NC04780 测量条件符合要求符合要求测量次数测量值(mA)测量值(mA) 1 11.9814 11.9813 2 11.9812 11.9817 3 11.9815 11.9816 4 11.9814 11.9815 5 11.9813 11.9816 6 11.9815 11.9817 7 11.9813 11.9815 8 11.9818 11.9815
产品稳定性考察管理规程 1.目的 建立一个产品稳定性考察管理规程,使能在产品有效期内监控已上市药品的质量,以发现药品与生产相关的稳定性问题,并确定药品能够在标示的贮存条件下,符合质量的各项要求。 2.范围 已获准上市的市售包装药品。 3.责任 QC部负责执行本规程。 4.内容 4.1 由够资格的专业技术人员制定稳定性计划,报主管部门负责人批准后执行。 4.2 由授权人担任稳定性试验的全面工作。 4.3稳定性分类 4.3.1影响因素试验 4.3.2加速试验 4.3.3长期试验 考察产品分为以下四类: A类:新产品头3批产品做长期稳定性考察;直至转正后。 B类:当影响产品质量的主要因素,如工艺改进、设备变更、改变内包装形 式、主要原辅料供应商变更的头三批产品做长期稳定性考察; C类:生产过程中遇到特殊情况,可能会影响质量稳定性的产品,如返工、或 有回收操作的批次,该批产品做长期稳定性考察。 D类:除上述A、B、C类之外的产品,长期生产的产品每年选择至少1批产品 做长期稳定性考察,除当年未生产 4.4考察原则 4.4.1 正常批量生产的最初一批产品应当列入持续稳定性考察计划,以进一步确认有效 期。 4.4.2 正常情况下,每一品种的每一规格、每一内包装形式的药品每年考察一个批次。 4.4.3 特殊情况下,重大变更或生产和包装有重大偏差的药品以及重新加工、返工或回 收的批次应列入稳定性考察,并增加考察批次,一般应不少于三批。 4.6制定稳定性计划 4.6.1质量保证部QA人员于每年年初依据本年度的生产计划制订年度稳定性试验计划, 确定本年度将进行的和可能要增加进入稳定性试验程序的品种,并于每年年终
稳定性考察方案 制定人:日期: 审核人:日期: 批准人:日期: 北京远策药业有限公司 目录 一、目的 二、范围 三、职责 四、产品介绍 五、药品稳定性考察信息表和检测方法依据 六、具体方案 1.产品批量的选择 2.考察条件、时间 3.样品测试时限的要求 七、稳定性考察报告 1.考察报告内容的要求 2.偏差处理 3.报告的时限要求 4.报告程序 5.记录管理要求 6.档案保存期限 一、目的 药品的稳定性是指原料药及其制剂保持其物理、化学、生物学和微生物学性质的能力。稳定性试验的目的是考察原料药、中间产品或制剂的性质在温度、湿度、光线等条件的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件和有效期的确定提供科学依据,以保障临床用药的安全有效。并且通过持续稳定性考察可以监测在有效期内药品的质量,并确定药品可以或预期可以在标示的贮存条件下,符合质量标准的各项要求。
二、范围 适用于公司所有成品及原液的考察。药品稳定性考察包括:加速试验和长期(持续)稳定性试验。长期(持续)稳定性考察主要针对市售包装产品,但也需兼顾待包装产品。例如,当待包装产品在完成包装前,还需要长期贮存时,应当在相应环境条件下,评估其对包装后产品稳定性的影响。此外,还应考虑到对贮存时间较长的中间产品进行考察。加速试验主要针对批量放大及上市后变更(如生产设备变更、原辅料变更、工艺调整等)时生产的产品的稳定性试验。 三、职责 质量保证部负责药品稳定性考察方案的起草、审核、实施过程的监督、数据的收集与报告的撰写; 质量控制部:负责药品稳定性考察的检验工作; 质量受权人:负责药品稳定性考察方案及报告的批准。 四、产品介绍: 将本年度需要做稳定性考察产品的信息如:产品名称、批号、规格、包装规格、考察数量、生产日期、有效期等详细信息填入《药品稳定性考察信息表》。
1计量标准的重复性、稳定性考核 一、概述 计量标准是准确度低于计量基准,用于检定或校准其他计量标准或者工作计量器具的计量器具,它处于国家量值传递(溯源)体系的中间环节,起承上启下的作用。因此,计量标准在使用前必须依照JJF1033《计量标准考核规范》的要求,进行各项技术准备,使计量标准符合规范的要求并通过考核。下面主要介绍计量标准的重复性、稳定性考核的内容。 二、计量标准的重复性考核 1.计量标准的重复性 计量标准的重复性即在相同测量条件下,重复测量同一被测量,计量标准提供相近示值的能力。计量标准的重复性通常用测量结果的分散性来定量表示,即用单次测量结果y的实验标准差s(y i)来表示。 计量标准的重复性通常是检定或校准结果的一个不确定度来源。 新建计量标准应当进行重复性试验,并提供试验的数据;已建计量标准,至少每年进行一次重复性 试验,测得的重复性应满足检定或校准结果的测量不确定度的要求。 在计量标准考核中,计量标准的重复性是指在重复性条件(这些条件包括测量程序、人员、仪器、环境等方面)下用该计量标准测量一常规的被测对象时,所得到的测量结果的一致性。为保证在尽量相同的条件下进行测量必须在尽量短的时间内完成重复性测量。 2.重复性的试验方法在重复性条件下,用计量标准对常规的被检定或被校准对象进行 结果为y i(i=1,2,…,n),则其重复性s(y i)为式中:y —n次测量结果的 算术平均值; n—重复测量次数,n应尽可能大,一般应不少于10次。 重复性试验结果也会受被测对象不稳定的影响,所以在进行计量标准的重复性试验时,选择的测量对象应为常规的被检定或被校准计量器具,而不是本身重复性和稳定性都是最佳的被检定或被校准计量器具,这样评定得到的不确定度可以用于大多数的检定或校准结果。 3?计量标准的重复性考核对于新建计量标准,只要按照要求进行重复性试验,并提供试验的重复性数据即可;对于已建计量标准, 至少每年进行一次重复性试验,如果重复性试验结果不大于新建计量标准时的重复性,则重复性符合要求;如果重复性试验结果大于新建计量标准时的重复性时,应按照新的重复性结果重新进行检定或校准结果的测量不确定度评定,并判断检定或校准结果的测量不确定度是否满足被检定或校准对象的需要。 4?《计量标准的重复性试验记录》参考格式及填写说明 (1)《计量标准的重复性试验记录》参考格式申请考核单位原则上应当按照本参考格式填写。如果本参考格式不适用,申请计量标准考核单位可 以自行设计《计量标准的重复性试验记录》格式,但是不应少于参考格式规定的内容。 《计量标准的重复性试验记录》参考格式: 的重复性试验记录 n次独立重复测量,若得到的测量 试验时间、、测量值()月日年年 月日 年 月日 年 月日 年 月日 试验条件 1 2
标题持续稳定性考察管理规程 编制记载分发记载 起草人:年月日文件编码:发布号: 审核人:年月日分发部门:复印号: 批准人:年月日 质量部发布 生效日:年月日 目的:建立持续稳定性考察管理规程,对上市后生产的药品继续进行稳定性考察和研究,监测在有效期内药品的质量,为规范此项工作而建立管理规程。 范围:主要适用于市售包装药品以及待包装产品。 主责:质量部、质量控制实验室。 释义: 关联: 正文: 1 持续稳定性考察的目的: 是在有效期内监控药品质量,以发现药品与生产相关的稳定性问题(如杂质含量或溶出度特性的变化),并确定药品能够在标示的贮存条件下,符合质量标准的各项要求。 2 持续稳定性考察对象: 主要针对市售包装药品。但也需兼顾待包装产品。还应当考虑对贮存时间较长的中间产品进行考察。 3 稳定性考察方案:每个品种需要制定考察方案,考察方案应由质量受权人批准执行。 3.1 考察方案应涵盖药品有效期; 3.2 每种规格、每个生产批量药品的考察批次数;
3.3 制定考察项目、检验方法依据及合格标准; 3.4 容器密封系统的描述; 3.5 考察周期及检验频次; 3.6 贮存条件(采用与药品标示贮存条件相对应的《中华人民共和国药典》规定的 长期稳定性试验标准条件)。 4 稳定性考察留样原则及批次数量: 4.1 产品批准上市后首次生产的前三批验证产品,对不同包装材料及包装规格的销售产品均要分别留样进行长期稳定性考察。 4.2 生产第二年起各年的产品,对生产的每种规格、每种内包装形式的药品,至少每年应当留取一批进行持续稳定性考察。 4.3 有重大变更或生产和包装有重大偏差的药品应当列入稳定性考察。改变原辅料、与药品直接接触的包装材料变更、生产工艺、主要生产设备及其他影响药品质量的主要因素变更时,应当对变更实施后生产的药品留样三批进行加速试验和长期稳定性试验。 4.4 重新加工、返工或回收的批次,也应当留样进行加速试验和长期稳定性试验。 4.5 考察样品留样数量:按照取样频次、考察项目、考察期内所需的全检量。 5 产品稳定性考察试验计划: 5.1 根据每年的生产情况,按要求填写每个品种“产品稳定性考察试验计划表”,按照计划进行稳定性试验管理。 5.2 产品稳定性考察试验计划表内容,产品名称、批号、规格、生产日期、有效期至、取样日期、检验时间、检验用量、考察目的、考察周期、考察期至。 5.3 样品提取要求: 5.3.1 样品必须按照稳定性试验计划从恒温恒湿箱和其他储存条件下按时取出,样品取样时间偏差范围:
持续稳定性考察方案 1.对各品种生产的前三批进行稳定性考察每批拟计划一定量进行 考察其余批次只做一般留样考察留样量为三次复检的全项检验量 2.考察项目:依据《中国药典》 XX版二部中《原料药与药物制剂稳定性试验指导原则》进行确定 3.考察方法: 3.1加速试验: 3.1.1按市售包装在温度40℃± 2℃、相对湿度 75%±5%的条件下放置六个月在试验期间第 1 个月、 2 个月、 3 个月、 6 个月末分别取样一次按稳定性考察要点项目进行检验 3.1.2 在上述条件下如 6 个月内供试品经检测不符合制定的质量标准则应在如下条件温度 30℃± 2℃、相对湿度 65%±5%情况下进行加速试验时间仍为六个月 3.2长期试验: 按市售包装在温度 18~26℃、相对湿度 60%±15%的条件下放置12 个月. 每 3 个月取样一次分别于 0 个月 3 个月 6 个月 9 个月 12个 月末取样按各剂型品种具体的稳定性考察要点项目进行检验12 个月后仍继续考察分别于18 个月 24 个月 36 个月(以此类推)末取样检测将结果与 0 月比较以确定药品有效期 3.3高温试验:
供试品置密封洁净容器中在60℃条件下放置 10 天于第 5 天和第10 天取样检测有关指标如供试品发生显著变化则在40℃下同法进行试验如 60℃无显著变化则不必进行40℃试验 3.4高湿试验: 试品置恒温密闭容器中于25℃相对湿度为 90%±5%条件下放置 10天在第 5 天和第 10 天取样检测检测项目应包括吸湿增重项若吸湿增 重 5%以上则应在 25℃RH75%±5%下同法进行试验;若吸湿增重 5%以 下且其他考察项目符合要求则不再进行此项试验液体可不进行高湿 试验 3.5光照试验:供试品置光照箱或其它适宜的光照容器内于照度 不< 5000Lx 的条件下放置 10 天在第 5 天和第 10 天取样检测 3.6以上为影响因素稳定性研究的一般要求根据药品的性质必要 时可以设计其他试验如酸、碱及氧化降解等 3.7检测时间的规定: 3.7.1取出时间:1个月加速绝不允许提前和推迟;两个月允许±1 天;三个月允许± 1 周;六个月允许± 2 周;一年后允许±四周 3.7.2样品取出先放在常温下一般要求一周内完成检测;温湿度 敏感的产品要及时检测 3.8恒湿条件的获得方式 恒湿条件可以通过在密闭容器如干燥器下部放置饱和盐溶液而获 得根据不同湿度要求可以选择NaCl 饱和溶液 [ 相对湿度为( 75±1)%15.5℃~60℃] 、KNO3饱和溶液 [ 相对湿度为 92.5%25℃] 、NaNO3
文件编号SMP-11-014 稳定性考察标准管理规程 版本号01 黑龙江宝庆隆生物技术有限责任公司 文件名称稳定性考察管理规程 文件编号SMP-11-014 版本号01 拷贝号 起草人起草日期年月日审核人审核日期年月日审核人审核日期年月日批准人批准日期年月日颁发部门质量管理部执行日期年月日分发部门中心化验室 1目的 为产品稳定性考察提供原则及依据,考察药品(包括原料、成品等)在温度、湿度、 光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件和有效期的确定提 供科学依据,同时通过考察建立产品的有效期;并在有效期内监控已上市药品的质量, 以发现药品与生产相关的稳定性问题,确定药品能够在标示的贮存条件下,符合质量标准的各项要求,确保产品质量。 2范围 适用于成品、原料的稳定性考察。 3责任者 中心化验室、质量管理部、质量受权人
文件编号SMP-11-014 稳定性考察标准管理规程 版本号 01 4职责 4.1 中心化验室副主任负责本标准管理规程的起草。 4.2 中心化验室主任负责本标准管理规程的审核。 4.3 质量管理部部长负责本标准管理规程的审核。 4.4 质量受权人负责本标准管理规程的批准。 5依据 《中国药典》2010 年版二部及《药品 GMP 指南》-质量控制实验室与物料系统 6内容 6.1 稳定性考察的类别 6.1.1 上市前阶段:影响因素试验、加速试验、长期试验。 6.1.2 上市后阶段:上市后持续稳定性考察(条件等同于长期稳定性试验)、承诺稳定性试验(条件等同于为加速试验和长期稳定性试验)。 6.1.3 其他稳定性试验:中间产品放置时间稳定性试验、批量放大及上市后变更(如生产设备变更,原辅料变更,工艺调整等 )稳定性试验、特殊目的稳定性试验,例如对偏差调查等的支持性试验。此类稳定性试验的条件均可参考上市前试验的条件,根据不同产品特性和稳定性试验的目的选择。 6.2 已上市阶段稳定性试验的目的 6.2.1 监控已上市药品在有效期内的质量,以发现药品与生产相关的稳定性问题(如含量、有关物质变化),并确定药品可以或预期可以在标示的贮存条件下,符合质量标准的各项 要求。考察产品上市后在生产、包装、质控、使用条件等诸多方面重大的变更对产品稳定 性的影响,考察变更后药品的稳定性趋势,以评价变更的合理性。
标准文件 qqqq药业有限责任公司 文件名称稳定性考察管理规程 起草人审核 人 批准 人 起草日期审核日 期 批准日 期 生效日期文件编 号 09SM1600-003页码1/5 分发部门QA、QC 1. 范围:适用于原料、辅料、内包材、中间产品、成品的稳定性考察试验。 2. 职责 留样管理员:负责原料、辅料、中间产品、成品的稳定性考察,对试验到期品种的稳定性进行评价,并对相关记录归档。 化验员:负责原料、辅料、中间产品、成品的检验。 QC负责人:负责对稳定性试验中出现的异常情况进行处理和总结的审核,监督、检查执行情况。 质量管理部长:对总结的审核和批准。 3. 内容 3.1. 试验前的准备 3.1.1. 计划
由QC化验员起草制订稳定性试验计划表,包括:品名、规格、实验批次、批号、考察条件、考察方式、考察项目及方法、实施部门等。稳定性试验计划表须经QC主任汇审,交质量管理部长审核、批准方可生效。 3.1.2. 包装 成品包装与销售包装一致,原辅料与实际保存包装一致或相似。中间体模拟生产周转包装,与生产保持一致或相似。 3.2. 原辅料稳定性试验 3.2.1. 观察项目:性状、鉴别、含量测定等。 3.2.2. 贮存条件:与该物料规定贮存条件相一致。 3.2.3. 贮存时间:按《留样管理规程》执行。 3.2. 4. 考察方式 编 号09SM1600-003 稳定性考察管理规程页 码 2/5 3.2. 4.1. 影响因素试验 将检品除去包装以后,平放在称量瓶或培养皿中摊成≤5mm厚的薄层,疏松样品摊成≤10mm厚薄层,在以下条件下贮存、观察、检测,考察各项指标变化情况。 高温条件下,温度分别为40℃、6 0℃2个温度水平。将供试品在60℃温度下放置10天,于第5天和第10天取样,按重点考察项目进行检测,若供试品无明显变化则不再进行40℃条件下试验;若供试品有明显变化(如含量下降5%、鉴别不明显、外观色泽变化大等),则须在40℃条件下用同样的方法进行试验。 高湿条件下,相对湿度分别为75%±5%、90%±5%2个湿度水平(温度为25℃)。将供试品置于相对湿度90%±5%湿度下(装有KNO3饱和溶液的干燥器中,用封口胶密封)放置10天,于第5天和第10天取样,按考察项目进行检测,同时准确称定试验前后供试
5[1].6计量标准的重复性及稳定性考核记录 91、8022 91、8032 91、8242 91、8052 91、8062 91、8272 91、8082 91、8092 91、80102 91、822 91、806其标准偏差:= 2、33μm注:已建计量标准,至少每年进行一次重复性试验,测得的重复性应满足检定或校准结果的测量不确定度的要求。 计量标准的稳定性考核记录参考格式检定游标量具标准组的稳定性考核记录用此套标准装置对300mm游标卡尺1 21、80点测量,编号0061,在规定的间隔时间内,进行4次等精度测量,测量数据如下: 测量时间xx年6月xx年8月xx年10月xx年12月测量次数10次10次10次10次测量值(单位:mm)11
21、801 21、801 21、8021 21、801 21、801 21、801 21、8031 21、801 21、801 21、801 21、8041 21、801 21、801 21、801 21、8051 21、801 21、801 21、801 21、8061 21、801 21、801
21、8071 21、801 21、801 21、801 21、8081 21、801 21、801 21、801 21、8091 21、801 21、801 21、801 21、80101 21、801 21、801 21、801 21、80平均值1 21、801 21、801 21、801 21、80考核人员罗琦郑义罗琦郑义最大值与最小值之差:
0mm根据上述测量数据可知,测量结果的最大值与最小值之差为1 21、80-1 21、80=0mm,其值小于本计量标准的最大允许误差的绝对值0、02mm结论: 该计量标准的稳定性符合要求。注:若计量标准在使用中采用标称值或示值,则稳定性应小于计量标准的最大允许误差的绝对值;如加修正值使用,则应小于修正值的扩展不确定度。计量标准的重复性试验记录参考格式衡器检定装置的重复性试验记录选取一台100kg台秤在装置正常工作的条件下,50kg重量等精度重复测量10次,各次测量值如下:序号 Xi (kg)U=Xi-U21 50、0 30、0 30、00092 50、0 20、0 20、00043 50、00004 50、00005 50、00006 49、97-0、0 30、00097
需要稳定性考察报告怎么打 篇一:稳定性考察范本 一、目的: 为公司新产品以及合同加工产品确定有效期和贮存运输条件提供科学依据;对公司产品以及合同加工产品进行持续稳定性考察,以监控在有效期内药品的质量;由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。 二、 适用范围:适用于公司新产品和合同加工产品的投产稳定性考察、公司产品和合同加工产品的持续稳定性考察、 由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。 三、责任: 质量保证部、质量检验部。 四、内容: 1.产品稳定性考察的一般规定 1.1产品稳定性考察分类 1.1.1为公司新产品以及合同加工产品确定有效期与贮存运输条件提供科学数据所进行的稳定性考察; 1.1.2为监控公司产品以及合同加工产品在有效期内质量所进行的持续稳定性考察;
1.1.3由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。 1.1.3.1重大变更或生产和包装有重大偏差的药品; 1.1.3.2任何采用非常规工艺重新加工、返工、或有回收操作的批次; 1.1.3.3改变主要物料供应商时所作验证的批次。 1.2产品稳定性考察样品批次的规定 1.2.1为公司新产品以及合同加工产品确定有效期与贮存运输条件提供科学数据所进行的稳定性考察,这种情况的稳定性考察需要连续试制的三批样品; 1.2.2公司新产品和合同加工产品正常批量生产的最初三批产品应列入持续稳定性考察计划,以进一步确认有效期。 1.2.3为监控公司产品以及合同加工产品在有效期内质量所进行的持续稳定性考察批次按产品不同规格每年考察一批, 除当年没有生产外。所考察批次采取随机抽取的方式; 1.2.4重大变更或生产和包装有重大偏差的药品批次; 1.2.5任何采用非常规工艺重新加工、返工、或有回收操作的批次; 1.2.6改变主要物料供应商时所作验证的批次。 1.2.7有效期短的原料药,在进行稳定性考察时应适当增加检验频次。
如何进行计量标准的重复性、稳定性考核和期间核查How to Check the Repetition,Stability of Measurement Standard 王兴东 (陕西省计量科学研究院,陕西西安710048) 摘 要:本文叙述了计量标准的测量重复性、稳定性考核和期间核查的目的,给出计量标准重复性和稳定性考核以及计量标准的期间核查的方法。同时给出考核结果的判定原则和考核时应注意的事项。 关键词:计量标准;重复性;稳定性;期间核查;方法;判定 新修订的JJ F1033-2008《计量标准考核规范》都对计量标准的重复性考核,稳定性考核和期间核查提出了要求,根据自己对这两个规范的学习和实际工作谈淡自己的理解。 1 计量标准的测量重复性考核 111 计量标准重复性测量的准备工作 (1)选择被测对象:选择被测对象一定要具有稳定的性能,并有代表性,的确能反映计量标准的实际情况,容易实现的样品。重复性测量中“被测量或被检测器具”的选取原则是在计量检定工作中,要求标准设备的不确定度尽可能小到使其对被检仪器的允许误差而言可以忽略不计,以使错判的风险减到最小。对重复性测量也是一样,应使“被测量或被检测器具”的选取对测量数据的影响尽可能地小。 (2)重复性试验的依据:对计量标准重复性试验,有规程或规范要求的一定要按要求去做重复性试验,如果没有,可参考有关技术资料进行。 (3)环境条件:重复性试验一定要在规定的环境条件下进行,环境条件如温度、相对湿度、振动、磁场等。如果环境条件无法满足要求时,对重复性试验的结果要进行修正。 (4)量值的溯源:做重复性试验时一定要注意量值的溯源,这样才能保证量值的统一、准确和可靠,如无法溯源的要进行互相比对,这样的计量标准的重复性才有意义。 (5)重复性记录:原始记录保留着做重复性试验数据和有关信息,计量标准的重复性是否满足要求都是来自原始记录,原始记录一定要真实,信息量要大,真实的反映重复性的实际情况。重复性的记录可根据JJ F1033-2008附录中的要求去设计。 112 重复性试验 (1)实验标准差:为了保证所得到的实验标准差具有可靠性,重复测量的次数在一般情况下n>10,但不得小于5次。对计量标准的重复性每年应进行一次。其结果用贝赛尔公式进行计算。被测仪器的分辩力也会对重复性测量带来影响,在不确定度评定中,当重复性引入的不确定度分量大于被测仪器的分辩力所引入的不确定度分量时,可以不考虑分辩引入的影晌。当重复性引入的不确定度分量小于被测仪器的分辩力引入的不确定度时,应该用分辩力引入的不确定度代替重复性分量,分辩力引入的不确定度分量为0129δ。计量标准的重复性计算公式为: S(Y)= ρn i=1 (Y i-Y)2 n-1 (2)合并样本标准差:对于常规的计量检定或校准,重复性测量无法满足n≥10时,为了得到实验标准差更可靠,可引用以前实验的数据,采用合并样本标准差来计算计量标准的重复性。其计算公式为: S m(Y)= ∑S(Y)2 m 113 重复性结果的判定 (1)测量重复性应不大于测量不确度评定中所采用的重复性数据。认为重复性满足要求。 (2)测量重复性应不大于测量结果的合成标准不确定度,即S(Y)5.6计量标准的重复性及稳定性考核记录
计量标准的重复性试验记录参考格式 检定游标量具标准组的重复性试验记录 选一把分度值0.02mm ,量程为(0-300)mm 的游标卡尺,在标准器组正常工作的条件下,等精度测量重复5次,各次测量值如下: 其标准偏差: S = =2.33μm 注:已建计量标准,至少每年进行一次重复性试验,测得的重复性应满足检定或校准结果的测量不确定度的要求。
计量标准的稳定性考核记录参考格式 检定游标量具标准组的稳定性考核记录用此套标准装置对300mm游标卡尺121.80点测量,编号0061,在规定的间隔时间内,进行4次等精度测量,测量数据如下: 根据上述测量数据可知,测量结果的最大值与最小值之差为121.80-121.80=0mm,其值小于本计量标准的最大允许误差的绝对值0.02mm 结论: 该计量标准的稳定性符合要求。 注:若计量标准在使用中采用标称值或示值,则稳定性应小于计量标准的最大允许误差的绝对值;如加修正值使用,则应小于修正值的扩展不确定度。
计量标准的重复性试验记录参考格式 衡器检定装置的重复性试验记录 选取一台100kg 台秤在装置正常工作的条件下,50kg 重量等精度重复测量10次,各次测量值如下: X =50kg n i 1 =∑U 2=0.0058 S=±1 ) (1 2 --∑=n X X n i i =± 9 0058.0=±0.025kg=±25g 该装置的最大重复性误差为25g 注:已建计量标准,至少每年进行一次重复性试验,测得的重复性应满足检定或校准结果的测量不确定度的要求。
计量标准的稳定性考核记录参考格式 衡器检定装置的稳定性考核记录 选取一台100kg台秤分度值为0.05kg,在装置正常工作的条件下称量50kg重量,在规定的间隔时间内,进行4次等精度测量,测量数据如下: 根据上述测量数据可知,测量结果的最大值与最小值之差为50.00-50.00=0kg,其值小于本计量标准的最大允许误差的绝对值。 结论: 该计量标准的稳定性符合要求。 注:若计量标准在使用中采用标称值或示值,则稳定性应小于计量标准的最大允许误差的绝对值;如加修正值使用,则应小于修正值的扩展不确定度。
一、目的: 为公司新产品以及合同加工产品确定有效期和贮存运输条件提供科学依据;对公司产品以及合同加工产品进行持续稳定性考察,以监控在有效期内药品的质量;由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。 二、 适用范围:适用于公司新产品和合同加工产品的投产稳定性考察、公司产品和合同加工产品的持续稳定性考察、 由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。 三、责任: 质量保证部、质量检验部。 四、内容: 1.产品稳定性考察的一般规定 1.1产品稳定性考察分类 1.1.1为公司新产品以及合同加工产品确定有效期与贮存运输条件提供科学数据所进行的稳定性考察;
1.1.2为监控公司产品以及合同加工产品在有效期内质量所进行的持续稳定性考察; 1.1.3由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。 1.1.3.1重大变更或生产和包装有重大偏差的药品; 1.1.3.2任何采用非常规工艺重新加工、返工、或有回收操作的批次; 1.1.3.3改变主要物料供应商时所作验证的批次。 1.2产品稳定性考察样品批次的规定 1.2.1为公司新产品以及合同加工产品确定有效期与贮存运输条件提供科学数据所进行的稳定性考察,这种情况的稳定性考察需要连续试制的三批样品; 1.2.2公司新产品和合同加工产品正常批量生产的最初三批产品 应列入持续稳定性考察计划,以进一步确认有效期。 1.2.3为监控公司产品以及合同加工产品在有效期内质量所进行的持续稳定性考察批次按产品不同规格每年考察一批, 除当年没有生产外。所考察批次采取随机抽取的方式; 1.2.4重大变更或生产和包装有重大偏差的药品批次;
1.目的: 在有效期内监控已上市药品质量,以发现市售包装药品与生产相关的稳定性问题(如杂质含量变化),保证按照固定验证过的生产参数制造的产品质量维持在稳定的趋势,并且经此考察可以在有效期内监控药品质量,并确定药品能够在标示的贮存条件下,符合质量标准的各项要求。 2.范围: 公司的所有市售包装药品。 3.职责: 制订每年的持续性考察计划质量部 每个产品的稳定性试验方案质量部 按计划进行考察,并做好记录,总结考察报告报质量受权人。化验室 4.程序 4.1要求 考察批次数和检验频次应当能够获得足够的数据,以供趋势分析。通常情况下,每种规程、每种内包装形式的药品,至少每年应当考察一个批次,除非当所没有生产。某些情况下,持续稳定性考察中应当额外增加批次数,如重大变更、生产和包装有重大偏差的药品应当列入稳定性考察。此外,重新加工、返工或回收的批次,也应当考虑列入考察,除非已经过验证和稳定性考察。稳定性报告必须定期更新。 4.2稳定性考察计划 质量保证部QA人员于每年年初依据本年度的生产计划制订年度稳定性试验计划,确定本年度将进行的和可能要增加进入稳定性试验程序的品种,并于每年年终对本年度公司的稳定性试验工作做出年度总结报告。 对不符合质量标准的结果或重要的异常趋势进行调查。任何已确认的不符合质量标准的结果或重大不良趋势,都应向当地药品监督管理部门报告;还应考虑是否可能对已上市药品造成影响,必要时应实施召回。 4.3稳定性考察方案 应涵盖药品有效期,至少应包括以下内容: ①每种规程、每种生产批量药品的考察年批次: 考察原因 批次 新产品正常批量生产后前三批产品 3批 为监控公司产品以及合同加工产品在有效期内质量所进行的持续稳定性考察 按产品不同品种、不同规格、不同内包装形式每年考察一批,除当年没有生产外。所考察批次采取随机抽取的方式。 重大变更或生产和包装有重大偏差的药品批次
计量标准的测量重复性考核和稳定性考核 新疆计量测试研究所马世英 JJF1033-2001《计量标准考核规范》明确提出了计量标准应进行稳定性和测量重复性考核及计量标准器在两次检定周期之间要进行运行检查或验证比对试验的要求。为此,新疆计量测试研究所近两年在组织新建计量标准的申报和已建计量标准的日常管理中,均按此要求分别进行了计量标准的测量重复性考核和稳定性考核,并对实际运作过程中遇到的有关问题进行了探讨。 一、计量标准与计量标准器 根据JJF1033-2001《计量标准考核规范》对计量标准与计量标准器在含义、法制要求、测量重复性考核、稳定性考核的方法等四个方面进行比较,如表1所示。
表1 计量标准与计量标准器的比较 二、计量标准的测量重复性考核 计量标准的测量重复性是指在重复性条件下,用该计量标准测量一稳定的被测对象时,所得到的观测值的实验标准差s(y)。重复性条件包括测量程序、人员、仪器、环境等,因此,必须在尽量短的时间内完成重复性测量。 在对计量标准进行测量重复性试验时,我们要求考核试验人员作好包括所选择的被测对象、试验依据、重复测量n次的观测数据、环境条件、试验人员等有关信息的原始记录,并把该原始记录作为《计量标准的测量重复性考核记录》的附件予以存档,使该试验具有一定的可追溯性和持续性,最后还要作出测量重复性是否符合要求的判断结论。表2是我所对原规定的《计量标准测量重复性考核记录》作了适当修改后的现用统一格式。
表2 计量标准测量重复性考核记录 为确保所得到的实验标准差s具有足够的可靠性,重复测量次数n一般情况下应满足n>10的要求,在某些情况下不可能进行如此多次的重复测量时,至少应满足n>5。
安徽丰汇生物制药有限公司文件 化的规律,为产品生产、包装、贮存、运输条件和有效期的确定提供科学依据,以保障产 品质量。 范围:本标准适用于本公司在研新药的小试、中试,首次商业生产的新产品;经批准进行的有关工艺改进;重要原辅料变更;以及产品包装材料的变更等情况下对产品质量进行的稳定性 考察。 责任:本文件由化验室负责起草,化验室主任审核,生产负责人批准,化验室负责本规程的实施。 正文: 1稳定性考察原则 研发阶段:应进行全面的稳定性试验,以得到注册所需所有数据。此数据用于证明环境因素对产品特性的影响,以确定包装、储存条件、复验周期和有效期。 已上市阶段:产品上市后,应进行适当的持续稳定性考察,监测已上市产品的稳定性。 2稳定性考察分类 a.影响因素试验 b.加速稳定性试验 c.长期稳定性试验 d.持续稳定性试验:公司根据法规的要求,同时开展中间产品放置时间稳定性试验。批量放大及 上市后变更(如生产设备变更,原辅料变更,工艺调整等)稳定性试验、以及特殊目的稳定性试验,例如对偏差调查等的支持性试验。 3. 影响因素试验 影响因素试验目的是考察制剂处方的合理性与生产工艺及包装条件,供试品用1批进行,将供试品脱去外包装,置适宜的开口容器中进行高温试验、高湿度试验、强光照射试验。 3.1. 高温试验 供试品置密封洁净容器中,在60℃条件下放置10天,于第5天和第10天取样,按稳定性重点考察项目进行检测。如供试品发生显著变化,则在40℃下同法进行试验。如60℃无显著变化,则不必进行40℃试验。 3.2.高湿试验 供试品置恒温密闭容器中,于25℃,相对湿度为90%±5%条件下放置10天,在第5天和第10天
一二三四五测量结果的重复性、复现性与测量器具的稳定性三者之间的区别 测量结果的重复性、测量结果的复现性、测量器具的稳定性是因概念和方法上的相似性,容易造成混淆,本文介绍三者在实际应用中的区别。 对测量时间要求的区别 表征测量结果的重复性,要求在重复条件下短时间内重复测量;表征测量器具的稳定性,则一般需要较长时间间隔,或者直接用计量特性变化到某个规定的量所经过的时间来表征;表征测量结果的复现性则通常按测量时间是否变化分为两种情况,一种是测量时间不变,其它条件变化;一种是测量时间变化,其它测量条件变化。 对测量过程控制要求的区别 表征测量结果的重复性要求测量过程中,相同条件而且连续测量;表征测量结果的复现性通常变化一种测量条件,其它测量条件不得改变;表征测量器具的稳定性,从概念上理解,是除测量时间间隔要求外,其它测量条件是不应改变的。 定量表示方式的区别 测量结果重复性,只有一组测量结果,用这组测量结果的实验标准偏差来表征测量结果的重复性,称为组内标准偏差。测量结果复现性,则根据变化条件的不同有着数组测量结果,每一组要表示出变化的测量条件是什么,而且通常要对测量结果进行修正,每一组测量结果对应一个组间标准偏差。测量器具稳定,一种是用计量特性变化到规定的量所需时间表示,一种是用规定时间后计量特性变化的量表示。 应用范围大小的区别 测量器具稳定性,只能用来表征测量器具的计量特性;测量结果重复性,既可用来检验测量器具的计量特性,也可检验被测量的变化情况(同一被测量不等于被测量一点都不改变),还可以在已知被测量变化程度的情况下,检验测量人员的测量技能;同时还可以检验有计算机软件控制测量过程的测量器具,其软件性能是否稳定。 在计量工作中作用的区别 在计量检定和校准工作中,首先要明确测量的目的,是检验测量器具的计量特性,还是针对其他测量条件,如测量原理、测量程序、测量方法、测量人员技能、环境温湿度等的不同对测量结果的影
13.稳定性实验 在这里你会找到以下问题的答案: 为什么需要进行稳定性试验? 存在什么样的稳定性试验? 运输条件是如何确定的? 怎样的程序和特殊要求是需要特别加以考虑的(指南)? 文件的要求是什么? 如何降低成本,以及在哪些领域能降低成本? 数据应该如何评估(推测)? 如何处理稳定性试验的超标及超出趋势结果? 10.5定义 药品的稳定性是指原料药及其制剂保持其物理、化学、生物学和微生物学性质的能力。稳定型试验的目的是考察原料药、中间产品或制剂的性质在温度、湿度、光线等条件的影响下随时间变化的规律,为药品的生产、包装、贮存、科学依据,以保障临床用药的安全有效。。并且通过持续稳定性考察可以在有效期内监控药品质量,并确定药品可以或预期可以在标示的贮存条件下,符合质量标准的各项要求。 10.6应用范围 稳定性研究是药品质量控制研究的主要内容之一,与药品质量研究和质量标准的建立紧密相关。其具有阶段性特点,贯穿原料药(API),制剂产品及中间产物的药品研究与开发的全过程,一般始于药品的临床前研究,在药品临床研究期间和上市后还应继续进行稳定性研究。 10.7原则 研发阶段:应进行全面的稳定性实验,以得到注册所需所有数据。此数据用于证明环境因素对产品特性的影响,以确定包装、储存条件、复验周期(API而言)和有效期。 已上市阶段:产品上市后,应进行适当的持续稳定性考察,监控已上市药品的稳定性,以发现市售包装药品与生产相关的任何稳定性问题(如杂质含量或溶出度特性的变化);也用于考察产品上市后因变更对产品稳定性的影响。 10.8稳定性分类 按照中国药典2010版及法规要求,我国的稳定性研究可以分为以下几类: 影响因素实验 加速稳定性实验 长期稳定性实验 持续稳定性实验 各公司根据需求及法规规定,还可以进行中间产品放置时间稳定性实验,批量放大及上市后变更(如生产设备变更,原辅料变更,工艺调整等)稳定性实验以及特殊目的稳定性实验,例如对偏差调查等的支持性实验。 10.9要点 10.9.1基本要求(参考中国药典2010) 稳定性试验应遵循具体问题具体分析的基本原则,其设计应根据不同的研究目的,结合原料药的理化性剂型的特点和具体的处方及工艺条件进行。一般性要求如下: a. 影响因素实验用1批原料药或1批制剂进行。加速实验和长期稳定性试验用3批供试品进行。 b. 原料药供试品应是一定规模生产的。供试品量相当于制剂稳定性试验所要求的批量,原料药合成工艺路线、方法、步骤应与大生产一致。药物制剂供试品应是放大试验的产品,