标准溶液的配制与标定PPT
- 格式:ppt
- 大小:608.00 KB
- 文档页数:14


EDTA 溶液的配制和标定(原理)EDTA 标准溶液的配制和标定一、实验目的1.学习 EDTA 标准溶液的配制和标定方法2.掌握络合滴定的原理,了解络合滴定的特点3.熟悉钙指示剂或二甲酚橙指示剂的使用及其终点的变化二、实验内容1. 0.02mol·L-1EDTA溶液的配制;2.以 CaCO3 和 ZnO 为基准物标定EDTA 溶液三、实验仪器、设备及材料1.仪器酸式滴定管(50.00mL);分析天平,台秤,量筒,大小烧瓶(500mL, 250mL),锥形瓶250mL )等2.试剂乙二胺四乙酸二钠,CaCO3,氨水(1:1 ),镁溶液(溶解 1 克MgSO4·7H2O于水中,稀释至200mL),NaOH 溶液( 10% 溶液),钙指示剂(固体指示剂),二甲酚橙指示剂( 0.2% 水溶液)四、实验原理乙二胺四乙酸(简称EDTA ,常用 H4Y 表示)难溶于水,常温下其溶解度为0.2g·L-1 ,在分析中不适用,通常使用其二钠盐配制标准溶液。
乙二胺四乙酸二钠盐的溶解度为120g·L-1,可配成0.3mol·L-1以上的溶液,其水溶液 pH=4.8 ,通常采用间接法配制标准溶液。
标定 EDTA 溶液常用的基准物有Zn 、ZnO 、CaCO3 、 Bi 、Cu 、MgSO4·7H2O、Hg、Ni、Pb等。
通常选用其中与被测组分相同的物质作基准物,这样滴定条件较一致。
EDTA 溶液若用于测定石灰石或白云石中CaO 、MgO 的含量,则宜用 CaCO3 为基准物。
首先可加 HCl 溶液与之作用,其反应如下:CaCO3+2HCl═ CaCl2+H2O+CO2↑然后把溶液转移到容量瓶中并稀释,制成钙标准溶液。
吸取一定量钙标准溶液,调节酸度至pH≥12 ,用钙指示剂作指示剂以EDTA 滴定至溶液从酒红色变为纯蓝色,即为终点,其变色原理如下:钙指示剂(常以H2Ind 表示)在溶液中按下式电离:H3Ind ═ 2H++HInd2 -在pH≥12 溶液中,HInd2- 与 Ca2+ 离子形成比较稳定的络离子,反应如下:HInd2- +Ca2+═ CaInd -+H+纯蓝色酒红色所以在钙标准溶液中加入钙指示剂,溶液呈酒红色,当用EDTA 溶液滴定时,由于E DTA 与 Ca2+ 离子形成C aInd- 络离子更稳定的络离子,因此在滴定终点附近,CaInd- 络离子不断转化为较稳定的CaY2- 络离子,而钙指示剂则被游离了出来,其反应可表示如下:CaInd-+H2Y2- ═ CaY2-+ HInd2-+H2O由于 CaY2- 离子无色,所以到达终点时溶液由酒红色变成纯蓝色。



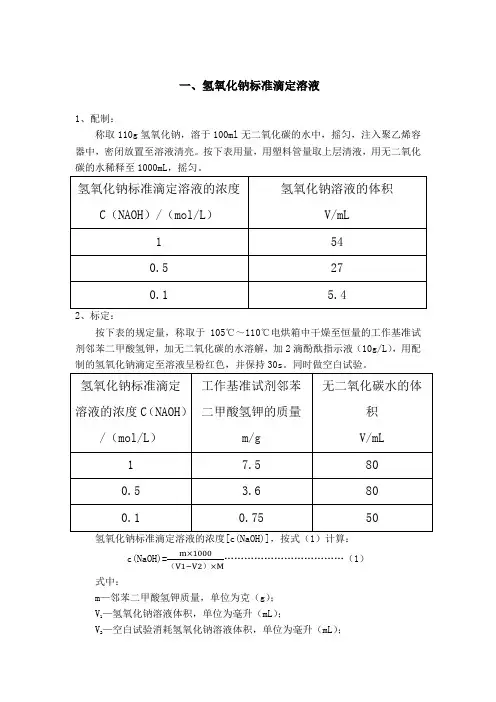
一、氢氧化钠标准滴定溶液1、配制:称取110g氢氧化钠,溶于100ml无二氧化碳的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
按下表用量,用塑料管量取上层清液,用无二氧化碳的水稀释至1000mL,摇匀。
2、标定:按下表的规定量,称取于105℃~110℃电烘箱中干燥至恒量的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示液(10g/L),用配制的氢氧化钠滴定至溶液呈粉红色,并保持30s。
同时做空白试验。
氢氧化钠标准滴定溶液的浓度[c(NaOH)],按式(1)计算:c(NaOH)= (1)()式中:m—邻苯二甲酸氢钾质量,单位为克(g);—氢氧化钠溶液体积,单位为毫升(mL);V1—空白试验消耗氢氧化钠溶液体积,单位为毫升(mL);V2M—邻苯二甲酸氢钾的摩尔质量,单位为克每摩尔(g/mol)[M(KHC8H4O4)=204.22]二、盐酸标准滴定溶液1、配制:按下表规定量,量取盐酸,注入1000mL水中,摇匀。
2、标定按下表规定量,称取于270℃~300℃高温炉中灼烧至恒量的工作基准试剂无水碳酸钠,溶于50mL水中,加10滴溴甲酚绿-甲基红指示液,用配制的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,加盖具钠石灰管的橡胶塞,冷却,继续滴定至溶液再呈暗红色。
同时做空白试验。
盐酸标准滴定溶液的浓度c[HCl],按式(2)计算:c(HCl)=() (2)式中:m—无水碳酸钠质量,单位为克(g);V1—盐酸溶液体积,单位为毫升(mL);V2—空白试验消耗盐酸溶液体积,单位为毫升(mL);M—无水碳酸钠的摩尔质量,单位为克每摩尔(g/mol)[M(1/2Na2CO3)=52.994]三、硫酸标准滴定溶液1、配制:按下表规定量,量取硫酸,缓缓注入1000mL水中,冷却,摇匀。
2、标定按下表规定量,称取于270℃~300℃高温炉中灼烧至恒量的工作基准试剂无水碳酸钠,溶于50mL水中,加10滴溴甲酚绿-甲基红指示液,用配制的硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,加盖具钠石灰管的橡胶塞,冷却,继续滴定至溶液再呈暗红色。

标准溶液的配制与标定一、硫代硫酸钠标准溶液1、称取30;60;120;……克硫代硫酸钠溶解于水中,稀释至10ml,加5ml三氯甲烷,1克无水碳酸钠,摇匀备用。
2、称取纯铜(电解99.99%)1.0000克于烧杯中,加10ml(1+1)硝酸,微热溶解后,加5ml硫酸(1+1),加热至冒白烟,(加盖表皿)。
冷却、次洗,加水约100ml,加热溶解,冷却。
移入1000ml容量瓶中,定容。
摇匀备用。
(此溶液含铜为1毫克/毫升)3、吸取纯铜溶液20.00或25.00ml于烧杯中,加氨水(1+1)中和并过量2滴,溶液显纯蓝色,加醋酸变成醋酸酸性,过量1ml,溶液显浅蓝色。
加碘化钾2克,摇匀后,用硫代硫酸钠标准液滴至浅黄色,加5ml淀粉溶液(0.5%)以硫代硫酸钠标准液滴至微蓝,加硫氢酸钾0.1克,用硫代硫酸钠标准液滴至蓝色消失。
4、计算:T硫代硫酸钠铜=消耗体积毫升克或/001.02520二、碘标准溶液1、称取纯碘25克于杯中,加少许水,加120克碘化钾,再加少许水,摇动溶解,于10升容量瓶中定容,此溶液对锡的滴定度约在0.0012克/毫升2、准称纯锡(99.99%)1.0000克于杯中,加50ml盐酸(1+1)水浴或低温加热溶解(时间会很长,可加双氧水少许会加快溶解速度)。
冷却,移入1000ml 容量瓶中,加80ml浓盐酸,然后用水定容。
溶液酸度保持在10%左右。
此溶液含锡为0.001克/毫升,也相当于1豪克/毫升。
3、吸取25.00或20.00ml纯锡溶液于500ml锥形瓶中,加30ml盐酸,加45或50ml水,加2克铝片(分成三小块,不可太碎),剧烈反应结束后,加盖格克尔漏斗(内装饱和碳酸氢钠溶液),加热至溶液澄清,冒均匀大气泡。
取下,冷却,随即补加饱和碳酸氢钠溶液。
冷却到室温,取下格克尔漏斗,立即加入5ml淀粉溶液,立即用碘标准溶液滴定稳定蓝色出现(30秒内不褪色)。
三、溴酸钾标准溶液1、称取1.4-1.5克溴酸钾加7.4-7.5克溴化钾,少许水溶液。


化验室常用药品的配制和标定方法一、氢氧化钠标准溶液的配制和标定..................... ... (4)二、盐酸标准溶液的配制和标定........................... (5)三、硫酸标准溶液的配制和标定.............................. (6)四、硝酸银标准溶液的配制和标定........................ (7)五、 碳酸钠标准溶液的配制和标定..................... ... (7)六、 高锰酸钾标准溶液的配制和标定..................... (8)七、 氯化钠标准溶液的配制和标定........................... (9)八、 硫代硫酸钠标准溶液的配制和标定............ ...... (10)九、 硫酸亚铁铵标准溶液的配制和标定.................. (10)十、 乙二胺四乙酸二钠标准溶液的配制和标定...... (11)十一、 常用洗涤液的配制和使用方法..................... (13)十二、 标准溶液的允许误差范围、保存、有效期 (13)一、氢氧化钠标准溶液的配制和标定(依据国标GB/T5009.1-2003)C(NaOH)= 1mol/LC(NaOH)= 0.5mol/LC(NaOH)= 0.1mol/L(一)氢氧化钠标准溶液的配制:称取120gNaOH,溶于100mL无CO2的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
用塑料管吸取下列规定体积的上层清液,注入用无CO2的水稀释至1000mL,摇匀。
C(NaOH),mol/L NaOH饱和溶液,mL1560.5 280.1 5.6(二)氢氧化钠标准溶液的标定:1.测定方法:称取下列规定量的、于105—110。
C电烘箱烘至恒重的工作基准试剂邻苯二甲酸氢钾,称准至0.0001 g,溶于下列规定体积的无CO2的水中,加2滴酚酞指示液(10 g/L),用配制好的NaOH溶液滴定至溶液呈粉红色并保持30S。

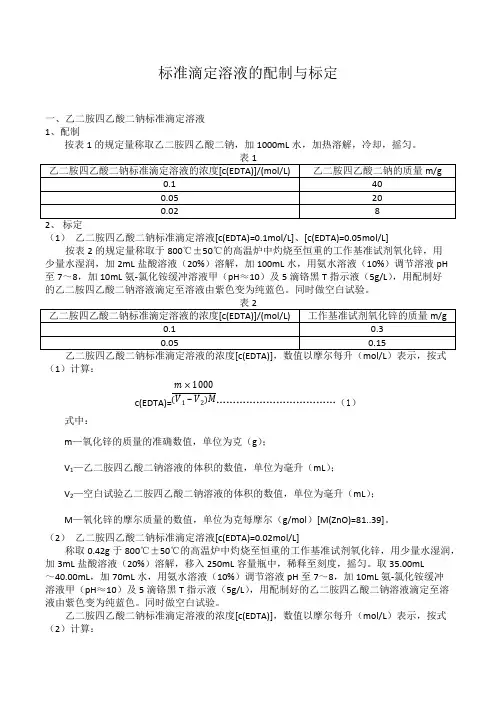
标准滴定溶液的配制与标定一、乙二胺四乙酸二钠标准滴定溶液1、配制按表1的规定量称取乙二胺四乙酸二钠,加1000mL 水,加热溶解,冷却,摇匀。
表1乙二胺四乙酸二钠标准滴定溶液的浓度[c(EDTA)]/(mol/L)乙二胺四乙酸二钠的质量m/g0.1400.05200.0282、标定(1)乙二胺四乙酸二钠标准滴定溶液[c(EDTA)=0.1mol/L]、[c(EDTA)=0.05mol/L]按表2的规定量称取于800℃±50℃的高温炉中灼烧至恒重的工作基准试剂氧化锌,用少量水湿润,加2mL 盐酸溶液(20%)溶解,加100mL 水,用氨水溶液(10%)调节溶液pH 至7~8,加10mL 氨-氯化铵缓冲溶液甲(pH ≈10)及5滴铬黑T 指示液(5g/L ),用配制好的乙二胺四乙酸二钠溶液滴定至溶液由紫色变为纯蓝色。
同时做空白试验。
表2乙二胺四乙酸二钠标准滴定溶液的浓度[c(EDTA)]/(mol/L)工作基准试剂氧化锌的质量m/g0.10.30.050.15乙二胺四乙酸二钠标准滴定溶液的浓度[c(EDTA)],数值以摩尔每升(mol/L )表示,按式(1)计算:c(EDTA)= (1)m ×1000(V 1‒V 2)M 式中:m —氧化锌的质量的准确数值,单位为克(g );V 1—乙二胺四乙酸二钠溶液的体积的数值,单位为毫升(mL );V 2—空白试验乙二胺四乙酸二钠溶液的体积的数值,单位为毫升(mL );M —氧化锌的摩尔质量的数值,单位为克每摩尔(g/mol )[M(ZnO)=81..39]。
(2) 乙二胺四乙酸二钠标准滴定溶液[c(EDTA)=0.02mol/L]称取0.42g 于800℃±50℃的高温炉中灼烧至恒重的工作基准试剂氧化锌,用少量水湿润,加3mL 盐酸溶液(20%)溶解,移入250mL 容量瓶中,稀释至刻度,摇匀。
取35.00mL ~40.00mL ,加70mL 水,用氨水溶液(10%)调节溶液pH 至7~8,加10mL 氨-氯化铵缓冲溶液甲(pH ≈10)及5滴铬黑T 指示液(5g/L ),用配制好的乙二胺四乙酸二钠溶液滴定至溶液由紫色变为纯蓝色。