高三常见气体制备-吸收装置
- 格式:pdf
- 大小:1.64 MB
- 文档页数:11


高中化学:常见气体的实验室制备1.掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
(高频)2.能绘制和识别典型的实验仪器装置图。
(高频)气体的实验室制法1.O2的实验室制法2.CO2的实验室制法3.H2的实验室制法4.NH3的实验室制法5.Cl2的实验室制法6.SO2的实验室制法气体的收集方法收集方法排水法向上排空气法向下排空气法收集原理收集的气体不与水反应且难溶于水收集的气体密度比空气大,与空气密度相差较大,且不与空气中的成分发生反应收集的气体密度比空气小,与空气密度相差较大,且不与空气中的成分发生反应收集装置适用的气体H2、O2、NO、CH4Cl2、CO2、NO2、SO2H2、NH31.易误诊断(正确的打“√”,错误的打“×”)。
(1)Cl2收集可用排饱和NaCl溶液方法不能用排水法()(2)CO2、H2的制备可以选用相同的发生装置()(3)Cl2、SO2、NH3均可用NaOH溶液吸收尾气()(4)除去CO2中的HCl可以将混合气通入饱和的Na2CO3溶液中()(5)Cl2、SO2、CO2、NH3均可用浓H2SO4作干燥剂()(6)Cl2、SO2的验满均可用湿润的品红试纸()【答案】(1)√(2)√(3)×(4)×(5)×(6)√2.在实验室中制取H2、CO2、NH3、NO、NO2、SO2、Cl2、O2是否均可以用如图所示装置来制取?答:_____________________________________________________________________ ___。
【答案】可以。
因为制取上述八种气体均可用固体与液体,且不需要加热的反应来制取3.据下图所示的实验装置回答问题:(1)实验室用高锰酸钾制取比较干燥的氧气应选用的发生装置是________,收集装置为________。
(2)实验室用双氧水制取并收集较纯的氧气时应选用的发生装置是________,收集装置为________。


2025届高考复习之常见气体和金属的制备-2019人教版一、气体制备1.Cl2制备原理:实验室加热:4HCl(浓)+MnO2MnCl2+2H2O+Cl2↑实验室不加热:16HCl(浓)+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O注:实验室还可通过浓盐酸与KClO3的反应、浓盐酸与K2Cr2O7的反应、PbO2和浓盐酸的反应制备Cl2。
工业制Cl2:2NaCl+2H2O 2NaOH+Cl2↑+H2↑考点:①涉及HCl的反应往往要除杂。
②两处的“浓”含义不一样,MnO2与稀HCl不反应,MnO4-与Cl-任何情况都反应,用浓溶液是为了加快V。
典型例题1.某学习小组利用下图装置制备84消毒液。
下列说法正确的是A .湿润的蓝色石蕊试纸褪色,说明2Cl 有漂白性B .Ⅱ中溶液出现浑浊,说明2Cl 降低了NaCl 的溶解度C .若无装置Ⅱ,制取的84消毒液中NaClO 的纯度下降D .该装置条件下,若用2MnO 代替4KMnO 也可制取84消毒液 2.在实验室采取如图装置和下列各组试剂,能使纸蝴蝶只变色不褪色的是 选项 液体A+C 固体BA稀硝酸+紫色石蕊溶液CuB 浓盐酸+紫色石蕊溶液4KMnOC 稀盐酸+品红溶液 FeSD 醋酸+酚酞溶液3CaCOA .AB .BC .CD .D2.SO2制备原理:实验室加热:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O实验室不加热: Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O考点:①SO2有四性:漂白性,还原性,氧化性,酸性。
检验酸性:把气体通到氢氧化钠的酚酞溶液中,会褪色;检验漂白性:把气体通到品红溶液中,会褪色,加热会恢复红色,这是可逆型漂白。
检验还原性:把气体通到酸性高锰酸钾溶液或溴水中,均会褪色。
(通到液溴中不反应)检验氧化性:通到硫化氢的水溶液中会看到黄色浑浊。
②SO2能漂白品红和有色布条的漂白性可逆,加热可恢复颜色。
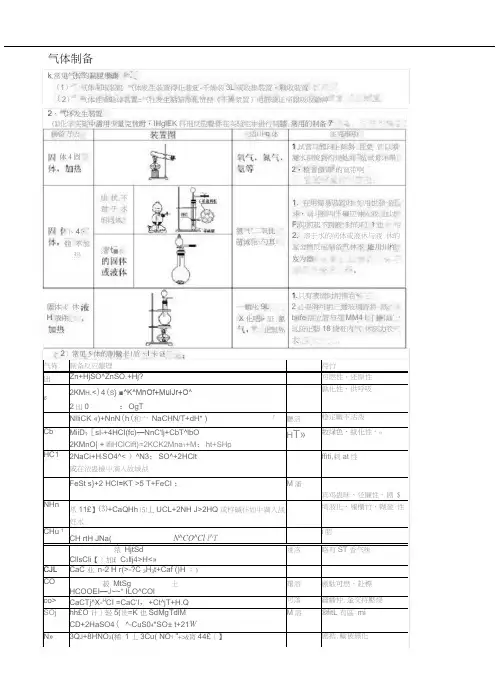
制备方法 适川q 休注克事项 氯气"二氧比 苗诫化:勺耳快状不 君于水 的同体灌t ■水固体( 休H 液件卜4•腹 不加热休4固1.只有液怵时用怫右*2必耍时可用三通玻璃晋将 蒸t»ife 版立管与芬MM4 I. 门柯通’以防止藝18烧粧内气 休压力衣大.軌叱9L 二 X 化吧・証 氯化氢% 1试营口醴向卜倾斜.且免 管口障凝水倒流到灼烧处而 览试骨洋舉.2•检音饋胃'的寬带啊「1. 在用简易裝置时.如用世颈 蹈斗•溺斗颈叫卜礙应伸入液 血以F,仰则起不到液:封的门 1也2. 溶于水的同体或液休与液 休的渥舍物反应制备气林不 能川川杵岌为器气体制备k 常见气悴的制脱歩骤(1) 气体制取装氈 气体发生装置待化装迓-千燥装3L 或收集裝置・戰收裝置(2)气体性质验诽裳置=气牡发生粘笳净化赞琵《干燥漿置)电筋验证帰跟吸收爺艸2、气坏发生装置⑴化学实鲨中需用少量完怵时・IHglEK 料刑反应聲件在实验宅中进行制牆.常用的制备7气佈制备反应龈理待竹出Zn+HjSO^ZnSO.+Hj?可燃性、还原性62KM H .<)4(S } ■^K^MnOf+MulJr+O^2出0:OgT孰化性、供呼吸NIliCK «)+NnN (h (和亠 NaCHN/T+dH* )「 廳涪稳定載不活泼 CbMiiD ?[sl-+4HCI(fc)—NnC'lj+CbT^lbO2KMnO| + lfiHClCift)=2KCK2Mna 1+M :ht+SHpH T»数绿色、紋化性、«HC1 2NaCi+H :SO4^< )^N3;SO^+2HClt或在浓蛊檢屮滴入故城战ffiti,剌at 性FeSt s}+2 HCI =KT >5 T+FeCI ;M 瀋宾鸡蛊昧、还廉性、剧 $NHn 爪11£】⑶+CaQHh ⑸丄UCL+2NH J>2HQ 或杵碱仆如屮満入战妊水埼液化、斶櫃竹,糊激 性CHu 1CH rtH JNa( N^CO^Cl l^Ti 朋1浓 HjtSdCllsCli 【]加£ C 3llj4>H<»难洛略有ST 香气味CJL CaC 业 n-2 H r(>-?C 3H 3t+Caf ()H ;)CO 菽 MtSg土HCOOEI —J ~~* ILO^COl曙溶 剧駄可燃、赴標 co> CaCTj^X-H CI =CaC'l ,+Ct^jT+H.Q 可落疆幡忡.金交持壓烧SOj hh£O 计]轻5(诜=K 也SdMgTdlM CD+2HaSO4( ^-CuS04*SO± t+21W M 溶®fitL 有區 miN»3Q J +8HNO 3(稀 1 丄3Cu( NO ? ”+>&肓44£〔】剧抵.輸被無化,〉常见5体的制儆卡|质、卡谜•验室制备的气体常常幣有恢券和水汽.仃时需要祎化和I•燥.酸雾“川水或物质的水溶液除去・k ;:・计I质选用浓硫酸.无水氯化纵碱石灰等吸收水汽。

第3课时NH3及常见气体的制备方法[核心素养发展目标] 1.掌握实验室制取NH3的方法。
2.掌握实验室制取常见气体的原理、装置、收集、净化方法及制备方法的比较。
一、氨的实验室制法1.氨的实验室制法制备原理实验装置收集NH3极易溶于水,可以用________________________收集验满把湿润的红色石蕊试纸置于试管口,试纸变____________;或将蘸有浓盐酸的玻璃棒置于试管口,有______________产生思考(1)此装置存在的弊端是什么?如何进行改进?________________________________________________________________________ (2)收集NH3时,试管口处为什么加一团棉花?________________________________________________________________________ 2.氨的简易制法方法及装置原理及化学方程式氨水具有________和______,受热易分解。
化学方程式为____________________________NaOH固体具有吸水性,溶于水放出大量的热,促使氨水分解。
CaO与水反应,使溶剂(水)减少;反应放热,促使氨水分解。
化学方程式为____________________________________1.判断正误(1)实验室中可以利用加热NH4Cl分解的方法制取NH3()(2)由于氨极易溶于水,所以不能用排水法收集氨,只能用向下排空气法收集()(3)氨不能用浓硫酸进行干燥,但可以用无水CaCl2干燥()(4)为加快产生NH3的速率,实验室中可以用NaOH和NH4Cl反应制NH3()(5)由于氨极易溶于水,所以多余的氨可以用导管直接插入水中进行吸收() 2.(2023·江苏盐城高一联考)下列装置用于实验室中制取干燥氨气的实验,其中能达到实验目的的是()A.用装置甲制备氨气B.用装置乙除去氨气中的少量水C.用装置丙收集氨气D.用装置丁吸收多余的氨气(1)制氨气所用的铵盐不能用NH4NO3、NH4HCO3、(NH4)2CO3等代替,NH4NO3加热时爆炸,而NH4HCO3、(NH4)2CO3极易分解产生CO2气体使制得的NH3不纯。


中学化学专题讲座气体的试验室制备、净化和收集1.气体制备试验的基本过程(1)气体制备试验装置一般包含以下几部分发生装置―→净扮装置―→干燥装置―→尾气处理装置 (2)气体制备的一般试验操作步骤①组装(从下到上,从左到右);②检验装置的气密性;③加入药品;④排尽装置内的空气;⑤验纯;⑥反应;⑦拆除装置。
2.气体发生装置依据制备气体所需的反应物状态和反应条件,可将制备气体的发生装置分为三类: (1)固体+固体――→△气体 发生装置:制备气体:O 2、NH 3、CH 4等留意事项:①试管口应稍向下倾斜,以防止产生的水蒸气在试管口冷凝后倒流,而使试管炸裂。
②铁夹应夹在距试管口1/3处。
③固体药品应平铺在试管底部。
④胶塞上的导管伸入试管内不能过长,否则会影响气体导出。
⑤如用排水集气法收集气体,当停止制气时,应先从水槽中把导管撤出,然后再撤走酒精灯,防止水倒吸。
(2)固体+液体或液体+液体――→△气体 发生装置:(a) (b) (c) 制备气体:Cl 2、C 2H 4等留意事项:①烧瓶应固定在铁架台上。
②先把固体药品放入烧瓶中,再缓缓加入液体。
③分液漏斗应盖上盖,留意盖上的凹槽对准分液漏斗颈部的小孔。
④对烧瓶加热时要垫上石棉网。
⑤液体+液体――→△气体时要加沸石,防止暴沸,如用(b)装置制取乙烯时需加碎瓷片。
⑥(c)装置中导管的作用是平衡气压,便于分液漏斗中的液体顺当滴下。
(3)固体+液体(不加热)―→气体发生装置:制备气体:H2、CO2、NO2、SO2、NO等留意事项:①块状固体及液体的混合物在常温下反应制备气体,可用启普发生器制备,当制取气体的量不多时,也可采纳简易装置。
②简易装置中长颈漏斗的下口应伸入液面以下,否则起不到液封作用而无法运用。
③加入块状固体药品的大小要相宜。
④加入液体的量要适当。
⑤最初运用时应待容器内原有的空气排净后,再收集气体。
⑥在导管口点燃氢气或其他可燃性气体时,必需先检验纯度。

【高考化学】11个题型突破高考化学实验题(解析版) 题型04 常见气体的制备原理与装置选用在近年高考中,常考查常见气体如CO 2、SO 2、NO 、Cl 2等的制备原理与装置的选用问题,多为装置+表格型形式,让考生判断选项中试剂能否用来制备对应气体(利用题给装置),涉及气体的制备原理、净化和尾气处理等环节。
有时候也会以题干中要制备的一种气体展开考查。
1.(2023·北京卷)完成下述实验,装置或试剂不正确的是A .实验室制2ClB .实验室收集24C HC .验证3NH 易溶于水且溶液呈碱性D .除去2CO 中混有的少量HCl 【答案】D【解析】MnO 2固体加热条件下将HCl 氧化为Cl 2,固液加热的反应该装置可用于制备Cl 2,A 项正确;C 2H 4不溶于水,可选择排水收集,B 项正确;挤压胶头滴管,水进入烧瓶将NH 3溶解,烧瓶中气体大量减少压强急剧降低打开活塞水迅速被压入烧瓶中形成红色喷泉,红色喷泉证明NH 3与水形成碱性物质,C 项正确;Na 2CO 3与HCl 、CO 2发生反应,不能达到除杂的目的,应该选用饱和NaHCO 3溶液,D 项错误。
2.(2022·山东卷)某同学按图示装置进行实验,欲使瓶中少量固体粉末最终消失并得到澄清溶液。
下列物质组合不符合要求的是【答案】A【解析】通入CO 2气体依次发生反应CO 2+Na 2CO 3+H 2O=2NaHCO 3、CaCO 3+H 2O+CO 2=Ca(HCO 3)2,由于在相同温度下NaHCO 3的溶解度小于Na 2CO 3,最终瓶中仍有白色晶体析出,不会得到澄清溶液,A 项正确;通入Cl 2,发生反应Cl2+2FeCl 2=2FeCl 3、2FeCl 3+Fe=3FeCl 2,最终Fe 消失得到澄清溶液,B 项错误;通入HCl ,在酸性条件下会表现强氧化性,发生离子反应:3Cu+8H ++2=3Cu 2++2NO↑+4H 2O ,最终Cu 消失得到澄清溶液,C 项错误;AgCl 在水中存在溶解平衡AgCl(s)⇌Ag +(aq)+Cl -(aq),通入NH 3后,Ag +与NH 3结合成[Ag(NH 3)2]+,使溶解平衡正向移动,最终AgCl 消失得到澄清溶液,D 项错误。

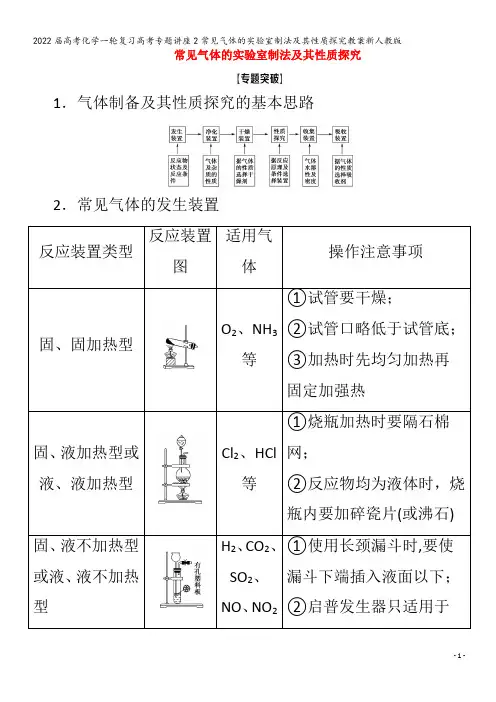
常见气体的实验室制法及其性质探究1.气体制备及其性质探究的基本思路2.常见气体的发生装置反应装置类型反应装置图适用气体操作注意事项固、固加热型O2、NH3等①试管要干燥;②试管口略低于试管底;③加热时先均匀加热再固定加强热固、液加热型或液、液加热型Cl2、HCl等①烧瓶加热时要隔石棉网;②反应物均为液体时,烧瓶内要加碎瓷片(或沸石)固、液不加热型或液、液不加热型H2、CO2、SO2、NO、NO2①使用长颈漏斗时,要使漏斗下端插入液面以下;②启普发生器只适用于等块状固体和液体反应,且气体不溶于水;③使用分液漏斗既可以增强气密性,又可控制液体流速注意:“固+液错误!气”装置的改进①控制温度(图1)②平衡气压、便于液体滴下(图2)图1图23.常见气体的净化(1)除杂试剂选择的依据:主体气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性。
除杂原则:①不损失主体气体;②不引入新的杂质气体;③在密闭装置内进行;④先除易除的杂质气体.(2)气体干燥净化装置类型液态干燥剂固态干燥剂固态干燥剂固体,加热装置ⅠⅡⅢⅣ常见干燥剂浓硫酸(酸性、强氧化性)无水氯化钙(中性)碱石灰(碱性)除杂试剂Cu、CuO、Mg等注意:①需净化的气体中含有多种杂质时,除杂顺序:一般先除去酸性气体,如氯化氢气体、CO2、SO2等,水蒸气要在最后除去。
②选用除杂方法时要保证杂质完全除掉,如除CO2最好用NaOH溶液不用Ca(OH)2溶液。
有时候为了保证气体除尽,还需要加一步骤验证杂质是否除尽,如验证混合气体中既有CO2,又有SO2,通常用品红溶液检验SO2,然后用溴水或酸性KMnO4溶液除去SO2,再用品红溶液检验是否除尽,最后用澄清石灰水检验CO2。
③酸性干燥剂(浓硫酸、P2O5):不能干燥NH3等碱性气体;碱性干燥剂(碱石灰、NaOH、CaO):不能干燥SO2、Cl2等酸性干燥剂;中性干燥剂(CaCl2):不能干燥NH3。
4.常见气体的收集方法(1)排水法:收集难溶于水且不与水反应的气体,如O2、H2、N2、NO、CO、C2H4等。
高中常见气体的制备1.常见气体的实验室制法中学化学实验中,应该学会氯气、氯化氢、氧气、硫化氢、二氧化硫、氨气、二氧化氮、一氧化氮、二氧化碳、氢气、甲烷、乙烯、乙炔等气体的实验室制法。
应该掌握的具体内容主要有:会选择适宜的反应物,并能熟练地书写有关气体生成的化学方程式;根据反应物的状态和反应条件等因素,选择适宜的气体发生装置,能判断装置图的正误,会组装气体发生装置;根据气体的密度、在水中的溶解性等性质,选择适宜的集气方法与装置;根据所制气体的性质,会用简便的方法检验或验满。
(一)气体的制备思路,可从下面几个方面来归纳:反应原理气体发生装置除杂提纯干燥收集检验尾气处理→→→→→→(二)组装仪器:自下而上,从左到右;气体净化:先净气装置,后干燥装置;(三)操作顺序:1.检验装置的气密性;2.装药品进行实验操作;3.记录实验现象、数据;1、气体制取装置:A. B. C. D.固/液体 + 液体(不加热)固/液体 + 液体(加热) 固体 + 固体(加热) 适用于收集不跟空气发生反应且密度比空气小的气体(装置见图C);(装置D中B管进A管出)2、气体干燥装置(1)气体干燥装置的基本类型和气体流动方向:注意事项:1、固体干燥剂颗粒大小要适当,颗粒太大气体和干燥剂接触面小,不利于干燥效果不好;颗粒太小,气体不易通过,容易堵塞,一般以黄豆粒大小为宜。
2、液体干燥剂用量要适当,并控制好通入气体的速度,为了防止发生倒吸,在洗气瓶与反应容器之间应连接安全瓶。
(2)、气体的分类1、根据酸碱性,酸性气体:CO2、SO2、NO2、HCl、Cl2、H2S、HBr、HI等碱性气体:只有NH3中性气体:H2、O2、CH4、CO、CH2=CH2、C2H2、N2等2、根据常温氧化还原性强弱,强还原性气体:H2S、HBr、HI、SO2等一般性气体:H2、O2、CH4等(3)、气体干燥剂的类型及选择1、常用气体干燥剂按酸碱性可分为三类:①酸性干燥剂,如浓硫酸、五氧化二磷、硅胶。