高中常见气体的制备方法总结.doc
- 格式:doc
- 大小:498.54 KB
- 文档页数:7

常见气体的实验室制备1.氧气的实验室制备(1)反应原理①高锰酸钾固体加热分解制备:2KMnO4=====△K2MnO4+MnO2 +O2↑。
②常温下,用过氧化氢溶液和二氧化锰反应制备2H2O2=====MnO22H2O+O2↑。
(2)发生装置图1原理①中反应物为固体,且需不断加热,一般选用图1装置。
在本发生装置中,为了防止生成的细小颗粒堵塞导管,在大试管口可放一松软棉花球,以吸附这些细微颗粒。
加热时,一般先均匀加热整个试管,后集中于反应物固体部位加热。
如果使用排水法收集气体,当停止制气时,应先从水槽中把导管撤出,然后再撤走酒精灯,以防止(冷)水倒流进入气体发生装置中,使(热)试管破裂。
原理②中反应物过氧化氢是液体,MnO2 是固体,反应不需加热,一般选用图2中装置。
在本反应原理中的两种反应物一般分开放置,其中固体(也可以是液体)放置在平底烧瓶、广口瓶或锥形瓶等适合反应的容器中,另一种液体可放在分液漏斗或长颈漏斗中。
一般气体发生装置只能有一个导气口,因此用长颈漏斗组装气体发生装置时,长颈漏斗下端要伸到液面以下,用液体封住下端口,从而防止氧气从长颈漏斗逸出。
图2(3)收集方法因为氧气是不溶于水、密度比空气大的气体,实验室既可以用排水法收集氧气,也可以用向上排空气法收集氧气。
当然,有时也可以用气球、氧气袋收集。
为保证尽可能将集气瓶中的空气排净,用向上排空气法收集氧气时,导管口要插到集气瓶底部;而用排水法收集氧气时,不能一有气泡产生就收集(开始排出气体实为装置内的空气),要等到气泡均匀冒出时,再开始收集气体。
(4)验满方法排水法收集气体时,直接观察瓶体中的水是否被排出或瓶口是否有气泡冒出,即可验满。
用排空气法收集O2时,检验O2收集满的方法是把带火星的木条放在集气瓶口,若复燃,证明氧气收集满了。
(5)集气瓶放置存有气体的集气瓶在放置时,应尽量避免气体因本身惯性而逸出,一般比空气轻的气体,容易上升;而密度比空气重的气体,容易下降。

高中18种常见气体制备原理(只有方程式) 高中常见18种气体的制备方法一、氢气实验室制法:锌和稀硫酸反应,生成锌硫酸和氢气。
工业制法:碳和水蒸气反应,生成一氧化碳和氢气,或者一氧化碳和水蒸气反应,生成二氧化碳和氢气。
二、一氧化碳实验室制法:甲酸和浓硫酸反应,生成一氧化碳和水。
工业制法:碳和水蒸气反应,生成一氧化碳。
三、二氧化碳实验室制法:碳酸钙和稀盐酸反应,生成氯化钙、二氧化碳和水。
工业制法:碳酸钙分解,生成氧化钙和二氧化碳。
四、甲烷实验室制法:乙酸钠和氢氧化钠反应,生成碳酸钠和甲烷。
五、乙烯实验室制法:乙醇和浓硫酸反应,生成乙烯和水。
工业制法:石油裂解或烷基化反应,生成乙烯。
六、乙炔实验室制法:电石和水反应,生成氢氧化钙和乙炔。
七、氮气实验室制法:亚硝酸钠和氯化铵反应,生成氮气、氯化钠和水,或者氧化铜和氨水反应,生成铜和氮气。
工业制法:液化空气再蒸馏,先蒸出氮气。
八、氨气实验室制法:氢氧化钙和氯化铵反应,生成氯化钙、氨气和水,高温高压。
工业制法:氮气和氢气催化反应,生成氨气。
九、一氧化氮实验室制法:铜和稀硝酸反应,生成硝酸铜和一氧化氮。
工业制法:氨气和氧气反应,生成一氧化氮和水,催化剂存在。
十、二氧化氮实验室制法:铜和浓硝酸反应,生成硝酸铜、二氧化氮和水。
工业制法:一氧化氮和氧气反应,生成二氧化氮。
十一、氧气实验室制法:高锰酸钾分解,生成高锰酸钾、氧气和二氧化锰,或者二氧化锰和氯酸钾反应,生成氯化钾、氧气和水。
工业制法:液化空气再蒸馏,蒸出氧气。
十二、SO2的制法在实验室中,可以通过将Na2SO3和浓度不低于70%的H2SO4反应来制得SO2,反应产物为Na2SO4、SO2和H2O。
而在工业上,可以将4FeS2和11O2反应,得到2Fe2O3和8SO2.另外,还有一种点燃硫和氧气反应的方法,可以得到SO2.十三、H2S的制法在实验室中,可以通过将FeS和稀盐酸反应来制得H2S,反应产物为FeCl2和H2S。

高中化学实验室气体制备总结引言气体制备是高中化学实验室中常见的实验操作之一。
通过控制反应条件,可以从化学反应中制备出各种气体。
本文将总结高中化学实验室中常用的气体制备方法及其原理,以供参考。
一、氧气制备氧气是一种无色、无味和可燃的气体,广泛应用于燃烧、氧化等化学反应中。
在高中化学实验室中,常用的氧气制备方法是通过高锰酸钾的分解来制取。
实验步骤如下:1.取适量高锰酸钾固体放入蒸馏烧瓶中;2.加入适量稀硫酸,使高锰酸钾充分溶解;3.使用导管将烧瓶与气体收集瓶连接,将气体收集瓶内的水排空;4.缓慢加热烧瓶,观察气体收集瓶中气体的变化。
原理解释:高锰酸钾的分解反应式为:2KMnO4(s) → K2MnO4(s) + MnO2(s) + O2(g)通过加热高锰酸钾和稀硫酸混合物,高锰酸钾分解产生氧气,并通过导管收集。
二、二氧化碳制备二氧化碳是一种无色、无味的气体,在高中化学实验室中常用于酸碱中和实验和植物光合作用研究中。
常见的二氧化碳制备方法有酸与碳酸盐反应法和酵母发酵法。
1. 酸与碳酸盐反应法实验步骤如下:1.取适量碳酸盐固体(如碳酸氢钠)放入烧杯中;2.缓慢滴加酸(如稀盐酸)至碳酸盐完全反应;3.使用盖有橡皮塞的试管收集气体。
原理解释:碳酸盐与酸反应产生二氧化碳的反应式如下:NaHCO3(s) + HCl(aq) → NaCl(aq) + H2O(l) + CO2(g)通过滴加酸与碳酸盐反应,产生二氧化碳气体,并用试管收集。
2. 酵母发酵法实验步骤如下:1.取适量酵母放入锥形瓶中;2.加入适量葡萄糖溶液,与酵母充分混合;3.盖上透明的气球或用试管堵住瓶口;4.静置一段时间后观察气球的膨胀情况。
原理解释:酵母通过发酵作用将葡萄糖分解生成酒精和二氧化碳。
二氧化碳气体通过瓶口进入气球内,使气球膨胀。
三、氯气制备氯气是一种黄绿色、有刺激性气味的气体,广泛应用于消毒、漂白和制取其他化学品中。
在高中化学实验室中,氯气可以通过盐酸与漂白粉的反应制备。

常见气体的实验室制法一、气体的制备:实验室制取纯净的气体一般有以下环节:(1)气体的发生 (2)气体的净化(3)气体的收集(4)尾气的处理(对于有毒气体) 1、常见气体的制备原理:气体发生装置的三种典型类型:中学化学中要求掌握约13种气体的制备,它们是:三种单质气体(O 2,H 2,Cl 2)、三种氢化物(HCl ,H 2S ,NH 3)、三种有机气体(CH 4,C 2H 4,C 2H 2)、四种氧化物(CO 2,SO 2,NO ,NO 2)。
写出下列制备反应的化学方程式: H 2: NH 3: O 2: NO 2: 或: NO : Cl 2: CO 2: HCl: CH 4: H 2S: C 2H 4: C 2H 2: SO 2:2、气体发生装置:(1)固、固加热:即: 固+固△气如制取 等。
装置如右图: (2)液固或液、液加热:即:液+固 △气; 液+液 △ 气,如制取 等。
装置如右图:(3)液固不加热: 即:液+固 气如制取 等。
装置如右图:启普发生器,它用于固—液常温下反应制取大量气体。
其优点是可以随时反应,随时停止。
使用时应注意装置是否漏气;液体不能添加太满;固体试剂应是块状。
启普发生器由 、 、 三部分组成。
3.气体的净化:(1) 净化选择气体吸收剂应根据气体的性质和杂质的性质而确定,所选用的吸收剂只能吸收气体中的杂质,而不能与被提纯的气体反应。
一般情况下:①易溶于水的气体杂质可用水吸收;②酸性气体杂质可用碱性物质吸收;③碱性气体杂质可用酸性物质吸收;④水蒸气可用干燥剂来吸收;⑤能与杂质反应生成沉淀(或可溶物)的物质也可用作吸收剂。
1、含有HCl杂质气体⑴CO2(HCl)––––- 溶液;SO2(HCl)––––溶液H2S(HCl)––––- 溶液;⑵Cl2(HCl)––––––;H2(HCl)––––- ;2、中性气体中含有酸性杂质气体:用溶液吸收①O2(Cl2)②H2(H2S)③O2(CO2)④CO(CO2)⑤C2H2(H2S)⑥NO(NO2)3、酸性气体中含有其它酸性杂质气体①CO2(SO2)––––- 溶液;②CO2(H2S)–––––- 溶液;4、含有O2杂质气体①CO2(O2)–––––;②N2(O2)––––-5、HCl(Cl2)–––––。

气体的制备和收集气体是物质存在的三种基本状态之一,与固体和液体相比,气体具有较低的密度和较高的可压缩性。
在各类化学实验和工业过程中,制备和收集气体是非常常见的操作。
本文将探讨气体的制备和收集的一些常见方法和技术。
一、气体的制备方法1. 化学反应法:利用化学反应产生气体是制备气体的常见方法之一。
例如,通过酸与金属的反应可以制备出氢气。
将酸与金属(如锌)反应,生成相应的金属盐和氢气。
化学反应法制备气体的关键是选择合适的反应物和反应条件。
2. 热分解法:有些物质在高温下能够发生热分解反应,生成气体。
例如,氢氧化铜加热至高温时会分解为氧气和氢气。
热分解法是制备气体的另一种常见方法,需要控制好温度和反应条件。
3. 物理法:某些气体可以通过物理手段从混合气体或液体中分离出来。
例如,液化空气可以通过低温冷凝,将其中的氮气和氧气分离出来。
物理法制备气体的关键是选择合适的分离技术和设备。
二、气体的收集方法1. 气液置换法:将气体收集在排水瓶或气囊中是一种常见的收集方法。
将瓶口或气囊的开口浸入液体中,然后通过物理或化学反应产生气体,气体会逐渐排出,占据容器的空间。
当气体完全占据容器时,即可关闭装置,取出气体。
2. 气体位移法:利用气体的轻重差异,将气体从较重的容器移至较轻的容器中。
这种方法常用于收集较轻的气体,如氢气。
首先将氢气制备好,然后通过导管或喇叭口将氢气转移至稍稍倾斜的玻璃瓶中,由于氢气较轻,会上浮至瓶口,然后用瓶塞封住。
3. 吸附法:有些气体可以通过吸附剂吸附收集。
例如,将一定量的活性炭放置在容器中,然后通入气体,气体中的某些成分会被活性炭吸附下来。
吸附法对某些具有吸附性能的气体非常有效。
三、注意事项在气体的制备和收集过程中,有一些注意事项需要遵守:1. 安全性:许多气体具有易燃、毒性或腐蚀性等危险性质,因此在操作过程中必须严格遵守安全操作规程,佩戴个人防护装备,确保实验室的通风良好。
2. 精确测量:为了获得准确的气体产量,需要使用精确的仪器和设备进行测量。

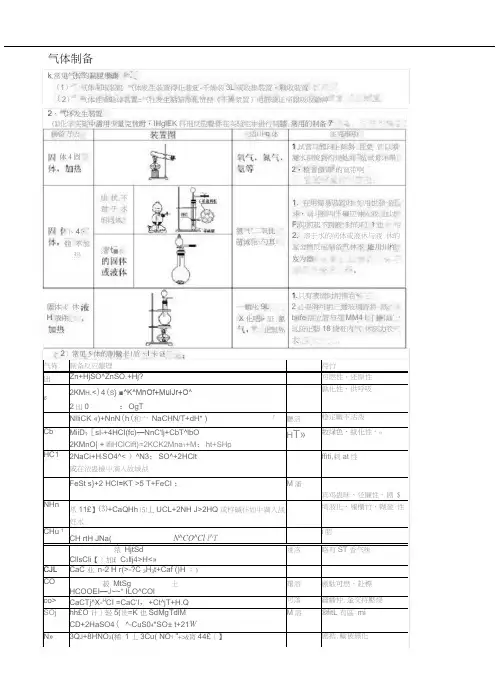
制备方法 适川q 休注克事项 氯气"二氧比 苗诫化:勺耳快状不 君于水 的同体灌t ■水固体( 休H 液件卜4•腹 不加热休4固1.只有液怵时用怫右*2必耍时可用三通玻璃晋将 蒸t»ife 版立管与芬MM4 I. 门柯通’以防止藝18烧粧内气 休压力衣大.軌叱9L 二 X 化吧・証 氯化氢% 1试营口醴向卜倾斜.且免 管口障凝水倒流到灼烧处而 览试骨洋舉.2•检音饋胃'的寬带啊「1. 在用简易裝置时.如用世颈 蹈斗•溺斗颈叫卜礙应伸入液 血以F,仰则起不到液:封的门 1也2. 溶于水的同体或液休与液 休的渥舍物反应制备气林不 能川川杵岌为器气体制备k 常见气悴的制脱歩骤(1) 气体制取装氈 气体发生装置待化装迓-千燥装3L 或收集裝置・戰收裝置(2)气体性质验诽裳置=气牡发生粘笳净化赞琵《干燥漿置)电筋验证帰跟吸收爺艸2、气坏发生装置⑴化学实鲨中需用少量完怵时・IHglEK 料刑反应聲件在实验宅中进行制牆.常用的制备7气佈制备反应龈理待竹出Zn+HjSO^ZnSO.+Hj?可燃性、还原性62KM H .<)4(S } ■^K^MnOf+MulJr+O^2出0:OgT孰化性、供呼吸NIliCK «)+NnN (h (和亠 NaCHN/T+dH* )「 廳涪稳定載不活泼 CbMiiD ?[sl-+4HCI(fc)—NnC'lj+CbT^lbO2KMnO| + lfiHClCift)=2KCK2Mna 1+M :ht+SHpH T»数绿色、紋化性、«HC1 2NaCi+H :SO4^< )^N3;SO^+2HClt或在浓蛊檢屮滴入故城战ffiti,剌at 性FeSt s}+2 HCI =KT >5 T+FeCI ;M 瀋宾鸡蛊昧、还廉性、剧 $NHn 爪11£】⑶+CaQHh ⑸丄UCL+2NH J>2HQ 或杵碱仆如屮満入战妊水埼液化、斶櫃竹,糊激 性CHu 1CH rtH JNa( N^CO^Cl l^Ti 朋1浓 HjtSdCllsCli 【]加£ C 3llj4>H<»难洛略有ST 香气味CJL CaC 业 n-2 H r(>-?C 3H 3t+Caf ()H ;)CO 菽 MtSg土HCOOEI —J ~~* ILO^COl曙溶 剧駄可燃、赴標 co> CaCTj^X-H CI =CaC'l ,+Ct^jT+H.Q 可落疆幡忡.金交持壓烧SOj hh£O 计]轻5(诜=K 也SdMgTdlM CD+2HaSO4( ^-CuS04*SO± t+21W M 溶®fitL 有區 miN»3Q J +8HNO 3(稀 1 丄3Cu( NO ? ”+>&肓44£〔】剧抵.輸被無化,〉常见5体的制儆卡|质、卡谜•验室制备的气体常常幣有恢券和水汽.仃时需要祎化和I•燥.酸雾“川水或物质的水溶液除去・k ;:・计I质选用浓硫酸.无水氯化纵碱石灰等吸收水汽。

高中常见气体的制备在高中化学的世界里,气体制备可谓是一门奇妙的艺术。
哎,谁不想在实验室里挥舞着试管,感受那种“科学家”的气息呢?咱们今天就聊聊几种常见的气体怎么做,顺便也来点儿轻松幽默的调侃,保证让你笑着学,乐着记。
咱们来说说氢气。
这个小家伙可神奇了,轻飘飘的,感觉随时能飞起来似的。
想要制备氢气,最简单的方法就是用锌和盐酸来搞定。
把锌片放进盐酸里,哎呀,那个反应可热闹了,咕噜咕噜的冒出小泡泡,简直像是在开派对。
想象一下,氢气的性格就像个小男孩,爱玩、爱闹,最后它会随着气泡飘上天,真是让人羡慕啊!小心点,氢气可是个易燃的家伙,别让它给你来个意外的惊喜哦。
然后,咱们再来聊聊氧气。
哦,氧气可是生命之源呀!没有它,咱们可就活不下去了。
制备氧气的方法也简单,常用的是分解过氧化氢。
把过氧化氢倒进烧杯里,加入点儿二氧化锰,哗啦啦,反应开始了,氧气一股脑儿冒出来,感觉就像一场盛大的烟火秀。
气泡越来越多,空气中都能闻到清新的味道,真让人心旷神怡。
嘿,你知道吗,氧气的性格就像个温柔的妈妈,默默地支持着我们,让我们能尽情呼吸,活得滋润。
再来看看二氧化碳。
这小子就爱搞事情,特别是在喝饮料的时候。
想要制备二氧化碳,一般用酸和碳酸钙反应。
你把醋倒在碳酸钙上,那个反应简直就像火山爆发一样,气泡直冒。
看到那些气泡在冒,仿佛在说:“快来,喝我!我能让你爽!”而二氧化碳可真是个调皮鬼,能让饮料起泡,带来爽口的体验。
哎,说到这里,谁不爱喝一口冰凉的饮料呢?还有一位常客,氨气。
氨气的气味可真不是好惹的,呛鼻得很。
想要制备氨气,咱们可以用氨水和石灰反应。
把氨水加到石灰里,哇,氨气就开始冒出来了,气味扑鼻而来,简直像是个小恶作剧,告诉你:我来了!氨气在化学中可是个多才多艺的角色,能用于肥料的制造,对农业有着不小的贡献。
再说说一氧化碳,这家伙可是个隐形的杀手。
它的制备方法有很多,但通常通过燃烧不完全的碳源来产生。
比如,点燃木炭,然后不让氧气完全进入,嘿,一氧化碳就悄然无声地出来了。

一:氯气1.实验室方法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O(反应条件加热)收集方法:向上排空气法或排饱和食盐水法净化方法:用饱和的食盐水除去HCl,再用浓H2SO4除去水蒸气。
2.工业制法:原理:电解食盐水2NaCl+2H2O====2NaOH+Cl2↑+H2↑(反应条件是通电)二:二氧化碳1.实验室方法:CaCO3+2HCl=CaCl2+CO2↑+H2O收集方法:向上排空气法净化方法:用饱和的NaHCO3除去HCl2.工业制法:CaCO3=====CaO+CO2↑(条件为高温)三:氧气实验室方法:KMnO4受热分解:2KMnO4=K2MnO4+MnO2+O2↑(条件:加热)KClO3和MnO2混合共热:KClO3=2KCl+3O2↑(条件:在MnO2下加热)工业制法:空气液化分离四:氨气实验室方法:Ca(OH)2+2NH4Cl=====2NH3↑+CaCl2+2H2O收集方法:向下排空气法、且容器口塞一团沾有稀H2SO4的棉花团,以防止所收集的气体与空气对流,也可吸收多余的NH3净化方法:用碱石灰吸收NH3中混有的水分工业制法:N2+3H2=====2NH3(条件:高温、高压、催化剂且此反应为可逆反应(上面的必需全部把握且对方程式一定要准确地记住,下面的只需知道)五:氮气实验室方法:NaNO2+NH4Cl==N2↑+2H2O +NaCl工业方法:液态空气分馏法六:二氧化氮实验室方法:Cu+4HNO3(浓)====Cu(NO3)2+2H2O↑(条件加热)工业方法:4NH3+ 5O2= 4NO + 6H2O(条件Pt/加热)2NO + O2= 2NO2七:一氧化碳实验室方法:HCOOH===H2O+CO↑(条件加热)工业方法:C + H2O(g) == CO + H2(条件高温)八:二氧化硫实验室方法:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑九:氢气实验室制法:H2SO4+Zn=====ZnSO4+H2↑2HCl+Zn=====ZnCl2+H2↑收集方法:向下排空气法工业制法:水煤气法 C + H2O(g) == CO + H2(条件高温)有机中常见气体的制取方法一:乙炔实验室方法:CaC2+2H2O→Ca(OH)2+CH≡CH↑收集方法:排水集气法或向下排空气法净化方法:因电石(CaC2)中含有CaS,与水反应会生成H2S,可用硫酸铜溶液或NaOH溶液将其除去。

高中常见18种气体的制备方法一 、H 2实验室制法:Zn+H 2SO 4 (稀)=== ZnSO 4+H 2↑工业制法:C+H 2O ========高温 CO+H 2CO+H 2O =====高温 CO 2+H 2二、CO实验室制法:HCOOH ========浓H 2SO 4△CO↑+H 2O 工业制法:C+H 2O =====高温 CO+H 2三、CO 2实验室制法:CaCO 3+2HCl(稀)=== CaCl 2+CO 2↑+H 2O工业制法:CaCO 3 ========高温 CaO+CO 2↑四、CH 4实验室制法:CH 3COONa(s)+NaOH(s)———→CaO △Na 2CO 3 + CH 4↑ 五、C 2H 4实验室制法:CH 3CH 2OH ————→浓硫酸170℃CH 2=CH 2 ↑+H 2O 工业制法:石油裂化、裂解六、C 2H 2实验室制法:CaC 2+2H 2O → Ca(OH)2+C 2H 2↑七、N 2实验室制法:NaNO 2+NH 4Cl=======△ N 2↑+NaCl+2H 2O3CuO+2NH 3=======△ 3Cu+N 2+3H 2O工业制法:液化空气再蒸馏(先蒸出N 2)八、NH 3实验室制法:Ca(OH)2+2NH 4Cl=======△ CaCl 2+2NH 3↑+2H 2O工业制法:N 2+3H 2 ========高温高压催化剂2NH 3 九、NO实验室制法:3Cu+8HNO 3(稀)=== 3Cu(NO 3)2+2NO↑+4H 2O工业制法:4NH 3+5O 2=========催化剂△4NO+6H 2O 十、NO 2实验室制法:Cu+4HNO 3(浓)=== Cu(NO 3)2+2NO 2↑+2H 2O 工业制法:2NO+O 2=== 2NO 2十一、O 2实验室制法:2KMnO 4 =======△ K 2MnO 4+MnO 2+O 2↑2KClO 3 =======MnO 2△2KCl+3O 2↑ 2H 2O 2 =======MnO 2 2H 2O+O 2↑工业制法:液化空气再蒸馏(蒸出N 2后剩下的主要为液氧) 十二、SO 2实验室制法:Na 2SO 3(s)+H 2SO 4(≥70%)=== Na 2SO 4+SO 2↑+H 2O工业制法:4FeS 2+11O 2 =======高温 2Fe 2O 3+8SO 2S+O 2 =======点燃 SO 2十三、H 2S实验室制法:FeS+2HCl(稀)=== FeCl 2+H 2S↑ 十四、HF实验室、工业制法:CaF 2(s)+H 2SO 4=======△ CaSO 4+2HF↑十五、HCl实验室制法:2NaCl(s)+H 2SO 4=======△ Na 2SO 4+2HCl↑工业制法:H 2+Cl 2=======点燃 2HCl十六、HBr实验室制法:NaBr(s)+H 3PO 4(浓)=======微热 NaH 2PO 4+HBr↑十七、HI实验室制法:KI(s)+H 3PO 4(浓)======= KH 2PO 4+HI↑ 十八、Cl 2实验室制法:4HCl+MnO 2=======△ MnCl 2+Cl 2↑+2H 2O工业制法:2NaCl+2H 2O =======通电 2NaOH+H 2↑+Cl 2↑。

高中化学的气体制备方程式总结高中化学气体制备方程综述1.常见气体(转弯)(1)氧气的准备和检查制备原理-含氧化合物的自分解制备方程式-2kcl O3 2kcl+3o 2↓装置-稍微向下倾斜的大试管,加热检查-用火星板条,再收集-排水法或向上排气法(2)氢气制备原理-用弱氧化性酸-锌+硫酸= = =硫酸+H2↓装置-cape发生器代替活性金属的制备方程式检查-点火、淡蓝色火焰、容器壁上的水滴收集-排放法或向下排放法(3)氯气制备原理——强氧化剂氧化含氧化合物准备方程式-二氧化锰+4盐酸(浓缩)二氯化锰+二氯化锰+2H2O装置-分液漏斗,圆底烧瓶,加热检验-可使湿的蓝色石蕊试纸先变红,然后褪色;去除杂质-首先引入饱和盐水溶液(去除氯化氢),然后引入浓H2SO4(去除水蒸汽)收集-去除饱和盐水法或向上排气法尾气回收-Cl2+2NaOH = = =氯化钠+氯化钠+H2O (4) H2S(1)制备原理-强酸和强碱的复分解反应(2)制备方程-FeS+2HCl = = = FeCl 2+H2S↓3)装置-通用发生器(4)检验——能使湿醋酸铅试纸变黑(5)杂质去除-首先引入饱和NaHS溶液(去除氯化氢),然后引入固体氯化钙(或P2O5)(去除水蒸气)和(6)收集-向上排放方法⑦尾气回收-H2S+2NaOH = = = Na2S+H2O或H2S+NaOH = = = nahs+H2O 5]二氧化硫(1)制备原理-稳定强酸和不稳定弱酸盐的复分解(2)制备方程-Na2SO 3+H2SO 4 = = = Na2SO 4+SO2↓H2O(3)装置-分液漏斗,圆底烧瓶(4)检查-首先,引入品红色测试溶液,褪色,然后加热以恢复原始红色;(5)去除杂质——引入浓H2SO4(去除水蒸气),( 6)收集——向上排放法⑦尾气回收-SO2+2NaOH = = = Na2SO3+H2O [6] CO2(1)制备原理-稳定强酸和不稳定弱酸盐的复分解(2)制备方程-碳酸钙+盐酸-氯化钙+二氧化碳+H2O (3)装置-rev发生器(4)检查-引入清水以改变浊度(5)除杂——通入饱和碳酸氢钠溶液(不含氯化氢),然后通入浓H2SO4(不含水蒸汽),( 6)收集-排放法或向上排放法(7)氨(1)制备原理——固体铵盐和固体强碱的复分解(2)准备方程式-ca(oh)2+2nh 4cl-CaCl 2+NH3↓2h2o(3)-稍微向下倾斜的大试管,加热(4)测试-湿红色石蕊试纸,变蓝(5)去除杂质-引入碱石灰(去除水蒸气)进行收集-向下排出氯化氢的方法(8)(1)制备原理——难挥发酸易挥发(2)配制方程式-氯化钠+硫酸-硫酸钠+盐酸↓3装置-分液漏斗,圆底烧瓶,加热(4)检查-引入硝酸银溶液产生白色沉淀,加入稀硝酸沉淀至不溶,(5)去除杂质-引入浓硫酸(去除水蒸气)和(6)收集-向上排放法(9)二氧化氮(1)制备原理-惰性金属和浓硝酸的氧化还原;(2)准备方程式-铜+4硝酸= = =铜(NO3)2+2NO2↓2H2O(3)装置-分液漏斗、圆底烧瓶(或大试管、锥形瓶)(4)检查-红棕色气体,引入硝酸银溶液使颜色变浅,但不产生沉淀(5)收集-向上排气法⑥尾气处理-3n O2+H2O = = = 2hno 3+nono+NO2+2NaOH = = = 2nano 2+H2O⑩一氧化氮(1)制备原理-惰性金属和稀硝酸的氧化还原;(2)方程式的制备-铜+8硝酸(稀释)= = 3Cu(NO3)2+2NO↓4H2O(3)装置-分液漏斗、圆底烧瓶(或大试管、锥形瓶)④检查-无色气体,暴露在空气中立即变成红棕色(5)收集-排放方法(11)一氧化碳(1)制备原理-浓硫酸脱水有机物(2)制备方程式-羟基乙酸一氧化碳+H2O (3)装置-分液漏斗,圆底烧瓶(4)检查-燃烧,蓝色火焰,无水滴,产生的气体能使澄清的石灰水浑浊(5)杂质去除-浓硫酸(水蒸气去除)引入(6)收集-排出方法(12)甲烷(1)准备一个方程式-ch3coona+NaOH CH4 = Na2CO3 (2)装置-一个稍向下倾斜的大试管,加热(3)收集-排放法或向下排气法(13)乙烯(1)制备原理-浓硫酸对有机物的脱水(2)制备方程-ch3ch 2oh CH2 = CH2↓+H2O(3)装置-分液漏斗,圆底烧瓶,加热(4)除杂-氢氧化钠溶液(SO2和CO2去除),浓硫酸(水蒸汽去除)收集-排放法(14)乙炔(1)制备原理-电石强吸水性(2)准备方程式-CAC 2+2h2o ca(oh)2+chch←(3)装置-分液漏斗、圆底烧瓶(或大试管、锥形瓶)(4)检查-无色气体,能够燃烧,产生明亮的火焰并发出浓浓的黑烟(5)去除杂质-引入硫酸铜溶液(除H2S和pH 3外),引入浓硫酸(除水蒸汽)进行收集-排水法或向下排气法。
实验室常见气体的制备一、O2图一图二图三图四实验装置图1、实验原理:2、收集方法:排水法、向上排空气法(图三、图四)3、验满方法:(用排水法收集)如果集气瓶口有气泡出现,说明气体收集满了。
(用向上排空气法收集)将带火星的木条放在集气瓶口,如果带火星的木条复燃,说明氧气收集满了。
4、检验氧气的方法:将带火星的木条放入集气瓶中,若复燃则证明是氧气5、干燥方法:用浓硫酸、碱石灰、无水CaCl2等干燥剂干燥6、注意事项:1)、停止反应时,应先把导管从水槽中移出,再熄灭酒精灯,防止水槽中的水被倒吸入热的试管中,使试管炸裂。
2)、加热高锰酸钾时,试管口要放一团棉花,防止高锰酸钾被吹入导管,使导管堵塞。
3)、棉花不要离高锰酸钾太近,否则会导致发生装置爆炸。
二、CO21、实验原理:CaCO3+2HCl=CaCl2+H2O+CO2↑2、收集方法:向上排空气法(图三、图四)3、验满方法:用燃着的木条放在集气瓶口,若熄灭则证明已收集满4、检验CO2的方法:通入澄清石灰水,若变浑浊则证明是CO25、干燥方法:用浓硫酸,无水CaCl2干燥,不能用碱石灰6、注意事项:1).不能选用稀硫酸,因为稀硫酸与碳酸钙反应生成微溶于水的硫酸钙会覆盖在碳酸钙的表面,阻止反应继续进行。
2).不能选用浓盐酸,因为浓盐酸易挥发,得不到纯净的二氧化碳气体。
3).不能用碳酸钠代替石灰石,因为反应太剧烈,产生的气体难以收集。
三、H2发生装置发生装置收集装置收集装置1、实验原理:2、收集方法:排水法(首选)、向下排空气法3、验纯方法:收集一试管气体用拇指堵住试管口,口朝下,接近酒精灯松手,听到尖锐的爆鸣声则说明氢气不纯。
4、检验方法:点燃气体(验纯后),有蓝色火焰,火焰上罩一干燥烧杯,烧杯壁上有水珠则证明是氢气5、干燥方法:用浓硫酸、无水CaCl2、碱石灰等干燥剂干燥6、注意事项:1)、通常选择Zn与稀硫酸来制氢气,镁条反应太快,铁反应较慢2)、若用稀盐酸则生成的气体中会混有挥发的HCl气体,要除杂3)、点燃氢气前一定要验纯四、NH31、实验原理:2、收集方法:向下排空气法(氨气极易溶于水,不能用排水法收集)3、验满方法:用湿润的红色石蕊试纸靠近试管口,若试纸变成蓝色则证明已收集满或者用蘸有浓盐酸的玻璃棒放在瓶口,产生白烟4、检验方法:用湿润的红色石蕊试纸检验,若使试纸变成蓝色则证明是氨气5、干燥方法:用碱石灰干燥,不能用浓硫酸和无水CaCl2干燥。
常见气体的制备氯气制取原理:强氧化剂氧化含氧化合物制取氯气的装置制取方程式:MnO2+4HCl(浓) =加热= MnCl2+Cl2↑+2H2O检验:能使湿润的蓝色石蕊试纸先变红后褪色;除杂质:先通入饱和食盐水(除HCl),再通入浓H2SO4(除水蒸气)收集:排饱和食盐水法或向上排气法尾气回收:Cl2+2NaOH = NaCl+NaClO+H2O氧气制取原理:H2O2分解、KMnO4分解、KClO3在MnO2催化与加热下分解检验:能使带火星的木条复燃;收集:排水法,向上排空气法;氯化氢制取原理:高沸点酸与金属氯化物的复分解制取方程式:NaCl+H2SO4= Na2SO4+2HCl↑装置:分液漏斗,圆底烧瓶,加热检验:通入AgNO3溶液,产生白色沉淀,再加稀HNO3沉淀不溶除杂质:通入浓硫酸(除水蒸气)收集:向上排气法氨气制取原理:固体铵盐与固体强碱的复分解加热制取氨气的装置制取方程式:Ca(OH)2+2NH4Cl = CaCl2+NH3↑+2H2O装置:略微向下倾斜的大试管,加热检验:湿润的红色石蕊试纸,变蓝除杂质:通入碱石灰(除水蒸气)收集:向下排气法硫化氢制取原理:强酸制弱酸的复分解反应制取方程式:FeS+2HCl = FeCl2+H2S↑装置:启普发生器检验:能使湿润的醋酸铅试纸变黑除杂质:先通入饱和NaHS溶液(除HCl),再通入固体CaCl2(或P2O5)(除水蒸气)收集:向上排气法二氧化氮、一氧化氮制取原理:不活泼金属与浓硝酸、稀硝酸的氧化—还原;[8]制取方程式:Cu+4HNO3= Cu(NO3)2+2NO2↑+2H2O3Cu+8HNO3 (稀) = 3Cu(NO3)2+2NO↑+4H2O装置:分液漏斗,圆底烧瓶(或用大试管,锥形瓶)检验:二氧化氮:红棕色气体,通入AgNO3溶液颜色变浅,但无沉淀生成一氧化氮:通入氧气,很快生成棕红色气体。
收集:二氧化氮:向上排气法一氧化氮:特殊方法尾气处理:2NO2+2NaOH = NaNO3+ NaNO2+H2ONO+NO2+2NaOH = 2NaNO2+H2O二氧化硫制取原理:稳定性强酸与不稳定性弱酸盐的复分解制取方程式:Na2SO3+H2SO4= Na2SO4+SO2↑+H2O装置:分液漏斗,锥形瓶[2]检验:先通入品红试液,褪色。
高中物理--常见气体制备方法(全面版)
一、氢气的制备方法
1. 金属与酸反应法:可使用锌或铁与浓盐酸反应,生成氢气。
2. 电解水制氢法:将电解水中的氢氧化物电解,可得到氢气。
3. 碱金属与水反应法:碱金属与水反应会产生氢气,其中比较常见的是钠与水反应。
二、氧气的制备方法
1. 加热金属氧化物分解法:将金属氧化物加热,可使其分解产生氧气。
2. 过氧化物分解法:过氧化物类物质在适当的条件下,可发生分解反应生成氧气。
3. 电解水制氧法:水在电解的过程中,氧气会被析出。
三、二氧化碳的制备方法
1. 碳酸盐与酸反应法:将碳酸盐与酸反应,在反应中会产生二氧化碳。
2. 酵母发酵法:在适当的条件下,酵母会分解产生二氧化碳。
3. 燃烧有机物质法:燃烧有机物质,如木材、糖类等,会产生二氧化碳。
四、氮气的制备方法
1. 空气分离法:通过空气的分离,可以得到其中的氮气成分。
2. 铜与浓稀硝酸反应法:铜与硝酸反应会产生氮气。
3. 氨气氧化反应法:将氨气与氧气反应,可得到氮气。
五、氯气的制备方法
1. 氯化物与酸反应法:将氯化物与酸反应会产生氯气。
2. 电解盐水制氯法:通过电解盐水,可以得到其中的氯气。
3. 氯化物与高温氧化反应法:将氯化物在高温条件下与氧气反应,可得到氯气。
以上是高中物理中常见气体的制备方法,希望能帮到您。
常见的气体制备方法及实验注意事项一、概述气体的制备方法是实验室中常见的工作之一,在各个科学领域都有广泛的应用。
本文将介绍几种常见的气体制备方法,并提供相关的实验注意事项。
二、常见气体制备方法1. 反应法反应法是一种常见的气体制备方法,通过化学反应产生气体。
例如,通过与酸反应得到氢气,如HCl + Zn → ZnCl2 + H2。
在进行反应法制备气体时,需要注意以下几点:- 需要知道反应的热力学条件,包括反应物的摩尔比例和反应温度。
- 注意选择反应容器,确保容器具有良好的耐腐蚀性。
- 实验操作时要注意安全,避免与有毒、易燃气体接触。
2. 分解法分解法是指通过化学反应使某种物质分解产生气体。
例如,过氧化氢分解成水和氧气,如2H2O2 → 2H2O + O2。
在进行分解法制备气体时,需要注意以下几点:- 确定分解反应的条件,包括温度、催化剂等。
- 注意选择合适的反应器和催化剂,以提高分解反应的效率。
- 实验时需注意分解产物的收集和储存方式,避免与有机物或易燃物接触。
3. 溶液法溶液法是一种通过将溶质溶解于溶剂中得到气体的制备方法。
例如,通过溶解氢氧化钠或氢氧化钾得到氨气,如2N aOH + NH4Cl →Na2SO4 + 2H2O + NH3。
在进行溶液法制备气体时,需要注意以下几点:- 确定溶质和溶剂的摩尔比例,保证溶液的浓度适宜。
- 选择适当的反应容器和搅拌装置,以促进反应的进行。
- 注意使用耐腐蚀的实验仪器和容器,避免产生有毒气体。
三、实验注意事项1. 安全措施气体制备实验过程中需要严格遵守实验室安全规定:- 确保实验室通风良好,避免有毒气体积聚。
- 使用个人防护装备,如实验手套、护目镜等。
- 避免与易燃物接触,并确保实验室远离明火。
2. 仪器设备- 选择适当的实验仪器和设备,确保其耐腐蚀性和密封性。
- 注意对仪器设备进行正确的操作和维护,以保证实验的准确性和安全性。
3. 质量测量- 在进行气体制备实验时,需要对反应物的质量进行准确测量,以保证制备的气体质量的准确性。
高中化学实验高考中常见12种气体的制备与收集知识整理梳理一.常见气体的制备1.实验原理(1).氧气的制备:①2H2O22H2O+O2②2KClO32KCl+3O2③2KMnO4K2MnO4+MnO2+O2④2Na2O2+2H2O===4NaOH+O2↑(2).氨气的制备:①2NH4Cl+Ca(OH)2CaCl2+2NH3+2H2O②NH3.H2O NH3+H2O③将浓氨水滴入固体CaO、固体NaOH、碱石灰固体中(作用:a.固体吸水有利于NH 3+H2O NH3·H2O NH4++OH-平衡左移b.反应放热有利于氨水分解和逸出)④工业制法:N2+3H22NH3(3).氯气的制备:①实验室制备MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O②若无MnO2可以用强氧化剂KMnO4、KClO3、K2Cr2O7、C a(ClO)2代替,但反应时不需要在加热2KMnO4+16HCl=5Cl2↑+2KCl+2MnCl2+8H2OKClO3+6HCl=3Cl2↑+KCl+3H2OK2Cr2O7+14HCl=3Cl2↑+2KCl+2CrCl3+7H2OCa(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O③工业制备2NaCl+2H2O2NaOH+H2+Cl2(4).CO2的制备:CaCO3+2HCl=CaCl2+H2O+CO2↑(5).H2的制备:Zn+H2SO4(稀)===ZnSO4+H2↑Zn+2HCl===ZnCl2+H2↑(6).SO2的制备:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2OCu+2H2SO4(浓)CuSO4+SO2↑+2H2O(7).NO2的制备:Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O(8).NO的制备:3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O(9)C 2H 4的制备:C 2H 5OH ――→浓硫酸170℃C 2H 4↑+H 2O*(10).HCl 的制备:H 2SO 4(浓)+NaClNaHSO 4+HCl↑(难挥发性酸制易挥发性酸)H 2SO 4(浓)+2NaCl Na 2SO 4+2HCl↑*(11).H 2S 的制备:FeS +H 2SO 4(稀)=FeSO 4+H 2S↑FeS+2HCl=FeCl 2+H 2S↑.Na 2S +H 2SO 4(稀)=Na 2SO 4+H 2S↑(Na 2S 粉末反应太多剧烈一般不用)*(12).N 2的制备:NaNO 2(aq )+NH 4Cl (aq )=NaCl +N 2↑+2H 2O2.实验装置(1)固体+固体−→−∆气体制备气体:O 2、NH 3、CH 4等(2)固体+液体(液体+液体)−→−∆气体制备气体:Cl 2、C 2H 4等(3)固体+液体(不加热)―→气体制备气体:H 2、CO 2、NO 2、SO 2、NO 等(4)装置的优点:①.分液漏斗或者启普发生器类:便于控制反应速率,随制随停。
1,常见气体的制取和检验⑴氧气制取原理——含氧化合物自身分解制取方程式——2KClO3 2KCl+3O2↑装置——略微向下倾斜的大试管,加热检验——带火星木条,复燃收集——排水法或向上排气法⑵氢气制取原理——活泼金属与弱氧化性酸的置换制取方程式——Zn+H2SO4 === H2SO4+H2↑装置——启普发生器检验——点燃,淡蓝色火焰,在容器壁上有水珠收集——排水法或向下排气法⑶氯气制取原理——强氧化剂氧化含氧化合物制取方程式——MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O装置——分液漏斗,圆底烧瓶,加热检验——能使湿润的蓝色石蕊试纸先变红后褪色;除杂质——先通入饱和食盐水(除HCl),再通入浓H2SO4(除水蒸气)收集——排饱和食盐水法或向上排气法尾气回收——Cl2+2NaOH=== NaCl+NaClO+H2O⑷硫化氢①制取原理——强酸与强碱的复分解反应②制取方程式——FeS+2HCl=== FeCl2+H2S↑③装置——启普发生器④检验——能使湿润的醋酸铅试纸变黑⑤除杂质——先通入饱和NaHS溶液(除HCl),再通入固体CaCl2(或P2O5)(除水蒸气)⑥收集——向上排气法⑦尾气回收——H2S+2NaOH=== Na2S+H2O或H2S+NaOH=== NaHS+H2O⑸二氧化硫①制取原理——稳定性强酸与不稳定性弱酸盐的复分解②制取方程式——Na2SO3+H2SO4=== Na2SO4+SO2↑+H2O③装置——分液漏斗,圆底烧瓶④检验——先通入品红试液,褪色,后加热又恢复原红色;⑤除杂质——通入浓H2SO4(除水蒸气)⑥收集——向上排气法⑦尾气回收——SO2+2NaOH=== Na2SO3+H2O⑹二氧化碳①制取原理——稳定性强酸与不稳定性弱酸盐的复分解②制取方程式——CaCO3+2HClCaCl2+CO2↑+H2O③装置——启普发生器④检验——通入澄清石灰水,变浑浊⑤除杂质——通入饱和NaHCO3溶液(除HCl),再通入浓H2SO4(除水蒸气)⑥收集——排水法或向上排气法⑺氨气①制取原理——固体铵盐与固体强碱的复分解②制取方程式——Ca(OH)2+2NH4ClCaCl2+NH3↑+2H2O③装置——略微向下倾斜的大试管,加热④检验——湿润的红色石蕊试纸,变蓝⑤除杂质——通入碱石灰(除水蒸气)收集——向下排气法⑻氯化氢①制取原理——高沸点酸与金属氯化物的复分解②制取方程式——NaCl+H2SO4Na2SO4+2HCl↑③装置——分液漏斗,圆底烧瓶,加热④检验——通入AgNO3溶液,产生白色沉淀,再加稀HNO3沉淀不溶⑤除杂质——通入浓硫酸(除水蒸气)⑥收集——向上排气法⑼二氧化氮①制取原理——不活泼金属与浓硝酸的氧化—还原;②制取方程式——Cu+4HNO3===Cu(NO3)2+2NO2↑+2H2O③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)④检验——红棕色气体,通入AgNO3溶液颜色变浅,但无沉淀生成⑤收集——向上排气法⑥尾气处理——3NO2+H2O===2HNO3+NONO+NO2+2NaOH===2NaNO2+H2O⑩一氧化氮①制取原理——不活泼金属与稀硝酸的氧化—还原;②制取方程式——Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)④检验——无色气体,暴露于空气中立即变红棕色⑤收集——排水法⑾一氧化碳①制取原理——浓硫酸对有机物的脱水作用②制取方程式——HCOOHCO↑+H2O③装置——分液漏斗,圆底烧瓶④检验——燃烧,蓝色火焰,无水珠,产生气体能使澄清石灰水变浑浊⑤除杂质——通入浓硫酸(除水蒸气)⑥收集——排水法⑿甲烷①制取方程式——CH3COONa+NaOH CH4↑+Na2CO3②装置——略微向下倾斜的大试管,加热③收集——排水法或向下排空气法⒀乙烯①制取原理——浓硫酸对有机物的脱水作用②制取方程式——CH3CH2OH CH2=CH2↑+H2O③装置——分液漏斗,圆底烧瓶,加热④除杂质——通入NaOH溶液(除SO2,CO2),通入浓硫酸(除水蒸气)收集——排水法⒁乙炔①制取原理——电石强烈吸水作用②制取方程式——CaC2+2H2OCa(OH)2+CH CH↑③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)④检验——无色气体,能燃烧,产生明亮的火焰,并冒出浓的黑烟⑤除杂质——通入硫酸铜溶液(除H2S,PH3),通入浓硫酸(除水蒸气)收集——排水法或向下排气法15。
实验基础知识补充
二、常见气体的制备方法(前6个最常考,有下划线的必须熟记)
1.氨气
(1)工业制法(合成氨工业):N 2+3H 2 2NH 3
(2)实验室制法(氯化铵和消石灰混合加热):2NH4Cl+Ca(OH)2 CaCl2+2NH 3 ↑+2H 2O 说明:试管口棉花的作用是支撑固定导管,且减少NH 3与空气的对流,提高氨气的纯度。
(3)实验室快速制氨法:浓氨水滴入到生石灰 (或烧碱或碱石灰 )表面快速产生氨气。
2.氯气
( 1)工业制法
①电解饱和食盐水得到烧碱、氢气和氯气:2NaCl+2H2O 2NaOH +H 2↑+ Cl 2↑
②冶炼钠(或镁)时得到金属和氯气:2NaCl(熔融)2Na + Cl2↑
( 2)实验室制法
①KMnO 4常温氧化浓盐酸: 2KMnO 4+16HCl(浓 ) = 2KCl+2MnCl 2+5Cl2↑+8H 2O
②MnO 2加热氧化浓盐酸: MnO 2+4HCl( 浓 )MnCl2+Cl 2↑+2H2O (与稀盐酸不反应)
3.二氧化硫
( 1)工业制法
①高温煅烧硫铁矿: 4FeS+11O2Fe O +8SO
22 2 3 2
②火法炼铜得到副产物二氧化硫:Cu2S+O22Cu+SO2
③燃烧硫磺得到二氧化硫:S+O2SO2
( 2)实验室制法
①Cu+2H2SO4(浓)CuSO4+SO2↑+2H 2O (向上排空气法收集)
②Na2SO3+ H 2SO4(70%) =Na2SO4+H 2O+SO2↑
说明: 1、浓硫酸的浓度过高会使得溶液中没有H+,反应无法发生;硫酸浓度过低,生成的
SO2与水反应并溶解在溶液中。
2、B 装置的作用是验证SO2具有还原性; B 装置中的现象是紫红色褪色或颜色变浅;
离子方程式为 5SO2+2MnO -4+2H2O===5SO 24-+2Mn2++ 4H+
3、C 装置的作用是验证SO2的氧化性;现象是溶液中产生黄色浑浊
4.氯化氢
(1)工业制法(氢气在氯气中燃烧):H2+Cl 22HCl
(2)实验室制法
① 2NaCl+H 2SO4(浓)Na2SO4+2HCl ↑
②浓硫酸滴入到浓盐酸中快速制备HCl 气体。
5.一氧化氮
( 1)工业制法:
①氨的催化氧化(硝酸工业的第一步反应):4NH3+5O24NO+6H 2O
②NO 2溶于水制硝酸的副产物:3NO 2+H 2O = 2HNO 3+NO
( 2)实验室制法:3Cu+8 HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
6.二氧化氮
(1)工业制法(硝酸工业的第二步反应): 2NO+O 2=2NO 2
(2)实验室制法: Cu+4 HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O (向上排空气法收集)7.乙烯
( 1)工业制法 (石油裂解制乙烯 ) : C4H 10C2H6+C 2H4C8H 18C6H 14+C2H 4 ( 2)实验室制法 (乙醇的消去反应 ) : CH3CH2OH CH2=CH 2↑ +H 2O
8.乙炔
实验室制法 (电石水解法 ):CaC2+2H 2O = Ca(OH)2+C 2H2↑
9.氢气
( 1)工业制法
①水煤气法:(高温还原水蒸气)C+H 2O(g)CO+H 2
②氯碱工业的副产物:(电解饱和食盐水) 2NaCl+2H2O 2 NaOH +H 2↑+ Cl2↑
( 2)实验室制法
①金属与非氧化性强酸反应:Zn+H 2SO4 = ZnSO 4+H 2↑
②金属与强碱溶液反应:2Al+2NaOH+2H 2O = 2NaAlO 2+3H 2↑
10.氧气
(1)工业制法:①分
离液态空气法
②电解氧化铝得到副产物氧气:2Al2O3(熔融)4Al+3O 2↑
③冶炼金属汞、银时得到副产物氧气:2HgO2Hg+O 2↑; 2Ag2O4Ag+O2↑( 2)实验室制法
①高锰酸钾受热分解: 2KMnO 4K 2MnO 4+MnO 2+O 2↑(固加热)
②氯酸钾受热分解: 2KClO 32KCl + 3O 2↑(固+ 固加热)
③双氧水催化分解: 2H2O22H2O+O 2↑(固 + 液不加热)
11.二氧化碳
( 1)工业制法
①高温分解,煅烧大理石:CaCO3 = CaO+CO 2↑
②玻璃工业副产物: SiO2+Na 2CO3 = Na2SiO3+CO 2↑; SiO2+CaCO3 = CaSiO3+CO 2↑
③联碱工业小苏打制纯碱的副产物:2NaHCO3 = Na 2CO3+H 2O+CO 2↑
(2)实验室制法: CaCO3+2HCl=CaCl 2+H 2O+CO 2↑
12.一氧化碳
( 1)工业制法
①水煤气法(高温条件下还原水蒸气): C+H 2O(g)CO+H 2
②焦炭还原二氧化硅(工业制粗硅的副产物):2C+SiO2= Si+2CO↑
(2)实验室制法
①草酸分解法:H2C2O 4 CO ↑+CO 2↑ +H 2O ,混合气体通过碱石灰得到一氧化碳
②甲酸分解法:HCOOH CO↑+H 2O
三、防倒吸装置
1、吸不满
2、吸不着
3、不愿吸(将硫酸换成水呢?可以。
将CCl4换成苯呢?不行)。