(完整版)沪教版初中化学酸碱盐知识点总结,推荐文档
- 格式:doc
- 大小:77.02 KB
- 文档页数:4


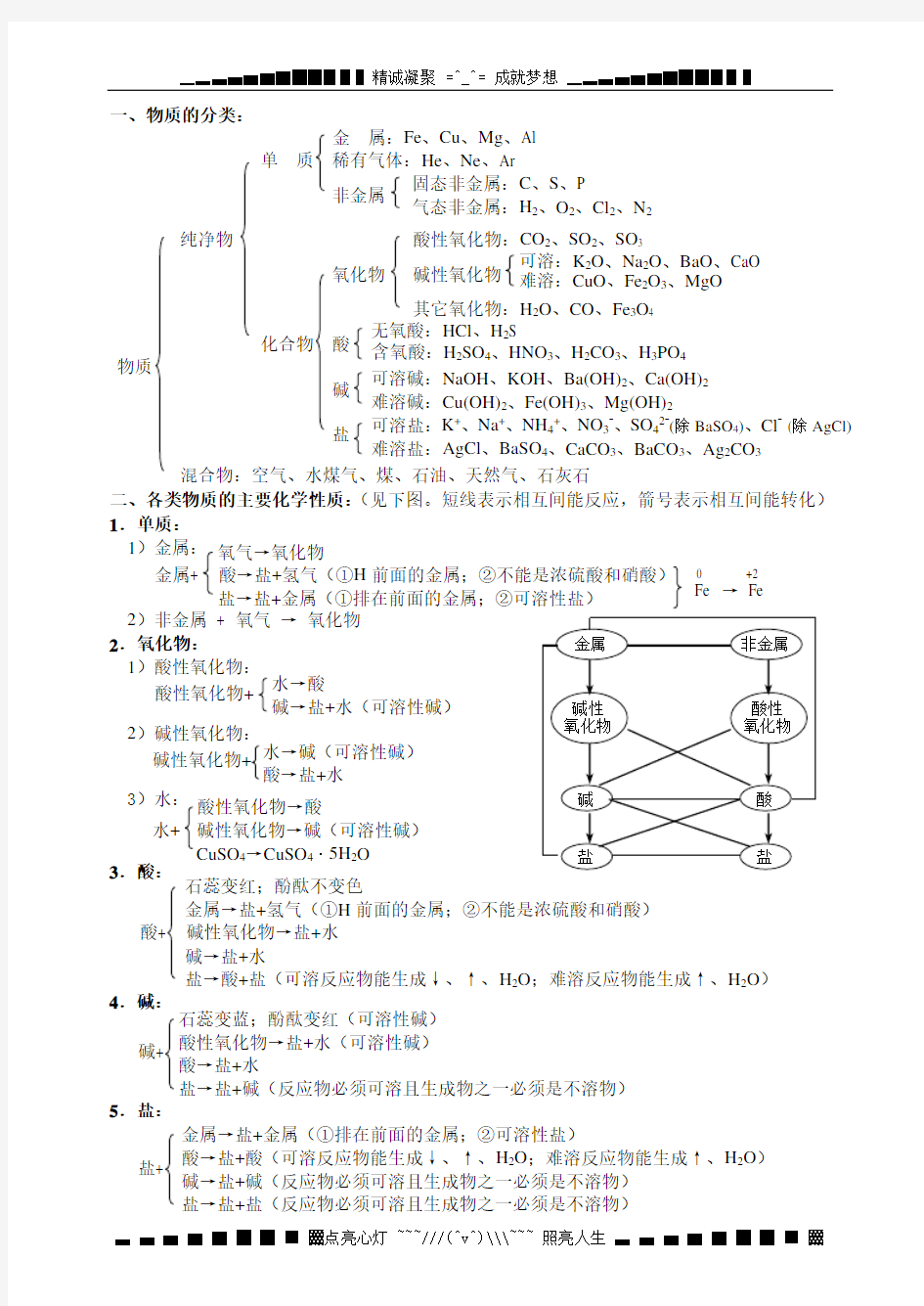
一、物质的分类:
二、各类物质的主要化学性质:(见下图。短线表示相互间能反应,箭号表示相互间能转化)
1.单质:
1)金属: 2)非金属 + 氧气 → 氧化物
2.氧化物: 1)酸性氧化物: 2)碱性氧化物:
3)水: 3.酸:
4.碱:
5.盐:
0 +2 Fe → Fe 氧气→氧化物
金属+ 酸→盐+氢气(①H 前面的金属;②不能是浓硫酸和硝酸) 盐→盐+金属(①排在前面的金属;②可溶性盐)
酸性氧化物+ 水→酸 碱→盐+水(可溶性碱) 碱性氧化物+ 水→碱(可溶性碱)
酸→盐+水 酸性氧化物→酸 水+ 碱性氧化物→碱(可溶性碱) CuSO 4→CuSO 4·5H 2O 石蕊变红;酚酞不变色
金属→盐+氢气(①H 前面的金属;②不能是浓硫酸和硝酸)
酸+ 碱性氧化物→盐+水
碱→盐+水
盐→酸+盐(可溶反应物能生成↓、↑、H 2O ;难溶反应物能生成↑、H 2O )
石蕊变蓝;酚酞变红(可溶性碱)
酸性氧化物→盐+水(可溶性碱) 酸→盐+水
盐→盐+碱(反应物必须可溶且生成物之一必须是不溶物)
碱+ 金属→盐+金属(①排在前面的金属;②可溶性盐) 酸→盐+酸(可溶反应物能生成↓、↑、H 2O ;难溶反应物能生成↑、H 2O ) 碱→盐+碱(反应物必须可溶且生成物之一必须是不溶物) 盐→盐+盐(反应物必须可溶且生成物之一必须是不溶物) 盐+ 金 属:Fe 、Cu 、Mg 、Al 单 质 稀有气体:He 、Ne 、Ar
非金属
纯净物 酸性氧化物:CO 2、SO 2、SO 3
氧化物 碱性氧化物 其它氧化物:H 2O 、CO 、Fe 3O 4
化合物 酸 物质 碱 盐 混合物:空气、水煤气、煤、石油、天然气、石灰石
可溶盐:K +、Na +、NH 4+、NO 3-、SO 42-(除BaSO 4)、Cl - (除AgCl) 难溶盐:AgCl 、BaSO 4、CaCO 3、BaCO 3、Ag 2CO 3 可溶碱:NaOH 、KOH 、Ba(OH)2、Ca(OH)2 难溶碱:Cu(OH)2、Fe(OH)3、Mg(OH)2 无氧酸:HCl 、H 2S 含氧酸:H 2SO 4、HNO 3、H 2CO 3、H 3PO 4 可溶:K 2O 、Na 2O 、BaO 、CaO 难溶:CuO 、Fe 2O 3、MgO 固态非金属:C 、S 、P 气态非金属:H 2、O 2、Cl 2、N 2
三、化学反应的基本类型:
1)化合反应:(有单质时化合价改变)
⑴单质+单质→化合物Mg + O2——P + O2——
⑵单质+化合物→化合物 C + CO2——
⑶化合物+化合物→化合物CaO + H2O ——CuSO4 + H2O ——
2)分解反应:(有单质时化合价改变)
⑴氧化物分解H2O ——HgO ——
⑵酸分解H2CO3——
⑶盐分解KMnO4——KClO3——
CaCO3——CuSO4·5H2O ——
Cu2(OH)2CO3——
3)置换反应:(化合价一定改变)
⑴金属+酸→盐+氢气(①H前面的金属;②不能是浓硫酸和硝酸)
Fe + HCl—Al + H2SO4—
⑵金属+盐→盐+金属(①排在前面的金属;②可溶性盐)
Fe + CuSO4—Cu + AgNO3—
⑶金属氧化物+H2(或C)→金属+水(或CO2)
CuO + H2— C + Fe2O3——
4)复分解反应:(化合价一定不变)
⑴碱性氧化物+酸→盐+水
Fe2O3 + HCl —CuO + H2SO4—
⑵酸+碱→盐+水
NaOH + H2SO4—Fe(OH)3 + HCl —
⑶酸+盐→盐+酸(可溶反应物能生成↓、↑、H2O;难溶反应物能生成↑、H2O)
H2SO4 + BaCl2—HCl + CaCO3—
⑷碱+盐→碱+盐(反应物必须可溶且生成物之一必须是不溶物)
Ca(OH)2 + Na2CO3—NaOH + FeCl3—
⑸盐+盐→盐+盐(反应物必须可溶且生成物之一必须是不溶物)
CaCl2 + K2CO3—Ba(NO3)2 + Na2SO4—
※不属于四种基本类型的反应:
⑴金属氧化物+CO→金属+CO2Fe2O3+ CO ——
⑵碱+酸性氧化物→盐+水(可溶性碱)NaOH + CO2—
⑶有机物+O2→H2O+CO2C2H5OH + O2——
☆氧化还原反应:
得到氧的物质被氧化,发生氧化反应,是还原剂;
失去氧的物质被还原,发生还原反应,是氧化剂。
如:在2Mg+CO2点燃2MgO+C中,是氧化剂,是还原剂,被氧化,被还原。
☆常见的原子团及其化合价:
+1 -1 -2 -2 -1
NH4Cl NaOH H2SO4H2CO3HNO3
铵根氢氧根硫酸根碳酸根硝酸根
铵根中N为-3价;硫酸根中S为+6价;碳酸根中C为+4价;硝酸根中N为+5价。
四、金属活动性顺序和复分解反应发生的条件:
1.金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au ⑴判断金属与酸反应时:金属必须排在(H)前面;酸不可用硝酸。
⑵判断金属与盐反应时:必须同时满足①排在前面的金属;②可溶性盐。
2.复分解反应发生的条件:
⑴可溶的反应物,能生成↓、或H 2O 、或↑(CO 2或NH 3)
⑵难溶的反应物,能生成↑、或H 2O
☆复分解反应生成的沉淀:
五、物质的鉴别、鉴定(检验)、提纯(除杂)、分离:
写出鉴别下列各组物质所需的试剂或方法:
①鉴别Na 2CO 3和CaCO 3: ②鉴别Na 2SO 4和NaCl : ③鉴别H 2和CH 4: 、 ④鉴别Na 2CO 3和NaCl : ⑵鉴定(检验):检验是用一定的化学方法或物理方法将某种物质确定出来的过程。 写出检验下列各物质所需的试剂或方法:
①盐酸: 、 ②Fe 2(SO 4)3: 、 ⑶除杂:除杂是用物理或化学方法除去混合物中的杂质的过程。
写出除去下列各物质中的杂质所需的试剂或方法:
①除去MnO 2中的KCl : ②除去NaOH 中的Na 2CO 3: ⑷提纯:提纯是用物理或化学方法除去混合物中的杂质除去并得到某纯净物的过程。 写出提纯下列各物质的实验步骤及所需的试剂或方法:
①从KCl 与MnO 2的混合物中提纯KCl : 、 、 ②从MgCl 2与CaCl 2的混合物中提纯MgCl 2: 、
、 、 ⑸分离:分离将混合物中的各成分用物理或化学方法分开从而得到各纯净物的过程。 写出分离下列各物质的实验步骤及所需的试剂或方法:
①分离KCl 与MnO 2的混合物; ②分离BaCl 2与NaCl 的混合物。
AgCl BaSO 4 难溶性盐 CaCO 3 BaCO 3 Ag 2CO 3 Mg(OH)2
难溶性碱 Cu(OH)2 Fe(OH)3 (白色) (白色)
(白色) (白色) (白色) (蓝色)
(红褐色)
可溶于酸 难溶于酸 ①所加试剂只与杂质反应,不与主要物质反应; 除杂过程对所加试剂的要求: ②使杂质转化为易与主要物质分离(即状态不同)的物质; ③不能引入新的杂质。