电解质溶液与胶体
- 格式:pptx
- 大小:455.83 KB
- 文档页数:31

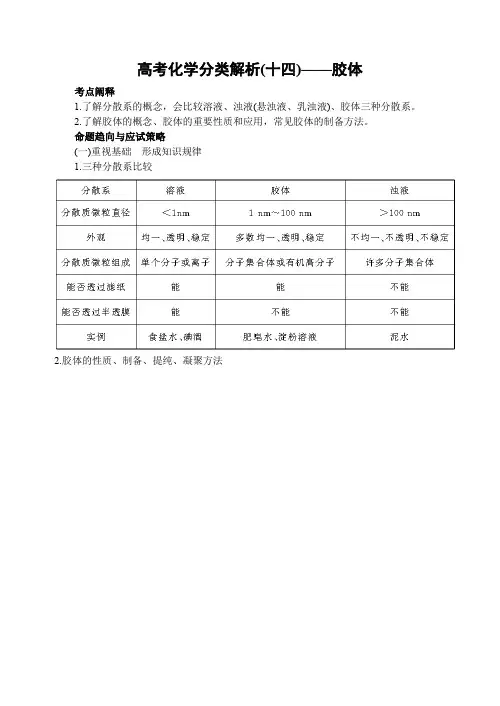
高考化学分类解析(十四)——胶体考点阐释1.了解分散系的概念,会比较溶液、浊液(悬浊液、乳浊液)、胶体三种分散系。
2.了解胶体的概念、胶体的重要性质和应用,常见胶体的制备方法。
命题趋向与应试策略(一)重视基础形成知识规律1.三种分散系比较2.胶体的性质、制备、提纯、凝聚方法(二)分析热点把握命题趋向分散系包括溶液、浊液、胶体三部分内容,其高考的热点有:分散系有关概念的理解,常见分散系的比较与判断,胶体的重要性质与应用。
命题主要集中在对胶体的制备。
胶体的性质和胶体提纯(渗析法)的考查上。
题目类型主要为选择题,解答的关键是要把握胶体是一种分散系,其胶粒直径在1 nm~100 nm之间,因此具有丁达尔现象、布朗运动、电泳、渗析及凝聚等特性。
纵观这几年有关考查胶体知识的试题,命题有向着考查胶体的基本知识与科技、生活、生产相结合的问题发展的趋势。
[例题]“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中。
所谓“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,如将纳米材料分散到分散剂中,所得混合物可能具有的性质是(1 nm=10-9 m)A.能全部透过半透膜B.有丁达尔现象C.所得液体可能呈胶状D.所得物质一定是浊液解析:纳米材料粒子直径为几个nm至几十个nm,介于胶体的分散质粒子直径 1 nm~100 nm之间,所以纳米材料形成的分散系属于胶体范围,具有胶体性质,不能透过半透膜,具有丁达尔现象等。
答案:B试题类编选择题1.将饱和FeCl3溶液分别滴入下述液体中,能形成胶体的是A.冷水B.沸水C.NaOH浓溶液D.NaCl浓溶液2.氯化铁溶液与氢氧化铁胶体具有的共同性质是A.分散质颗粒直径都在1 nm~100 nm之间B.能透过半透膜C.加热蒸干、灼烧后都有氧化铁生成D.呈红褐色3.下列过程中不涉及化学变化的是A.甘油加水作护肤剂B.用明矾净化水C.烹鱼时加入少量的料酒和食醋可减少腥味,增加香味D.烧菜用过的铁锅,经放置常出现红棕色斑迹4.下列关于胶体的叙述不正确的是A.布朗运动是胶体微粒特有的运动方式,可以据此把胶体和溶液、悬浊液区别开来B.光线透过胶体时,胶体发生丁达尔现象C.用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过D.胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象5.用特殊方法把固体物质加工到纳米级(1~10 nm,1 nm=10-9m)的超细粉末粒子,然后制得纳米材料。

第十三章胶体溶液1861年英国科学家Graham T使用胶体(colloid)这个名词来描述扩散速度小,不能透过如羊皮纸一类的半透膜,溶剂蒸发后不结晶而形成无定形胶状物的物质。
四十多年后,俄国科学家Веймарн(韦曼)研究了200多种物质,证明任何能结晶的物质在一定介质中用适当的方法都能成为胶体。
后来胶体的概念改变为物质的一种分散状态,“胶体”的涵意就是高度分散的意思,准确地讲,粒子大小范围在1 100nm的物质称为胶体。
一些高分子物质粒子的大小与前述胶体物质具有共性,属于胶体研究的范围;随着二十世纪三十年代以后高分子研究的发展,阐明了这些物质中因存在柔性程度不同的线性长链而又具有其自身的本质特征。
液体介质中,胶体的质点也可由许多较小的两亲性分子(分子具亲水的极性基团和亲油的碳键烃基)缔合而成,此类胶体称为缔合胶体。
胶体系统在医学上有特殊的实际意义。
在活的机体、组织和细胞结构中,作为基础的物质如蛋白质、核酸、淀粉、糖原、纤维素等是由链状分子组成的,且体液具有胶体系统的性质。
哺乳动物的乳汁是油脂和酪蛋白等物质分散在水中所成的乳状液;将药材制成乳状液,有剂量大、疗效好的优点。
乳状液也属于胶体化学讨论的内容。
第一节分散系统和胶体分散系一、分散系统及其分类一种或数种物质分散在另一种物质中所形成的系统称为分散系(dispersed system)。
例如矿物分散在岩石中生成矿石,水滴分散在空气中形成云雾,聚苯乙烯分散在水中形成乳胶,溶质分散在溶剂中形成溶液等。
被分散的物质称为分散相(dispersed phase),容纳分散相的连续介质称为分散介质(dispersed medium)。
按照分散相粒子的大小,可以把分散系分为真溶液、胶体分散系和粗分散系三类(表13-1),它们具有不同的扩散速度、膜的通透性和滤纸的通透性能。
真溶液的分散相粒子小于1nm,粗分散系分散相粒子大于100nm,介于两者之间的是胶体分散系。


胶体粒子的结构与胶体的聚沉一,胶体的结构以AgI胶体为例说明胶体的形成及结构:1.胶核及吸附①胶核的形成若将稀溶液与KI稀溶液混合后,将发生如下的化学反应:生成m个AgI分子聚集成直径为1nm~100nm范围内的微晶粒子是分散质的核心,称之为胶核.②胶核的选择性吸附体系中有多种离子,如等,胶核吸附何者实验表明胶核选择性吸附与其组成有关,浓度较大的离子,例如制备AgI时,如果KI过量,胶核就优先吸附了n个而带负电荷,反之,若过量,则吸附了n个而带正电荷.③反离子的分布与体系中的胶核所带电荷电性相反的离子称为反离子,如KI过量时的或过量时的就是反离子,体系中的反离子受到两种相反的作用力.静电作用力:由于反离子带有与胶核表面电荷电性相反的电荷,所以反离子与胶核间将产生静电作用,使反离子尽量靠近胶核分布.分子热运动:反离子在不停地运动之中,这种运动驱使反离子趋向均匀分布.静电作用和分子热运动共同作用的结果,使体系反离子按一定的梯度分布,即自胶核表面向外,单位体积的反离子数目越来越少.2.胶粒与胶团靠近胶粒表面的n-x个反离子,由于受到较强的静电作用,因而较紧密地束缚在胶核周围,与胶核表面吸附的离子共同组成吸附层,吸附层与胶核构成胶粒.胶粒与扩散层包括在一起称为胶团.较外层的x个反离子,由于受到静电作用力很弱,很疏松地分布在胶粒的周围,称为扩散层.从胶团的结构可知,由于吸附层内离子或离子数目少于或,因此胶粒是带电的,但整个胶团是电中性的.由于扩散层并不与胶粒一起运动,因此,在外电场作用下,胶粒作为一个整体而向某一电极移动,而扩散层的离子移向另一电极.二,胶体的稳定性与聚沉1.胶体的稳定性从理论上讲,胶体是热力学不稳定体系,胶粒有相互聚集成大颗粒而沉降析出的趋势.然而实际上经过纯化的胶体往往可以保存数日甚至更长时间也不会沉降析出.其原因主要有以下两点:①胶粒的静电作用同一体系胶粒带有同种电荷,相互排斥,阻止了胶粒的靠近,聚集.②水化膜的保护作用胶粒中的吸附离子和反离子都是水化的(即离子外围包裹着水分子),所以胶粒是带水化膜的粒子.水化膜犹如一层弹性隔膜,起到了防止运动中的胶粒在碰撞时相互聚集变大的作用. 2.胶体的聚沉胶体的稳定性是相对的,是有条件的.只要减弱或消除使胶体稳定的因素,就能使胶体胶粒聚集成较大的颗粒而沉降,这种使胶粒聚集成较大颗粒而沉降的现象称为聚沉.(1)电解质对胶体的聚沉作用在胶体体系中,加入少量电解质后,增加了体系中离子的浓度,将有较多的反离子挤入吸附层,从而减少甚至完全中和了胶粒所带的电荷,使胶粒之间的相互斥力减少甚至丧失,导致胶粒聚集合并变大,最终从胶体中聚沉下来.聚沉规律有以下两点:①电解质对胶体的聚沉作用,主要是由与胶粒电性相反的离子引起的,这种离子的价数越高,其聚沉值越大.②同价离子的聚沉能力虽相近,但也略有不同,半径大的离子聚沉能力强.(2)胶体的相互聚沉作用将两种带相反电荷的胶体以适当的比例混合也会发生聚沉.如所带电荷相互抵消,形成较大颗粒,产生聚沉.由蛋白质离心想到的一种或几种物质分散在另一种介质中所形成的体系称为分散系。


胶体电荷测定技术指南【知乎文章】胶体电荷测定技术指南胶体电荷是指胶体颗粒表面所带的电荷性质,它在胶体化学和界面科学研究中扮演着重要的角色。
准确测定胶体电荷可以帮助我们深入了解胶体颗粒间的相互作用机制以及它们在溶液中的行为。
本文将为你介绍胶体电荷测定的基本原理、常用的技术方法以及其在实际应用中的意义。
一、胶体电荷测定的基本原理胶体颗粒表面的电荷来源于离子溶解和离子交换等过程。
在溶液中,由于离子化作用,水分子会被离子化为正负带电的“水合离子”。
当胶体颗粒与水分子接触时,这些水合离子会吸附在胶体颗粒表面,形成电荷层,从而使胶体颗粒带有电荷。
胶体电荷的性质和强度决定了胶体颗粒之间的相互作用力,进而影响了胶体溶液的流变性质和稳定性。
准确测定胶体电荷对于研究胶体体系的行为至关重要。
二、胶体电荷测定的常用技术方法1. 电动势(zeta potential)测定法电动势是表征胶体颗粒表面电荷的重要参数,它可以通过测量胶体颗粒在电场中的运动速度来确定。
电动势测定法常用的仪器是激光多普勒仪或光散射仪。
该方法的优点是测量简单、需要样品量少,并且可以获得胶体颗粒表面电位的准确数值。
然而,该方法对胶体样品的稀释要求较高,且结果受溶剂pH、离子强度等因素影响较大。
2. 电泳法电泳法是通过观察胶体颗粒在外加电场下的电泳迁移来确定胶体电荷的方法。
该方法利用电泳现象,即胶体颗粒在电场中由于电荷的作用而产生的运动,来间接反映胶体颗粒表面的电荷状态。
相比于电动势测定法,电泳法的优点是无需稀释样品,适用范围更广。
但是,该方法需要测定胶体溶液中胶体颗粒的迁移速度,因此样品的处理和测量条件要求较高。
3. 离子选择电极法离子选择电极法是一种基于离子选择电极原理的胶体电荷测定方法。
该方法利用特定的离子选择电极来测量溶液中胶体颗粒表面电荷的变化,从而推断胶体颗粒的电荷性质。
离子选择电极法的优点是操作简便、测量快速,适用于胶体颗粒表面电荷性质较简单的情况。

胶粒所带电荷的断定方法游建德胶体本身都具有较大的表面积,绝大多数在溶液中会吸附某些离子而形成胶粒带上相应的电荷。
如何快而准判断胶粒所带电荷?笔者总结以下四法,以飨读者。
方法一:依据规律断定一般来说,金属氢氧化物、金属氧化物的胶体粒子带正电荷;非金属氧化物、金属硫化物的胶体粒子带负电荷。
例1. 在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量的问题,解决方法之一是把这些陶土和水一起搅拌,使粒子直径在之间,然后插入两根电极,接通直流电源,这时阳极聚集___________,阴极聚集___________,理由是___________。
分析:由于形成了陶土(主要成分为)胶体粒子(带负电荷)及氧化铁胶体粒子(带正电荷),带相反电荷的胶体粒子通电时产生电泳现象,分别向两极移动,阳极聚集陶土胶体粒子,阴极聚集氧化铁胶体粒子。
答案:陶土氧化铁陶土胶体粒子带负电荷,氧化铁胶体粒子带正电荷,在通电条件下分别向相反的两极移动方法二:依据带电荷不同的胶粒相遇现象断定两种不同电荷的胶粒相遇会相互凝聚,而同种电荷的胶粒相遇互不凝聚,故据此可判定胶粒所带电荷。
例2. 有甲、乙、丙、丁和五种溶液,按甲和乙、丙和丁、乙和丁、甲和胶体两两混合均出现沉淀,则上述溶胶中胶体粒子带正电荷的是_____________。
分析:由于胶体带负电荷,且与甲相遇产生沉淀,可知甲带正电荷,同理:乙带负电荷,丁带正电荷,丙带负电荷。
答案:甲、丁方法三:依据胶体粒子产生电泳现象断定带电荷的胶体粒子均能产生电泳现象,规律为:带正电荷的胶体粒子向阴极(即与外加电源负极相连一极)移动,带负电荷胶粒向阳极(即与外加电源的正极相连一极)移动,可据此判定胶粒所带电荷。
例3. 向盛有沸水的小烧杯中滴入溶液,然后将此溶液倒入U形管里并加外电源,最后加溶液到U形管里,简述上面实验过程中发生的现象并写出有关的化学方程式。
分析:将滴到沸水中会产生红褐色胶体,通电产生电泳现象,因胶粒带正电荷,故向阴极移动,导致阴极颜色加深,若再加电解质则产生凝聚,即有红褐色沉淀产生。



牛奶是溶液吗
不是溶液。
1、牛奶是“胶体”,是介于溶液和浊液之间的物质,胶体又称胶状分散体是一种
较均匀混合物,在胶体中含有两种不同状态的物质,一种分散相,另一种连续相。
2、分散质的一部分是由微小的粒子或液滴所组成,分散质粒子直径在1~100nm之
间的分散系是胶体;胶体是一种分散质粒子直径介于粗分散体系和溶液之间的一类分
散体系,这是一种高度分散的多相不均匀体系。
3、溶液是由至少两种物质组成的均一、稳定的混合物,被分散的物质(溶质)以
分子或更小的质点分散于另一物质(溶剂)中。物质在常温时有固体、液体和气体三
种状态。
4、因此溶液也有三种状态,大气本身就是一种气体溶液,固体溶液混合物常称固
溶体,如合金。一般溶液只是专指液体溶液。液体溶液包括两种,即能够导电的电解
质溶液和不能导电的非电解质溶液。所谓胶体溶液,更确切的说应称为溶胶。
5、其中,溶质相当于分散质,溶剂相当于分散剂。在生活中常见的溶液有蔗糖溶
液、碘酒、澄清石灰水、稀盐酸、盐水、空气等。
胶体电泳原理是什么
胶体电泳原理是一种将带电胶体粒子分离和纯化的方法。
它利用电场的作用,将带电胶体粒子在电场中迁移,通过胶体粒子的迁移速度差异,实现不同粒径大小、表面电荷、形态等特性的分离。
具体原理如下:
1. 胶体粒子带电:在水溶液中,胶体粒子表面通常带有电荷,可能是正电荷或负电荷。
这种电荷来源于溶液中的电解质、胶体粒子的自身电离或吸附的电解质。
2. 电场作用:通过在胶体分散体系中施加一个外加电场,胶体粒子会受到电场力的作用,向电极迁移。
正电荷粒子向阴极迁移,而负电荷粒子则向阳极迁移。
3. 分离:由于胶体粒子之间的迁移速度差异,不同表面电荷、粒径大小的胶体粒子将在电场作用下分散迁移,并最终达到分离的效果。
4. 操作参数:胶体电泳过程中的操作参数对分离效果有着重要影响,如电场强度、胶体粒子之间的排斥或吸引作用、溶液pH值、胶体粒子浓度等。
总的来说,胶体电泳原理是利用带电胶体粒子在电场作用下的迁移差异,实现对胶体粒子的分离和纯化。
晶体液与胶体液
临床常用液体根据其分子大小及是否可以自由透过毛细血管壁分为晶体液和胶体液
一.晶体液Crystalloids
(一)晶体溶液特点
小分子溶液
不能自由透过细胞膜
可以自由透过毛细血管
在血管内存留时间短,半衰期20-30分
维持细胞内外水分的相对平衡
纠正电解质紊乱
价格便宜
(二)晶体溶液分类:按其是否导电分为电解质溶液和非电解质溶液1.电解质溶液
0.9%氯化钠
复方氯化钠
乳酸林格液:等渗电解质平衡液
5%碳酸氢钠
2.非电解质溶液(主要是各浓度的葡萄糖溶液)
5%葡萄糖
10%葡萄糖
25%葡萄糖
50%葡萄糖
(三)主要适应症
1.用于组织间隙容量替代和维持
2.用于液体复苏和液体维持治疗二.胶体液colloids
(一)胶体溶液特点
分子量较大
不能透过毛细血管壁
在血管内存留时间长,半衰期长
有效维持血浆胶体渗透压
增加血容量,提高血压
改善微循环
价格相对贵一些
(二)胶体溶液分类
1.天然胶体Natural colloids
全血:新鲜全血;贮存全血
血浆:冷冻血浆;新鲜冷冻血浆
白蛋白:5%白蛋白;25%白蛋白
2.人工合成胶体Synthetic colloids
氧化聚明胶
右旋糖酐40
右旋糖酐70
羟乙基淀粉
喷他淀粉
(三)主要适应症
1.用于血管内容量替代
2.合成胶体适合于液体复苏。