蛋白酶抑制分类和应用
- 格式:doc
- 大小:190.50 KB
- 文档页数:7

昆虫天然蛋白酶抑制剂的结构和功能研究昆虫是我们生活中不可或缺的一部分,除了充当着自然界中的生态平衡维护者之一外,昆虫还能为生物学、医学、农业等领域的研究带来很大的帮助。
而其中的昆虫天然蛋白酶抑制剂(PKI)也成为了人们长期以来所关注的研究热点之一。
PKI是一类由昆虫体征生产的抑制蛋白,它的主要作用是在昆虫机体中,对内源性的消化酶发挥抑制作用。
与此同时,PKI也有着极高的生物活性,可以在其它领域的生命体内发挥作用。
因此,为了更好的了解昆虫天然蛋白酶抑制剂的结构和功能,人们通过不断的研究和创新,在这方面中取得了许多成果。
从结构上来看,PKI具有多种形式和分子量。
其中主要有分子量为8-10kDa的小分子聚体和分子量为20-70kDa的高分子聚体。
这些PKI的分子结构具有高度的多样性,表现为: 在原构计算上呈现出不同的构象,从而发挥不同的生物功能。
在功能上,PKI主要分为胰蛋白酶抑制剂、胰蛋白酶类似物、氨基蛋白酶抑制剂等多个亚型,并且各亚型之间的生物功能有着很大的差异。
除了结构和功能,PKI还具有着其他的特性。
例如,在昆虫进食时,由于昆虫口耳相连,由口进入的有对虫卵、寄生虫和细菌等多种外来物质,PKI正式作为一种防卫性蛋白,它可以抑制这些外来物质的消化酶,从而保护昆虫体内部分机能的正常运作。
而在其它领域中,PKI也表现出了很高的生物活性,如在医学领域上PKI结构可以用于生物药物的研制。
在这方面中,PKI可以用于人体和动物体内药物的研制和研究,从而帮助人们更好地对其对人体的影响和使用方式进行了解。
总的来说,昆虫天然蛋白酶抑制剂是目前人们关注的研究热点之一。
通过对PKI结构和功能的研究,不仅可以对昆虫体内生物学机制进行深入理解,同时也可以为其它领域发展提供帮助。
相信在未来的发展中,我们能够通过对PKI结构和功能的研究,更好地理解这种天然蛋白抑制剂在生命体内部的作用机制,并发挥更多的作用。

文章编号: 1000-1336(2011)02-0238-06白细胞弹性蛋白酶抑制剂胡显腾 宋 歌 孔令超 刘小宇第二军医大学生物化学与分子生物学教研室,上海 200433摘要:人白细胞弹性蛋白酶广泛参与体内的组织损伤反应,与炎症反应、自身免疫、肿瘤形成和转移等有密切关系。
目前人白细胞弹性蛋白酶抑制剂已成为新药开发的热点,具有很高的应用价值,其中西维来司钠已经成功进入市场。
本文对近几年发现的人白细胞弹性蛋白酶抑制剂的结构及其作用进行综述。
关键词:人白细胞弹性蛋白酶;抑制剂;西维来司钠中图分类号:Q71;Q74收稿日期:2010-07-12第二军医大学大学生创新能力培养计划基金项目(MS2009029)资助作者简介:胡显腾(1987-),男,本科生,E-mail: thefalling snow@ ;宋歌(1988-),男,本科生,E-mail :sganthem @ ;孔令超(1988-),男,本科生,E-mail :790215986@ ;刘小宇(1971-),女,硕士,副教授,通讯作者,E-mail :liuxiaoyu8888@人白细胞弹性蛋白酶(human leukocyte elastase, HLE),是多形核白细胞(polymorphonuclear leukocyte, PMNL)因受炎症刺激而释放出的一种破坏性丝氨酸蛋白酶[1],其功能酶包含218个氨基酸残基,构成两个β-桶状(β-barrel)结构域,由4个二硫键维持稳定[2],定位于多形核白细胞嗜苯胺蓝颗粒中,可以水解纤连蛋白、胶原、软骨等组织连接成分[3]。
细胞因子、内毒素、血小板活化因子(platelet-activating factor, PAF)和甲酰甲硫氨酰亮氨酰苯丙氨酸(N-formyl-methionyl-leucylphenylalanine, fMLP)可激活HLE 的释放[4],同时,HLE 的作用也受某些内源性抑制因子,如α1蛋白酶抑制剂、α2-巨球蛋白和HLE 抑制因子的调控[5]。

酶抑制剂的发展和应用研究酶抑制剂是一类能够抑制酶活性的化合物。
它们可以通过与酶结合,抑制酶的活性,从而阻碍生物体内的某些代谢过程。
酶抑制剂广泛应用于医学、农业和食品加工等领域。
在这篇文章中,我们将探讨酶抑制剂的发展和应用研究。
一、酶抑制剂的发展1.1 早期酶抑制剂最早的酶抑制剂是抗生素。
抗生素可以抑制细菌体内的某些代谢酶活性,从而有效地杀死细菌。
然而,由于抗生素的应用广泛,细菌很快就会产生耐药性,严重影响了抗生素的临床应用。
1.2 新型酶抑制剂随着生物技术的迅速发展,酶抑制剂的研究也不断取得进展。
近年来,利用计算机辅助设计,研发了一系列新型酶抑制剂,如蛋白酶抑制剂、糖苷酶抑制剂、酸类抑制剂等。
这些新型酶抑制剂具有高效、低毒性、广谱性等优点,已经成为临床应用研究的热点之一。
二、酶抑制剂的应用研究2.1 药物研究酶抑制剂在药物研究中有着广泛的应用。
例如,利用蛋白酶抑制剂可以抑制癌细胞的生长和扩散,从而有效地治疗多种恶性肿瘤。
此外,糖苷酶抑制剂也被广泛应用于治疗糖尿病和肥胖症等疾病。
2.2 农业研究酶抑制剂在农业研究中也有着广泛的应用。
例如,利用植物生长调节剂和酶抑制剂可以有效地提高作物产量和品质。
此外,酶抑制剂还被广泛用于植物和动物的疫苗研究中。
2.3 食品加工研究酶抑制剂在食品加工研究中也有着重要的应用。
例如,利用酶抑制剂可以有效地控制酵母生长,从而延长面包的保鲜期。
此外,酶抑制剂还可以用于葡萄酒和啤酒等酒类的生产。
总之,酶抑制剂的发展和应用研究已经成为当前生物技术研究的热点之一。
未来,我们可以预见,新型的酶抑制剂将会不断涌现,并且在医学、农业和食品加工等领域发挥更为广泛的作用。


常用抗病毒药物的作用机制和特点抗病毒药物是一类被广泛使用于治疗各种病毒感染的药物。
它们通过不同的作用机制来抵制病毒的复制和传播,从而达到抗病毒的效果。
本文将介绍几种常用抗病毒药物的作用机制和特点。
一、核苷类似物核苷类似物是一类通过模拟自然核苷酸入侵病毒基因组并抑制病毒复制的药物。
它们通过与病毒复制时所需的核苷酸结合,阻断病毒的核酸合成。
常见的核苷类似物药物包括阿昔洛韦、利巴韦林等。
这些药物在治疗疱疹病毒、带状疱疹病毒等病毒感染时表现出良好的疗效。
二、蛋白酶抑制剂蛋白酶抑制剂是一类能够抑制病毒蛋白酶活性的药物。
病毒蛋白酶是病毒复制过程中必需的酶类,它参与了病毒的蛋白质合成和成熟过程。
通过抑制病毒蛋白酶的活性,蛋白酶抑制剂能够阻断病毒的复制和传播。
例如,草果糖基苷和洛匹那韦等抗人免疫缺陷病毒(HIV)药物就属于蛋白酶抑制剂类药物。
三、中和剂中和剂是一类通过与病毒颗粒结合,阻断病毒与宿主细胞结合的药物。
一般来说,病毒入侵宿主细胞的过程需要先与细胞表面的受体结合,然后进入细胞内部进行复制。
中和剂能够结合病毒表面的结构蛋白,阻断病毒与受体的结合,从而抑制病毒的侵染。
例如,恩替卡韦是一种中和剂药物,常用于治疗流感病毒感染。
四、干扰素干扰素是一类具有抗病毒活性的蛋白质。
它能够刺激宿主细胞产生一系列抗病毒蛋白,从而抑制病毒的复制和传播。
干扰素还能够增强宿主细胞的免疫功能,提高机体对病毒感染的抵抗能力。
干扰素主要用于治疗乙型肝炎、丙型肝炎、乙型人类免疫缺陷病毒(HIV)感染等病毒性疾病。
总结起来,常用抗病毒药物的作用机制和特点各有不同。
核苷类似物通过干扰病毒的核酸合成来抑制病毒复制;蛋白酶抑制剂通过抑制病毒蛋白酶的活性来阻断病毒的复制和传播;中和剂通过阻断病毒与宿主细胞的结合来抑制病毒侵染;干扰素则通过增强机体的免疫功能来抵抗病毒感染。
这些药物在临床应用中具有重要的疗效,但也需要在医生的指导下合理使用,以确保疗效和安全性的平衡。
蛋白酶的分类及酶切位点氨基酸0.ppt氨基酸的名称与符号alanine 丙氨酸Ala Aarginine 精氨酸Arg Rasparagine 天冬酰氨Asn Asx Naspartic acid 天冬氨酸Asp Asx Dcysteine 半胱氨酸Cys Cglutamine 谷氨酰胺Gln Glx Qglutamic acid 谷氨酸Glu Glx Eglycine 甘氨酸Gly Ghistidine 组氨酸His Hisoleucine 异亮氨酸Ile Ileucine 亮氨酸Leu Llysine 赖氨酸Lys Kmethionine 甲硫氨酸Met Mphenylalanine 苯丙氨酸Phe Fproline 脯氨酸Pro Pserine 丝氨酸Ser Sthreonine 苏氨酸Thr Ttryptophan 色氨酸Trp Wtyrosine 酪氨酸Tyr Yvaline 缬氨酸Val V血清终止胰酶消化的原理血清终止的原理其实是竞争抑制。
就是用过量的牛血清中含有的蛋白来和胰酶结合。
不给胰酶消化细胞蛋白的机会。
细胞传代时,血清为什么能终止胰酶消化?胰蛋白酶的酶切位点是肽链的Lys和Arg两个残疾的羧基端肽键,血清的加入可使酶饱和,严格上说不是竞争性抑制,因为血清蛋白不是抑制剂,还是底物!什么样的细胞不能用胰酶-EDTA消化植物细胞不能用胰酶-EDTA消化,要用纤维素酶消化。
应该是肿瘤细胞吧。
正常的细胞,貌似都需要用胰酶或者胶原酶消化。
EDTA-胰酶,只不过是在胰酶里加入了EDTA而已。
EDTA是乙二胺四乙酸,一种金属螯合剂。
一般和胰蛋白酶配合使用。
原因在于,钙,镁等金属离子会降低胰酶活力,故在使用胰酶消化液时要配合加入EDTA。
它可以螯合这些离子,消除对胰酶的抑制。
干细胞饲养层制作中,胰酶—EDTA消化成纤维细胞(MEF)时,EDTA的作用是什么?应该是胰酶分散细胞,EDTA鳌合金属离子使金属酶失活《军医进修学院学报》1992年02期加入收藏投稿正常人血浆蛋白酶解产物对胃癌细胞肺转移抑制作用的研究焦顺昌赵东海黄昌霞王洪海【摘要】:本文采用胰凝乳蛋白酶和胃蛋白酶联合消化方法得到正常人血浆(NHP)有限蛋白酶解产物(NHP-EP)。


蛋白酶的分类及酶切位点氨基酸0.ppt氨基酸的名称与符号alanine 丙氨酸Ala Aarginine 精氨酸Arg Rasparagine 天冬酰氨Asn Asx Naspartic acid 天冬氨酸Asp Asx Dcysteine 半胱氨酸Cys Cglutamine 谷氨酰胺Gln Glx Qglutamic acid 谷氨酸Glu Glx Eglycine 甘氨酸Gly Ghistidine 组氨酸His Hisoleucine 异亮氨酸Ile Ileucine 亮氨酸Leu Llysine 赖氨酸Lys Kmethionine 甲硫氨酸Met Mphenylalanine 苯丙氨酸Phe Fproline 脯氨酸Pro Pserine 丝氨酸Ser Sthreonine 苏氨酸Thr Ttryptophan 色氨酸Trp Wtyrosine 酪氨酸Tyr Yvaline 缬氨酸Val V血清终止胰酶消化的原理血清终止的原理其实是竞争抑制。
就是用过量的牛血清中含有的蛋白来和胰酶结合。
不给胰酶消化细胞蛋白的机会。
细胞传代时,血清为什么能终止胰酶消化?胰蛋白酶的酶切位点是肽链的Lys和Arg两个残疾的羧基端肽键,血清的加入可使酶饱和,严格上说不是竞争性抑制,因为血清蛋白不是抑制剂,还是底物!什么样的细胞不能用胰酶-EDTA消化植物细胞不能用胰酶-EDTA消化,要用纤维素酶消化。
应该是肿瘤细胞吧。
正常的细胞,貌似都需要用胰酶或者胶原酶消化。
EDTA-胰酶,只不过是在胰酶里加入了EDTA而已。
EDTA是乙二胺四乙酸,一种金属螯合剂。
一般和胰蛋白酶配合使用。
原因在于,钙,镁等金属离子会降低胰酶活力,故在使用胰酶消化液时要配合加入EDTA。
它可以螯合这些离子,消除对胰酶的抑制。
干细胞饲养层制作中,胰酶—EDTA消化成纤维细胞(MEF)时,EDTA的作用是什么?应该是胰酶分散细胞,EDTA鳌合金属离子使金属酶失活《军医进修学院学报》1992年02期加入收藏投稿正常人血浆蛋白酶解产物对胃癌细胞肺转移抑制作用的研究焦顺昌赵东海黄昌霞王洪海【摘要】:本文采用胰凝乳蛋白酶和胃蛋白酶联合消化方法得到正常人血浆(NHP)有限蛋白酶解产物(NHP-EP)。


一、蛋白酶的分类、主要用途及作用二、产蛋白酶菌株的筛选三、产酶发酵四、蛋白酶活性测定的方法蛋白酶的分类、主要用途及作用酶:酶是具有生物催化功能的生物大分子。
蛋白酶:水解蛋白质肽键的一类酶的总称蛋白酶分类:1据水解多肽的方式分为内肽酶和外肽酶2据反应的最适pH值分为酸性,碱性,中性蛋白酶蛋白酶简介:广泛存在于动物内脏、植物茎叶、果实和微生物中。
微生物蛋白酶,主要由霉菌、细菌,其次由酵母、放线菌生产。
催化蛋白质水解的酶种类很多,重要的有胃蛋白酶、胰蛋白酶、组织蛋白酶、木瓜蛋白酶和枯草杆菌蛋白酶等。
蛋白酶对所作用的底物有严格的选择性,一种蛋白酶只能作用于蛋白质分子中一定的肽键,如胰蛋白酶催化水解碱性氨基酸所形成的肽键。
蛋白酶分布广泛,主要存在于人和动物消化道中,在植物和微生物中含量丰富,由于动植物资源有限,工业生产上生产蛋白酶制剂主要利用枯草杆菌等微生物发酵设备。
一、酸性蛋白酶定义:酸性蛋白酶是一种能在酸性环境下水解蛋白质的酶类注:酸性蛋白酶是指蛋白酶具有较低的最适pH,不是指酸性基团存在于酶的活性部位.简介:主要来源于动物的脏器和微生物分泌物,包括胃蛋白酶、凝乳酶和一些微生物蛋白酶。
根据其产菌的不同,微生物酸性蛋白酶可以分为霉菌酸性蛋白酶、酵母菌酸性蛋白酶和担子菌酸性蛋白酶,根据作用方式可以分为两类:一类是与胃蛋白酶相似,主要的产酶微生物是曲霉、青霉和根酶等;另一类是与凝乳酶相似,主要产酶微生物是毛酶和栗疫酶等,从酶的活力-PH曲线分析,在酶的活性部位中含有一个或更多的羧基,这一类蛋白酶中研究最彻底的是胃蛋白酶。
酸性蛋白酶具有较好的耐酸性,目前用于工业化生产的酸性蛋白酶大多为霉菌酸性蛋白酶,此类酶的最适作用pH值为3.0左右,当pH值升高时,酸性蛋白酶的酶活会明显降低,且此类酶不耐热,当温度达到50℃以上时很不稳定,从而限制了酸性蛋白酶的应用范围。
基本性质酸性蛋白酶的最适PH从2左右(胃蛋白酶)到4左右应用1酿酒:酸性蛋白酶在酿酒的过程中起协同作用,具有溶解发酵原料,促进微生物繁殖,降解酵母菌体蛋白等多种功能。
抗HIV药物种类抗HIV药物种类:HIV(Human Immunodeficiency Virus)即人类免疫缺陷病毒,是导致艾滋病(AIDS)的主要病因。
艾滋病是一种严重的免疫系统疾病,对患者的健康和生命构成了严重威胁。
然而,自20世纪80年代HIV 被发现以来,医学界已取得了巨大的进展,通过研发出多种抗HIV药物,有效地控制了病症的进展。
本文将详细介绍目前已知的主要抗HIV药物种类。
1.核苷类逆转录酶抑制剂(Nucleoside Reverse Transcriptase Inhibitors,NRTIs)核苷类逆转录酶抑制剂通过抑制病毒复制过程中关键酶逆转录酶的活性,阻断病毒的复制,从而抑制HIV的繁殖。
常见的核苷类逆转录酶抑制剂有:阿巴卡韦(Abacavir)、拉米夫定(Lamivudine)、特诺福韦(Tenofovir)等。
2.非核苷类逆转录酶抑制剂(Non-Nucleoside Reverse Transcriptase Inhibitors,NNRTIs)非核苷类逆转录酶抑制剂通过直接与逆转录酶结合,阻止其活性,从而抑制病毒的复制。
常见的非核苷类逆转录酶抑制剂有:尼拉韦林(Nevirapine)、培菲诺韦(Efavirenz)等。
3.蛋白酶抑制剂(Protease Inhibitors,PIs)蛋白酶抑制剂通过抑制病毒在感染人细胞后的去鞘过程,阻止病毒在宿主细胞内蛋白质的合成与复制,从而抑制HIV的繁殖。
常见的蛋白酶抑制剂有:洛匹那韦(Lopinavir)、阿扎那韦(Atazanavir)等。
4.整合酶抑制剂(Integrase Inhibitors,INSTIs)整合酶抑制剂通过抑制HIV整合酶这一重要的酶活性,阻止病毒基因组的整合过程,从而阻碍病毒的复制。
常见的整合酶抑制剂有:拉度夫定(Raltegravir)、达卡他韦(Dolutegravir)等。
5.核苷酸合成酶抑制剂(Nucleotide Synthesis Inhibitors)核苷酸合成酶抑制剂通过抑制病毒核苷酸合成过程中的关键酶活性,阻碍病毒的复制。
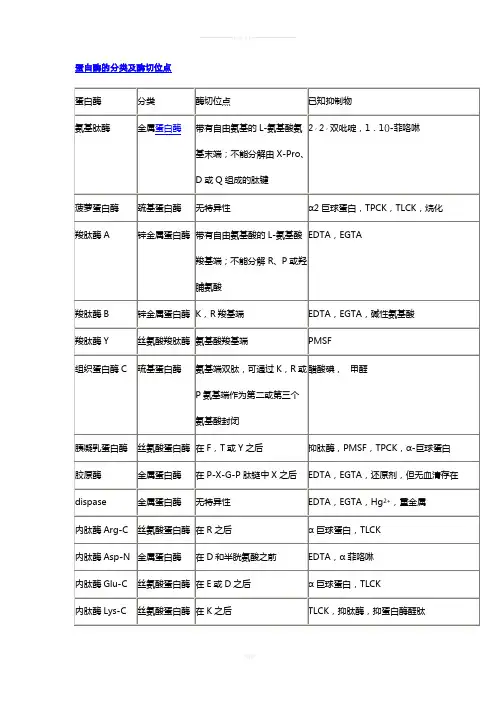
蛋白酶酶切位点蛋白酶的分类及作用位点蛋白酶分类作用位点已知抑制物,,氨基肽酶金属蛋白酶带有自由氨基的L-氨基酸氨基末端,22双吡啶,1,1()-菲咯啉不分解由X-Pro、D或Q组成的肽键菠萝蛋白酶巯基蛋白酶无特异性α2巨球蛋白,TPCK,TLCK,烷化羧肽酶A 锌金属蛋白酶带有自由氨基酸的L-氨基酸羧基端,EDTA,EGTA不能分解R、P或羟脯氨酸羧肽酶B 锌金属蛋白酶 K- Lys,R- Arg羧基端 EDTA,EGTA,碱性氨基酸羧肽酶Y 丝氨酸羧肽酶氨基酸羧基端 PMSF组织蛋白酶C 琉基蛋白酶氨基端双肽,可通过K,R或P氨基醋酸碘, 甲醛端作为第二或第三个氨基酸封闭胰凝乳蛋白酶丝氨酸蛋白酶在F- Phe,T- Thr或Y- Tyr之后抑肽酶,PMSF,TPCK,α-巨球蛋白胶原酶金属蛋白酶在P-X-G-P肽链中X之后EDTA,EGTA,还原剂,但无血清存在2+dispase 金属蛋白酶无特异性 EDTA,EGTA,Hg,重金属内肽酶Arg-C 丝氨酸蛋白酶在R- Arg之后α巨球蛋白,TLCK 内肽酶Asp-N 金属蛋白酶在D- Asp和C-Cys半胱氨酸之前EDTA,α菲咯啉内肽酶Glu-C 丝氨酸蛋白酶在E- Glu/Gln 或D- Asp之后α巨球蛋白,TLCK 内肽酶Lys-C 丝氨酸蛋白酶在K- Lys之后TLCK,抑肽酶,抑蛋白酶醛肽肠激酶丝氨酸蛋白酶在D-D-D-D-K-肽链中K之后Xa因子丝氨酸蛋白酶在R- Arg之后 PMSF,APMS,大豆胰蛋白酶抑制物无花果蛋白酶琉基蛋白酶无特异性TPCK,TLCK,α-巨球蛋白激肽释放酶丝氨酸蛋白酶在一些R- Arg之后抑肽酶,抑蛋白酶醛肽木瓜蛋白酶巯基蛋白酶长期孵育时具有广泛特异性arg、lys TPCK,TLCK,抑蛋白酶醛肽α—、gly、L-Citrulline 巨球蛋白,烷化剂胃蛋白酶酸蛋白酶广泛特异性phe、trp、tyr等疏水aa 胃蛋白酶抑制素纤溶酶丝氨酸蛋白酶在K- Lys或R- Arg之后 PMSF,TLCK,抑肽酶,α-巨球蛋白链霉蛋白酶混合型无特异性 B,M,完整药片蛋白酶K 丝氨酸蛋白酶广泛特异性 PMSF,PefablocSc 枯草杆菌蛋白酶丝氨酸蛋白酶无特异性PMSF,α巨球蛋白,苯甲脒热溶素锌金属蛋白酶在非极性残基之前 EDTA凝血酶丝氨酸蛋白酶在K- Lys之后 TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白,苯甲脒胰蛋白酶丝氨酸蛋白酶在K- Lys或R -Arg之后arg、lys TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白蛋白酶分类作用位点已知抑制物木瓜蛋白酶巯基蛋白酶具有广泛特异性 TPCK,TLCK,抑蛋白酶醛肽α-巨球蛋白,烷化剂胃蛋白酶酸蛋白酶广泛特异性胃蛋白酶抑制素胰蛋白酶丝氨酸蛋白酶在K或R之后 TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白人体20种氨基酸及其英文缩写1名称三字符号单字符号丙氨酸 Ala A精氨酸 Arg R天冬氨酸 Asp D半胱氨酸 Cys C谷氨酰胺 Gln Q谷氨酸 Glu/Gln E组氨酸 His H异亮氨酸 Ile I甘氨酸 Gly G天冬酰胺 Asn N亮氨酸 Leu L赖氨酸 Lys K甲硫氨酸 Met M苯丙氨酸 Phe F脯氨酸 Pro P丝氨酸 Ser S苏氨酸 Thr T色氨酸 Trp W酪氨酸 Tyr Y缬氨酸 Val V【生化】特异性蛋白酶的酶切位点胰蛋白酶arg、lys,得到以arg、lys为C末端残基的肽段。
蛋白酶的作用机理一、蛋白酶的定义和分类蛋白酶是一种能够催化蛋白质分子内部的化学键断裂反应的酶。
根据其作用的位置和方式,蛋白酶可以分为胃蛋白酶、肠蛋白酶、细胞蛋白酶等多个类别。
二、蛋白酶的结构和活性位点蛋白酶通常由多个氨基酸残基组成,其中一个或多个氨基酸残基形成具有催化活性的活性位点。
常见的蛋白酶活性位点包括丝氨酸、色氨酸、半胱氨酸和组氨酸等。
三、蛋白酶的作用机理蛋白酶通过水解反应将蛋白质分子内部的肽键进行断裂,从而使蛋白质分子失去原有的空间构象,导致其失去活性。
蛋白酶在催化反应中起到两个关键作用:结合亲和力和催化力。
1. 结合亲和力蛋白酶与底物之间的结合亲和力是催化反应进行的先决条件。
蛋白酶通过活性位点上的氨基酸残基与底物结合,形成酶底物复合体。
这种结合既可以是具有空穴的结合,也可以是完全配对的结合。
2. 催化力催化力是蛋白酶催化反应的核心。
蛋白酶通过活性位点上的氨基酸残基提供催化反应所需的酸碱性环境或功能基团。
常见的催化机制包括酸碱催化、亲核攻击和金属离子参与等。
四、蛋白酶的作用过程蛋白酶的作用过程可以分为四个步骤:底物识别、底物结合、催化反应和产物释放。
1. 底物识别蛋白酶通过活性位点上的氨基酸残基与底物中的特定肽键结合,实现对底物的识别。
2. 底物结合蛋白酶与底物形成酶底物复合体,通过结合亲和力使底物在活性位点上定向排列。
3. 催化反应蛋白酶通过活性位点的氨基酸残基提供催化反应所需的环境或功能基团,促进底物的肽键断裂。
4. 产物释放蛋白酶将底物水解成产物后,释放产物并恢复到活性状态,准备进一步的底物结合和催化反应。
五、蛋白酶的影响因素蛋白酶的活性受到多种因素的影响,包括温度、pH值、底物浓度和蛋白酶抑制剂等。
1. 温度蛋白酶的活性随温度的升高而增加,但过高的温度会导致蛋白酶变性失活。
2. pH值蛋白酶的活性通常在特定的pH范围内最高,过高或过低的pH值都会降低蛋白酶的活性。
3. 底物浓度底物浓度越高,蛋白酶的活性越高,但当底物浓度接近饱和时,蛋白酶的活性会达到饱和状态。
蛋白酶抑制剂对心肌缺血再灌注损伤的作用机制研究心肌梗塞是全球范围内高发的疾病,其主要病因為冠状动脉疾病造成的。
当心肌缺血时,可以采取再灌注的方式来恢复血液供应,然而,在再灌注的过程中会导致心肌损伤。
研究表明,心肌缺血再灌注损伤是由多种复杂的病理生理机制导致的。
其中,蛋白酶抑制剂对心肌缺血再灌注损伤的作用机制备受关注。
本文将讨论蛋白酶抑制剂的作用机制及其对心肌缺血再灌注损伤的影响。
蛋白酶抑制剂是一类能够抑制蛋白酶活性的药物。
在心肌缺血再灌注过程中,心肌细胞受到氧化应激、炎症反应和细胞凋亡等多种损伤,其中蛋白酶在心肌损伤过程中具有重要作用。
蛋白酶的产生和活性增加不仅可以加速心肌细胞凋亡,还能够导致血管内皮细胞受损等一系列不良反应。
因此,蛋白酶抑制剂具有广泛的临床应用前景。
蛋白酶抑制剂通过抑制心肌损伤过程中产生的蛋白酶活性,从而减轻心肌细胞的凋亡和炎症反应,从而能够降低心肌缺血再灌注损伤的程度。
一些药物例如氨基酰胺酸、磷酸氢钠盐等都具有蛋白酶抑制剂的作用,已经在大规模临床实验和动物实验中证实了它们对心肌损伤的保护作用。
蛋白酶抑制剂作为一种抗心肌缺血再灌注损伤的药物,其作用机制非常复杂。
一方面,蛋白酶抑制剂能够通过减轻心肌细胞受损程度,从而保护心肌细胞结构和生物学功能;另一方面,蛋白酶抑制剂还能够抑制一定程度上的炎症反应,降低血管通透性,从而减轻组织水肿等不良反应。
此外,蛋白酶抑制剂还能够干扰血栓形成过程,保护血管内皮层健康。
总之,蛋白酶抑制剂作为一种心肌缺血再灌注损伤防治的药物具有重要意义。
其作用机制非常复杂,但其主要作用是通过抑制蛋白酶活性减轻心肌细胞的损伤和炎症反应,从而维护心脏健康。
目前,蛋白酶抑制剂已经广泛应用于心肌病、冠心病等心血管疾病的治疗中,展示出良好的应用前景。
未来,我们有理由相信,在深入研究蛋白酶抑制剂作用机制的同时,其可能为心肌健康的保护作出更大的贡献。
蛋白酶抑制剂分类和应用 在分离蛋白时,组织或细胞裂解液中充满了来自溶酶体的酶,并且原来无活性的蛋白酶原被充分激火,开始消化其周围的蛋白质. 为避免此因素,蛋白酶抑制剂必须被加入在缓冲液内以阻止蛋白酶对细胞组织的消化作用. 来自哺乳类动物,植物, 霉菌或细菌的组织,蛋白酶成分是不同的, 并根据机体状态的发展蛋白酶也可以发生变化. 哺乳类动物组织分离时比细菌或其它组织分离时更需要应用蛋白酶抑制剂使组织细胞受到完全的保护.
因此,在各种蛋白分离时, 在各种蛋白电泳时蛋白酶抑制剂的适当选用就成了很重要的因素。
蛋白酶功能 : 涉及到许多细胞内和细胞外的过程:
o 食物蛋白在消化道的消化 o 激活无活性酶原和多肽激素/神经转移介质的释放 o 调节血凝物质和纤维素 o 内源性和外源性蛋白的细胞内消化 o 跨膜的蛋白转移 o 微生物对生物体攻击,通过释放蛋白酶的导致毒性增加
蛋白酶分类 : 根据催化中心结构的不同蛋白酶可分为4类 :
1. 丝氨酸蛋白酶在其活性中心含有丝氨酸和组氨酸,如: 糜蛋白酶, 弹性蛋白酶,血纤维蛋白溶酶,凝血酶,枯草杆菌蛋白酶,胰酶Chymotrypsin, Elastase, Plasmin, Subtilisin, Thrombin, Trypsin
2. 半胱氨酸蛋白酶(别名 :硫醇或SH 蛋白酶)在其催化中心含有半胱氨酸,如 : Calpain, 组织蛋白酶 B,C 和L,和木瓜蛋白酶
3 天(门)冬氨酸蛋白酶 (羧基蛋白酶)在其活化中心含有天(门)冬氨酸, 如 : 组织蛋白酶D, 木瓜蛋白酶, 肾素
4. 金属蛋白酶含有金属离子, 即 : 锌2+在其催化中心,如氨基肽酶,羧基蛋白酶A 和 B,嗜热菌蛋白酶 机体防止蛋白酶破坏作用几种可能性 :
• 酶在特殊囊性小泡的分配 (溶酶体,包涵体)
• 内源性蛋白酶抑制剂(如 : Aprotinin, 抗凝血酶,抗胰酶) SERVA 6种蛋白酶抑制剂鸡尾酒的作用 :
➢ SERVA提供6种不同的蛋白酶抑制剂鸡尾酒,用于分离纯化各种组织的蛋白,多肽的最佳选择 ➢ 蛋白酶抑制剂混合物G含有5种水溶性的抑制剂用于抗丝氨酸- , 半胱氨酸- 和金属蛋白酶作用,并且是常用选择的鸡尾酒,应当避免同时使用有机体溶剂 ➢ 蛋白酶抑制剂混合物H P含有4种水溶性抑制剂用于抗丝氨酸- , 半胱氨酸蛋白酶作用,并且有效地
用于分离和提取重组蛋白,岳阳家政 避免金属螯合物。 ➢ 蛋白酶抑制剂混合物M含有6种不同的抑制剂用于抗丝氨酸- , 半胱氨酸和天(门)冬氨酸酶以及金属蛋白酶作用,并用于哺乳动物组织的蛋白分离。 ➢ 蛋白酶抑制剂混合物P含有6种不同的抑制剂用于抗丝氨酸- , 半胱氨酸和天(门)冬氨酸酶以及金属蛋白酶作用。此被推荐用于从植物来源的蛋白分离 ➢ 蛋白酶抑制剂混合物FY含有4种不同的抑制剂用于抗丝氨酸- , 半胱氨酸, 天(门)冬氨酸蛋和金属蛋白酶作用。用于从酵母和其它真菌来源的蛋白制备。 ➢ 蛋白酶抑制剂混合物B含有5种不同的抑制剂用于抗丝氨酸- , 半胱氨酸, 天(门)冬氨酸和金属蛋白酶作用。尤其应用于在细菌提取蛋白。
产品包装 : 所有混合物为冻干粉剂. 溶解在1 ml 水或DMSO 浓度100x , 足够用于100 ml 组织提取物
每种抑制剂混合物的成分列表如下 :
注 : ➢ AEBSF (PEFABLOC SC)和Aprotinin 是丝氨酸蛋白酶的抑制剂 ➢ 苯丁抑制素 (Bestatin)是氨基肽酶的抑制剂 ➢ E-64是半胱氨酸蛋白酶的抑制剂 ➢ Leupeptin 是丝氨酸和半胱氨酸蛋白酶的抑制剂
➢ Pepstatin A毛孔大怎么办 是天门冬氨酸蛋白酶的抑制剂 ➢ EDTA 和 1,10-Phenanthroline 是 金属蛋白酶抑制剂
蛋白酶抑制剂表. 以下表显示了竞争者产品与SERVA蛋白酶抑制剂在应用或成分的比较
蛋白酶抑制剂特征 :
成份 混合G 39101 混合 M 39102 混合P 39103 混合 FY 39104 混合B 39105 混合HP
39106
AEBSF + + + + + + Aprotinin + + - - - + Bestatin - + + - + - E-64 + + + + + + Leupeptin + + + - - + Pepstatin A - + + + + - 1,10-Phenanthroline - - + + - -
EDTA-Na2-salt + - - - + -
SERVA 混合 G 39101 混合M 39102 混合P 39103 混合FY 39104 混合B 39105 混合HP
39106
S公司 P 2714 P 8340 P 9599 P 8215 P 8465 P 8849
R公司 Complete - - - - Complete EDTA-free
C公司 539131 539134 - 539136 539132 539137 ➢ SERVA 提供了全面的高纯度的用于4组蛋白酶 (丝氨酸- , 半胱氨酸和天(门) 冬氨酸蛋白 酶和金属蛋白酶) 抑制剂的产品线 ➢ 以下 应用表显示适用于不同领域抑制剂特征使用 ➢ 产品线怎么减肚子正在伸展 ➢ 蛋白酶抑制剂的生产在制备中 ➢ 100多篇文献可查阅
蛋白酶抑制剂应用范畴 :
➢ 细胞调节过程的研究 (如老年痴呆症/肿瘤研究) ➢ 抗体, 酶在诊断系统蛋白降解的抑制 (如 : 诊断试剂盒) ➢ 为了避免在细胞裂解时蛋白酶释放的破坏作用 (如 : 在制备性生化方面) ➢ 抑制由蛋白酶引起的组织裂解 (如 : 细胞培养)
应用表 : 此表总结了在生化和细胞生物学常见蛋白酶抑制剂的应用 (近40种). 该表概括了 作用机制, 靶蛋白酶类型排毒养颜胶囊, 溶解度, 浓度和有关的文献参考
货号 产品 分子量 作用 / 抑制的特异性 溶解度 稳定性 浓度范围 a) 文献参考 12745 AEBSF-HCl 239.7 Irreversible inhibitor of Thrombin and other serine proteases. Inhibits by acylation of the active site of the enzyme. Much less toxic than PMSF and DFP H2O, Aqueous solutions are stable between pH 5-6 0.1 - 2 µM 60,83,84
12309 Amastatin-HCl 511 Non-toxic reversible metallo-protease inhibitor. Inhibits many membrane-bound peptidases which are critical regulators of peptide hormones, e.g. aminopeptidase A and M, but not aminopeptidase B. Inhibits also leucine aminopeptidase. Ethanol 0.5 % AcOH 1 - 100 µM 1,2,3,4
12548 (epsilon)-Aminocaproic acid 131.2 Highly active inhibitor of fibrinolysin and chymotrypsin. H2O 1 - 20 µM 5,6 13684 (alpha)1-Antichymotypsin from human plasma 68000 Glycoprotein that inhibits chymotrypsin-like proteases (above all human neutrophil cathepsin G) by forming stable complexes. Acute phase protein; concentration in plasma increases after events like inflammation or tissue damage Aqueous buffers Used at equimolar concentration 7,8,9,10
13685 Antipain-HCL 678.2 Reversible inhibitor of serine and cysteine proteases. Inhibits papain and trypsin more specificly than leupeptin. Plasmin is inhibited only slightly. Also involved in inhibition of RNA synthesis H2O Methanol DMSO 1 - 100 µM 11,12,13 13695 Antithrombin III from human plasma ca. 60000 Glycoprotein that plays a major role in controlling serine proteases in the blood clotting cascade. Inactivates above all thrombin by forming an extremely stable complex, an effect which is enhanced by heparin. Inhibits also other proteases of the coagulation cascade like plasmin, kallikrein, factor IXa, Xa, XIa and XIIa. H2O Used at equimolar concentrations 8,14 15,16 13694 (alpha)1-Antitrypsin from human plasma ((alpha)1-proteinase inhibitor) ca. 53000 Glycoprotein that is mainly involved in the control of neutrophil elastase activity. Inhibits also most of other mammalian serine proteases but at a lower rate. Blocks the action of target enzymes by binding nearly irreversibly to their active site. H2O Aqueous buffers Used at equimolar concentra tions 8,9,17,18,19 13718 Aprotinin (Trypsin inhibitor from bovine lung) ca. 6500 Basic single-chain polypeptide that inhibits numerous serine proteases by binding to the active site of the enzyme, form ing tight complexes. It inhibits above all plasmin, kallikrein, trypsin, chymotrypsin and urokinase, but not carboxypeptidase A and B, papain, pepsin, subtilisin, thrombin and factor X. Used in cell culture to prevent proteolytic damage to cells and to extend lifetime of cells. H2O, Aqueous buffers. Sterile filtered solutions at pH 5-8 are stable for several months. Denatures at pH > 12 In cell culture: 0.01 - 3 µg/ml; in other applications: 10 - 250 µg/ml 22,23,24,25