具有除草活性的异恶唑啉类化合物的研究进展
- 格式:pdf
- 大小:299.92 KB
- 文档页数:5


櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄櫄累积和淋失的影响[J ].农业工程学报,2004,20(5):105-109.[56]樊军,郝明德.旱地长期定位施肥对土壤剖面硝态氮分布与累积的影响[J ].生态环境学报,2000,9(1):23-26.[57]陆安祥,赵云龙,王纪华,等.不同土地利用类型下氮磷在土壤剖面中的分布特征[J ].生态学报,2007,27(9):3923-3929.[58]寇长林,巨晓棠,张福锁.三种集约化种植体系氮素平衡及其对地下水硝酸盐含量的影响[J ].应用生态学报,2005,16(4):660-667.[59]钟玉娟,张白鸽,罗少波,等.菜薹硝酸盐积累与品种、营养品质之间的关系[J ].中国农学通报,2017(18):49-55.汤涛,张昌朋,吴珉,等.异唑草酮水解及在水中的光解[J ].江苏农业科学,2019,47(3):249-252.doi :10.15889/j.issn.1002-1302.2019.03.059异唑草酮水解及在水中的光解汤涛,张昌朋,吴珉,许振岚,赵华,赵学平(浙江省农业科学院农产品质量标准研究所/省部共建国家重点实验室培育基地/浙江省植物有害生物防控重点实验室/农业部农药残留检测重点实验室,浙江杭州310021)摘要:实验室条件下,采用高效液相色谱研究了异唑草酮水解和在水中的光解动态特性,结果表明,异唑草酮在碱性缓冲液中水解最快,在酸性缓冲液中水解最慢,其水解速率随着温度的升高而加快,温度效应系数和活化能均是在碱性缓冲液中最低。
在pH 值分别为4、7、9的缓冲液中,25ħ时异唑草酮的水解半衰期分别为150.70、82.50、3.90h ,50ħ时的水解半衰期分别为19.40、4.10、0.75h ,根据我国农药登记试验水解等级划分标准,异唑草酮属于易水解农药。
在25ħ,光照度为3350lx 以及紫外强度为58.8μW /cm 2条件下,异唑草酮在水中的光解半衰期为6.4h ,根据我国农药登记试验的光解特性等级划分标准,异唑草酮属于中等光解类农药。
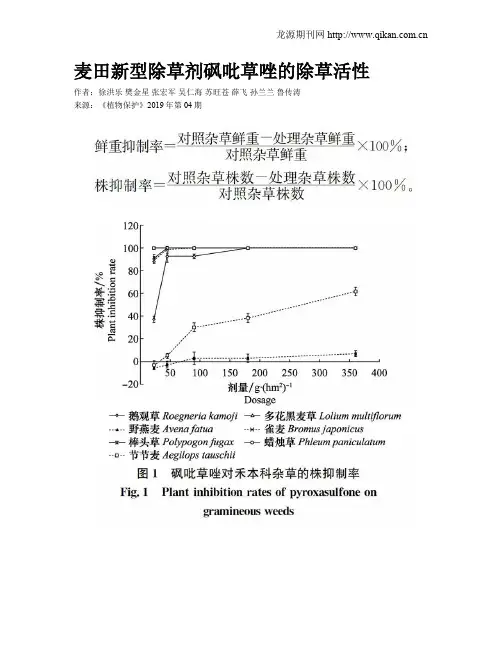
麦田新型除草剂砜吡草唑的除草活性作者:徐洪乐樊金星张宏军吴仁海苏旺苍薛飞孙兰兰鲁传涛来源:《植物保护》2019年第04期摘要杂草严重影响小麦的丰产丰收,而使用除草剂是麦田杂草防除中最经济有效的手段。
砜吡草唑是新型广谱、高活性的苗前土壤处理除草剂。
明确砜吡草唑对麦田杂草的除草活性是该药剂在麦田应用的重要内容。
本文采用温室盆栽法研究了其对麦田常见杂草的杀草谱及除草活性。
研究结果表明:砜吡草唑土壤处理对麦田禾本科杂草鹅观草Roegneria kamoji、多花黑麦草Lolium multiflorum、雀麦Bromus japonicus、棒头草Polypogon fugax、蜡烛草Phleum paniculatum,阔叶杂草大巢菜Vicia sativa、播娘蒿Descurainia sophia、麦家公Lithospermum arvense、泽漆Euphorbia helioscopia具有良好的防除效果,但对节节麦Aegilops tauschii和野燕麦Avena fatua的防除效果略差。
在推荐剂量180 g/hm2下,对鹅观草、多花黑麦草、雀麦、棒头草、蜡烛草、大巢菜、播娘蒿、麦家公、泽漆的株抑制率和鲜重抑制率均可达到90%以上。
而对节节麦和野燕麦的ED90分别为209.54和886.43 g/hm2,高于砜吡草唑的田间推荐剂量。
砜吡草唑具有广泛的杀草谱及较高的除草活性,可作为小麦田杂草化学防除的重要候选药剂。
关键词除草剂; 杂草; 苗前土壤处理; 小麦; 砜吡草唑中图分类号: S 482.4文献标识码: BDOI: 10.16688/j.zwbh.2018312小麦是全世界分布范围最广,种植面积最大,总产量最高的粮食作物,小麦的安全生产对世界经济乃至人类发展至关重要。
我国是世界第一大小麦生产、消费和进口国[1]。
国家统计局数据显示:2015年我国小麦的总播种面积为2 414万hm2,占全国粮食作物总播种面积的21.3%[2]。

这真是一款除草剂界的“万金油”三天不学习,智商比猪低,在任何领域要保持领先的水平,都要不停的补充新知识、新信息。
今天浏览时突然发现一款好用的除草剂,真正的好用,广谱。
结构图它,就是砜吡草唑。
它是化合物,日本组合化学公司发明创制的,无心插柳的结果,本来想着提升其除草品种禾草丹的活性,就像小孩子玩玩具搭积木一样,把禾草丹的结构上一个氨基甲酸酯基团变为杂环基,根据其他公司专利把它导入异噁唑基而实现了异噁化,在这个异噁唑基上又导入一个二甲基的化合物,结果在土壤处理时对稗草和谷子等禾本科杂草有卓越的效果。
后来又经过各种优化,使它的用量只有精异丙甲草胺和乙草胺的十分之一,了不起啊。
就此,砜吡草唑诞生了。
作用机理比较简单,通过抑制超长链脂肪酸延长合成酶(VLCFAE)而发挥药效,至于什么是VLCFAE,自己可以百度,反正是破坏了杂草体内复杂的反应中的某一个环节而使杂草死亡。
这款发明可以说是真正的应用广泛,可以在小麦、玉米、棉花、向日葵、花生、水稻等作物上应用,可以防治的杂草有狗尾草属、马唐属、稗属等禾本科杂草,最最不普通的还可以防治苋属、曼陀罗属、茄属、苘麻属等阔叶杂草,对大巢菜、播娘蒿、麦家公、泽漆的防效达到90%以上,这个把甲草胺、乙草胺这类货甩两条街,用量也只有其十分之一。
怎么用呢?当然是封闭除草,土壤处理,芽前使用,在杂草未出土前,按照推荐用量均有喷雾,当然,用水量不要太少,每亩不少于40升,土地要平整,墒情好时有利于药效发挥,天气干旱时加大用水量。
砜吡草唑发明以来,全球都很关注,好多世界级的企业都开始登记这个证件,像拜耳、FMC、巴斯夫、AMMC、Valent等国际农化巨头企业,有单剂、有复配,复配的搭配品种是丙炔氟草胺,还有和莠去津、嗪草酸甲酯,登记在小麦、玉米、大豆比较多,有的登记了多种作物。
国内目前只有一家,上海群力化工,只登记了98%原药和40%悬浮液单剂。
总结下:这是一款非常有前景真真不懒的产品,土壤封闭类除草剂,以封杀禾本科杂草为主、阔叶杂草为辅,适用范围广,除草广谱,安全性好,对当茬作物安全,对下茬作物安全,持效期可达28天。

异噁唑衍生物合成及其生物活性张峥;李忠【期刊名称】《农药研究与应用》【年(卷),期】2007(011)004【摘要】异噁唑含氮杂环化合物在现代农药化学中占有很重要的地位,许多已经被开发成了除草剂。
杀虫剂。
杀菌剂等多种农用化学品。
本文将部分吡啶杂环引入到异噁唑环。
对异噁唑环进行结构修饰合成了两个系列共19个化合物,所有化合物结构经1HNMR,13CNMR,HR-EI,IR确证。
生物活性测试结果显示系列1化合物ZZA1,ZZA2,ZZA3,ZZA4,ZZA5,ZZA6,ZZA7,ZZA8,ZZA9,ZZA10,ZZA11,ZZA12未表现出任何生物活性,系列2化合物ZZB1,ZZB2,ZZB3,ZZB4,ZZB5,ZZB6,ZZB7对瓜白粉病菌有一定的防效,其中化合物2287在500ppm下对白粉病菌有50%的防效。
【总页数】6页(P21-26)【作者】张峥;李忠【作者单位】华东理工大学药物化工研究所,上海200237【正文语种】中文【中图分类】O626.24【相关文献】1.3-异丙基-6-溴苯并异噁唑及其衍生物的合成和研究 [J], 罗维;余权;苑丽红;蔡慧华;许美玲;何旭伦;王强2.1-(取代异噁唑基)-1,2,4-三唑和1-(取代嘧啶基)-1,2,4-三唑的合成及生物活性 [J], 黄震年3.2-芳基-5-(5-甲基异噁唑-3基)-1、3,4-噁二唑的合成及生物活性的研究 [J],4.含羧基或酯基的新型二氧代氮杂茂并[3',4'-d]异(噁)唑衍生物的合成及其生物活性 [J], 穆赫塔尔·伊米尔艾山;库尔班·吾斯曼;吐尔洪·买买提;萨提瓦尔迪·海力力;古丽伯斯坦·阿依达尔5.苯并咪唑与苯并异噁唑桥连衍生物的合成及其生物活性 [J], 丁海关;蔡志强;赵蓉;金正盛;许娣;孟苗苗;曹慧;李帅因版权原因,仅展示原文概要,查看原文内容请购买。

一种异噁唑草酮的合成方法(原创实用版2篇)目录(篇1)1.异噁唑草酮的概述2.异噁唑草酮的合成方法的背景和意义3.异噁唑草酮的合成方法的具体步骤4.异噁唑草酮的合成方法的优点和可能的改进方向正文(篇1)【1.异噁唑草酮的概述】异噁唑草酮是一种新型的草酮类除草剂,其结构中含有异噁唑环和草酮环,对多种杂草具有高效、广谱的除草活性。
与传统的草酮类除草剂相比,异噁唑草酮具有更高的选择性和更低的毒性,因此,其在农业生产中的应用前景广阔。
【2.异噁唑草酮的合成方法的背景和意义】异噁唑草酮的合成方法的研究,是为了满足农业生产对高效、环保的除草剂的需求。
目前,虽然已有一些异噁唑草酮的合成方法,但这些方法存在产率较低、反应条件苛刻、操作复杂等问题,因此,开发一种高效、简便的异噁唑草酮的合成方法具有重要的实际意义。
【3.异噁唑草酮的合成方法的具体步骤】本研究提供的异噁唑草酮的合成方法包括以下步骤:步骤一:在催化剂的作用下,将草酮和异噁唑反应,生成异噁唑草酮的亚胺酸酯中间体。
步骤二:将亚胺酸酯中间体进行环化,生成异噁唑草酮。
步骤三:通过萃取、分离和纯化,得到目标产物异噁唑草酮。
【4.异噁唑草酮的合成方法的优点和可能的改进方向】该方法具有以下优点:反应条件温和,操作简便,产率高,产品纯度高。
目录(篇2)1.引言2.异噁唑草酮的背景和应用3.异噁唑草酮的合成方法3.1 反应原理3.2 反应步骤3.3 反应条件3.4 反应产物4.实验结果与分析5.结论正文(篇2)【引言】异噁唑草酮是一种新型的草酮类化合物,具有良好的生物活性和选择性,被广泛应用于农药、医药和染料等领域。
然而,关于异噁唑草酮的合成方法却鲜有报道。
本文旨在探讨一种异噁唑草酮的合成方法,为相关领域的研究提供参考。
【异噁唑草酮的背景和应用】异噁唑草酮是一种新型的草酮类化合物,其结构中含有异噁唑环和草酮环,具有独特的生物活性和选择性。
在农药领域,异噁唑草酮可用于防治多种农作物病虫害;在医药领域,异噁唑草酮具有抗炎、抗菌、抗病毒等多种生物活性;在染料领域,异噁唑草酮可作为一种新型染料中间体。

异恶唑啉结构式异恶唑啉(Imidazoline)是一种具有环结构的生物活性分子,其化学式为C8H11N。
它含有两个氮原子和一个环状结构,具有广泛的应用领域。
在药物化学、农药化学和化学生物学领域,它被广泛应用于药物、农药及生物材料的研究与开发中。
异恶唑啉化合物具有许多生物活性,包括抑制神经递质的释放,维持血糖稳定,改善认知功能及降低血压等。
另外,起药物辅助作用,常含于一些非处方药、食品添加剂和化妆品中。
目前,已经开发出大量的异恶唑啉衍生物,其中一些已经被证实有抗肿瘤、抗心血管疾病、调节血糖等多种疾病的作用。
异恶唑啉的结构式与噻唑及其他杂环有些类似,它们都含有一个杂环结构,但是异恶唑啉的结构中还有一个亚甲基(CH2)基和一个烷基,这些基团可以对其化学性质和活性特征产生深远的影响。
在药物领域,异恶唑啉衍生物被广泛应用于治疗神经系统疾病、心血管疾病和代谢性疾病等广泛领域。
如:可乐定(Clonidine)是一种抗高血压药,在治疗高血压方面已经广泛应用,其药效作用通过对肾脏和交感神经系统的影响,可以降低体液中儿茶酚胺水平的减少,从而达到降低心率和血压的效果。
另外,可乐定还具有镇痛和缓解戒烟作用等。
牛膝(Radix Aconiti Lateralis Preparata)中的异恶唑啉类成分具有镇痛、收缩胃肠道等作用,而政大五虎防风糖浆中的异恶唑啉成分则用于治疗感冒、咳嗽和鼻塞等症状。
此外,异恶唑啉还以具有镇静、抗惊厥、促进睡眠和改善记忆力等作用而得到广泛应用。
在农药领域,异恶唑啉衍生物也被广泛应用于农业生产中。
如甲氧氟萘啶(MCPA)是一种用于控制杂草和草本植物的广谱性草地杀草剂,其分子中含有一个相对稳定的联胺结构,是一种适用于植物培养基和生物样品中的质量标志。
氟萘啶胺(Flupyrsulfuron-methyl)是一种除草剂,能抑制植物的依赖性。
此外,异恶唑啉还被用作粘剂、涂料、涂料添加剂和染料等。
在化学生物学领域,异恶唑啉的衍生物被广泛应用于生物材料的制备、药物筛选和结构优化等领域。

26%丙炔噁草酮·异噁草松·丙草胺乳油防除水稻移栽田杂草试验1. 引言1.1 研究背景水稻是我国主要粮食作物之一,但水稻田杂草的生长严重影响了水稻的生长和产量。
为了有效防除水稻移栽田杂草,提高水稻产量和质量,许多研究者都在不断探索新的防治方法。
丙炔噁草酮·异噁草松·丙草胺乳油作为新型除草剂,在防治水稻田杂草方面具有潜在的优势和应用前景。
目前对于该药剂在水稻移栽田杂草防治中的效果和应用效果尚未有系统的研究和实验验证。
本研究旨在通过试验验证26%丙炔噁草酮·异噁草松·丙草胺乳油对水稻移栽田杂草的防治效果,为农田除草提供科学依据,并探讨其在水稻生产中的应用前景和推广价值。
通过本研究,可以为提高水稻产量和减少除草成本提供可行性建议,促进水稻生产的可持续发展。
1.2 研究目的本次试验的研究目的主要是评估26%丙炔噁草酮·异噁草松·丙草胺乳油对水稻移栽田杂草的防除效果,探讨其在农田应用中的可行性和效果。
通过本次试验,我们希望能够验证该药剂在田间环境下对杂草的控制效果,为农业生产提供更为有效的防除措施,并为农民提供科学、经济、环保的草坪移栽方案。
通过对试验结果的分析和总结,进一步明确该药剂的适用范围和存在的问题,为今后的农业生产和防治工作提供科学依据。
希望通过本次试验,为农田杂草防除工作提供有力支撑,推动农业生产的可持续发展。
1.3 研究意义水稻是我国的重要粮食作物,但是在移栽后容易受到田杂草的侵害,严重影响水稻的生长发育和产量。
寻找一种有效的方法防除水稻移栽田杂草对于提高水稻产量,保障粮食安全具有重要意义。
本研究旨在探究26%丙炔噁草酮·异噁草松·丙草胺乳油在防除水稻移栽田杂草方面的效果,为水稻种植提供科学依据,并为农业生产提供更好的技术支持。
通过本次试验的开展,我们希望能够验证该药剂在田间应用中的有效性,进一步探讨其在实际生产中的推广应用前景,为农业生产和粮食安全做出贡献。

紫堇属植物中异喹啉类生物碱的化学结构和生物活性的研究进展刘璐;吴立军;杨春娟【摘要】目的:综述紫堇属中异喹啉类生物碱的化学成分和生物活性的研究进展。
方法阅读国内外文献数据库中近年来关于紫堇属植物的文献,从化学结构和生物活性方面对文献进行整理和综述。
结果紫堇属植物含有丰富的异喹啉类生物碱,按照结构类型可分为9类:原小檗碱类、原阿片碱类、苯酞异喹啉类、苯菲啶类、苄基异喹啉类、阿朴菲类、枯拉灵类、螺苄异喹啉类、其他类。
紫堇属植物中的生物碱具有清热解毒、消炎止痛等功效,还具有免疫、抗菌、抗炎等生物活性。
结论本文对紫堇属植物中含有的异喹啉类生物碱的化学结构和生物活性进行了整理,为紫堇属植物的深入研究和临床应用提供理论依据。
%Objective To summarize the research progress of chemical structures of isoquinoline alkaloids in the genus Corydalis and their bioactivities. Methods Related articles of genus Corydalis were analyzed and summa-rized regarding the chemical structures and bioactivities. Results Genus Corydalis was rich in isoquinoline alkaloids. Alkaloids were divided into aporphine, protopine, protoberberine, tetrahydroprotoberberine, benzophenathridine, phthalide-isoquinoline, benzylisoquinoline, spirobenzylisoquinoline, and others according to different chemical struc-tures. Genus Corydalis had various biological properties including anti-inflammatory properties,antiviral activities,an-tinociceptive activities,antibacterial activities,etc. Conclusion The article provides theoretical evidence for intensive study and clinicalapplication of genus Corydalis by analyzing their chemical structures and bioactivities.【期刊名称】《实用药物与临床》【年(卷),期】2016(019)003【总页数】10页(P371-379,380)【关键词】紫堇属;生物活性;化学结构【作者】刘璐;吴立军;杨春娟【作者单位】哈尔滨医科大学药学院,哈尔滨150081;哈尔滨医科大学药学院,哈尔滨150081;哈尔滨医科大学药学院,哈尔滨150081【正文语种】中文紫堇属(Corydalis DC.)是广义罂粟科(Papaveraceae)的最大属,全世界紫堇属植物约有440种,共41组。

(中国植物志)[M].Beijing:Science Press,1980.[3] Th e Commis sion of Chines e Woody Plants.Rec or d ChineseWood y P lants(中国树木志)[M].Beijing:Chinese Fores tryPress,1982.[4] Yook C S.Med icinal Herbs of Acan thop anax in Asia[M].Seou l:Kyu ng W on M edia,2001.[5] Kim C H,Sun B Y.New taxa and combinations in Eleuthero-coccus(Araliacaea)from eas tern Asia[J].N ovon,2000,10(3):209-214.[6] Park S Y.Studies on RAPD analysis and triterpen oidal cons-titu ents of Acanthopana x species[A].Doctor Degree Thesisof Kumanoto Univer isyt[D].Kumamoto:Kumanoto Univer-sity,2002.[7] Liu X Q,Chang S Y,Yook C S,et al.Ess en tial oils of Acan-thopanax gracilistylus[J].Ch in Tr adit Herb Dru gs(中草药),2001,32(12):1074-1075.[8] Liu X Q.Studies on th e activ e cons tituents of Acan thopana xg racilistr ylus W.W.Smith[A].Doctor Deg ree Thesis ofKyung Hee Univer s ity[D].Korea:Kyung Hee University,2003.[9] Yook C S,Liu X Q,Chang S Y,et al.Lupane triterpene gly-cosides from the leaves of Acan thop ana x gracilistylus[J].Chem Pha rm Bull,2002,50(10):1383-1385.[10] Liu X Q,Chang S Y,Park S Y,et al.A new lupane triter-pene glycosid es from th e leaves of Acanthopana x graci-listry-lus[J].Arch Pha rm Res,2002,25(6):831-836.[11] M ats umoto K,Kasai R,Kanamaru F,et al.3,4-s eco-Lu-pane-type triterpenen glycosid e es ters from leaves of Acan-thopanax d ivarica tus S EEM[J].Chem Pharm B ull,1987,35(1):413-415.[12] Oh O J,Chang S Y,Yook C S,et a l.New3,4-seco-lu panetype triterpen e glycosid es from Acanthopanax s enticosus formainermis[J].J N at P rod,2000,63(12):1630-1633.[13] Oh O J,Chang S Y,Yook C S,et a l.Tw o3,4-seco-lu panetriterpenes from leaves of A.d ivaricatus var.a lbeof rutus[J].Chem Pharm B ull,2000,48(6):879-881.[14] M iyakoshi M,Shirasuna K,Hirar Y,et al.Triterpen e glyco-sides from the leav es of A canthop anax nipponicus leaves[J].J Nat Prod,1999,62(3):445-448.[15] Park S Y,Chang S Y,Oh O J,et al.Nor-oleanane typetriterpene glycosides from th e leav es of Acanthopanax japoni-cus[J].Phytochem istr y,2002,59(1):379-384.[16] Park S Y,Ch ang S Y,Yook C S,et al.Triterp ene glycosidesfrom Acanthopanax sentic osus fo rma inerm is[J].Na t Med,2000,54(1):43.[17] M iyakoshi M,Ida Y,Sh oji J.3α-Hyd rox y-oleanane-typetriterpene g lycos yl esters from leaves of Acan thop anaxspinosus[J].Phytochemistry,1993,34(6):1599-1602. [18] M iyakoshi M,Id a Y,Sho j i J.3-Ep i-oleanane-type triterpeneglycos yl esters from leav es of Acan thop anax sp inosus[J].Ph ytochem istry,1993,33(3):891-895.[19] Cai X F,Lee J J,Kim Y H,et al.A new24-nor-lupane-g ly-coside of Acanthopana x trifoliatus[J].A rch Pharm Res,2003,26(9):706-708.[20] Kim Y H,Ryu J H,Ch ung B S.Diterp ene glycosides fromAcanthopanax koreanum[J].Kor J Ph arm,1990,21(1):49-51.[21] Cai X F,Shen G H,Kim Y H,et al.Inhibitory effect of kau-rane type diterp enoids from Acanthopana x koreanum on TN F-αsecretion from trypsin-s timulated HM C-1cells[J].ArchPh arm Res,2003,26(9):731-734.[22] Liu X Q,Yook C S,Chang S Y.Ch emical constituen ts of A-canthopanax g racilistylus[J].Chin Tradit Her b Dr ugs(中草药),2004,35(3):250-252.[23] M iyakoshi M,Sh uras una K,Sho j i J,et al.Cons tituents ofAcanthopanax d ivarica tus and A.sieboldianus roots[J].N atMed,1995,49(2):218.[24] Chang Q,Ch en D,ZHu Z,et a l.Chemical cons tituents of A-canthopanax g iraldii Harms var.Hispidus Hoo[J].Ch ina JChin Mater Med(中国中药杂志),1993,18(3):162-164. [25] Liu X Q,Chang S Y,Park S Y,et al.Studies on th e con-s tituen ts of th e s tem bark s of Acan thop ana x gracilistrylus[J].N at Prod Sci,2002,8(1):23-25.[26] Liu X Q,Chang S Y,Yook C S.Constituen ts of Acantho-p anax g racilistylus W.W.Smith[J].Nat Med2002,56(5):215.[27] Oh O J,Chang S Y,Yang K S,et al.Cons tituen ts of Acan-thopanax divar icatus var.albeofr uctus[J].Nat Med,2000,54(1):29-32.[28] J iangsu New M edical College.Dicti onary of Mater ia Med ica(中国大辞典)[M].Shanghai:Shanghai Scien tific and Tech-nical Publis hers,1977.[29] Zh eng H Z.Modern Research and App lication of Chines e Ma-ter ia Medica(中药现代研究与应用)[M].Beijing:Xu e-yuanPres s,1998.[30] W ang Z R,Lin J M,Zhang Z Y.The chemical com positionand ph armacological res earch progres s of A canthop anax senti-cosus[J].J Ch in Mater Med(中药材),2003,26(8):603-606.异喹啉类生物碱的生物活性和构效关系研究进展程轩轩1,2,王冬梅1,杨得坡1*(1.中山大学药学院,广东广州 510080; 2.中山大学生命科学学院,广东广州 510275)摘 要:异喹啉类生物碱在自然界中分布广泛。

具杀菌活性噻唑类化合物的研究进展具杀菌活性噻唑类化合物的研究进展第10卷第3期2006年6月农药研究与应用AGROCHEMICALSRESEARCH&APPLICATION V01.10No.3Jun2006具杀菌活性噻唑类化合物的研究进展罗晓艳,任叶果一,黄明智(1.湖南师范大学,湖南长沙410081;2.湖南化工研究院,湖南长沙410007; 3.国家农药创制工程技术研究中心,湖南长沙410007)摘要:噻唑类化合物是近年来发展的一个热点.噻唑基团引入到各种不同的化合物结构中.通过结构修饰能产生一系列具有广谱生物活性的化合物,使得它在新型超高效农药创制中发挥出越来越重要的作用.本文按照不同的结构进行分类.着重从化学结构,生物活性方面对具有杀菌活性的噻唑类化合物进行综述.并对其发展趋势和应用前景进行了展望.关键词:噻唑;杀菌剂;生物活性;进展中图分类号:$482.2文献标识码:AProwessesofStudiesonThiazoleDerivativeswitllFungicidalActivityLUOXiao-yan,RENYe-guo,HUANGMing-zhi?.(J.HunanNormalUniversity,Changsha410081,China;2.HunanResearchInstituteof ChemicalIndustry,Changsha410007,China;3.NationalEngineeringResearchCenterforAgrochemicalsChan gsha410007,China)Abstract:ThiazolecompoundshavebecometllefoCUSinthesearchofnewpestici desinrecentyears.Withtlleintrtoductionofthiazolemoietymanycompoundsdisplaybroadspectrumbioact ivities.Thiazolecompoundshaveplayedanincreasinglyimportantroleinthedevelopmentofhighlyactivepesticides. Thechemicalstructuresandbioactivitiesofthiazolecompoundswereemphaticallyreviewedbydifferentstructureinthe paper.ThedevelopingtrendandapplicationprospectsofthiazoleandthederivativesWel'~alsodiscussed.Keywords:thiazole;fungicide;bioactivity;progress目前,由于杂环化合物具有不同的生物活性,如杀菌,杀虫,除草,植物生长调节和抗病毒等,从而使之受到农药及药物研发者的极大重视[".近年来.在杂环化合物中已商品化的噻唑类化合物品种繁多.其中已开发为杀菌剂的品种有噻氟酰胺(trifluzamide)1,噻唑菌胺(ethaboxam)2和苯噻菌胺(benthiavalicarb-isopropy1)3等.噻唑类化合物因具有低毒,优良的生物活性和结构变化多样的特点,已经成为绿色农药研究的一个热点,其化学结构类型主要包括噻唑酰胺类,苯并噻唑类和联噻唑类等.本文对近十年来噻唑类杀菌剂的化学结构与生物活性的关系及其应用等方面的研究进行了综述.1噻唑酰胺类化合物吉川辛雄等合成了一系列噻唑酰胺类化合物,该类化合物对纹枯病(Rhizoctoniasolani),麦类白粉病(Erysiphegraminis),大麦条纹病F3iI2(Pnophoragraminea),黄锈病(Pucciniastriiformis)和水稻赤霉病(Gibberellazeae)等病害有较好的防治作用.噻唑菌胺[212(ethaboxam)是LG生命科学公司开发的一种内吸性杀菌剂,主要防治卵菌病害.大量的田间实验结果表明.间隔7,10d进行叶面喷施.噻唑菌胺以200ga.i/hm的用药量能有效防治葡萄霜霉病(Plasmoparaviticola),以250ga.i/ hm:的用药量能有效防治马铃薯晚疫病作者简介:罗晓艳(1982一),女,湖南攸县人,硕士研究生,主要从事新农药研制.收稿日期:20o6—03—206农药研究与应用AGROCHEMICALSRESEARCH&APPLICATION第1o卷(Phytophthorainfestarrs). W.GaryPhillips等[3]对^L苯基噻唑酰胺类化合物构效关系(SAR)的研究结果亦表明,该类化合物能够有效地抑制立枯病(Rhizoctoniasolani).苯环上取代基的吸电子效应和亲脂性对化合物的生物活性非常重要.当苯环上引入吸电子基时,则可提高对琥珀酸酯脱氢酶的抑制活性.若需达到较高活性(,卯<0.1umo1),至少要在苯环上引入三个吸电子基,而且其位置亦十分重要,当其中两个吸电子基互为邻位时活性最高,如化合物5和6.刘长令等合成了化合物7和8.化合物7在 300ga.i/hmz剂量下对马铃薯晚疫病的防效为 90%.化合物8在375ga.i/hm剂量下对西红柿晚疫病(Phytophthorainfestans)的防效为90%. 3/HVO旦2苯并噻唑类化合物2.1含肼基的苯并噻唑类化合物侯仲轲等[6]以20世纪90年代罗门?哈斯公司研究开发的二芳酰肼类昆虫生长调节剂RH一5992 为先导化合物,用稠杂环分子内碳氮双键替代二芳酰肼中的一个羰基,合成了?一特丁基位置异构的 ?一苯并噻唑一?一特丁基酰肼类新型化合物9和l0. 采用含毒介质法,在浓度0.5g/L时对水稻纹枯病菌(Rhizoctoniasolani),油菜菌核病菌(Sclerotiniasclerotiorum),黄瓜灰霉病菌(Botryt~ cinerea)和小麦赤霉病菌(Gibberellazecle)等菌丝生长抑制作用进行测试,经构效关系研究表明. 在R=4一F时化合物和R=2一C1时化合物l0分别对油菜菌核病菌的抑制活性分别达95.8%和 96.5%;R=3,5一(CH3)z时化合物对小麦赤霉病菌等的抑制率为97.5%;R=4一CHiCH3时化合物l0 对黄瓜灰霉病菌的抑制活性为82.5%.并且试验表明,化合物l0的活性略高于化合物9.E1一Gaby等例合成了具有杀菌活性的苯并噻唑衍生物丛.以生长速率法测试目标化合物的杀菌生物活性,在浓度1.0g/L时,该化合物对变型杆菌有较高的抑制活性;对金黄色葡萄球菌,青霉菌有中等抑制活性;对灵杆菌,曲霉菌的抑制活性微弱.RR910钭.112.2含酰胺基的苯并噻唑类化合物侯学太等[8合成了7一甲酰甲酯一2一酰胺基苯并噻唑化合物l,经离体平皿法测试表明,在浓度 1.0g/L时部分化合物对黄瓜灰霉病菌具有60%, 70%的抑制活性.Khedekar等[]以2一氨基一苯并噻唑为原料.合成了具有杀菌活性的含.1B一内酰胺环的苯并噻唑系列衍生物l3.由组合化学和Ihara化学工业公司联合开发的苯噻菌胺[10]3(benthiavalicarb—isopropy1)是一种新型杀菌剂.对多种作物的卵菌纲病菌都有很好的活性,以较低的剂量(25,75ga.i/hmz)能够有效地控制马铃薯和番茄的晚疫病,葡萄霜霉病,瓜类霜霉病(Pseudoperonosporacubensis),寄生霜霉病(Peronosporaparasitica),且具有较好的毒理性和环保性,对许多蔬菜和水果无毒害.l2l32.3含醚(硫醚)的苯并噻唑类化合物'Steven等[1l报道了2一(2一氟乙硫基)一4,5,6,7一四取代苯并噻唑衍生物l4,l5和l6的合成.初步生物根活性测试表明,大多数化合物对供试的真菌 [小麦根腐病菌(Fusariumgraminearum),小麦禾顶囊壳菌(Gaeumannomycesgraminis),小麦颖枯病菌(Septoriatritici),葡萄灰霉病菌(Bortrytis cinerea),稻瘟病菌(Piriculariaoryzae),水稻纹枯病菌(Rhizoctoniasolani),黑根腐病病原菌(Thielaviopsisbasicola),青霉菌(Penicillium]都有不同程度的杀死或抑制 italicumwehmer)等第3期罗晓艳.等:具杀菌活性噻唑类化合物的研究进展7 活性.Streetingc合成了(E)-2一[2一(苯并噻唑一2一氧甲基)苯基卜3一甲氧基丙烯酸甲酯17和(E)-?l_甲基一 D一甲基一2一[2一(苯并噻唑一2一氧甲基)苯基]一肟基乙酰胺塑,采用活体小株法测试表明,在浓度为0.1 时,化合物17和18对锈病的抑制率达到60%, 100%,同时化合物18对苹果黑星病(Fusicladium dendriticum)的抑制率达到60%一100%. Sidoova等[13合成了2一烷硫基一6一氨基苯并噻唑系列化合物19,以细菌(大肠杆菌,金黄色葡萄球菌)和真菌(曲霉菌,念珠菌,癣菌)为测试对象,生物活性测试结果表明,该类化合物对金黄色葡萄球菌和念珠菌都具有一定的活性.构效关系研究表明,在浓度为15.6mg/L,R一(CH2)3CH= CH2,--~H2CH=CHC2H时化合物19对念珠菌的抑制率高达100%;在浓度为32mg/L,R一(CH2)4CH =CH:时,该类化合物对金黄色葡萄球菌的抑制率达到100%.瓤142.4含磷酸酯基团的苯并噻唑类化合物冯彬等[14】以2一肼基苯并噻唑与亚磷酸酯或磷酰氯反应合成苯并噻唑肼基磷酸酯20和21,生物活性测试结果表明,化合物20(R3=Et,—Pr,n—Bu) 基本上无生物活性;采用小株活体法,在浓度为 20.0mmol/L时,化合物20对小麦锈病的抑制活性可达90%,100%;采用离体平皿法,在浓度为5.0 mmol/L时,发现化合物21(R3=4一Me,H,m—OMe,m—NO:)对小麦赤霉病有90%,100%的抑制活性.黄润秋等[1合成了?一(2一苯并噻唑基)一Ot一氨基膦酸二乙酯类化合物22.采用半叶法对烟草花叶病毒(TMV)进行抑制活性测试,并经构效关系研究表明,当R2为间位弱吸电子基时,化合物活性较好;当R2为间位供电子基时,化合物活性消失;而当R2为对位强供电子基时,化合物又有较明显的活性.李在国等[16】以2一氨基苯并噻唑与亚磷酸三苯酯及醛为原料一锅法合成了?一(2一苯并噻唑基)一一氨基膦酸二苯酯类化合物23.采用半叶法对所有化合物抗烟草花叶病毒(TMV)生物活性测试, 结果表明,在浓度为1.0mmol/L时,其中R.为甲基,R2为苯基或2,4一二氯苯基的2种化合物均具有较好的活性,抑制率均达到60%.H22232.5含硫脲基团的苯并噻唑类化合物刘源发等[17利用活性拼接原理合成了苯并噻唑基硫脲类化合物24,以苹果炭疽病菌(Colletotrichumgloeosporioides),苹果黑斑病菌 (Venturiainaequalis),甘蓝黑斑病菌(Ahernaria brassiciola),西瓜枯萎病菌(Fusariumoxysporiumf.sp.niveum)作为试验对象,所有化合物的室内生物活性试验表明,化合物对大多数菌种都有抑制活性,特别是对苹果炭疽病菌的抑制活性最高;从构效关系上看,R.为甲基,R2为硝基的化合物的抑菌杀菌生物活性优异.并b243联噻唑类化合物卞伟[18,19等报道了联噻唑化合物25,实验采用纸片扩散法选用革兰氏阴性菌大肠杆菌和革兰氏阳性菌金黄色葡萄球菌两种菌种测试化合物的抗菌活性.实验结果表明当R=H,R2=C1或R=NO2,R2 =H时化合物对阴性菌和阳性菌均有一定的抑制性, 但R=C1,R2=H时化合物对阴性菌和阳性菌均无抑制性,而R.=H,R2=OH时化合物对阴性菌有较强抑制性,对阳性菌有一定抑制性.而且实验表明联噻唑基团两侧所连的取代基团部分的结构变化对联噻唑生物活性的强弱具有一定的影响,而结构的变化对生物活性产生影响的具体原因还有待进一步探索.一8农药研究与应用AGROCHEMICALSRESEARCH&APPLICATION第lo卷4结束语删R噻唑类农药经过三十多年的发展,到现在已开发出多种高效,安全的杀菌剂,杀虫剂,除草剂, 植物生长调节剂和抗病毒剂.上面对近年来报道的部分具有杀菌活性的三种不同结构类型的噻唑类化合物作了简单的介绍,可以看出.不同的噻唑结构具有不同的生物活性.同时近几年由噻唑基团衍生而来的一系列噻唑啉类化合物和噻二唑类化合物也具有良好的杀菌活性,如韩嘉祥等合成的2一取代苯胺基一5一甲基噻唑啉类化合物对抗性的芦笋茎枯病菌表现了很高活性;毛杰等[:合成的2一取代苯氨基噻唑啉化合物对芦笋茎枯病菌和小麦赤霉病菌具有较好的抑菌活性;((PesticideOutlook))杂志曾以"下一代水稻杀菌剂"为题报道了由日本农药株式会研发的新型稻田杀菌剂噻酰菌胺E"l(tiadinil) 可用于防治稻瘟病;由浙江龙湾化工有限公司自主创制的一种噻二唑类有机铜杀菌剂噻菌铜(thiodiazole—copper)对防治作物细菌性病害具有特效,对真菌性病害有高效.由此可见,噻唑类化合物因其低毒,优良的生物活性和结构变化多样的特点将会引起更广泛的关注,我们也深信,以植物,林产品的活性物质为先导物.引人噻唑基.通过计算机辅助的分子设计和组合化学的手段.将可以找到结构新颖的先导化合物并最终会开发出环境友好,功能特异的噻唑类新农药,新药物.参考文献:[1]prehensiveHeterocyclicChemistry[M].5VdumesPergamon:Oxford,1983.733. [2]姜景久,姜升勋,金达洙,等.含有N一(一氰基一2一噻吩基)一4一乙基一2一(乙氨基)一5一噻唑甲酰胺的杀真菌组合物[P].CN:1431865,2003—07—23.[3]GaryPhillipsW,RejdaHeathJM,Thiazolecarboxanilidefungicides:anewstructure-activityrelationshipforsuocinatedehydrogenaseinhibitors[J].PesticSci,1993,38:1-7. [4]刘长令,李正名.新型先导化合物4一[4一(3,4一二甲氧苯基)一2一甲基噻唑一5一甲酰基]吗啉的设计,合成与生物活性[J].农药,2004,43(4):157—159.[5]"uCL,"ZM,ZhangB.Synthesisandbiological activityofnovel2-methy-4-trifiuoromethyl-thiazole——5——carboxamidederivatives[J].JFluorineChem,2004,125 (9):1287—1290.[6]候仲轲,任叶果,张立杰,等.N一苯并噻唑一N一特丁基酰肼类化合物的合成及生物活性研究[J].精细化工中间体,2002,32(4):18—19.[7]E1-GabyMA,MickyJ,TahaN,eta1.Antimicrobial activityofsomenovelthiourea,hydrazine,fused pyrimidineand2一f4一substituted)anilinobenzoazolederivativescontainingsu~onamidemoieties[J].Journalof theChineseChemicalSociety,2002,49:4O7—414.[8]候学太,江树人,王敏.苯并噻二唑,噻唑类植物抗病诱导剂的合成及其生物活性研究[D].北京:中国农业大学.2001.[9]KhedekarPB,BahekarRH,ChopadeRS,eta1. Synthesisandantiinflamatoryactivityofalkylidene/ arylidene-2-aminobenzothiazolesand1—ben2othiazol一2一yl一3一chl0ro—4一substituted—azetidin一2一ones[J].Arzneim—Fo~ch,2003,53(9):640—647.[1O]陈启辉.新型杀菌剂苯噻菌胺[J].农药,2004,43(11):515-517.[11]StevenF,PeterRM.Benzoxazoleandbenzothiazolederivatives[P].WO:9406783,1994-03—31.[12]StreetingDI,WorthingtonP.Benzoxazole,benzothiazole andbenzimidazolederivativesasfungicides[P].US: 5491156,1996-02-13.[13]SidoovaE,LoosD,BujdakovaH,eta1.Newanticandidous2一alkyltllio一6一aminobenzothiazoles[J].Molecules,1997,(2):36—42.[14]冯彬,黄天宝,周青春,等.芳杂环肼基磷酸酯的合成和结构表征[J].华中师范大学(自然科学版), 1998,32(4):442—448.[15]李在国,黄润秋,杨昭,等.含苯并噻唑杂环的一氨基烷基膦酸二乙酯的合成及生物活性[J].高等学校化学,1998,19(12):1970—1972.[16]李在国,黄润秋,杨昭,等.含苯并噻唑杂环的一氨基膦酸二苯酯的合成及生物活性[J].应用化学, 1999,16(2):90—92.[17]刘源发,孙国锋,孙晓红,等.1一芳酰基一3一(2一苯并噻唑)硫脲化合物毒力测定[J].西北大学(自然科学版),2003,33(1):49—51.[18]卞伟,田燕妮,杨频,等.两种新4,4,_联噻唑衍生物的合成,表征及抗菌性研究[J].山西大学(自然科学版),2000,23(3):231—233.[19]卞伟,杨频.两种新4,4"-联噻唑衍生物的合成及抗菌性研究[J].山西大学(自然科学版),2004,27 (4):381-383.[2O]韩嘉祥,李健,李树正,等.2一取代苯胺基一5一甲基噻唑啉类化合的合成和杀菌活性研究[J].浙江化工, 2000,31(1):30-31.[21]毛杰,陈建宇,李如兴,等.噻唑啉类化合物的合成和抑菌活性[J].应用化学,2004,21(12).1265—1268. [22]赵卫光,刘桂龙,王素华,等.新型稻田杀菌剂噻酰菌胺[J].农药,2003,42(1O):47-48. [23]张学郎,贾伟龙,王一风.主克白叶枯病的杀菌剂 [P].CN:1227224A.1999—09—01.。