黄铁矿制取硫酸
- 格式:doc
- 大小:26.50 KB
- 文档页数:1

工业制硫酸方案引言工业制硫酸是一种重要的化工工艺,广泛应用于许多工业领域,例如化肥生产、金属冶炼和废水处理等。
本文将介绍一种常见的工业制硫酸方案,包括硫矿的选矿与制酸过程。
硫矿的选矿硫矿的种类硫矿是指含有高浓度硫元素的矿石,常见的硫矿主要有黄铁矿、白铁矿和黄铜矿等。
在工业制硫酸的过程中,选择适合的硫矿对于提高产量和质量至关重要。
选矿工艺硫矿的选矿工艺一般包括破碎、磨矿、浮选等步骤。
首先,将原始硫矿经过破碎和磨矿处理,得到合适的矿石颗粒大小;然后,采用浮选工艺将硫矿与杂质分离,得到富含硫的硫精矿。
制酸过程硫矿的烧结硫精矿通过烧结工艺转化为硫酸。
烧结是将硫精矿加热至一定温度,使硫精矿中的硫元素氧化为二氧化硫气体的过程。
烧结炉是常用的设备,硫矿与空气在炉内进行反应,生成二氧化硫气体。
二氧化硫的净化二氧化硫气体中常含有一定的杂质,如尘埃和氧气等。
这些杂质会影响后续的反应产物质量和设备运行。
因此,需要对二氧化硫气体进行净化处理。
净化二氧化硫气体的常用方法是采用干法洗涤和湿法洗涤。
干法洗涤一般使用碱液吸附气体中的杂质,湿法洗涤则是通过水洗涤将杂质溶解掉。
选择适合的净化方法取决于具体的要求和硫矿的特性。
硫酸的制备经过净化的二氧化硫气体可以进一步用于硫酸的制备。
硫酸通常采用接触法制备,具体步骤如下:1.将净化后的二氧化硫气体经过压缩处理,以提高反应速率和减少空间占用。
2.将压缩后的二氧化硫气体与氧气在催化剂存在下进行反应,生成三氧化硫。
3.三氧化硫与水反应生成硫酸。
硫酸的制备工艺一般较为成熟,而且可以根据需要进行优化或改良,以提高产量和降低能耗。
结论工业制硫酸是一种复杂的化工工艺,涉及到选矿、烧结、气体净化和硫酸制备等多个过程。
这些过程都需要合理的工艺控制和设备支持,以确保硫酸的质量和产量达到预期的要求。
希望本文所介绍的工业制硫酸方案能对相关领域的从业人员提供参考和帮助。

【化学】化学化学综合题题20套(带答案)一、中考化学综合题1.黄铁矿(主要成分为FeS2,杂质高温下不反应。
)是我国硫酸厂制取硫酸的主要原料。
某兴趣小组欲测定某黄铁矿中FeS2含量,设计了如下实验 (假设每步反应均完全)。
【查阅资料】①4FeS2+11O2 2Fe2O3+8SO2②Na2SO3+H2O2 =Na2SO4+H2③BaSO4为一种不溶于水、不溶于盐酸的沉淀。
【实验探究】Ⅰ.称取4.80g黄铁矿样品放入下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
Ⅱ.反应结束后,将B瓶中的溶液按上图流程进行处理。
【问题讨论】(1)Ⅰ中B瓶内发生反应的化学反应方程式是______和______;(2)Ⅰ中通入的空气中作用是______和______;(3)Ⅱ中加入盐酸溶液的目的是______;(4)Ⅱ中检验滤渣洗涤是否干净的方法是______。
【含量测定】(5)另取 4.80g黄铁矿样品在空气中加热,测出样品的固体残留率(固体样品的剩余质量固体样品的起始质量×100%)随温度的变化如下图所示,计算该黄铁矿中FeS2的质量分数为______。
(请写出计算过程)【答案】CO2+2NaOH=Na2CO3+H2O SO2+2NaOH=Na2SO3+H2O;提供反应所需的氧气将生成的二氧化硫气体排入装置B中除去产生的BaCO3沉淀;取最后一次洗涤液1~2mL于试管中,向其中滴加硝酸银(或稀硫酸、碳酸钠)溶液,若无白色沉淀生成,则表明已洗涤干净。
75%【解析】(1)根据空气中的二氧化碳与氢氧化钠溶液反应生成碳酸钠和水及FeS2与氧气反应生成的二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水解答;(2)根据空气能提供与硫化亚铁反应所需的氧气和将生成的二氧化硫气体排入装置B中解答;(3)根据盐酸能将反应生成的碳酸钡除去解答;(4)根据过滤出来的硫酸钡沉淀是湿润的分析解答;(5)根据反应的化学方程式计算解答。

黄铁矿的性质及应用黄铁矿,化学式为FeS2,是一种含有铁和硫元素的矿石。
它是一种非金属矿石,也被称为"黄金"。
黄铁矿有着特殊的性质和广泛的应用。
首先,黄铁矿的外观呈金黄色,晶体形态多为立方体。
它的硬度较小,在3.5-4之间,比较脆,比较重。
黄铁矿的特殊之处在于,当它被碰撞或加热时,会产生火花。
这是由于黄铁矿具有高碳的特性,与空气中的氧气反应产生高温。
这一特点使黄铁矿在火药和火焰效果的制备中有着重要的应用。
黄铁矿的主要成分是硫化铁,它含有丰富的铁元素。
铁是一种非常重要的金属,广泛应用于建筑、制造、冶金等许多领域。
黄铁矿是一种较为常见的矿石,具有丰富的储量和开发潜力。
通过对黄铁矿的采矿和炼制,可以获取纯度较高的铁矿石,用于制造钢铁、机械设备、建筑材料等。
此外,黄铁矿还有着一些其他的应用。
由于其特殊的物理和化学性质,黄铁矿被广泛应用于冶金和冶炼过程中。
在冶金过程中,黄铁矿可以作为还原剂,与氧气反应,将含氧化合物还原为金属。
这使得黄铁矿在提取铜、镍等贵金属的过程中具有重要的作用。
此外,黄铁矿还可以用于储能材料。
其高压相在合适温度和压力下具有较高电导率和稳定性,被广泛应用于锂离子电池和储能设备中。
黄铁矿在这些应用中的主要作用是作为电极材料,存储和释放电荷。
此外,黄铁矿还可以用于制备硫酸和硫酸盐。
黄铁矿可以与酸反应,生成硫酸和硫酸盐。
这些化合物在化工、肥料、水处理等领域中有着广泛的应用。
此外,黄铁矿还有一些其他的应用领域。
比如,黄铁矿可以用于制备染料、颜料和橡胶填料。
此外,由于其特殊的颜色和火花效果,黄铁矿还经常被用于制作漂亮的首饰和装饰品。
综上所述,黄铁矿具有特殊的物理和化学性质,具有广泛的应用领域。
它的主要应用包括制造钢铁、冶金过程中的还原剂、储能材料、制备硫酸和硫酸盐等。
此外,黄铁矿还有一些其他的应用领域,如染料、颜料和装饰品等。
由于黄铁矿资源丰富,其在工业和科技领域的应用前景十分广阔。

硫铁矿制酸技术理论简易计算及综合说明在硫化铁全部被氧化成三氧化二铁(Fe2O3)的计算过程一.黄铁矿(二硫化铁FeS2)制酸计算1. 造气(制SO2): 4 FeS2 + 11 O2 ===高温(850℃~980℃)=== 8 SO2 + 2 Fe2O3以及:S + O2 == SO24 FeS2的分子量:4×(56 + 32×2)= 4×120 = 4802 Fe2O3的分子量:2×(56×2 + 16×3)= 2×160 = 320(从理论上讲:100%的FeS2中,铁占其46.66%,硫占其53.34%;而100%的Fe2O3中,铁占其70%,氧占其30%)即:在完全反应的情况下,干基480单位的硫精砂(二硫化铁——黄铁矿砂)能反应生成320单位的三氧化二铁(硫酸渣)。
在不考虑杂质含量的前提下,理论产渣率为66.67%,也就是说一吨纯净干基的二硫化铁能产三氧化二铁666.7公斤。
但由于实际的工业硫精砂内有2.5%~4% 的杂质,且反应不能完全,所以通常的产渣率在64%~65%之间,设备差一点的也应不低于63%。
2. 接触氧化(SO2再经氧化,制成SO3):2 SO2 + O2 ===催化剂V2O5(400℃~500℃)=== 2 SO3 (制SO3)即:480单位的FeS2可以生成512单位的SO2,再经氧化可以生成640单位的SO3。
3. 三氧化硫的吸收(制H2SO4):SO3 + H2O ==== H2SO4 (制硫酸)即:640单位的SO3可以生成784单位的H2SO4,也就是说:干基480单位的硫精砂(二硫化铁——黄铁矿砂)能反应生成784单位的H2SO4,即理论上一吨优质硫精砂(二硫化铁——黄铁矿砂)可以制成1.63吨H2SO4。
工业上为了更可能把三氧化硫吸收干净并在吸收过程中不形成酸雾,则:SO3 + H2SO4(浓) == H2S2O7 再加水配成各种浓度的H2SO4二.硫化亚铁(一硫化铁FeS)制酸计算1. 造气(制SO2): 4 FeS + 7 O2 ===高温(850℃~980℃)=== 4 SO2 + 2 Fe2O3以及:S + O2 == SO24 FeS的分子量:4×(56 + 32)= 4×88 = 3522 Fe2O3的分子量:2×(56×2 + 16×3)= 2×160 = 320(从理论上讲:100%的FeS中,铁占其63.64%,硫占其36.36%;而100%的Fe2O3中,铁占其70%,氧占其30%)即:在完全反应的情况下,干基352单位的硫精砂(硫化亚铁)能反应生成320单位的三氧化二铁(硫酸渣)。

【化学】化学化学综合题练习题含答案及解析一、中考化学综合题1.黄铁矿(主要成分为FeS2,杂质高温下不反应。
)是我国硫酸厂制取硫酸的主要原料。
某兴趣小组欲测定某黄铁矿中FeS2含量,设计了如下实验 (假设每步反应均完全)。
【查阅资料】①4FeS2+11O2 2Fe2O3+8SO2②Na2SO3+H2O2 =Na2SO4+H2③BaSO4为一种不溶于水、不溶于盐酸的沉淀。
【实验探究】Ⅰ.称取4.80g黄铁矿样品放入下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
Ⅱ.反应结束后,将B瓶中的溶液按上图流程进行处理。
【问题讨论】(1)Ⅰ中B瓶内发生反应的化学反应方程式是______和______;(2)Ⅰ中通入的空气中作用是______和______;(3)Ⅱ中加入盐酸溶液的目的是______;(4)Ⅱ中检验滤渣洗涤是否干净的方法是______。
【含量测定】(5)另取 4.80g黄铁矿样品在空气中加热,测出样品的固体残留率(固体样品的剩余质量固体样品的起始质量×100%)随温度的变化如下图所示,计算该黄铁矿中FeS2的质量分数为______。
(请写出计算过程)【答案】CO2+2NaOH=Na2CO3+H2O SO2+2NaOH=Na2SO3+H2O;提供反应所需的氧气将生成的二氧化硫气体排入装置B中除去产生的BaCO3沉淀;取最后一次洗涤液1~2mL于试管中,向其中滴加硝酸银(或稀硫酸、碳酸钠)溶液,若无白色沉淀生成,则表明已洗涤干净。
75%【解析】(1)根据空气中的二氧化碳与氢氧化钠溶液反应生成碳酸钠和水及FeS2与氧气反应生成的二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水解答;(2)根据空气能提供与硫化亚铁反应所需的氧气和将生成的二氧化硫气体排入装置B中解答;(3)根据盐酸能将反应生成的碳酸钡除去解答;(4)根据过滤出来的硫酸钡沉淀是湿润的分析解答;(5)根据反应的化学方程式计算解答。
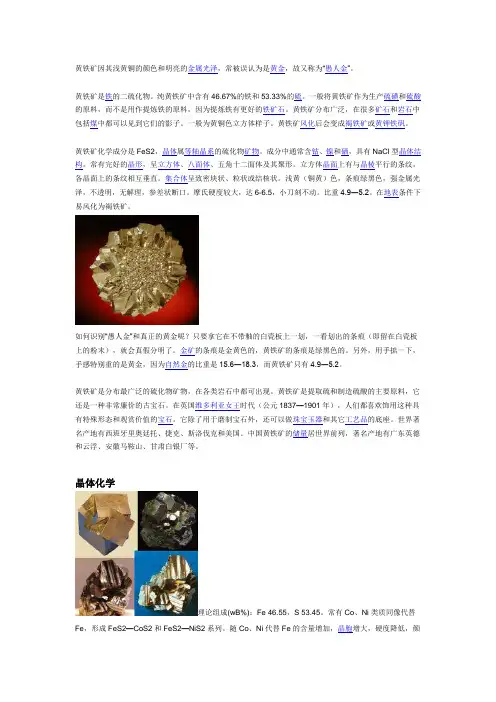
黄铁矿因其浅黄铜的颜色和明亮的金属光泽,常被误认为是黄金,故又称为“愚人金”。
黄铁矿是铁的二硫化物。
纯黄铁矿中含有46.67%的铁和53.33%的硫。
一般将黄铁矿作为生产硫磺和硫酸的原料,而不是用作提炼铁的原料,因为提炼铁有更好的铁矿石。
黄铁矿分布广泛,在很多矿石和岩石中包括煤中都可以见到它们的影子。
一般为黄铜色立方体样子。
黄铁矿风化后会变成褐铁矿或黄钾铁矾。
黄铁矿化学成分是FeS2,晶体属等轴晶系的硫化物矿物。
成分中通常含钴、镍和硒,具有NaCl型晶体结构。
常有完好的晶形,呈立方体、八面体、五角十二面体及其聚形。
立方体晶面上有与晶棱平行的条纹,各晶面上的条纹相互垂直。
集合体呈致密块状、粒状或结核状。
浅黄(铜黄)色,条痕绿黑色,强金属光泽,不透明,无解理,参差状断口。
摩氏硬度较大,达6-6.5,小刀刻不动。
比重4.9―5.2。
在地表条件下易风化为褐铁矿。
如何识别“愚人金”和真正的黄金呢?只要拿它在不带釉的白瓷板上一划,一看划出的条痕(即留在白瓷板上的粉末),就会真假分明了。
金矿的条痕是金黄色的,黄铁矿的条痕是绿黑色的。
另外,用手掂一下,手感特别重的是黄金,因为自然金的比重是15.6―18.3,而黄铁矿只有4.9―5.2。
黄铁矿是分布最广泛的硫化物矿物,在各类岩石中都可出现。
黄铁矿是提取硫和制造硫酸的主要原料,它还是一种非常廉价的古宝石。
在英国维多利亚女王时代(公元1837—1901年),人们都喜欢饰用这种具有特殊形态和观赏价值的宝石。
它除了用于磨制宝石外,还可以做珠宝玉器和其它工艺品的底座。
世界著名产地有西班牙里奥廷托、捷克、斯洛伐克和美国。
中国黄铁矿的储量居世界前列,著名产地有广东英德和云浮、安徽马鞍山、甘肃白银厂等。
晶体化学理论组成(wB%):Fe 46.55,S 53.45。
常有Co、Ni类质同像代替Fe,形成FeS2—CoS2和FeS2—NiS2系列。
随Co、Ni代替Fe的含量增加,晶胞增大,硬度降低,颜色变浅。

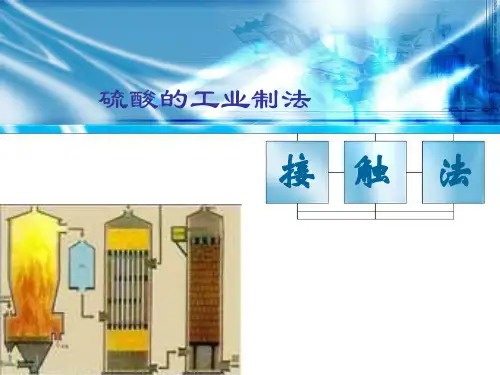
硫酸的工业制法———接触法制硫酸
⑴接触法制硫酸的过程和原理(完成化学方程式):
(1)造气:4FeS2+11O2==2Fe2O3+8SO2(在沸腾炉中进行);
(2)接触氧化:2SO2+O2==2SO3(在接触室中进行);
(3)SO3的吸收:SO3+H2O==H2SO4(在吸收塔中进行)。
量空气。
⑶煅烧黄铁矿制得的炉气中含有SO2、O2、N2、水蒸气及砷、硒等化合物和矿尘,
需要除尘、__洗涤____和干燥,避免催化剂中毒。
条件下进行有利?
①使用催化剂:V2O5
②温度的选择:400℃--500℃
③压强的选择:常压
⑸接触氧化过程,应用了热交换器设备,其优点是预热炉气、冷却反应后生成的气体。
⑹工业上用98%浓硫酸吸收SO3,是因为防止形成酸雾,以便使三氧化硫吸收完全,提高三氧化硫的吸收效率。
⑺硫酸工业“三废”的处理和利用:
①尾气中的SO2,用氨水吸收,可得到氮肥。
反应方程式是SO2+2NH3+H2O=(NH4)2SO3
(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O。
②污水中含有硫酸,可用石灰乳吸收,反应方程式是Ca(OH)2+H2SO4=CaSO4+2H2O
③废渣的利用。
矿渣一般可用来作为制造水泥的原料或用于制砖
含铁品位高的矿渣,经处理后可以炼铁。
④硫酸生产过程中的三个反应是放热反应。
⑤如果要筹建一间硫酸厂,你认为应该考虑哪些因素?
硫酸厂靠近消费中心比靠近原料产地更为有利
硫酸厂不应建在人口稠密的居民区和环保要求高的地区。
生产过程示意图。



工业制硫酸1.原料:主要有硫铁矿、(或者硫磺)、空气、有色金属冶炼的烟气、石膏等。
2.生产流程(1)SO2的制取(设备:沸腾炉)①原料为硫黄:S+O2SO2,②原料为硫铁矿:4FeS+11O28SO2+2Fe2O3。
(2)SO2的催化氧化(设备:接触室):2SO2+O22SO3(3)SO3的吸收(设备:吸收塔):SO3+H2O===H2SO4。
注意:工业上用98%的浓硫酸吸收SO3,这样可避免形成酸雾并提高吸收效率。
3.三废的利用(1)尾气吸收废气中的SO2用氨水吸收,生成的(NH4)2SO4作化肥,SO2循环使用。
SO2+2NH3+H2O===(NH4)2SO3或SO2+NH3+H2O===NH4HSO3(NH4)2SO3+H2SO4===(NH4)2SO4+SO2↑+H2O或2NH4HSO3+H2SO4===(NH4)2SO4+2SO2↑+2H2O(2)污水处理废水可用Ca(OH)2中和,发生反应为SO2+Ca(OH)2===CaSO3↓+H2O。
(3)废渣的处理作水泥或用于建筑材料;回收有色金属等综合利用。
4.反应条件:2SO2+O22SO3放热可逆反应(低温、高压会提升转化率)转化率、控制条件的成本、实际可能性。
即选:400℃~500℃,常压,五氧化二钒(V2O5)作催化剂。
5.以黄铁矿为原料生产硫酸的工艺流程图如下:人工固氮技术——合成氨1.反应原理N2+3H22NH3ΔH<0反应特点:(1)该反应为可逆反应。
(2)正反应为气体体积减小的反应。
(3)正反应为放热反应。
2.条件的选择结合反应的三个特点及实际生产中的动力,材料设备,成本等因素,得出合成氨的适宜条件是:(1)压强:20MPa~50MPa;(2)温度:500℃;(3)催化剂:铁触媒;(4)循环操作:反应混合气通过冷凝器,使氨液化并分离出来,N2、H2再通过循环压缩机送入合成塔。
3.生产流程(1)造气①N2:可用分离液态空气获得。
硫酸的原材料硫酸是一种重要的化工原料,广泛应用于冶金、石化、制药、农业等领域。
硫酸的生产需要大量的原材料,其中最主要的原材料是硫和氧气。
硫酸的原材料主要来源于硫矿石和硫化氢。
硫矿石是硫酸的重要原料之一,它是一种含有丰富硫元素的矿石,常见的硫矿石有辉石、黄铁矿、黄铜矿等。
硫矿石的开采和提炼是硫酸生产的重要环节,一般经过破碎、浮选、干燥等工艺过程,将硫矿石中的硫元素提取出来,制成硫粉或硫砂,作为硫酸的原料。
另外,硫化氢也是硫酸的重要原材料之一。
硫化氢是一种无色有刺激性气味的气体,常见于石油、天然气等化石燃料的加工过程中。
硫化氢可以通过加热硫矿石或硫化物矿石,或者通过水煤气反应得到。
硫化氢作为硫酸的原材料,在工业生产中有着重要的应用价值。
除了硫和硫化氢,氧气也是硫酸的重要原材料之一。
氧气是硫酸生产过程中的氧化剂,它可以与硫元素发生氧化反应,生成二氧化硫,再与水反应生成硫酸。
因此,氧气在硫酸生产中起着至关重要的作用。
除了硫、硫化氢和氧气,还有一些辅助原材料在硫酸生产中发挥着重要作用。
比如在硫酸生产过程中,常常需要使用一些催化剂和助剂,以提高反应速率和产率,减少能耗和原材料消耗。
此外,还需要使用一定量的水和其他溶剂,以调节反应体系的温度、浓度和流动性。
总的来说,硫酸的原材料主要包括硫、硫化氢、氧气以及一些辅助原材料。
这些原材料经过一系列的化工反应和工艺处理,最终可以得到高纯度的硫酸产品。
硫酸作为一种重要的化工原料,在工业生产和日常生活中有着广泛的应用,其生产过程中对原材料的选择和利用至关重要。
希望本文对硫酸的原材料有所帮助,谢谢阅读。
第一节接触法制硫酸•教学目标1•了解接触法制硫酸的化学原理、原料、生产流程和典型设备。
2•通过二氧化硫接触氧化条件的讨论,复习巩固关于化学反应速率和化学平衡的知识,训练学生应用理论知识分析和解决问题的能力。
一、反应原理1.S+ O2===SO2催化剂生2S0:十Q 區一ZSO H3.SO3+ H2O===H2SO4现阶段我国硫酸的生产原料以黄铁矿(主要成分为FeS2)为主,部分工厂用有色金属冶炼厂的烟气、矿产硫黄或从石油、天然气脱硫获得硫黄作原料。
咼温4FeS2+ IIO2 2Fe2O3 + 8SO2如以石膏为原料的第一步反应就是:2CaSO4 + C 2CaO + 2SO2 f + CO2二、工业制硫酸的生产流程。
工业上制硫酸主要经过以下几个途径:-- ”造"壬--- ”罠化 --- *■成燧--- ►1、以黄铁矿为原料制取SO2的设备叫沸腾炉。
沸腾炉示意图潯腭炉矿石粉碎成细小的矿粒,是为了增大与空气的接触面积,通入强大的空气流为使矿粒燃烧得更充分,从而提高原料的利用率。
[设问]黄铁矿经过充分燃烧,以燃烧炉里出来的气体叫做“炉气”。
但这种炉气往往不能直接用于制取SO3,这是为什么呢?这是因为炉气中常含有很多杂质,如N2,水蒸气,还有砷、硒的化合物及矿尘等。
这些杂质有些是对生产不利的,如砷硒的化合物、矿尘能够使下一步氧化时的催化剂中毒,水蒸气对设备也有不良影响,因此炉气必须经过净化、干燥处理。
问题:1.N 2对硫酸生产没有用处,为什么不除去?2.工业生产上为什么要控制条件使 S02、02处于上述比例呢?[答案]1.N 2对硫酸的生产没有用处,但也没有不利之处,若要除去,势必会增加生产 成本,从综合经济效益分析没有除去的必要。
2•这样的比例是增大反应物中廉价的氧气的浓度,而提高另一种反应物二氧化硫的转化率,从而有利于 S02的进一步氧化。
三、生产设备及工艺流程炉气(S0z .0z 及亲质)需净■化、干煥2•接触室根据化学反应原理,二氧化硫的氧化是在催化剂存在条件下进行的,目前工业生产上采用的是钒催化剂。
1前言 加人世贸组织两年多来,硫磺、硫酸的国际、国内两个市场风诡云橘,足以使我国硫酸
界人士初识市场经济的“庐山”真面目。在2002年四季度,也就是在我国加人WTO还不到一
年的时候,进口硫磺价格猛涨,从40一50美元/t上涨到70-80美元/t,从而遏制了我国硫磺制
酸迅猛发展的势头,同时也给多年来已经跌至低谷的自有资源硫铁矿制酸的重新发展创造了
一线生机。目前硫磺价格在125美夕口t左右,处于相对高的价位。解读当前硫铁矿和硫磺
制酸成本,不难发现硫铁矿制酸成本已经大大低于硫磺制酸。2004年是我国人世的第三年,
今后的两三年,加人世贸组织对我国经济的影响将全面显现,硫酸市场和其他产品市场一样将
面临真正的考验。在这种错综复杂的新形势下,我国的硫铁矿制酸如何抓住机遇科学发展?笔
者试述自己的一孔之见,与硫酸界同仁商榷共勉。2硫铁矿、硫磺制酸生产成本对照分析 据
有关资料统计仁’〕:2001年硫铁矿制酸成本为242.13元/t,硫磺制酸成本为237.53元/t,两者
基本持平,硫铁矿制酸高出4.6元/t;2002年,由于硫磺涨价,硫铁矿制酸成本为243.85元/t,硫磺
制酸成本为297.38元/t,硫磺制