几丁质酶(Chitinase)试剂盒使用说明
- 格式:pdf
- 大小:83.14 KB
- 文档页数:5
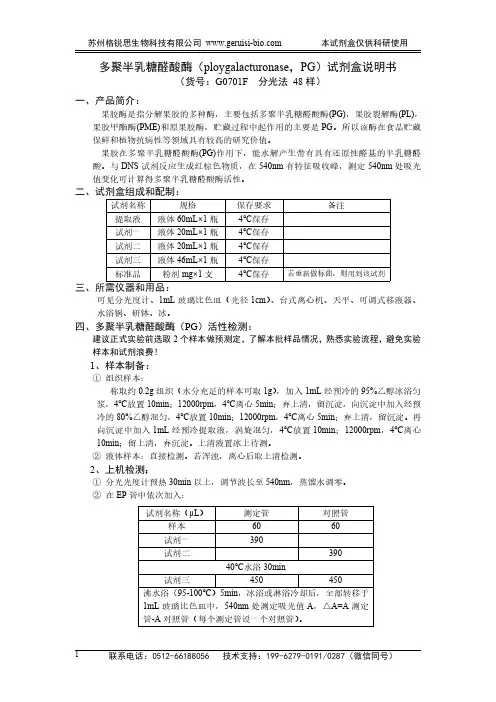
多聚半乳糖醛酸酶(ploygalacturonase,PG)试剂盒说明书(货号:G0701F分光法48样)一、产品简介:果胶酶是指分解果胶的多种酶,主要包括多聚半乳糖醛酸酶(PG),果胶裂解酶(PL),果胶甲酯酶(PME)和原果胶酶,贮藏过程中起作用的主要是PG。
所以该酶在食品贮藏保鲜和植物抗病性等领域具有较高的研究价值。
果胶在多聚半乳糖醛酸酶(PG)作用下,能水解产生带有具有还原性醛基的半乳糖醛酸。
与DNS试剂反应生成红棕色物质,在540nm有特征吸收峰,测定540nm处吸光值变化可计算得多聚半乳糖醛酸酶活性。
二、试剂盒组成和配制:试剂名称规格保存要求备注提取液液体60mL×1瓶4℃保存试剂一液体20mL×1瓶4℃保存试剂二液体20mL×1瓶4℃保存试剂三液体46mL×1瓶4℃保存标准品粉剂mg×1支4℃保存若重新做标曲,则用到该试剂三、所需仪器和用品:可见分光度计、1mL玻璃比色皿(光径1cm)、台式离心机、天平、可调式移液器、水浴锅、研钵、冰。
四、多聚半乳糖醛酸酶(PG)活性检测:建议正式实验前选取2个样本做预测定,了解本批样品情况,熟悉实验流程,避免实验样本和试剂浪费!1、样本制备:①组织样本:称取约0.2g组织(水分充足的样本可取1g),加入1mL经预冷的95%乙醇冰浴匀浆,4℃放置10min;12000rpm,4℃离心5min;弃上清,留沉淀,向沉淀中加入经预冷的80%乙醇混匀,4℃放置10min;12000rpm,4℃离心5min;弃上清,留沉淀。
再向沉淀中加入1mL经预冷提取液,涡旋混匀,4℃放置10min;12000rpm,4℃离心10min;留上清,弃沉淀。
上清液置冰上待测。
②液体样本:直接检测。
若浑浊,离心后取上清检测。
2、上机检测:①分光光度计预热30min以上,调节波长至540nm,蒸馏水调零。
②在EP管中依次加入:试剂名称(μL)测定管对照管样本6060试剂一390试剂二39040℃水浴30min试剂三450450沸水浴(95-100℃)5min,冰浴或淋浴冷却后,全部转移于1mL玻璃比色皿中,540nm处测定吸光值A,△A=A测定管-A对照管(每个测定管设一个对照管)。

透析透析专用专用专用细菌内细菌内细菌内毒毒素检测鲎试剂盒使用说明书(凝胶法)【品名品名】】透析用水及透析液细菌内毒素检测鲎试剂盒【规格规格】】1样份/盒【用途用途】】用于透析用水或透析液细菌内毒素检测。
【原理原理】】该鲎试剂为鲎科动物东方鲎的血液变形细胞溶解物的冷冻干燥品, 鲎试剂中含有C因子、B 因子、凝固酶原、凝固蛋白原等。
在适宜的条件下,细菌内毒素激活C 因子,引起一系列酶促反应,使鲎试剂产生凝集反应形成凝胶。
【试剂盒组成试剂盒组成】】名称 规格/数量 用途 1 鲎试剂(TAL ) 0.5EU/ml ×8支 反应主剂 2 内毒素工作标准品(CSE ) 1EU/支×2支 阳性对照和供试品阳性对照 3 细菌内毒素检查用水(TRW ) 2ml ×3支 鲎试剂与内毒素溶解 4 辅液Ⅰ 0.7ml ×1支 样本稀释 5 采样瓶 10ml ×1支 透析用水或透析液采集 6 空安瓿 2ml ×1支 样本稀释 7 除热原吸头 200µl ×2包,1ml ×1包 移取样本及内毒素溶液 8 使用说明书 1份 操作说明 9 质检报告 1份 质检报告【需准备的材料和设备需准备的材料和设备】】除本试剂盒外需准备旋涡混合器、移液器、试管架、恒温水浴箱或恒温器(37±1℃)。
【用法用法】】1. 供试品溶液及对照制备1.1阴性对照溶液的制备即细菌内毒素检查用水(TRW )。
1.2阳性对照溶液的制备一般为浓度为2λ的内毒素溶液(λ为鲎试剂的的标示灵敏度)。
例如:取效价为1EU/支的内毒素工作品(CSE )1支,加入1.0ml 细菌内毒素检查用水(TRW ),在旋涡混合器震摇2-3min 得1.0EU/ml 内毒素阳性对照溶液。
1.3供试品溶液的制备用无热原采样瓶采集适量透析用水或透析液。
若样本的内毒素限值(L )为1.0EU/ml ,按鲎试剂的灵敏度λ及样本的内毒素限值L 计算供试品德最大有效稀释倍数(MVD ),M V D = L /λ当λ= 0.5 EU/ml ,L= 1.0EU/ml 时,M V D =2(倍),取样本0.7ml 于试剂盒配套辅液Ⅰ中,用旋涡混合器混匀1min 后,即为待测供试品溶液。

细胞基质金属蛋白酶2活性荧光定量检测试剂盒产品说明书(中文版)主要用途细胞基质金属蛋白酶2(MMP2)活性荧光定量检测试剂是一种旨在通过荧光探针MCA供体和DAP/DNP 受体双重标记的多肽底物PLGLAR,在特定抑制剂存在与否的情况下,受到MMP2蛋白酶的水解,解离抑制基团,产生荧光产物,即采用荧光法来测定样品中酶活性的权威而经典的技术方法。
该技术经过精心研制、成功实验证明的。
其适用于各种细胞裂解萃取液样品(动物、人体)、部分或完全纯化酶样品中基质金属蛋白酶2的特异活性定量检测,以及抑制剂和激活剂的筛选。
产品严格无菌,即到即用,操作简捷,性能稳定,安全可靠。
技术背景基质金属蛋白酶(Matrix metalloproteinases;MMPs)是一类结构高度同源的分泌型或膜相关性锌内肽酶的总称,因含有金属(锌、钙)离子而得名。
其功能在于分解细胞外基质成分。
迄今为止发现的MMPs至少有28种,几乎能降解除多糖以外的全部细胞外基质(extracellular matrix)成分,同时参与胚胎发育、形态形成、胚泡植入(blastocyst)、血管形成、组织再吸收(tissue resorption)、疾病发生,例如关节炎、癌细胞浸入转移等。
根据降解的底物不同可将MMPs分为4大类:(1)胶原酶:MMP1、MMP8、MMP13主要消化Ⅰ、Ⅱ、Ⅲ、Ⅶ、Ⅹ型胶原和蛋白多糖;(2)明胶酶(Ⅳ型胶原酶):MMP2、MMP9,又称明胶酶A、B,主要消化Ⅳ、Ⅴ、Ⅶ、Ⅹ型胶原和弹性纤维;(3)基质溶解素:MMP3、MMP7、MMP16、MMP11、MMP12,主要作用于纤维粘连蛋白、层粘连蛋白、弹力纤维、Ⅲ、Ⅳ、Ⅴ、Ⅶ、Ⅸ胶原及MMP1、MMP8、MMP9;(4)膜型金属蛋白酶:MT1-MMP、MT2-MMP、MT3-MMP,主要作用于明胶、Ⅳ型胶原、MMP2。
体内绝大多数细胞并不储备MMPs,当需要MMPs的信号传递到细胞后才临时合成,合成的MMPs以无活性的酶原(proenzyme)形式分泌到细胞外,随后被多种蛋白酶和非蛋白酶水解以及热处理激活,一种激活的MMPs 可激活另一种MMPs,形成瀑布效应。
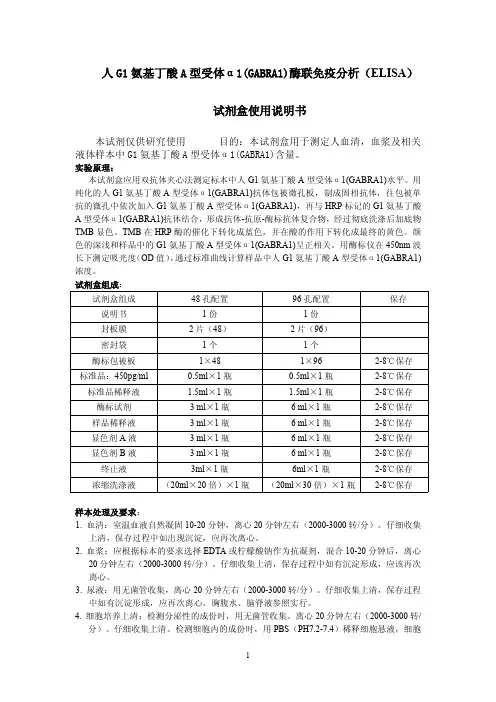
人G1氨基丁酸A型受体α1(GABRA1)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,血浆及相关液体样本中G1氨基丁酸A型受体α1(GABRA1)含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中人G1氨基丁酸A型受体α1(GABRA1)水平。
用纯化的人G1氨基丁酸A型受体α1(GABRA1)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入G1氨基丁酸A型受体α1(GABRA1),再与HRP标记的G1氨基丁酸A型受体α1(GABRA1)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的G1氨基丁酸A型受体α1(GABRA1)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人G1氨基丁酸A型受体α1(GABRA1)浓度。
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×481×962-8℃保存标准品:450pg/ml0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂3ml×1瓶6ml×1瓶2-8℃保存样品稀释液3ml×1瓶6ml×1瓶2-8℃保存显色剂A液3ml×1瓶6ml×1瓶2-8℃保存显色剂B液3ml×1瓶6ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存样本处理及要求:1.血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。

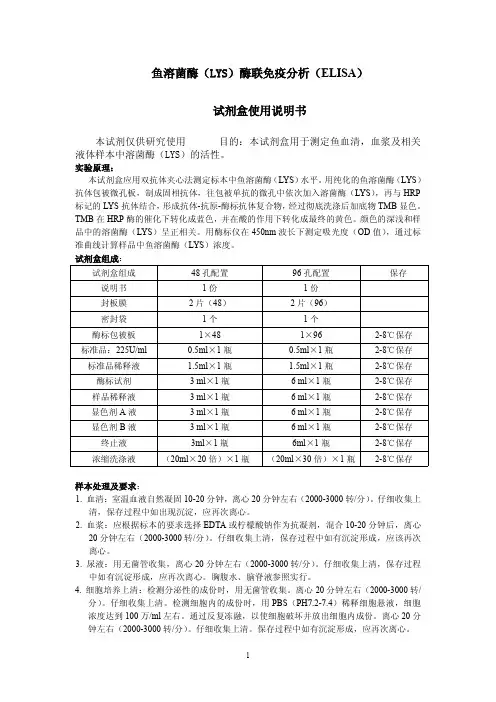
鱼溶菌酶(LYS)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定鱼血清,血浆及相关液体样本中溶菌酶(LYS)的活性。
实验原理:本试剂盒应用双抗体夹心法测定标本中鱼溶菌酶(LYS)水平。
用纯化的鱼溶菌酶(LYS)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入溶菌酶(LYS),再与HRP 标记的LYS抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的溶菌酶(LYS)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中鱼溶菌酶(LYS)浓度。
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×481×962-8℃保存标准品:225U/ml0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂3ml×1瓶6ml×1瓶2-8℃保存样品稀释液3ml×1瓶6ml×1瓶2-8℃保存显色剂A液3ml×1瓶6ml×1瓶2-8℃保存显色剂B液3ml×1瓶6ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存样本处理及要求:1.血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2.血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。

大肠杆菌菌体蛋白残留量(E.coli DH-5α)酶联免疫分析(ELISA)试剂盒使用说明书本试剂盒仅供研究使用。
1使用目的:本试剂盒用于饲料、鱼、虾和肉类组织(如鸡、牛肉和猪肉),药物、血清和尿样中大肠杆菌菌体蛋白残留量(E.coli DH-5α)残留的定量检测。
2实验原理本试剂盒采用竞争ELISA方法,在微孔板包被有大肠杆菌菌体蛋白残留量(E.coli DH-5α)偶联抗原,加入大肠杆菌菌体蛋白残留量(E.coli DH-5α)标准品或样品,游离大肠杆菌菌体蛋白残留量(E.coli DH-5α)与微孔条上预包被的大肠杆菌菌体蛋白残留量(E.coli DH-5α)偶联抗原互相竞争抗大肠杆菌菌体蛋白残留量(E.coli DH-5α)抗体酶标记物,用TMB底物显色,加入终止液后颜色由蓝色变为黄色,用酶标仪在450nm波长下进行检测,吸光值与样品中大肠杆菌菌体蛋白残留量(E.coli DH-5α)含量成反比,通过标准曲线计算样品中大肠杆菌菌体蛋白残留量(E.coli DH-5α)的含量。
3试剂盒组成3.1预包被的大肠杆菌菌体蛋白残留量(E.coli DH-5α)偶联抗原的可拆酶标板:1块(12孔×8条)。
3.2大肠杆菌菌体蛋白残留量(E.coli DH-5α)标准品:6瓶(1ml/瓶),含量分别是:0ug/ml, 0.1ug/ml,0.3ug/ml,0.9ug/ml,2.7ug/ml,8.1ug/ml3.3抗大肠杆菌菌体蛋白残留量(E.coli DH-5α)抗体酶结合物:1瓶(6ml)。
3.4显色液A:1瓶(6ml)。
3.5显色液B:1瓶(6ml)。
3.6终止液:1瓶(6ml),2M硫酸。
3.7样本稀释液:1瓶(10×,6ml),用于样品稀释用。
3.8浓缩洗涤液:1瓶(20×,20ml),用于洗板。
3.9说明书一份。
4需要而未提供的材料4.1设备4.1.1波长450nm酶标仪。

碱性蛋白酶活性测定试剂盒使用说明分光光度法注意:正式测定前务必取2-3个预期差异较大的样本做预测定货号:BC2300规格:50T/24样产品内容:试剂一:液体×1瓶,4℃保存。
试剂二:粉剂×1瓶,4℃保存。
临用前加10mL蒸馏水溶解。
试剂三:粉剂×1瓶,4℃避光保存。
临用前加入10mL试剂一,沸水浴中溶解。
试剂四:粉剂×1瓶,4℃保存。
临用前加50mL蒸馏水溶解。
试剂五:液体×1瓶,4℃保存。
标准品:液体×1支,0.25μmol/mL标准酪氨酸溶液,4℃保存。
产品说明:AKP是指在碱性条件下催化蛋白质肽键水解的酶类,属于丝氨酸蛋白酶。
此外,该酶还能够水解酯键、酰胺键,具有转酯及转肽的功能。
该酶是主要工业用酶之一,广泛应用于制药、丝绸、食品、制革等行业。
在碱性条件下,AKP水解酪蛋白生成酪氨酸;在碱性条件下,酪氨酸还原磷钼酸生成钨蓝;钨蓝在680nm有特征吸收峰,测定680nm吸光度增加速率,来计算AKP活性。
需自备的仪器和用品:可见分光光度计、水浴锅、磁力搅拌器、可调式移液枪、 1.5mL EP管、1mL玻璃比色皿和蒸馏水。
操作步骤:一、粗酶液提取:1.组织:按照组织质量(g):试剂一体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL试剂一)冰浴匀浆,8000g,4℃离心10min,取上清,即粗酶液。
2.血清或培养液:直接测定。
3.细菌、真菌:按照细胞数量(104个):试剂一体积(mL)为500~1000:1的比例(建议500万细胞加入1mL试剂一),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);然后8000g,4℃,离心10min,取上清置于冰上待测。
二、测定操作:1.分光光度计预热30min,调节波长到680nm,蒸馏水调零。
2.试剂二、试剂三和试剂四置于40℃水浴保温30min。
3.对照管:取一支EP管,加入100μL粗酶液(血清或培养液),200μL试剂二,混匀后置于40℃水浴保温10min;加入200μL试剂三,混匀后8000g,4℃离心10min;取200μL上清液,加入新的EP管,再加入1000μL试剂四,200μL试剂五,混匀后置于40℃水浴保温20min,于680nm测定光吸收,记为A对照管。

冰冻切片组织碱性磷酸酶活性染色试剂盒产品说明书(中文版)主要用途冰冻切片组织碱性磷酸酶活性染色试剂是一种旨在使用偶联偶氮技术,在底物存在的情况下,分析组织样本中碱性磷酸酶表达,而呈现亮红色沉淀现象的权威而经典的技术方法。
该技术经过精心改良、成功实验证明的。
主要适用于动物组织冰冻切片,同时也适合原生代或培养细胞的酶活性检测。
尤其可用于骨组织病理生理的研究和干细胞分化能力的鉴定。
产品严格无菌,即到即用,操作简捷,性能稳定,灵敏牢固,显色清晰。
技术背景碱性磷酸酶(ALKALINE PHOSPHATASE)在碱性环境下催化各种醇和酚的磷酸酯水解,存在于活跃运输的膜上,如毛细血管及毛细血管的动脉部分的内皮,肾近曲小管壁边缘和小肠上皮的纹状缘,胎盘组织,未分化的干细胞等表达含量最为丰富。
它与骨质的形成,维持细胞内磷酸酶的浓度,以及与经膜吸收和转运过程有关。
偶联偶氮技术的基本原理为碱性磷酸酶水解底物(磷酸萘酯)释放出萘酚,立即为重氮盐所捕获而成为不溶性有色的偶氮染料。
实验最初(1944)应用β-萘磷酸盐作为底物,释放出的萘酚与重氮α-萘胺偶联,在酶的活动处形成有色沉淀。
Burstone (1962)推荐使用替代萘酚,如萘酚AS-MX磷酸盐。
重氮盐有很多种,但较适宜的有Fast blue RR,Fast red TR,Fast violet B,Fast blue VRT 和Fast black B。
偶联偶氮技术孵育时间短;稳定,灵敏;在正常组织中因无萘酚,故不需要对照;反应产物为偶氮染料难以溶解,不易弥散因而图象清晰。
产品内容清理液(Reagent A)120毫升固着液(Reagent B)10毫升反应液(Reagent C)10毫升染色液(Reagent D)5管产品说明书1份保存方式保存在4℃冰箱里,避免光照,有效保证6月用户自备甲基绿复染试剂盒(HL40010)或苏木素复染试剂盒(HL80050):用于常规染色后复染小型染色缸:用于染色操作光学显微镜:用于组织细胞染色后观察分析实验步骤样本染色操作开始前,将试剂盒里的反应液(Reagent C)和染色液(Reagent D)置于室温下预热,并避光。
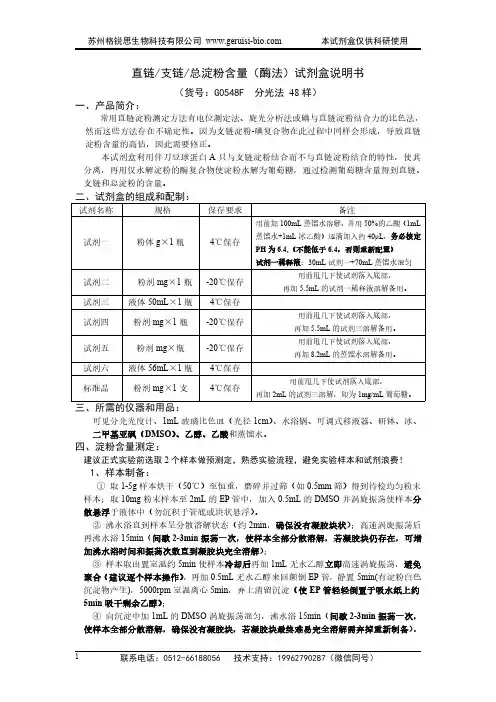
直链/支链/总淀粉含量(酶法)试剂盒说明书(货号:G0548F分光法48样)一、产品简介:常用直链淀粉测定方法有电位测定法、旋光分析法或碘与直链淀粉结合力的比色法,然而这些方法存在不确定性。
因为支链淀粉-碘复合物在此过程中同样会形成,导致直链淀粉含量的高估,因此需要修正。
本试剂盒利用伴刀豆球蛋白A只与支链淀粉结合而不与直链淀粉结合的特性,使其分离,再用仅水解淀粉的酶复合物使淀粉水解为葡萄糖,通过检测葡萄糖含量得到直链、支链和总淀粉的含量。
二、试剂盒的组成和配制:试剂名称规格保存要求备注试剂一粉体g×1瓶4℃保存用前加100mL蒸馏水溶解,并用50%的乙酸(1mL 蒸馏水+1mL冰乙酸)逐滴加入约40μL,务必核定PH为6.4,(不能低于6.4,否则重新配置)试剂一稀释液:30mL试剂一+70mL蒸馏水混匀试剂二粉剂mg×1瓶-20℃保存用前甩几下使试剂落入底部,再加5.5mL的试剂一稀释液溶解备用。
试剂三液体50mL×1瓶4℃保存试剂四粉剂mg×1瓶-20℃保存用前甩几下使试剂落入底部,再加5.5mL的试剂三溶解备用。
试剂五粉剂mg×瓶-20℃保存用前甩几下使试剂落入底部,再加8.2mL的蒸馏水溶解备用。
试剂六液体56mL×1瓶4℃保存标准品粉剂mg×1支4℃保存用前甩几下使试剂落入底部,再加2mL的试剂三溶解,即为1mg/mL葡萄糖。
三、所需的仪器和用品:可见分光光度计、1mL玻璃比色皿(光径1cm)、水浴锅、可调式移液器、研钵、冰、二甲基亚砜(DMSO)、乙醇、乙酸和蒸馏水。
四、淀粉含量测定:建议正式实验前选取2个样本做预测定,熟悉实验流程,避免实验样本和试剂浪费!1、样本制备:①取1-5g样本烘干(50℃)至恒重,磨碎并过筛(如0.5mm筛)得到待检均匀粉末样本;取10mg粉末样本至2mL的EP管中,加入0.5mL的DMSO并涡旋振荡使样本分散悬浮于液体中(勿沉积于管底或块状悬浮)。

CCK8试剂盒说明书1. 产品介绍CCK8试剂盒是一种常用的细胞增殖和存活检测试剂盒,可以用于测定细胞的代谢活性和细胞存活率。
该试剂盒采用水溶性黄色产物2,3-Bis-(2-Methoxy-4-Nitro-5-Sulfophenyl)-2H-Tetrazolium-5-Carboxanilide(CCK-8)作为底物,可通过检测还原型CCK-8的生成来间接反映细胞代谢和生长情况。
2. 试剂成分CCK8试剂盒包含以下成分:•CCK-8底物溶液•无血清细胞培养基3. 使用方法3.1 准备工作•将CCK-8底物溶液室温静置30分钟,使其达到常温;•无血清细胞培养基预先加温至37℃。
3.2 测定步骤1.将待测细胞悬液均匀分装到96孔板中,每孔约包含1-2 x 10^4的细胞数量。
2.将空白对照孔设置为仅包含细胞培养基的孔。
3.将96孔板中的培养基替换为100μL的无血清细胞培养基。
4.添加10μL的CCK-8底物溶液到每个孔中,包括空白对照孔。
5.将带有试剂的96孔板放入培养箱中,以37℃、5% CO2的条件孵育1-4小时。
6.使用包含酶标仪的96孔板读取器,在450nm波长处测定吸光度值。
4. 结果与解读CCK8试剂盒测定结果的吸光度值与细胞数量和活性呈正相关关系。
吸光度值越高,表示细胞代谢和生长能力越强,细胞存活率越高。
5. 注意事项•CCK-8底物溶液对光敏感,避免阳光直射;•试剂过期后,请勿使用;•存储温度应在2-8℃。
6. 参考文献1.Zhang D, Li S, Xi J, et al. CCK-8 Assay for Cell Viability:Some Suggestions to the Users[J]. Journal of ClinicalLaboratory Analysis, 2016, 30(6): 195-201.以上为CCK8试剂盒说明书,仅供参考。
如有任何疑问,请联系厂家或进一步咨询相关专业人士。
苏云金芽孢杆菌几丁质酶基因的克隆及诱导表达摘要:从苏云金芽孢杆菌(Bacillus thuringiensis)T04A001中提取基因组DNA,通过PCR的方法克隆了几丁质酶chiAC基因(GenBank登录号为EF427670)。置换chiAC基因的启动子为T7启动子时,chiAC基因能在IPTG诱导下在大肠杆菌中大量表达,并产生大小约70 kDa的表达产物。关键词:苏云金芽孢杆菌;几丁质酶基因;克隆;序列分析;表达Cloning and Expression of Chitinase Encoding Gene of Bacillus thuringiensis T04A001 StrainAbstract: Chitinase gene chiAC(GenBank Accession Number:EF427670) was cloned by PCR from Bacillus thuringiensis T04A001 genomic DNA. Expression of chiAC under T7 promoter in Escherichia coli could induced by IPTG; and it produced a protein whose molecular weight was about 70 kDa.Key words: Bacillus thuringiensis; chitinase gene; clone; sequence analysis; expression几丁质酶在芽孢杆菌中广泛存在,目前已有多种芽孢杆菌的几丁质酶基因得到了克隆与表达,如环状芽孢杆菌(Bacillus circulans)、蜡状芽孢杆菌(B. cereus)、苏云金芽孢杆菌(B. thuringiensis,简称Bt)、枯草芽孢杆菌(B. subtilis)以及地衣芽孢杆菌(B. licheniformis)等[1,2]。苏云金芽孢杆菌因为对多种害虫具有毒杀作用而一直为人们所关注,目前已有十多个亚种的苏云金芽孢杆菌被证明能产生几丁质酶[3]。有报道证明,苏云金芽孢杆菌自身产生的几丁质酶对其杀虫毒力具有增效作用,其杀虫毒力与几丁质酶的活力呈高的正相关(0.75~0.79)[4],表明几丁质酶在外界因素对害虫的侵害中起着重要的作用。增加外源的几丁质酶可以提高苏云金芽孢杆菌杀虫效果,而用阿洛菌素(一种几丁质酶抑制剂)抑制苏云金芽孢杆菌的几丁质酶后,LC50值增高[5]。因此,对苏云金芽孢杆菌几丁质酶的性质、编码基因的序列差异性以及几丁质酶基因的表达等方面进行研究,可为几丁质酶更好的应用于生物防治提供依据。本研究对产几丁质酶活力高的Bt菌株T04A001[6]的几丁质酶基因进行了克隆、测序分析,并将T04A001菌株的几丁质酶基因chiAC的开放阅读框(Open reading frame,ORF)在T7启动子调控下进行原核表达。几丁质酶基因的序列测定及其在大肠杆菌中的大量表达为研究芽孢杆菌几丁质酶的进化关系、几丁质酶的纯化与制备及更进一步研究提供了条件。1材料与方法1.1菌株与培养基Bt菌株T04A001为本实验室分离保藏,大肠杆菌(Escherichia coli)DH5α、BL21为本实验室保存菌株。LB培养基(每升含10 g蛋白胨,5 g酵母粉,10 g NaCl);氨苄青霉素和卡那霉素使用终浓度分别为50 μg/mL和30 μg/mL,IPTG 使用终浓度为1 mmol/L。1.2主要试剂与仪器所用内切酶均购自TaKaRa公司;质粒提取、PCR产物回收和DNA片段快速纯化试剂盒购自New England Biolabs公司;His-bind亲和层析蛋白纯化试剂盒购自Novagen公司;其余常规试剂均为Sigma进口分装。主要仪器有美国Biotecsynergy HT全波长自动酶标仪,美国ABI 9800 PCR仪,电泳系统为美国BioRad DNA电泳系统和蛋白质电泳系统。1.3DNA的提取大肠杆菌质粒DNA提取参照《分子克隆实验指南》第二版(1989)小量碱法进行[7]。芽孢杆菌的总DNA按照如下方法提取。将芽孢杆菌单菌落接入LB培养基中,30℃ 200 r/min振荡培养4~5 h至OD600约0.6~0.8,取1.5 mL菌液至Eppendorf 管中,离心收集菌体,用TES缓冲液(50 mmol/L Tris-HCl、pH值为8.0,5 mmol/L EDTA、pH值为8.0,20%蔗糖)洗涤菌体1次,沉淀中加入500 μL含10 mg/mL溶菌酶的TES,混匀后37℃下作用1.0~1.5 h至菌体形成原生质球,加100 μL 10% SDS 溶液及终浓度为2 mg/mL的蛋白酶K,上下颠倒数次混匀,37℃下作用1 h,12 000 r/min离心10 min,上清加等体积的酚氯仿抽提后,加入两倍体积预冷无水乙醇温和混匀,-20℃放置30 min左右后12 000 r/min离心10 min,沉淀用70%乙醇洗涤,风干,最后溶于含2 mg/mL RNA酶的适量的无菌去离子水中。1.4几丁质酶基因的PCR扩增根据GenBank中Bt以色列亚种几丁质酶基因(GenBank序列号为AF526379)全序列设计了扩增引物[8],ICHI1 5′-GTCGACTTTCCTCCCATACCA-3′(带SalⅠ酶切位点),CCHI1 5′-GGGGCATGCATGCCTTAAATATATC-3′(带EcoRⅠ酶切位点),CCHI2 5′-GGGGCATGCATGCCTTAAATATATC-3′(带HindⅢ酶切位点)。扩增体系为:芽孢杆菌总DNA 0.1 μg,1×PCR Buffer 2.5 μL, 2.5 pmol dNTPs,Taq plus(Taq+pfu DNA polymerase)1 U,引物各10 pmol,加ddH2O至25 μL。扩增程序为:94℃预变性4 min;94℃变性30 s,50℃退火3 min,72℃延伸3 min,28个循环;72℃延伸7 min。1.5几丁质酶基因的克隆以Bt菌株T04A001总DNA为模板,ICHI1/CCHI2为引物,PCR扩增得到包含启动子和chiAC基因ORF和终止子的几丁质酶全长基因,将PCR产物(为确保PCR 产物末端加上了A残基,扩增完成后直接向PCR反应管中加入1U Taq DNA polymerase,72 ℃延伸30 min),用PCR产物回收试剂盒纯化回收后连接到PCR产物克隆载体pMD18-T上,连接产物转化进E. coli DH5α,在氨苄青霉素抗性LB平板上挑取白色克隆子,提取质粒酶切鉴定,得到T04A001几丁质酶基因的正确克隆子E-pMDC26,送往上海博道生物公司测序。1.6用于几丁质酶基因原核表达的重组质粒的构建以CCHI1/CCHI2为引物PCR扩增得到不含启动子序列的chiAC基因ORF,其两端分别带有EcoRⅠ和Hind Ⅲ酶切位点,PCR产物经PCR产物回收试剂盒纯化回收后EcoR I/Hind Ⅲ双酶切。双酶切后的PCR片段与表达质粒pET28a EcoRⅠ/Hind Ⅲ酶切后的片段连接,将连接产物转化E.coli DH5α后在卡那霉素抗性LB平板上筛选克隆子,随机挑取菌落提取质粒进行酶切鉴定,鉴定正确的质粒即为chiAC基因在质粒pET28a T7启动子控制下表达的重组质粒,命名为pETC21。1.7几丁质酶的诱导表达及蛋白质纯化将质粒pETC21转化E. coli BL21,得到用于诱导表达的重组菌株E-pETC21。E-pETC21接到5 mL LB液体培养基中,30℃震荡培养(200 r/min)过夜,按1∶1 000比例转接到500 mL的新鲜LB中,当菌液培养至OD600约0.6时加入终浓度为1 mmol/L的IPTG诱导继续培养4 h,取样处理后经His-bind亲和层析试剂盒纯化得到表达的几丁质酶。具体纯化方法见试剂盒说明。考马斯亮蓝G250染色法测定纯化的蛋白质浓度。3,5-二硝基水杨酸测定几丁质酶活力[6]。一个酶活力单位(U)定义为合适温度下每小时产生1 μg还原糖的酶量。1.8抗血清制备和Western blot分析约400 ng的纯化的ChiAC蛋白质经SDS-PAGE分离、考马斯亮蓝染液染色、脱色后,将70 kDa目的蛋白带切下,冻融3次,用研钵研碎,悬浮于1 mL生理盐水中。蛋白样品制备好后,注射兔子进行免疫反应。2周后加强一次注射免疫,1个月后再一次加强,1个半月后取兔血,离心得到70 kDa ChiAC的抗血清。制备E-pET28a菌体破碎后的可溶性部分0.5 mL,与10 mL抗血清在4℃孵育过夜,然后3 000 r/min 离心3 min,除去所有抗原抗体凝集反应的沉淀,得到去除宿主菌杂抗体的抗血清。本研究经摸索后确定Western blot分析均用1 000倍稀释度的ChiAC抗血清进行一抗杂交。Western blot方法按《分子克隆实验指南》[7]进行。2结果2.1几丁质酶基因和氨基酸序列分析序列测定表明,Bt菌株T04A001的几丁质酶基因编码序列(GenBank登录号为EF427670)由2 031个核苷酸组成,是编码676个氨基酸的74 kDa蛋白质。与GenBank中其他ChiA家族几丁质酶基因进行核酸序列比对,菌株T04A001(H4血清型)几丁质酶基因chiAC的全序列与B. thuringiensis subsp. israelensis(H14血清型)几丁质酶基因ichi相似性最高,为99%;与B. thuringiensis subsp. konkukian(H34血清型)几丁质酶基因Bt及B. thuringiensis subsp. kenyae(H4a4c血清型)几丁质酶基因chiA74相似98%;与B. thuringiensis subsp. sotto(H4a4b血清型)几丁质酶基因Bts相似96%;与B. thuringiensis subsp. pakistani(H13血清型)几丁质酶基因chiA71相似80%;与枯草芽孢杆菌几丁质酶基因Bsu相似42%;与地衣芽孢杆菌TP菌株几丁质酶基因Bl相似28%;与S. marcescens菌株141 几丁质酶基因Sm相似7%(见图1)。将chiAC翻译得到的蛋白序列ChiAC与GenBank中其他Bt菌株的几丁质酶进行比对,结果显示ChiAC与其他Bt菌株的几丁质酶存在高度相似性,与 B. thuringiensis subsp. pp在ChiAC的N端,首先是一段34氨基酸的信号肽,该信号肽能被革兰氏阳性菌、革兰氏阴性菌以及其他原核生物识别,在革兰氏阴性菌中其断裂位点是Leu-33和Ala-34,在革兰氏阳性菌和其他原核生物中其断裂位点是Ala-34和Asp-35。其后为催化区,该结构域在Bt菌株的几丁质酶中高度保守,与几丁质酶活性相关的Asp-207、Asp-209和Glu-211高度保守。催化区之后为两个纤粘蛋白相似区(Fbronectin-like domain,FLD),尽管两个FLD相互之间相似性很低(10%左右),但均含有粘蛋白的典型保守氨基酸残基(FLD1:Trp-373、Tyr-384和Tyr-411;FLD2:Trp-507、Tyr-519和Tyr-546)。在Bt菌株的几丁质酶中,仅巴基斯坦亚种几丁质酶不含FLD1,其余几丁质酶FLDs的相似性均达到90%以上。在FLDs 之后为位于C端的几丁质结合区,其保守残基为Trp-591、Tyr-595和Trp-626,Bt菌株的几丁质酶的该结构域相似性也均达到90%以上。2.2chiAC基因在T7启动子下的表达几丁质酶基因chiAC ORF插入载体pET28a,得到chiAC基因ORF在T7启动子调控下的重组表达质粒pETC21,转进E. coli BL21中,得到重组菌株E-pETC21。对E. coli BL21、E-pET28a、E-pETC21全菌体和纯化的几丁质酶进行SDS-PAGE 和Western blot分析,原始菌株E. coli BL21和转化空载体的对照菌株E-pET28a 均不产生几丁质酶,而E-pETC21及由其所提取的几丁质酶均能观察到ChiAC蛋白质对应的70 kDa表达带,同时还可观察到两条大小分别约40 kDa和29 kDa的降解蛋白质条带(图2)。2.3在E-pETC21中的表达时相分析同时接种两瓶E-pETC21培养,当培养4 h时OD600均达到约0.6,此时在一个摇瓶中加入1 mmol/L IPTG继续培养,另一瓶则不加IPTG用作对照。由图3可知,在加入IPTG诱导后菌株的生长明显受到抑制,菌体OD600最高仅能达到0.8左右,而未加IPTG诱导的菌体OD600可达到1.1左右。诱导后菌株的几丁质酶产量显著增强,且随培养时间的延长不断增长,直至培养100 h左右酶活最高可达到约420 U/mL,之后酶活逐渐下降;而未诱导的E-pETC21虽然也能表达产生几丁质酶,但其产量不高,酶活最高仅能达到100 U/mL。3讨论本研究所克隆的Bt菌株T04A001的几丁质酶基因chiAC包括启动子、编码区和终止子序列,其编码区由分泌信号肽、催化区、FLDs和几丁质结合区4个结构域组成。蛋白质前体的信号肽符合原核生物信号序列特点,即N末端带电荷,其后形成一个疏水中心以及极性氨基酸串。成熟的ChiAC蛋白质的N端存在一个催化区,与糖基水解酶18家族的催化区有较高的同源性,其中D207、D209、E211高度保守,可能是质子供体。催化区后有两个与Fn Ⅲ结构域有同源性的区域——FLDs。该结构域对几丁质酶与几丁质的结合作用无影响,却与胶状几丁质降解程度有关。目前已在Bacillus sp.、Streptomyces sp.等细菌的几丁质酶中发现了FnⅢ同源结构域。除几丁质酶外,α-淀粉酶、纤维素酶、PHB解聚酶等也存在FnⅢ同源结构域。在进行氨基酸序列比对时发现,在其他结构域高度相似的情况下,同时具有FLD1和FLD2的Bt菌株的几丁质酶ChiA74为内切酶,而缺少FLD1区域的ChiA71却为外切酶,因此推测FLD1可能影响了几丁质酶的水解切口部位,同时推测与ChiA74相似度达99%且具有FLD1的ChiAC也为内切酶。ChiAC蛋白C端几丁质结合区中的芳香族氨基酸——酪氨酸(Tyr)和色氨酸(Trp)也是高度保守的,该结构域能特异结合不可溶几丁质(如胶状几丁质或再生几丁质)及晶体几丁质,却不能与可溶性几丁质及其他不溶性多糖结合。几丁质酶基因chiAC在载体pET28a的T7启动子调控下能够诱导表达,虽然其自身具有较高的本底表达水平,但在IPTG诱导下,几丁质酶产量能够得到显著且迅速的提高。表达的几丁质酶在胞内和胞外都能检测到。对菌体进行时相SDS-PAGE分析显示,在37℃诱导培养时,加入1 mmol/L IPTG后的最初2 h内可观察到逐渐增强的70 kDa表达蛋白质条带,但之后继续培养,则表达带的强度保持不变(数据未显示)。对比酶活时相检测诱导后酶活不断增强的结果,表明在大肠杆菌中诱导表达的几丁质酶主要分泌到了胞外。此外,在SDS-PAGE和Western blot分析中,重组菌株在表达产生70 kDa几丁质酶ChiAC的同时还产生两条大小分别为40 kDa左右和29 kDa左右的蛋白质条带,推测它们是70 kDa ChiAC的降解产物。参考文献:[1] 冯波. 微生物几丁质酶的研究概况[J]. 天津师范大学学报(自然科学版),1998,18(3):50-56.[2] 冯俊丽,朱旭分. 微生物几丁质酶的分子生物学研究[J]. 浙江大学学报(农业与生命科学版),2004,30(1):102-108.[3] 卢伟,蔡峻,陈月华.苏云金芽孢杆菌几丁质酶的研究进展[J]. 微生物学通报,2007,34(1):143-147.[4] 邱立友.微生物几丁质酶与害虫防治[J].河南农业大学学报,1995, 29(2):184-191.[5] SAMPSON M N,GOODAY G W. Involvement of chitinases of Bacillus thuringiensis during pathogenesis in insects[J]. Microbiology,1998,144(8):2189-2194.[6] LIU M,CAI Q X,LIU H Z,et al. Chitinolytic activities in Bacillus thuringiensis and their synergistic effects on larvicidal activity[J]. J Appl Microbiol,2002,93(3):374-379.[7] SAMBROOK J,FRITSCH E F,MANIATIS T. Molecular cloning: A laboratory manual[M]. Second edition. New York:Cold Spring Harbour Laboratory Press,1989.[8] ZHONG W F,JIANG L H,YAN W Z,et al. Cloning and sequencing of chitinase gene from Bacillus thuringiensis subsp. israelensis[J]. Acta Genetica Sinica,2003,30(4):364-369.。
土壤纤维素酶(Solid—cellulase,S—CL)活性测定试剂盒说明书土壤纤维素酶(Solidcellulase,SCL)活性测定试剂盒说明书微量法100管/48样注意:正式测定前务必取23个预期差别较大的样本做猜测定测定意义:SCL重要来源于土壤微生物,SCL催化农作物秸秆产生的葡萄糖是重要的碳源营养物质。
测定原理:采用蒽酮比色法测定SCL催化纤维素降解产生的还原糖的含量。
需自备的仪器和用品:酶标仪/可见分光光度计、水浴锅、可调式移液器、96孔板/微量石英比色皿、甲苯、硫酸(不允许快递)和蒸馏水。
试剂的构成和配制:试剂一:甲苯10mL×1瓶,4℃保管;(自备)试剂二:液体6mL×1瓶,4℃保管;试剂三:液体40mL×1瓶,4℃保管;试剂四:粉剂×1瓶,4℃保管;临用前加入5mL蒸馏水和45mL浓硫酸充分溶解待用。
样品处理:新鲜土样自然风干或37度烘箱风干,过30~50目筛。
加样表和测定步骤:对照管测定管风干土样(g)0.050.05试剂一(μL)5050振荡混匀15min试剂二(μL )90试剂三(μL )370370蒸馏水(μL )1809037℃振荡反应3h后,90℃水浴15min(盖紧,防止水分散失),冷却后8000g 25℃离心10min,取上清,得糖化液糖化液(μL)140140试剂四(μL)260260混匀,90℃水浴10min(盖紧,防止水分散失),冷却,取200μL至微量石英比色皿或96孔板中,测620nm下吸光值A,计算ΔA=A测定管A对照管。
每个测定管设一个对照管。
SCL活力计算:a.用微量石英比色皿测定的计算公式如下标准条件下测定的回归方程为y = 5.018x 0.0462;x为标准品浓度(mg/mL),y为吸光值。
单位的定义:每天每g土样中产生1mg 葡萄糖定义为一个酶活力单位。
SCL活力(mg/d/g)=(ΔA+0.0462)÷5.018×V反总÷W÷T =19.1×(ΔA+0.0462)T:反应时间,3h=1/8d; V反总:反应体系总体积:0.6mL;W:样本质量,0.05g。
几丁质酶(Chitinase)试剂盒使用说明
微量法货号:BC0825
规格:100T/48S
产品内容:
提取液:液体105mL×1瓶,4℃保存。
试剂一:液体10mL×1瓶,4℃保存。
试剂二:液体5mL×1瓶,4℃保存。
试剂三:液体5mL×1瓶,4℃保存。
试剂四:液体10mL×1瓶,4℃避光保存。
产品说明:
几丁质酶要存在于虾、蟹、昆虫等甲壳类动物的外壳与软体动物的器官(例如乌贼的软骨),以及真菌类的细胞壁中。
而几丁质酶(EC3.2.1.14)可催化几丁质水解,具有抵御真菌侵染的作用,成为抗真菌病害的研究热点。
几丁质酶水解几丁质产生N-乙酰氨基葡萄糖,进一步与对二甲氨基苯甲醛产生红色化合物,在585nm处有特征吸收峰,吸收值增加速率反映了几丁质酶的活性。
自备实验用品及仪器
天平、水浴锅、离心机、可见分光光度计/酶标仪、微量石英比色皿/96孔板、蒸馏水。
操作步骤:
一、粗酶液提取
1.组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g
组织,加入1mL提取液)进行冰浴匀浆,然后10000g,4℃离心20min,取上清,置冰
上待测。
2.真菌:按照细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议
500万细胞加入1mL提取液),冰浴超声波破碎细胞(功率300w,超声3s,间隔7s,总时间3min);然后10000g,4℃,离心20min,取上清置于冰上待检。
3.培养液:直接测定。
二、测定操作表
对照管测定管
粗酶液(mL)8080
提取液(mL)12040
试剂一(mL)80
混匀,37℃水浴1h,5000rpm,4℃,离心10min,取上清。
试剂二(mL)4040
混匀,沸水浴7min
试剂三(mL)4040
试剂四(mL)8080
混匀,37℃,15min,于微量石英比色皿/96孔板,对照管调零,测定A585。
三、计算公式
a.用微量石英比色皿测定的计算公式如下
标准曲线:y=2.3575x-0.0143,R2=0.9989
计算公式:
1、按照样本重量计算
酶活性定义:37℃条件下,每克组织每小时分解几丁质产生1mg N-乙酰氨基葡萄糖的酶量为一个酶活性单位。
几丁质酶活性(U/g)=(A 585+0.0143)/2.3575×V 反总÷(V 样÷V 样总×W)=1.91×(A 585+0.0143)÷W
V 反总:反应体系总体积,0.36mL;V 样:反应体系中样本体积,0.08mL;V 样总:加入提取液体积,1mL;W:样本质量,g
2、按照蛋白质浓度计算
酶活性定义:37℃条件下,每毫克蛋白每小时分解几丁质产生1mg N-乙酰氨基葡萄糖的酶量为一个酶活性单位。
几丁质酶活性(U/mg prot)=(A 585+0.0143)/2.3575×V 反总÷(V 样×Cpr)=1.91×(A 585+0.0143)÷Cpr
V 反总:反应体系总体积,0.36mL;V 样:反应体系中样本体积,0.08mL;Cpr:蛋白浓度,mg/mL;
3、按照细胞数量计算
酶活性定义:37℃条件下,每104个细胞每小时分解几丁质产生1mg N-乙酰氨基葡萄糖的酶量为一个酶活性单位。
几丁质酶活性(U/104cell)=(A 585+0.0143)/2.3575×V 反总÷(V 样÷V 样总×细胞数量)=1.91×(A 585+0.0143)÷细胞数量
4、按照液体体积计算
酶活性定义:37℃条件下,每毫升培养液每小时分解几丁质产生1mg N-乙酰氨基葡萄糖的酶量为一个酶活性单位。
几丁质酶活性(U/mL)=(A 585+0.0143)/2.3575×V 反总÷V 样=1.91×(A 585+0.0143)
b.用96孔板测定的计算公式如下标准曲线:y=1.1788x-0.0143,R2=0.9989
1.按照样本重量计算
酶活性定义:37℃条件下,每克组织每小时分解几丁质产生1mg N-乙酰氨基葡萄糖的酶量为一个酶活性单位。
几丁质酶活性(U/g)=(A 585+0.0143)/2.3575×V 反总÷(V 样÷V 样总×W)=3.82×(A 585+0.0143)÷W
V 反总:反应体系总体积,0.36mL;V 样:反应体系中样本体积,0.08mL;V 样总:加入提取液体积,1mL;W:样本质量,g
2.按照蛋白质浓度计算
酶活性定义:37℃条件下,每毫克蛋白每小时分解几丁质产生1mg N-乙酰氨基葡萄糖的酶量为一个酶活性单位。
几丁质酶活性(U/mg prot)=(A 585+0.0143)/2.3575×V 反总÷(V 样×Cpr)=3.82×(A 585+0.0143)÷Cpr
V 反总:反应体系总体积,0.36mL;V 样:反应体系中样本体积,0.08mL;Cpr:蛋白浓度,mg/mL;
3.按照细胞数量计算
酶活性定义:37℃条件下,每104个细胞每小时分解几丁质产生1mg N-乙酰氨基葡萄糖的酶量为一个酶活性单位。
几丁质酶活性(U/104cell)=(A 585+0.0143)/2.3575×V 反总÷(V 样÷V 样总×细胞数量)=3.82×(A 585+0.0143)÷细胞数量
4.按照液体体积计算
酶活性定义:37℃条件下,每毫升培养液每小时分解几丁质产生1mg N-乙酰氨基葡萄糖的酶量为一个酶活性单位。
几丁质酶活性(U/mL)=(A 585+0.0143)/2.3575×V 反总÷V 样=3.82×(A 585+0.0143)注意事项:
1、反应结束后立即进行比色。
2、OD 值大于0.8,样品适当稀释再测定,注意计算公式里乘以稀释倍数;或者缩短37℃水浴时间到X 小时(如0.5小时),按照原先计算公式得到的结果再除以X。
3、试剂四有一定的毒性,请操作时做好防护措施。