安罗替尼治疗阿帕替尼用药进展后的晚期肺腺癌1例
- 格式:pdf
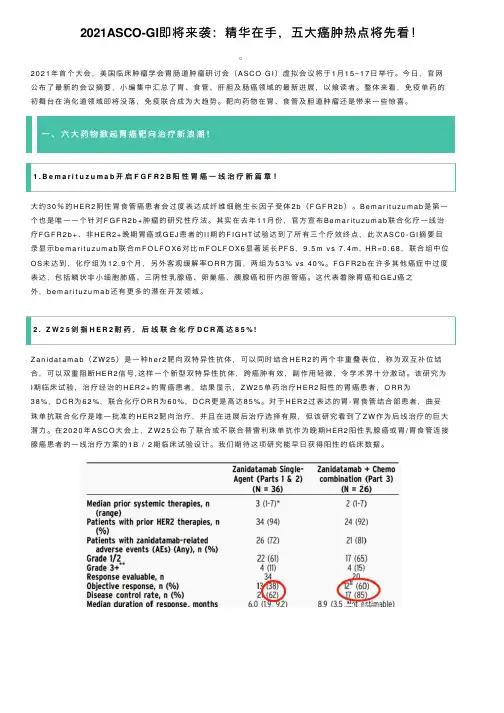
- 大小:1.17 MB
- 文档页数:2


医院抗肿瘤药物临床合理应用培训考核试题患者,女,31岁,诊断为左侧乳腺非特殊类型浸润性癌(pTINOMO,ER(+),PR(-),HER-2(0))。
拟行内分泌治疗,该患者首选用的药物为()他莫昔芬(正确答案)依西美坦氟维司群来曲嗖阿那曲□坐卡培他滨应在餐后何时服用()20分钟30分钟(正确答案)40分钟60分钟50分钟患者,男,57岁,161Cm,65kg,1.73m2,右肺磷癌IV期(右侧恶性胸腔积液),予吉西他滨2160mgd1,5联合顺粕40mgd1-3。
该患者存在的不合理用药的是()吉西他滨的给药剂量顺箱的给药剂量顺伯分次给药吉西他滨给药间隔(正确答案)选用顺伯化疗患者,男,79岁。
诊断为肺恶性肿瘤,患者心功能不全,在给患者拟定化疗方案时,尽可能不选的药物是()博来霉素长春碱类顺粕环磷酰胺多柔比星(正确答案)为了减轻甲氨喋吟的毒性反应所用的救援剂是()叶酸维生素B硫酸亚铁甲酰四氢叶酸钙(正确答案)维生素C下列药物中容易发生化学性膀胱炎的抗癌药物是()替莫喋胺环磷酰胺(正确答案)白消安司莫司汀顺伯患者,男,75岁。
自觉排尿困难伴疼痛,偶有血尿,泌尿系超声示前列腺占位,若确诊为前列腺癌后,可用()治疗亮丙瑞球(正确用托瑞米芬氯米芬替勃龙十一酸睾酮下列药物,只能用5%葡萄糖注射液配置的是()顺伯奥沙利伯(正确答案)甲氨喋吟吉西他滨表柔比星FoRF1R1方案中,伊立替康、5-氟尿喀咤、甲酰四氢叶酸钙三个药物的正确给药顺序是()先伊立替康后立即注射CF,再予5-FU(正确答案)先5-FU后立即注射CF,再予伊立替康先伊立替康后5-FU,再立即注射CF先后顺序没有特定要求恶性淋巴瘤复发患者,此次选择Hyper-CVAD方案(包含环磷酰胺、长春碱、表柔比星、阿糖胞甘、甲氨喋吟)化疗,化疗过程中出现皮疹、腹痛、低热,可能为下列什么药物所致?()环磷酰胺长春碱表柔比星阿糖胞昔(正确答案)甲氨喋吟患者,女,58岁,诊断为胃腺癌IV期(cT4bNxM1)(腹膜、网膜转移),免疫组化HER-2(2+),进一步查F1SH检测:阴性(HER-2基因无扩增)。
3.雷莫芦单抗亚洲数据公布,为后续拿下国内胃癌⼆线适应症奠定坚实基础雷莫芦单抗是第⼀个、同时也是⽬前唯⼀以中国患者为主的晚期胃癌⼆线⼈群中经I I I期临床研究证实延长⽣存期获益的靶向药物,被纳⼊全球及亚洲胃癌治疗指南作为1类推荐。
R a m u c i r u m a b最新亚洲I I I期临床R A I N B O W-A s i a达到预设的研究终点,结果显⽰,R a m u c i r u m a b联合紫杉醇组患者中位⽆进展⽣存期(P F S)较安慰剂组显著延长(m P F S 4.14个⽉v s 3.15个⽉;p=0.0184),并显⽰出与全球关键注册临床试验R A I N B O W⼀致的中位总⽣存期(O S)获益(H R=0.963)。
患者整体耐受性良好。
除了单药,雷莫芦单抗联合伊⽴替康作为⼆线治疗的I I期临床试验结果,显⽰中位P F S和O S为4.2和9.6个⽉,D C R为85%,虽然没有达到主要终点,但该研究纳⼊了更多⽼年患者,所以结果依旧是令⼈⿎舞。
4.v a r l i t i n i b联合每周紫杉醇⼆线治疗E G F R/H E R2共表达晚期胃癌患者初显疗效V a r l i t i n i b(A S L A N001)是⼀种⾼效、⼝服、可逆的泛H E R⼩分⼦抑制剂,其作⽤对象是⼈表⽪⽣长因⼦受体H E R 1、H E R2和H E R4。
在美国,V a r l i t i n i b被授予治疗胃癌和肝外胆管癌(⼀种亚型胆管癌)的孤⼉药物称号。
之前报道过v a r l i t i n i b联合化疗⼀线治疗晚期胃癌的临床研究失败,此次v a r l i t i n i b联合每周紫杉醇治疗9例患者,其中4例患者为S D,结论:V a r l i t i n i b300m g b i d+紫杉醇每周80m g具有可管理的安全性,⽬前,⼆期试验正在进⾏中。
5.D S-8201冲击胃癌⼀线,正在开展临床试验,期待中D S-8201a由阿斯利康和第⼀三共合作开发的靶向HE R2的抗体偶联(A D C)药物。

DOI:10.16662/ki.1674-0742.2023.36.078信迪利单抗治疗晚期实体恶性肿瘤的临床疗效分析衣素琴,严文跃,刘红旗,卞伟钢盐城市第一人民医院肿瘤科,江苏盐城224001[摘要]目的分析信迪利单抗或甲磺酸阿帕替尼片单药治疗不能耐受或拒绝化放疗以及无合适靶向药物的晚期实体恶性肿瘤的临床疗效及不良反应。
方法回顾性选取2020年7月—2022年8月在盐城市第一人民医院就诊的91例不能耐受或拒绝化放疗以及无合适靶向药物的晚期实体恶性肿瘤患者的临床资料信息,根据不同的治疗方法将其分为两组,其中观察组46例,均予以信迪利单抗单药免疫治疗;对照组45例,均予以甲磺酸阿帕替尼片。
所有患者经两个周期治疗后进行影像学评估疗效。
结果观察组的客观的缓解率(ob‐jective response rate, ORR)为21.74%,疾病的控制率(disease control rate,DCR)为80.43%;对照组ORR是20.00%,DCR是71.11%,两组比较,差异无统计学意义(P均>0.05)。
观察组与对照组不良反应均为1~2级,1级不良反应发生居多,总发生率分别为54.35%、75.55%,两组比较,差异有统计学意义(χ2=4.487,P<0.05)。
结论对于不能耐受或拒绝化放疗以及无合适靶向药物的晚期肿瘤患者,信迪利单抗单药治疗较甲磺酸阿帕替尼片单药治疗疗效相当,但不良反应的发生率更低。
[关键词]信迪利单抗;阿帕替尼;免疫治疗;靶向治疗[中图分类号]R4 [文献标识码]A [文章编号]1674-0742(2023)12(c)-0078-04Clinical Efficacy Analysis of Sintilimab in the Treatment of Advanced Solid Malignant TumorsYI Suqin, YAN Wenyue, LIU Hong qi, BIAN WeigangDepartment of Oncology, Yancheng First People's Hospital, Yancheng, Jiangsu Province, 224001 China[Abstract] Objective To analyze the clinical efficacy and adverse reactions of sintilimab or apatinib mesylate tablets as monotherapy for advanced solid malignant tumors that cannot tolerate or refuse chemoradiotherapy as well as those with no suitable targeted drugs. Methods The clinical data of 91 patients with advanced solid malignant tumors who could not tolerate or refused chemoradiotherapy and had no suitable targeted drugs who were admitted to Yancheng First People's Hospital from July 2020 to August 2022 were retrospectively selected, and the study was divided into two groups according to the different treatments. Among them, 46 patients in the observation group were treated with sintilimab single-agent immunotherapy, and 45 patients in the control group were treated with apatinib mesylate tab‐lets. After two cycles of treatment, all patients underwent imaging to evaluate the efficacy. Results The objective re‐sponse rate (ORR) was 21.74% and the disease control rate (DCR) was 80.43% in the observation group. In the con‐trol group, the ORR was 20.00% and the DCR was 71.11%, there were no statistically significant differences between the two groups (both P>0.05). The occurrence of adverse reactions in the observation group and the control group were grade 1-2, with grade 1 adverse reactions occurring predominantly, and the total incidence rates were 54.35% and 75.55%, respectively, there was statistically significant difference in the incidence of adverse reactions between the two groups (χ2=4.487, P<0.05). Conclusion For patients with advanced tumors who cannot tolerate or refuse chemora‐[基金项目]江苏省卫生健康委科研课题(Z2018044)。

DOI:10.7683/xxyxyxb.2021.04.006收稿日期:2021-01-17基金项目:河南省医学科技攻关项目(编号:2018020369);河南省高等学校重点科研项目计划(编号:20B310010)。
作者简介:姬颖华(1982-),女,河南卫辉人,硕士,副主任医师,主要从事肿瘤化疗、靶向、免疫治疗工作。
通信作者:张景航(1976-),男,河南滑县人,博士,副主任医师,硕士研究生导师,主要从事肿瘤病理及临床转化工作;E mail:zhangjing hang1116@163.com欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁氉氉氉氉。
本文引用:姬颖华,杨晓煜,王瑾,等.安罗替尼联合伊立替康方案二线治疗晚期复发难治性小细胞肺癌的临床疗效观察[J].新乡医学院学报,2021,38(4):328 331.DOI:10.7683/xxyxyxb.2021.04.006.【临床研究】安罗替尼联合伊立替康方案二线治疗晚期复发难治性小细胞肺癌的临床疗效观察姬颖华1,杨晓煜2,王 瑾1,孟祥丽1,张景航3(1.新乡医学院第一附属医院肿瘤科,河南 卫辉 453100;2.新乡医学院基础医学院病理教研室,河南 新乡 453003;3.新乡医学院第一附属医院病理科,河南 卫辉 453100)摘要: 目的 探讨安罗替尼联合伊立替康二线治疗晚期复发难治性小细胞肺癌(smallcelllungcancer,SCLC)的疗效与安全性。
方法 选择2018年1月至2019年1月新乡医学院第一附属医院收治的20例晚期复发难治性SCLC患者为研究对象,均给予伊立替康65mg·m-2静脉滴注,第1、7天;口服盐酸安罗替尼胶囊12mg,每日1次,第1~14天,每21d为1个治疗周期,持续治疗4~6个周期。
每2个治疗周期评价1次患者临床疗效,记录最佳疗效评价。



Advances in Clinical Medicine 临床医学进展, 2020, 10(3), 320-326Published Online March 2020 in Hans. /journal/acmhttps:///10.12677/acm.2020.103051Analysis of the Efficacyof Anlotinib in the Treatmentof Soft Tissue SarcomaMiao Ge, Bin YueDone Oncology Department of the Affiliated Hospital of Qingdao University Medical College, QingdaoShandongReceived: Mar. 3rd, 2020; accepted: Mar. 18th, 2020; published: Mar. 25th, 2020AbstractObjective: To compare the efficacy of anlotinib combined with conventional chemotherapy and con-ventional chemotherapy alone in patients with soft tissue sarcoma that could not be removed by complete surgery. Methods: Thirty-nine patients with soft tissue sarcoma were included, all of whom were confirmed by histopathological examination after surgical resection, and the tumor could not be completely removed by surgery. Twenty-three patients were treated with anlotinib combined with chemotherapy, 16 patients were treated with chemotherapy, and 39 patients were finally followed up for efficacy. Results: The data of tumor recurrence time in the two groups were compared between the two groups. The tumor recurrence time and lung metastasis time in the anlotinib group were sig-nificantly prolonged, with statistically significant differences (P < 0.05). In addition, the recurrence rate and lung metastasis rate of soft tissue sarcoma patients decreased significantly within 1 year.Conclusion: The efficacy of anlotinib combined with conventional chemotherapy in the treatment of soft tissue sarcoma is better than that of conventional chemotherapy alone.KeywordsSoft Tissue Sarcoma, Anlotinib, Recurrence Time, Pulmonary Metastasis Time安罗替尼综合治疗软组织肉瘤的疗效分析葛淼,岳斌青岛大学附属医院骨肿瘤科,山东青岛收稿日期:2020年3月3日;录用日期:2020年3月18日;发布日期:2020年3月25日葛淼,岳斌摘 要目的:探究无法完整手术切除的软组织肉瘤患者后期行安罗替尼联合传统化疗和单纯传统化疗的疗效对比。

安罗替尼联合伊立替康二线治疗小细胞肺癌临床效果观察摘要:目的分析观察安罗替尼联合伊立替康二线治疗小细胞肺癌的临床效果。
方法本次将我院在2021年1月-12月收治的84例小细胞肺癌患者作为研究的对象,按随机盲选法分成两组,对照组42例采取伊立替康治疗,观察组42例采取安罗替尼联合伊立替康二线治疗,进一步对两组治疗效果进行对比评价。
结果(1)观察组疾病客观缓解率为61.90%,明显高于对照组的45.24%,两组数据差异有显著统计学意义(P<0.05)。
(2)观察组与对照组用药不良反应总发生率分别为7.14%、9.52%,均偏低,对比无明显差异(P>0.05)。
结论小细胞肺癌患者采取安罗替尼联合伊立替康二线治疗的效果理想,有助于病情缓解,并降低用药不良反应发生率,安全高效;因此,值得推广及应用。
关键词:安罗替尼;伊立替康;小细胞肺癌;临床效果小细胞肺癌,为起源于支气管黏膜或腺体的一种肺恶性肿瘤疾病,在所有肺癌中占比14%左右,该疾病易致使支气管管腔狭窄,出现表面肿胀、充血明显状况,严重情况下会有血性分泌物。
为改善小细胞肺癌患者的病情及生存质量,需采取及时有效的治疗措施[1]。
因此,本次将我院在2021年1月-12月收治的84例小细胞肺癌患者作为研究的对象,其目的是分析观察安罗替尼联合伊立替康二线治疗小细胞肺癌的临床效果,现将研究内容及成果作如下报道。
1.资料和方法1.1一般资料本次将我院在2021年1月-12月收治的84例小细胞肺癌患者作为研究的对象,均符合临床有关“小细胞肺癌”疾病的诊断标准[2],均知情签署相关治疗干预同意书,均经医院医学伦理委员会审批通过;此外,排除合并其他严重脏器疾病、严重精神障碍及抗拒本次实验者。
按随机盲选法分成两组,观察组42例中,男23例、女19例;年龄跨度为25-67岁,平均为(45.89±2.13)岁;燕麦细胞型14例、中间细胞型11例、复合燕麦细胞型9例、神经内分泌型8例。

盐酸安罗替尼对晚期恶性肿瘤患者的甲状腺激素的变化及干预治疗效果分析【摘要】目的:研究分析盐酸安罗替尼对晚期恶性肿瘤患者的甲状腺激素的变化及干预后临床疗效。
方法:选择2019年5月至2020年5月我院收治的晚期恶性肿瘤患者50例,对晚期恶性肿瘤患者口服盐酸安罗替尼治疗前后甲状腺激素水平变化及临床疗效进行对比。
结果:游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)水平治疗前后无明显差异(P>0.05),三碘甲状腺原氨酸(T3)、四碘甲状腺原氨酸(T4)、超敏促甲状腺素(TSH)水平有所好转,差异明显(P<0.05)。
结论:盐酸安罗替尼应用于晚期恶性肿瘤患者中可以改善部分甲状腺功能水平。
临床疗效确切,值得应用。
关键词:盐酸安罗替尼;晚期恶性肿瘤;甲状腺激素变化;治疗效果;恶性肿瘤又称为癌症。
当身体内细胞发生突变后,它会不断地分裂,不受身体控制,最后形成癌症[1]。
其病情发展迅速,一经发现,可通过手术治疗,但治愈率极低。
盐酸安罗替尼这种药物主要是用于治疗癌肿,是一种分子靶向药物,可以达到抗肿瘤血管生成和抑制肿瘤生长的作用[2]。
据相关研究发现该药用于晚期恶性肿瘤患者中有显著效果,基于此,本文特选取50例患者分析盐酸安罗替尼对晚期恶性肿瘤患者的甲状腺激素的变化及干预后临床疗效,现报道如下。
1.资料与方法1.1一般资料选择我院2019年5月至2020年5月期间收治的晚期恶性肿瘤患者50例作为研究对象,其中男29例,女21例,年龄49~78岁,平均年龄值(63.49±3.51)岁,经病理学明确诊断,50例患者符合晚期恶性肿瘤标准,全部晚期恶性肿瘤患者治疗前均已签署知情同意书,配合治疗。
1.2方法全部晚期恶性肿瘤患者均服用盐酸安罗替尼胶囊(生产厂家:正大天晴药业集团股份有限公司,批准文号:国药准字H20180004,。
包装规格;12 mg、10 mg、8 mg)。
推荐剂量为每次12mg,每日1次,早餐前口服。

安罗替尼联合多西他赛与多西他赛单药治疗晚期非小细胞肺癌的疗效观察【摘要】目的安罗替尼联合多西他赛与多西他赛单药治疗驱动基因阴性晚期非小细胞肺癌的疗效观察。
方法随机选取2018年9月-2020年9月在我院治疗的晚期非小细胞肺癌患者共80例,随机分为对照组和观察组,各40例。
对照组应用多西他赛单药治疗,观察组应用安罗替尼联合多西他赛治疗。
对比两组的疾病控制率、肺功能。
结果两组在临床疗效的对比上有差异,观察组高于对照组,差异明显(P<0.05)。
两组在肺功能指标的对比上有差异,观察组优于对照组,差异明显(P<0.05)。
结论安罗替尼联合多西他赛治疗驱动基因阴性晚期非小细胞肺癌可有效控制病情,且能提高患者的肺功能,值得推广。
【关键词】安罗替尼;多西他赛;晚期非小细胞肺癌;疾病控制率非小细胞肺癌是肺癌中最为常见的一种类型,临床研究显示,此病的发生同吸烟、环境、遗传等因素相关。
罹患此病的患者早期主要以低热、胸痛以及咳嗽为主要症状,中晚期患者会出现易疲劳、体重下降、呼吸困难等症状。
就临床实际而言,非小细胞肺癌患者早期并无典型症状,故而极易被患者所忽略,许多患者出现严重症状前往医院就诊时,此病多已经进展至中晚期[1]。
而在对处在此阶段的患者进行治疗时,临床则需要采用化疗的方法,以此来延长患者的生存时间。
过往在对患者进行化疗时多应用铂类化疗药物,这类药物属于晚期非小细胞肺癌化疗的常用药物,其可以取得一定的化疗效果,但副作用较为严重,且患者容易产生耐药[2]。
因此在对患者治疗时,采用安罗替尼联合多西他赛治疗的方法就成为一种可能。
基于此,此次研究将围绕着安罗替尼联合多西他赛与多西他赛单药治疗晚期非小细胞肺癌的疗效进行分析论述,详细报道如下:1资料和方法1.1.随机选取2018年9月-2020年9月在我院治疗的晚期非小细胞肺癌患者共80例,随机分为观察组和观察组,各40例。
对照组男27例,女13例,年龄47-71岁,平均年龄(59.33±6.37)岁;观察组男28例,女12例,年龄47 -72岁,平均年龄(59.75±6.26)岁;两组一般资料比较无明显差异(P>0.05)。
阿帕替尼治疗晚期软组织肉瘤的临床疗效和安全性左立杰;刘维丽;李蕊;王月华;杨已起;刘铮;依荷芭丽·迟【摘要】目的分析阿帕替尼治疗晚期软组织肉瘤(STS)的临床疗效和安全性.方法回顾性分析31例一线及以上化疗失败的晚期STS患者的临床资料.所有患者口服阿帕替尼250 mg/d、425 mg/d或500 mg/d,持续用药至疾病进展或出现不可耐受的不良反应,分析STS患者的近远期临床疗效.结果 31例晚期STS患者的客观有效率(ORR)为16.1%,疾病控制率(DCR)为77.4%,中位无进展生存时间(PFS)为4.6个月(95%CI:1.5~12.0),12周疾病无进展率为64.5%,中位总生存时间(OS)为8.0个月(95%CI:3.0~12.0).常见的1~2级不良反应为高血压、蛋白尿、手足综合征、白细胞减少、口腔溃疡和出血.3级非血液学不良反应为出血、蛋白尿和声音嘶哑.结论阿帕替尼治疗一线及以上化疗失败的晚期STS患者,有一定的临床疗效,不良反应可耐受.【期刊名称】《癌症进展》【年(卷),期】2019(017)004【总页数】5页(P427-430,448)【关键词】软组织肉瘤;阿帕替尼;疗效;安全性【作者】左立杰;刘维丽;李蕊;王月华;杨已起;刘铮;依荷芭丽·迟【作者单位】北京市朝阳区三环肿瘤医院肿瘤内科,北京 100122;北京市朝阳区三环肿瘤医院肿瘤内科,北京 100122;北京市朝阳区三环肿瘤医院肿瘤内科,北京100122;北京市朝阳区三环肿瘤医院肿瘤内科,北京 100122;北京市朝阳区三环肿瘤医院肿瘤内科,北京 100122;国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院肿瘤内科,北京 1000210;国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院肿瘤内科,北京1000210【正文语种】中文【中图分类】R738.6软组织肉瘤(soft tissue sarcoma,STS)是一类间叶组织来源的恶性肿瘤,可发生于全身及各年龄段,其发病率为(2~3)/10万,占成年恶性肿瘤的1%,病死率占所有肿瘤相关死亡的2%[1]。
安罗替尼联合替吉奥胶囊治疗复发性或难治性小细胞肺癌的近期疗效及安全性王微; 王建华; 叶军辉; 吕冬青; 吴小脉; 周苏娜; 姚桂飞; 周超; 杨海华【期刊名称】《《浙江医学》》【年(卷),期】2019(041)023【总页数】4页(P2536-2539)【关键词】复发性; 难治性; 小细胞肺癌; 安罗替尼; 联合治疗【作者】王微; 王建华; 叶军辉; 吕冬青; 吴小脉; 周苏娜; 姚桂飞; 周超; 杨海华【作者单位】317000 浙江省台州医院放疗科; 三门县人民医院呼吸科; 317000 浙江省台州医院呼吸科【正文语种】中文小细胞肺癌(small cell lung cancer,SCLC)约占所有肺癌的15%[1-2]。
它是一种高度侵袭、快速倍增、易在早期广泛转移、恶性程度极高的神经内分泌性癌。
尽管SCLC对初始的放化疗具有较高的敏感性,但多数患者仍会在初始治疗后出现复发和转移。
因此,SCLC的二线及以上的后线治疗十分重要。
但近30年来,SCLC的二线治疗进展缓慢,仍以系统性化疗为主。
拓扑替康是唯一获美国和欧盟批准的用于SCLC二线治疗的药物[3-4],其疗效非常有限,铂类敏感患者的应答率约为25%,铂类耐药或难治性患者的客观缓解率(ORR)不到10%,二线化疗后中位生存时间仅为4~5个月。
因此,研发新的后线治疗药物是复发性或难治性SCLC患者的迫切需求。
近年来在SCLC后线治疗中,已开始对纳武单抗和派姆单抗等免疫检查点PD-L1抑制剂[5]、阿帕替尼等小分子血管生成抑制剂、靶向DLL3的抗体耦联药物Rova-T[6]及RNA聚合酶Ⅱ的抑制剂Lurbinectedin等[7]新型药物进行探索性应用,并取得了一定的应答率,但效果仍不是很理想。
盐酸安罗替尼是我国自主研发的一类口服新型小分子多靶点酪氨酸激酶抑制剂(TKI),能够有效抑制血管内皮生长因子受体(VEGFR)、血小板衍生生长因子受体(PDGFR)、成纤维细胞生长因子受体(FGFR)及c-Kit等激酶,具有抗肿瘤血管生成和抑制肿瘤生长的作用[8]。
肿瘤靶向治疗相关的毒性反应全球疾病负担研究数据显示,在发达国家由恶性肿瘤导致的患者死亡人数已位居全部死亡原因的第二位,在发展中国家位居第三位。
2020 年全世界约有1 930 万新发恶性肿瘤病例,其中1 000 万患者死于恶性肿瘤。
目前针对恶性肿瘤的治疗方法包括手术、放疗、化疗及生物治疗,由于化疗药物存在细胞毒性及不良反应较多,因此临床上需要靶向性更强、不良反应更小的治疗手段来提高肿瘤的治疗效果。
分子靶向治疗是指使用靶向特定分子( 分子靶点) 的药物或其他物质来阻止肿瘤细胞的生长和扩散,其具有较强的靶向性、疗效性,近年来作为临床治疗肿瘤的主要手段逐渐被应用于临床,但分子靶向抗肿瘤药物在临床应用过程中同样会出现一些毒性反应,限制了其临床应用和发展。
一、皮肤毒性反应皮肤毒性反应是众多靶向药物治疗中最常见的不良反应,发生率高达79% ~88% ,皮肤毒性反应的出现可能会降低患者的用药依从性,影响后续治疗甚至导致治疗计划中断。
此外,严重的皮肤毒性反应还会增加患者感染的风险,降低生活质量,同时还会增加额外的医疗负担。
由于表皮生长因子受体存在于皮肤组织当中,因此使用表皮生长因子相关药物的患者最易出现皮肤毒性,如表皮生长因子抑制剂,包括厄落替尼、拉索菲尼、西妥昔单抗等。
以上药物会对皮肤、指甲、毛发等有特殊的不良反应,常见的毒性反应包括黏膜炎和皮疹。
1.黏膜炎靶向治疗药物引发的黏膜炎症往往易出现在口腔黏膜上,形成口腔黏膜炎,溃疡部位相对较浅,其周围会有异常疼痛,中央部分呈灰色,周围伴有红斑,常始发于治疗后5 天。
Reyes-Habito 等研究结果显示患者服用表皮生长因子受体( EGFR) -酪氨酸激酶抑制剂( TKI) 后出现口腔黏膜炎,表现为口干、口腔溃疡等。
Sonis 等通过给78 例实体肿瘤患者应用雷帕霉素进行治疗后发现,66% 的患者出现口腔黏膜溃疡。
针对此类靶向抗肿瘤药引起的黏膜炎症,临床上通常采取减少给药剂量、延长给药周期甚至是停药处理等措施以减轻毒性反应,但无论是减量或停药均会影响药物作用,而目前有研究使用氨磷汀、谷氨酰胺、口服抗氧化剂( 如锌剂、维生素E 等) 、盐酸苯海拉明、己酮可可碱、水杨酸盐等药物治疗皮肤毒性,其效果还需进行临床试验进一步验证。
别再为肿瘤担心,看看肿瘤内科医生是怎么治疗肺癌的!发表时间:2020-08-11T07:14:08.167Z 来源:《健康世界》2020年7期作者:贺显华[导读] 肺癌已经成为我国第一大恶性肿瘤,发病率、死亡率均位于首位。
四川省成都市大邑县人民医院 611330肺癌已经成为我国第一大恶性肿瘤,发病率、死亡率均位于首位。
肺癌又可划分为小细胞肺癌、非小细胞肺癌,根据肺癌类别的差异,治疗方法也具有一定差异。
那么,肿瘤内科医生是怎么治疗肺癌的呢?肿瘤内科医生常用的肺癌治疗方法有哪些?(一)化疗化疗是早期肺癌、中期肺癌常用辅助治疗手段,常配合化疗使用,也可以用于晚期肺癌的姑息治疗。
现阶段,在肺腺癌治疗时,化疗逐渐被更加有效的靶向药取代,但在小细胞肺癌、鳞癌治疗方面仍然处于不可替代地位。
(二)放疗放疗是一种早期肺癌不可耐受手术、拒绝接受手术患者替代治疗手段,也是局部晚期肺癌姑息治疗手段(在骨转移、脑转移时针对骨转移灶、脑转移灶进行姑息放疗)。
除小细胞癌治疗外,对于无法手术的局部晚期非小细胞癌患者,也可以考虑同步放疗。
(三)靶向药物治疗靶向药物治疗是当前肿瘤内科最重要治疗方法之一,主要适用于部分肺癌内特定驱动基因突变的患者,特别是肺腺癌内特定驱动基因,在进行初步检测后,利用厄洛替尼、埃克替尼、吉非替尼等一代EGFR-TKI或达克替尼、奥希替尼等二代、三代EGFR-TKI进行治疗,也可以利用ALK ROS-1C-Met等通路靶向药物进行治疗。
除阿帕替尼、安罗替尼等抗血管生成的靶向药外,在肺癌靶向药物治疗前需要进行基因检测。
(四)免疫治疗免疫治疗是当前肿瘤内科最受关注度治疗手段,主要指利用K药、O药、T药等抗PD-L1/PD-1的免疫药物进行治疗。
相较于靶向治疗而言,免疫治疗覆盖人群更多,不仅可以治疗肺腺癌,而且可以治疗鳞癌、小细胞肺癌,有效提高肺癌患者五年生存率。
但是现阶段免疫疫苗仍然在研发阶段,没有确切的受益患者识别方法,在提高患者远期生存方面还没有取得明显的进展。
2561国际医药卫生导报 2019年 第25卷 第15期 IMHGN,August 2019,Vol. 25 No. 151 临床资料 患者,女,57岁,无吸烟史,于2014年2月出现咳嗽、痰中带血,2014年3月于山东省某三甲医院行CT示右肺占位及右肾上腺占位,考虑右肺癌并右肾上腺转移,行支气管镜检,病理提示(右肺)腺癌,2014年3月18日全身麻醉下行右肺下叶切除+肺门纵膈淋巴结清扫+腹腔镜右肾上腺切除术,术后病理诊断:右肺中分化浸润性腺癌,肿物切面积5.0 cm×4.3 cm,支气管断端未查见癌,肺门淋巴结5枚、肺下韧带淋巴结1枚、上纵膈淋巴结13枚、前纵膈淋巴结4枚均未查见转移;隆突下淋巴结12枚,2枚查见转移(2/12);肺门淋巴结7枚,2枚查见转移(2/7);右肾上腺查见转移,术后病理分期:pT2bN2M1 Ⅳ期,基因检测示Exon-19、Exon-21、Exon-20均为野生型,2014年4月9日给予吉西他滨+顺铂化疗6周期,其后定期复查,2015年8
月15日胸部CT示双肺转移,给予培美曲塞+顺铂化疗6周期,疗效SD,培美曲塞单药维持治疗3周期,自行中断治疗。2016年10月17日复查CT示双肺转移灶较前增大、增多,病情进展,给予口服阿帕替尼,1月后复查CT示双肺结节较前缩小,治疗有效,故继续原治疗,期间出现高血压、蛋白尿,根据情况调整阿帕替尼用药在250~500 mg/d,期间复查CT示病情稳定。患者2017年6月出现蛋白尿及手足关节肿胀,给予口服黄葵胶囊等药物对症处理,24 h尿蛋白定量波动在500~100 mg/24 h,2017年10月蛋白尿症状加重,尿蛋白定量>3 000 mg/24 h,患者自行停服阿帕替尼,2月后复查CT示病灶较前增大,2018年1月2日给予多西他赛3周方案+阿帕替尼250 mg(口服5 d,停2 d),2周期后复查稳定,4周期后复查CT病灶增大,病情进展,再次行基因检测示EGFR19外显子突变,突变频率2.49%,因突变
安罗替尼治疗阿帕替尼用药进展后的晚期肺腺癌1例
陈国华1 杨鑫1 李宁2 孟琦11德州市人民医院肿瘤科 253000;2德州市人民医院血液科 253000
通信作者:陈国华,Email:26458719@qq.com
【摘要】 目前针对晚期非小细胞肺癌(NSCLC)的抗肿瘤治疗主要集中在两个方面:针对肿瘤细胞自身的治疗和对肿瘤微环境进行调整。肿瘤的生长和转移都需要持续血管生成的支持,抑制血管生成为肿瘤治疗提供了一条针对肿瘤微环境的新途径。安罗替尼和阿帕替尼均为我国自主研发的小分子抗血管生成药物,但两者作用靶点有所不同,因此,临床疗效也有所差别。本文报道安罗替尼治疗阿帕替尼用药失败后的晚期肺腺癌1例。 【关键词】 安罗替尼;阿帕替尼;晚期肺腺癌;抗血管生成 DOI:10.3760/cma.j.issn.1007-1245.2019.15.055
Anlotinib for advanced lung adenocarcinoma after failure treatment by apatinib: a case reportChen Guohua1, Yang Xin1, Li Ning2, Meng Qi11Department of Oncology, Dezhou People's Hospital, Dezhou 253000, China; 2Department of Hematology,
Dezhou People's Hospital, Dezhou 253000, ChinaCorresponding author: Chen Guohua, Email: 26458719@qq.com 【Abstract】 At present, the anti-tumor therapy for advanced non-small cell lung cancer (NSCLC) mainly focuses on two aspects: the treatment targeting to the tumor cells and the adjustment of the tumor microenvironment. Tumour angiogenesis is a pre-requisite for tumor proliferation and metastasis, the inhibition of angiogenesis provides a new approach to tumor microenvironment. Apatinib and anlotinib are two new generations of small-molecule anti-angiogenic drugs independently developed in China. Although both belong to anti-angiogenesis drugs, their targets are different, so are their clinical effects. This paper reports a case of advanced lung adenocarcinoma treated with anlotinib after the failure treatment by apatinib. 【Key words】 Anlotinib; Apatinib; Advanced lung adenocarcinoma; Anti-angiogenic DOI:10.3760/cma.j.issn.1007-1245.2019.15.055
·病例报告·2562
国际医药卫生导报 2019年 第25卷 第15期 IMHGN,August 2019,Vol. 25 No. 15丰度较低,给予EGFR-TKI(埃克替尼)联合阿帕替尼(250 mg,口服5 d,停2 d)靶向治疗,2月后(2018年6月)复查CT,疗效SD,患者腹胀、纳差,蛋白尿加重,遂停服阿帕替尼,口服埃克替尼单药靶向治疗,2018年9月7日复查CT,病情进展,给予安罗替尼(12 mg)靶向治疗,2018年10月24日及2019年1月6日复查CT,病灶缩小(见图1),部分病灶形成空洞,患者耐受性好,高血压及蛋白尿症状较前减轻,目前已口服安罗替尼9个月,病情稳定,患者状态良好,PS=1分。
2 讨论 目前,在我国常见恶性肿瘤中,肺癌的发病率和病死率均占首位,非小细胞肺癌(NSCLC)占肺癌的80%~85%,晚期NSCLC的治疗以化疗、靶向治疗等综合治疗手段为主,无论是化疗还是靶向治疗,最终都会出现耐药。抗血管生成药物在晚期NSCLC领域的应用是目前研究的热点之一,且部分已取得理想结果。安罗替尼和阿帕替尼均为我国自主研发的抗血管生成的小分子多靶点酪氨酸激酶抑制剂,两者虽同属抗血管生成药物,但作用靶点有所不同,因此,临床疗效也有所差别。阿帕替尼2014年于国内上市,被批准用于晚期胃癌的二线以上治疗,已有多项研究证实其在晚期肺癌同样疗效确切[1-2],安罗替尼则于2018年5月被正式批准用于
晚期 NSCLC 患者的三线及以上治疗,ALTER0303研究[3]奠
定了安罗替尼作为晚期 NSCLC三线治疗方案的基础,该研究显示,安罗替尼组OS 延长 3.3 个月(9.6个月比 6.3 个月,HR=0.68,95% CI:0.54-0.87;P=0.001 8);PFS 延长 4.0
个月(5.4个月比1.4 个月,HR=0.25,95% CI:0.19-0.31;
P<0.0001)。另有多项试验证实,安罗替尼可强效抑制血
管内皮细胞生长因子受体(vascular endothelial growth factor receptor,VEGFR)、血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)、纤维母细胞生长因子受体(fibroblast growth factor receptor,FGFR)和c-Kit等多个靶点,尤其是针对VEGFR2的半抑制浓度(IC50)值显著低于其他多靶点酪氨酸激酶抑制剂,其与作用靶标的亲和力更高,因此有效率及安全性也更高[4-6]。本例患者初诊即为晚期肺腺癌,
在化疗失败后选择阿帕替尼靶向治疗,PFS超过1年,说明
该患者对于此类抗血管生成药物治疗敏感,治疗过程中出现病情进展是因出现严重蛋白尿后阿帕替尼减量或停药所致,并非对阿帕替尼耐药,更换为安罗替尼后疾病再次得以控制,且耐受性良好,患者的生活质量也得到提高,从而进一步证实了安罗替尼的疗效和安全性,也从临床的角度上证实了相较阿帕替尼而言,安罗替尼对VEGFR2的IC50值更低、与作用靶标的亲和力更高这一结论。 另外,该患者在治疗过程中出现了EGFR 的敏感突变,但突变丰度较低,笔者采用埃克替尼与阿帕替尼联合用药的方式,疾病得以控制,而单独使用埃克替尼期间,疾病很快进展,这可能预示着抗血管生成药物联合靶向药物会增加整体疗效,自2005年起便有学者尝试EGFR-TKI和VEGFR-TKI双靶联合治疗,包括中国的BELIEF研究、日本的JO25567研究,以及2018年ASCO报道的NEJ026研究,其中,北医三院梁莉团队[7]通过临床回顾性研究发现,阿帕
替尼联合吉非替尼有效地延长了患者的中位生存期(PFS),并通过进一步基础研究证实,阿帕替尼联合吉非替尼可以增强吉非替尼对 NSCLC细胞的抗肿瘤活性,这与本文观点一致,双靶联合或许会成为将来晚期NSCLC中EGFR敏感突变患者的选择之一,我们也期待晚期NSCLC的治疗能迎来更美好的明天。
参考文献[1] Song Z, Yu X, Lou G, et al. Salvage treatment with apatinib for advanced non-small-cell lung cancer [J]. Onco Targets Ther, 2017, 10: 1821-1825. DOI: 10.2147/OTT.S113435.[2] 王学敏, 张维红, 杜伟娇, 等.阿帕替尼用于一线治疗进展后晚期非鳞非小细胞肺癌的疗效和生存分析 [J].中国肺癌杂志, 2017, 20(11): 761-768. DOI: 10.3779/j.issn.1009-3419.2017.11.07.[3] Han B, Li K, Wang Q, et al. Effect of Anlotinib as a Third-Line or Further Treatment on Overall Survival of Patients With Advanced Non-Small Cell Lung Cancer: The ALTER 0303 Phase 3 Randomized Clinical Trial [J]. JAMA Oncol, 2018, 4(11): 1569-1575. DOI: 10.1001/jamaoncol.2018.3039.[4] Lin B, Song X, Yang D, et al. Anlotinib inhibits angiogenesis via suppressing the activation of VEGFR2, PDGFRβand FGFR1 [J]. Gene, 2018, 654: 77-86. DOI: 10.1016/j.gene.2018.02.026.[5] Sun Y, Niu W, Du F, et al. Safety, pharmacokinetics, and antitumor properties of anlotinib, an oral multi-target tyrosine kinase inhibitor, in patients with advanced refractory solid tumors [J]. J Hematol Oncol, 2016, 9(1) : 105. DOI: 10.1186/s13045-016-0332-8.[6] 杨斌, 谢辉, 王春平, 等.安罗替尼对人肝内胆管细胞癌细胞系HCCC-9810作用研究[J].中国医药导刊, 2017, 19(12): 1389-1391. DOI: 10.3969/j.issn.1009-0959.2017.12.037.[7] Li F, Zhu T, Cao B, et al. Apatinib enhances antitumour activity of EGFR-TKIs in non-small cell lung cancer with EGFR-TKI resistance [J]. Eur J Cancer, 2017, 84: 184-192. DOI: 10.1016/j.ejca.2017.07.037.