高中化学基本概念基础理论
- 格式:doc
- 大小:224.00 KB
- 文档页数:13


基本概念基础理论
一、物质的组成、分类和变化
注意:电解质必须是化合物。因而金属不是电解质。CuSO 4是电解质,不能说CuSO 4溶液是电解质,因其是混合物。
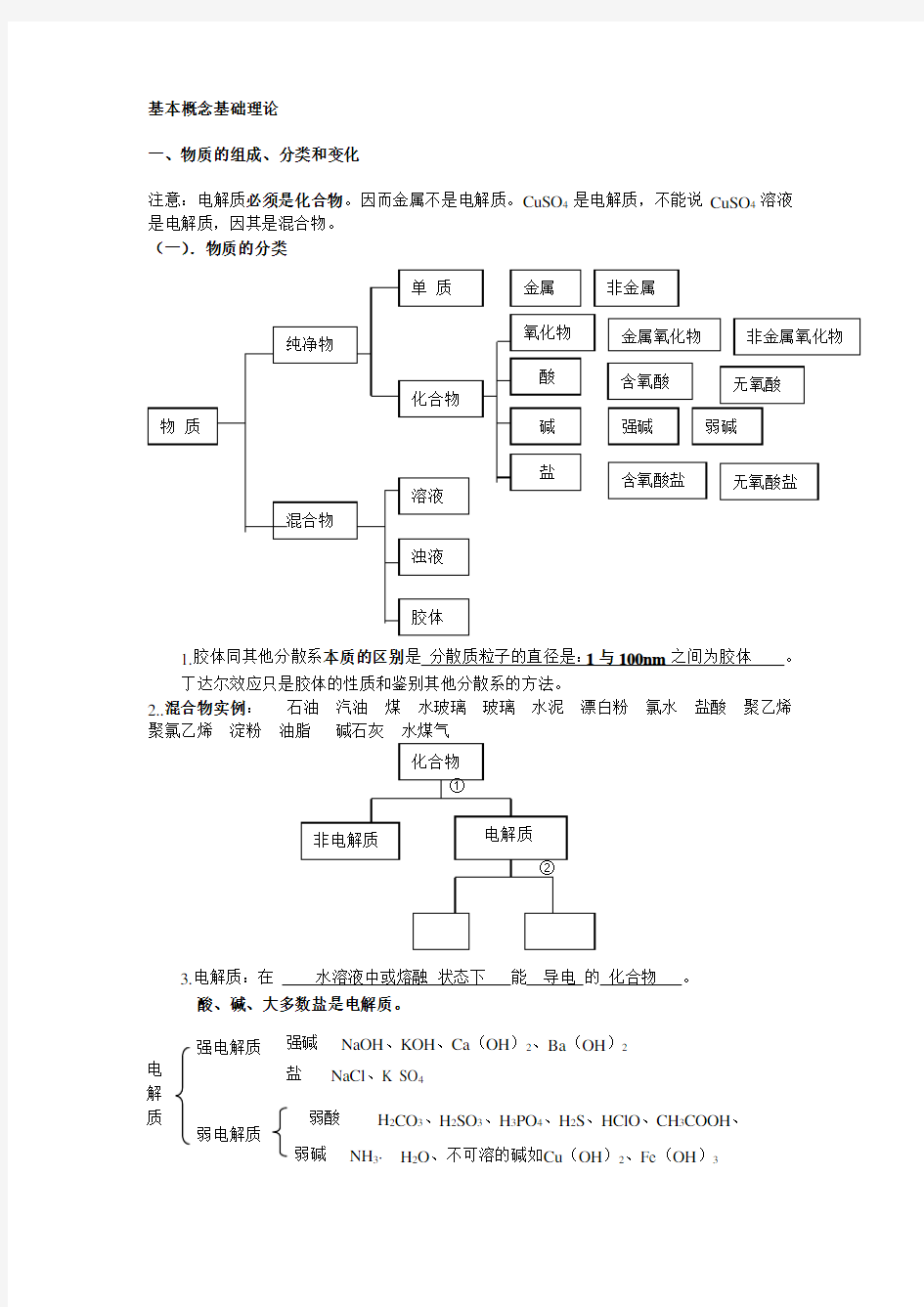
(一).物质的分类
1.胶体同其他分散系本质的区别是 分散质粒子的直径是:1与100nm 之间为胶体 。
丁达尔效应只是胶体的性质和鉴别其他分散系的方法。
2..混合物实例: 石油 汽油 煤 水玻璃 玻璃 水泥 漂白粉 氯水 盐酸 聚乙烯 聚氯乙烯 淀粉
3.电解质:在 水溶液中或熔融 状态下 能 导电 的 化合物 。
酸、碱、大多数盐是电解质。
电 解 质 强电解质 弱电解质
强碱 NaOH 、KOH 、Ca (OH )2、Ba (OH )2 盐 NaCl 、K SO 4 弱酸 H 2CO 3、H 2SO 3、H 3PO 4、H 2S 、HClO 、CH 3COOH 、 弱碱 NH 3· H 2O 、不可溶的碱如Cu (OH )2、Fe (OH )3
二、各类反应
(一).基本反应类型:会熟练判断一个反应属于化合、分解、置换、复分解中的哪一种。
反应类型表达式
化合反应A+B=AB
分解反应AB=A+B
置换反应A+BC=AC+B
复分解反应AB+CD=AD+CB
1、置换反应要遵循两大“活动性顺序”:
①金属活动性顺序:K Ba Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属的还原性:强弱
离子的氧化性:K+弱Fe2+强Ag+、Fe3+
②非金属活动性顺序: F O Cl Br I S
非金属单质的氧化性:强弱,即:F2>O2>Cl2>Br2>I2>S
离子的还原性:弱强,即:F— 2、复分解反应要掌握能否发生的条件:沉淀,气体,水或其他弱电解质 (二).氧化还原反应 会根据有无化合价的变化来判断一个反应是否是氧化还原反应。 升价—失e——作还原剂—表现还原性—发生氧化反应(被氧化)—变为氧化产物降价74—得e——作氧化剂—表现氧化性—发生还原反应(被还原)—变为还原产物 常见的重要氧化剂、还原剂 氧化剂还原剂 活泼非金属单质:X2、O2、S 活泼金属单质:Na、Mg、Al、Zn、Fe 某些非金属单质:C、H2、S 高价金属离子:Fe3+、Sn4+ 不活泼金属离子:Cu2+、Ag+其它:[Ag(NH3)2]+、新制Cu(OH)2 低价金属离子:Fe2+、Sn2+ 非金属的阴离子及其化合物: S2-、H2S、I -、HI、NH3、Cl-、HCl、Br-、HBr 含氧化合物:NO2、N2O5、MnO2、Na2O2、H2O2、HClO、HNO3、浓H2SO4、NaClO、Ca(ClO)2、KClO3、KMnO4、王水低价含氧化合物:CO、SO2、H2SO3、Na2SO3、Na2S2O3、NaNO2、H2C2O4、含-CHO的有机物:醛、甲酸、甲酸盐、甲酸某酯、 葡萄糖、麦芽糖等 既作氧化剂又作还原剂的有:S、SO3、HSO3、H2SO3、SO2、NO2、Fe及含-CHO的有机物▲氧化还原反应配平 标价态、列变化、求总数、定系数、后检查 一标出有变的元素化合价; 二列出化合价升降变化 三找出化合价升降的最小公倍数,使化合价升高和降低的数目相等; 四定出氧化剂、还原剂、氧化产物、还原产物的系数; 五平:观察配平其它物质的系数; 六查:检查是否原子守恒、电荷守恒(通常通过检查氧元素的原子数),画上等号。反应物 反应条件对氧化-还原反应的影响. 1.浓度:可能导致反应能否进行或产物不同 8HNO 3(稀)+3Cu==2NO↑+2Cu(NO 3)2+4H 2O S+6HNO 3(浓)===H 2SO 4+6NO 2 ↑+2H 2O 4HNO 3(浓)+Cu==2NO 2↑+Cu(NO 3)2+2H 2O 3S+4 HNO 3(稀)===3SO 2+4NO ↑+2H 2O 2.温度:可能导致反应能否进行或产物不同 Cl 2+2NaOH=====NaCl+NaClO+H 2O 3Cl 2+6NaOH=====5NaCl+NaClO 3+3H 2O 3.溶液酸碱性. 2S 2- +SO 32-+6H+=3S ↓+3H 2O 5Cl -+ClO 3-+6H +=3Cl 2↑+3H 2O S 2-、SO 32-,Cl -、ClO 3-在酸性条件下均反应而在碱性条件下共存. Fe 2+与NO 3-共存,但当酸化后即可反应.3Fe 2++NO 3-+4H +=3Fe 3++NO ↑+2H 2O 一般含氧酸盐作氧化剂,在酸性条件下,氧化性比在中性及碱性环境中强.故酸性KMnO 4溶 液氧化性较强. 4.条件不同,生成物则不同 1、2P +3Cl 2点燃===2PCl 3(Cl 2不足) ; 2P +5Cl 2点燃===2 PCl 5(Cl 2充足) 2、2H 2S +3O 2点燃===2H 2O +2SO 2(O 2充足) ; 2H 2S +O 2点燃===2H 2O +2S(O 2不充足) 3、4Na +O 2缓慢氧化=====2Na 2O 2Na +O 2点燃===Na 2O 2 4、Ca(OH)2+CO 2CO 2适量====CaCO 3↓+H 2O ; Ca(OH)2+2CO 2(过量)==Ca(HCO 3)2 5、C +O 2点燃===CO 2(O 2充足) ; 2 C +O 2点燃===2CO (O 2不充足) 6、8HNO 3(稀)+3Cu==2NO↑+2Cu(NO 3)2+4H 2O 4HNO 3(浓)+Cu==2NO 2↑+Cu(NO 3)2+2H 2O 7、AlCl 3+3NaOH==Al(OH)3↓+3NaCl ; AlCl 3+4NaOH(过量)==NaAlO 2+2H 2O 8、NaAlO 2+4HCl(过量)==NaCl +2H 2O +AlCl 3 NaAlO 2+HCl +H 2O==NaCl +Al(OH)3↓ 9、Fe +6HNO 3(热、浓)==Fe(NO 3)3+3NO 2↑+3H 2O Fe +HNO 3(冷、浓)→(钝化) 10、Fe +6HNO 3(热、浓)Fe 不足====Fe(NO 3)3+3NO 2↑+3H 2O Fe +4HNO 3(热、浓)Fe 过量====Fe(NO 3)2+2NO 2↑+2H 2O 11、Fe +4HNO 3(稀)Fe 不足====Fe(NO 3)3+NO↑+2H 2O 3Fe +8HNO 3(稀) Fe 过量====3Fe(NO 3)3+ 2NO↑+4H 2O 12、C 2H 5OH CH 2=CH 2↑+H 2O C 2H 5-OH +HO -C 2H 5 C 2H 5-O 浓H 2SO 4 170℃ 浓H 2SO 4 140℃ 冷、稀4 高温